专题4、专题5综合练习 (含解析)2022——2023学年上学期高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题4、专题5综合练习 (含解析)2022——2023学年上学期高一化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-22 09:12:32 | ||
图片预览




文档简介
专题4、专题5综合练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列反应的离子方程式书写正确的是
A.将氢氧化铁溶于氢碘酸: Fe(OH)3+3H+= Fe3++3H2O
B.向CuSO4溶液中加入少量Na2O2: 2Na2O2+2Cu2++2H2O= 4Na++2Cu(OH)2↓+O2↑
C.从酸化的海带灰浸出液中提取碘: 2I-+H2O2=I2+2OH-
D.向稀HNO3中滴加Na2SO3溶液: +2H+= SO2↑+H2O
2.下列关于物质或离子检验的叙述正确的是
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在
B.向某无色溶液中滴入酚酞试液后显红色,该溶液不一定是碱溶液
C.加入BaCl2溶液,生成白色沉淀,加稀硝酸后沉淀不溶解,可确定有SO存在
D.加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO存在
3.某小组拟从苦卤(含Br-等)中提取溴,设计的流程如图所示:
下列说法错误的是
A.提取溴包括浓缩、氧化、提取
B.步骤1和4利用的原理是氯的失电子能力比溴的强
C.步骤3的离子方程式为SO2+Br2+2H2O=4H++2Br-+SO
D.步骤2利用的原理是液溴的挥发性(或低沸点性)
4.实验室模拟工业处理含铬废水,操作及现象如图1,反应过程中铬元素的化合价变化如图2。已知H2O2是常用的强氧化剂之一。下列说法正确的是
A.实验开始至5 s,铬元素被氧化
B.实验开始至30 s,溶液中生成Cr3+时的氧化剂与还原剂的物质的量之比为1∶3
C.30 s至80 s的过程,一定是氧气氧化了Cr3+
D.80 s时,溶液中的主要阴离子仍为Cr2O
5.N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂。下述反应能产生N2O:3CO+2NO2=3CO2+ N2O。下列关于该反应的说法正确的是
A.CO是氧化剂
B.NO2发生氧化反应
C.NO2被还原
D.常温常压下,0.2 mol NO2参加反应会生成6.72 L CO2
6.我省为沿海省份,海洋中有丰富的食品、矿产、能源、药物和水产等资源,海水资源的综合利用可以用下图表示。
下列关于海水提取Br2的说法正确的是
A.将NaBr转化为Br2,可以选用Cl2、O2等还原剂
B.将Br2转化为HBr,可利用溴单质易升华的特性用空气将溴吹出
C.将Br2转化为HBr的离子方程式为:SO2+2H2O+Br2=2H++SO+2HBr
D.海水提取溴中出现了两次溴离子被氧化的过程
7.根据SO2通入不同溶液中的实验现象,所得结论不正确的是
选项 溶液 现象 结论
A 含HCl的Ba(NO3)2溶液 产生白色沉淀 SO2有还原性
B H2S溶液 产生黄色沉淀 SO2有氧化性
C 酸性KMnO4溶液 紫色溶液褪色 SO2有漂白性
D 品红溶液 溶液褪色 SO2有漂白性
A.A B.B C.C D.
8.中国传统文化中包含大量化学知识,下列说法错误的是
A.“石硫磺(S)能化……银、铜、铁,奇物”,这句话体现了石硫磺的氧化性
B.“春蚕到死丝方尽,蜡炬成灰泪始干”,其中的“蜡炬成灰”属于化学变化
C.《本草纲目》中多次提到“烧酒”,用高梁酿酒中的“馏酒”是指蒸馏操作
D.“至于矾现五色之形,硫为群石之将,皆变化于烈火”,其中的“矾”指的是金属硫化物
9.CsICl2是一种碱金属的化合物,在化学反应中既可表现氧化性又可表现还原性,则下列有关该物质的说法不正确的是
A.Cs显+1价
B.向CsICl2溶液中通入Cl2,有单质碘生成
C.CsICl2是离子化合物
D.向酸性高锰酸钾溶液中滴加CsICl2溶液,溶液褪色
10.五种短周期元素a、b、c、d、e,其原子半径与原子序数的关系如图,下列说法错误的是
A.c元素的离子半径比a的离子半径大
B.d元素对应的最高价氧化物的水化物酸性比e元素的弱
C.b、c、e三种元素对应的最高价氧化物的水化物相互间能发生反应
D.a、d两元素分别形成的最简单氢化物的稳定性为d<a
11.短周期主族元素X、Y、Z的原子序数依次增大,X元素最外层电子数是内层电子数的2倍,Y元素是地壳中含量最多的金属元素,常温下金属Y能溶于Z的最高价氧化物对应水化物的稀溶液,而不溶于其浓溶液。下列说法不正确的是
A.X是形成化合物种类最多的元素 B.Y的最高价氧化物属于两性氧化物
C.原子半径: D.实验室可用清洗装有硫磺的试管
12.我国火星探测器“祝融号”已在火星表而工作了很长的时间。火星气体及岩石中富含W、X、Y、Z四种元素。已知:W、X、Y、Z为原子序数递增的四种短周期元素,W和Z为同一主族元素,其中X是地壳中含量最高的元素,Y元素原子的M层电子数与K层电子数相同,W的最高正化合价与最低负化合价的代数和为0。下列说法错误的是
A.W的最高价氧化物对应的水化物为弱酸
B.W和X形成的化合物都是酸性氧化物
C.原子半径大小:
D.Y和Al两者的最高价氧化物对应的水化物的碱性较强的是Y
13.最近,中科院核化学研究室科研人员自主研发Ge分离纯化工艺和Ge/Ga发生器制备技术,并测得Ge的半衰期为271天。已知:质量数相同、质子数不同的原子互为同量素;半衰期指质量减少一半所需要的时间。下列说法正确的是
A.Ge和Ga互为同位素 B.Ge和Ge互为同量素
C.的中子数与质子数之差为6 D.mgGe衰变813天时剩余的质量为mg
14.X、Y、Z、W是四种短周期元素,原子序数依次增大。X元素原子的最外层电子数是Y元素原子最外层电子数的3倍,Y、Z元素的原子序数之比为4:5,X、W元素形成的一种阴离子的结构如图所示。下列说法正确的是
A.该阴离子中X元素均显-1价
B.简单离子半径:X<Y
C.最高价氧化物对应水化物的酸性:W<Z
D.X、Y形成化合物的熔点高于X、W形成化合物的熔点
15.表中是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与Z的最外层电子数之和为10。下列说法正确的是
W Y
X Z
A.W一定为第ⅢA族元素 B.X最高价氧化物能与强碱反应
C.原子半径:Z>X D.气态氢化物稳定性:Y<Z
二、实验题
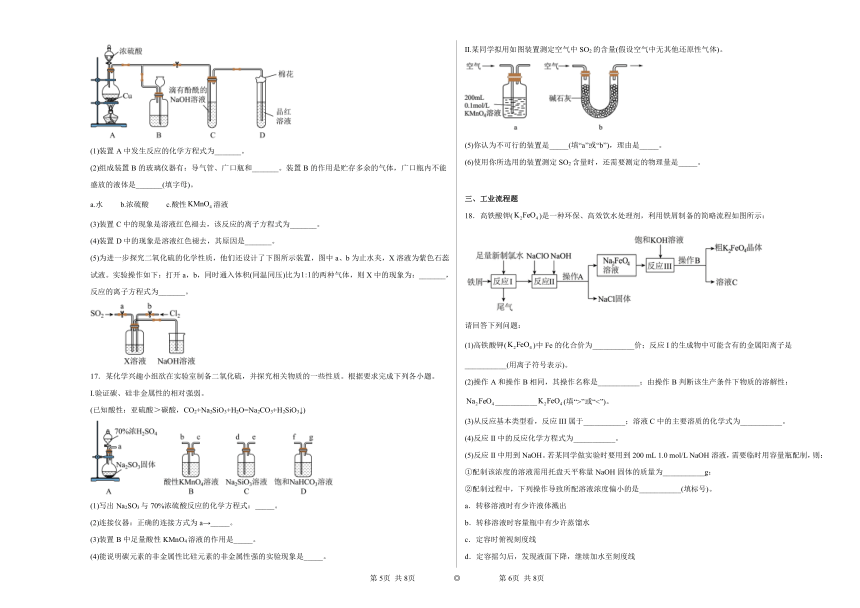
16.某化学兴趣小组为探究二氧化硫的化学性质,他们采用下图装置进行有关实验。请回答下列问题:
(1)装置A中发生反应的化学方程式为_______。
(2)组成装置B的玻璃仪器有:导气管、广口瓶和_______。装置B的作用是贮存多余的气体,广口瓶内不能盛放的液体是_______(填字母)。
a.水 b.浓硫酸 c.酸性溶液
(3)装置C中的现象是溶液红色褪去,该反应的离子方程式为_______。
(4)装置D中的现象是溶液红色褪去,其原因是_______。
(5)为进一步探究二氧化硫的化学性质,他们还设计了下图所示装置,图中a、b为止水夹,X溶液为紫色石蕊试液。实验操作如下:打开a,b,同时通入体积(同温同压)比为的两种气体,则X中的现象为:_______,反应的离子方程式为_______。
17.某化学兴趣小组欲在实验室制备二氧化硫,并探究相关物质的一些性质。根据要求完成下列各小题。
I.验证碳、硅非金属性的相对强弱。
(已知酸性:亚硫酸>碳酸,CO2+Na2SiO3+H2O=Na2CO3+H2SiO3↓)
(1)写出Na2SO3与70%浓硫酸反应的化学方程式:_____。
(2)连接仪器:正确的连接方式为a→_____。
(3)装置B中足量酸性KMnO4溶液的作用是_____。
(4)能说明碳元素的非金属性比硅元素的非金属性强的实验现象是_____。
Ⅱ.某同学拟用如图装置测定空气中SO2的含量(假设空气中无其他还原性气体)。
(5)你认为不可行的装置是_____(填“a”或“b”),理由是_____。
(6)使用你所选用的装置测定SO2含量时,还需要测定的物理量是_____。
三、工业流程题
18.高铁酸钾()是一种环保、高效饮水处理剂,利用铁屑制备的简略流程如图所示:
请回答下列问题:
(1)高铁酸钾()中Fe的化合价为___________价;反应I的生成物中可能含有的金属阳离子是___________(用离子符号表示)。
(2)操作A和操作B相同,其操作名称是___________;由操作B判断该生产条件下物质的溶解性:___________(填“>”或“<”)。
(3)从反应基本类型看,反应III属于___________;溶液C中的主要溶质的化学式为___________。
(4)反应II中的反应化学方程式为___________。
(5)反应II中用到NaOH。若某同学做实验时要用到200 mL 1.0 mol/L NaOH溶液,需要临时用容量瓶配制,则:
①配制该浓度的溶液需用托盘天平称量NaOH固体的质量为___________g;
②配制过程中,下列操作导致所配溶液浓度偏小的是___________(填标号)。
a.转移溶液时有少许液体溅出
b.转移溶液时容量瓶中有少许蒸馏水
c.定容时俯视刻度线
d.定容摇匀后,发现液面下降,继续加水至刻度线
19.在脆硫铅锑矿火法冶炼过程中,产出的铅锑合金经氧化吹炼后,得到一种含铅锑锡的复合渣(俗称“吹渣”),其主要成分是Sn、Sb、Pb的氧化物。以“吹渣”为原料,制备锡酸钠晶体的工艺流程如图所示:
已知:i.锡(Sn)与C同主族,SnO2不溶于水、稀酸或碱液,但能溶于熔融NaOH;
ii.“高温碱熔”时,相关氧化物的反应顺序:Sn>Sb>Pb;
iii.“浸出”后,溶液中主要溶质是Na2SnO3,还有少量Na3SbO4、Na2PbO2;
iv.Na2SnO3 xH2O易溶于水,在水中的溶解度随着温度的升高而降低。
回答下列问题:
(1)Sn的原子序数为50,其在元素周期表中的位置为_____。
(2)蒸余渣中Sn元素的主要存在形式是SnO2,还有少量单质Sn,单质Sn在“高温碱熔”时生成Na2SnO3,对应的化学方程式为_____。
(3)“高温碱熔”时,配料比对Sn浸出率的影响如表所示:
蒸余渣:NaOH(质量比) NaOH:NaNO3(质量比) Sn浸出率/%
1:0.2 1:0.15 90.27
1:0.35 1:0.15 93.52
1:0.5 1:0.15 93.65
1:0.5 1:0.20 93.83
①由表可知,随着蒸余渣:NaOH和NaOH:NaNO3质量比值的______(填“增大”或“减小”),Sn的浸出率逐渐增大。
②适当增加熔剂NaOH和NaNO3的用量有助于提高Sn浸出率,但熔剂用量过大会导致_____,增加成本。
(4)“浸出”时控制温度40℃有助于降低杂质量,需要缓慢加水的原因是______。
(5)获得Na2SnO3 xH2O的“系列操作”是______、洗涤、干燥;浓缩结晶母液返回置换液这一操作的优点是______。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】A.三价铁离子能够氧化碘离子,氢氧化铁溶于氢碘酸,离子方程式为,故A错误;
B.向CuSO4溶液中加入Na2O2生成氢氧化铜和氧气,离子方程式为:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑,故B正确;
C.从酸化的海带灰浸出液中提取碘,离子方程式为:2H++2I-+H2O2=I2+2H2O,故C错误;
D.向稀HNO3中滴加Na2SO3溶液会发生氧化还原反应:2H++2NO+3SO=3SO+H2O+2NO↑,故D错误;
故选B。
2.B
【详解】A.因加HCl之前生成的可能是AgCl沉淀,也可能是别的白色沉淀,但是后面加上HCl中含有大量Cl-离子也可以与硝酸银溶液反应生成白色沉淀,所以不能确定Cl-离子是原溶液里的还是后来加进去的,选项A错误;
B.能使酚酞试液变红说明呈碱性,有可能是碱溶液,或碳酸钠等可溶性碳酸盐溶液,选项B正确;
C.加稀盐酸后沉淀不溶解,白色沉淀可能为硫酸钡或AgCl,故原溶液中可能含或Ag+,选项C错误;
D.能和盐酸反应生成能使澄清石灰水变浑浊的二氧化碳气体的可以是碳酸根、碳酸氢根等离子,此外二氧化硫也能使石灰水变浑浊,选项D错误;
答案选B。
3.B
【分析】氯气与溴离子发生氧化还原反应生成溴单质,用热空气将溴单质吹出,再与二氧化硫反应生成HBr和硫酸,HBr再与氯气反应生成溴单质,最后蒸馏得到纯溴;
【详解】A.提取溴过程中溴离子被氧化生成溴单质,步骤4富集溴元素,步骤5通过蒸馏收集溴单质,包括浓缩、氧化、提取,A正确;
B.步骤1和4反应的离子方程式均是Cl2+2Br-=2Cl-+Br2,氧化性:Cl2> Br2,非金属性:Cl>Br,即氯的得电子能力比溴的强,B错误;
C.步骤3是溴单质与二氧化硫反应生成HBr和硫酸,离子方程式为SO2+Br2+2H2O=4H++2Br-+ ,C正确;
D.步骤2利用的原理是液溴的挥发性,可用热空气将溴单质吹出,D正确;
故选:B。
4.B
【详解】A.根据图2可知,实验开始至5 s,铬元素的化合价保持为+6,没有被氧化,A错误;
B.实验开始至30 s,由图2知生成Cr3+,铬元素的化合价降低,则双氧水中氧元素化合价升高生成氧气,离子方程式为:3 H2O2++8H+=2 Cr3++7H2O+3O2↑,氧化剂与还原剂H2O2的物质的量之比为1∶3,B正确;
C.实验开始时,加入的H2O2过量,30s时,向溶液中加入NaOH,80s时,铬元素的化合价变为+6,可能是因为过氧化氢在碱性溶液中氧化性更强,过量的过氧化氢氧化了Cr3+,C错误;
D.根据图2知80 s时铬元素呈+6价,实验过程中加入了NaOH,溶液呈碱性,溶液中的主要阴离子为,D错误;
故选:B。
5.C
【详解】A.CO中碳化合价升高,失去电子,是还原剂,故A错误;
B.NO2中氮化合价降低,发生还原反应,故B错误;
C.NO2中氮化合价降低,被还原,故C正确;
D.0.2 mol NO2参加反应会生成0.3mol CO2,常温常压下,0.3mol CO2体积不等于6.72L,故D错误。
综上所述,答案为C。
6.D
【分析】氯碱工业即电解氯化钠溶液可生成氢氧化钠,氯化镁加入氢氧化钙反应生成氢氧化镁,再加入稀盐酸得到氯化镁溶液,溴化钠通入氯气氧化生成溴单质,再加入二氧化硫反应生成硫酸和HBr,最后用氯气氧化得到溴单质;
【详解】A.将NaBr转化为Br2,可以选用Cl2作还原剂,A错误;
B.利用溴单质易挥发的物理性质,可用热空气将溴单质吹出,B错误;
C.Br2与二氧化硫反应生成硫酸和HBr,离子方程式为:SO2+2H2O+Br2=4H+++2Br-,C错误;
D.溴化钠通入氯气氧化生成溴单质,HBr最后用氯气氧化得到溴单质,溴离子两次被氧化,D正确;
故选:D。
7.C
【详解】A.硝酸根离子在酸性条件下具有强氧化性,能氧化二氧化硫,说明生成二氧化硫有还原性,A正确;
B.硫化氢和二氧化硫反应,二氧化硫具有氧化性,B正确;
C.二氧化硫能被酸性高锰酸钾溶液氧化,二氧化硫有还原性,C错误;
D.二氧化硫能使品红溶液褪色,二氧化硫具有漂白性,D正确;
故选C。
8.D
【详解】A.硫黄与金属反应生成金属硫化物,硫元素化合价降低,硫作氧化剂,表现氧化性,故A正确;
B.石蜡燃烧生成二氧化碳、水,属于化学变化,故B正确;
C.“馏酒”是指用蒸馏方法将乙醇蒸出,故C正确;
D.“矾”指的是金属(如钠、锌、铁、铜等)的硫酸盐,故D错误;
选D。
9.B
【详解】A.Cs是ⅠA族元素,在化合物CsICl2中的化合价为+1,A正确;
B.CsICl2溶液中I显+1价,无I-存在,所以通Cl2无I2生成,B不正确;
C.CsICl2可看成由Cs+、Cl-、ICl等构成,则CsICl2是离子化合物,C正确;
D.CsICl2中Cl显-1价,具有还原性,向酸性高锰酸钾溶液中滴加CsICl2溶液,溶液褪色,D正确;
故选B。
10.A
【分析】根据原子半径与原子序数的关系图可推知元素a、b、c、d、e分别为O、Na、Al、Si、Cl,据此进行分析。
【详解】A.c元素的离子Al3+半径与a的离子O2-具有相同的电子排布,但Al3+的核电荷数大于O2-,则Al3+半径较小,A错误;
B.非金属性:SiC.b、c、e三种元素对应的最高价氧化物的水化物NaOH、Al(OH)3、HClO4,分别属于强碱、两性氢氧化物、强酸,则相互间能两两反应,C正确;
D.非金属性a>d,则a、d两元素分别形成的最简单氢化物的稳定性为d<a,D正确;
故选A。
11.C
【分析】短周期主族元素X、Y、Z的原子序数依次增大,X元素最外层电子数是电子层数的2倍,则X为C,Y元素是地壳中含量最多的金属元素,Y能溶于Z的最高价氧化物对应水化物的稀溶液,而不溶于其浓溶液,则Y为Al,Z为S。
【详解】A.有机化合物数量庞大、种类繁多,X(C)是形成化合物种类最多的元素,A正确;
B.Y(Al)的最高价氧化物是Al2O3,既能与酸反应生成铝盐和水,又能与碱反应生成偏铝酸盐和水,属于两性氧化物,故B正确;
C.同周期从左到右元素原子半径递减,同主族时,核电荷数越大,原子半径越大,原子半径:Y(Al)>Z(S)>X(C),C错误;
D.硫难溶于水、易溶于二硫化碳,实验室可用XZ2即二硫化碳清洗装有硫磺的试管,D正确;
答案选C。
12.B
【分析】已知:W、X、Y、Z为原子序数递增的四种短周期元素,其中X是地壳中含量最高的元素,X为氧;Y元素原子的M层电子数与K层电子数相同,为镁;W和Z为同一主族元素,W的最高正化合价与最低负化合价的代数和为0,则W为碳、Z为硅;
【详解】A.W的最高价氧化物对应的水化物为碳酸,碳酸为弱酸,A正确;
B.W和X形成的化合物CO不是酸性氧化物,B错误;
C.电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小;原子半径大小:,C正确;
D.金属性越强,最高价氧化物对应水化物的碱性越强,Y和Al两者的最高价氧化物对应的水化物的碱性较强的是Mg,D正确;
故选B。
13.C
【详解】A.Ge和Ga二者质子数不同,不互为同位素,A错误;
B.Ge和Ge二者质量数不相同,不互为同量素,B错误;
C.的质子数为31,中子数为68-31=37,中子数与质子数之差为6,C正确;
D.Ge的半衰期为271天,则mgGe衰变813天时剩余的质量为mg,D错误;
故选C。
14.D
【分析】X、Y、Z、W是四种短周期元素,原子序数依次增大。根据X、W元素形成的一种阴离子的结构可知,X和W均为第ⅥA族元素,最外层有6个电子,则X为O,W为S。X元素原子的最外层电子数是Y元素原子最外层电子数的3倍,则Y原子最外层有2个电子,则Y为Mg,Y、Z元素的原子序数之比为4:5,则Z为P。
【详解】A.该阴离子中中间的两个O显-1价,其他O元素的化合价为-2价,故A错误;
B.O2-和Mg2+电子层结构相同,质子数越多半径越小,则简单离子半径:X>Y,故B错误;
C.元素的非金属性越强,最高价氧化物对应水化物的酸性就越强。非金属性S>P,则酸性:H2SO4>H3PO4,故C错误;
D.X、Y形成化合物MgO常温下呈固态,X、W形成化合物SO2常温下为气体、SO3常温下为液态,则熔点MgO>SO3>SO2,故D正确;
故选D。
15.B
【分析】根据元素周期表所示位置, W 与 Z 的最外层电子数之和为10,可知W为C,Y为F,X为Si,Z为S,据此分析解题。
【详解】A.W为C,为第ⅣA族元素,A错误;
B.X为Si,其最高价氧化物为SiO2,是酸性氧化物,能和强碱溶液反应生成盐和水,B正确;
C.同周期元素从左到右原子半径逐渐减小,故原子半径: X>Z ,C错误;
D.非金属性越强,气态氢化物越稳定。非金属性 Y>Z ,故气态氢化物稳定性: Y>Z ,D错误;
答案选B。
16.(1)
(2) 长颈漏斗 ac
(3)
(4)具有漂白性
(5) 溶液由紫色变为红色
【分析】分析实验装置,装置A中铜与浓硫酸反应生成二氧化硫和水,B中SO2易溶于水,能与酸性KMnO4溶液、H2O2溶液反应,B可以起到安全瓶或者吸收、储存SO2的作用,C中滴有酚酞的NaOH溶液显红色,SO2与NaOH溶液反应生成Na2SO3与H2O,消耗了OH-,溶液变为无色,D中SO2能使品红溶液褪色,据此分析解题。
【详解】(1)装置A中进行的是Cu与浓硫酸的反应,产物为硫酸铜、二氧化硫、水,反应方程式为;
(2)组成装置B的玻璃仪器有:导气管,广口瓶和长颈漏斗;SO2易溶于水,能与酸性KMnO4溶液、H2O2溶液反应,但与浓硫酸不反应,因此,为贮存多余的SO2,广口瓶中不能盛放的液体为水和酸性高锰酸钾溶液,故答案为:长颈漏斗;ac;
(3)滴有酚酞的NaOH溶液显红色,SO2与NaOH溶液反应生成Na2SO3与H2O,消耗了OH-,溶液变为无色,因此C中的现象是溶液由红色变为无色,反应的离子方程式为;
(4)SO2能使品红溶液褪色,体现了SO2的漂白性,因此D中红色褪去的原因是SO2具有漂白性,故答案为:SO2具有漂白性;
(5)由图可知,打开a、b,往紫色石蕊溶液中同时通入体积(同温同压)比为1:1的SO2和Cl2,发生反应的化学方程式为:,故溶液颜色由紫色变为红色。
17.(1)Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
(2)f→g→b→c→d→e
(3)检验CO2中的SO2是否完全除去
(4)酸性高锰酸钾溶液不褪色,硅酸钠溶液中产生白色沉淀
(5) b 装置b中的碱石灰不仅能吸收二氧化硫还能吸收空气的二氧化碳和水蒸气
(6)需测定当高锰酸钾溶液刚褪色时通入的空气的体积
【分析】装置A中与70%浓硫酸反应制SO2气体, SO2进入装置D制取CO2气体,装置B用于除净CO2中的SO2,然后CO2进入装置C中验证碳、硅的非金属性;
【详解】(1)与70%浓硫酸反应的化学方程式:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)A中制取SO2,SO2进入D制取CO2气体,B用于除去CO2中的SO2,然后CO2进入C验证碳、硅的非金属性,则正确的连接方式为a→f→g→b→c→d→e;
(3)装置B中发生反应:5SO2+2MnO+2H2O=5SO+2Mn2++4H+;故足量酸性溶液的作用是除去CO2中的SO2;
(4)二氧化碳和水反应生成碳酸,若二氧化碳通入硅酸钠溶液中产生白色的硅酸沉淀,说明碳酸能制取硅酸,能证明碳酸酸性强于硅酸酸性,从而证明碳的非金属性强于硅;而二氧化硫和水反应生成亚硫酸,能硅酸钠溶液反应产生硅酸,故二氧化硫存在干扰,则能说明碳元素的非金属性比硅元素的非金属性强的实验现象是:高锰酸钾溶液不褪色、硅酸钠溶液中产生白色沉淀,
(5)装置b中的碱石灰不仅能吸收二氧化硫还能吸收空气的二氧化碳和水蒸气,会使得结果偏大,故b不可行;
(6)二氧化硫能使酸性高锰酸钾溶液褪色,用装置a测定SO2含量时,需测定当高锰酸钾溶液刚褪色时,通入的空气的体积。
18.(1) +6 Fe3+
(2) 过滤 >
(3) 复分解反应 NaOH
(4)
(5) 10.0 ad
【分析】足量新制氯水与铁屑反应,生成物中含有的金属阳离子只有,在碱性条件下被NaClO氧化为溶液,溶液中加饱和KOH溶液可转化为晶体析出,以此解答。
【详解】(1)由化学式,可知Fe的化合价为+6价;足量新制氯水与铁屑反应,则生成物中含有的金属阳离子只有。
(2)从溶液中分离固体(或晶体)的操作名称是过滤,则操作A和操作B均为过滤;向溶液中加饱和KOH溶液可转化为晶体析出,说明溶解度小。
(3)向溶液中加饱和KOH溶液可转化为晶体析出,反应III的化学方程式为:+2KOH=↓+2NaOH,从反应基本类型看,反应III属于复分解反应;溶液C中的主要溶质的化学式为NaOH。
(4)反应Ⅱ的反应物:反应Ⅰ的生成物和加入的NaClO、NaOH,生成物:溶液和NaCl固体,故反应化学方程式为。
(5)①要用到溶液,需要临时用容量瓶配制,则只能用250mL容量瓶配制,需NaOH的质量为,则用托盘天平称量NaOH固体的质量应为10.0g;
②a.转移溶液时有少许液体溅出,则溶质减少,导致所配溶液浓度偏小,a符合题意;
b.容量瓶中有少许蒸馏水,对溶液浓度无影响,b不符合题意;
c.定容时俯视刻度线,液面最低点没有达到刻度线,溶液体积小于要求体积,结果浓度偏大,c不符合题意;
d.定容摇匀后,发现液面下降,继续加水至刻度线,所得溶液体积大于要求体积,结果浓度偏小,d符合题意;
故答案选ad。
19.(1)第五周期ⅣA族
(2)5Sn+4NaNO3+6NaOH=5Na2SnO3+2N2+3H2O
(3) 减小 熔融时消耗的能量增多
(4)有利于控制温度
(5) 加热浓缩、趁热过滤 提高原料利用率,增加产品质量
【分析】吹渣高温真空蒸发除去Sb2O3,蒸余渣加氢氧化钠、硝酸钠高温碱溶,加水浸出,“浸出液”中主要溶质是Na2SnO3,还有少量Na3SbO4、Na2PbO2;“浸出液”加10%的Na2S溶液生成PbS除Pb;过滤,滤液中加Zn置换出Sb,“置换液”加热浓缩、趁热过滤、洗涤、干燥得Na2SnO3 xH2O。
【详解】(1)Sn的原子序数为50,其在元素周期表中的位置为第五周期ⅣA族;
(2)单质Sn在“高温碱熔”时与NaNO3、NaOH反应生成Na2SnO3、N2、H2O,反应的化学方程式为5Sn+4NaNO3+6NaOH=5Na2SnO3+2N2+3H2O;
(3)①由表可知,随着蒸余渣:NaOH和NaOH:NaNO3质量比值的减小,Sn的浸出率逐渐增大。
②适当增加熔剂NaOH和NaNO3的用量有助于提高Sn浸出率,但熔剂用量过大会导致熔融时消耗的能量增多,增加成本。
(4)“浸出”时控制温度40℃有助于降低杂质量,缓慢加水有利于控制温度;
(5)Na2SnO3 xH2O易溶于水,在水中的溶解度随着温度的升高而降低,获得Na2SnO3 xH2O的“系列操作”是加热浓缩、趁热过滤、洗涤、干燥;浓缩结晶母液返回置换液这一操作的优点是提高原料利用率,增加产品质量。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列反应的离子方程式书写正确的是
A.将氢氧化铁溶于氢碘酸: Fe(OH)3+3H+= Fe3++3H2O
B.向CuSO4溶液中加入少量Na2O2: 2Na2O2+2Cu2++2H2O= 4Na++2Cu(OH)2↓+O2↑
C.从酸化的海带灰浸出液中提取碘: 2I-+H2O2=I2+2OH-
D.向稀HNO3中滴加Na2SO3溶液: +2H+= SO2↑+H2O
2.下列关于物质或离子检验的叙述正确的是
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在
B.向某无色溶液中滴入酚酞试液后显红色,该溶液不一定是碱溶液
C.加入BaCl2溶液,生成白色沉淀,加稀硝酸后沉淀不溶解,可确定有SO存在
D.加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO存在
3.某小组拟从苦卤(含Br-等)中提取溴,设计的流程如图所示:
下列说法错误的是
A.提取溴包括浓缩、氧化、提取
B.步骤1和4利用的原理是氯的失电子能力比溴的强
C.步骤3的离子方程式为SO2+Br2+2H2O=4H++2Br-+SO
D.步骤2利用的原理是液溴的挥发性(或低沸点性)
4.实验室模拟工业处理含铬废水,操作及现象如图1,反应过程中铬元素的化合价变化如图2。已知H2O2是常用的强氧化剂之一。下列说法正确的是
A.实验开始至5 s,铬元素被氧化
B.实验开始至30 s,溶液中生成Cr3+时的氧化剂与还原剂的物质的量之比为1∶3
C.30 s至80 s的过程,一定是氧气氧化了Cr3+
D.80 s时,溶液中的主要阴离子仍为Cr2O
5.N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂。下述反应能产生N2O:3CO+2NO2=3CO2+ N2O。下列关于该反应的说法正确的是
A.CO是氧化剂
B.NO2发生氧化反应
C.NO2被还原
D.常温常压下,0.2 mol NO2参加反应会生成6.72 L CO2
6.我省为沿海省份,海洋中有丰富的食品、矿产、能源、药物和水产等资源,海水资源的综合利用可以用下图表示。
下列关于海水提取Br2的说法正确的是
A.将NaBr转化为Br2,可以选用Cl2、O2等还原剂
B.将Br2转化为HBr,可利用溴单质易升华的特性用空气将溴吹出
C.将Br2转化为HBr的离子方程式为:SO2+2H2O+Br2=2H++SO+2HBr
D.海水提取溴中出现了两次溴离子被氧化的过程
7.根据SO2通入不同溶液中的实验现象,所得结论不正确的是
选项 溶液 现象 结论
A 含HCl的Ba(NO3)2溶液 产生白色沉淀 SO2有还原性
B H2S溶液 产生黄色沉淀 SO2有氧化性
C 酸性KMnO4溶液 紫色溶液褪色 SO2有漂白性
D 品红溶液 溶液褪色 SO2有漂白性
A.A B.B C.C D.
8.中国传统文化中包含大量化学知识,下列说法错误的是
A.“石硫磺(S)能化……银、铜、铁,奇物”,这句话体现了石硫磺的氧化性
B.“春蚕到死丝方尽,蜡炬成灰泪始干”,其中的“蜡炬成灰”属于化学变化
C.《本草纲目》中多次提到“烧酒”,用高梁酿酒中的“馏酒”是指蒸馏操作
D.“至于矾现五色之形,硫为群石之将,皆变化于烈火”,其中的“矾”指的是金属硫化物
9.CsICl2是一种碱金属的化合物,在化学反应中既可表现氧化性又可表现还原性,则下列有关该物质的说法不正确的是
A.Cs显+1价
B.向CsICl2溶液中通入Cl2,有单质碘生成
C.CsICl2是离子化合物
D.向酸性高锰酸钾溶液中滴加CsICl2溶液,溶液褪色
10.五种短周期元素a、b、c、d、e,其原子半径与原子序数的关系如图,下列说法错误的是
A.c元素的离子半径比a的离子半径大
B.d元素对应的最高价氧化物的水化物酸性比e元素的弱
C.b、c、e三种元素对应的最高价氧化物的水化物相互间能发生反应
D.a、d两元素分别形成的最简单氢化物的稳定性为d<a
11.短周期主族元素X、Y、Z的原子序数依次增大,X元素最外层电子数是内层电子数的2倍,Y元素是地壳中含量最多的金属元素,常温下金属Y能溶于Z的最高价氧化物对应水化物的稀溶液,而不溶于其浓溶液。下列说法不正确的是
A.X是形成化合物种类最多的元素 B.Y的最高价氧化物属于两性氧化物
C.原子半径: D.实验室可用清洗装有硫磺的试管
12.我国火星探测器“祝融号”已在火星表而工作了很长的时间。火星气体及岩石中富含W、X、Y、Z四种元素。已知:W、X、Y、Z为原子序数递增的四种短周期元素,W和Z为同一主族元素,其中X是地壳中含量最高的元素,Y元素原子的M层电子数与K层电子数相同,W的最高正化合价与最低负化合价的代数和为0。下列说法错误的是
A.W的最高价氧化物对应的水化物为弱酸
B.W和X形成的化合物都是酸性氧化物
C.原子半径大小:
D.Y和Al两者的最高价氧化物对应的水化物的碱性较强的是Y
13.最近,中科院核化学研究室科研人员自主研发Ge分离纯化工艺和Ge/Ga发生器制备技术,并测得Ge的半衰期为271天。已知:质量数相同、质子数不同的原子互为同量素;半衰期指质量减少一半所需要的时间。下列说法正确的是
A.Ge和Ga互为同位素 B.Ge和Ge互为同量素
C.的中子数与质子数之差为6 D.mgGe衰变813天时剩余的质量为mg
14.X、Y、Z、W是四种短周期元素,原子序数依次增大。X元素原子的最外层电子数是Y元素原子最外层电子数的3倍,Y、Z元素的原子序数之比为4:5,X、W元素形成的一种阴离子的结构如图所示。下列说法正确的是
A.该阴离子中X元素均显-1价
B.简单离子半径:X<Y
C.最高价氧化物对应水化物的酸性:W<Z
D.X、Y形成化合物的熔点高于X、W形成化合物的熔点
15.表中是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与Z的最外层电子数之和为10。下列说法正确的是
W Y
X Z
A.W一定为第ⅢA族元素 B.X最高价氧化物能与强碱反应
C.原子半径:Z>X D.气态氢化物稳定性:Y<Z
二、实验题
16.某化学兴趣小组为探究二氧化硫的化学性质,他们采用下图装置进行有关实验。请回答下列问题:
(1)装置A中发生反应的化学方程式为_______。
(2)组成装置B的玻璃仪器有:导气管、广口瓶和_______。装置B的作用是贮存多余的气体,广口瓶内不能盛放的液体是_______(填字母)。
a.水 b.浓硫酸 c.酸性溶液
(3)装置C中的现象是溶液红色褪去,该反应的离子方程式为_______。
(4)装置D中的现象是溶液红色褪去,其原因是_______。
(5)为进一步探究二氧化硫的化学性质,他们还设计了下图所示装置,图中a、b为止水夹,X溶液为紫色石蕊试液。实验操作如下:打开a,b,同时通入体积(同温同压)比为的两种气体,则X中的现象为:_______,反应的离子方程式为_______。
17.某化学兴趣小组欲在实验室制备二氧化硫,并探究相关物质的一些性质。根据要求完成下列各小题。
I.验证碳、硅非金属性的相对强弱。
(已知酸性:亚硫酸>碳酸,CO2+Na2SiO3+H2O=Na2CO3+H2SiO3↓)
(1)写出Na2SO3与70%浓硫酸反应的化学方程式:_____。
(2)连接仪器:正确的连接方式为a→_____。
(3)装置B中足量酸性KMnO4溶液的作用是_____。
(4)能说明碳元素的非金属性比硅元素的非金属性强的实验现象是_____。
Ⅱ.某同学拟用如图装置测定空气中SO2的含量(假设空气中无其他还原性气体)。
(5)你认为不可行的装置是_____(填“a”或“b”),理由是_____。
(6)使用你所选用的装置测定SO2含量时,还需要测定的物理量是_____。
三、工业流程题
18.高铁酸钾()是一种环保、高效饮水处理剂,利用铁屑制备的简略流程如图所示:
请回答下列问题:
(1)高铁酸钾()中Fe的化合价为___________价;反应I的生成物中可能含有的金属阳离子是___________(用离子符号表示)。
(2)操作A和操作B相同,其操作名称是___________;由操作B判断该生产条件下物质的溶解性:___________(填“>”或“<”)。
(3)从反应基本类型看,反应III属于___________;溶液C中的主要溶质的化学式为___________。
(4)反应II中的反应化学方程式为___________。
(5)反应II中用到NaOH。若某同学做实验时要用到200 mL 1.0 mol/L NaOH溶液,需要临时用容量瓶配制,则:
①配制该浓度的溶液需用托盘天平称量NaOH固体的质量为___________g;
②配制过程中,下列操作导致所配溶液浓度偏小的是___________(填标号)。
a.转移溶液时有少许液体溅出
b.转移溶液时容量瓶中有少许蒸馏水
c.定容时俯视刻度线
d.定容摇匀后,发现液面下降,继续加水至刻度线
19.在脆硫铅锑矿火法冶炼过程中,产出的铅锑合金经氧化吹炼后,得到一种含铅锑锡的复合渣(俗称“吹渣”),其主要成分是Sn、Sb、Pb的氧化物。以“吹渣”为原料,制备锡酸钠晶体的工艺流程如图所示:
已知:i.锡(Sn)与C同主族,SnO2不溶于水、稀酸或碱液,但能溶于熔融NaOH;
ii.“高温碱熔”时,相关氧化物的反应顺序:Sn>Sb>Pb;
iii.“浸出”后,溶液中主要溶质是Na2SnO3,还有少量Na3SbO4、Na2PbO2;
iv.Na2SnO3 xH2O易溶于水,在水中的溶解度随着温度的升高而降低。
回答下列问题:
(1)Sn的原子序数为50,其在元素周期表中的位置为_____。
(2)蒸余渣中Sn元素的主要存在形式是SnO2,还有少量单质Sn,单质Sn在“高温碱熔”时生成Na2SnO3,对应的化学方程式为_____。
(3)“高温碱熔”时,配料比对Sn浸出率的影响如表所示:
蒸余渣:NaOH(质量比) NaOH:NaNO3(质量比) Sn浸出率/%
1:0.2 1:0.15 90.27
1:0.35 1:0.15 93.52
1:0.5 1:0.15 93.65
1:0.5 1:0.20 93.83
①由表可知,随着蒸余渣:NaOH和NaOH:NaNO3质量比值的______(填“增大”或“减小”),Sn的浸出率逐渐增大。
②适当增加熔剂NaOH和NaNO3的用量有助于提高Sn浸出率,但熔剂用量过大会导致_____,增加成本。
(4)“浸出”时控制温度40℃有助于降低杂质量,需要缓慢加水的原因是______。
(5)获得Na2SnO3 xH2O的“系列操作”是______、洗涤、干燥;浓缩结晶母液返回置换液这一操作的优点是______。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】A.三价铁离子能够氧化碘离子,氢氧化铁溶于氢碘酸,离子方程式为,故A错误;
B.向CuSO4溶液中加入Na2O2生成氢氧化铜和氧气,离子方程式为:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑,故B正确;
C.从酸化的海带灰浸出液中提取碘,离子方程式为:2H++2I-+H2O2=I2+2H2O,故C错误;
D.向稀HNO3中滴加Na2SO3溶液会发生氧化还原反应:2H++2NO+3SO=3SO+H2O+2NO↑,故D错误;
故选B。
2.B
【详解】A.因加HCl之前生成的可能是AgCl沉淀,也可能是别的白色沉淀,但是后面加上HCl中含有大量Cl-离子也可以与硝酸银溶液反应生成白色沉淀,所以不能确定Cl-离子是原溶液里的还是后来加进去的,选项A错误;
B.能使酚酞试液变红说明呈碱性,有可能是碱溶液,或碳酸钠等可溶性碳酸盐溶液,选项B正确;
C.加稀盐酸后沉淀不溶解,白色沉淀可能为硫酸钡或AgCl,故原溶液中可能含或Ag+,选项C错误;
D.能和盐酸反应生成能使澄清石灰水变浑浊的二氧化碳气体的可以是碳酸根、碳酸氢根等离子,此外二氧化硫也能使石灰水变浑浊,选项D错误;
答案选B。
3.B
【分析】氯气与溴离子发生氧化还原反应生成溴单质,用热空气将溴单质吹出,再与二氧化硫反应生成HBr和硫酸,HBr再与氯气反应生成溴单质,最后蒸馏得到纯溴;
【详解】A.提取溴过程中溴离子被氧化生成溴单质,步骤4富集溴元素,步骤5通过蒸馏收集溴单质,包括浓缩、氧化、提取,A正确;
B.步骤1和4反应的离子方程式均是Cl2+2Br-=2Cl-+Br2,氧化性:Cl2> Br2,非金属性:Cl>Br,即氯的得电子能力比溴的强,B错误;
C.步骤3是溴单质与二氧化硫反应生成HBr和硫酸,离子方程式为SO2+Br2+2H2O=4H++2Br-+ ,C正确;
D.步骤2利用的原理是液溴的挥发性,可用热空气将溴单质吹出,D正确;
故选:B。
4.B
【详解】A.根据图2可知,实验开始至5 s,铬元素的化合价保持为+6,没有被氧化,A错误;
B.实验开始至30 s,由图2知生成Cr3+,铬元素的化合价降低,则双氧水中氧元素化合价升高生成氧气,离子方程式为:3 H2O2++8H+=2 Cr3++7H2O+3O2↑,氧化剂与还原剂H2O2的物质的量之比为1∶3,B正确;
C.实验开始时,加入的H2O2过量,30s时,向溶液中加入NaOH,80s时,铬元素的化合价变为+6,可能是因为过氧化氢在碱性溶液中氧化性更强,过量的过氧化氢氧化了Cr3+,C错误;
D.根据图2知80 s时铬元素呈+6价,实验过程中加入了NaOH,溶液呈碱性,溶液中的主要阴离子为,D错误;
故选:B。
5.C
【详解】A.CO中碳化合价升高,失去电子,是还原剂,故A错误;
B.NO2中氮化合价降低,发生还原反应,故B错误;
C.NO2中氮化合价降低,被还原,故C正确;
D.0.2 mol NO2参加反应会生成0.3mol CO2,常温常压下,0.3mol CO2体积不等于6.72L,故D错误。
综上所述,答案为C。
6.D
【分析】氯碱工业即电解氯化钠溶液可生成氢氧化钠,氯化镁加入氢氧化钙反应生成氢氧化镁,再加入稀盐酸得到氯化镁溶液,溴化钠通入氯气氧化生成溴单质,再加入二氧化硫反应生成硫酸和HBr,最后用氯气氧化得到溴单质;
【详解】A.将NaBr转化为Br2,可以选用Cl2作还原剂,A错误;
B.利用溴单质易挥发的物理性质,可用热空气将溴单质吹出,B错误;
C.Br2与二氧化硫反应生成硫酸和HBr,离子方程式为:SO2+2H2O+Br2=4H+++2Br-,C错误;
D.溴化钠通入氯气氧化生成溴单质,HBr最后用氯气氧化得到溴单质,溴离子两次被氧化,D正确;
故选:D。
7.C
【详解】A.硝酸根离子在酸性条件下具有强氧化性,能氧化二氧化硫,说明生成二氧化硫有还原性,A正确;
B.硫化氢和二氧化硫反应,二氧化硫具有氧化性,B正确;
C.二氧化硫能被酸性高锰酸钾溶液氧化,二氧化硫有还原性,C错误;
D.二氧化硫能使品红溶液褪色,二氧化硫具有漂白性,D正确;
故选C。
8.D
【详解】A.硫黄与金属反应生成金属硫化物,硫元素化合价降低,硫作氧化剂,表现氧化性,故A正确;
B.石蜡燃烧生成二氧化碳、水,属于化学变化,故B正确;
C.“馏酒”是指用蒸馏方法将乙醇蒸出,故C正确;
D.“矾”指的是金属(如钠、锌、铁、铜等)的硫酸盐,故D错误;
选D。
9.B
【详解】A.Cs是ⅠA族元素,在化合物CsICl2中的化合价为+1,A正确;
B.CsICl2溶液中I显+1价,无I-存在,所以通Cl2无I2生成,B不正确;
C.CsICl2可看成由Cs+、Cl-、ICl等构成,则CsICl2是离子化合物,C正确;
D.CsICl2中Cl显-1价,具有还原性,向酸性高锰酸钾溶液中滴加CsICl2溶液,溶液褪色,D正确;
故选B。
10.A
【分析】根据原子半径与原子序数的关系图可推知元素a、b、c、d、e分别为O、Na、Al、Si、Cl,据此进行分析。
【详解】A.c元素的离子Al3+半径与a的离子O2-具有相同的电子排布,但Al3+的核电荷数大于O2-,则Al3+半径较小,A错误;
B.非金属性:Si
D.非金属性a>d,则a、d两元素分别形成的最简单氢化物的稳定性为d<a,D正确;
故选A。
11.C
【分析】短周期主族元素X、Y、Z的原子序数依次增大,X元素最外层电子数是电子层数的2倍,则X为C,Y元素是地壳中含量最多的金属元素,Y能溶于Z的最高价氧化物对应水化物的稀溶液,而不溶于其浓溶液,则Y为Al,Z为S。
【详解】A.有机化合物数量庞大、种类繁多,X(C)是形成化合物种类最多的元素,A正确;
B.Y(Al)的最高价氧化物是Al2O3,既能与酸反应生成铝盐和水,又能与碱反应生成偏铝酸盐和水,属于两性氧化物,故B正确;
C.同周期从左到右元素原子半径递减,同主族时,核电荷数越大,原子半径越大,原子半径:Y(Al)>Z(S)>X(C),C错误;
D.硫难溶于水、易溶于二硫化碳,实验室可用XZ2即二硫化碳清洗装有硫磺的试管,D正确;
答案选C。
12.B
【分析】已知:W、X、Y、Z为原子序数递增的四种短周期元素,其中X是地壳中含量最高的元素,X为氧;Y元素原子的M层电子数与K层电子数相同,为镁;W和Z为同一主族元素,W的最高正化合价与最低负化合价的代数和为0,则W为碳、Z为硅;
【详解】A.W的最高价氧化物对应的水化物为碳酸,碳酸为弱酸,A正确;
B.W和X形成的化合物CO不是酸性氧化物,B错误;
C.电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小;原子半径大小:,C正确;
D.金属性越强,最高价氧化物对应水化物的碱性越强,Y和Al两者的最高价氧化物对应的水化物的碱性较强的是Mg,D正确;
故选B。
13.C
【详解】A.Ge和Ga二者质子数不同,不互为同位素,A错误;
B.Ge和Ge二者质量数不相同,不互为同量素,B错误;
C.的质子数为31,中子数为68-31=37,中子数与质子数之差为6,C正确;
D.Ge的半衰期为271天,则mgGe衰变813天时剩余的质量为mg,D错误;
故选C。
14.D
【分析】X、Y、Z、W是四种短周期元素,原子序数依次增大。根据X、W元素形成的一种阴离子的结构可知,X和W均为第ⅥA族元素,最外层有6个电子,则X为O,W为S。X元素原子的最外层电子数是Y元素原子最外层电子数的3倍,则Y原子最外层有2个电子,则Y为Mg,Y、Z元素的原子序数之比为4:5,则Z为P。
【详解】A.该阴离子中中间的两个O显-1价,其他O元素的化合价为-2价,故A错误;
B.O2-和Mg2+电子层结构相同,质子数越多半径越小,则简单离子半径:X>Y,故B错误;
C.元素的非金属性越强,最高价氧化物对应水化物的酸性就越强。非金属性S>P,则酸性:H2SO4>H3PO4,故C错误;
D.X、Y形成化合物MgO常温下呈固态,X、W形成化合物SO2常温下为气体、SO3常温下为液态,则熔点MgO>SO3>SO2,故D正确;
故选D。
15.B
【分析】根据元素周期表所示位置, W 与 Z 的最外层电子数之和为10,可知W为C,Y为F,X为Si,Z为S,据此分析解题。
【详解】A.W为C,为第ⅣA族元素,A错误;
B.X为Si,其最高价氧化物为SiO2,是酸性氧化物,能和强碱溶液反应生成盐和水,B正确;
C.同周期元素从左到右原子半径逐渐减小,故原子半径: X>Z ,C错误;
D.非金属性越强,气态氢化物越稳定。非金属性 Y>Z ,故气态氢化物稳定性: Y>Z ,D错误;
答案选B。
16.(1)
(2) 长颈漏斗 ac
(3)
(4)具有漂白性
(5) 溶液由紫色变为红色
【分析】分析实验装置,装置A中铜与浓硫酸反应生成二氧化硫和水,B中SO2易溶于水,能与酸性KMnO4溶液、H2O2溶液反应,B可以起到安全瓶或者吸收、储存SO2的作用,C中滴有酚酞的NaOH溶液显红色,SO2与NaOH溶液反应生成Na2SO3与H2O,消耗了OH-,溶液变为无色,D中SO2能使品红溶液褪色,据此分析解题。
【详解】(1)装置A中进行的是Cu与浓硫酸的反应,产物为硫酸铜、二氧化硫、水,反应方程式为;
(2)组成装置B的玻璃仪器有:导气管,广口瓶和长颈漏斗;SO2易溶于水,能与酸性KMnO4溶液、H2O2溶液反应,但与浓硫酸不反应,因此,为贮存多余的SO2,广口瓶中不能盛放的液体为水和酸性高锰酸钾溶液,故答案为:长颈漏斗;ac;
(3)滴有酚酞的NaOH溶液显红色,SO2与NaOH溶液反应生成Na2SO3与H2O,消耗了OH-,溶液变为无色,因此C中的现象是溶液由红色变为无色,反应的离子方程式为;
(4)SO2能使品红溶液褪色,体现了SO2的漂白性,因此D中红色褪去的原因是SO2具有漂白性,故答案为:SO2具有漂白性;
(5)由图可知,打开a、b,往紫色石蕊溶液中同时通入体积(同温同压)比为1:1的SO2和Cl2,发生反应的化学方程式为:,故溶液颜色由紫色变为红色。
17.(1)Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
(2)f→g→b→c→d→e
(3)检验CO2中的SO2是否完全除去
(4)酸性高锰酸钾溶液不褪色,硅酸钠溶液中产生白色沉淀
(5) b 装置b中的碱石灰不仅能吸收二氧化硫还能吸收空气的二氧化碳和水蒸气
(6)需测定当高锰酸钾溶液刚褪色时通入的空气的体积
【分析】装置A中与70%浓硫酸反应制SO2气体, SO2进入装置D制取CO2气体,装置B用于除净CO2中的SO2,然后CO2进入装置C中验证碳、硅的非金属性;
【详解】(1)与70%浓硫酸反应的化学方程式:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)A中制取SO2,SO2进入D制取CO2气体,B用于除去CO2中的SO2,然后CO2进入C验证碳、硅的非金属性,则正确的连接方式为a→f→g→b→c→d→e;
(3)装置B中发生反应:5SO2+2MnO+2H2O=5SO+2Mn2++4H+;故足量酸性溶液的作用是除去CO2中的SO2;
(4)二氧化碳和水反应生成碳酸,若二氧化碳通入硅酸钠溶液中产生白色的硅酸沉淀,说明碳酸能制取硅酸,能证明碳酸酸性强于硅酸酸性,从而证明碳的非金属性强于硅;而二氧化硫和水反应生成亚硫酸,能硅酸钠溶液反应产生硅酸,故二氧化硫存在干扰,则能说明碳元素的非金属性比硅元素的非金属性强的实验现象是:高锰酸钾溶液不褪色、硅酸钠溶液中产生白色沉淀,
(5)装置b中的碱石灰不仅能吸收二氧化硫还能吸收空气的二氧化碳和水蒸气,会使得结果偏大,故b不可行;
(6)二氧化硫能使酸性高锰酸钾溶液褪色,用装置a测定SO2含量时,需测定当高锰酸钾溶液刚褪色时,通入的空气的体积。
18.(1) +6 Fe3+
(2) 过滤 >
(3) 复分解反应 NaOH
(4)
(5) 10.0 ad
【分析】足量新制氯水与铁屑反应,生成物中含有的金属阳离子只有,在碱性条件下被NaClO氧化为溶液,溶液中加饱和KOH溶液可转化为晶体析出,以此解答。
【详解】(1)由化学式,可知Fe的化合价为+6价;足量新制氯水与铁屑反应,则生成物中含有的金属阳离子只有。
(2)从溶液中分离固体(或晶体)的操作名称是过滤,则操作A和操作B均为过滤;向溶液中加饱和KOH溶液可转化为晶体析出,说明溶解度小。
(3)向溶液中加饱和KOH溶液可转化为晶体析出,反应III的化学方程式为:+2KOH=↓+2NaOH,从反应基本类型看,反应III属于复分解反应;溶液C中的主要溶质的化学式为NaOH。
(4)反应Ⅱ的反应物:反应Ⅰ的生成物和加入的NaClO、NaOH,生成物:溶液和NaCl固体,故反应化学方程式为。
(5)①要用到溶液,需要临时用容量瓶配制,则只能用250mL容量瓶配制,需NaOH的质量为,则用托盘天平称量NaOH固体的质量应为10.0g;
②a.转移溶液时有少许液体溅出,则溶质减少,导致所配溶液浓度偏小,a符合题意;
b.容量瓶中有少许蒸馏水,对溶液浓度无影响,b不符合题意;
c.定容时俯视刻度线,液面最低点没有达到刻度线,溶液体积小于要求体积,结果浓度偏大,c不符合题意;
d.定容摇匀后,发现液面下降,继续加水至刻度线,所得溶液体积大于要求体积,结果浓度偏小,d符合题意;
故答案选ad。
19.(1)第五周期ⅣA族
(2)5Sn+4NaNO3+6NaOH=5Na2SnO3+2N2+3H2O
(3) 减小 熔融时消耗的能量增多
(4)有利于控制温度
(5) 加热浓缩、趁热过滤 提高原料利用率,增加产品质量
【分析】吹渣高温真空蒸发除去Sb2O3,蒸余渣加氢氧化钠、硝酸钠高温碱溶,加水浸出,“浸出液”中主要溶质是Na2SnO3,还有少量Na3SbO4、Na2PbO2;“浸出液”加10%的Na2S溶液生成PbS除Pb;过滤,滤液中加Zn置换出Sb,“置换液”加热浓缩、趁热过滤、洗涤、干燥得Na2SnO3 xH2O。
【详解】(1)Sn的原子序数为50,其在元素周期表中的位置为第五周期ⅣA族;
(2)单质Sn在“高温碱熔”时与NaNO3、NaOH反应生成Na2SnO3、N2、H2O,反应的化学方程式为5Sn+4NaNO3+6NaOH=5Na2SnO3+2N2+3H2O;
(3)①由表可知,随着蒸余渣:NaOH和NaOH:NaNO3质量比值的减小,Sn的浸出率逐渐增大。
②适当增加熔剂NaOH和NaNO3的用量有助于提高Sn浸出率,但熔剂用量过大会导致熔融时消耗的能量增多,增加成本。
(4)“浸出”时控制温度40℃有助于降低杂质量,缓慢加水有利于控制温度;
(5)Na2SnO3 xH2O易溶于水,在水中的溶解度随着温度的升高而降低,获得Na2SnO3 xH2O的“系列操作”是加热浓缩、趁热过滤、洗涤、干燥;浓缩结晶母液返回置换液这一操作的优点是提高原料利用率,增加产品质量。
答案第1页,共2页
答案第1页,共2页
同课章节目录
