专题5第一单元元素周期律和元素周期表同步练习(含解析)2022——2023学年上学期高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题5第一单元元素周期律和元素周期表同步练习(含解析)2022——2023学年上学期高一化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 458.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-22 09:19:23 | ||
图片预览




文档简介
专题5第一单元元素周期律和元素周期表同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.当汽车遭受一定碰撞力量以后,安全气囊中的物质会发生剧烈的反应:
NaN3+ KNO3= K2O + Na2O + N2↑(未配平),生成大量气体。下列说法正确的是
A.半径大小:r(Na+) < r(N3-) B.电负性大小:χ(N) > χ(O)
C.第一电离能:I1(K) > I1(Na) D.碱性强弱:KOH < NaOH
2.X、Y、Z均为元素周期表中前20号元素,、、简单离子的电子层结构相同,下列说法正确的是
A.已知与,得
B.离子半径:
C.的还原性一定大于
D.气态氢化物的稳定性一定大于
3.下列说法中错误的是
A.钠的金属性比镁强 B.溴的非金属性比氯强
C.硝酸的酸性比磷酸弱 D.气态氢化物的热稳定性:H2S4.某短周期元素X的最外层电子数比次外层电子数少1个电子,则关于该元素说法正确的是
A.该元素一定是氯元素
B.X元素形成的单质都具有氧化性
C.X元素形成的单质都可能与H2O发生氧化还原反应
D.X元素形成的氢化物一定是一种强酸
5.如图为某国外学术期刊上刊登的八角形元素周期表,八角形的每个顶角对应一种元素,下列说法错误的是
A.图中虚线八角形所标元素属于我们现行元素周期表的第四周期
B.图中虚线箭头所经过的元素按箭头,原子的电子层数增多
C.图中①代表的元素单质在常温下能稳定存在,不发生化学反应
D.此八角形元素周期表中所表示的所有元素中没有副族元素
6.几种短周期元素的原子半径及主要化合价见下表:
元素符号 X Y Z R T
原子半径(nm) 0.160 0.089 0.102 0.143 0.074
主要化合价 +2 +2 -2、+4、+6 +3 -2
根据表中信息,判断以下说法正确的是
A.单质与稀硫酸反应的剧烈程度:R>Y>X
B.离子半径:X2+>R3+>T2-
C.最高价氧化物水化物的碱性:R>X
D.相同条件下,简单气态氢化物的稳定性:T>Z
7.X、Y、Z是三种主族元素,X的阳离子与Y的阴离子具有相同的电子层结构,Z的阴离子半径大于等电荷数的Y的阴离子的半径,则三种元素的原子序数大小顺序是
A.X>Y>Z B.Z>Y>X C.X>Z>Y D.Z>X>Y
8.短周期元素X和Y的离子X2+和Y2-具有相同电子层结构,下列说法正确的是
A.X2+的离子半径比Y2-小
B.X的原子序数比Y小
C.X和Y原子的电子层数相等
D.X和Y原子最外层电子数相等
9.氮族元素随原子核外电子层数的增加,下列变化规律的叙述有错误的是
A.非金属性逐渐减弱,金属性逐渐增强
B.单质的密度依次增大
C.氮、磷、砷单质的熔、沸点依次升高
D.单质与氢化合能力依次增强
10.向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL1mol·L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是
A.b曲线表示的离子方程式为:AlO+H++H2O=Al(OH)3↓
B.d和c曲线表示的离子反应是相同的
C.M点时Al(OH)3的质量等于3.9g
D.原混合溶液中的与AlO的物质的量之比为1︰2
11.砹(At)是放射性元素,它的化学性质符合卤素性质的变化规律,下列说法正确的是
A.HAt很稳定 B.AgAt易溶于水
C.砹易溶于有机溶剂 D.砹(At2)是白色固体
12.向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol·L-1Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是
A.图中C点铝元素存在形式是[Al(OH)4]-
B.向D点溶液中通入CO2气体,立即产生白色沉淀
C.原混合溶液中c[Al2(SO4)3]:c(AlCl3)=1:2
D.OA段反应的离子方程式为2Al3++3+3Ba2++8OH-=2[Al(OH)4]-+3BaSO4↓
13.根据元素周期律,由下列事实进行归纳推测,推测不合理的是
事实 推测
A. 12Mg与水反应缓慢,20Ca与水反应较快 56Ba(ⅡA)与水反应会更快
B. Si是半导体材料,同族的Ge也是半导体材料 ⅣA族的元素都是半导体材料
C. HCl在1500℃时分解,HI在230℃时分解 HBr的分解温度介于二者之间
D. Si与H2高温时反应,S与H2加热能反应 P与H2在高温时能反应
A.A B.B C.C D.D
14.X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10,X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是
A.熔点:X的氧化物比Y的氧化物高
B.热稳定性:X的氢化物大于Z的氢化物
C.X与Z可形成离子化合物ZX
D.Y的单质与Z的单质均能溶于浓硝酸
15.W、X、Y、Z为原子序数依次增大的短周期主族元素,四种元素原子的最外层电子数之和为15;W、X同周期且相邻,其中一种元素的单质为空气的主要成分之一;W、Z同主族.下列结论正确的是
A.原子半径的大小顺序为
B.Y的氯化物中含有离子键和共价键
C.Y的氧化物中不含离子键
D.X的氧化物对应的水化物的酸性比W的弱
二、实验题
16.铝、铁是生产、生活中常见的金属,其合金与盐在各领域都有着广泛的应用。
(1)铝合金是一种建筑装潢材料,它具有坚硬、轻巧、耐用的特性。铝合金的下列性质与这些特性无关的是
A.不易生锈 B.导电性好 C.密度小 D.硬度大
(2)铝元素在周期表中的位置是_______。写出与稀硫酸反应的离子方程式_______。铁粉与水蒸气在高温条件下反应,生成的固态产物是_______。
(3)焊接金属时常用的焊接液为氯化铵,其作用是消除焊接金属表面的铁锈。;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为_______个,有同学认为,该反应产物中不应该有Fe生成,他的理由是(用化学方程式表示原因)_______。
(4)现有仪器和药品:试管和胶头滴管,溶液、酸性溶液、溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:
实验步骤 操作 现象与结论
第一步 取少量液体装于试管,向试管中滴入几滴溶液。 _______
第二步 _______ _______;若无明显变化,则说明不含。
17.某同学为验证同主族元素原子得电子能力强弱进行如下实验:
Ⅰ.向溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;
Ⅱ.向溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;
Ⅲ.在淀粉碘化钾试纸上滴加几滴溴水。
回答下列问题:
(1)实验Ⅰ的现象_______。
(2)根据Ⅰ、Ⅱ、Ⅲ的实验现象可得实验结论为_______,请用原子结构的知识解释其原因:_______。
(3)实验Ⅰ、Ⅱ得到的层中含有卤素单质,可用浓溶液反萃取分离回收。以下是反萃取回收的操作过程:
①向装有的溶液的_______(填仪器名称)中加入少量浓溶液;
②振荡至溶液的_______色消失,振荡过程中仪器内压强会增大,需要打开_______(填“上口玻璃塞”或“下口活塞”)放气;
③静置、分层,先将层从仪器的下口放出,再将含碘的碱溶液从仪器的_______(填“上”、“下”)口倒入烧杯中;
④边搅拌边加入几滴45%的溶液,溶液立即转为棕黄色,并析出碘晶体,写出该反应的离子方程式_______。
三、工业流程题
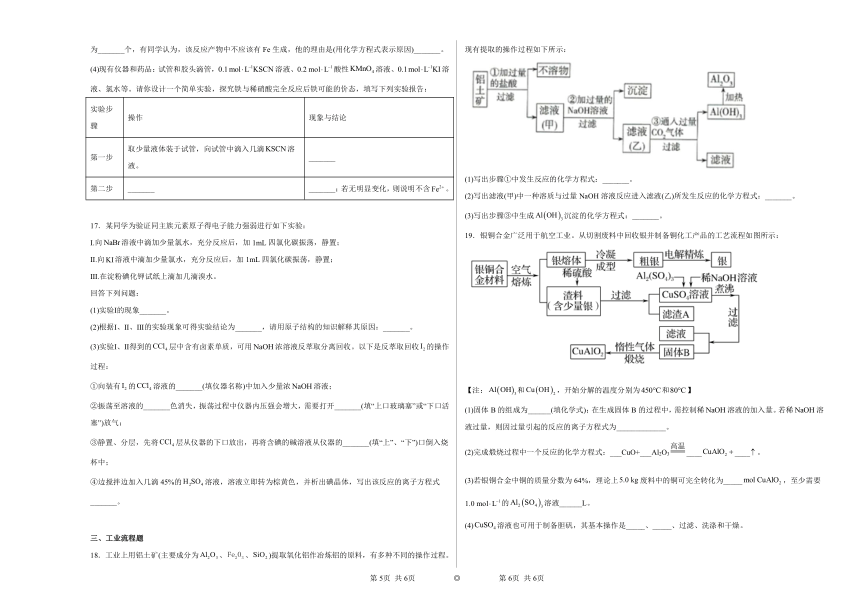
18.工业上用铝土矿(主要成分为、、)提取氧化铝作冶炼铝的原料,有多种不同的操作过程。现有提取的操作过程如下所示:
(1)写出步骤①中发生反应的化学方程式:_______。
(2)写出滤液(甲)中一种溶质与过量NaOH溶液反应进入滤液(乙)所发生反应的化学方程式:_______。
(3)写出步骤③中生成沉淀的化学方程式:_______。
19.银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺流程如图所示:
【注:和,开始分解的温度分别为和】
(1)固体B的组成为______(填化学式);在生成固体B的过程中,需控制稀溶液的加入量。若稀溶液过量,则因过量引起的反应的离子方程式为_____________。
(2)完成煅烧过程中一个反应的化学方程式:___CuO+___Al2O3________。
(3)若银铜合金中铜的质量分数为64%,理论上废料中的铜可完全转化为_____,至少需要的溶液______L。
(4)溶液也可用于制备胆矾,其基本操作是_____、_____、过滤、洗涤和干燥。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.A
【详解】A.钠离子和氮离子电子层数相同,但氮离子的核电荷数更小,半径更大,A正确;
B.非金属性O>N,所以电负性大小:χ(N)<χ(O),B错误;
C.最外层电子数相同,电子层数越多,第一电离能越小,所以电离能大小:I1(Na)>I1(K),C错误;
D.同主族自上而下金属性增强,最高价氧化物对应的水化物的碱性增强,所以碱性:KOH>NaOH,D错误;
综上所述答案为A。
2.C
【详解】A.与的电子层结构相同,则二种离子核外电子数相等,从而得出m-a=n+b,A不正确;
B.、、的电子层结构相同,则原子序数Z<Y<X,核电荷数越小,离子半径越大,则离子半径:,B不正确;
C.、的电子层结构相同,则Y、Z属于同一周期元素,且Z在Y的左边,非金属性Z<Y,所以的还原性一定大于,C正确;
D.由C选项的分析可知,非金属性Z<Y,非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性小于,D不正确;
故选C。
3.B
【详解】A.同周期自左至右金属性减弱,所以Na的金属性比Mg强,A正确;
B.同主族自上而下非金属性减弱,所以溴的非金属性比氯弱,B错误;
C.N的非金属性强于P,所以最高价氧化物的水化物的酸性更强,C正确;
D.S的非金属性弱于Cl,所以气态氢化物的稳定性:H2S综上所述答案为B。
4.C
【分析】短周期元素X的最外层电子数比次外层电子数少1个电子,当处于第二周期时X为Li,也可能处于第三周期,此时X为Cl。
【详解】A.由分析可知,Li元素也满足,A错误;
B.若X为Li元素,Li在反应中只能失电子,只有还原性,B错误;
C.单质Li或者Cl2都能与水发生氧化还原反应,C正确;
D.HCl属于强酸,若X为Li元素,LiH不属于酸,D错误;
故选C。
5.C
【详解】A.由图可知,虚线八角形所标元素由K到Kr,属于我们现行元素周期表的第四周期,正确;
B.由图可知,虚线箭头所经过的元素是同主族元素,C到Sn,原子的电子层数增多,正确;
C.图中①代表的元素是Al,铝单质在常温下能稳定存在,是由于Al和氧气在常温下反应生成致密的氧化铝薄膜,防止Al进一步腐蚀,发生了化学反应,错误;
D.八角形元素周期表是按同主族元素序数增大来排列的,所表示的所有元素只有主族和0族,没有副族元素,正确;
故选C。
6.D
【分析】短周期元素Z主要化合价是-2、+4、+6,则Z是S元素;X、Y主要化合价是+2价,说明它们是第IIA的元素,由于原子半径:X>Z>Y,则X是Mg元素,Y是Be元素;R主要化合价是+3价,原子半径:X>R,则R是Al元素;T主要化合价是-2价,Z原子半径小于Y,则T是O元素。
【详解】A.金属活动性越强,其单质与酸发生置换反应就越剧烈,同一周期中元素的金属性从左到右逐渐减弱,则金属性Mg>Al;同一主族元素的金属性从上到逐渐增大Mg>Be,在Mg、Al、Be三种元素中Mg最活泼,因此Mg(X)与稀硫酸反应最剧烈,A项错误;
B.X是Mg元素,R是Al元素,T是O元素,它们形成的离子分别为Mg2+、Al3+、O2-,核外电子排布都是2、8,电子层结构相同,对于电子层结构相同的离子,离子的核电荷数越大,离子半径越小,所以离子半径由大到小的顺序是:T2->X2+>R3+,B项错误;
C.同一周期从左到右,元素的最高价氧化物水化物的碱性逐渐减弱,则碱性:X[Mg(OH)2]>R[Al(OH)3],C项错误;
D.元素的非金属性越强,其形成的简单氢化物的稳定性就越强。Z是S元素,T是O元素,它们是同一主族的元素,元素的非金属性:O>S,所以氢化物的稳定性:H2O(T)>H2S(Z),D项正确;
答案选D。
7.D
【详解】元素原子核外电子数等于原子核内质子数,等于其核电荷数。金属元素的原子失去电子形成阳离子;非金属元素的原子获得电子形成阴离子。X、Y、Z三种主族元素,X的阳离子与Y的阴离子具有相同的电子层结构,则X处于Y的下一周期,原子序数:X>Y;Z阴离子半径大于等电荷数的Y的阴离子半径,则Y与Z处于同一主族,原子序数:Z>Y;Z与X可能处于同一周期也可能其周期数比X的周期数大。X形成阳离子,说明X为金属元素;Y、Z形成阴离子,则Y、Z为非金属,原子序数Z>X,故X、Y、Z三种主族元素的原子序数大小关系为:Z>X>Y,合理选项是D。
8.A
【分析】短周期元素X和Y的离子X2+和Y2-具有相同电子层结构,则X为Mg元素,Y为O元素。
【详解】A.电子层数相同时,原子序数越小,半径越大,则X2+的离子半径比Y2-小,A正确;
B.X为12号Mg元素,Y为8号O元素,则X的原子序数比Y大,B错误;
C.X原子有3层电子层,而Y原子有2层电子层,则X和Y原子的电子层数不相等,C错误;
D.X原子最外层电子数为2,而Y原子最外层电子数为6,则X和Y原子最外层电子数不相等,D错误;
故选A。
9.D
【详解】A.同主族元素从上到下,非金属性逐渐减弱,金属性逐渐增强,故A正确;
B.单质的密度依次增大,故B正确;
C.氮、磷、砷都是非金属元素,单质由分子构成,相对分子质量逐渐增大,熔沸点逐渐升高,故C正确;
D.同主族元素从上到下,非金属性逐渐减弱,单质与氢化合能力依次减弱,故D错误;
选D。
10.C
【分析】Na2CO3、NaAlO2的混合溶液中加入HCl溶液,先发生反应AlO+H++H2O═Al(OH)3↓,a线表示AlO减少;第二阶段,AlO反应完毕,发生反应CO+H+═HCO,b线表示CO减少,c线表示HCO的增加;第三阶段,CO反应完毕,发生反应HCO+H+═CO2↑+H2O,d线表示HCO减少,此阶段Al(OH)3不参与反应。
【详解】A.由分析可知,b曲线表示的离子方程式为:CO+H+═HCO,A错误;
B.由分析可知,d和c曲线表示的离子反应是不相同的,B错误;
C.盐酸50mL时NaAlO2中铝元素全部转化为氢氧化铝沉淀,加50mL盐酸之后CO反应,氢氧化铝沉淀不溶解,则M点沉淀的质量和盐酸50mL时沉淀的质量相同,由NaAlO2+HCl+H2O=NaCl+Al(OH)3↓知,n(Al(OH)3)=n(NaAlO2)=n(HCl)=0.05mol,m[Al(OH)3]=0.05mol×78g/mol=3.9g,C正确;
D.第一、第二两段消耗的盐酸的体积都是50ml,所以消耗的氯化氢的物质的量相等,依据第一阶段、第二阶段发生反应AlO2-+H++H2O═Al(OH)3↓,CO+H+═HCO3-,可知CO与AlO的物质的量之比为1:1,D错误;
故选C。
11.C
【分析】砹(At)为第六周期第ⅦA族元素;
【详解】A.卤族元素随着原子半径增大,卤化氢的稳定性减弱,Hat不稳定,A错误;
B.氟化银到碘化银溶解性减小,则AgAt难溶于水,B错误;
C.同主族由上而下,溴、碘易溶于有机溶剂,则砹易溶于有机溶剂,C正确;
D.同主族由上而下,卤素单质颜色变深,砹(At2)不是白色固体,D错误;
故选C。
12.D
【分析】从图象可以看出,加入3L氢氧化钡溶液即3mol氢氧化钡时,生成的沉淀的物质的量为5mol,此时对应A点,硫酸铝和氢氧化钡恰好反应完全,硫酸根离子完全沉淀,可知硫酸铝的物质的量为1mol,生成的5mol沉淀其中有3mol为硫酸钡,2mol为氢氧化铝,再继续加入3mol氢氧化钡,沉淀继续增多,生成的沉淀为氢氧化铝,可知氯化铝的物质的量为2mol,B点时沉淀最多,硫酸根离子和铝离子都沉淀完全,硫酸钡的物质的量为3mol,氢氧化铝的物质的量为4mol。再加入氢氧化钡,氢氧化铝溶解,加入2mol氢氧化钡,4mol氢氧化铝完全溶解,生成Na[Al(OH)4],此时到达C点,此时沉淀只有硫酸钡,再加入氢氧化钡,沉淀量无变化。
【详解】A.由以上分析可知,C点为BaSO4沉淀,其物质的量为3mol,此时铝元素以[Al(OH)4]-的形式存在,故A正确;
B.D点溶液中有过量的氢氧化钡和Na[Al(OH)4],通入的二氧化碳和氢氧化钡反应立即生成碳酸钡白色沉淀,故B正确;
C.由以上分析可知,原溶液中硫酸铝的物质的量为1mol,氯化铝的物质的量为2mol,即c[Al2(SO4)3]:c(AlCl3)=1:2,故C正确;
D.由以上分析可知,OA段相当于硫酸铝和氢氧化钡反应,反应的离子方程式为2Al3++3 +3Ba2++6OH- = 3BaSO4↓+2Al(OH)3↓,故D错误;
故选D。
13.B
【详解】A.同主族金属元素从上到下元素的金属性逐渐增强,与水反应剧烈程度增强。元素的金属性:Ba>Ca>Mg,故可根据Ca与水反应较快推知Ba与水反应会更快,A正确;
B.半导体材料通常位于元素周期表中金属元素和非金属元素的分界处,Si和Ge处于金属和非金属分界线处,能作半导体,而C和Pb不能作半导体,所以第IVA族元素并不都是半导体材料,B错误;
C.同主族元素从上到下元素的非金属元素逐渐减弱,元素的非金属性越强,其简单氢化物的稳定性就越强。元素的非金属性:Cl>Br>I,所以HBr的稳定性介于HCl、HI之间,其分解温度介于二者之间,C正确;
D.同周期元素的非金属元素从左到右逐渐增强,元素的非金属性越强,其单质与H2化合就越容易,元素的非金属性:S>P>Si,所以可根据Si与H2高温时反应,S与H2加热能反应推知P与H2在高温时能反应,D正确;
故合理选项是B。
14.B
【分析】Y的最外层电子数等于X次外层电子数,由于均是主族元素,所以Y的最外层电子数不可能是8个,则X只能是第二周期元素,因此Y的最外层电子数是2个,又因为Y的原子半径大于Z,则Y只能是第三周期的Mg,因此X与Z的最外层电子数是,则X是C,Z是Si;据此分析解答。
【详解】A.碳的氧化物形成的分子晶体,Y的氧化物是离子化合物氧化镁,则氧化镁的熔点高于碳的氧化物熔点,A错误;
B.碳元素的非金属性强于硅元素,非金属性越强,氢化物越稳定,则碳的氢化物稳定性强于硅的氢化物稳定性,B正确;
C.C与Si形成的是共价化合物SiC,C错误;
D.单质镁能溶于浓硝酸,单质硅不溶于浓硝酸,D错误;
故答案选B。
15.A
【分析】由W、X同周期且相邻,其中一种元素的单质为空气的主要成分之一,可知W、X位于第二周期,分别为C、N或O、F,W、Z同主族,则Z为或S,根据四种元素原子的最外层电子数之和为15可知,W、Z不可能为O、S,故W、X、Y、Z分别为C、N、Mg、。
【详解】A.同周期元素原子半径从左往右减小,同主族元素原子从上往下增大,故原子半径:,A正确;
B.中只含离子键,B错误;
C.Mg的氧化物为,为离子化合物,其中含有离子键,C错误;
D.N的氧化物对应的水化物为或,其酸性均强于,D错误;
故选A。
16.(1)B
(2) 第3周期第ⅢA族 Fe3O4
(3) 0.9NA
(4) 若溶液呈血红色,则说明含,Fe3+若不显血红色,证明没有Fe3+ 取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液 若高锰酸钾溶液紫红色褪去,说明含Fe2+
【分析】铝镁合金具有耐腐蚀性、密度小、机械强度高等方面的特点;铝元素核电荷数为13,核外电子层数三个,最外层电子数3个,周期序数=电子层数,主族族序数=原子最外层电子数,据此判断在周期表中的位置,Al(OH)3与稀硫酸反应生成硫酸铝和水,铁粉与水蒸气在高温条件下反应,生成四氧化三铁和氢气,铁离子能和硫氰化钾溶液反应络合物而使溶液呈血红色,亚铁离子和硫氰化钾溶液不反应,亚铁离子能被酸性高锰酸钾氧化而使酸性高锰酸钾溶液褪色,铁离子不能被酸性高锰酸钾溶液氧化,以此解题。
【详解】(1)A.不易生锈,用作建筑装潢材料,美观,A正确;
B.导电性好,与装潢无关,B错误;
C.密度小,有利于用作建筑装潢材料,C正确;
D.强度高,用作建筑装潢材料,坚固耐用,D正确;
故选B;
(2)铝是13号元素,在周期表中的位置是:第3周期第ⅢA族;与稀硫酸反应生成硫酸铝和水,离子方程式为:;铁粉与水蒸气在高温条件下反应生成Fe3O4和氢气;
(3)3.36L氮气的物质的量为0.15mol,根据方程式,上述反应中氮元素化合价- 3价升高到0价,生成3mol氮气,电子转移总数18mole-,当生成0.15mol氮气时,转移的电子数;,有同学认为,该反应产物中不应该有Fe生成,他的理由是铁和氯化铁反应生成氯化亚铁,反应的化学方程式为:;
(4)铁离子能和硫氰化钾溶液反应生成络合物而使溶液呈血红色,亚铁离子和硫氰化钾溶液不反应,亚铁离子能被酸性高锰酸钾氧化而使酸性高锰酸钾溶液褪色,铁离子不能被酸性高锰酸钾溶液氧化,如果向溶液中滴加硫氰化钾溶液,溶液变为血红色就说明含有铁离子,否则不含铁离子如果向溶液中滴加酸性高锰酸钾溶液,如果酸性高锰酸钾溶液褪色,就说明含有亚铁离子,否则不含亚铁离子,故答案为:若溶液呈血红色,则说明含,Fe3+若不显血红色,证明没有Fe3+;取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液;若高锰酸钾溶液紫红色褪去,说明含Fe2+。
17. 溶液分层,下层呈橙色 元素原子得电子能力: 氯、溴、碘元素位于元素周期表中的同一主族,三种元素原子的最外层电子数相同,因此随着核外电子层数的依次增加,原子半径依次增加,元素原子吸引电子的能力依次减弱 分液漏斗 紫红 下口活塞 上
【分析】元素的非金属性越强,其单质的氧化性越强,同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;氯气能氧化溴离子生成溴单质,能氧化碘离子生成碘单质,溴能氧化碘离子生成碘单质,据此判断非金属性强弱。
【详解】(1) 根据分析,向溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置,发生置换反应,生成的溴单质溶于四氯化碳,四氯化碳不溶于水,密度比水大,则现象为溶液分层,下层呈橙色,故答案为:溶液分层,下层呈橙色;
(2) Ⅰ中氧化剂是Cl2,氧化产物是Br2,Ⅱ中氧化剂是Cl2,氧化产物是I2,Ⅲ中氧化剂是Br2,氧化产物是I2,所以氧化性强弱顺序是Cl2> Br2> I2,则元素原子得电子能力:。用原子结构的知识解释为:氯、溴、碘元素位于元素周期表中的同一主族,三种元素原子的最外层电子数相同,因此随着核外电子层数的依次增加,原子半径依次增加,元素原子吸引电子的能力依次减弱,故答案为:元素原子得电子能力:;氯、溴、碘元素位于元素周期表中的同一主族,三种元素原子的最外层电子数相同,因此随着核外电子层数的依次增加,原子半径依次增加,元素原子吸引电子的能力依次减弱;
(3)①用浓溶液反萃取后再加稀酸,可以分离和,向装有的溶液的分液漏斗中加入少量浓溶液进行反萃取,故答案为:分液漏斗;
②碘单质溶于四氯化碳时呈紫红色,加入氢氧化钠浓溶液后振荡,碘单质与氢氧化钠反应,至溶液的紫红色消失。萃取时振荡过程中分液漏斗内压强会增大,要将分液漏斗倒置让漏斗颈向上,慢慢打开下口活塞放气,故答案为:紫红;下口活塞;
③充分反应后NaI、NaIO3溶于水,密度小于四氯化碳,分层后水溶液位于上层,因此含碘的碱溶液从分液漏斗的上口倒出,故答案为:上;
④由题给信息可知,NaI、NaIO3在酸性条件下发生归中反应生成碘,根据得失电子守恒、电荷守恒和原子守恒,写出该反应的离子方程式为:,故答案为:。
18. 、
【解析】铝土矿加过量盐酸溶解,、Al2O3和HCl反应溶解,反应方程式分别为:+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O。而SiO2不与盐酸反应,所以沉淀为不溶物SiO2;滤液中含有的阳离子有Fe3+、Al3+、H+,加入过量烧碱,氢离子和氢氧化钠反应生成水,铁离子和氢氧化钠反应生成氢氧化铁沉淀,生成的氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,所以沉淀的成分是氢氧化铁;滤液甲中含有偏铝酸钠和氯化钠,通入过量的二氧化碳可以得到碳酸氢钠和氢氧化铝沉淀,反应的方程式为,滤液乙主要成分为NaHCO3,氢氧化铝沉淀加热可以得到氧化铝,即2Al(OH)3Al2O3+3H2O,以此解答该题。
【详解】(1)步骤①中加入盐酸,发生反应的方程式为、,故答案为:、;
(2)步骤②加入过量的NaOH,先生成的沉淀为Al(OH)3、Fe(OH)3,继续加NaOH,氢氧化铝溶于强碱生成偏铝酸钠,因此滤液(甲)中一种溶质与过量NaOH溶液反应进入滤液(乙)所发生反应的化学方程式:,故答案为:;
(3)步骤③中通入过量的二氧化碳,与偏铝酸钠反应生成氢氧化铝沉淀和碳酸氢钠,发生的化学方程式为,故答案为:;
19. CuO、Al(OH)3 Al(OH)3+OH-=+ 2H2O 4 2 4 O2 50 25 蒸发浓缩 冷却结晶
【分析】银铜合金废料在空气中熔炼得到银溶体和渣料,Cu加热氧化产生CuO,所以渣料中含有CuO和少量Ag,向渣料中加入稀硫酸,CuO反应变为CuSO4,Ag不发生反应,经过滤除去Ag单质,向CuSO4溶液中加入Al2(SO4)3和适量稀NaOH溶液,反应产生Cu(OH)2、Al(OH)3沉淀,加热煮沸,结合Al(OH)3和Cu(OH)2开始分解的温度,Cu(OH)2分解变为CuO,因此过滤得到的固体B中含有CuO和Al(OH)3,在惰性环境中煅烧固体B,其中一个反应为:4CuO+2Al2O34CuAlO2+O2↑,然后利用元素守恒并结合物质的性质逐项分析解答。
【详解】(1)根据上述分析可知固体B成分为CuO和Al(OH)3;由于Al(OH)3是两性氢氧化物,能够与强碱NaOH溶液发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,所以在生成固体B的过程中,需控制稀NaOH溶液的加入量,该反应的离子方程式为:Al(OH)3+OH-=+ 2H2O;若稀NaOH溶液过量,则Al(OH)3会转化为NaAlO2;
(2)该反应为氧化还原反应,根据电子守恒、原子守恒,可得反应方程式为:4CuO+2Al2O34CuAlO2+O2↑,故按照物质书写顺序,由前到后各种的系数及缺项物质分别是4、2、4、O2;
(3)根据Cu元素守恒,则理论上生成CuAlO2的物质的量n(CuAlO2)==50 mol,则由CuAlO2中Al、Cu的物质的量的比是1:1至少需要Al2(SO4)3的物质的量为25 mol,因此至少需要1.0 mol/L的Al2(SO4)3溶液的体积V[Al2(SO4)3]==25 L;
(4)由于CuSO4的溶解度较大,并且随溶液温度的升高而增大,所以由CuSO4溶液制备胆矾需要的操作为蒸发浓缩、冷却结晶,然后过滤、洗涤和干燥就得到晶体CuSO4·5H2O。
【点睛】本题以物质制备为线索,考查物质性质的应用、混合物的分离提纯。注意结合Cu(OH)2、Al(OH)3的分解温度判断物质B的成分,最后根据目标产物,结合元素守恒确定缺少的物质并进行配平和有关物质的化学计算。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.当汽车遭受一定碰撞力量以后,安全气囊中的物质会发生剧烈的反应:
NaN3+ KNO3= K2O + Na2O + N2↑(未配平),生成大量气体。下列说法正确的是
A.半径大小:r(Na+) < r(N3-) B.电负性大小:χ(N) > χ(O)
C.第一电离能:I1(K) > I1(Na) D.碱性强弱:KOH < NaOH
2.X、Y、Z均为元素周期表中前20号元素,、、简单离子的电子层结构相同,下列说法正确的是
A.已知与,得
B.离子半径:
C.的还原性一定大于
D.气态氢化物的稳定性一定大于
3.下列说法中错误的是
A.钠的金属性比镁强 B.溴的非金属性比氯强
C.硝酸的酸性比磷酸弱 D.气态氢化物的热稳定性:H2S
A.该元素一定是氯元素
B.X元素形成的单质都具有氧化性
C.X元素形成的单质都可能与H2O发生氧化还原反应
D.X元素形成的氢化物一定是一种强酸
5.如图为某国外学术期刊上刊登的八角形元素周期表,八角形的每个顶角对应一种元素,下列说法错误的是
A.图中虚线八角形所标元素属于我们现行元素周期表的第四周期
B.图中虚线箭头所经过的元素按箭头,原子的电子层数增多
C.图中①代表的元素单质在常温下能稳定存在,不发生化学反应
D.此八角形元素周期表中所表示的所有元素中没有副族元素
6.几种短周期元素的原子半径及主要化合价见下表:
元素符号 X Y Z R T
原子半径(nm) 0.160 0.089 0.102 0.143 0.074
主要化合价 +2 +2 -2、+4、+6 +3 -2
根据表中信息,判断以下说法正确的是
A.单质与稀硫酸反应的剧烈程度:R>Y>X
B.离子半径:X2+>R3+>T2-
C.最高价氧化物水化物的碱性:R>X
D.相同条件下,简单气态氢化物的稳定性:T>Z
7.X、Y、Z是三种主族元素,X的阳离子与Y的阴离子具有相同的电子层结构,Z的阴离子半径大于等电荷数的Y的阴离子的半径,则三种元素的原子序数大小顺序是
A.X>Y>Z B.Z>Y>X C.X>Z>Y D.Z>X>Y
8.短周期元素X和Y的离子X2+和Y2-具有相同电子层结构,下列说法正确的是
A.X2+的离子半径比Y2-小
B.X的原子序数比Y小
C.X和Y原子的电子层数相等
D.X和Y原子最外层电子数相等
9.氮族元素随原子核外电子层数的增加,下列变化规律的叙述有错误的是
A.非金属性逐渐减弱,金属性逐渐增强
B.单质的密度依次增大
C.氮、磷、砷单质的熔、沸点依次升高
D.单质与氢化合能力依次增强
10.向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL1mol·L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是
A.b曲线表示的离子方程式为:AlO+H++H2O=Al(OH)3↓
B.d和c曲线表示的离子反应是相同的
C.M点时Al(OH)3的质量等于3.9g
D.原混合溶液中的与AlO的物质的量之比为1︰2
11.砹(At)是放射性元素,它的化学性质符合卤素性质的变化规律,下列说法正确的是
A.HAt很稳定 B.AgAt易溶于水
C.砹易溶于有机溶剂 D.砹(At2)是白色固体
12.向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol·L-1Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是
A.图中C点铝元素存在形式是[Al(OH)4]-
B.向D点溶液中通入CO2气体,立即产生白色沉淀
C.原混合溶液中c[Al2(SO4)3]:c(AlCl3)=1:2
D.OA段反应的离子方程式为2Al3++3+3Ba2++8OH-=2[Al(OH)4]-+3BaSO4↓
13.根据元素周期律,由下列事实进行归纳推测,推测不合理的是
事实 推测
A. 12Mg与水反应缓慢,20Ca与水反应较快 56Ba(ⅡA)与水反应会更快
B. Si是半导体材料,同族的Ge也是半导体材料 ⅣA族的元素都是半导体材料
C. HCl在1500℃时分解,HI在230℃时分解 HBr的分解温度介于二者之间
D. Si与H2高温时反应,S与H2加热能反应 P与H2在高温时能反应
A.A B.B C.C D.D
14.X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10,X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是
A.熔点:X的氧化物比Y的氧化物高
B.热稳定性:X的氢化物大于Z的氢化物
C.X与Z可形成离子化合物ZX
D.Y的单质与Z的单质均能溶于浓硝酸
15.W、X、Y、Z为原子序数依次增大的短周期主族元素,四种元素原子的最外层电子数之和为15;W、X同周期且相邻,其中一种元素的单质为空气的主要成分之一;W、Z同主族.下列结论正确的是
A.原子半径的大小顺序为
B.Y的氯化物中含有离子键和共价键
C.Y的氧化物中不含离子键
D.X的氧化物对应的水化物的酸性比W的弱
二、实验题
16.铝、铁是生产、生活中常见的金属,其合金与盐在各领域都有着广泛的应用。
(1)铝合金是一种建筑装潢材料,它具有坚硬、轻巧、耐用的特性。铝合金的下列性质与这些特性无关的是
A.不易生锈 B.导电性好 C.密度小 D.硬度大
(2)铝元素在周期表中的位置是_______。写出与稀硫酸反应的离子方程式_______。铁粉与水蒸气在高温条件下反应,生成的固态产物是_______。
(3)焊接金属时常用的焊接液为氯化铵,其作用是消除焊接金属表面的铁锈。;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为_______个,有同学认为,该反应产物中不应该有Fe生成,他的理由是(用化学方程式表示原因)_______。
(4)现有仪器和药品:试管和胶头滴管,溶液、酸性溶液、溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:
实验步骤 操作 现象与结论
第一步 取少量液体装于试管,向试管中滴入几滴溶液。 _______
第二步 _______ _______;若无明显变化,则说明不含。
17.某同学为验证同主族元素原子得电子能力强弱进行如下实验:
Ⅰ.向溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;
Ⅱ.向溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;
Ⅲ.在淀粉碘化钾试纸上滴加几滴溴水。
回答下列问题:
(1)实验Ⅰ的现象_______。
(2)根据Ⅰ、Ⅱ、Ⅲ的实验现象可得实验结论为_______,请用原子结构的知识解释其原因:_______。
(3)实验Ⅰ、Ⅱ得到的层中含有卤素单质,可用浓溶液反萃取分离回收。以下是反萃取回收的操作过程:
①向装有的溶液的_______(填仪器名称)中加入少量浓溶液;
②振荡至溶液的_______色消失,振荡过程中仪器内压强会增大,需要打开_______(填“上口玻璃塞”或“下口活塞”)放气;
③静置、分层,先将层从仪器的下口放出,再将含碘的碱溶液从仪器的_______(填“上”、“下”)口倒入烧杯中;
④边搅拌边加入几滴45%的溶液,溶液立即转为棕黄色,并析出碘晶体,写出该反应的离子方程式_______。
三、工业流程题
18.工业上用铝土矿(主要成分为、、)提取氧化铝作冶炼铝的原料,有多种不同的操作过程。现有提取的操作过程如下所示:
(1)写出步骤①中发生反应的化学方程式:_______。
(2)写出滤液(甲)中一种溶质与过量NaOH溶液反应进入滤液(乙)所发生反应的化学方程式:_______。
(3)写出步骤③中生成沉淀的化学方程式:_______。
19.银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺流程如图所示:
【注:和,开始分解的温度分别为和】
(1)固体B的组成为______(填化学式);在生成固体B的过程中,需控制稀溶液的加入量。若稀溶液过量,则因过量引起的反应的离子方程式为_____________。
(2)完成煅烧过程中一个反应的化学方程式:___CuO+___Al2O3________。
(3)若银铜合金中铜的质量分数为64%,理论上废料中的铜可完全转化为_____,至少需要的溶液______L。
(4)溶液也可用于制备胆矾,其基本操作是_____、_____、过滤、洗涤和干燥。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.A
【详解】A.钠离子和氮离子电子层数相同,但氮离子的核电荷数更小,半径更大,A正确;
B.非金属性O>N,所以电负性大小:χ(N)<χ(O),B错误;
C.最外层电子数相同,电子层数越多,第一电离能越小,所以电离能大小:I1(Na)>I1(K),C错误;
D.同主族自上而下金属性增强,最高价氧化物对应的水化物的碱性增强,所以碱性:KOH>NaOH,D错误;
综上所述答案为A。
2.C
【详解】A.与的电子层结构相同,则二种离子核外电子数相等,从而得出m-a=n+b,A不正确;
B.、、的电子层结构相同,则原子序数Z<Y<X,核电荷数越小,离子半径越大,则离子半径:,B不正确;
C.、的电子层结构相同,则Y、Z属于同一周期元素,且Z在Y的左边,非金属性Z<Y,所以的还原性一定大于,C正确;
D.由C选项的分析可知,非金属性Z<Y,非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性小于,D不正确;
故选C。
3.B
【详解】A.同周期自左至右金属性减弱,所以Na的金属性比Mg强,A正确;
B.同主族自上而下非金属性减弱,所以溴的非金属性比氯弱,B错误;
C.N的非金属性强于P,所以最高价氧化物的水化物的酸性更强,C正确;
D.S的非金属性弱于Cl,所以气态氢化物的稳定性:H2S
4.C
【分析】短周期元素X的最外层电子数比次外层电子数少1个电子,当处于第二周期时X为Li,也可能处于第三周期,此时X为Cl。
【详解】A.由分析可知,Li元素也满足,A错误;
B.若X为Li元素,Li在反应中只能失电子,只有还原性,B错误;
C.单质Li或者Cl2都能与水发生氧化还原反应,C正确;
D.HCl属于强酸,若X为Li元素,LiH不属于酸,D错误;
故选C。
5.C
【详解】A.由图可知,虚线八角形所标元素由K到Kr,属于我们现行元素周期表的第四周期,正确;
B.由图可知,虚线箭头所经过的元素是同主族元素,C到Sn,原子的电子层数增多,正确;
C.图中①代表的元素是Al,铝单质在常温下能稳定存在,是由于Al和氧气在常温下反应生成致密的氧化铝薄膜,防止Al进一步腐蚀,发生了化学反应,错误;
D.八角形元素周期表是按同主族元素序数增大来排列的,所表示的所有元素只有主族和0族,没有副族元素,正确;
故选C。
6.D
【分析】短周期元素Z主要化合价是-2、+4、+6,则Z是S元素;X、Y主要化合价是+2价,说明它们是第IIA的元素,由于原子半径:X>Z>Y,则X是Mg元素,Y是Be元素;R主要化合价是+3价,原子半径:X>R,则R是Al元素;T主要化合价是-2价,Z原子半径小于Y,则T是O元素。
【详解】A.金属活动性越强,其单质与酸发生置换反应就越剧烈,同一周期中元素的金属性从左到右逐渐减弱,则金属性Mg>Al;同一主族元素的金属性从上到逐渐增大Mg>Be,在Mg、Al、Be三种元素中Mg最活泼,因此Mg(X)与稀硫酸反应最剧烈,A项错误;
B.X是Mg元素,R是Al元素,T是O元素,它们形成的离子分别为Mg2+、Al3+、O2-,核外电子排布都是2、8,电子层结构相同,对于电子层结构相同的离子,离子的核电荷数越大,离子半径越小,所以离子半径由大到小的顺序是:T2->X2+>R3+,B项错误;
C.同一周期从左到右,元素的最高价氧化物水化物的碱性逐渐减弱,则碱性:X[Mg(OH)2]>R[Al(OH)3],C项错误;
D.元素的非金属性越强,其形成的简单氢化物的稳定性就越强。Z是S元素,T是O元素,它们是同一主族的元素,元素的非金属性:O>S,所以氢化物的稳定性:H2O(T)>H2S(Z),D项正确;
答案选D。
7.D
【详解】元素原子核外电子数等于原子核内质子数,等于其核电荷数。金属元素的原子失去电子形成阳离子;非金属元素的原子获得电子形成阴离子。X、Y、Z三种主族元素,X的阳离子与Y的阴离子具有相同的电子层结构,则X处于Y的下一周期,原子序数:X>Y;Z阴离子半径大于等电荷数的Y的阴离子半径,则Y与Z处于同一主族,原子序数:Z>Y;Z与X可能处于同一周期也可能其周期数比X的周期数大。X形成阳离子,说明X为金属元素;Y、Z形成阴离子,则Y、Z为非金属,原子序数Z>X,故X、Y、Z三种主族元素的原子序数大小关系为:Z>X>Y,合理选项是D。
8.A
【分析】短周期元素X和Y的离子X2+和Y2-具有相同电子层结构,则X为Mg元素,Y为O元素。
【详解】A.电子层数相同时,原子序数越小,半径越大,则X2+的离子半径比Y2-小,A正确;
B.X为12号Mg元素,Y为8号O元素,则X的原子序数比Y大,B错误;
C.X原子有3层电子层,而Y原子有2层电子层,则X和Y原子的电子层数不相等,C错误;
D.X原子最外层电子数为2,而Y原子最外层电子数为6,则X和Y原子最外层电子数不相等,D错误;
故选A。
9.D
【详解】A.同主族元素从上到下,非金属性逐渐减弱,金属性逐渐增强,故A正确;
B.单质的密度依次增大,故B正确;
C.氮、磷、砷都是非金属元素,单质由分子构成,相对分子质量逐渐增大,熔沸点逐渐升高,故C正确;
D.同主族元素从上到下,非金属性逐渐减弱,单质与氢化合能力依次减弱,故D错误;
选D。
10.C
【分析】Na2CO3、NaAlO2的混合溶液中加入HCl溶液,先发生反应AlO+H++H2O═Al(OH)3↓,a线表示AlO减少;第二阶段,AlO反应完毕,发生反应CO+H+═HCO,b线表示CO减少,c线表示HCO的增加;第三阶段,CO反应完毕,发生反应HCO+H+═CO2↑+H2O,d线表示HCO减少,此阶段Al(OH)3不参与反应。
【详解】A.由分析可知,b曲线表示的离子方程式为:CO+H+═HCO,A错误;
B.由分析可知,d和c曲线表示的离子反应是不相同的,B错误;
C.盐酸50mL时NaAlO2中铝元素全部转化为氢氧化铝沉淀,加50mL盐酸之后CO反应,氢氧化铝沉淀不溶解,则M点沉淀的质量和盐酸50mL时沉淀的质量相同,由NaAlO2+HCl+H2O=NaCl+Al(OH)3↓知,n(Al(OH)3)=n(NaAlO2)=n(HCl)=0.05mol,m[Al(OH)3]=0.05mol×78g/mol=3.9g,C正确;
D.第一、第二两段消耗的盐酸的体积都是50ml,所以消耗的氯化氢的物质的量相等,依据第一阶段、第二阶段发生反应AlO2-+H++H2O═Al(OH)3↓,CO+H+═HCO3-,可知CO与AlO的物质的量之比为1:1,D错误;
故选C。
11.C
【分析】砹(At)为第六周期第ⅦA族元素;
【详解】A.卤族元素随着原子半径增大,卤化氢的稳定性减弱,Hat不稳定,A错误;
B.氟化银到碘化银溶解性减小,则AgAt难溶于水,B错误;
C.同主族由上而下,溴、碘易溶于有机溶剂,则砹易溶于有机溶剂,C正确;
D.同主族由上而下,卤素单质颜色变深,砹(At2)不是白色固体,D错误;
故选C。
12.D
【分析】从图象可以看出,加入3L氢氧化钡溶液即3mol氢氧化钡时,生成的沉淀的物质的量为5mol,此时对应A点,硫酸铝和氢氧化钡恰好反应完全,硫酸根离子完全沉淀,可知硫酸铝的物质的量为1mol,生成的5mol沉淀其中有3mol为硫酸钡,2mol为氢氧化铝,再继续加入3mol氢氧化钡,沉淀继续增多,生成的沉淀为氢氧化铝,可知氯化铝的物质的量为2mol,B点时沉淀最多,硫酸根离子和铝离子都沉淀完全,硫酸钡的物质的量为3mol,氢氧化铝的物质的量为4mol。再加入氢氧化钡,氢氧化铝溶解,加入2mol氢氧化钡,4mol氢氧化铝完全溶解,生成Na[Al(OH)4],此时到达C点,此时沉淀只有硫酸钡,再加入氢氧化钡,沉淀量无变化。
【详解】A.由以上分析可知,C点为BaSO4沉淀,其物质的量为3mol,此时铝元素以[Al(OH)4]-的形式存在,故A正确;
B.D点溶液中有过量的氢氧化钡和Na[Al(OH)4],通入的二氧化碳和氢氧化钡反应立即生成碳酸钡白色沉淀,故B正确;
C.由以上分析可知,原溶液中硫酸铝的物质的量为1mol,氯化铝的物质的量为2mol,即c[Al2(SO4)3]:c(AlCl3)=1:2,故C正确;
D.由以上分析可知,OA段相当于硫酸铝和氢氧化钡反应,反应的离子方程式为2Al3++3 +3Ba2++6OH- = 3BaSO4↓+2Al(OH)3↓,故D错误;
故选D。
13.B
【详解】A.同主族金属元素从上到下元素的金属性逐渐增强,与水反应剧烈程度增强。元素的金属性:Ba>Ca>Mg,故可根据Ca与水反应较快推知Ba与水反应会更快,A正确;
B.半导体材料通常位于元素周期表中金属元素和非金属元素的分界处,Si和Ge处于金属和非金属分界线处,能作半导体,而C和Pb不能作半导体,所以第IVA族元素并不都是半导体材料,B错误;
C.同主族元素从上到下元素的非金属元素逐渐减弱,元素的非金属性越强,其简单氢化物的稳定性就越强。元素的非金属性:Cl>Br>I,所以HBr的稳定性介于HCl、HI之间,其分解温度介于二者之间,C正确;
D.同周期元素的非金属元素从左到右逐渐增强,元素的非金属性越强,其单质与H2化合就越容易,元素的非金属性:S>P>Si,所以可根据Si与H2高温时反应,S与H2加热能反应推知P与H2在高温时能反应,D正确;
故合理选项是B。
14.B
【分析】Y的最外层电子数等于X次外层电子数,由于均是主族元素,所以Y的最外层电子数不可能是8个,则X只能是第二周期元素,因此Y的最外层电子数是2个,又因为Y的原子半径大于Z,则Y只能是第三周期的Mg,因此X与Z的最外层电子数是,则X是C,Z是Si;据此分析解答。
【详解】A.碳的氧化物形成的分子晶体,Y的氧化物是离子化合物氧化镁,则氧化镁的熔点高于碳的氧化物熔点,A错误;
B.碳元素的非金属性强于硅元素,非金属性越强,氢化物越稳定,则碳的氢化物稳定性强于硅的氢化物稳定性,B正确;
C.C与Si形成的是共价化合物SiC,C错误;
D.单质镁能溶于浓硝酸,单质硅不溶于浓硝酸,D错误;
故答案选B。
15.A
【分析】由W、X同周期且相邻,其中一种元素的单质为空气的主要成分之一,可知W、X位于第二周期,分别为C、N或O、F,W、Z同主族,则Z为或S,根据四种元素原子的最外层电子数之和为15可知,W、Z不可能为O、S,故W、X、Y、Z分别为C、N、Mg、。
【详解】A.同周期元素原子半径从左往右减小,同主族元素原子从上往下增大,故原子半径:,A正确;
B.中只含离子键,B错误;
C.Mg的氧化物为,为离子化合物,其中含有离子键,C错误;
D.N的氧化物对应的水化物为或,其酸性均强于,D错误;
故选A。
16.(1)B
(2) 第3周期第ⅢA族 Fe3O4
(3) 0.9NA
(4) 若溶液呈血红色,则说明含,Fe3+若不显血红色,证明没有Fe3+ 取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液 若高锰酸钾溶液紫红色褪去,说明含Fe2+
【分析】铝镁合金具有耐腐蚀性、密度小、机械强度高等方面的特点;铝元素核电荷数为13,核外电子层数三个,最外层电子数3个,周期序数=电子层数,主族族序数=原子最外层电子数,据此判断在周期表中的位置,Al(OH)3与稀硫酸反应生成硫酸铝和水,铁粉与水蒸气在高温条件下反应,生成四氧化三铁和氢气,铁离子能和硫氰化钾溶液反应络合物而使溶液呈血红色,亚铁离子和硫氰化钾溶液不反应,亚铁离子能被酸性高锰酸钾氧化而使酸性高锰酸钾溶液褪色,铁离子不能被酸性高锰酸钾溶液氧化,以此解题。
【详解】(1)A.不易生锈,用作建筑装潢材料,美观,A正确;
B.导电性好,与装潢无关,B错误;
C.密度小,有利于用作建筑装潢材料,C正确;
D.强度高,用作建筑装潢材料,坚固耐用,D正确;
故选B;
(2)铝是13号元素,在周期表中的位置是:第3周期第ⅢA族;与稀硫酸反应生成硫酸铝和水,离子方程式为:;铁粉与水蒸气在高温条件下反应生成Fe3O4和氢气;
(3)3.36L氮气的物质的量为0.15mol,根据方程式,上述反应中氮元素化合价- 3价升高到0价,生成3mol氮气,电子转移总数18mole-,当生成0.15mol氮气时,转移的电子数;,有同学认为,该反应产物中不应该有Fe生成,他的理由是铁和氯化铁反应生成氯化亚铁,反应的化学方程式为:;
(4)铁离子能和硫氰化钾溶液反应生成络合物而使溶液呈血红色,亚铁离子和硫氰化钾溶液不反应,亚铁离子能被酸性高锰酸钾氧化而使酸性高锰酸钾溶液褪色,铁离子不能被酸性高锰酸钾溶液氧化,如果向溶液中滴加硫氰化钾溶液,溶液变为血红色就说明含有铁离子,否则不含铁离子如果向溶液中滴加酸性高锰酸钾溶液,如果酸性高锰酸钾溶液褪色,就说明含有亚铁离子,否则不含亚铁离子,故答案为:若溶液呈血红色,则说明含,Fe3+若不显血红色,证明没有Fe3+;取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液;若高锰酸钾溶液紫红色褪去,说明含Fe2+。
17. 溶液分层,下层呈橙色 元素原子得电子能力: 氯、溴、碘元素位于元素周期表中的同一主族,三种元素原子的最外层电子数相同,因此随着核外电子层数的依次增加,原子半径依次增加,元素原子吸引电子的能力依次减弱 分液漏斗 紫红 下口活塞 上
【分析】元素的非金属性越强,其单质的氧化性越强,同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;氯气能氧化溴离子生成溴单质,能氧化碘离子生成碘单质,溴能氧化碘离子生成碘单质,据此判断非金属性强弱。
【详解】(1) 根据分析,向溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置,发生置换反应,生成的溴单质溶于四氯化碳,四氯化碳不溶于水,密度比水大,则现象为溶液分层,下层呈橙色,故答案为:溶液分层,下层呈橙色;
(2) Ⅰ中氧化剂是Cl2,氧化产物是Br2,Ⅱ中氧化剂是Cl2,氧化产物是I2,Ⅲ中氧化剂是Br2,氧化产物是I2,所以氧化性强弱顺序是Cl2> Br2> I2,则元素原子得电子能力:。用原子结构的知识解释为:氯、溴、碘元素位于元素周期表中的同一主族,三种元素原子的最外层电子数相同,因此随着核外电子层数的依次增加,原子半径依次增加,元素原子吸引电子的能力依次减弱,故答案为:元素原子得电子能力:;氯、溴、碘元素位于元素周期表中的同一主族,三种元素原子的最外层电子数相同,因此随着核外电子层数的依次增加,原子半径依次增加,元素原子吸引电子的能力依次减弱;
(3)①用浓溶液反萃取后再加稀酸,可以分离和,向装有的溶液的分液漏斗中加入少量浓溶液进行反萃取,故答案为:分液漏斗;
②碘单质溶于四氯化碳时呈紫红色,加入氢氧化钠浓溶液后振荡,碘单质与氢氧化钠反应,至溶液的紫红色消失。萃取时振荡过程中分液漏斗内压强会增大,要将分液漏斗倒置让漏斗颈向上,慢慢打开下口活塞放气,故答案为:紫红;下口活塞;
③充分反应后NaI、NaIO3溶于水,密度小于四氯化碳,分层后水溶液位于上层,因此含碘的碱溶液从分液漏斗的上口倒出,故答案为:上;
④由题给信息可知,NaI、NaIO3在酸性条件下发生归中反应生成碘,根据得失电子守恒、电荷守恒和原子守恒,写出该反应的离子方程式为:,故答案为:。
18. 、
【解析】铝土矿加过量盐酸溶解,、Al2O3和HCl反应溶解,反应方程式分别为:+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O。而SiO2不与盐酸反应,所以沉淀为不溶物SiO2;滤液中含有的阳离子有Fe3+、Al3+、H+,加入过量烧碱,氢离子和氢氧化钠反应生成水,铁离子和氢氧化钠反应生成氢氧化铁沉淀,生成的氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,所以沉淀的成分是氢氧化铁;滤液甲中含有偏铝酸钠和氯化钠,通入过量的二氧化碳可以得到碳酸氢钠和氢氧化铝沉淀,反应的方程式为,滤液乙主要成分为NaHCO3,氢氧化铝沉淀加热可以得到氧化铝,即2Al(OH)3Al2O3+3H2O,以此解答该题。
【详解】(1)步骤①中加入盐酸,发生反应的方程式为、,故答案为:、;
(2)步骤②加入过量的NaOH,先生成的沉淀为Al(OH)3、Fe(OH)3,继续加NaOH,氢氧化铝溶于强碱生成偏铝酸钠,因此滤液(甲)中一种溶质与过量NaOH溶液反应进入滤液(乙)所发生反应的化学方程式:,故答案为:;
(3)步骤③中通入过量的二氧化碳,与偏铝酸钠反应生成氢氧化铝沉淀和碳酸氢钠,发生的化学方程式为,故答案为:;
19. CuO、Al(OH)3 Al(OH)3+OH-=+ 2H2O 4 2 4 O2 50 25 蒸发浓缩 冷却结晶
【分析】银铜合金废料在空气中熔炼得到银溶体和渣料,Cu加热氧化产生CuO,所以渣料中含有CuO和少量Ag,向渣料中加入稀硫酸,CuO反应变为CuSO4,Ag不发生反应,经过滤除去Ag单质,向CuSO4溶液中加入Al2(SO4)3和适量稀NaOH溶液,反应产生Cu(OH)2、Al(OH)3沉淀,加热煮沸,结合Al(OH)3和Cu(OH)2开始分解的温度,Cu(OH)2分解变为CuO,因此过滤得到的固体B中含有CuO和Al(OH)3,在惰性环境中煅烧固体B,其中一个反应为:4CuO+2Al2O34CuAlO2+O2↑,然后利用元素守恒并结合物质的性质逐项分析解答。
【详解】(1)根据上述分析可知固体B成分为CuO和Al(OH)3;由于Al(OH)3是两性氢氧化物,能够与强碱NaOH溶液发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,所以在生成固体B的过程中,需控制稀NaOH溶液的加入量,该反应的离子方程式为:Al(OH)3+OH-=+ 2H2O;若稀NaOH溶液过量,则Al(OH)3会转化为NaAlO2;
(2)该反应为氧化还原反应,根据电子守恒、原子守恒,可得反应方程式为:4CuO+2Al2O34CuAlO2+O2↑,故按照物质书写顺序,由前到后各种的系数及缺项物质分别是4、2、4、O2;
(3)根据Cu元素守恒,则理论上生成CuAlO2的物质的量n(CuAlO2)==50 mol,则由CuAlO2中Al、Cu的物质的量的比是1:1至少需要Al2(SO4)3的物质的量为25 mol,因此至少需要1.0 mol/L的Al2(SO4)3溶液的体积V[Al2(SO4)3]==25 L;
(4)由于CuSO4的溶解度较大,并且随溶液温度的升高而增大,所以由CuSO4溶液制备胆矾需要的操作为蒸发浓缩、冷却结晶,然后过滤、洗涤和干燥就得到晶体CuSO4·5H2O。
【点睛】本题以物质制备为线索,考查物质性质的应用、混合物的分离提纯。注意结合Cu(OH)2、Al(OH)3的分解温度判断物质B的成分,最后根据目标产物,结合元素守恒确定缺少的物质并进行配平和有关物质的化学计算。
答案第1页,共2页
答案第1页,共2页
