江苏省盐城市滨海县部分学校2022-2023学年高二下学期5月月考化学试题(含答案)
文档属性
| 名称 | 江苏省盐城市滨海县部分学校2022-2023学年高二下学期5月月考化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-22 09:51:15 | ||
图片预览

文档简介
滨海县部分学校2022-2023学年高二下学期5月月考
化学学科试卷
注意事项:
1.本试卷包含选择题和非选择题两部分,满分100分;考试用时75分钟。
2.答题前,请考生务必将自己的姓名、学校、班级、准考号等填涂在答题卷上相应的位置。
3.选择题请用28铅笔将对应试题的答案符号按要求涂黑,非选择题请用0.5毫米黑色墨水的签字笔在答题卷指定位置作答,不在答题区域内的答案一律无效。
4.可能用到的相对原子质量:H1 C12 N14 O16 F19
Ⅰ卷(54分)
一、单项选择题:共14小题,每题3分,共42分。每小题只有一个选项最符合题意。
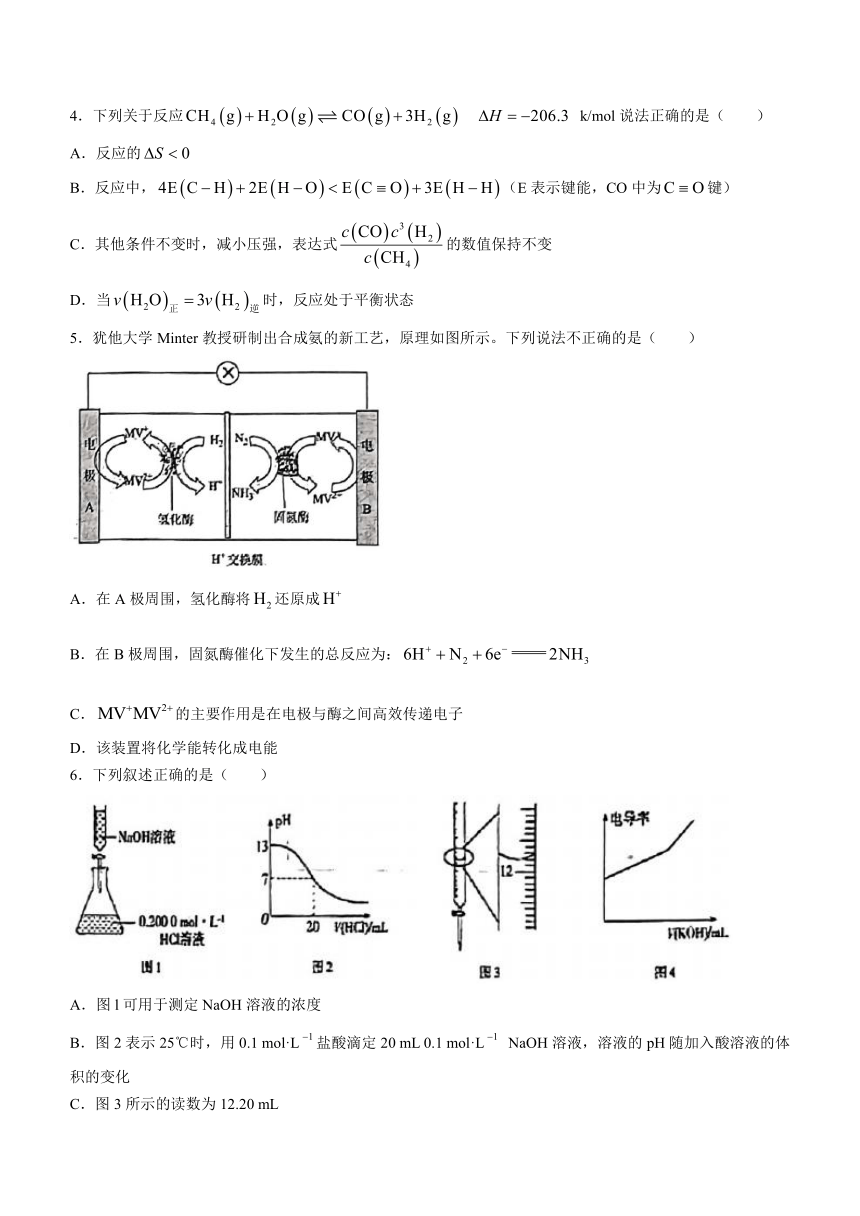
1.下列变化属于“氮的固定”的是( )
A.氮气→氨气 B.氨气→氯化铵 C.二氧化氮→硝酸 D.硝酸→硝酸铜
2.下列说法正确的是( )
A.为极性分子 B.的填充模型为
C.的电子式为 D.第一电离能:N>O>C
3.合成氨是人工固氮的主要途径,工业生产采用Haber-Bosch法,反应条件严苛,能源消耗大。制取氢气原料的途径之一为: k/mol。研究和的反应机理,有利于开发新的氨气合成技术。在釘催化剂表面合成氨的反应历程如图所示(吸附在催化剂表面的物种用*标注)。下列说法不正确的是( )
A.合成氨反应属于放热反应
B.过程①决定整个合成氨反应的快慢
C.在该反应历程中,与反应的是
D.选用优质催化剂,能够进步降低合成氨反应的焓变
4.下列关于反应 k/mol说法正确的是( )
A.反应的
B.反应中,(E表示键能,CO中为键)
C.其他条件不变时,减小压强,表达式的数值保持不变
D.当时,反应处于平衡状态
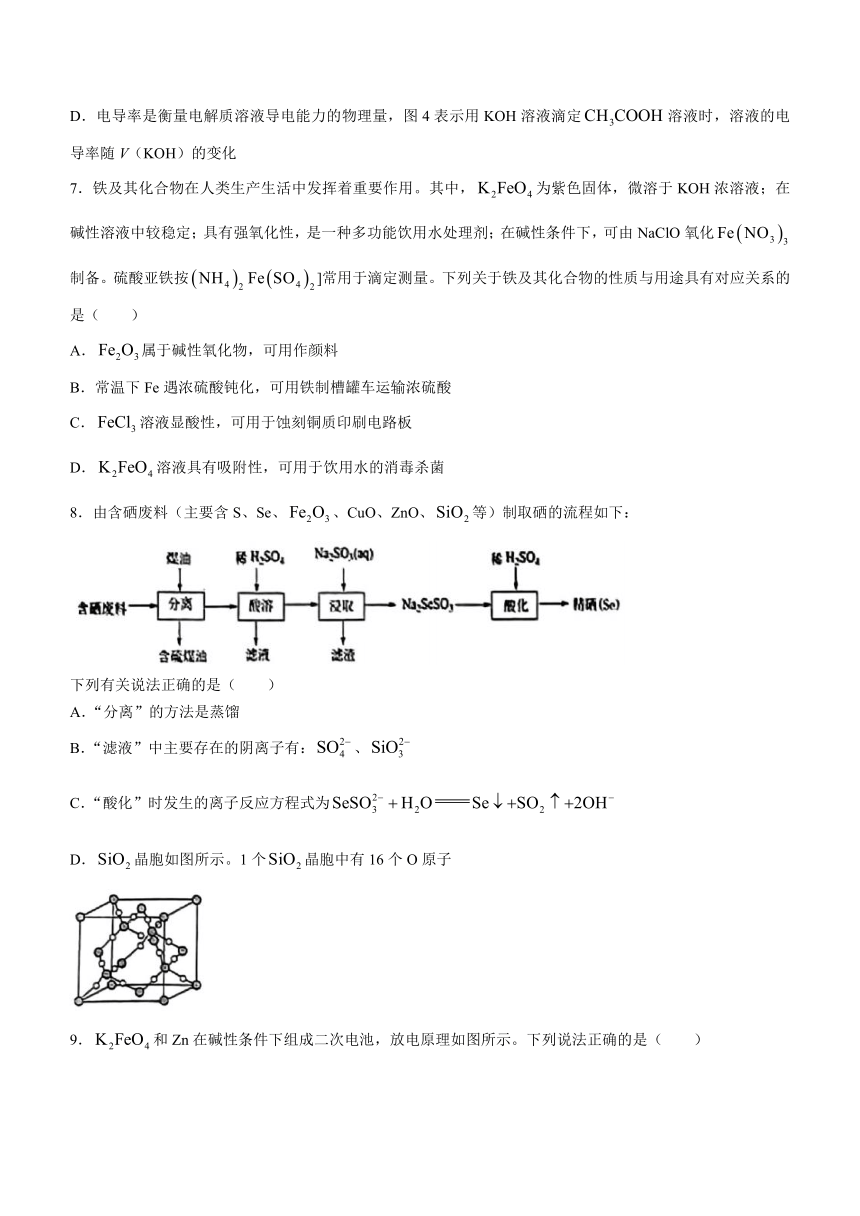
5.犹他大学Minter教授研制出合成氨的新工艺,原理如图所示。下列说法不正确的是( )
A.在A极周围,氢化酶将还原成
B.在B极周围,固氮酶催化下发生的总反应为:
C.的主要作用是在电极与酶之间高效传递电子
D.该装置将化学能转化成电能
6.下列叙述正确的是( )
A.图l可用于测定NaOH溶液的浓度
B.图2表示25℃时,用0.1 mol·L盐酸滴定20 mL 0.1 mol·L NaOH溶液,溶液的pH随加入酸溶液的体积的变化
C.图3所示的读数为12.20 mL
D.电导率是衡量电解质溶液导电能力的物理量,图4表示用KOH溶液滴定溶液时,溶液的电导率随V(KOH)的变化
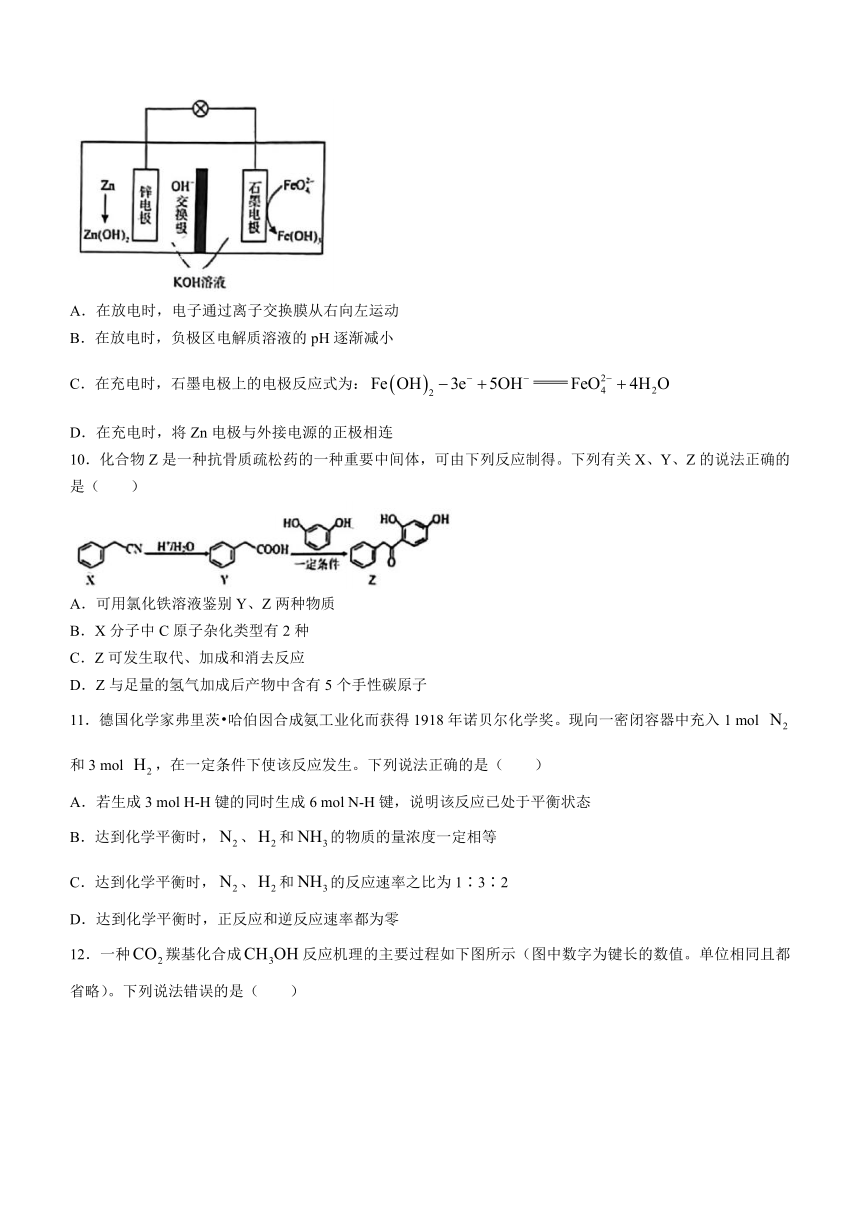
7.铁及其化合物在人类生产生活中发挥着重要作用。其中,为紫色固体,微溶于KOH浓溶液;在碱性溶液中较稳定;具有强氧化性,是一种多功能饮用水处理剂;在碱性条件下,可由NaClO氧化制备。硫酸亚铁按]常用于滴定测量。下列关于铁及其化合物的性质与用途具有对应关系的是( )
A.属于碱性氧化物,可用作颜料
B.常温下Fe遇浓硫酸钝化,可用铁制槽罐车运输浓硫酸
C.溶液显酸性,可用于蚀刻铜质印刷电路板
D.溶液具有吸附性,可用于饮用水的消毒杀菌
8.由含硒废料(主要含S、Se、、CuO、ZnO、等)制取硒的流程如下:
下列有关说法正确的是( )
A.“分离”的方法是蒸馏
B.“滤液”中主要存在的阴离子有:、
C.“酸化”时发生的离子反应方程式为
D.晶胞如图所示。1个晶胞中有16个O原子
9.和Zn在碱性条件下组成二次电池,放电原理如图所示。下列说法正确的是( )
A.在放电时,电子通过离子交换膜从右向左运动
B.在放电时,负极区电解质溶液的pH逐渐减小
C.在充电时,石墨电极上的电极反应式为:
D.在充电时,将Zn电极与外接电源的正极相连
10.化合物Z是一种抗骨质疏松药的一种重要中间体,可由下列反应制得。下列有关X、Y、Z的说法正确的是( )
A.可用氯化铁溶液鉴别Y、Z两种物质
B.X分子中C原子杂化类型有2种
C.Z可发生取代、加成和消去反应
D.Z与足量的氢气加成后产物中含有5个手性碳原子
11.德国化学家弗里茨 哈伯因合成氨工业化而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol 和3 mol ,在一定条件下使该反应发生。下列说法正确的是( )
A.若生成3 mol H-H键的同时生成6 mol N-H键,说明该反应已处于平衡状态
B.达到化学平衡时,、和的物质的量浓度一定相等
C.达到化学平衡时,、和的反应速率之比为1∶3∶2
D.达到化学平衡时,正反应和逆反应速率都为零
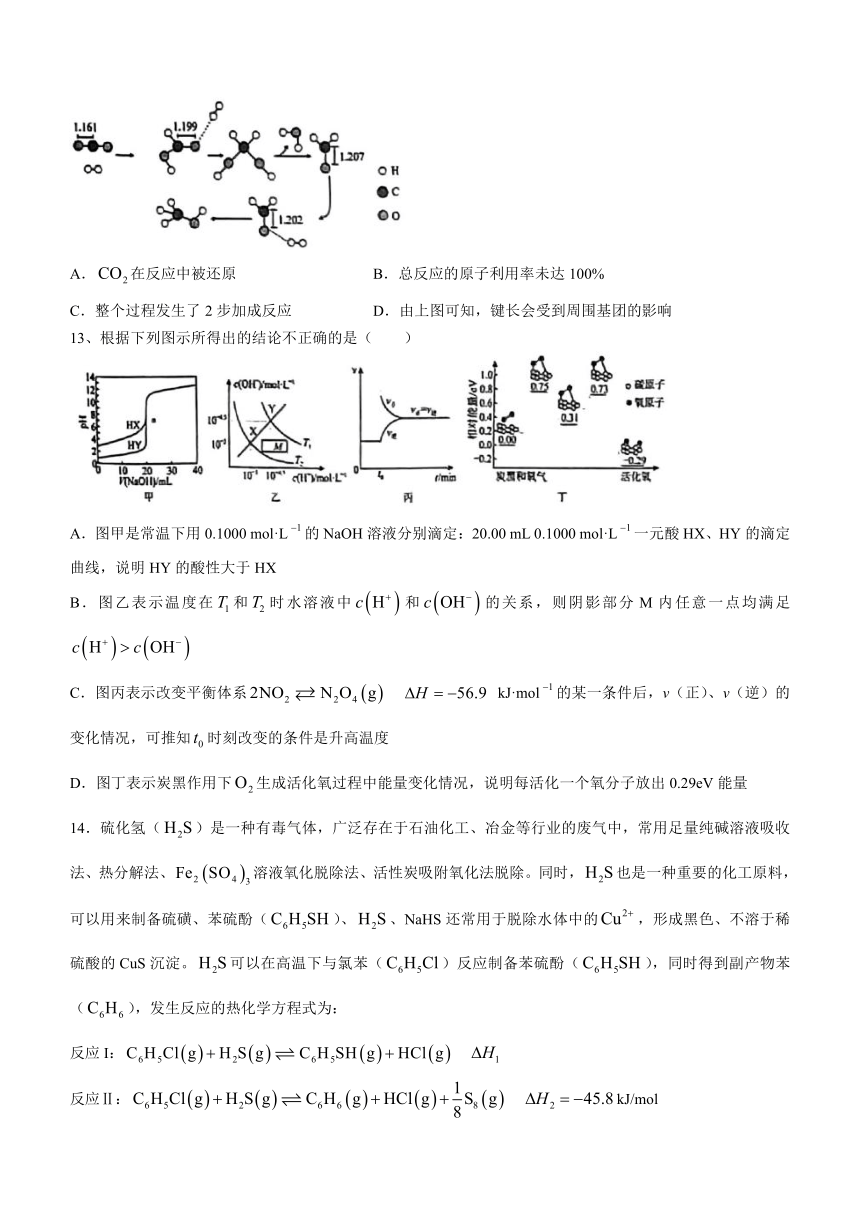
12.一种羰基化合成反应机理的主要过程如下图所示(图中数字为键长的数值。单位相同且都省略)。下列说法错误的是( )
A.在反应中被还原 B.总反应的原子利用率未达100%
C.整个过程发生了2步加成反应 D.由上图可知,键长会受到周围基团的影响
13、根据下列图示所得出的结论不正确的是( )
A.图甲是常温下用0.1000 mol·L的NaOH溶液分别滴定:20.00 mL 0.1000 mol·L一元酸HX、HY的滴定曲线,说明HY的酸性大于HX
B.图乙表示温度在和时水溶液中和的关系,则阴影部分M内任意一点均满足
C.图丙表示改变平衡体系 kJ·mol的某一条件后,v(正)、v(逆)的变化情况,可推知时刻改变的条件是升高温度
D.图丁表示炭黑作用下生成活化氧过程中能量变化情况,说明每活化一个氧分子放出0.29eV能量
14.硫化氢()是一种有毒气体,广泛存在于石油化工、冶金等行业的废气中,常用足量纯碱溶液吸收法、热分解法、溶液氧化脱除法、活性炭吸附氧化法脱除。同时,也是一种重要的化工原料,可以用来制备硫磺、苯硫酚()、、NaHS还常用于脱除水体中的,形成黑色、不溶于稀硫酸的CuS沉淀。可以在高温下与氯苯()反应制备苯硫酚(),同时得到副产物苯(),发生反应的热化学方程式为:
反应I:
反应Ⅱ: kJ/mol
将与(体积比5∶2)加入某恒容密闭容,器中,反应20 min后测得混合气中和的产率(实际产量与理论产量之比)与温度的关系如图所示。下列说法不正确的是( )
A.由图可知
B.在500℃时,反应Ⅱ处于平衡状态
C.在590℃时,反应Ⅰ的平衡常数为
D.在645℃时,延长反应时间,会提高的产率
Ⅱ卷(58分)
二、非选择题(本题共4小题,共58分)
15.(14分)一定温度下,在恒容的密闭容器内,将2 mol 和1 mol 混合发生反应: 。回答下列问题:
(1)升高温度,混合气体的密度______(填“变大”“变小”或“不变”)。
(2)若反应达到平衡后,再充入,平衡将______(填“正向”“逆向”或“不”)移动,的转化率______(填“增大”“减小”或“不变”)。
(3)若反应达到平衡后,将、、同时增大1倍,平衡将______移动。
(4)如图表示合成反应在某段时间中反应速率与时间的曲线图,、时刻分别改变某一外界条件,它们依次为__________________、__________________:的体积分数最小的平衡时间段是______(填序号)。
16.(14分)铁元素被称为“人类第一元素”,铁及其化合物具有广泛的用途。
(1)水体中过量的是一种重要污染物,可利用纳米铁粉将其除去。
①基态铁原子核外电子排布式:______:铁元素在元素周期表中的位置为______,属于______区元素。
②相同条件下,向含有50 mg L 的两份水样中分别加入纳米铁粉、纳米铁粉-活性炭-铜粉,的去除速率差异如图1所示,产生该差异的可能原因为__________________。
(2)铁镁合金是目前储氢密度最高的材料之一,其晶胞结构如图2所示。储氢时,分子位于晶胞体心和棱的中心位置。
①该晶胞中Fe的配位数是__________________。
②该合金储满氢后所得晶体的化学式是__________________。
(3)在生产中,常用处理pH=3的含Cr(+6价)废水得到和。易被氧化为,请利用核外电子排布的相关原理解释其原因:______________________________________________________.
17.(14分)化合物G是一种作用手神经系统药物的中间体,其合成路线如下:
(1)B中的含氧官能团名称是____________、____________。
(2)C→D的反应类型为________________________。
(3)G中含有手性碳原子的个数为______。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:____________.
①分子中含有苯环,能发生水解反应,能发生银镜反应:
②分子中有4种不同化学环境的氢原子。
(5)写出以为原料,合成的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
18.(16分)的资源化利用能有效减少碳排放充分利用碳资源。
Ⅰ.合成甲醇()
该反应包括下列两步:
反应Ⅰ kJ/mol
反应Ⅱ kJ/mol
(1)由CO与合成的热化学方程式为____________________________________.
(2)在一定温度下,向体积为2L的恒容密闭容器中充入3 mol 和1 mol ,控制条件仅发生反应Ⅰ,测得、和的物质的量(n)随时间的变化如图所示:
①0~3 min内,用表示的化学反应速率____________.
②在平衡后,再向容器中加入2 mol 和2 mol 则平衡向______移动。(填“正反应方向”“逆反应方向”或“不移动”)。
(3)在光电催化下可以合成甲醇,原理如图所示。阴极的电极反应式为__________________.
Ⅱ.合成二甲醚()
控制反应条件,同时发生反应Ⅰ、反应Ⅱ和反应Ⅲ,可以合成二甲醚()。
反应Ⅲ kJ/moI
在压强30MPa、时,的平衡转化率、CO的选择性和的选择性随
温度变化情况如图所示(X的选择性:)
(4)图中,代表选择性的是曲线______(填“A”、“B”或“C”).
(5)当温度超过290℃,曲线B随温度升高而增大的原因是____________________________________.
滨海县部分学校2022-2023学年高二下学期5月月考
化学答案
一、选择题
1-5ADDBA 6-10 DBDCA 11-15 ACCB
二、非选择题.
15.不变,正向,增大,正向
升高温度、降低压强,
16.(1)①,第四周期Ⅷ族,d
②形成Fe-Cu或C原电池加快纳米铁粉去除的反应速率。
(2)8,
(3)外围电子排布为,再失去一个电子可形成的半满稳定结构.
17.(1)醚键、羰基
(2)还原反应
(3)1
(4)
(5)
18.(1) kJ·mol
(2)0.375 mol·L·min,正反应方向,
(3)
(4)A
(5)生成CO的反应为吸热反应高温有利于反应向生成CO方向进行,从而提高其选择性。
化学学科试卷
注意事项:
1.本试卷包含选择题和非选择题两部分,满分100分;考试用时75分钟。
2.答题前,请考生务必将自己的姓名、学校、班级、准考号等填涂在答题卷上相应的位置。
3.选择题请用28铅笔将对应试题的答案符号按要求涂黑,非选择题请用0.5毫米黑色墨水的签字笔在答题卷指定位置作答,不在答题区域内的答案一律无效。
4.可能用到的相对原子质量:H1 C12 N14 O16 F19
Ⅰ卷(54分)
一、单项选择题:共14小题,每题3分,共42分。每小题只有一个选项最符合题意。
1.下列变化属于“氮的固定”的是( )
A.氮气→氨气 B.氨气→氯化铵 C.二氧化氮→硝酸 D.硝酸→硝酸铜
2.下列说法正确的是( )
A.为极性分子 B.的填充模型为
C.的电子式为 D.第一电离能:N>O>C
3.合成氨是人工固氮的主要途径,工业生产采用Haber-Bosch法,反应条件严苛,能源消耗大。制取氢气原料的途径之一为: k/mol。研究和的反应机理,有利于开发新的氨气合成技术。在釘催化剂表面合成氨的反应历程如图所示(吸附在催化剂表面的物种用*标注)。下列说法不正确的是( )
A.合成氨反应属于放热反应
B.过程①决定整个合成氨反应的快慢
C.在该反应历程中,与反应的是
D.选用优质催化剂,能够进步降低合成氨反应的焓变
4.下列关于反应 k/mol说法正确的是( )
A.反应的
B.反应中,(E表示键能,CO中为键)
C.其他条件不变时,减小压强,表达式的数值保持不变
D.当时,反应处于平衡状态
5.犹他大学Minter教授研制出合成氨的新工艺,原理如图所示。下列说法不正确的是( )
A.在A极周围,氢化酶将还原成
B.在B极周围,固氮酶催化下发生的总反应为:
C.的主要作用是在电极与酶之间高效传递电子
D.该装置将化学能转化成电能
6.下列叙述正确的是( )
A.图l可用于测定NaOH溶液的浓度
B.图2表示25℃时,用0.1 mol·L盐酸滴定20 mL 0.1 mol·L NaOH溶液,溶液的pH随加入酸溶液的体积的变化
C.图3所示的读数为12.20 mL
D.电导率是衡量电解质溶液导电能力的物理量,图4表示用KOH溶液滴定溶液时,溶液的电导率随V(KOH)的变化
7.铁及其化合物在人类生产生活中发挥着重要作用。其中,为紫色固体,微溶于KOH浓溶液;在碱性溶液中较稳定;具有强氧化性,是一种多功能饮用水处理剂;在碱性条件下,可由NaClO氧化制备。硫酸亚铁按]常用于滴定测量。下列关于铁及其化合物的性质与用途具有对应关系的是( )
A.属于碱性氧化物,可用作颜料
B.常温下Fe遇浓硫酸钝化,可用铁制槽罐车运输浓硫酸
C.溶液显酸性,可用于蚀刻铜质印刷电路板
D.溶液具有吸附性,可用于饮用水的消毒杀菌
8.由含硒废料(主要含S、Se、、CuO、ZnO、等)制取硒的流程如下:
下列有关说法正确的是( )
A.“分离”的方法是蒸馏
B.“滤液”中主要存在的阴离子有:、
C.“酸化”时发生的离子反应方程式为
D.晶胞如图所示。1个晶胞中有16个O原子
9.和Zn在碱性条件下组成二次电池,放电原理如图所示。下列说法正确的是( )
A.在放电时,电子通过离子交换膜从右向左运动
B.在放电时,负极区电解质溶液的pH逐渐减小
C.在充电时,石墨电极上的电极反应式为:
D.在充电时,将Zn电极与外接电源的正极相连
10.化合物Z是一种抗骨质疏松药的一种重要中间体,可由下列反应制得。下列有关X、Y、Z的说法正确的是( )
A.可用氯化铁溶液鉴别Y、Z两种物质
B.X分子中C原子杂化类型有2种
C.Z可发生取代、加成和消去反应
D.Z与足量的氢气加成后产物中含有5个手性碳原子
11.德国化学家弗里茨 哈伯因合成氨工业化而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol 和3 mol ,在一定条件下使该反应发生。下列说法正确的是( )
A.若生成3 mol H-H键的同时生成6 mol N-H键,说明该反应已处于平衡状态
B.达到化学平衡时,、和的物质的量浓度一定相等
C.达到化学平衡时,、和的反应速率之比为1∶3∶2
D.达到化学平衡时,正反应和逆反应速率都为零
12.一种羰基化合成反应机理的主要过程如下图所示(图中数字为键长的数值。单位相同且都省略)。下列说法错误的是( )
A.在反应中被还原 B.总反应的原子利用率未达100%
C.整个过程发生了2步加成反应 D.由上图可知,键长会受到周围基团的影响
13、根据下列图示所得出的结论不正确的是( )
A.图甲是常温下用0.1000 mol·L的NaOH溶液分别滴定:20.00 mL 0.1000 mol·L一元酸HX、HY的滴定曲线,说明HY的酸性大于HX
B.图乙表示温度在和时水溶液中和的关系,则阴影部分M内任意一点均满足
C.图丙表示改变平衡体系 kJ·mol的某一条件后,v(正)、v(逆)的变化情况,可推知时刻改变的条件是升高温度
D.图丁表示炭黑作用下生成活化氧过程中能量变化情况,说明每活化一个氧分子放出0.29eV能量
14.硫化氢()是一种有毒气体,广泛存在于石油化工、冶金等行业的废气中,常用足量纯碱溶液吸收法、热分解法、溶液氧化脱除法、活性炭吸附氧化法脱除。同时,也是一种重要的化工原料,可以用来制备硫磺、苯硫酚()、、NaHS还常用于脱除水体中的,形成黑色、不溶于稀硫酸的CuS沉淀。可以在高温下与氯苯()反应制备苯硫酚(),同时得到副产物苯(),发生反应的热化学方程式为:
反应I:
反应Ⅱ: kJ/mol
将与(体积比5∶2)加入某恒容密闭容,器中,反应20 min后测得混合气中和的产率(实际产量与理论产量之比)与温度的关系如图所示。下列说法不正确的是( )
A.由图可知
B.在500℃时,反应Ⅱ处于平衡状态
C.在590℃时,反应Ⅰ的平衡常数为
D.在645℃时,延长反应时间,会提高的产率
Ⅱ卷(58分)
二、非选择题(本题共4小题,共58分)
15.(14分)一定温度下,在恒容的密闭容器内,将2 mol 和1 mol 混合发生反应: 。回答下列问题:
(1)升高温度,混合气体的密度______(填“变大”“变小”或“不变”)。
(2)若反应达到平衡后,再充入,平衡将______(填“正向”“逆向”或“不”)移动,的转化率______(填“增大”“减小”或“不变”)。
(3)若反应达到平衡后,将、、同时增大1倍,平衡将______移动。
(4)如图表示合成反应在某段时间中反应速率与时间的曲线图,、时刻分别改变某一外界条件,它们依次为__________________、__________________:的体积分数最小的平衡时间段是______(填序号)。
16.(14分)铁元素被称为“人类第一元素”,铁及其化合物具有广泛的用途。
(1)水体中过量的是一种重要污染物,可利用纳米铁粉将其除去。
①基态铁原子核外电子排布式:______:铁元素在元素周期表中的位置为______,属于______区元素。
②相同条件下,向含有50 mg L 的两份水样中分别加入纳米铁粉、纳米铁粉-活性炭-铜粉,的去除速率差异如图1所示,产生该差异的可能原因为__________________。
(2)铁镁合金是目前储氢密度最高的材料之一,其晶胞结构如图2所示。储氢时,分子位于晶胞体心和棱的中心位置。
①该晶胞中Fe的配位数是__________________。
②该合金储满氢后所得晶体的化学式是__________________。
(3)在生产中,常用处理pH=3的含Cr(+6价)废水得到和。易被氧化为,请利用核外电子排布的相关原理解释其原因:______________________________________________________.
17.(14分)化合物G是一种作用手神经系统药物的中间体,其合成路线如下:
(1)B中的含氧官能团名称是____________、____________。
(2)C→D的反应类型为________________________。
(3)G中含有手性碳原子的个数为______。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:____________.
①分子中含有苯环,能发生水解反应,能发生银镜反应:
②分子中有4种不同化学环境的氢原子。
(5)写出以为原料,合成的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
18.(16分)的资源化利用能有效减少碳排放充分利用碳资源。
Ⅰ.合成甲醇()
该反应包括下列两步:
反应Ⅰ kJ/mol
反应Ⅱ kJ/mol
(1)由CO与合成的热化学方程式为____________________________________.
(2)在一定温度下,向体积为2L的恒容密闭容器中充入3 mol 和1 mol ,控制条件仅发生反应Ⅰ,测得、和的物质的量(n)随时间的变化如图所示:
①0~3 min内,用表示的化学反应速率____________.
②在平衡后,再向容器中加入2 mol 和2 mol 则平衡向______移动。(填“正反应方向”“逆反应方向”或“不移动”)。
(3)在光电催化下可以合成甲醇,原理如图所示。阴极的电极反应式为__________________.
Ⅱ.合成二甲醚()
控制反应条件,同时发生反应Ⅰ、反应Ⅱ和反应Ⅲ,可以合成二甲醚()。
反应Ⅲ kJ/moI
在压强30MPa、时,的平衡转化率、CO的选择性和的选择性随
温度变化情况如图所示(X的选择性:)
(4)图中,代表选择性的是曲线______(填“A”、“B”或“C”).
(5)当温度超过290℃,曲线B随温度升高而增大的原因是____________________________________.
滨海县部分学校2022-2023学年高二下学期5月月考
化学答案
一、选择题
1-5ADDBA 6-10 DBDCA 11-15 ACCB
二、非选择题.
15.不变,正向,增大,正向
升高温度、降低压强,
16.(1)①,第四周期Ⅷ族,d
②形成Fe-Cu或C原电池加快纳米铁粉去除的反应速率。
(2)8,
(3)外围电子排布为,再失去一个电子可形成的半满稳定结构.
17.(1)醚键、羰基
(2)还原反应
(3)1
(4)
(5)
18.(1) kJ·mol
(2)0.375 mol·L·min,正反应方向,
(3)
(4)A
(5)生成CO的反应为吸热反应高温有利于反应向生成CO方向进行,从而提高其选择性。
同课章节目录
