第1章 原子结构 元素周期律 单元测试(含答案) 2022-2023学年高一下学期鲁科版(2019)必修第二册
文档属性
| 名称 | 第1章 原子结构 元素周期律 单元测试(含答案) 2022-2023学年高一下学期鲁科版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 242.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-22 10:08:11 | ||
图片预览


文档简介
第1章《原子结构 元素周期律》检测题
一、单选题(共13题)
1.NA为阿伏加德罗常数的值。下列说法不正确的是
A.13gZn与一定量盐酸反应最终产生0.2gH2,Zn失去的电子数为0.4NA
B.1L0.5 mol/LNa2CO3溶液中含有的Na+的数目为NA
C.常温常压下,1.8gD2O中含有质子的数目为0.9NA
D.标准状况下,2.24L氦气中含有原子的数目为0.1NA
2.下列事实不能用元素周期律解释的是
A.酸性:H2SO3>H2CO3 B.还原性:S2->Cl-
C.气态氢化物的稳定性:H2O>NH3 D.Cl2从KBr溶液中置换出Br2
3.核电荷数为1~18的元素中,下列叙述正确的是
A.最外层只有1个电子的元素一定是金属元素
B.最外层只有2个电子的元素一定是金属元素
C.原子核外各层电子数相等的元素一定是金属元素
D.原子最外层电子数不能超过8个
4.下列说法不正确的是
A.金刚石、石墨和C60都是碳元素的同素异形体
B.医疗上硫酸亚铁可用于生产防治缺铁性贫血的药剂
C.FeO在空气里受热,能迅速被氧化成Fe2O3
D.水质检测员在自来水出厂前会对水中的Cl-、SO、微生物、有机物等进行检测和分析
5.科学家发明的透明坚硬镁铝氧化物新型材料,可以用作显示器和手机屏幕。下列有关镁 和铝的说法正确的是
A.镁的金属性比铝弱
B.镁和铝的氧化物都可以与盐酸反应
C.镁和铝原子的最外层电子数都为3
D.镁和铝的氧化物都可以与氢氧化钠溶液反应
6.下列关于碱土金属元素及其单质的叙述错误的是
A.这些元素的原子最外层都有2个电子,都容易失去2个电子达到8电子稳定结构
B.碱土金属性质活泼,在自然界都以化合态存在
C.该主族中的每一种金属元素的单质都呈亮白色,都具有良好的导电性
D.含钙、锶、钡等元素的物质灼烧时都会产生绚丽的颜色,可用于制造焰火
7.作为全球最大的电子产品制造国,中国却有着“芯”病。我国国产芯片自给率不到30%,产值不足全球的7%,市场份额不到10%。下列说法正确的是
A.CPU半导体芯片与光导纤维是同种材料
B.水泥和玻璃属于硅酸盐材料
C.水晶和陶瓷都是硅酸盐制品
D.二氧化氮、二氧化硅都是酸性氧化物
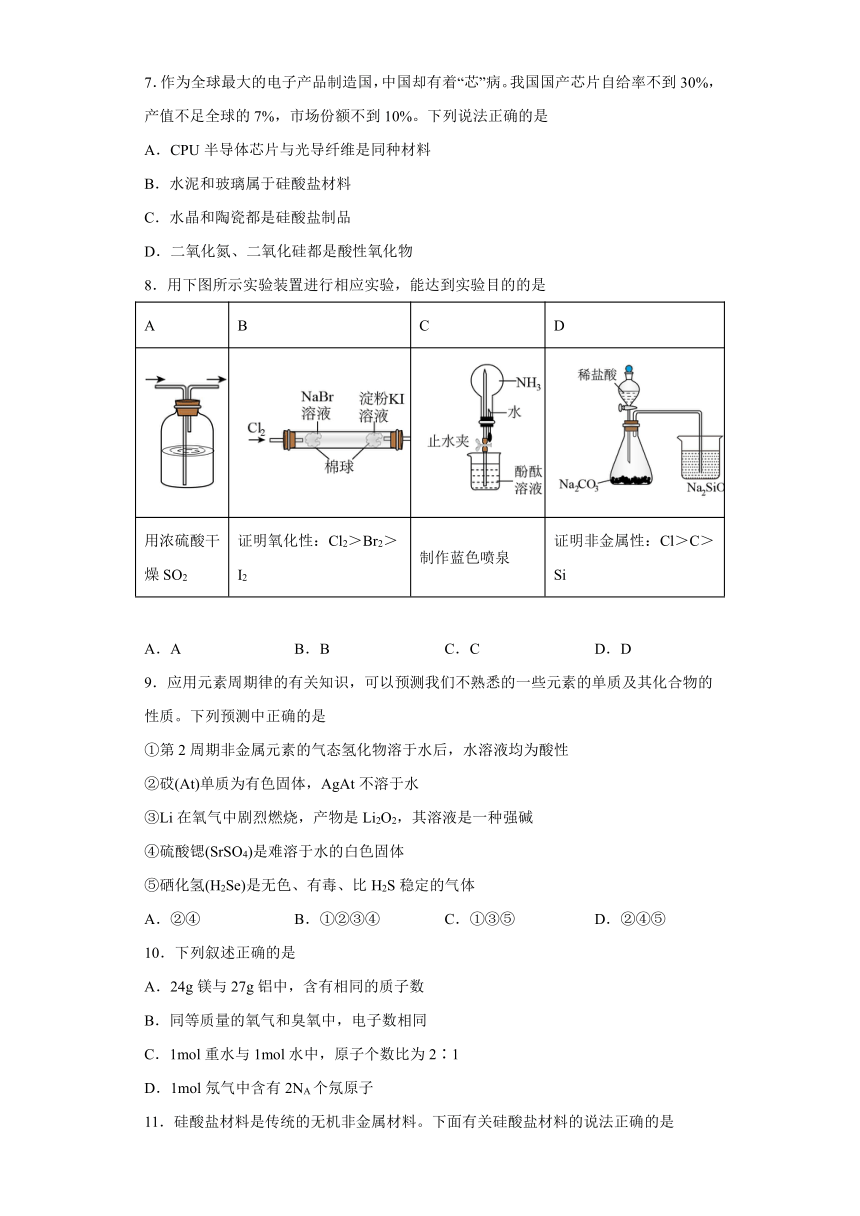
8.用下图所示实验装置进行相应实验,能达到实验目的的是
A B C D
用浓硫酸干燥SO2 证明氧化性:Cl2>Br2>I2 制作蓝色喷泉 证明非金属性:Cl>C>Si
A.A B.B C.C D.D
9.应用元素周期律的有关知识,可以预测我们不熟悉的一些元素的单质及其化合物的性质。下列预测中正确的是
①第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
②砹(At)单质为有色固体,AgAt不溶于水
③Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
④硫酸锶(SrSO4)是难溶于水的白色固体
⑤硒化氢(H2Se)是无色、有毒、比H2S稳定的气体
A.②④ B.①②③④ C.①③⑤ D.②④⑤
10.下列叙述正确的是
A.24g镁与27g铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,电子数相同
C.1mol重水与1mol水中,原子个数比为2∶1
D.1mol氖气中含有2NA个氖原子
11.硅酸盐材料是传统的无机非金属材料。下面有关硅酸盐材料的说法正确的是
A.普通玻璃的主要成分是纯碱、石灰石和石英
B.制造水泥的主要原料是石灰石和黏土
C.高纯度的硅广泛用于制造光导纤维,光导纤维遇强碱会“断路”
D.陶器比瓷器的结构致密,几乎不吸水
12.表示阿伏加德罗常数的值。下列说法正确的是
A.12g金刚石和12g石墨中均含有个碳原子
B.1mol重水比1mol水多个质子
C.标准状况下,中含有的共价键数为
D.溶液中含有的氯离子数为
13.下列说法中有错误的是( )
A.某原子K层上只有一个电子 B.某离子M层和L层上的电子数均为K层的4倍
C.某原子M层上的电子数为L层电子数的4倍 D.存在核电荷数与最外层电子数相等的离子
二、非选择题(共10题)
14.普通玻璃的主要原料是纯碱、石灰石和石英,窑里加强热时,纯碱与石英的 反应化学方程式为Na2CO3+SiO2Na2SiO3+CO2↑,其中产物Na2SiO3 的名称为_______,仿造这个方程式,写出石灰石(CaCO3)与SiO2 加强热的反应方程式_______.
15.(1)中的质子数是__________,中子数是__________,核外电子数是__________,质量数是__________。
(2)Fe、、是__________元素的三种粒子,它们的__________数相同,它们的__________数不相同。
(3)由与所代表的物质中,共有__________种元素,__________种原子,互为同位素的原子有__________。
三、实验题
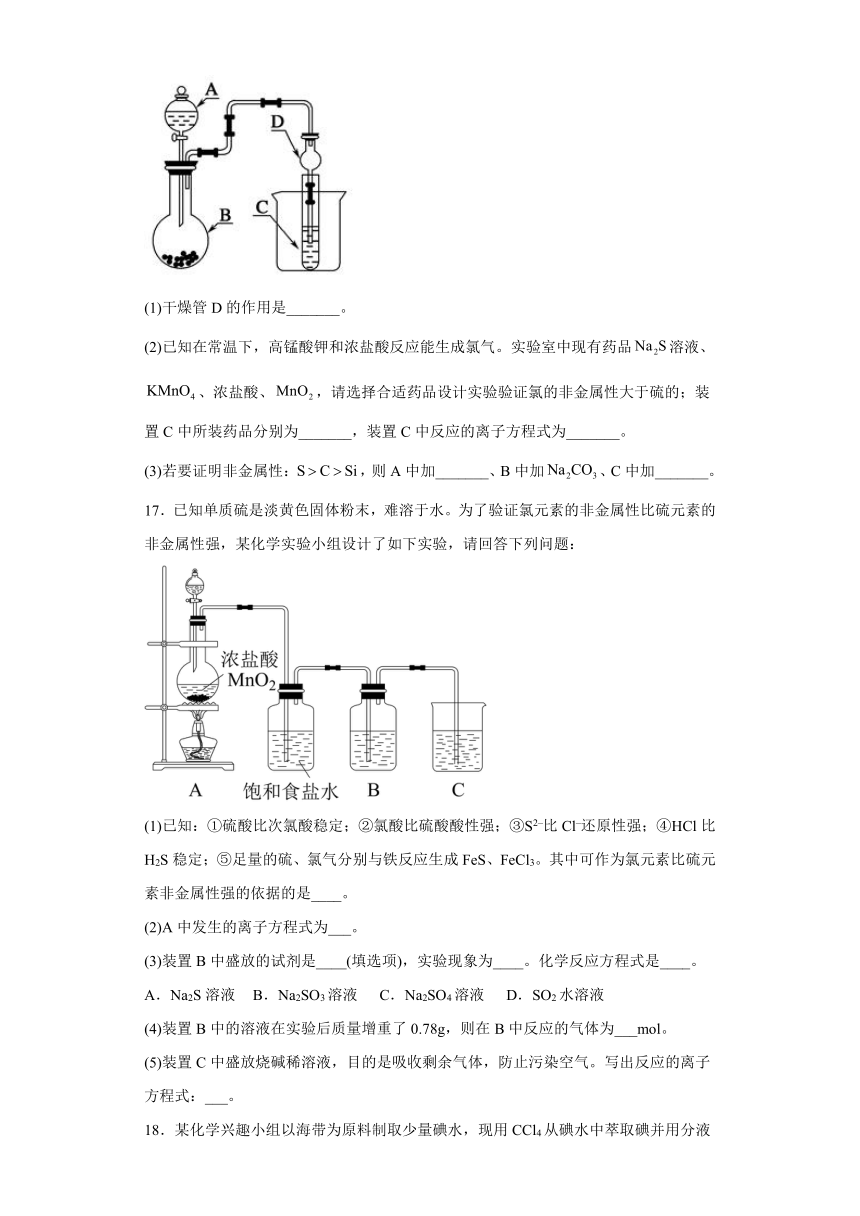
16.利用如图装置可以验证非金属性的变化规律。
(1)干燥管D的作用是_______。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品溶液、、浓盐酸、,请选择合适药品设计实验验证氯的非金属性大于硫的;装置C中所装药品分别为_______,装置C中反应的离子方程式为_______。
(3)若要证明非金属性:,则A中加_______、B中加、C中加_______。
17.已知单质硫是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)已知:①硫酸比次氯酸稳定;②氯酸比硫酸酸性强;③S2–比Cl–还原性强;④HCl比H2S稳定;⑤足量的硫、氯气分别与铁反应生成FeS、FeCl3。其中可作为氯元素比硫元素非金属性强的依据的是____。
(2)A中发生的离子方程式为___。
(3)装置B中盛放的试剂是____(填选项),实验现象为____。化学反应方程式是____。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液 D.SO2水溶液
(4)装置B中的溶液在实验后质量增重了0.78g,则在B中反应的气体为___mol。
(5)装置C中盛放烧碱稀溶液,目的是吸收剩余气体,防止污染空气。写出反应的离子方程式:___。
18.某化学兴趣小组以海带为原料制取少量碘水,现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液.其实验可分解为如下各步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中
B.把50mL碘水和15mL CCl4加入分液漏斗中,并盖好玻璃塞
C.检验分液漏斗活塞和上口的玻璃塞是否漏液
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧杯接收下层溶液
F.从分液漏斗上口倒出上层溶液
G.将分液漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准分液漏斗口上的小孔
H.静置、分层
就此实验完成下列填空:
(1)正确操作步骤的顺序是(用上述各操作的编号字母填写):
_________→_________→_________→A→H_________→E→F
(2)上述E步骤的操作中应注意__________________________。
(3)上述G步骤操作的目的是______________________。
(4)能选用CCl4从碘水中萃取碘的原因是______________________。
四、计算题
19.有A、B、C三种二价金属,它们的相对原子质量之比为 3:5:7,如果把7 mol A、5 mol B、3 mol C 混合,取出均匀混合物5.36 g,加入2 mol·L1 HCl 150 mL 恰好完全反应。试求A、B、C三种金属的相对原子质量______、______、________;若A、B原子中质子数和中子数相等,C中质子数比中子数少4个,则A、B、C 各是什么元素 _____、____、______
20.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。
试回答:
(1)写出铁与该硝酸反应的离子方程式_______;
(2)合金中铁的质量为_______g;
(3)原硝酸的物质的量浓度为_______。
21.按要求填空:
(1)有相同温度和压强下的两种气体12C18O和14N2,若两种气体的质量相同,则两种气体所含的质子数之比为__________,若两种气体的原子数相等,则两种气体所含中子数之比_________,若两种气体的体积相同,则两种气体的密度之比为_________。
(2)10.8 g R2O5中氧原子的数目为3.01×1023,则元素R的相对原子质量为 ________。
(3)将10 mL1.00 mol/L Na2CO3溶液与10 mL1.00 mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为___________(忽略混合前后溶液体积的变化)。
(4)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是_________。
(5)在空气中煅烧CoC2O4生成钴的氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为_______________。
22.元素周期表与元素周期律在学习、研究中有很重要的作用。下表所示为某5种元素的相关信息,已知W、X都位于第三周期。回答下列问题:
元素 信息
Q 地壳中含量最高的元素
W 最高化合价为+7
X 最高价氧化物对应的水化物在本周期中碱性最强
Y 焰色试验(透过蓝色钴玻璃)的火焰呈紫色
Z 原子结构示意图为
(1)W在元素周期表中的位置为______,X的最高价氧化物对应的水化物的电子式为_______。
(2)金属性:Y_____X(填“>”或“<”)
(3)下列对于Z及其化合物的推断中正确的是___________(填标号)。
A.Z元素的化合价只有-1和+7
B.Z的最高价氧化物对应水化物的酸性弱于W的最高价氧化物对应水化物的酸性
C.Z的气态氢化物比W的气态氢化物稳定
D.Z单质的熔沸点比W单质的熔沸点高
(4)将X元素的单质在Q元素的单质中点燃生成M,预测将M投入FeSO4溶液中,主要的反应现象是______。
23.元素周期表是学习化学的重要工具.下表列出了①~⑩十种元素在周期表中的位置:
族 周期 IA IIA IIIA IVA VA VIA VIIA 0
2 ① ②
3 ③ ④ ⑤ ⑥ ⑦ ⑧
4 ⑨ ⑩
请按要求回答下列问题:
(1)写出元素①单质的电子式是_____,元素②简单氢化物的结构式________
(2)③、④、⑨三种元素按原子半径由大到小的顺序排列为________(用元素符号表示).
(3)元素⑥、⑦、⑧三种元素最高价氧化物对应水化物的酸性最强的为________(用化学式表示).
(4)向元素③的单质与水反应后的溶液中加入元素⑤的单质,发生反应的化学方程式为_______.
(5)小组利用如图所示装置探究卤族元素的非金属性强弱.
①写出装置A中发生的离子反应方程式__________.
②取2mL A中橙黄色溶液于试管中,再滴入几滴KI淀粉溶液,观察到溶液变为蓝色.通过以上实验,不能得出非金属性:Br>I,理由____________________.
参考答案:
1.A 2.A 3.C 4.C 5.B 6.A 7.B 8.A 9.A 10.B 11.B 12.A 13.C
14. 硅酸钠 CaCO3+SiO2CaSiO3+CO2↑
15. 16 18 18 34 铁 质子 核外电子 2 4 与、与
16. 防倒吸 溶液 稀硫酸 溶液
17. ③④⑤ MnO2+4H++2Cl–Mn2++Cl2↑+2H2O A 生成淡黄色沉淀或溶液变浑浊 Na2S+Cl2=2NaCl+S↓ 0.02 Cl2+2OH–=Cl–+ClO–+H2O
18. C B D G 使分液漏斗下端管口紧靠烧杯内壁;及时关闭活塞,不让上层液体流出 使分液漏斗内外空气相通,以保证进行E操作时漏斗里的液体顺利流出 CCl4与水既不反应也不互溶,且碘在CCl4中的溶解度比在水中大得多
19. 24 40 56 Mg Ca Fe
20.(1)
(2)1.344
(3)1.48
21. 14:15 8:7 15:14 14 1.00mol/L 1:3 Co3O4
22.(1) 第三周期第VIIA族
(2)>
(3)BD
(4)有气泡产生,并生成红褐色沉淀
23. :N N: H-O-H K>Na>Mg HClO4 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Cl2+2Br-=Br2+2Cl- 过量的氯气与碘化钾反应生成氯化钾和碘
一、单选题(共13题)
1.NA为阿伏加德罗常数的值。下列说法不正确的是
A.13gZn与一定量盐酸反应最终产生0.2gH2,Zn失去的电子数为0.4NA
B.1L0.5 mol/LNa2CO3溶液中含有的Na+的数目为NA
C.常温常压下,1.8gD2O中含有质子的数目为0.9NA
D.标准状况下,2.24L氦气中含有原子的数目为0.1NA
2.下列事实不能用元素周期律解释的是
A.酸性:H2SO3>H2CO3 B.还原性:S2->Cl-
C.气态氢化物的稳定性:H2O>NH3 D.Cl2从KBr溶液中置换出Br2
3.核电荷数为1~18的元素中,下列叙述正确的是
A.最外层只有1个电子的元素一定是金属元素
B.最外层只有2个电子的元素一定是金属元素
C.原子核外各层电子数相等的元素一定是金属元素
D.原子最外层电子数不能超过8个
4.下列说法不正确的是
A.金刚石、石墨和C60都是碳元素的同素异形体
B.医疗上硫酸亚铁可用于生产防治缺铁性贫血的药剂
C.FeO在空气里受热,能迅速被氧化成Fe2O3
D.水质检测员在自来水出厂前会对水中的Cl-、SO、微生物、有机物等进行检测和分析
5.科学家发明的透明坚硬镁铝氧化物新型材料,可以用作显示器和手机屏幕。下列有关镁 和铝的说法正确的是
A.镁的金属性比铝弱
B.镁和铝的氧化物都可以与盐酸反应
C.镁和铝原子的最外层电子数都为3
D.镁和铝的氧化物都可以与氢氧化钠溶液反应
6.下列关于碱土金属元素及其单质的叙述错误的是
A.这些元素的原子最外层都有2个电子,都容易失去2个电子达到8电子稳定结构
B.碱土金属性质活泼,在自然界都以化合态存在
C.该主族中的每一种金属元素的单质都呈亮白色,都具有良好的导电性
D.含钙、锶、钡等元素的物质灼烧时都会产生绚丽的颜色,可用于制造焰火
7.作为全球最大的电子产品制造国,中国却有着“芯”病。我国国产芯片自给率不到30%,产值不足全球的7%,市场份额不到10%。下列说法正确的是
A.CPU半导体芯片与光导纤维是同种材料
B.水泥和玻璃属于硅酸盐材料
C.水晶和陶瓷都是硅酸盐制品
D.二氧化氮、二氧化硅都是酸性氧化物
8.用下图所示实验装置进行相应实验,能达到实验目的的是
A B C D
用浓硫酸干燥SO2 证明氧化性:Cl2>Br2>I2 制作蓝色喷泉 证明非金属性:Cl>C>Si
A.A B.B C.C D.D
9.应用元素周期律的有关知识,可以预测我们不熟悉的一些元素的单质及其化合物的性质。下列预测中正确的是
①第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
②砹(At)单质为有色固体,AgAt不溶于水
③Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
④硫酸锶(SrSO4)是难溶于水的白色固体
⑤硒化氢(H2Se)是无色、有毒、比H2S稳定的气体
A.②④ B.①②③④ C.①③⑤ D.②④⑤
10.下列叙述正确的是
A.24g镁与27g铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,电子数相同
C.1mol重水与1mol水中,原子个数比为2∶1
D.1mol氖气中含有2NA个氖原子
11.硅酸盐材料是传统的无机非金属材料。下面有关硅酸盐材料的说法正确的是
A.普通玻璃的主要成分是纯碱、石灰石和石英
B.制造水泥的主要原料是石灰石和黏土
C.高纯度的硅广泛用于制造光导纤维,光导纤维遇强碱会“断路”
D.陶器比瓷器的结构致密,几乎不吸水
12.表示阿伏加德罗常数的值。下列说法正确的是
A.12g金刚石和12g石墨中均含有个碳原子
B.1mol重水比1mol水多个质子
C.标准状况下,中含有的共价键数为
D.溶液中含有的氯离子数为
13.下列说法中有错误的是( )
A.某原子K层上只有一个电子 B.某离子M层和L层上的电子数均为K层的4倍
C.某原子M层上的电子数为L层电子数的4倍 D.存在核电荷数与最外层电子数相等的离子
二、非选择题(共10题)
14.普通玻璃的主要原料是纯碱、石灰石和石英,窑里加强热时,纯碱与石英的 反应化学方程式为Na2CO3+SiO2Na2SiO3+CO2↑,其中产物Na2SiO3 的名称为_______,仿造这个方程式,写出石灰石(CaCO3)与SiO2 加强热的反应方程式_______.
15.(1)中的质子数是__________,中子数是__________,核外电子数是__________,质量数是__________。
(2)Fe、、是__________元素的三种粒子,它们的__________数相同,它们的__________数不相同。
(3)由与所代表的物质中,共有__________种元素,__________种原子,互为同位素的原子有__________。
三、实验题
16.利用如图装置可以验证非金属性的变化规律。
(1)干燥管D的作用是_______。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品溶液、、浓盐酸、,请选择合适药品设计实验验证氯的非金属性大于硫的;装置C中所装药品分别为_______,装置C中反应的离子方程式为_______。
(3)若要证明非金属性:,则A中加_______、B中加、C中加_______。
17.已知单质硫是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)已知:①硫酸比次氯酸稳定;②氯酸比硫酸酸性强;③S2–比Cl–还原性强;④HCl比H2S稳定;⑤足量的硫、氯气分别与铁反应生成FeS、FeCl3。其中可作为氯元素比硫元素非金属性强的依据的是____。
(2)A中发生的离子方程式为___。
(3)装置B中盛放的试剂是____(填选项),实验现象为____。化学反应方程式是____。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液 D.SO2水溶液
(4)装置B中的溶液在实验后质量增重了0.78g,则在B中反应的气体为___mol。
(5)装置C中盛放烧碱稀溶液,目的是吸收剩余气体,防止污染空气。写出反应的离子方程式:___。
18.某化学兴趣小组以海带为原料制取少量碘水,现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液.其实验可分解为如下各步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中
B.把50mL碘水和15mL CCl4加入分液漏斗中,并盖好玻璃塞
C.检验分液漏斗活塞和上口的玻璃塞是否漏液
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧杯接收下层溶液
F.从分液漏斗上口倒出上层溶液
G.将分液漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准分液漏斗口上的小孔
H.静置、分层
就此实验完成下列填空:
(1)正确操作步骤的顺序是(用上述各操作的编号字母填写):
_________→_________→_________→A→H_________→E→F
(2)上述E步骤的操作中应注意__________________________。
(3)上述G步骤操作的目的是______________________。
(4)能选用CCl4从碘水中萃取碘的原因是______________________。
四、计算题
19.有A、B、C三种二价金属,它们的相对原子质量之比为 3:5:7,如果把7 mol A、5 mol B、3 mol C 混合,取出均匀混合物5.36 g,加入2 mol·L1 HCl 150 mL 恰好完全反应。试求A、B、C三种金属的相对原子质量______、______、________;若A、B原子中质子数和中子数相等,C中质子数比中子数少4个,则A、B、C 各是什么元素 _____、____、______
20.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。
试回答:
(1)写出铁与该硝酸反应的离子方程式_______;
(2)合金中铁的质量为_______g;
(3)原硝酸的物质的量浓度为_______。
21.按要求填空:
(1)有相同温度和压强下的两种气体12C18O和14N2,若两种气体的质量相同,则两种气体所含的质子数之比为__________,若两种气体的原子数相等,则两种气体所含中子数之比_________,若两种气体的体积相同,则两种气体的密度之比为_________。
(2)10.8 g R2O5中氧原子的数目为3.01×1023,则元素R的相对原子质量为 ________。
(3)将10 mL1.00 mol/L Na2CO3溶液与10 mL1.00 mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为___________(忽略混合前后溶液体积的变化)。
(4)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是_________。
(5)在空气中煅烧CoC2O4生成钴的氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为_______________。
22.元素周期表与元素周期律在学习、研究中有很重要的作用。下表所示为某5种元素的相关信息,已知W、X都位于第三周期。回答下列问题:
元素 信息
Q 地壳中含量最高的元素
W 最高化合价为+7
X 最高价氧化物对应的水化物在本周期中碱性最强
Y 焰色试验(透过蓝色钴玻璃)的火焰呈紫色
Z 原子结构示意图为
(1)W在元素周期表中的位置为______,X的最高价氧化物对应的水化物的电子式为_______。
(2)金属性:Y_____X(填“>”或“<”)
(3)下列对于Z及其化合物的推断中正确的是___________(填标号)。
A.Z元素的化合价只有-1和+7
B.Z的最高价氧化物对应水化物的酸性弱于W的最高价氧化物对应水化物的酸性
C.Z的气态氢化物比W的气态氢化物稳定
D.Z单质的熔沸点比W单质的熔沸点高
(4)将X元素的单质在Q元素的单质中点燃生成M,预测将M投入FeSO4溶液中,主要的反应现象是______。
23.元素周期表是学习化学的重要工具.下表列出了①~⑩十种元素在周期表中的位置:
族 周期 IA IIA IIIA IVA VA VIA VIIA 0
2 ① ②
3 ③ ④ ⑤ ⑥ ⑦ ⑧
4 ⑨ ⑩
请按要求回答下列问题:
(1)写出元素①单质的电子式是_____,元素②简单氢化物的结构式________
(2)③、④、⑨三种元素按原子半径由大到小的顺序排列为________(用元素符号表示).
(3)元素⑥、⑦、⑧三种元素最高价氧化物对应水化物的酸性最强的为________(用化学式表示).
(4)向元素③的单质与水反应后的溶液中加入元素⑤的单质,发生反应的化学方程式为_______.
(5)小组利用如图所示装置探究卤族元素的非金属性强弱.
①写出装置A中发生的离子反应方程式__________.
②取2mL A中橙黄色溶液于试管中,再滴入几滴KI淀粉溶液,观察到溶液变为蓝色.通过以上实验,不能得出非金属性:Br>I,理由____________________.
参考答案:
1.A 2.A 3.C 4.C 5.B 6.A 7.B 8.A 9.A 10.B 11.B 12.A 13.C
14. 硅酸钠 CaCO3+SiO2CaSiO3+CO2↑
15. 16 18 18 34 铁 质子 核外电子 2 4 与、与
16. 防倒吸 溶液 稀硫酸 溶液
17. ③④⑤ MnO2+4H++2Cl–Mn2++Cl2↑+2H2O A 生成淡黄色沉淀或溶液变浑浊 Na2S+Cl2=2NaCl+S↓ 0.02 Cl2+2OH–=Cl–+ClO–+H2O
18. C B D G 使分液漏斗下端管口紧靠烧杯内壁;及时关闭活塞,不让上层液体流出 使分液漏斗内外空气相通,以保证进行E操作时漏斗里的液体顺利流出 CCl4与水既不反应也不互溶,且碘在CCl4中的溶解度比在水中大得多
19. 24 40 56 Mg Ca Fe
20.(1)
(2)1.344
(3)1.48
21. 14:15 8:7 15:14 14 1.00mol/L 1:3 Co3O4
22.(1) 第三周期第VIIA族
(2)>
(3)BD
(4)有气泡产生,并生成红褐色沉淀
23. :N N: H-O-H K>Na>Mg HClO4 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Cl2+2Br-=Br2+2Cl- 过量的氯气与碘化钾反应生成氯化钾和碘
