物理人教版(2019)选择性必修第三册4.4氢原子光谱和玻尔的原子模型(共70张ppt)
文档属性
| 名称 | 物理人教版(2019)选择性必修第三册4.4氢原子光谱和玻尔的原子模型(共70张ppt) | 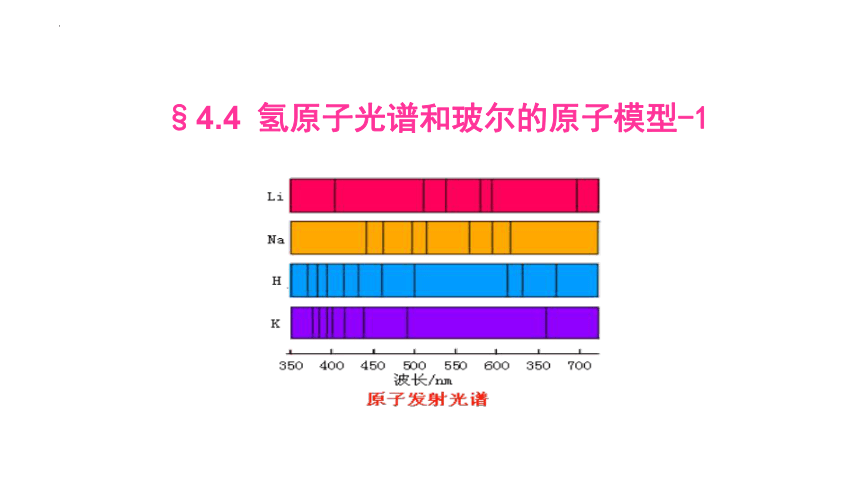 | |
| 格式 | pptx | ||
| 文件大小 | 28.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 物理 | ||
| 更新时间 | 2023-06-22 22:23:49 | ||
图片预览











文档简介
(共70张PPT)
§4.4 氢原子光谱和玻尔的原子模型-1
把食盐放在火中灼烧,会发出黄色的光。食盐为什么发黄光而不发其他颜色的光呢?
新课导入
早在17世纪,牛顿就发现了日光通过三棱镜后的色散现象,并把实验中得到的彩色光带叫做光谱。
一、光谱
光谱:
是电磁辐射(不论是在可见光区域还是在不可见光区域)的波长成分和强度分布的记录。有时只是波长成分的记录。
发射光谱可分为两类:
连续谱和线状谱。
1.发射光谱
物体发光直接产生的光谱叫做发射光谱。
光谱分析仪
气体放电管
金属导杆
感应圈
电源
玻璃管中稀薄气体的分子在强电场的作用下会电离,成为自由移动的正负电荷,于是气体变成导体,导电时会发光。
观察光谱的实验装置
A
S
L1
P
L2
B
M
N
L3
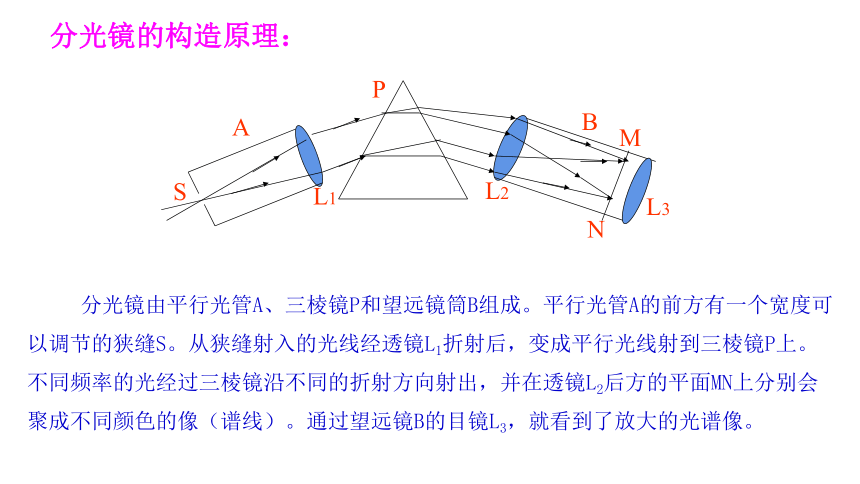
分光镜由平行光管A、三棱镜P和望远镜筒B组成。平行光管A的前方有一个宽度可以调节的狭缝S。从狭缝射入的光线经透镜L1折射后,变成平行光线射到三棱镜P上。不同频率的光经过三棱镜沿不同的折射方向射出,并在透镜L2后方的平面MN上分别会聚成不同颜色的像(谱线)。通过望远镜B的目镜L3,就看到了放大的光谱像。
分光镜的构造原理:
用分光镜观察连续光谱
(1)连续谱:
①连续分布的包含有从红光到紫光各种色光的光谱叫做连续谱。
②炽热的固体、液体和高压气体的发射光谱是连光谱。
例如:白炽灯丝发出的光、烛焰、炽热的钢水发出的光都形成连续谱。
炽热的固体
炽热的液体
高压气体
用分光镜观察原子光谱
(2)线状谱
①只含有一些不连续的亮线的光谱叫做线状谱。明线光谱中的亮线叫谱线,各条谱线对应不同波长的光。
②稀薄气体或金属的蒸气的发射光谱是线状谱。
③明线光谱是由游离状态的原子发射的,所以也叫原子的光谱。
实例:霓虹灯发出的光
几种原子的发射光谱
④各种原子的发射光谱都是线状谱,说明原子只发出几种特定频率的光。
⑤不同原子的亮线位置(谱线)不同,说明不同原子的发光频率不同。因此线状谱的谱线被称为原子的特征谱线。
铜——蓝色火焰
钠——橙黄色火焰
锶——红色火焰
钡——黄绿色火焰
烟花中的绚烂的色彩从哪里来?
用分光镜观察吸收光谱
(3)吸收光谱
①高温物体发出的白光(其中包含连续分布的一切波长的光)通过物质时,某些波长的光被物质吸收后产生的光谱,叫做吸收光谱。
②各种原子的吸收光谱中的每一条暗线都跟该种原子的原子的发射光谱中的一条明线相对应。
③低温气体原子吸收的光,恰好就是这种原子在高温时发出的光。因此吸收光谱中的暗谱线,也是原子的特征谱线。
各种原子的吸收光谱中的每一条暗线都跟该种原子的发射光谱(线状谱)中的一条明线相对应。
氢的发射光谱
氢的吸收光谱
吸收光谱也是原子的特征谱线
太阳光谱是吸收光谱
Na的发射光谱
Na的吸收光谱
几种光谱的比较
比较 光谱 产生条件 光谱形式及应用
发射光谱 线状谱 稀薄气体发光形成的光谱 由一些不连续的明线组成,不同元素的明线光谱不同(又叫特征光谱),可用于光谱分析
连续谱 炽热的固体、液体和高压气体发光形成的 连续分布,一切波长的光都有
吸收光谱 炽热物体发出的白光通过温度较低的气体后,再色散形成的 用分光镜观察时,见到连续光谱背景上出现一些暗线(与特征谱线相对应),可用于光谱分析
1、光谱分析:
由于每一种元素都有自己的特征谱线,因此可以根据光谱来鉴别物质和确定它的化学组成。这种方法叫做光谱分析。
2、光谱分析的的原理:利用发射光谱和吸收光谱。
3、光谱分析的优点:非常灵敏而且迅速。
4、光谱分析的应用:发现新元素和研究天体的化学组成。
(4)光谱分析
光谱分析的技术在科学研究中有广泛的应用,一种元素在样品中的含量即使很少,也能观察到它的光谱.因此光谱分析可以用来确定样品中包含哪些元素,这种方法非常灵敏,利用光谱还能确定遥远星球的物质成分.
漆碗:第三文化层(距今6500~6000年).利用红外光分析其表面,其光谱图和马王堆汉墓出土漆皮的裂解光谱图相似.
X射线照射激发荧光,通过分析荧光判断越王勾践宝剑的成分.
氢原子是最简单的原子,其光谱也最简单。从氢气放电管可以获得氢原子光谱。
氢原子的光谱
可见光区
氢原子在可见光区的四条谱线
3、可见光的波长范围: 4.0×10-7m~7.6×10-7m (400nm~760nm)。
1、氢原子在可见光区有四条谱线。氢原子光谱呈现分立的明线条纹,在可见光区内,由右向左,相邻谱线间的距离越来越小,表现出明显的规律性。
紫外区
红外区
2、氢原子的谱线由不同色亮线组成,每种颜色对应着一种波长。
氢原子是最简单的原子,其光谱也最简单。
二、氢原子光谱
里德伯常量:
巴耳末公式:
其他谱系
经典理论认为
核外电子绕核运动
辐射电磁波,损失能量
电子轨道半径连续变小
最终落在原子核上
原子不稳定
事实
原子是稳定的
经典理论的困难
+
+
经典理论认为
电子轨道的变化是连续的
辐射电磁波的频率等于绕核运动的频率,连续变化
原子光谱应该是连续光谱
事实
原子光谱是不连续的线状谱
经典理论的困难
①按经典理论电子绕核旋转,作加速运动,电子将不断向四周辐射电磁波,它的能量不断减小,从而将逐渐靠近原子核,最后落入原子核中。
②轨道及转动频率不断变化,辐射电磁波频率也是连续的,原子光谱应是连续的光谱。
实验表明:
原子相当稳定,这一结论与实验不符。实验测得原子光谱是不连续的谱线,具有分立特征。
卢瑟福原子核式模型无法解释氢原子光谱的规律。
三、卢瑟福原子核式模型的困难
【例1】(多选)如图甲所示是a,b,c,d四种元素线状谱,图乙是某矿物的线状谱,通过光谱分析可以了解该矿物中缺乏的是( )
A. a元素
B. b元素
C. c元素
D. d元素
BD
【练1】(多选)关于太阳光谱,下列说法正确的是( )
A. 太阳光谱是吸收光谱
B. 太阳光谱中的暗线,是太阳光经过太阳大气层时某些特定频率的光被吸收后而产生的
C. 根据太阳光谱中的暗线,可以分析太阳的物质组成
D. 根据太阳光谱中的暗线,可以分析地球大气层中含有哪些元素
AB
【练1】(多选)关于光谱和光谱分析,下列说法正确的是( )
A. 太阳光谱与白炽灯光谱是连续光谱
B. 霓虹灯产生的光谱是明线光谱
C. 做光谱分析可以用明线光谱,也可用吸收光谱
D. 我们观察月亮的光谱可以确定月亮的化学组成
BC
【例2】(多选)关于巴耳末公式的理解,下列说法错误的是( )
A. 公式中n只能取不小于3的整数值,故氢原子光谱是线状谱
B. 公式中n可取任意值,故氢原子光谱是连续谱
C. 所有氢原子光谱的波长都可由巴耳末公式求出
D. 公式不但适用于氢原子光谱的分析,也适用于其他原子光谱的分析
BCD
【练2】判断下列语句的正误:
( )各种原子的发射光谱都是线状谱,并且只能发出几个特定的频率
( )原子的发射光谱和吸收光谱都是分立的线状谱
( )可以利用光谱分析来鉴别物质和确定物质的组成成分
( )光谱研究是探索原子核内部结构的一条重要途径
( )氢气放电管内气体导电发光是热辐射现象
【例3】电子绕核作圆周运动,按经典物理学观点推断,下列说法错误的是( )
A. 要发射电磁波,电磁波的频率是连续的
B. 电子轨道半径应逐渐减小
C. 原子应该是不稳定的
D. 辐射电磁波的频率只是某些确定的值
D
卢瑟福的核式结构学说与经典电磁理论的矛盾(一)
原子是稳定的
电子绕核运动将不断向外辐射电磁波,电子损失了能量,其轨道半径不断缩小,最终落在原子核上,而使原子变得不稳定.
+
经典理论认为
事实
+
七彩的夜景
卢瑟福的核式结构学说与经典电磁理论的矛盾(二)
由于电子轨道的变化是连续的,辐射电磁波的频率等于绕核运动的频率,连续变化,原子光谱应该是连续光谱
经典理论认为
事实
原子光谱是不连续的线状谱
玻尔原子理论假设的基础
普朗克黑体辐射的量子论
爱因斯坦的光量子论
玻尔原子结构假说
1、围绕原子核运动的电子轨道半径只能是某些分立的数值且电子在这些轨道上绕核的转动是稳定的,不产生电磁辐射
2、原子在不同的轨道上运动时,原子处于不同的状态.波尔指出,原子的不同的状态中具有不同的能量,所以原子的能量也是量子化的
1913年玻尔提出了自己的原子结构假说
轨道量子化假说
能量量子化假说
——针对原子的核式结构模型
——针对原子的稳定性
玻尔,丹麦物理学家1885年10月7日—1962年11月18日,1922获得诺贝尔物理学奖
一、玻尔原子理论的基本假设
(三个重要假设)
假说1:轨道量子化
针对原子核式结构模型提出
+
rn
n=1
n=2
n=3
v
-
n=4
n=∞
绕核运动的电子轨道半径只能是某些分立的数值。
轨道量子化:
氢原子:
量子数
一、玻尔原子理论的基本假设
(三个重要假设)
假说2:能量量子化
针对原子的稳定性提出
n=∞
⑵能级:原子的在各种定态时的能量值
⑴定态:原子具有确定能量的稳定状态
①基态:能量最低的状态(离核最近)
②激发态:其他的能量状态
能量量子化:
氢原子:
原子的能量与电子所在的轨道相对应
当电子在不同的轨道上运动时,原子具有不同的能量。
⑶电子轨道与原子能级的对应关系
基态
激发态
E4
1
2
3
4
E1
E3
E2
E∞
n
轨道与能级相对应
原子能级图
第1激发态
∞
第n-1激发态
电子轨道图
氢原子:
+
n=1
n=2
n=3
v
-
n=4
v
-
v
-
v
-
n=∞
一、玻尔原子理论的基本假设
(三个重要假设)
假说3:频率条件(跃迁假说)
针对原子光谱是线状谱提出
+
m
n
低能级(En)
高能级(Em)
电子吸收光子克服库仑引力做功,原子能量增加
电子辐射光子,原子能量减少
跃 迁
频率条件:
-
二、玻尔理论对氢光谱的解释
轨道量子化:
氢原子:
能量量子化:
氢原子:
频率条件:
(辐射条件)
玻
尔
原
子
模
型
13.6
3.4
1.51
0.85
E/eV
0
1、电子从高能级向低能级跃迁(自发跃迁)
处于激发态的原子是不稳定的,可自发地经过一次或几次跃迁到达基态。
发射光子的能量:
——发射光子
由于能级是分立的,所以放出的光子的能量也是分立的,因此原子的发射光谱只有一些分立的亮线。
-
-
2、电子从低能级向高能级跃迁(受激跃迁)
吸收光子的能量:
——吸收光子
-
-
-
吸收光子的能量必须等于能级差
-
-
处于某个能级的电子吸收能量,挣脱原子核的束缚,成为自由电子的现象,叫做电离。电离后自由电子动能EK = hv - En
发射光谱的明线与吸收光谱的暗线频率相同
电子从低能级向高能级跃迁(受激跃迁):
①吸收光子(光照)
1)原子的电离:原子由某一定态轨道跃迁到最高能级n=∞的过程。(对于能量大于或等于13.6eV的光子,氢原子电离,即原子结构被破坏)
电离后电子剩余动能为:
注意:En为负值
电离条件:
2)光子使原子跃迁(n→m):光子的能量必须等于能级差,才能被吸收。(对于能量小于13.6eV的光子,光子能量必须恰好等于能级差即要么全被吸收,要么不吸收。)
跃迁条件:
要么全被吸收,要么不吸收。
吸收能量
②吸收实物粒子能量(碰撞、加热)
只要实物粒子(如微观粒子中的电子、α粒子等)能量足以使氢原子向高能级跃迁,就能被氢原子全部吸收或部分吸收而使氢原子向高能级跃迁,多余能量仍为实物粒子动能(自己保留)。
电离后电子剩余动能为:
2)实物粒子使原子跃迁(n→m) :
实物粒子的能量可以全部或部分被吸收,需要多少,吸收多少。多余的能量由实物粒子自己保留。
1)原子的电离:原子由某一定态轨道跃迁到最高能级n=∞的过程。
电离条件:
注意:En为负值
氢原子能级图
跃迁条件:
从高能级向低能级跃迁(自发跃迁)
从低能级向高能级跃迁(受激跃迁)
1
∞
n
5
4
3
2
- 0.85
-13.6
0
- 0.54
-1.51
- 3.4
E/eV
巴耳末系
赖曼系
帕邢系
思考:在具有下列能量的光子中,能被基态氢离子吸收而发生跃迁的是( )
A、13.6eV
B、12.75eV
C、 10ev
D、1.9eV
玻尔理论成功解释了氢光谱的规律,甚至预言了氢原子的其他谱线系
氢原子的能级图
布喇开系
玻尔在解决核外电子的运动时成功引入了量子化的观念
同时又应用了“粒子、轨道”等经典概念和有关牛顿力学规律
除了氢原子光谱外,在解决其他问题上遇到了很大的困难
没有绕开经典理论
无法解释复杂一点的原子的光谱现象
无法解释谱线的强度等
1、玻尔理论的局限性
2、原子结构理论的发展过程
汤姆孙发现电子
汤姆孙的西瓜模型
α 粒子散射实验
卢瑟福的核式结构模型
原子不可割
汤姆孙的西瓜模型
原子稳定性事实氢光谱实验
卢瑟福的核式结构模型
复杂(氦)原子光谱
量子力学理论
玻尔模型
建 立
否 定
建 立
否 定
建 立
否 定
否 定
观察与实验所获得的事实
建
立
科
学
模
型
提
出
科
学
假
说
玻尔模型
彻底放弃经典概念,用电子云概念取代经典的轨道概念
建 立
电子云
电子在某处单位体积内出现的概率
课堂小结
提出假说--玻尔的原子结构假说:
1)轨道量子化假说
2)能量量子化假说
3)跃迁假说:
提出问题:原子的稳定性、原子光谱是线状谱
验证:氢原子光谱
(弗兰克—赫兹实验)
【例1】(多选)玻尔在他提出的原子模型中所做的假设有( )
A. 原子处于称为定态的能量状态时,虽然电子做加速运动,但并不向外辐射能量
B. 原子的不同能量状态与电子沿不同的圆轨道绕核运动相对应,而电子的可能轨道的分布是不连续的
C. 电子从一个轨道跃迁到另一轨道时,辐射(或吸收)一定频率的光子
D. 电子跃迁时辐射的光子的频率等于电子绕核做圆周运动的频率
ABC
【练1】关于玻尔建立的氢原子模型,下列说法正确的是 ( )
A. 氢原子处于基态时,电子的轨道半径最大
B. 氢原子在不同能量态之间跃迁时可以吸收任意频率的光子
C. 氢原子从基态向较高能量态跃迁时,电子的动能减小
D. 氢原子从基态向较高能量态跃迁时,系统的电势能减小
C
【例2】(多选)根据玻尔理论,氢原子的核外电子在离核最近的第一条轨道和第二条轨道上运动时( )
A. 第二条轨道上动能小
B. 第二条轨道上电势能小
C. 第二条轨道上氢原子能量小
D. 第二条轨道上电离能小
AD
【练2】(多选)按照玻尔理论,下列关于氢原子的论述正确的是( )
A.第m个定态和第n个定态的轨道半径rm和rn之比为rm:rn=m2:n2
B.电子沿一轨道绕核运动,若其圆周运动的频率为v,则其发光频率也是v
C.第m个定态和第n个定态的能量Em:En之比为 n2:m2
D.若氢原子处于能量为E的定态,则其发光频率为ν=E / h
AC
【例3】利用氢原子能级跃迁时辐射出来的电磁波去控制校准石英钟,可以制成氢原子钟。如图所示为氢原子的能级图,一群处于n=4能级的氢原子向低能级跃迁,能辐射出波长最短的电磁波的频率为(已知普朗克常数为6.63×10﹣34J s)( )
A. 3.08×1014Hz
B. 3.08×1015Hz
C. 1.93×1014Hz
D. 1.93×1014Hz
B
【练3】(多选)氦原子被电离一个核外电子,形成类氢结构的氦离子。已知基态的氦离子能量为E1=﹣54.4eV,氦离子能级的示意图如下所示。在具有下列能量的光子中,能被基态氦离子吸收而发生跃迁的是( )
A. 40.8eV
B. 43.2eV
C. 51.0eV
D. 54.4eV
ACD
【例4】原子核外甲处电子云密度是乙处的三倍,说明( )
A. 在甲处出现的电子至少有三个
B. 该原子至少有四个电子
C. 电子在甲处出现的机会是乙处的三倍
D. 电子在丙处不出现
C
在解决核外电子的运动时成功引入了量子化的观念
同时又应用了“粒子、轨道”等经典概念和有关牛顿力学规律
除了氢原子光谱外,在解决其他问题上遇到了很大的困难.
氦原子光谱
量子化条件的引进没有适当的理论解释。
玻尔理论成功的解释并预言了氢原子辐射的电磁波的问题,但是也有它的局限性.
三、玻尔模型的局限性
汤姆孙发现电子
汤姆孙的
西瓜模型
α 粒子散射实验
卢瑟福的
核式结构模型
原子不可割
汤姆孙的
西瓜模型
原子稳定性事实
氢光谱实验
卢瑟福的核式结构模型
矛盾
玻尔模型
复杂(氦)原子光谱
量子力学理论
矛盾
矛盾
否 定
建 立
否 定
建 立
否 定
建 立
玻尔模型
否 定
建 立
修正
修正
1.对玻尔理论的下列说法中,正确的是( )
A.继承了卢瑟福的原子模型,但对原子能量和电子轨道引入了量子化假设
B.对经典电磁理论中关于“做加速运动的电荷要辐射电磁波”的观点提出了异议
C.用能量转化与守恒建立了原子发光频率与原子能量变化之间的定量关系
D.玻尔的两个公式是在他的理论基础上利用经典电磁理论和牛顿力学计算出来的
ABCD
小试牛刀
2.下面关于玻尔理论的解释中,不正确的说法是( )
A.原子只能处于一系列不连续的状态中,每个状态都对应一定的能量
B.原子中,虽然核外电子不断做加速运动,但只要能量状态不改变,就不会向外辐射能量
C.原子从一种定态跃迁到另一种定态时,一定要辐射一定频率的光子
D.原子的每一个能量状态都对应一个电子轨道,并且这些轨道是不连续的
C
小试牛刀
3.根据玻尔理论,氢原子中,量子数N越大,则下列说法中正确的是( )
A.电子轨道半径越大
B.核外电子的速率越大
C.氢原子能级的能量越大
D.核外电子的电势能越大
ACD
小试牛刀
4.根据玻尔的原子理论,原子中电子绕核运动的半径( )
A.可以取任意值
B.可以在某一范围内取任意值
C.可以取一系列不连续的任意值
D.是一系列不连续的特定值
D
小试牛刀
5.按照玻尔理论,一个氢原子中的电子从一半径为ra的圆轨道自发地直接跃迁到一半径为rb的圆轨道上,已知ra>rb,则在此过程中( )
A.原子要发出一系列频率的光子
B.原子要吸收一系列频率的光子
C.原子要发出某一频率的光子
D.原子要吸收某一频率的光子
C
小试牛刀
6、如果大量氢原子处在n=4的能级,会辐射出几种频率的光 其中波长最短的光是在哪两个能级之间跃迁时发出的
小试牛刀
§4.4 氢原子光谱和玻尔的原子模型-1
把食盐放在火中灼烧,会发出黄色的光。食盐为什么发黄光而不发其他颜色的光呢?
新课导入
早在17世纪,牛顿就发现了日光通过三棱镜后的色散现象,并把实验中得到的彩色光带叫做光谱。
一、光谱
光谱:
是电磁辐射(不论是在可见光区域还是在不可见光区域)的波长成分和强度分布的记录。有时只是波长成分的记录。
发射光谱可分为两类:
连续谱和线状谱。
1.发射光谱
物体发光直接产生的光谱叫做发射光谱。
光谱分析仪
气体放电管
金属导杆
感应圈
电源
玻璃管中稀薄气体的分子在强电场的作用下会电离,成为自由移动的正负电荷,于是气体变成导体,导电时会发光。
观察光谱的实验装置
A
S
L1
P
L2
B
M
N
L3
分光镜由平行光管A、三棱镜P和望远镜筒B组成。平行光管A的前方有一个宽度可以调节的狭缝S。从狭缝射入的光线经透镜L1折射后,变成平行光线射到三棱镜P上。不同频率的光经过三棱镜沿不同的折射方向射出,并在透镜L2后方的平面MN上分别会聚成不同颜色的像(谱线)。通过望远镜B的目镜L3,就看到了放大的光谱像。
分光镜的构造原理:
用分光镜观察连续光谱
(1)连续谱:
①连续分布的包含有从红光到紫光各种色光的光谱叫做连续谱。
②炽热的固体、液体和高压气体的发射光谱是连光谱。
例如:白炽灯丝发出的光、烛焰、炽热的钢水发出的光都形成连续谱。
炽热的固体
炽热的液体
高压气体
用分光镜观察原子光谱
(2)线状谱
①只含有一些不连续的亮线的光谱叫做线状谱。明线光谱中的亮线叫谱线,各条谱线对应不同波长的光。
②稀薄气体或金属的蒸气的发射光谱是线状谱。
③明线光谱是由游离状态的原子发射的,所以也叫原子的光谱。
实例:霓虹灯发出的光
几种原子的发射光谱
④各种原子的发射光谱都是线状谱,说明原子只发出几种特定频率的光。
⑤不同原子的亮线位置(谱线)不同,说明不同原子的发光频率不同。因此线状谱的谱线被称为原子的特征谱线。
铜——蓝色火焰
钠——橙黄色火焰
锶——红色火焰
钡——黄绿色火焰
烟花中的绚烂的色彩从哪里来?
用分光镜观察吸收光谱
(3)吸收光谱
①高温物体发出的白光(其中包含连续分布的一切波长的光)通过物质时,某些波长的光被物质吸收后产生的光谱,叫做吸收光谱。
②各种原子的吸收光谱中的每一条暗线都跟该种原子的原子的发射光谱中的一条明线相对应。
③低温气体原子吸收的光,恰好就是这种原子在高温时发出的光。因此吸收光谱中的暗谱线,也是原子的特征谱线。
各种原子的吸收光谱中的每一条暗线都跟该种原子的发射光谱(线状谱)中的一条明线相对应。
氢的发射光谱
氢的吸收光谱
吸收光谱也是原子的特征谱线
太阳光谱是吸收光谱
Na的发射光谱
Na的吸收光谱
几种光谱的比较
比较 光谱 产生条件 光谱形式及应用
发射光谱 线状谱 稀薄气体发光形成的光谱 由一些不连续的明线组成,不同元素的明线光谱不同(又叫特征光谱),可用于光谱分析
连续谱 炽热的固体、液体和高压气体发光形成的 连续分布,一切波长的光都有
吸收光谱 炽热物体发出的白光通过温度较低的气体后,再色散形成的 用分光镜观察时,见到连续光谱背景上出现一些暗线(与特征谱线相对应),可用于光谱分析
1、光谱分析:
由于每一种元素都有自己的特征谱线,因此可以根据光谱来鉴别物质和确定它的化学组成。这种方法叫做光谱分析。
2、光谱分析的的原理:利用发射光谱和吸收光谱。
3、光谱分析的优点:非常灵敏而且迅速。
4、光谱分析的应用:发现新元素和研究天体的化学组成。
(4)光谱分析
光谱分析的技术在科学研究中有广泛的应用,一种元素在样品中的含量即使很少,也能观察到它的光谱.因此光谱分析可以用来确定样品中包含哪些元素,这种方法非常灵敏,利用光谱还能确定遥远星球的物质成分.
漆碗:第三文化层(距今6500~6000年).利用红外光分析其表面,其光谱图和马王堆汉墓出土漆皮的裂解光谱图相似.
X射线照射激发荧光,通过分析荧光判断越王勾践宝剑的成分.
氢原子是最简单的原子,其光谱也最简单。从氢气放电管可以获得氢原子光谱。
氢原子的光谱
可见光区
氢原子在可见光区的四条谱线
3、可见光的波长范围: 4.0×10-7m~7.6×10-7m (400nm~760nm)。
1、氢原子在可见光区有四条谱线。氢原子光谱呈现分立的明线条纹,在可见光区内,由右向左,相邻谱线间的距离越来越小,表现出明显的规律性。
紫外区
红外区
2、氢原子的谱线由不同色亮线组成,每种颜色对应着一种波长。
氢原子是最简单的原子,其光谱也最简单。
二、氢原子光谱
里德伯常量:
巴耳末公式:
其他谱系
经典理论认为
核外电子绕核运动
辐射电磁波,损失能量
电子轨道半径连续变小
最终落在原子核上
原子不稳定
事实
原子是稳定的
经典理论的困难
+
+
经典理论认为
电子轨道的变化是连续的
辐射电磁波的频率等于绕核运动的频率,连续变化
原子光谱应该是连续光谱
事实
原子光谱是不连续的线状谱
经典理论的困难
①按经典理论电子绕核旋转,作加速运动,电子将不断向四周辐射电磁波,它的能量不断减小,从而将逐渐靠近原子核,最后落入原子核中。
②轨道及转动频率不断变化,辐射电磁波频率也是连续的,原子光谱应是连续的光谱。
实验表明:
原子相当稳定,这一结论与实验不符。实验测得原子光谱是不连续的谱线,具有分立特征。
卢瑟福原子核式模型无法解释氢原子光谱的规律。
三、卢瑟福原子核式模型的困难
【例1】(多选)如图甲所示是a,b,c,d四种元素线状谱,图乙是某矿物的线状谱,通过光谱分析可以了解该矿物中缺乏的是( )
A. a元素
B. b元素
C. c元素
D. d元素
BD
【练1】(多选)关于太阳光谱,下列说法正确的是( )
A. 太阳光谱是吸收光谱
B. 太阳光谱中的暗线,是太阳光经过太阳大气层时某些特定频率的光被吸收后而产生的
C. 根据太阳光谱中的暗线,可以分析太阳的物质组成
D. 根据太阳光谱中的暗线,可以分析地球大气层中含有哪些元素
AB
【练1】(多选)关于光谱和光谱分析,下列说法正确的是( )
A. 太阳光谱与白炽灯光谱是连续光谱
B. 霓虹灯产生的光谱是明线光谱
C. 做光谱分析可以用明线光谱,也可用吸收光谱
D. 我们观察月亮的光谱可以确定月亮的化学组成
BC
【例2】(多选)关于巴耳末公式的理解,下列说法错误的是( )
A. 公式中n只能取不小于3的整数值,故氢原子光谱是线状谱
B. 公式中n可取任意值,故氢原子光谱是连续谱
C. 所有氢原子光谱的波长都可由巴耳末公式求出
D. 公式不但适用于氢原子光谱的分析,也适用于其他原子光谱的分析
BCD
【练2】判断下列语句的正误:
( )各种原子的发射光谱都是线状谱,并且只能发出几个特定的频率
( )原子的发射光谱和吸收光谱都是分立的线状谱
( )可以利用光谱分析来鉴别物质和确定物质的组成成分
( )光谱研究是探索原子核内部结构的一条重要途径
( )氢气放电管内气体导电发光是热辐射现象
【例3】电子绕核作圆周运动,按经典物理学观点推断,下列说法错误的是( )
A. 要发射电磁波,电磁波的频率是连续的
B. 电子轨道半径应逐渐减小
C. 原子应该是不稳定的
D. 辐射电磁波的频率只是某些确定的值
D
卢瑟福的核式结构学说与经典电磁理论的矛盾(一)
原子是稳定的
电子绕核运动将不断向外辐射电磁波,电子损失了能量,其轨道半径不断缩小,最终落在原子核上,而使原子变得不稳定.
+
经典理论认为
事实
+
七彩的夜景
卢瑟福的核式结构学说与经典电磁理论的矛盾(二)
由于电子轨道的变化是连续的,辐射电磁波的频率等于绕核运动的频率,连续变化,原子光谱应该是连续光谱
经典理论认为
事实
原子光谱是不连续的线状谱
玻尔原子理论假设的基础
普朗克黑体辐射的量子论
爱因斯坦的光量子论
玻尔原子结构假说
1、围绕原子核运动的电子轨道半径只能是某些分立的数值且电子在这些轨道上绕核的转动是稳定的,不产生电磁辐射
2、原子在不同的轨道上运动时,原子处于不同的状态.波尔指出,原子的不同的状态中具有不同的能量,所以原子的能量也是量子化的
1913年玻尔提出了自己的原子结构假说
轨道量子化假说
能量量子化假说
——针对原子的核式结构模型
——针对原子的稳定性
玻尔,丹麦物理学家1885年10月7日—1962年11月18日,1922获得诺贝尔物理学奖
一、玻尔原子理论的基本假设
(三个重要假设)
假说1:轨道量子化
针对原子核式结构模型提出
+
rn
n=1
n=2
n=3
v
-
n=4
n=∞
绕核运动的电子轨道半径只能是某些分立的数值。
轨道量子化:
氢原子:
量子数
一、玻尔原子理论的基本假设
(三个重要假设)
假说2:能量量子化
针对原子的稳定性提出
n=∞
⑵能级:原子的在各种定态时的能量值
⑴定态:原子具有确定能量的稳定状态
①基态:能量最低的状态(离核最近)
②激发态:其他的能量状态
能量量子化:
氢原子:
原子的能量与电子所在的轨道相对应
当电子在不同的轨道上运动时,原子具有不同的能量。
⑶电子轨道与原子能级的对应关系
基态
激发态
E4
1
2
3
4
E1
E3
E2
E∞
n
轨道与能级相对应
原子能级图
第1激发态
∞
第n-1激发态
电子轨道图
氢原子:
+
n=1
n=2
n=3
v
-
n=4
v
-
v
-
v
-
n=∞
一、玻尔原子理论的基本假设
(三个重要假设)
假说3:频率条件(跃迁假说)
针对原子光谱是线状谱提出
+
m
n
低能级(En)
高能级(Em)
电子吸收光子克服库仑引力做功,原子能量增加
电子辐射光子,原子能量减少
跃 迁
频率条件:
-
二、玻尔理论对氢光谱的解释
轨道量子化:
氢原子:
能量量子化:
氢原子:
频率条件:
(辐射条件)
玻
尔
原
子
模
型
13.6
3.4
1.51
0.85
E/eV
0
1、电子从高能级向低能级跃迁(自发跃迁)
处于激发态的原子是不稳定的,可自发地经过一次或几次跃迁到达基态。
发射光子的能量:
——发射光子
由于能级是分立的,所以放出的光子的能量也是分立的,因此原子的发射光谱只有一些分立的亮线。
-
-
2、电子从低能级向高能级跃迁(受激跃迁)
吸收光子的能量:
——吸收光子
-
-
-
吸收光子的能量必须等于能级差
-
-
处于某个能级的电子吸收能量,挣脱原子核的束缚,成为自由电子的现象,叫做电离。电离后自由电子动能EK = hv - En
发射光谱的明线与吸收光谱的暗线频率相同
电子从低能级向高能级跃迁(受激跃迁):
①吸收光子(光照)
1)原子的电离:原子由某一定态轨道跃迁到最高能级n=∞的过程。(对于能量大于或等于13.6eV的光子,氢原子电离,即原子结构被破坏)
电离后电子剩余动能为:
注意:En为负值
电离条件:
2)光子使原子跃迁(n→m):光子的能量必须等于能级差,才能被吸收。(对于能量小于13.6eV的光子,光子能量必须恰好等于能级差即要么全被吸收,要么不吸收。)
跃迁条件:
要么全被吸收,要么不吸收。
吸收能量
②吸收实物粒子能量(碰撞、加热)
只要实物粒子(如微观粒子中的电子、α粒子等)能量足以使氢原子向高能级跃迁,就能被氢原子全部吸收或部分吸收而使氢原子向高能级跃迁,多余能量仍为实物粒子动能(自己保留)。
电离后电子剩余动能为:
2)实物粒子使原子跃迁(n→m) :
实物粒子的能量可以全部或部分被吸收,需要多少,吸收多少。多余的能量由实物粒子自己保留。
1)原子的电离:原子由某一定态轨道跃迁到最高能级n=∞的过程。
电离条件:
注意:En为负值
氢原子能级图
跃迁条件:
从高能级向低能级跃迁(自发跃迁)
从低能级向高能级跃迁(受激跃迁)
1
∞
n
5
4
3
2
- 0.85
-13.6
0
- 0.54
-1.51
- 3.4
E/eV
巴耳末系
赖曼系
帕邢系
思考:在具有下列能量的光子中,能被基态氢离子吸收而发生跃迁的是( )
A、13.6eV
B、12.75eV
C、 10ev
D、1.9eV
玻尔理论成功解释了氢光谱的规律,甚至预言了氢原子的其他谱线系
氢原子的能级图
布喇开系
玻尔在解决核外电子的运动时成功引入了量子化的观念
同时又应用了“粒子、轨道”等经典概念和有关牛顿力学规律
除了氢原子光谱外,在解决其他问题上遇到了很大的困难
没有绕开经典理论
无法解释复杂一点的原子的光谱现象
无法解释谱线的强度等
1、玻尔理论的局限性
2、原子结构理论的发展过程
汤姆孙发现电子
汤姆孙的西瓜模型
α 粒子散射实验
卢瑟福的核式结构模型
原子不可割
汤姆孙的西瓜模型
原子稳定性事实氢光谱实验
卢瑟福的核式结构模型
复杂(氦)原子光谱
量子力学理论
玻尔模型
建 立
否 定
建 立
否 定
建 立
否 定
否 定
观察与实验所获得的事实
建
立
科
学
模
型
提
出
科
学
假
说
玻尔模型
彻底放弃经典概念,用电子云概念取代经典的轨道概念
建 立
电子云
电子在某处单位体积内出现的概率
课堂小结
提出假说--玻尔的原子结构假说:
1)轨道量子化假说
2)能量量子化假说
3)跃迁假说:
提出问题:原子的稳定性、原子光谱是线状谱
验证:氢原子光谱
(弗兰克—赫兹实验)
【例1】(多选)玻尔在他提出的原子模型中所做的假设有( )
A. 原子处于称为定态的能量状态时,虽然电子做加速运动,但并不向外辐射能量
B. 原子的不同能量状态与电子沿不同的圆轨道绕核运动相对应,而电子的可能轨道的分布是不连续的
C. 电子从一个轨道跃迁到另一轨道时,辐射(或吸收)一定频率的光子
D. 电子跃迁时辐射的光子的频率等于电子绕核做圆周运动的频率
ABC
【练1】关于玻尔建立的氢原子模型,下列说法正确的是 ( )
A. 氢原子处于基态时,电子的轨道半径最大
B. 氢原子在不同能量态之间跃迁时可以吸收任意频率的光子
C. 氢原子从基态向较高能量态跃迁时,电子的动能减小
D. 氢原子从基态向较高能量态跃迁时,系统的电势能减小
C
【例2】(多选)根据玻尔理论,氢原子的核外电子在离核最近的第一条轨道和第二条轨道上运动时( )
A. 第二条轨道上动能小
B. 第二条轨道上电势能小
C. 第二条轨道上氢原子能量小
D. 第二条轨道上电离能小
AD
【练2】(多选)按照玻尔理论,下列关于氢原子的论述正确的是( )
A.第m个定态和第n个定态的轨道半径rm和rn之比为rm:rn=m2:n2
B.电子沿一轨道绕核运动,若其圆周运动的频率为v,则其发光频率也是v
C.第m个定态和第n个定态的能量Em:En之比为 n2:m2
D.若氢原子处于能量为E的定态,则其发光频率为ν=E / h
AC
【例3】利用氢原子能级跃迁时辐射出来的电磁波去控制校准石英钟,可以制成氢原子钟。如图所示为氢原子的能级图,一群处于n=4能级的氢原子向低能级跃迁,能辐射出波长最短的电磁波的频率为(已知普朗克常数为6.63×10﹣34J s)( )
A. 3.08×1014Hz
B. 3.08×1015Hz
C. 1.93×1014Hz
D. 1.93×1014Hz
B
【练3】(多选)氦原子被电离一个核外电子,形成类氢结构的氦离子。已知基态的氦离子能量为E1=﹣54.4eV,氦离子能级的示意图如下所示。在具有下列能量的光子中,能被基态氦离子吸收而发生跃迁的是( )
A. 40.8eV
B. 43.2eV
C. 51.0eV
D. 54.4eV
ACD
【例4】原子核外甲处电子云密度是乙处的三倍,说明( )
A. 在甲处出现的电子至少有三个
B. 该原子至少有四个电子
C. 电子在甲处出现的机会是乙处的三倍
D. 电子在丙处不出现
C
在解决核外电子的运动时成功引入了量子化的观念
同时又应用了“粒子、轨道”等经典概念和有关牛顿力学规律
除了氢原子光谱外,在解决其他问题上遇到了很大的困难.
氦原子光谱
量子化条件的引进没有适当的理论解释。
玻尔理论成功的解释并预言了氢原子辐射的电磁波的问题,但是也有它的局限性.
三、玻尔模型的局限性
汤姆孙发现电子
汤姆孙的
西瓜模型
α 粒子散射实验
卢瑟福的
核式结构模型
原子不可割
汤姆孙的
西瓜模型
原子稳定性事实
氢光谱实验
卢瑟福的核式结构模型
矛盾
玻尔模型
复杂(氦)原子光谱
量子力学理论
矛盾
矛盾
否 定
建 立
否 定
建 立
否 定
建 立
玻尔模型
否 定
建 立
修正
修正
1.对玻尔理论的下列说法中,正确的是( )
A.继承了卢瑟福的原子模型,但对原子能量和电子轨道引入了量子化假设
B.对经典电磁理论中关于“做加速运动的电荷要辐射电磁波”的观点提出了异议
C.用能量转化与守恒建立了原子发光频率与原子能量变化之间的定量关系
D.玻尔的两个公式是在他的理论基础上利用经典电磁理论和牛顿力学计算出来的
ABCD
小试牛刀
2.下面关于玻尔理论的解释中,不正确的说法是( )
A.原子只能处于一系列不连续的状态中,每个状态都对应一定的能量
B.原子中,虽然核外电子不断做加速运动,但只要能量状态不改变,就不会向外辐射能量
C.原子从一种定态跃迁到另一种定态时,一定要辐射一定频率的光子
D.原子的每一个能量状态都对应一个电子轨道,并且这些轨道是不连续的
C
小试牛刀
3.根据玻尔理论,氢原子中,量子数N越大,则下列说法中正确的是( )
A.电子轨道半径越大
B.核外电子的速率越大
C.氢原子能级的能量越大
D.核外电子的电势能越大
ACD
小试牛刀
4.根据玻尔的原子理论,原子中电子绕核运动的半径( )
A.可以取任意值
B.可以在某一范围内取任意值
C.可以取一系列不连续的任意值
D.是一系列不连续的特定值
D
小试牛刀
5.按照玻尔理论,一个氢原子中的电子从一半径为ra的圆轨道自发地直接跃迁到一半径为rb的圆轨道上,已知ra>rb,则在此过程中( )
A.原子要发出一系列频率的光子
B.原子要吸收一系列频率的光子
C.原子要发出某一频率的光子
D.原子要吸收某一频率的光子
C
小试牛刀
6、如果大量氢原子处在n=4的能级,会辐射出几种频率的光 其中波长最短的光是在哪两个能级之间跃迁时发出的
小试牛刀
同课章节目录
- 第一章 分子动理论
- 1 分子动理论的基本内容
- 2 实验:用油膜法估测油酸分子的大小
- 3 分子运动速率分布规律
- 4 分子动能和分子势能
- 第二章 气体、固体和液体
- 1 温度和温标
- 2 气体的等温变化
- 3 气体的等压变化和等容变化
- 4 固体
- 5 液体
- 第三章 热力学定律
- 1 功、热和内能的改变
- 2 热力学第一定律
- 3 能量守恒定律
- 4 热力学第二定律
- 第四章 原子结构和波粒二象性
- 1 普朗克黑体辐射理论
- 2 光电效应
- 3 原子的核式结构模型
- 4 氢原子光谱和玻尔的原子模型
- 5 粒子的波动性和量子力学的建立
- 第五章 原子核
- 1 原子核的组成
- 2 放射性元素的衰变
- 3 核力与结合能
- 4 核裂变与核聚变
- 5 “基本”粒子
