4.4 化学方程式第二课时课件(共31张PPT)
文档属性
| 名称 | 4.4 化学方程式第二课时课件(共31张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-22 00:00:00 | ||
图片预览











文档简介
(共31张PPT)
4.4 化学方程式(课时2)
第四章 生命之源——水
学习目标
1.理解化学方程式含义。
2.掌握已知一种反应物(或生成物)的质量,求生成物(或反应物)的质量。
3.知道化学方程式计算的书写格式规范化。
新课导入
(1)从化学角度看,发射“神舟十号”需要什么?
(2)为了合理利用资源和准确控制火箭,燃料和助燃剂能随意量填充吗?需要做些什么?
如果火箭用氢气作燃料。而你是火箭发动机设计师,火箭助推上升时,燃烧需要氢气200Kg时,你会在火箭助燃剂仓中填充多少氧气使之完全燃烧?800Kg氧气行吗?为什么?
新课导入
思 考
新课导入
化学方程式的含义
(1)表示化学反应的反应物、生成物和反应条件。
(2)表示化学反应的各物质的质量关系。
(3)表示各反应物、生成物之间的粒子个数之比。
新课导入
化学方程式的含义:以电解水的反应为例
2H2O 2H2↑+O2↑
通电
(1)表示水通电生成氢气和氧气。
(2)表示每36份质量的水完全反应,生成4份质量的氢气和32份质量的氧气。
2×18=36
2×2=4
32
18g
(3)表示水分子、氢分子和氧分子的个数比为2﹕2﹕1。
2g
16g
新课导入
写出氢气在氧气中燃烧的化学方程式,并标出各物质的质量比等于各物质的相对分子(原子)质量与化学计量数的乘积之比。
2H2 + O2 ===== 2 H2O
2×1×2 :16×2 : 2 ×(2+16)
4 : 32 : 36
若 4克 :( )克 : ( )克
点燃
若( )克 :( )克 :18克
32
36
16
2
一、化学方程式计算的理论依据
新课讲解
36 4 32
36g 4 g 32g
各物质之间按一定的质量比发生化学反应,利用化学方程式中各物质之间的质量关系可以进行物质间质量的计算。
新课讲解
二、利用化学方程式计算的方法
利用化学方程式的计算步骤:
(1)设未知量
(2)写出反应的化学方程式
(3)找出相关物质的质量比和已知量、未知量
(4)列出比例式
(5)解比例式
(6)简明地写出答语
一设、二写、三找、四列、五解、六答
新课讲解
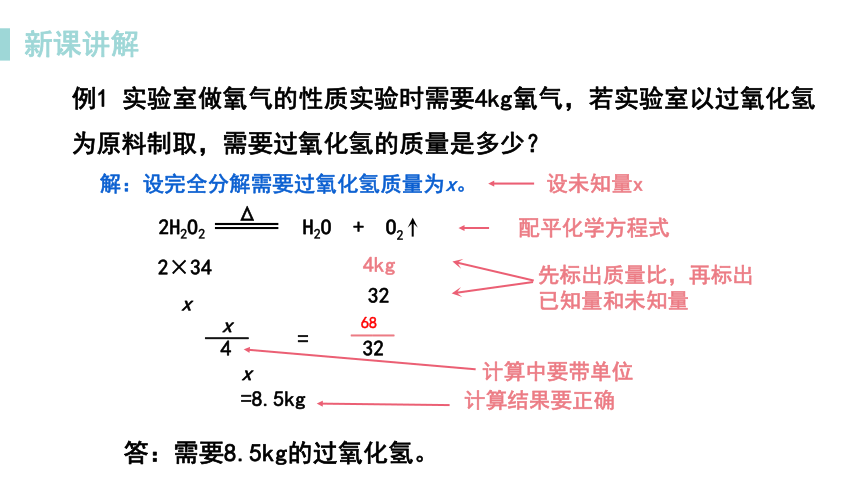
2H2O2 H2O + O2
解:设完全分解需要过氧化氢质量为x。
x
4kg
答:需要8.5kg的过氧化氢。
x
=8.5kg
2×34
32
x
——
4
=
——
32
设未知量x
先标出质量比,再标出已知量和未知量
配平化学方程式
计算中要带单位
计算结果要正确
Δ
例1 实验室做氧气的性质实验时需要4kg氧气,若实验室以过氧化氢为原料制取,需要过氧化氢的质量是多少?
68
新课讲解
例2 6克镁粉与8克氧气充分反应后能生成氧化镁多少克?
6克
8克
∵48 × 8克 32×6克
>
∴反应后氧气有剩余
48
32
80
X
48
6克
80
X
=
X=10克
解:设反应后生成氧化镁的质量为X。
∴
答:6克镁粉与8克氧气充分反应能生成氧化镁10克。
2Mg + O2 ==== 2MgO
点燃
点燃
新课讲解
一、设
二、写
三、找
四、列
五、解
六、答
利用化学方程式的计算的注意事项
1.设未知量为X,不带单位
2.化学方程式一定要配平
3.相对分子质量计算要准确,乘以化学计量数,写在
对应的化学式下
4.已知量带单位,未知量不带单位
5.注意是否能约分,保留位数
新课讲解
化学方程式计算的四种类型
已知反应物的质量求生成物的质量;
01
02
已知生成物的质量求反应物的质量;
03
已知一种反应物的质量求另一种反应物的质量;
04
已知一种生成物的质量求另一种生成物的质量。
新课讲解
化学方程式计算的三个要领和三个关键
三个要领
1.步骤要完整;
2.格式要规范;
3.得数要准确。
三个关键
1.准确书写化学式;
2.化学方程式要配平;
3.准确计算相对分子质量。
新课讲解
典例分析
例
下列两份质量相等的碳,一份与足量氧气完全反应生成二氧化碳,另一份与氧气反应全部生成一氧化碳,则前者与后者消耗氧气的质量比为( )
A.3:4 B.3:8
C.2:1 D.1:2
C
新课讲解
解析:碳充分燃烧时,C+O2 === CO2, 12g碳消耗32g氧气;碳不充分燃烧时,2C+O2 ====2CO,12g碳消耗16g氧气;前者与后者消耗氧气的质量之比2:1。
点燃
点燃
课堂小结
根据化学方程式进行计算的步骤
(1)设未知数 ………………设
(2)写出化学方程式并配平 ………写
(3) 标出有关物质的量
(4) 列比例式,求解 ………列
(5) 简明地写出答案 …………答
…标
上标相对分子质量
下标已知质量和未知数
课堂小结
化学反应计算中的几种方法
计算方法 适用范围
(1)利用化学式进行计算
(2)利用化学方程式计算
(3)利用质量守恒定律计算
物质中的某元素完全转化到另一种物质中
已知任何一种物质的质量,可求其他物质的质量
所有反应物和生成物中只有一种未知
D
当堂小练
1. 实验室用氯酸钾加少量二氧化锰共热制取氧气,现称取122.5克氯酸钾和少量二氧化锰放在制氧气的发生装置中加热,理论上能收集到氧气( )
A.96g B.48g
C.24g D.12g
B
D
当堂小练
2.【多选】在密闭容器中氢气和氧气的混合气体共20g,点燃得到水18g,则反应前氢气和氧气的质量比为( )
A.1:4 B.1:2
C.1:9 D.2:1
AC
D
当堂小练
3.在反应2Mg+O2 == 2MgO中镁、氧气、氧化镁的质量比为( )
A.48:32:80 B.24:32:40
C.24:32:64 D.24:32:80
A
点燃
D
当堂小练
4. 在某课外小组为了测定石灰石中碳酸钙的含量,把10g石灰石固体样品进行高温煅烧,完全反应后,冷却、称量,残余固体质量为7.8g(假设杂质不参与反应),计算石灰石样品中碳酸钙的质量分数。
当堂小练
解:二氧化碳的质量为10g-7.8g=2.2g
设参加反应的碳酸钙的质量为X。
CaCO3 CaO + CO2
100 44
X 2.2 g
100:44 = X:2.2g
X=5g
×100%=50%
答:石灰石样品中碳酸钙的质量分数为50%。
5g
10g
1.下列化学方程式书写和配平没有错误或遗漏的是( )。
A.2H2O2 === 2H20 +O2
B.2Al +O3 === Al2O3
C.S+O2↑ === SO2↑
D.2KMnO4 === K2MnO4 + MnO2 +O2↑
教材习题
点燃
△
D
教材习题
2.下列化学方程式书写有错误的是( ) 。
B
教材习题
4.火箭推进器中装有液态肼(N2H4)和过氧化氢(H202),当它们混合反应时,放出大量的热量,有关反应方程式为N2H4 +2H202 === X2+4H20,据此判断X2的化学式是 。
5
4
2
3
2
2
2
3
2
4
N2
5.写出氧化汞受热分解的化学方程式,并指出反应物和生成物各物质之间的质量比,计算氧化汞中氧元素的质量分数。每100g氧化汞受热完全分解后,最多可生成氧气的质量是多少
教材习题
2HgO△ 2Hg+O2↑
m(HgO)∶m(Hg)∶m(O2)=216.6∶200.6∶16
w(O)=氧的相对原子质量氧化汞的相对分子质量×100%=16216.6×100%≈7.39%。
教材习题
设最多可生成O2的质量为x。
2HgO△ 2Hg+O2↑
2×216.616×2
100 gx2×216.616×2=100 gxx=16×2×100 g2×216.6≈7.39 g
答:氧化汞中氧元素的质量分数为7.39%;100 g氧化汞受热完全分解后最多可生成氧气7.39 g。
教材习题
6.用高锰酸钾加热分解法制取氧气,为了在一般条件下能得到0.48 L氧气,求被分解的高锰酸钾的质量是多少 ( 按氧气的密度为1.43g. L-1计算)
解:在一般条件下,0.48 L氧气的质量为1.43g·L-1×0.48 L=0.6864g。
设被分解的高锰酸钾的质量为x。
2KMnO4△ K2MnO4+MnO2+O2↑
316 32
x 0.6864 g
316x0.6864 g=x g32≈6.78 g
答:被分解的KMnO4的质量为6.78 g。
7.某城镇1天要烧煤100t,其中含碳的质量分数为80%。计算该城镇1年烧煤产生的温室气体的量是多少 (1年按360天计)
解:该城市1年烧的煤中含碳的质量为100 t×80%×360=2.88×104 t。因为温室气体是二氧化碳,所以1年烧煤产生的二氧化碳的质量为2.88×104 t1244×100%≈1.06×105 t。
答:该城市一年烧煤产生的温室气体的质量是1.06×105 t。
教材习题
THANKS
4.4 化学方程式(课时2)
第四章 生命之源——水
学习目标
1.理解化学方程式含义。
2.掌握已知一种反应物(或生成物)的质量,求生成物(或反应物)的质量。
3.知道化学方程式计算的书写格式规范化。
新课导入
(1)从化学角度看,发射“神舟十号”需要什么?
(2)为了合理利用资源和准确控制火箭,燃料和助燃剂能随意量填充吗?需要做些什么?
如果火箭用氢气作燃料。而你是火箭发动机设计师,火箭助推上升时,燃烧需要氢气200Kg时,你会在火箭助燃剂仓中填充多少氧气使之完全燃烧?800Kg氧气行吗?为什么?
新课导入
思 考
新课导入
化学方程式的含义
(1)表示化学反应的反应物、生成物和反应条件。
(2)表示化学反应的各物质的质量关系。
(3)表示各反应物、生成物之间的粒子个数之比。
新课导入
化学方程式的含义:以电解水的反应为例
2H2O 2H2↑+O2↑
通电
(1)表示水通电生成氢气和氧气。
(2)表示每36份质量的水完全反应,生成4份质量的氢气和32份质量的氧气。
2×18=36
2×2=4
32
18g
(3)表示水分子、氢分子和氧分子的个数比为2﹕2﹕1。
2g
16g
新课导入
写出氢气在氧气中燃烧的化学方程式,并标出各物质的质量比等于各物质的相对分子(原子)质量与化学计量数的乘积之比。
2H2 + O2 ===== 2 H2O
2×1×2 :16×2 : 2 ×(2+16)
4 : 32 : 36
若 4克 :( )克 : ( )克
点燃
若( )克 :( )克 :18克
32
36
16
2
一、化学方程式计算的理论依据
新课讲解
36 4 32
36g 4 g 32g
各物质之间按一定的质量比发生化学反应,利用化学方程式中各物质之间的质量关系可以进行物质间质量的计算。
新课讲解
二、利用化学方程式计算的方法
利用化学方程式的计算步骤:
(1)设未知量
(2)写出反应的化学方程式
(3)找出相关物质的质量比和已知量、未知量
(4)列出比例式
(5)解比例式
(6)简明地写出答语
一设、二写、三找、四列、五解、六答
新课讲解
2H2O2 H2O + O2
解:设完全分解需要过氧化氢质量为x。
x
4kg
答:需要8.5kg的过氧化氢。
x
=8.5kg
2×34
32
x
——
4
=
——
32
设未知量x
先标出质量比,再标出已知量和未知量
配平化学方程式
计算中要带单位
计算结果要正确
Δ
例1 实验室做氧气的性质实验时需要4kg氧气,若实验室以过氧化氢为原料制取,需要过氧化氢的质量是多少?
68
新课讲解
例2 6克镁粉与8克氧气充分反应后能生成氧化镁多少克?
6克
8克
∵48 × 8克 32×6克
>
∴反应后氧气有剩余
48
32
80
X
48
6克
80
X
=
X=10克
解:设反应后生成氧化镁的质量为X。
∴
答:6克镁粉与8克氧气充分反应能生成氧化镁10克。
2Mg + O2 ==== 2MgO
点燃
点燃
新课讲解
一、设
二、写
三、找
四、列
五、解
六、答
利用化学方程式的计算的注意事项
1.设未知量为X,不带单位
2.化学方程式一定要配平
3.相对分子质量计算要准确,乘以化学计量数,写在
对应的化学式下
4.已知量带单位,未知量不带单位
5.注意是否能约分,保留位数
新课讲解
化学方程式计算的四种类型
已知反应物的质量求生成物的质量;
01
02
已知生成物的质量求反应物的质量;
03
已知一种反应物的质量求另一种反应物的质量;
04
已知一种生成物的质量求另一种生成物的质量。
新课讲解
化学方程式计算的三个要领和三个关键
三个要领
1.步骤要完整;
2.格式要规范;
3.得数要准确。
三个关键
1.准确书写化学式;
2.化学方程式要配平;
3.准确计算相对分子质量。
新课讲解
典例分析
例
下列两份质量相等的碳,一份与足量氧气完全反应生成二氧化碳,另一份与氧气反应全部生成一氧化碳,则前者与后者消耗氧气的质量比为( )
A.3:4 B.3:8
C.2:1 D.1:2
C
新课讲解
解析:碳充分燃烧时,C+O2 === CO2, 12g碳消耗32g氧气;碳不充分燃烧时,2C+O2 ====2CO,12g碳消耗16g氧气;前者与后者消耗氧气的质量之比2:1。
点燃
点燃
课堂小结
根据化学方程式进行计算的步骤
(1)设未知数 ………………设
(2)写出化学方程式并配平 ………写
(3) 标出有关物质的量
(4) 列比例式,求解 ………列
(5) 简明地写出答案 …………答
…标
上标相对分子质量
下标已知质量和未知数
课堂小结
化学反应计算中的几种方法
计算方法 适用范围
(1)利用化学式进行计算
(2)利用化学方程式计算
(3)利用质量守恒定律计算
物质中的某元素完全转化到另一种物质中
已知任何一种物质的质量,可求其他物质的质量
所有反应物和生成物中只有一种未知
D
当堂小练
1. 实验室用氯酸钾加少量二氧化锰共热制取氧气,现称取122.5克氯酸钾和少量二氧化锰放在制氧气的发生装置中加热,理论上能收集到氧气( )
A.96g B.48g
C.24g D.12g
B
D
当堂小练
2.【多选】在密闭容器中氢气和氧气的混合气体共20g,点燃得到水18g,则反应前氢气和氧气的质量比为( )
A.1:4 B.1:2
C.1:9 D.2:1
AC
D
当堂小练
3.在反应2Mg+O2 == 2MgO中镁、氧气、氧化镁的质量比为( )
A.48:32:80 B.24:32:40
C.24:32:64 D.24:32:80
A
点燃
D
当堂小练
4. 在某课外小组为了测定石灰石中碳酸钙的含量,把10g石灰石固体样品进行高温煅烧,完全反应后,冷却、称量,残余固体质量为7.8g(假设杂质不参与反应),计算石灰石样品中碳酸钙的质量分数。
当堂小练
解:二氧化碳的质量为10g-7.8g=2.2g
设参加反应的碳酸钙的质量为X。
CaCO3 CaO + CO2
100 44
X 2.2 g
100:44 = X:2.2g
X=5g
×100%=50%
答:石灰石样品中碳酸钙的质量分数为50%。
5g
10g
1.下列化学方程式书写和配平没有错误或遗漏的是( )。
A.2H2O2 === 2H20 +O2
B.2Al +O3 === Al2O3
C.S+O2↑ === SO2↑
D.2KMnO4 === K2MnO4 + MnO2 +O2↑
教材习题
点燃
△
D
教材习题
2.下列化学方程式书写有错误的是( ) 。
B
教材习题
4.火箭推进器中装有液态肼(N2H4)和过氧化氢(H202),当它们混合反应时,放出大量的热量,有关反应方程式为N2H4 +2H202 === X2+4H20,据此判断X2的化学式是 。
5
4
2
3
2
2
2
3
2
4
N2
5.写出氧化汞受热分解的化学方程式,并指出反应物和生成物各物质之间的质量比,计算氧化汞中氧元素的质量分数。每100g氧化汞受热完全分解后,最多可生成氧气的质量是多少
教材习题
2HgO△ 2Hg+O2↑
m(HgO)∶m(Hg)∶m(O2)=216.6∶200.6∶16
w(O)=氧的相对原子质量氧化汞的相对分子质量×100%=16216.6×100%≈7.39%。
教材习题
设最多可生成O2的质量为x。
2HgO△ 2Hg+O2↑
2×216.616×2
100 gx2×216.616×2=100 gxx=16×2×100 g2×216.6≈7.39 g
答:氧化汞中氧元素的质量分数为7.39%;100 g氧化汞受热完全分解后最多可生成氧气7.39 g。
教材习题
6.用高锰酸钾加热分解法制取氧气,为了在一般条件下能得到0.48 L氧气,求被分解的高锰酸钾的质量是多少 ( 按氧气的密度为1.43g. L-1计算)
解:在一般条件下,0.48 L氧气的质量为1.43g·L-1×0.48 L=0.6864g。
设被分解的高锰酸钾的质量为x。
2KMnO4△ K2MnO4+MnO2+O2↑
316 32
x 0.6864 g
316x0.6864 g=x g32≈6.78 g
答:被分解的KMnO4的质量为6.78 g。
7.某城镇1天要烧煤100t,其中含碳的质量分数为80%。计算该城镇1年烧煤产生的温室气体的量是多少 (1年按360天计)
解:该城市1年烧的煤中含碳的质量为100 t×80%×360=2.88×104 t。因为温室气体是二氧化碳,所以1年烧煤产生的二氧化碳的质量为2.88×104 t1244×100%≈1.06×105 t。
答:该城市一年烧煤产生的温室气体的质量是1.06×105 t。
教材习题
THANKS
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
