3.2 制取氧气第一课时课件(共19张PPT)
文档属性
| 名称 | 3.2 制取氧气第一课时课件(共19张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-22 16:43:37 | ||
图片预览






文档简介
(共19张PPT)
3.2 制取氧气(课时1)
第三章 维持生命之气—氧气
学习目标
1.能说出催化剂的定义,认识催化剂的重要作用。
2.了解实验室用过氧化氢、高锰酸钾制取氧气的反应原理。
3.初步学习实验室用高锰酸钾制取氧气的方法,初步学习检查装置气密性的方法。
4.认识分解反应定义及其与化合反应的区别,能识别判断具体的分解反应与化合反应。
新课导入
鱼池缺氧,造成大量鱼死亡。渔民损失10万余元。
新课导入
【主要成分】过氧化氢
【含量规格】15%
【作用与用途】
本品在分解过程中释放出活泼的新生态氧,用于养殖池塘的增氧,药性温和,使用方便,无残留,绿色环保。
新课导入
氧气是我们日常生活中不可缺少的物质,它具有广泛的用途,急救病人、电氧焊、炼钢等都需要较为纯净的氧气,如何制取氧气?这节课我们就来学习氧气的制取。
【用法与用量】
用法:将本品以1000倍水稀释后直接泼洒于养殖池塘中。
用量:每亩水深1米用本品100~150ml,病情严重可加量使用。
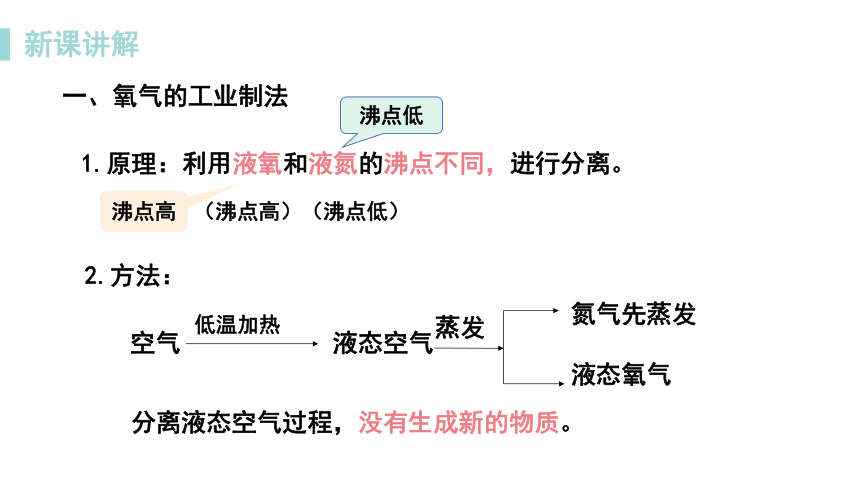
一、氧气的工业制法
新课讲解
(沸点高)(沸点低)
2.方法:
1.原理:利用液氧和液氮的沸点不同,进行分离。
分离液态空气过程,没有生成新的物质。
低温加热
空气 液态空气
氮气先蒸发
液态氧气
蒸发
沸点高
沸点低
二、实验室制氧气
新课讲解
实验1:用约10%的过氧化氢溶液和二氧化锰做下列实验:
(1)用量筒量取4mL过氧化氢溶液加入试管中,将带火星的木条伸入试管的上部,结果怎样?
带火星的木条不能复燃因为过氧化氢溶液在常温下分解缓慢,放出的氧气少。
新课讲解
(2)另取少量二氧化锰装入试管中,又将带火星的木条伸入试管内,结果怎样?
实验现象:带火星的木条不能复燃
新课讲解
(3)再量取4mL过氧化氢溶液加入另一支试管,用药匙加入少量二氧化锰,将带火星的木条伸进试管口,有什么现象发生?
实验现象:带火星的木条复燃,说明在常温下过氧化氢溶液遇到二氧化锰时会产生氧气。
新课讲解
实验2:待实验(3)的试管内的液体不再放出气泡时,重新加入4mL过氧化氢溶液,再用带火星的木条伸进试管口,又有什么现象发生?
实验现象:带火星的木条复燃,说明在常温下过氧化氢溶液遇到二氧化锰时会产生氧气。
新课讲解
以上实验事实表明:
在有二氧化锰存在的条件下,过氧化氢能更快地分解产生氧气。
新课讲解
总 结
过氧化氢在二氧化锰催化下产生氧气,这个变化的文字表达式是:
过氧化氢
水+氧气
二氧化锰
(H2O2)
(O2)
化学上把这种在化学反应里能改变其他物质的反应速率,而本身的质量和化学性质在化学反应前后没有发生变化的物质叫做催化剂。催化剂所起的作用称为催化作用。
新课讲解
知识窗口
催化剂在生产生活中的作用
石油炼制
化肥生产
制取药品
煤的利用
食品酿造
新课讲解
归 纳
汽车尾气安装催化转化器,能够把有毒的汽车尾气转化成无毒的气体。
课堂小结
1.实验室用过氧化氢制取氧气的反应原理;
2.催化剂的概念及其催化作用的理解。
过氧化氢
水+氧气
二氧化锰
(H2O2)
(O2)
催化剂:在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质。
催化作用:催化剂在化学反应中所起的作用。
1.过氧化氢溶液俗称双氧水。向一定浓度的过氧化氢溶液中加一些二氧化锰,立即产生氧气,下列说法正确的是( )
A.过氧化氢中含有水和氧气
B.过氧化氢使二氧化锰分解产生氧气
C.反应物有过氧化氢和二氧化锰,不属于分解反应
D.二氧化锰促进过氧化氢分解出氧气和水
D
当堂小练
D
D
当堂小练
2.双氧水制取氧气时,忘记加二氧化锰,其结果是( )
A.不放出氧气
B.放出氧气速率慢
C.放出氧气总量会减少
D.放出氧气总量更多
B
3.催化剂在化学反应前后:①质量变少;②质量不变;③化学性质改变;④化学性质不变;⑤二氧化锰可以作为各种化学反应的催化剂:在上述说法中正确的是( )
A.①和③ B.②和④
C.④和⑤ D.②和③
D
当堂小练
B
THANKS
3.2 制取氧气(课时1)
第三章 维持生命之气—氧气
学习目标
1.能说出催化剂的定义,认识催化剂的重要作用。
2.了解实验室用过氧化氢、高锰酸钾制取氧气的反应原理。
3.初步学习实验室用高锰酸钾制取氧气的方法,初步学习检查装置气密性的方法。
4.认识分解反应定义及其与化合反应的区别,能识别判断具体的分解反应与化合反应。
新课导入
鱼池缺氧,造成大量鱼死亡。渔民损失10万余元。
新课导入
【主要成分】过氧化氢
【含量规格】15%
【作用与用途】
本品在分解过程中释放出活泼的新生态氧,用于养殖池塘的增氧,药性温和,使用方便,无残留,绿色环保。
新课导入
氧气是我们日常生活中不可缺少的物质,它具有广泛的用途,急救病人、电氧焊、炼钢等都需要较为纯净的氧气,如何制取氧气?这节课我们就来学习氧气的制取。
【用法与用量】
用法:将本品以1000倍水稀释后直接泼洒于养殖池塘中。
用量:每亩水深1米用本品100~150ml,病情严重可加量使用。
一、氧气的工业制法
新课讲解
(沸点高)(沸点低)
2.方法:
1.原理:利用液氧和液氮的沸点不同,进行分离。
分离液态空气过程,没有生成新的物质。
低温加热
空气 液态空气
氮气先蒸发
液态氧气
蒸发
沸点高
沸点低
二、实验室制氧气
新课讲解
实验1:用约10%的过氧化氢溶液和二氧化锰做下列实验:
(1)用量筒量取4mL过氧化氢溶液加入试管中,将带火星的木条伸入试管的上部,结果怎样?
带火星的木条不能复燃因为过氧化氢溶液在常温下分解缓慢,放出的氧气少。
新课讲解
(2)另取少量二氧化锰装入试管中,又将带火星的木条伸入试管内,结果怎样?
实验现象:带火星的木条不能复燃
新课讲解
(3)再量取4mL过氧化氢溶液加入另一支试管,用药匙加入少量二氧化锰,将带火星的木条伸进试管口,有什么现象发生?
实验现象:带火星的木条复燃,说明在常温下过氧化氢溶液遇到二氧化锰时会产生氧气。
新课讲解
实验2:待实验(3)的试管内的液体不再放出气泡时,重新加入4mL过氧化氢溶液,再用带火星的木条伸进试管口,又有什么现象发生?
实验现象:带火星的木条复燃,说明在常温下过氧化氢溶液遇到二氧化锰时会产生氧气。
新课讲解
以上实验事实表明:
在有二氧化锰存在的条件下,过氧化氢能更快地分解产生氧气。
新课讲解
总 结
过氧化氢在二氧化锰催化下产生氧气,这个变化的文字表达式是:
过氧化氢
水+氧气
二氧化锰
(H2O2)
(O2)
化学上把这种在化学反应里能改变其他物质的反应速率,而本身的质量和化学性质在化学反应前后没有发生变化的物质叫做催化剂。催化剂所起的作用称为催化作用。
新课讲解
知识窗口
催化剂在生产生活中的作用
石油炼制
化肥生产
制取药品
煤的利用
食品酿造
新课讲解
归 纳
汽车尾气安装催化转化器,能够把有毒的汽车尾气转化成无毒的气体。
课堂小结
1.实验室用过氧化氢制取氧气的反应原理;
2.催化剂的概念及其催化作用的理解。
过氧化氢
水+氧气
二氧化锰
(H2O2)
(O2)
催化剂:在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质。
催化作用:催化剂在化学反应中所起的作用。
1.过氧化氢溶液俗称双氧水。向一定浓度的过氧化氢溶液中加一些二氧化锰,立即产生氧气,下列说法正确的是( )
A.过氧化氢中含有水和氧气
B.过氧化氢使二氧化锰分解产生氧气
C.反应物有过氧化氢和二氧化锰,不属于分解反应
D.二氧化锰促进过氧化氢分解出氧气和水
D
当堂小练
D
D
当堂小练
2.双氧水制取氧气时,忘记加二氧化锰,其结果是( )
A.不放出氧气
B.放出氧气速率慢
C.放出氧气总量会减少
D.放出氧气总量更多
B
3.催化剂在化学反应前后:①质量变少;②质量不变;③化学性质改变;④化学性质不变;⑤二氧化锰可以作为各种化学反应的催化剂:在上述说法中正确的是( )
A.①和③ B.②和④
C.④和⑤ D.②和③
D
当堂小练
B
THANKS
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
