第一章第三节氧化还原反应同步练习(含解析) (2022-2023学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 第一章第三节氧化还原反应同步练习(含解析) (2022-2023学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 491.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-22 15:49:41 | ||
图片预览



文档简介
第一章第三节氧化还原反应同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在下列反应中,硝酸既表现出氧化性,又表现出酸性的是
A.2HNO3+H2S=S↓+2NO2↑+2H2O
B.2HNO3+CuO=Cu(NO3)2+H2O
C.4HNO34NO2↑+O2↑+2H2O
D.8HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O
2.下列氧化还原反应中,电子转移的方向和数目均正确的是
A. B.
C. D.
3.工业上制取ClO2的化学反应:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。下列说法正确的是
A.SO2在反应中被氧化
B.NaClO3在反应中失去电子
C.H2SO4在反应中作氧化剂
D.每生成1个ClO2,转移2个电子
4.氢化钠(NaH)可在野外用作生氢剂,其中氢元素为-1价。NaH用作生氢剂时的化学反应原理为:NaH+H2O=NaOH+H2↑。下列有关该反应的说法中,正确的是
A.该反应属于置换反应 B.该反应属于复分解反应
C.NaH是氧化剂 D.H2O中的氢元素被还原
5.海水是一个巨大的化学资源宝库。下列有关海水综合利用的说法正确的是
A.从海水中可以获得,电解溶液可制备金属钠
B.从海水中提取溴的过程中利用了氧化还原反应原理
C.海水中含有镁元素,只需经过物理变化就可以得到镁单质
D.目前工业上可直接从海水中提取
6.碘在地壳中主要以的形式存在,在海水中主要以的形式存在,几种粒子之间的转化关系如图所示(淀粉遇碘单质变蓝)。
下列说法中不正确的是
A.用淀粉试纸和食醋检验加碘盐时淀粉试纸会变蓝
B.足量能使湿润的、已变蓝的淀粉试纸褪色的原因可能是:
C.由图可知氧化性的强弱顺序为
D.途径II中若生成1,则反应中转移的电子数为10
7.下列叙述中正确的是
序号 氧化剂 还原剂 其他反 应物 氧化 产物 还原产 物
① Cl2 FeBr2 FeCl3
② KMnO4 H2O2 H2SO4 O2 MnSO4
③ KC1O3 HCl(浓) Cl2 Cl2
④ KMnO4 HCl(浓) Cl2 MnCl2
A.①中反应的氧化产物一定只有FeCl3
B.氧化性:KMnO4>Cl2>Fe3+>Br2>Fe2+
C.还原性:H2O2>Mn2+>Cl-
D.④中的HCl(浓)既做还原剂,又起到酸的作用
8.已知反应:
①2BrO+Cl2=Br2+2ClO;
②5Cl2+I2+6H2O=2HIO3+10HCl;
③ClO+5Cl-+6H+=3Cl2↑+3H2O。
下列微粒氧化性强弱顺序正确的是
A.ClO>BrO>HIO3>Cl2 B.BrO>Cl2>ClO>HIO3
C.BrO>ClO>Cl2>HIO3 D.Cl2>BrO>ClO>HIO3
9.具有还原性,加碘食盐中的碘元素主要以的形式存在,、、在一定条件下可发生如图转化关系。下列说法不正确的是
A.生成等质量的碘,途径I和途径II转移电子数目之比为2∶5
B.由图可知氧化性的强弱顺序为
C.用淀粉-KI试纸和食醋可检验食盐是否加碘(遇淀粉呈蓝色)
D.途径Ⅲ反应的离子方程式:
10.化学实验中若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。在如图所示有编号的反应中,属于氧化还原反应的有
A.3个 B.4个 C.5个 D.6个
11.下列化学反应中,属于氧化还原反应的是
A.Na2CO3+CaCl2=CaCO3↓+2NaCl
B.Fe+CuSO4=Cu+FeSO4
C.2NaHCO3Na2CO3+CO2↑+H2O
D.CaO+H2O=Ca(OH)2
12.我国是世界上第一个在海域成功试采可燃冰的国家,可燃冰主要含有甲烷水合物,用作燃料时反应的微观示意图如图,下列说法正确的是
A.可燃冰中只有甲烷
B.化学变化中原子数目变化
C.反应的化学方程为CH4+O2 CO2+H2O
D.反应前后的物质均由分子构成
13.高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平):。下列说法正确的是
A.是氧化剂,是还原产物 B.的还原性强于
C.生成物水的化学计量数是16 D.生成4个水分子时,转移10个电子
14.CO2可以支持镁燃烧,发生以下反应:2Mg+CO22MgO+C。下列关于该反应的判断中正确的是
A.Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B.由此反应可以判断氧化性:CO2>MgO,还原性:Mg>C
C.CO2作氧化剂,表现氧化性,发生氧化反应
D.Mg原子失去的电子数目等于氧原子得到的电子数目
15.某同学在做实验时不小心引发了镁失火,他立即拿起灭火器欲把火扑灭,被老师及时制止。原因是可以支持镁燃烧,反应为。下列对该反应的判断中错误的是
A.元素化合价升高被还原
B.由此反应可以得出还原性:
C.为氧化剂,表现氧化性,发生还原反应
D.失去的电子数目等于得到的电子数目
二、实验题
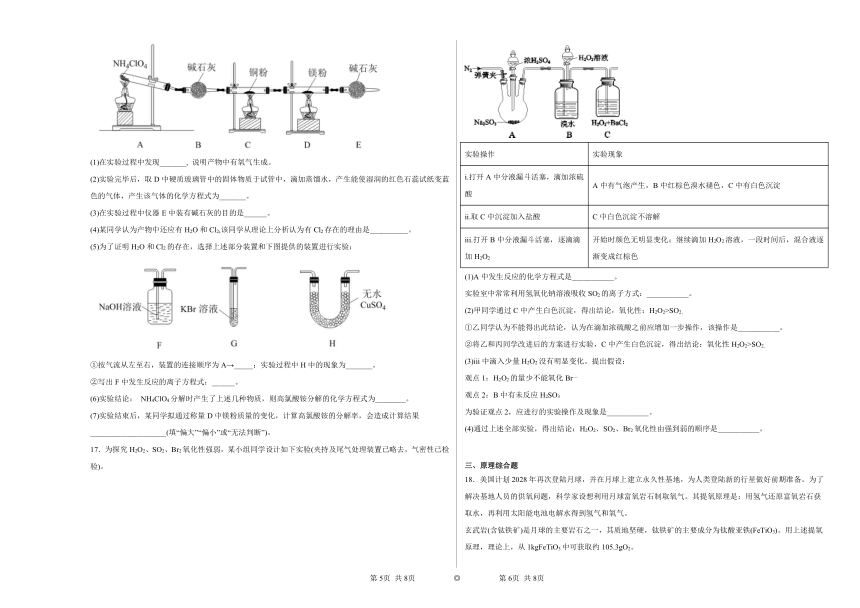
16.高氯酸铵(NH4ClO4)为白色晶体,具有不稳定性,在400°C时开始分解产生多种气体,常用于生产火箭推进剂。某化学兴趣小组同学利用如图所示装置对NH4ClO4的分解产物进行探究。(假设装置内药品均足量,部分夹持装置已省略。)
(1)在实验过程中发现_______, 说明产物中有氧气生成。
(2)实验完毕后,取D中硬质玻璃管中的固体物质于试管中,滴加蒸馏水,产生能使湿润的红色石蕊试纸变蓝色的气体,产生该气体的化学方程式为_______。
(3)在实验过程中仪器E中装有碱石灰的目的是______。
(4)某同学认为产物中还应有H2O和Cl2,该同学从理论上分析认为有Cl2存在的理由是__________。
(5)为了证明H2O和Cl2的存在,选择上述部分装置和下图提供的装置进行实验:
①按气流从左至右,装置的连接顺序为A→_____;实验过程中H中的现象为_______。
②写出F中发生反应的离子方程式:______。
(6)实验结论: NH4ClO4分解时产生了上述几种物质,则高氯酸铵分解的化学方程式为________。
(7)实验结束后,某同学拟通过称量D中镁粉质量的变化,计算高氯酸铵的分解率,会造成计算结果____________________(填“偏大”“偏小”或“无法判断”)。
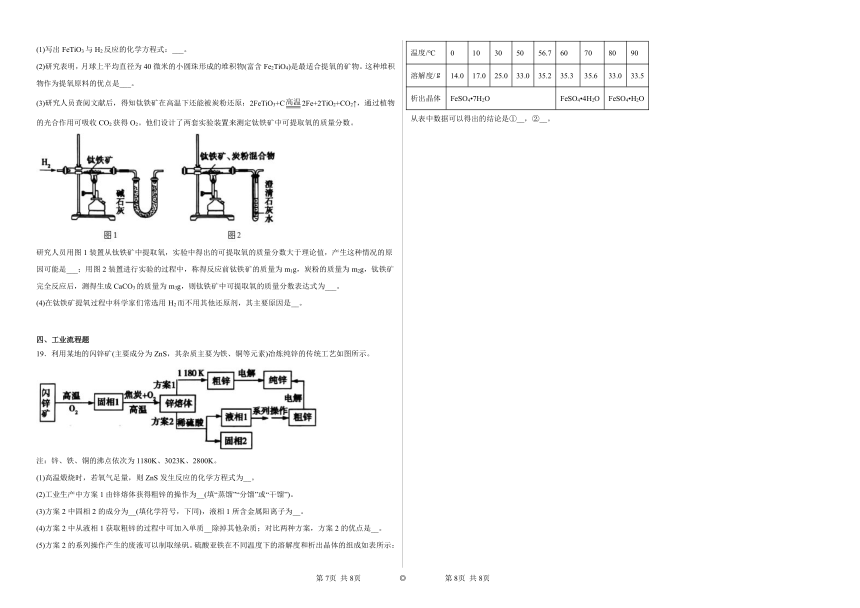
17.为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
实验操作 实验现象
i.打开A中分液漏斗活塞,滴加浓硫酸 A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀
ii.取C中沉淀加入盐酸 C中白色沉淀不溶解
iii.打开B中分液漏斗活塞,逐滴滴加H2O2 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色
(1)A中发生反应的化学方程式是___________。
实验室中常常利用氢氧化钠溶液吸收SO2的离子方式:___________。
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。
①乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是___________。
②将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性H2O2>SO2。
(3)iii中滴入少量H2O2没有明显变化。提出假设:
观点1:H2O2的量少不能氧化Br—
观点2:B中有未反应H2SO3
为验证观点2,应进行的实验操作及现象是___________。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是___________。
三、原理综合题
18.美国计划2028年再次登陆月球,并在月球上建立永久性基地,为人类登陆新的行星做好前期准备。为了解决基地人员的供氧问题,科学家设想利用月球富氧岩石制取氧气。其提氧原理是:用氢气还原富氧岩石获取水,再利用太阳能电池电解水得到氢气和氧气。
玄武岩(含钛铁矿)是月球的主要岩石之一,其质地坚硬,钛铁矿的主要成分为钛酸亚铁(FeTiO3)。用上述提氧原理,理论上,从1kgFeTiO3中可获取约105.3gO2。
(1)写出FeTiO3与H2反应的化学方程式:___。
(2)研究表明,月球上平均直径为40微米的小圆珠形成的堆积物(富含Fe2TiO4)是最适合提氧的矿物。这种堆积物作为提氧原料的优点是___。
(3)研究人员查阅文献后,得知钛铁矿在高温下还能被炭粉还原:2FeTiO3+C2Fe+2TiO2+CO2↑,通过植物的光合作用可吸收CO2获得O2。他们设计了两套实验装置来测定钛铁矿中可提取氧的质量分数。
研究人员用图1装置从钛铁矿中提取氧,实验中得出的可提取氧的质量分数大于理论值,产生这种情况的原因可能是___;用图2装置进行实验的过程中,称得反应前钛铁矿的质量为m1g,炭粉的质量为m2g,钛铁矿完全反应后,测得生成CaCO3的质量为m3g,则钛铁矿中可提取氧的质量分数表达式为___。
(4)在钛铁矿提氧过程中科学家们常选用H2而不用其他还原剂,其主要原因是__。
四、工业流程题
19.利用某地的闪锌矿(主要成分为ZnS,其杂质主要为铁、铜等元素)冶炼纯锌的传统工艺如图所示。
注:锌、铁、铜的沸点依次为1180K、3023K、2800K。
(1)高温煅烧时,若氧气足量,则ZnS发生反应的化学方程式为__。
(2)工业生产中方案1由锌熔体获得粗锌的操作为__(填“蒸馏”“分馏”或“干馏”)。
(3)方案2中固相2的成分为__(填化学符号,下同),液相1所含金属阳离子为__。
(4)方案2中从液相1获取粗锌的过程中可加入单质__除掉其他杂质;对比两种方案,方案2的优点是__。
(5)方案2的系列操作产生的废液可以制取绿矾。硫酸亚铁在不同温度下的溶解度和析出晶体的组成如表所示:
温度/℃ 0 10 30 50 56.7 60 70 80 90
溶解度/ 14.0 17.0 25.0 33.0 35.2 35.3 35.6 33.0 33.5
析出晶体 FeSO4 7H2O FeSO4 4H2O FeSO4 H2O
从表中数据可以得出的结论是①__,②__。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【详解】A.反应中HNO3中的N元素的化合价全部降低,被还原,故只表现出氧化性,选项A不合题意;
B.反应中HNO3中的N元素的化合价全部不变,只表现出酸性,选项B不合题意;
C.反应中HNO3中的N元素的化合价全部降低被还原,但O元素的化合价升高被氧化,故既表现出氧化性,又表现出还原性,选项C不合题意;
D.反应中HNO3中的N元素的化合价部分降低,被还原,还有一部分不变,表现酸性,故既表现出氧化性,又表现出酸性,选项D符合题意;
答案选D。
2.B
【详解】A.该反应中Cl化合价从+5价降低为-1价,共得到个电子,同理O共失去个电子,A错误;
B.该反应中Mg化合价从0价升高为+2价,共失去个电子,同理O共得到个电子,B正确;
C.该反应中Cu化合价从+2价降低为0价,共得到个电子,C化合价从0价升高到+4价,共失去4个电子,C错误;
D.该反应中O化合价从0价降低到-2价,共得到个电子,D错误;
故答案选B。
3.A
【详解】A.反应时,SO2中S元素的化合价升高,失电子发生氧化反应,故A正确;
B.NaClO3中Cl元素的化合价降低,得电子发生还原反应,故B错误;
C.H2SO4在反应中各元素化合价均未发生改变,既不是氧化剂,也不是还原剂,故C错误;
D.2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4反应中Cl从+5价降低为+4价,生成1个ClO2,转移1个电子,故D错误;
选A。
4.D
【分析】NaH中H元素显-1价,H2O中H元素显+1价,H2中H元素的化合价为0,根据氧化还原反应的归中规律分析。
【详解】A.置换反应是单质+化合物→单质+化合物,根据该反应的特点,该反应不属于置换反应,故A错误;
B.该反应不属复分解反应,属于氧化还原反应,故B错误;
C.NaH中H元素显-1价,在反应中转化成0价,化合价升高被氧化,NaH为还原剂,故C错误;
D.H2O中部分H元素由+1价→0价,化合价降低被还原,H2O中部分H被还原,故D正确;
故选D。
5.B
【详解】A.海水晒盐得到NaCl,Na为活泼金属,则电解熔融NaCl可制备Na同时产生氯气,A错误;
B.从海水中提取溴的过程中溴离子发生氧化反应生成溴单质,利用了氧化还原反应原理,B正确;
C.海水中镁以离子形成存在,经过化学反应可以获得氯化镁,然后电解熔融氯化镁可冶炼Mg,一定发生化学变化,C错误;
D.虽然海水中碘的总含量很大,但是海水中碘的浓度很低,不能直接由海水提取碘,D错误;
故选B。
6.C
【详解】A.加碘盐中含有KIO3,+5I +6H+=3I2+3H2O,I2使淀粉变蓝,所以用KI 淀粉试纸和食醋可以检验加碘盐中是否含有碘,故A正确;
B.根据图示转化Ⅲ可知氧化性Cl2>,已变蓝的淀粉 KI试纸褪色的原因可能是氯气将碘氧化为HIO3,反应方程式为5Cl2+I2+6H2O=2HIO3+10HCl,故B正确;
C.由途径I可知氧化性Cl2>I2,由途径Ⅱ可知氧化性I2NaIO3,故氧化性的强弱顺序为Cl2>>I2,故C错误;
D.根据转化关系2~I2~10e 可知,生成1molI2反应中转移的电子数为10NA,故D正确。
故选C。
7.D
【详解】A.氯气和溴化亚铁反应时先氧化亚铁离子后氧化溴离子,所以表中第①组反应的氧化产物中一定有FeCl3,还有溴水生成的可能,A错误;
B.根据①可知,氧化性Cl2>Fe3+,根据②可知,氧化性KMnO4>O2,根据③可知,氧化性KClO3>Cl2,根据④可知,氧化性KMnO4>Cl2,根据以上分析无法判断Br2、Fe2+氧化性相对大小,B错误;
C.根据②可知,还原性H2O2>Mn2+,根据③可知,还原性Mn2+D.④中Cl元素化合价由-1价变为0价,生成Cl2说明HCl(浓)做还原剂,生成MnCl2说明HCl(浓)的酸性,D正确;
故选D。
8.C
【分析】根据氧化还原反应的规律可知,有元素化合价降低的物质参与反应作氧化剂;有元素化合价升高的物质得到的对应产物为氧化产物,根据氧化剂的氧化性大于氧化产物的氧化性判断即可。
【详解】①中BrO是氧化剂,ClO是氧化产物,所以氧化性BrO>ClO;
②中Cl2是氧化剂,HIO3是氧化产物,所以氧化性Cl2>HIO3;
③中ClO是氧化剂,是Cl2氧化产物,所以氧化性ClO>Cl2,
则氧化能力强弱顺序为BrO>ClO>Cl2>HIO3,故C正确。
故选C。
9.A
【详解】A.途径Ⅱ转化关系2~I2~10e-,途径Ⅰ中2I-~I2~2e-,生产等量的碘,途径Ⅰ和途径Ⅱ转移电子数目之比为1:5,故A错误;
B.由途径I可知氧化性Cl2>I2,由途径Ⅱ可知氧化性I2<NaIO3,由途径Ⅲ可知氧化性Cl2>NaIO3,故氧化性的强弱顺序为Cl2>>I2,故B正确;
C.I-和酸性条件下可发生氧化还原反应生成I2,则可用淀粉-KI试纸和食醋检验加碘盐中是否含有碘,故C正确;
D.径Ⅲ反应是通入足量氯气,碘离子被氧化为碘酸根离子,反应的离子方程式:3Cl2+I-+3H2O═6Cl-++6H+,故D正确;
故选:A。
10.A
【详解】由转化流程图可知,反应①中Cr的化合价降低了,是氧化还原反应,反应②中元素的化合价未改变,是非氧化还原反应,反应③元素的化合价未改变,是非氧化还原反应,反应④Cr的化合价升高了,是氧化还原反应,反应⑥中Cr元素的化合价降低了,是氧化还原反应,反应⑤元素的化合价未改变,是非氧化还原反应,综上所述,有①④⑥三个反应属于氧化还原反应,故答案为:A。
11.B
【详解】A.该反应属于复分解反应,没有元素的化合价变化,不属于氧化还原反应,故A不选;
B.反应前Fe、Cu元素的化合价分别为:0、+2,反应后Fe、Cu元素的化合价分别为:+2、0,有元素的化合价变化,属于氧化还原反应,故B选;
C.该反应属于分解反应,没有元素的化合价变化,不属于氧化还原反应,故C不选;
D.没有元素的化合价变化,不属于氧化还原反应,故D不选;
故选:B。
12.D
【详解】A.可燃冰主要含甲烷水合物,为混合物,故不符合题意;
B.由反应的方程式可知:化学变化中原子数目没有变化,故不符合题意;
C.反应的方程式是:CH4+2O2 CO2+2H2O。故不符合题意;
D.反应前后的物质均由分子构成,故符合题意。
故答案为:D。
13.B
【详解】A.被氧化生成,为氧化产物,A错误;
B.Fe2+在该反应中是还原剂,为还原产物,B正确;
C.配平该反应的化学方程式为,水的化学计量数是8,C错误;
D.根据配平方程式可知,生成4个水分子时,转移5个电子,D错误;
故答案选B。
14.B
【详解】A.镁化合价由0价升高到MgO的+2价,所以镁为还原剂,被氧化,MgO为氧化产物,故A错误;
B.还原剂的还原性大于还原产物,所以还原性Mg>C,氧化剂的氧化性大于氧化产物,则氧化性CO2>MgO,故B正确;
C.CO2作氧化剂,表现氧化性,发生还原反应,故C错误;
D.根据得失电子守恒,Mg原子失去的电子数目等于C原子得到的电子数目,故D错误;
故选B。
15.A
【详解】A.反应中元素化合价升高,镁作还原剂,被氧化,A错误;
B.该反应中为还原剂,C为还原产物,还原剂的还原性大于还原产物的还原性,则还原性:,B正确;
C.中C元素化合价降低,作氧化剂,具有氧化性,被还原,发生还原反应,C正确;
D.氧化还原反应中得、失电子数相等,即失去的电子数目等于得到的电子数目,D正确;
答案选A。
16.(1)铜粉由红色变为黑色
(2)Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
(3)吸收空气中的二氧化碳和水蒸气
(4)根据氧化还原反应规律,还应存在还原产物,从而判断出氯元素的化合价降低,可能生成氯气
(5) H→G→F 从白色变蓝色
(6)2NH4C1O4=N2↑+4H2O+Cl2↑+2O2↑
(7)偏大
【分析】NH4C1O4受热分解产生的气体,经碱石灰干燥除氯气后,用铜粉检验氧气的存在,用镁粉检验氮气的存在。
(1)
NH4C1O4受热分解产生的气体,经碱石灰干燥后,能使铜粉由红色变为黑色,说明生成了CuO,所以分解产物中含有O2。
(2)
NH4C1O4受热分解产物中有N2生成,N2与镁粉生成Mg3N2,产生的能使湿润的红色石蕊试纸变蓝色的气体为氨气,发生反应为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑。
(3)
空气中的二氧化碳和水蒸气会与镁粉反应,在实验过程中仪器E中的碱石灰可以吸收空气中的二氧化碳和水蒸气。
(4)
根据分析可知,NH4C1O4分解产物中含有O2和N2, O2和N2都是氧化产物,根据氧化还原反应规律,还应存在还原产物,从而判断出氯元素的化合价降低,可能生成氯气。
(5)
①检验水蒸气和氯气,应该先用H中的无水硫酸铜检验水的存在,再用溴化钾检验氯气现象是水溶液变为橙黄色;为了防止多余的氯气污染环境,还需要使用尾气吸收装置,所以按气流从左至右,装置的连接顺序为A→H→G→F;无水硫酸铜粉末遇到水从白色变蓝色。
②F中NaOH溶液吸收多余的Cl2,发生反应的离子方程式:。
(6)
实验结论: NH4ClO4分解时产生了氮气、氧气、氯气和水,高氯酸铵分解的化学方程式为2NH4C1O4=N2↑+4H2O+Cl2↑+2O2↑。
(7)
通过称量D中镁粉质量的变化,计算高氯酸铵的分解率,镁粉与装置中的氧气、氮气反应,造成产物质量增大,会造成计算结果偏大。
17. Na2SO3 + H2SO4 = Na2SO4 + SO2↑ + H2O 2OH- + SO2 = SO+ H2O 打开弹簧夹,通入氮气,排净装置空气,关闭弹簧夹 取少量滴加H2O2溶液前的B中溶液于试管中,加热,将气体通入品红溶液中,品红溶液褪色 H2O2>Br>SO2
【详解】(1) 在A中浓硫酸与Na2SO3发生复分解反应产生SO2气体,该反应的化学方程式是Na2SO3 + H2SO4 = Na2SO4 + SO2↑ + H2O;实验室中常常利用氢氧化钠溶液吸收SO2的离子方式:2OH- + SO2 = SO+ H2O;
(2)①由于在装置中含有空气,空气中的氧气和SO2在溶液中也会发生反应将其氧化,所以乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是打开弹簧夹,通入N2,待排净装置内空气后,关闭弹簧夹;
(3)由于H2SO3不稳定,受热容易分解产生有漂白性的SO2,所以为验证观点2,应进行的实验操作及现象是取少量滴加H2O2溶液前的B中溶液于试管中,加热,将气体通入品红溶液中,品红溶液褪色;
(4)物质在发生氧化还原反应中氧化性强的可以把氧化性弱的制取出来,所以通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是H2O2>Br2>SO2。
18. FeTiO3+H2Fe+TiO2+H2O 无需进行岩石破碎工作、可提取氧的质量分数大 H2未经干燥、U形管中碱石灰吸收了空气中的水分 % H2的氧化产物水无污染,电解水产生的H2能够被循环利用
【详解】(1)根据从中可获得约,结合提氧原理可确定反应的化学方程式为;
(2)因为是40微米的小圆珠,故无需进行岩石破碎工作,而且可提取氧的质量分数大;
(3)测得的可提取氧的质量分数大于理论值,则可能是通入的未经干燥,U形管中的碱石灰吸收了空气中的水蒸气;因为生成的质量为,故经光合作用可获得的质量为,所以钛铁矿中可提取氧的质量分数表达式为;
(4) H2的氧化产物水无污染,电解水产生的H2能够被循环利用。
19. 分馏 C、Cu Zn2+、Fe2+ Zn 节约能量 随温度升高,硫酸亚铁的溶解度先升高后降低 温度超过60℃时,析出晶体中结晶水含量越来越少
【详解】(1)高温煅烧时,若氧气足量,则与氧气反应生成氧化锌和二氧化硫,其化学方程式为;
(2)方案1中,锌熔体为锌和少量铁、铜、碳的混合物,三种金属沸点不同,获得粗锌的操作为分馏;
(3)锌熔体为锌和少量铁、铜、碳的混合物,加入稀硫酸,锌和铁与稀硫酸反应生成硫酸亚铁、硫酸锌和氢气,固相2的成分为、;液相1所含金属阳离子为、;
(4)方案2中液相1为硫酸锌、硫酸亚铁和少量硫酸的混合液,获取粗锌的过程中可加入单质锌除掉其他杂质;对比两种方案,方案2的优点是节约能量(或不需加热);
(5)分析表中数据可以得出的结论是:①随温度升高,硫酸亚铁的溶解度先升高后降低;②温度超过60℃时,析出晶体中结晶水含量越来越少。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在下列反应中,硝酸既表现出氧化性,又表现出酸性的是
A.2HNO3+H2S=S↓+2NO2↑+2H2O
B.2HNO3+CuO=Cu(NO3)2+H2O
C.4HNO34NO2↑+O2↑+2H2O
D.8HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O
2.下列氧化还原反应中,电子转移的方向和数目均正确的是
A. B.
C. D.
3.工业上制取ClO2的化学反应:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。下列说法正确的是
A.SO2在反应中被氧化
B.NaClO3在反应中失去电子
C.H2SO4在反应中作氧化剂
D.每生成1个ClO2,转移2个电子
4.氢化钠(NaH)可在野外用作生氢剂,其中氢元素为-1价。NaH用作生氢剂时的化学反应原理为:NaH+H2O=NaOH+H2↑。下列有关该反应的说法中,正确的是
A.该反应属于置换反应 B.该反应属于复分解反应
C.NaH是氧化剂 D.H2O中的氢元素被还原
5.海水是一个巨大的化学资源宝库。下列有关海水综合利用的说法正确的是
A.从海水中可以获得,电解溶液可制备金属钠
B.从海水中提取溴的过程中利用了氧化还原反应原理
C.海水中含有镁元素,只需经过物理变化就可以得到镁单质
D.目前工业上可直接从海水中提取
6.碘在地壳中主要以的形式存在,在海水中主要以的形式存在,几种粒子之间的转化关系如图所示(淀粉遇碘单质变蓝)。
下列说法中不正确的是
A.用淀粉试纸和食醋检验加碘盐时淀粉试纸会变蓝
B.足量能使湿润的、已变蓝的淀粉试纸褪色的原因可能是:
C.由图可知氧化性的强弱顺序为
D.途径II中若生成1,则反应中转移的电子数为10
7.下列叙述中正确的是
序号 氧化剂 还原剂 其他反 应物 氧化 产物 还原产 物
① Cl2 FeBr2 FeCl3
② KMnO4 H2O2 H2SO4 O2 MnSO4
③ KC1O3 HCl(浓) Cl2 Cl2
④ KMnO4 HCl(浓) Cl2 MnCl2
A.①中反应的氧化产物一定只有FeCl3
B.氧化性:KMnO4>Cl2>Fe3+>Br2>Fe2+
C.还原性:H2O2>Mn2+>Cl-
D.④中的HCl(浓)既做还原剂,又起到酸的作用
8.已知反应:
①2BrO+Cl2=Br2+2ClO;
②5Cl2+I2+6H2O=2HIO3+10HCl;
③ClO+5Cl-+6H+=3Cl2↑+3H2O。
下列微粒氧化性强弱顺序正确的是
A.ClO>BrO>HIO3>Cl2 B.BrO>Cl2>ClO>HIO3
C.BrO>ClO>Cl2>HIO3 D.Cl2>BrO>ClO>HIO3
9.具有还原性,加碘食盐中的碘元素主要以的形式存在,、、在一定条件下可发生如图转化关系。下列说法不正确的是
A.生成等质量的碘,途径I和途径II转移电子数目之比为2∶5
B.由图可知氧化性的强弱顺序为
C.用淀粉-KI试纸和食醋可检验食盐是否加碘(遇淀粉呈蓝色)
D.途径Ⅲ反应的离子方程式:
10.化学实验中若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。在如图所示有编号的反应中,属于氧化还原反应的有
A.3个 B.4个 C.5个 D.6个
11.下列化学反应中,属于氧化还原反应的是
A.Na2CO3+CaCl2=CaCO3↓+2NaCl
B.Fe+CuSO4=Cu+FeSO4
C.2NaHCO3Na2CO3+CO2↑+H2O
D.CaO+H2O=Ca(OH)2
12.我国是世界上第一个在海域成功试采可燃冰的国家,可燃冰主要含有甲烷水合物,用作燃料时反应的微观示意图如图,下列说法正确的是
A.可燃冰中只有甲烷
B.化学变化中原子数目变化
C.反应的化学方程为CH4+O2 CO2+H2O
D.反应前后的物质均由分子构成
13.高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平):。下列说法正确的是
A.是氧化剂,是还原产物 B.的还原性强于
C.生成物水的化学计量数是16 D.生成4个水分子时,转移10个电子
14.CO2可以支持镁燃烧,发生以下反应:2Mg+CO22MgO+C。下列关于该反应的判断中正确的是
A.Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B.由此反应可以判断氧化性:CO2>MgO,还原性:Mg>C
C.CO2作氧化剂,表现氧化性,发生氧化反应
D.Mg原子失去的电子数目等于氧原子得到的电子数目
15.某同学在做实验时不小心引发了镁失火,他立即拿起灭火器欲把火扑灭,被老师及时制止。原因是可以支持镁燃烧,反应为。下列对该反应的判断中错误的是
A.元素化合价升高被还原
B.由此反应可以得出还原性:
C.为氧化剂,表现氧化性,发生还原反应
D.失去的电子数目等于得到的电子数目
二、实验题
16.高氯酸铵(NH4ClO4)为白色晶体,具有不稳定性,在400°C时开始分解产生多种气体,常用于生产火箭推进剂。某化学兴趣小组同学利用如图所示装置对NH4ClO4的分解产物进行探究。(假设装置内药品均足量,部分夹持装置已省略。)
(1)在实验过程中发现_______, 说明产物中有氧气生成。
(2)实验完毕后,取D中硬质玻璃管中的固体物质于试管中,滴加蒸馏水,产生能使湿润的红色石蕊试纸变蓝色的气体,产生该气体的化学方程式为_______。
(3)在实验过程中仪器E中装有碱石灰的目的是______。
(4)某同学认为产物中还应有H2O和Cl2,该同学从理论上分析认为有Cl2存在的理由是__________。
(5)为了证明H2O和Cl2的存在,选择上述部分装置和下图提供的装置进行实验:
①按气流从左至右,装置的连接顺序为A→_____;实验过程中H中的现象为_______。
②写出F中发生反应的离子方程式:______。
(6)实验结论: NH4ClO4分解时产生了上述几种物质,则高氯酸铵分解的化学方程式为________。
(7)实验结束后,某同学拟通过称量D中镁粉质量的变化,计算高氯酸铵的分解率,会造成计算结果____________________(填“偏大”“偏小”或“无法判断”)。
17.为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
实验操作 实验现象
i.打开A中分液漏斗活塞,滴加浓硫酸 A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀
ii.取C中沉淀加入盐酸 C中白色沉淀不溶解
iii.打开B中分液漏斗活塞,逐滴滴加H2O2 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色
(1)A中发生反应的化学方程式是___________。
实验室中常常利用氢氧化钠溶液吸收SO2的离子方式:___________。
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。
①乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是___________。
②将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性H2O2>SO2。
(3)iii中滴入少量H2O2没有明显变化。提出假设:
观点1:H2O2的量少不能氧化Br—
观点2:B中有未反应H2SO3
为验证观点2,应进行的实验操作及现象是___________。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是___________。
三、原理综合题
18.美国计划2028年再次登陆月球,并在月球上建立永久性基地,为人类登陆新的行星做好前期准备。为了解决基地人员的供氧问题,科学家设想利用月球富氧岩石制取氧气。其提氧原理是:用氢气还原富氧岩石获取水,再利用太阳能电池电解水得到氢气和氧气。
玄武岩(含钛铁矿)是月球的主要岩石之一,其质地坚硬,钛铁矿的主要成分为钛酸亚铁(FeTiO3)。用上述提氧原理,理论上,从1kgFeTiO3中可获取约105.3gO2。
(1)写出FeTiO3与H2反应的化学方程式:___。
(2)研究表明,月球上平均直径为40微米的小圆珠形成的堆积物(富含Fe2TiO4)是最适合提氧的矿物。这种堆积物作为提氧原料的优点是___。
(3)研究人员查阅文献后,得知钛铁矿在高温下还能被炭粉还原:2FeTiO3+C2Fe+2TiO2+CO2↑,通过植物的光合作用可吸收CO2获得O2。他们设计了两套实验装置来测定钛铁矿中可提取氧的质量分数。
研究人员用图1装置从钛铁矿中提取氧,实验中得出的可提取氧的质量分数大于理论值,产生这种情况的原因可能是___;用图2装置进行实验的过程中,称得反应前钛铁矿的质量为m1g,炭粉的质量为m2g,钛铁矿完全反应后,测得生成CaCO3的质量为m3g,则钛铁矿中可提取氧的质量分数表达式为___。
(4)在钛铁矿提氧过程中科学家们常选用H2而不用其他还原剂,其主要原因是__。
四、工业流程题
19.利用某地的闪锌矿(主要成分为ZnS,其杂质主要为铁、铜等元素)冶炼纯锌的传统工艺如图所示。
注:锌、铁、铜的沸点依次为1180K、3023K、2800K。
(1)高温煅烧时,若氧气足量,则ZnS发生反应的化学方程式为__。
(2)工业生产中方案1由锌熔体获得粗锌的操作为__(填“蒸馏”“分馏”或“干馏”)。
(3)方案2中固相2的成分为__(填化学符号,下同),液相1所含金属阳离子为__。
(4)方案2中从液相1获取粗锌的过程中可加入单质__除掉其他杂质;对比两种方案,方案2的优点是__。
(5)方案2的系列操作产生的废液可以制取绿矾。硫酸亚铁在不同温度下的溶解度和析出晶体的组成如表所示:
温度/℃ 0 10 30 50 56.7 60 70 80 90
溶解度/ 14.0 17.0 25.0 33.0 35.2 35.3 35.6 33.0 33.5
析出晶体 FeSO4 7H2O FeSO4 4H2O FeSO4 H2O
从表中数据可以得出的结论是①__,②__。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【详解】A.反应中HNO3中的N元素的化合价全部降低,被还原,故只表现出氧化性,选项A不合题意;
B.反应中HNO3中的N元素的化合价全部不变,只表现出酸性,选项B不合题意;
C.反应中HNO3中的N元素的化合价全部降低被还原,但O元素的化合价升高被氧化,故既表现出氧化性,又表现出还原性,选项C不合题意;
D.反应中HNO3中的N元素的化合价部分降低,被还原,还有一部分不变,表现酸性,故既表现出氧化性,又表现出酸性,选项D符合题意;
答案选D。
2.B
【详解】A.该反应中Cl化合价从+5价降低为-1价,共得到个电子,同理O共失去个电子,A错误;
B.该反应中Mg化合价从0价升高为+2价,共失去个电子,同理O共得到个电子,B正确;
C.该反应中Cu化合价从+2价降低为0价,共得到个电子,C化合价从0价升高到+4价,共失去4个电子,C错误;
D.该反应中O化合价从0价降低到-2价,共得到个电子,D错误;
故答案选B。
3.A
【详解】A.反应时,SO2中S元素的化合价升高,失电子发生氧化反应,故A正确;
B.NaClO3中Cl元素的化合价降低,得电子发生还原反应,故B错误;
C.H2SO4在反应中各元素化合价均未发生改变,既不是氧化剂,也不是还原剂,故C错误;
D.2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4反应中Cl从+5价降低为+4价,生成1个ClO2,转移1个电子,故D错误;
选A。
4.D
【分析】NaH中H元素显-1价,H2O中H元素显+1价,H2中H元素的化合价为0,根据氧化还原反应的归中规律分析。
【详解】A.置换反应是单质+化合物→单质+化合物,根据该反应的特点,该反应不属于置换反应,故A错误;
B.该反应不属复分解反应,属于氧化还原反应,故B错误;
C.NaH中H元素显-1价,在反应中转化成0价,化合价升高被氧化,NaH为还原剂,故C错误;
D.H2O中部分H元素由+1价→0价,化合价降低被还原,H2O中部分H被还原,故D正确;
故选D。
5.B
【详解】A.海水晒盐得到NaCl,Na为活泼金属,则电解熔融NaCl可制备Na同时产生氯气,A错误;
B.从海水中提取溴的过程中溴离子发生氧化反应生成溴单质,利用了氧化还原反应原理,B正确;
C.海水中镁以离子形成存在,经过化学反应可以获得氯化镁,然后电解熔融氯化镁可冶炼Mg,一定发生化学变化,C错误;
D.虽然海水中碘的总含量很大,但是海水中碘的浓度很低,不能直接由海水提取碘,D错误;
故选B。
6.C
【详解】A.加碘盐中含有KIO3,+5I +6H+=3I2+3H2O,I2使淀粉变蓝,所以用KI 淀粉试纸和食醋可以检验加碘盐中是否含有碘,故A正确;
B.根据图示转化Ⅲ可知氧化性Cl2>,已变蓝的淀粉 KI试纸褪色的原因可能是氯气将碘氧化为HIO3,反应方程式为5Cl2+I2+6H2O=2HIO3+10HCl,故B正确;
C.由途径I可知氧化性Cl2>I2,由途径Ⅱ可知氧化性I2
D.根据转化关系2~I2~10e 可知,生成1molI2反应中转移的电子数为10NA,故D正确。
故选C。
7.D
【详解】A.氯气和溴化亚铁反应时先氧化亚铁离子后氧化溴离子,所以表中第①组反应的氧化产物中一定有FeCl3,还有溴水生成的可能,A错误;
B.根据①可知,氧化性Cl2>Fe3+,根据②可知,氧化性KMnO4>O2,根据③可知,氧化性KClO3>Cl2,根据④可知,氧化性KMnO4>Cl2,根据以上分析无法判断Br2、Fe2+氧化性相对大小,B错误;
C.根据②可知,还原性H2O2>Mn2+,根据③可知,还原性Mn2+
故选D。
8.C
【分析】根据氧化还原反应的规律可知,有元素化合价降低的物质参与反应作氧化剂;有元素化合价升高的物质得到的对应产物为氧化产物,根据氧化剂的氧化性大于氧化产物的氧化性判断即可。
【详解】①中BrO是氧化剂,ClO是氧化产物,所以氧化性BrO>ClO;
②中Cl2是氧化剂,HIO3是氧化产物,所以氧化性Cl2>HIO3;
③中ClO是氧化剂,是Cl2氧化产物,所以氧化性ClO>Cl2,
则氧化能力强弱顺序为BrO>ClO>Cl2>HIO3,故C正确。
故选C。
9.A
【详解】A.途径Ⅱ转化关系2~I2~10e-,途径Ⅰ中2I-~I2~2e-,生产等量的碘,途径Ⅰ和途径Ⅱ转移电子数目之比为1:5,故A错误;
B.由途径I可知氧化性Cl2>I2,由途径Ⅱ可知氧化性I2<NaIO3,由途径Ⅲ可知氧化性Cl2>NaIO3,故氧化性的强弱顺序为Cl2>>I2,故B正确;
C.I-和酸性条件下可发生氧化还原反应生成I2,则可用淀粉-KI试纸和食醋检验加碘盐中是否含有碘,故C正确;
D.径Ⅲ反应是通入足量氯气,碘离子被氧化为碘酸根离子,反应的离子方程式:3Cl2+I-+3H2O═6Cl-++6H+,故D正确;
故选:A。
10.A
【详解】由转化流程图可知,反应①中Cr的化合价降低了,是氧化还原反应,反应②中元素的化合价未改变,是非氧化还原反应,反应③元素的化合价未改变,是非氧化还原反应,反应④Cr的化合价升高了,是氧化还原反应,反应⑥中Cr元素的化合价降低了,是氧化还原反应,反应⑤元素的化合价未改变,是非氧化还原反应,综上所述,有①④⑥三个反应属于氧化还原反应,故答案为:A。
11.B
【详解】A.该反应属于复分解反应,没有元素的化合价变化,不属于氧化还原反应,故A不选;
B.反应前Fe、Cu元素的化合价分别为:0、+2,反应后Fe、Cu元素的化合价分别为:+2、0,有元素的化合价变化,属于氧化还原反应,故B选;
C.该反应属于分解反应,没有元素的化合价变化,不属于氧化还原反应,故C不选;
D.没有元素的化合价变化,不属于氧化还原反应,故D不选;
故选:B。
12.D
【详解】A.可燃冰主要含甲烷水合物,为混合物,故不符合题意;
B.由反应的方程式可知:化学变化中原子数目没有变化,故不符合题意;
C.反应的方程式是:CH4+2O2 CO2+2H2O。故不符合题意;
D.反应前后的物质均由分子构成,故符合题意。
故答案为:D。
13.B
【详解】A.被氧化生成,为氧化产物,A错误;
B.Fe2+在该反应中是还原剂,为还原产物,B正确;
C.配平该反应的化学方程式为,水的化学计量数是8,C错误;
D.根据配平方程式可知,生成4个水分子时,转移5个电子,D错误;
故答案选B。
14.B
【详解】A.镁化合价由0价升高到MgO的+2价,所以镁为还原剂,被氧化,MgO为氧化产物,故A错误;
B.还原剂的还原性大于还原产物,所以还原性Mg>C,氧化剂的氧化性大于氧化产物,则氧化性CO2>MgO,故B正确;
C.CO2作氧化剂,表现氧化性,发生还原反应,故C错误;
D.根据得失电子守恒,Mg原子失去的电子数目等于C原子得到的电子数目,故D错误;
故选B。
15.A
【详解】A.反应中元素化合价升高,镁作还原剂,被氧化,A错误;
B.该反应中为还原剂,C为还原产物,还原剂的还原性大于还原产物的还原性,则还原性:,B正确;
C.中C元素化合价降低,作氧化剂,具有氧化性,被还原,发生还原反应,C正确;
D.氧化还原反应中得、失电子数相等,即失去的电子数目等于得到的电子数目,D正确;
答案选A。
16.(1)铜粉由红色变为黑色
(2)Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
(3)吸收空气中的二氧化碳和水蒸气
(4)根据氧化还原反应规律,还应存在还原产物,从而判断出氯元素的化合价降低,可能生成氯气
(5) H→G→F 从白色变蓝色
(6)2NH4C1O4=N2↑+4H2O+Cl2↑+2O2↑
(7)偏大
【分析】NH4C1O4受热分解产生的气体,经碱石灰干燥除氯气后,用铜粉检验氧气的存在,用镁粉检验氮气的存在。
(1)
NH4C1O4受热分解产生的气体,经碱石灰干燥后,能使铜粉由红色变为黑色,说明生成了CuO,所以分解产物中含有O2。
(2)
NH4C1O4受热分解产物中有N2生成,N2与镁粉生成Mg3N2,产生的能使湿润的红色石蕊试纸变蓝色的气体为氨气,发生反应为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑。
(3)
空气中的二氧化碳和水蒸气会与镁粉反应,在实验过程中仪器E中的碱石灰可以吸收空气中的二氧化碳和水蒸气。
(4)
根据分析可知,NH4C1O4分解产物中含有O2和N2, O2和N2都是氧化产物,根据氧化还原反应规律,还应存在还原产物,从而判断出氯元素的化合价降低,可能生成氯气。
(5)
①检验水蒸气和氯气,应该先用H中的无水硫酸铜检验水的存在,再用溴化钾检验氯气现象是水溶液变为橙黄色;为了防止多余的氯气污染环境,还需要使用尾气吸收装置,所以按气流从左至右,装置的连接顺序为A→H→G→F;无水硫酸铜粉末遇到水从白色变蓝色。
②F中NaOH溶液吸收多余的Cl2,发生反应的离子方程式:。
(6)
实验结论: NH4ClO4分解时产生了氮气、氧气、氯气和水,高氯酸铵分解的化学方程式为2NH4C1O4=N2↑+4H2O+Cl2↑+2O2↑。
(7)
通过称量D中镁粉质量的变化,计算高氯酸铵的分解率,镁粉与装置中的氧气、氮气反应,造成产物质量增大,会造成计算结果偏大。
17. Na2SO3 + H2SO4 = Na2SO4 + SO2↑ + H2O 2OH- + SO2 = SO+ H2O 打开弹簧夹,通入氮气,排净装置空气,关闭弹簧夹 取少量滴加H2O2溶液前的B中溶液于试管中,加热,将气体通入品红溶液中,品红溶液褪色 H2O2>Br>SO2
【详解】(1) 在A中浓硫酸与Na2SO3发生复分解反应产生SO2气体,该反应的化学方程式是Na2SO3 + H2SO4 = Na2SO4 + SO2↑ + H2O;实验室中常常利用氢氧化钠溶液吸收SO2的离子方式:2OH- + SO2 = SO+ H2O;
(2)①由于在装置中含有空气,空气中的氧气和SO2在溶液中也会发生反应将其氧化,所以乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是打开弹簧夹,通入N2,待排净装置内空气后,关闭弹簧夹;
(3)由于H2SO3不稳定,受热容易分解产生有漂白性的SO2,所以为验证观点2,应进行的实验操作及现象是取少量滴加H2O2溶液前的B中溶液于试管中,加热,将气体通入品红溶液中,品红溶液褪色;
(4)物质在发生氧化还原反应中氧化性强的可以把氧化性弱的制取出来,所以通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是H2O2>Br2>SO2。
18. FeTiO3+H2Fe+TiO2+H2O 无需进行岩石破碎工作、可提取氧的质量分数大 H2未经干燥、U形管中碱石灰吸收了空气中的水分 % H2的氧化产物水无污染,电解水产生的H2能够被循环利用
【详解】(1)根据从中可获得约,结合提氧原理可确定反应的化学方程式为;
(2)因为是40微米的小圆珠,故无需进行岩石破碎工作,而且可提取氧的质量分数大;
(3)测得的可提取氧的质量分数大于理论值,则可能是通入的未经干燥,U形管中的碱石灰吸收了空气中的水蒸气;因为生成的质量为,故经光合作用可获得的质量为,所以钛铁矿中可提取氧的质量分数表达式为;
(4) H2的氧化产物水无污染,电解水产生的H2能够被循环利用。
19. 分馏 C、Cu Zn2+、Fe2+ Zn 节约能量 随温度升高,硫酸亚铁的溶解度先升高后降低 温度超过60℃时,析出晶体中结晶水含量越来越少
【详解】(1)高温煅烧时,若氧气足量,则与氧气反应生成氧化锌和二氧化硫,其化学方程式为;
(2)方案1中,锌熔体为锌和少量铁、铜、碳的混合物,三种金属沸点不同,获得粗锌的操作为分馏;
(3)锌熔体为锌和少量铁、铜、碳的混合物,加入稀硫酸,锌和铁与稀硫酸反应生成硫酸亚铁、硫酸锌和氢气,固相2的成分为、;液相1所含金属阳离子为、;
(4)方案2中液相1为硫酸锌、硫酸亚铁和少量硫酸的混合液,获取粗锌的过程中可加入单质锌除掉其他杂质;对比两种方案,方案2的优点是节约能量(或不需加热);
(5)分析表中数据可以得出的结论是:①随温度升高,硫酸亚铁的溶解度先升高后降低;②温度超过60℃时,析出晶体中结晶水含量越来越少。
答案第1页,共2页
答案第1页,共2页
