第三章第二节金属材料同步练习 (含解析)(2022-2023学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 第三章第二节金属材料同步练习 (含解析)(2022-2023学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 186.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-22 16:06:55 | ||
图片预览



文档简介
第三章第二节金属材料同步练习
单选题
1. 下列对铝热反应的说法错误的是 ( )
A. 铝热剂中还原剂是铝粉 B. 铝热剂是纯净物
C. 铝与可组成铝热剂 D. 铝热反应是放热反应
2. 将、组成的混合物投入一定量稀盐酸中,固体完全溶解,收集到气体为标准状况,向反应后溶液中加入溶液时,金属离子恰好沉淀完全,则形成沉淀的质量为( )
A. (m+1.7)g B. (m+3.4)g C. (m+5.1)g D. (m+6.8)g
3. 某无色透明的溶液能与铝作用放出氢气,此溶液中可以大量共存的离子组是。( )
A. 、、、 B. 、、、
C. 、、、 D. 、、、
4. 下列离子方程式的书写及评价均合理的是。( )
选项 离子方程式 评价
A. 将通入含的溶液中: 正确;过量,可将 、均氧化
B. 的溶液和 的溶液等体积均匀混合: 正确;与 消耗的的物质的量之比为:
C. 过量通入溶液中: 正确;说明酸性:
D. 溶液与足量的溶液反应: 正确酸式盐与碱反应生成正盐和水
A. B. C. D.
5. 甲、乙两烧杯中各盛有的盐酸和溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的为甲:乙:,则加入铝粉的质量为( )
A. B. C. D.
6. 把镁粉中混入的少量铝粉除去,应选用的试剂是。( )
A. 盐酸 B. 氯水 C. 烧碱溶液 D. 食盐水
7. 下列事实能说明刚玉是共价晶体的是( )
是两性氧化物;硬度很大;它的熔点为;自然界中的刚玉有红宝石和蓝宝石。
A. B. C. D.
8. 已去除表面氧化膜的金属铝投入溶液中不涉及下列哪种变化( )
A. 金属键破坏 B. 共价键破坏 C. 共价键形成 D. 离子键破坏
9. 向、混合溶液中逐滴加入溶液,生成沉淀的量随溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )
A. 点对应的溶液中:、、、
B. 点对应的溶液中:、、、
C. 点对应的溶液中:、、、
D. 点对应的溶液中:、、、
10. 、、、为原子序数依次增大的短周期元素,四种元素的核外电子总数满足;气态化合物,能使滴加了的红色石蕊试纸变蓝。下列叙述正确的是( )
A. 原子半径:
B. 最高正化合价:
C. 最简单气态氢化物的稳定性:
D. 的盐溶液中通入过量,先析出沉淀后又变澄清
11. 传统的工业生产金属铝的基本流程如图所示:
结合流程图,判断下列说法错误的是。( )
A. 铝土矿的主要成分是,电解铝的阴极和阳极材料均为碳
B. 加入冰晶石和少量的目的是降低氧化铝的熔融温度
C. 将氧化铝转化为氯化铝再进行电解冶炼金属铝时可以节约大量能源
D. 冶炼过程中,阳极材料可能会因不断被消耗而需要定期更换
12. 近年来,科学家在探索利用铝粉作燃料的可能性,期望铝能成为石油的替代物。假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法。你认为错误的是。( )
A. 铝质轻,便于运输、贮存,且安全
B. 铝燃烧时放出的热量大,且燃烧后产物对环境的污染容易得到有效的控制
C. 在地球上,铝矿资源丰富
D. 现代电解冶铝的工业技术已为铝作为新能源奠定了重要基础
13. 下列有关金属及其合金的说法不正确的是 ( )
A. 目前我国流通的硬币是由合金材料制成的
B. 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
C. 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
D. 生铁、普通钢和不锈钢中的碳含量依次增加
14. 下列说法不正确的是( )
A. 钠在空气中燃烧时,先熔化,再燃烧,发出黄色火焰,生成过氧化钠
B. 铝是地壳里含量最多的金属元素,在常温下,铝不能与氧气反应
C. 青铜是我国使用最早的合金,钢是用量最大、用途最广的合金
D. 铁在潮湿的空气中生成的氧化物疏松多孔,不能保护内层金属
15. 下列说法错误的是
钠着火用干沙土扑灭;
明矾可用于水的净化和消毒;
打磨过的铝片加热熔化时会滴落,未打磨的铝片则不会滴落;
可用铁制容器盛放和运输浓硫酸;
青铜、不锈钢、硬铝都是合金;
用作呼吸面具的供氧剂;
氧化铝常用来制造耐火材料;
灼烧某待测液,焰色反应为黄色,则待测液中一定不含钾离子;
用电子式表示的形成过程:;
A. B. C. D.
二、填空题
16. 已知硝酸与金属发生反应时,随着硝酸浓度的下降和金属活动性的增大,产物中氮元素的化合价会逐渐下降,它们可能是、、、或中的一种或几种。某同学取一定量的铝铁合金与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入溶液,所加溶液的体积与产生沉淀的物质的量的关系如图所示。试回答下列问题:
写出合金中铁与该稀硝酸反应的离子方程式:___________。
合金中铝的物质的量为__________。
点对应的沉淀的物质的量为__________, 点对应的沉淀的物质的量为__________。
点对应的氢氧化钠溶液的体积为__________。
17. 铁是人类较早使用的金属之一,铁合金也是用量最大的金属材料。请按要求完成下列问题。
在自然界中,铁元素主要以_____________填写“游离态”或“化合态”形式存在
下列铁的化合物中,不能直接化合得到的是_______用字母代号填。
A.
高铁酸钾是一种新型、高效、多功能水处理剂,与水反应可生成透明的红褐色胶体,反应原理:胶体
胶体分散质粒子的直径范围是______________。
该反应中是_______。
A.氧化剂 还原剂 被氧化 被还原
高铁酸钾能杀灭水中细菌的原因是______________________________________。
电子工业常用左右的溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。为了从腐蚀废液中回收铜,并重新获得溶液,某同学设计下列方案:
实验室用无水氯化铁固体粗略配制的溶液,需要的主要玻璃仪器除了量筒外还有__________。
写出溶液与铜箔发生反应的离子方程式_____________________________。
现用溶液制造印刷电路板,生产后的腐蚀废液用该同学设计方案处理,最终获得氯化铁溶液中的物质的量至少为__________。
铝及其合金是金属材料界后起之秀。某研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,溶液温度迅速上升。若用同样的铝片投入相同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。造成不同现象的原因可能是 ________填序号。
A.铝与氯化铜溶液反应,与硫酸铜溶液不反应 氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.生成物溶于水,而不溶于水 氯离子能破坏氧化铝薄膜,而硫酸根离子不能
请设计一个简单实验验证你的选择:________________________________________。
三、实验题
18. 图甲是演示金属钠与水反应的重要实验,为收集并检验气体产物,某兴趣小组将甲装置改进成图乙或图丙装置。请根据要求回答下列问题:
写出钠与水反应的离子方程式:________________________。
按乙装置进行实验,液体添加完毕后,关闭活塞,打开右边胶塞,向煤油中加入一小块钠,立即塞好胶塞,可观察到的现象是________填字母。
A.钠块始终保持在处,直至完全消失
B.钠沉入形管处后又慢慢浮到处
C.钠处于煤油和水的交界处上下浮动
D.随反应的进行煤油与胶塞处液面下降,漏斗中液面上升
E.最终钠块在煤油中燃烧起来
乙装置中漏斗在反应过程中的主要作用是________________________。
用乙装置进行实验,点燃气体产物时,是否需要检验纯度?________填“是”或“否”。
按图丙所示方法来收集产生的气体,需将钠包好,再放入水中。取相同质量的钠,按下列两种情况收集产生的气体,收集的气体体积在相同条件下的关系是________填字母。
用铝箔包住钠 用铜箔包住钠
收集的气体一样多 收集的气体体积较多 收集的气体体积较多
19. 实验探究铝的性质
铝的燃烧。
用镊子夹住一小团脱脂棉,蘸上铝粉。
在酒精灯上点燃。
立即伸入盛有氧气的集气瓶中瓶底有细沙。
实现现象:_________________________________________________。
结论、解释及化学方程式:_____________________________________________________________。
铝与酸碱的反应。
将两小片用砂纸打磨过的铝片分别放入两支洁净的试管中,再向试管分别加入盐酸和氢氧化钠各,观察现象。
实现现象:___________________________________________________________________。
结论、解释及化学方程式:__________________________________________________________________。
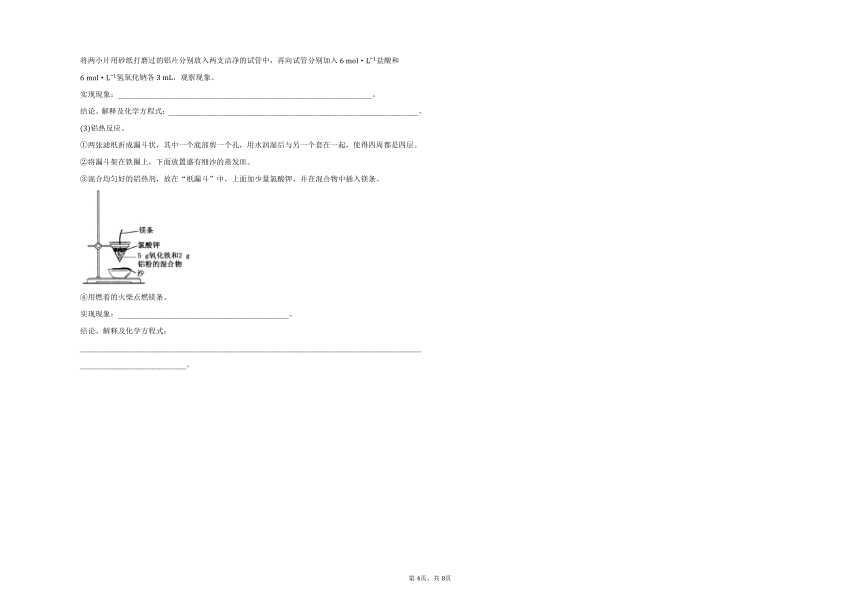
铝热反应。
两张滤纸折成漏斗状,其中一个底部剪一个孔,用水润湿后与另一个套在一起,使得四周都是四层。
将漏斗架在铁圈上,下面放置盛有细沙的蒸发皿。
混合均匀好的铝热剂,放在“纸漏斗”中,上面加少量氯酸钾,并在混合物中插入镁条。
用燃着的火柴点燃镁条。
实现现象:_____________________________________________。
结论、解释及化学方程式:______________________________________________________________________________________________________________________。
答案和解析
1.【答案】
【解析】和可组成铝热剂,属于混合物,其中铝作还原剂,铝热反应是放热反应。
2.【答案】
【解析】金属Mg、Al在稀盐酸中完全溶解,生成可溶的氯化物(MgCl2、AICl3),盐酸可能恰好反应,也可能剩余,向溶液中加入NaOH溶液,盐酸被中和,金属离子恰好沉淀,生成Mg(OH)2、Al(OH)3。
梳理本题物质变化思路:Mg→Mg2+→Mg(OH)2, Al→Al3+→Al(OH)3,生成沉淀的质量可由金属元素的质量加上沉淀中OH-的质量求得。而Mg2+、Al3+生成沉淀结合的OH-的物质的量正好是Mg、Al变成离子时失去电子的物质的量,而Mg、Al失去电子的物质的量正好是H+变成H2得到电子的物质的量。由2H+~2e-~H2,可求出得到电子的物质的量为2×=0.1 mol,故 Mg2+、Al3+生成沉淀结合的OH-的物质的量也是0.1 mol,质量为1.7g,故生成沉淀的质量为(m+1.7)g,故选A。
3.【答案】
【解析】由于是无色溶液,选项中有,选项中有,则不是正确选项;溶液与铝作用能放出氢气,溶液可以是酸性也可以是碱性,则选项错误选项酸性环境下,不生产,碱性条件下,离子可共存,故选C。
4.【答案】
【解析】项,将通入含的溶液中,不足,先氧化,离子方程式为;
项,与以物质的量之比:反应时,生成沉淀,以:反应时生成,所以的溶液和的溶液等体积均匀混合,离子方程式为,可理解为 消耗,生成,其中又消耗了,生成,所以与消耗的的物质的量之比为:;
项,过量通入溶液中,发生氧化还原反应,无法比较和的酸性强弱;
项,溶液与足量溶液反应的离子方程式为,酸式盐与碱反应生成正盐和水的说法不全面。
5.【答案】
【解析】思路:
等物质的量的两份分别在盐酸和溶液中完全反应,生成的物质的量相等时,
的消耗值大于的消耗值。
等物质的量的和分别与完全反应,盐酸中消耗的少,生成的也少。
。
若两份都完全反应,则生成的是甲:乙:,实际上甲: 乙
:,则盐酸中剩余,完全反应,要根据以及相关化学方程式计算盐
酸中生成的 。
因甲: 乙:和盐酸中生成 ,故溶液中生成的
。
根据 ,生成 要消耗。
。
6.【答案】
【解析】铝可以与烧碱溶液反应,而金属镁不能。
7.【答案】
【解析】
【分析】
本题考查了共价晶体的特征及判断方法,题目难度不大。
【解答】
共价晶体的特征是硬度大、熔点高,故B正确,而是两性氧化物属于物质分类,自然界中的刚玉有红宝石和蓝宝石是刚玉在自然界的存在形式,与晶体类型无关。
8.【答案】
【解析】
【分析】
已去除表面氧化膜的金属铝投入溶液中,铝先与水反应 ,氢氧化与强碱反应。
【解答】
A.铝含有金属键,铝单质参加反应,金属键破坏,故不选A;
B.水参与反应,水中共价键破坏,故不选B;
C.反应生成氢气,共价键形成,故不选C;
D.根据反应方程式,没有离子键的破坏和形成,故选D;
选D。
9.【答案】
【解析】错,点时酸未反应完,故溶液显酸性,、在酸性条件下发生氧化还原反应;
错,点时酸与氢氧化钠恰好完全反应,溶液中含有大量,会与发生相互促进的水解反应;
错,点与未完全反应,与发生相互促进的水解反应;
对,点时氢氧化铝与未完全反应,与、、、均不反应。
10.【答案】
【解析】根据题给信息分析,、、、四种元素分别为氢、氮、氧、铝。四种元素的原子半径铝最大,氢最小,氮、氧均为第周期元素,原子半径从左到右递减,故原子半径:铝氮氧氢,故A正确;氧没有最高正价,故B错误;非金属性越强,最简单气态氢化物越稳定,应是,故C错误;铝的盐溶液有铝盐与偏铝酸盐,铝盐溶液中通入过量,析出的氢氧化铝沉淀不溶于过量氨水,不会变澄清,且偏铝酸盐溶液中通入氨气不析出氢氧化铝沉淀,故D错误。
11.【答案】
【解析】铝土矿的主要成分是,电解铝的阴极和阳极材料均为碳,阳极需要定期更换,项正确;加入冰晶石和少量的目的是降低氧化铝的熔融温度,从而降低成本,项正确;氯化铝是共价化合物,熔融状态下不导电,无法电解,项错误;用石墨电极电解熔融氧化铝,阳极生成的氧气在高温条件下能氧化石墨生成,则冶炼过程中,阳极材料可能会因不断被消耗而需要定期更换,项正确。
12.【答案】
【解析】现代电解冶铝的工业生产耗电量很大,这是制约铝成为能源的重要因素。
13.【答案】
【解析】
【分析】本题考查了常见的合金及其应用,镁、铝的相关知识,试题难度较易
【解答】目前我国流通的硬币是由合金材料制成的,A正确;
B.制造照明弹利用了镁燃烧可发出耀眼的白光的性质,B正确;
C.常温下,铝能与空气中的氧气反应生成一层致密的氧化物薄膜,对内部金属起保护作用,C正确;
D.生铁含碳量高于普通钢和不锈钢,D错误。
14.【答案】
【解析】
【分析】钠的熔点较低,钠在空气中燃烧生成过氧化钠;
B.铝是地壳里含量最多的金属元素,铝和氧气反应生成一层致密是氧化物薄膜,阻止进一步反应;
C.我国使用最早的合金是青铜,钢是用量最大、用途最广的合金;
D.铁合金易发生电化学腐蚀.
本题主要考查了金属的性质方面的知识,掌握钠、铝、合金知识是解答关键,明确铝在空气中不需要特殊保护的原因,题目难度不大.
【解答】钠的熔点较低,所以在空气燃烧时先熔化,再燃烧,燃烧时生成淡黄色的,故A正确;
B.铝是地壳里含量最多的金属元素,铝是亲氧元素,极易在空气中形成了一薄层致密的氧化膜阻止了铝进一步反应,从而保护内层金属,不是铝不能与氧气反应,故B错误;
C.我国最早使用的合金是由铜、锡形成的青铜,目前世界上用途最广的合金是钢,如炊具、建筑材料等材料,故C正确;
D.铁合金易发生电化学腐蚀,氧化膜疏松,不能保护内层金属,易进一步氧化,应加防护措施,故D正确.
故选B.
15.【答案】
【解析】
【分析】
本题考查了金属元素化合物的性质与应用,题目难道不大,侧重于考查学生的分析能力和对基础知识的应用能力,注意把握、、、等金属元素单质及其化合物的性质。
【解答】
钠能与水和二氧化碳等反应,故钠着火通常用干沙土扑灭,正确;
明矾溶于水电离出的铝离子水解生成氢氧化铝胶体,具有净水的作用但是没有消毒的作用,错误;
打磨过的铝片在加热时也会迅速生成致密的氧化膜,加热熔化时不会滴落,错误;
铁遇到冷的浓硫酸发生钝化,可用铁制容器盛放和运输浓硫酸,正确;
青铜是铜锡合金、不锈钢是铁铬镍合金,硬铝是铝硅镁等形成的合金,三种物质都是合金,正确;
可与二氧化碳反应生成氧气,可用作呼吸面具的供氧剂,正确;
氧化铝熔点高,常用来制造耐火材料,正确;
钾元素的焰色反应必须通过蓝色钴玻璃滤掉钠的黄光才能观察到,所以焰色反应为黄色不一定没有钾元素,错误;
镁失电子生成镁离子,氟得电子生成氟离子,氟离子和镁离子通过离子键形成氯化镁,用电子式表示的形成过程为,错误;
故选:。
16.【答案】
;
【解析】
【分析】
本题考查金属与硝酸的反应、氧化还原反应、化学计算等知识点,属于中等难度试题,解答此题关键是判断出硝酸的还原产物以及电子转移守恒的运用。
【解答】
从图像可知,段加入氢氧化钠溶液无沉淀产生,说明溶液中有稀硝酸,铝粉和铁粉的混合物与一定量稀充分反应,被氧化为、,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又因硝酸的浓度越稀,对应的还原产物中氮元素的化合价越低,可以推测元素由变成了价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与发生了反应,则随着的滴加,发生的反应依次有: 段:, 段:,, 段:, 段:,再结合消耗的溶液的体积可知:,根据氧化还原反应,元素由价变为价,而金属都由价变为价,可以运用得失电子守恒得出金属的物质的量为:,则段消耗的溶液的体积为:,则段体积为,对应溶液中含有;,则;据此解答。
由上述分析可知,金属铁和稀硝酸反应生成硝酸铁、硝酸铵和水,反应的离子方程式为:;故答案为:;
由上述分析计算可知:;故答案为:;
由上述分析计算可知:点对应的沉淀的物质的量为;点对应的沉淀为氢氧化铁沉淀,根据铁元素守恒可知其物质的量为;故答案为:;;
由上述分析计算可知:点对应的氢氧化钠溶液的体积为,故答案为:。
17.【答案】化合态
;;具有强氧化性,能使蛋白质变性
烧杯、玻璃棒; ;
;在硫酸铜溶液中加入铝片,无明显现象,再加入不能加入盐酸,若反应明显加快了,说明判断正确。
【解析】
【分析】
本题考查了铁元素和铝元素相关知识涉及化学工艺流程、化学计算、元素化合物性质等知识,题目难度中等,掌握元素化合物的性质是关键,试题培养了学生灵活应用所学知识的能力。
【解答】
铁性质活泼,在自然界中,铁元素主要以化合态形式存在,
故答案为:化合态;
铁丝在氧气燃烧可生成四氧化三铁,故A不符合;
B.氯化铁和铁粉反应可生成氯化亚铁,故B不符合;
C.氢氧化亚铁不能通过化合反应制的,故C符合;
氢氧化亚铁、氧气和水化合生成氢氧化铁,故D不符合;
胶体分散质粒子的直径范围是;
该反应中是中从价升高到价,化合价升高被氧化,作还原剂,故选BC;
高铁酸钾能杀灭水中细菌的原因是:具有强氧化性,能使蛋白质变性;
配制一定质量分数的溶液时,溶解时需要烧杯、玻璃棒;
氯化铁和铜反应生成氯化亚铁和氯化铜,其离子方程式为: ;
溶液含物质的量,,最多可生成氯化铜物质的量,,在溶解铁物质的量,此时混合溶液中最少含铁物质的量,最终可被氧化成氯化铁,最终获得氯化铁溶液中的物质的量至少为;
铝与氯化铜溶液反应,与硫酸铜溶液都能发生置换反应,故A错误;
B. 氯化铜溶液酸性与同浓度的硫酸铜溶液酸性相同,故B错误;
C.生成物溶于水和都能溶于水,故 C错误;
D.金属铝的表面有一层致密的氧化物薄膜,氯化铝和硫酸铝阴离子的不同,氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能,故D正确;
设计简单实验如下:在硫酸铜溶液中加入铝片,无明显现象,再加入不能加入盐酸,若反应明显加快了,说明判断正确。
18.【答案】 ;
;
储存反应过程中排出的水;
否;
;
【解析】【解答】
钠和水反应生成氢氧化钠和氢气,离子方程式为: ;
因钠的密度比水小,比煤油大,钠与水接触时反应产生氢气,生成的气体将钠块带离水层,进入煤油层后,停止反应又下沉,如此往复,直至钠反应完全,反应过程中没有氧气,钠不可能燃烧,所以钠处于煤油和水的交界处上下浮动,生成氢气不溶于煤油和水,随反应的进行,形管右侧气体压强增大,煤油与胶塞处液面下降,左侧漏斗中液面上升;
故选:。
乙装置中漏斗在反应过程中的主要作用是储存反应过程中排出的水;
液体充满形管,反应过程中只产生氢气,点燃时不会发生爆炸,因而不需要检验氢气的纯度;
和反应产生的同时产生,可以和发生反应继续放出氢气,
,故产生的的体积较大。
19.【答案】发出耀眼的白光,产生大量热;铝粉与氧气反应:;
两支试管中,铝片均逐渐溶解,同时放出气泡;铝与盐酸、反应:、;
镁条剧烈燃烧,引发纸漏斗中反应,纸漏斗被烧穿,有熔融物落到盛有细沙的蒸发皿上;铝在高温条件下能还原铁的氧化物:。
【解析】略
第1页,共1页
单选题
1. 下列对铝热反应的说法错误的是 ( )
A. 铝热剂中还原剂是铝粉 B. 铝热剂是纯净物
C. 铝与可组成铝热剂 D. 铝热反应是放热反应
2. 将、组成的混合物投入一定量稀盐酸中,固体完全溶解,收集到气体为标准状况,向反应后溶液中加入溶液时,金属离子恰好沉淀完全,则形成沉淀的质量为( )
A. (m+1.7)g B. (m+3.4)g C. (m+5.1)g D. (m+6.8)g
3. 某无色透明的溶液能与铝作用放出氢气,此溶液中可以大量共存的离子组是。( )
A. 、、、 B. 、、、
C. 、、、 D. 、、、
4. 下列离子方程式的书写及评价均合理的是。( )
选项 离子方程式 评价
A. 将通入含的溶液中: 正确;过量,可将 、均氧化
B. 的溶液和 的溶液等体积均匀混合: 正确;与 消耗的的物质的量之比为:
C. 过量通入溶液中: 正确;说明酸性:
D. 溶液与足量的溶液反应: 正确酸式盐与碱反应生成正盐和水
A. B. C. D.
5. 甲、乙两烧杯中各盛有的盐酸和溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的为甲:乙:,则加入铝粉的质量为( )
A. B. C. D.
6. 把镁粉中混入的少量铝粉除去,应选用的试剂是。( )
A. 盐酸 B. 氯水 C. 烧碱溶液 D. 食盐水
7. 下列事实能说明刚玉是共价晶体的是( )
是两性氧化物;硬度很大;它的熔点为;自然界中的刚玉有红宝石和蓝宝石。
A. B. C. D.
8. 已去除表面氧化膜的金属铝投入溶液中不涉及下列哪种变化( )
A. 金属键破坏 B. 共价键破坏 C. 共价键形成 D. 离子键破坏
9. 向、混合溶液中逐滴加入溶液,生成沉淀的量随溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )
A. 点对应的溶液中:、、、
B. 点对应的溶液中:、、、
C. 点对应的溶液中:、、、
D. 点对应的溶液中:、、、
10. 、、、为原子序数依次增大的短周期元素,四种元素的核外电子总数满足;气态化合物,能使滴加了的红色石蕊试纸变蓝。下列叙述正确的是( )
A. 原子半径:
B. 最高正化合价:
C. 最简单气态氢化物的稳定性:
D. 的盐溶液中通入过量,先析出沉淀后又变澄清
11. 传统的工业生产金属铝的基本流程如图所示:
结合流程图,判断下列说法错误的是。( )
A. 铝土矿的主要成分是,电解铝的阴极和阳极材料均为碳
B. 加入冰晶石和少量的目的是降低氧化铝的熔融温度
C. 将氧化铝转化为氯化铝再进行电解冶炼金属铝时可以节约大量能源
D. 冶炼过程中,阳极材料可能会因不断被消耗而需要定期更换
12. 近年来,科学家在探索利用铝粉作燃料的可能性,期望铝能成为石油的替代物。假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法。你认为错误的是。( )
A. 铝质轻,便于运输、贮存,且安全
B. 铝燃烧时放出的热量大,且燃烧后产物对环境的污染容易得到有效的控制
C. 在地球上,铝矿资源丰富
D. 现代电解冶铝的工业技术已为铝作为新能源奠定了重要基础
13. 下列有关金属及其合金的说法不正确的是 ( )
A. 目前我国流通的硬币是由合金材料制成的
B. 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
C. 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
D. 生铁、普通钢和不锈钢中的碳含量依次增加
14. 下列说法不正确的是( )
A. 钠在空气中燃烧时,先熔化,再燃烧,发出黄色火焰,生成过氧化钠
B. 铝是地壳里含量最多的金属元素,在常温下,铝不能与氧气反应
C. 青铜是我国使用最早的合金,钢是用量最大、用途最广的合金
D. 铁在潮湿的空气中生成的氧化物疏松多孔,不能保护内层金属
15. 下列说法错误的是
钠着火用干沙土扑灭;
明矾可用于水的净化和消毒;
打磨过的铝片加热熔化时会滴落,未打磨的铝片则不会滴落;
可用铁制容器盛放和运输浓硫酸;
青铜、不锈钢、硬铝都是合金;
用作呼吸面具的供氧剂;
氧化铝常用来制造耐火材料;
灼烧某待测液,焰色反应为黄色,则待测液中一定不含钾离子;
用电子式表示的形成过程:;
A. B. C. D.
二、填空题
16. 已知硝酸与金属发生反应时,随着硝酸浓度的下降和金属活动性的增大,产物中氮元素的化合价会逐渐下降,它们可能是、、、或中的一种或几种。某同学取一定量的铝铁合金与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入溶液,所加溶液的体积与产生沉淀的物质的量的关系如图所示。试回答下列问题:
写出合金中铁与该稀硝酸反应的离子方程式:___________。
合金中铝的物质的量为__________。
点对应的沉淀的物质的量为__________, 点对应的沉淀的物质的量为__________。
点对应的氢氧化钠溶液的体积为__________。
17. 铁是人类较早使用的金属之一,铁合金也是用量最大的金属材料。请按要求完成下列问题。
在自然界中,铁元素主要以_____________填写“游离态”或“化合态”形式存在
下列铁的化合物中,不能直接化合得到的是_______用字母代号填。
A.
高铁酸钾是一种新型、高效、多功能水处理剂,与水反应可生成透明的红褐色胶体,反应原理:胶体
胶体分散质粒子的直径范围是______________。
该反应中是_______。
A.氧化剂 还原剂 被氧化 被还原
高铁酸钾能杀灭水中细菌的原因是______________________________________。
电子工业常用左右的溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。为了从腐蚀废液中回收铜,并重新获得溶液,某同学设计下列方案:
实验室用无水氯化铁固体粗略配制的溶液,需要的主要玻璃仪器除了量筒外还有__________。
写出溶液与铜箔发生反应的离子方程式_____________________________。
现用溶液制造印刷电路板,生产后的腐蚀废液用该同学设计方案处理,最终获得氯化铁溶液中的物质的量至少为__________。
铝及其合金是金属材料界后起之秀。某研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,溶液温度迅速上升。若用同样的铝片投入相同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。造成不同现象的原因可能是 ________填序号。
A.铝与氯化铜溶液反应,与硫酸铜溶液不反应 氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.生成物溶于水,而不溶于水 氯离子能破坏氧化铝薄膜,而硫酸根离子不能
请设计一个简单实验验证你的选择:________________________________________。
三、实验题
18. 图甲是演示金属钠与水反应的重要实验,为收集并检验气体产物,某兴趣小组将甲装置改进成图乙或图丙装置。请根据要求回答下列问题:
写出钠与水反应的离子方程式:________________________。
按乙装置进行实验,液体添加完毕后,关闭活塞,打开右边胶塞,向煤油中加入一小块钠,立即塞好胶塞,可观察到的现象是________填字母。
A.钠块始终保持在处,直至完全消失
B.钠沉入形管处后又慢慢浮到处
C.钠处于煤油和水的交界处上下浮动
D.随反应的进行煤油与胶塞处液面下降,漏斗中液面上升
E.最终钠块在煤油中燃烧起来
乙装置中漏斗在反应过程中的主要作用是________________________。
用乙装置进行实验,点燃气体产物时,是否需要检验纯度?________填“是”或“否”。
按图丙所示方法来收集产生的气体,需将钠包好,再放入水中。取相同质量的钠,按下列两种情况收集产生的气体,收集的气体体积在相同条件下的关系是________填字母。
用铝箔包住钠 用铜箔包住钠
收集的气体一样多 收集的气体体积较多 收集的气体体积较多
19. 实验探究铝的性质
铝的燃烧。
用镊子夹住一小团脱脂棉,蘸上铝粉。
在酒精灯上点燃。
立即伸入盛有氧气的集气瓶中瓶底有细沙。
实现现象:_________________________________________________。
结论、解释及化学方程式:_____________________________________________________________。
铝与酸碱的反应。
将两小片用砂纸打磨过的铝片分别放入两支洁净的试管中,再向试管分别加入盐酸和氢氧化钠各,观察现象。
实现现象:___________________________________________________________________。
结论、解释及化学方程式:__________________________________________________________________。
铝热反应。
两张滤纸折成漏斗状,其中一个底部剪一个孔,用水润湿后与另一个套在一起,使得四周都是四层。
将漏斗架在铁圈上,下面放置盛有细沙的蒸发皿。
混合均匀好的铝热剂,放在“纸漏斗”中,上面加少量氯酸钾,并在混合物中插入镁条。
用燃着的火柴点燃镁条。
实现现象:_____________________________________________。
结论、解释及化学方程式:______________________________________________________________________________________________________________________。
答案和解析
1.【答案】
【解析】和可组成铝热剂,属于混合物,其中铝作还原剂,铝热反应是放热反应。
2.【答案】
【解析】金属Mg、Al在稀盐酸中完全溶解,生成可溶的氯化物(MgCl2、AICl3),盐酸可能恰好反应,也可能剩余,向溶液中加入NaOH溶液,盐酸被中和,金属离子恰好沉淀,生成Mg(OH)2、Al(OH)3。
梳理本题物质变化思路:Mg→Mg2+→Mg(OH)2, Al→Al3+→Al(OH)3,生成沉淀的质量可由金属元素的质量加上沉淀中OH-的质量求得。而Mg2+、Al3+生成沉淀结合的OH-的物质的量正好是Mg、Al变成离子时失去电子的物质的量,而Mg、Al失去电子的物质的量正好是H+变成H2得到电子的物质的量。由2H+~2e-~H2,可求出得到电子的物质的量为2×=0.1 mol,故 Mg2+、Al3+生成沉淀结合的OH-的物质的量也是0.1 mol,质量为1.7g,故生成沉淀的质量为(m+1.7)g,故选A。
3.【答案】
【解析】由于是无色溶液,选项中有,选项中有,则不是正确选项;溶液与铝作用能放出氢气,溶液可以是酸性也可以是碱性,则选项错误选项酸性环境下,不生产,碱性条件下,离子可共存,故选C。
4.【答案】
【解析】项,将通入含的溶液中,不足,先氧化,离子方程式为;
项,与以物质的量之比:反应时,生成沉淀,以:反应时生成,所以的溶液和的溶液等体积均匀混合,离子方程式为,可理解为 消耗,生成,其中又消耗了,生成,所以与消耗的的物质的量之比为:;
项,过量通入溶液中,发生氧化还原反应,无法比较和的酸性强弱;
项,溶液与足量溶液反应的离子方程式为,酸式盐与碱反应生成正盐和水的说法不全面。
5.【答案】
【解析】思路:
等物质的量的两份分别在盐酸和溶液中完全反应,生成的物质的量相等时,
的消耗值大于的消耗值。
等物质的量的和分别与完全反应,盐酸中消耗的少,生成的也少。
。
若两份都完全反应,则生成的是甲:乙:,实际上甲: 乙
:,则盐酸中剩余,完全反应,要根据以及相关化学方程式计算盐
酸中生成的 。
因甲: 乙:和盐酸中生成 ,故溶液中生成的
。
根据 ,生成 要消耗。
。
6.【答案】
【解析】铝可以与烧碱溶液反应,而金属镁不能。
7.【答案】
【解析】
【分析】
本题考查了共价晶体的特征及判断方法,题目难度不大。
【解答】
共价晶体的特征是硬度大、熔点高,故B正确,而是两性氧化物属于物质分类,自然界中的刚玉有红宝石和蓝宝石是刚玉在自然界的存在形式,与晶体类型无关。
8.【答案】
【解析】
【分析】
已去除表面氧化膜的金属铝投入溶液中,铝先与水反应 ,氢氧化与强碱反应。
【解答】
A.铝含有金属键,铝单质参加反应,金属键破坏,故不选A;
B.水参与反应,水中共价键破坏,故不选B;
C.反应生成氢气,共价键形成,故不选C;
D.根据反应方程式,没有离子键的破坏和形成,故选D;
选D。
9.【答案】
【解析】错,点时酸未反应完,故溶液显酸性,、在酸性条件下发生氧化还原反应;
错,点时酸与氢氧化钠恰好完全反应,溶液中含有大量,会与发生相互促进的水解反应;
错,点与未完全反应,与发生相互促进的水解反应;
对,点时氢氧化铝与未完全反应,与、、、均不反应。
10.【答案】
【解析】根据题给信息分析,、、、四种元素分别为氢、氮、氧、铝。四种元素的原子半径铝最大,氢最小,氮、氧均为第周期元素,原子半径从左到右递减,故原子半径:铝氮氧氢,故A正确;氧没有最高正价,故B错误;非金属性越强,最简单气态氢化物越稳定,应是,故C错误;铝的盐溶液有铝盐与偏铝酸盐,铝盐溶液中通入过量,析出的氢氧化铝沉淀不溶于过量氨水,不会变澄清,且偏铝酸盐溶液中通入氨气不析出氢氧化铝沉淀,故D错误。
11.【答案】
【解析】铝土矿的主要成分是,电解铝的阴极和阳极材料均为碳,阳极需要定期更换,项正确;加入冰晶石和少量的目的是降低氧化铝的熔融温度,从而降低成本,项正确;氯化铝是共价化合物,熔融状态下不导电,无法电解,项错误;用石墨电极电解熔融氧化铝,阳极生成的氧气在高温条件下能氧化石墨生成,则冶炼过程中,阳极材料可能会因不断被消耗而需要定期更换,项正确。
12.【答案】
【解析】现代电解冶铝的工业生产耗电量很大,这是制约铝成为能源的重要因素。
13.【答案】
【解析】
【分析】本题考查了常见的合金及其应用,镁、铝的相关知识,试题难度较易
【解答】目前我国流通的硬币是由合金材料制成的,A正确;
B.制造照明弹利用了镁燃烧可发出耀眼的白光的性质,B正确;
C.常温下,铝能与空气中的氧气反应生成一层致密的氧化物薄膜,对内部金属起保护作用,C正确;
D.生铁含碳量高于普通钢和不锈钢,D错误。
14.【答案】
【解析】
【分析】钠的熔点较低,钠在空气中燃烧生成过氧化钠;
B.铝是地壳里含量最多的金属元素,铝和氧气反应生成一层致密是氧化物薄膜,阻止进一步反应;
C.我国使用最早的合金是青铜,钢是用量最大、用途最广的合金;
D.铁合金易发生电化学腐蚀.
本题主要考查了金属的性质方面的知识,掌握钠、铝、合金知识是解答关键,明确铝在空气中不需要特殊保护的原因,题目难度不大.
【解答】钠的熔点较低,所以在空气燃烧时先熔化,再燃烧,燃烧时生成淡黄色的,故A正确;
B.铝是地壳里含量最多的金属元素,铝是亲氧元素,极易在空气中形成了一薄层致密的氧化膜阻止了铝进一步反应,从而保护内层金属,不是铝不能与氧气反应,故B错误;
C.我国最早使用的合金是由铜、锡形成的青铜,目前世界上用途最广的合金是钢,如炊具、建筑材料等材料,故C正确;
D.铁合金易发生电化学腐蚀,氧化膜疏松,不能保护内层金属,易进一步氧化,应加防护措施,故D正确.
故选B.
15.【答案】
【解析】
【分析】
本题考查了金属元素化合物的性质与应用,题目难道不大,侧重于考查学生的分析能力和对基础知识的应用能力,注意把握、、、等金属元素单质及其化合物的性质。
【解答】
钠能与水和二氧化碳等反应,故钠着火通常用干沙土扑灭,正确;
明矾溶于水电离出的铝离子水解生成氢氧化铝胶体,具有净水的作用但是没有消毒的作用,错误;
打磨过的铝片在加热时也会迅速生成致密的氧化膜,加热熔化时不会滴落,错误;
铁遇到冷的浓硫酸发生钝化,可用铁制容器盛放和运输浓硫酸,正确;
青铜是铜锡合金、不锈钢是铁铬镍合金,硬铝是铝硅镁等形成的合金,三种物质都是合金,正确;
可与二氧化碳反应生成氧气,可用作呼吸面具的供氧剂,正确;
氧化铝熔点高,常用来制造耐火材料,正确;
钾元素的焰色反应必须通过蓝色钴玻璃滤掉钠的黄光才能观察到,所以焰色反应为黄色不一定没有钾元素,错误;
镁失电子生成镁离子,氟得电子生成氟离子,氟离子和镁离子通过离子键形成氯化镁,用电子式表示的形成过程为,错误;
故选:。
16.【答案】
;
【解析】
【分析】
本题考查金属与硝酸的反应、氧化还原反应、化学计算等知识点,属于中等难度试题,解答此题关键是判断出硝酸的还原产物以及电子转移守恒的运用。
【解答】
从图像可知,段加入氢氧化钠溶液无沉淀产生,说明溶液中有稀硝酸,铝粉和铁粉的混合物与一定量稀充分反应,被氧化为、,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又因硝酸的浓度越稀,对应的还原产物中氮元素的化合价越低,可以推测元素由变成了价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与发生了反应,则随着的滴加,发生的反应依次有: 段:, 段:,, 段:, 段:,再结合消耗的溶液的体积可知:,根据氧化还原反应,元素由价变为价,而金属都由价变为价,可以运用得失电子守恒得出金属的物质的量为:,则段消耗的溶液的体积为:,则段体积为,对应溶液中含有;,则;据此解答。
由上述分析可知,金属铁和稀硝酸反应生成硝酸铁、硝酸铵和水,反应的离子方程式为:;故答案为:;
由上述分析计算可知:;故答案为:;
由上述分析计算可知:点对应的沉淀的物质的量为;点对应的沉淀为氢氧化铁沉淀,根据铁元素守恒可知其物质的量为;故答案为:;;
由上述分析计算可知:点对应的氢氧化钠溶液的体积为,故答案为:。
17.【答案】化合态
;;具有强氧化性,能使蛋白质变性
烧杯、玻璃棒; ;
;在硫酸铜溶液中加入铝片,无明显现象,再加入不能加入盐酸,若反应明显加快了,说明判断正确。
【解析】
【分析】
本题考查了铁元素和铝元素相关知识涉及化学工艺流程、化学计算、元素化合物性质等知识,题目难度中等,掌握元素化合物的性质是关键,试题培养了学生灵活应用所学知识的能力。
【解答】
铁性质活泼,在自然界中,铁元素主要以化合态形式存在,
故答案为:化合态;
铁丝在氧气燃烧可生成四氧化三铁,故A不符合;
B.氯化铁和铁粉反应可生成氯化亚铁,故B不符合;
C.氢氧化亚铁不能通过化合反应制的,故C符合;
氢氧化亚铁、氧气和水化合生成氢氧化铁,故D不符合;
胶体分散质粒子的直径范围是;
该反应中是中从价升高到价,化合价升高被氧化,作还原剂,故选BC;
高铁酸钾能杀灭水中细菌的原因是:具有强氧化性,能使蛋白质变性;
配制一定质量分数的溶液时,溶解时需要烧杯、玻璃棒;
氯化铁和铜反应生成氯化亚铁和氯化铜,其离子方程式为: ;
溶液含物质的量,,最多可生成氯化铜物质的量,,在溶解铁物质的量,此时混合溶液中最少含铁物质的量,最终可被氧化成氯化铁,最终获得氯化铁溶液中的物质的量至少为;
铝与氯化铜溶液反应,与硫酸铜溶液都能发生置换反应,故A错误;
B. 氯化铜溶液酸性与同浓度的硫酸铜溶液酸性相同,故B错误;
C.生成物溶于水和都能溶于水,故 C错误;
D.金属铝的表面有一层致密的氧化物薄膜,氯化铝和硫酸铝阴离子的不同,氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能,故D正确;
设计简单实验如下:在硫酸铜溶液中加入铝片,无明显现象,再加入不能加入盐酸,若反应明显加快了,说明判断正确。
18.【答案】 ;
;
储存反应过程中排出的水;
否;
;
【解析】【解答】
钠和水反应生成氢氧化钠和氢气,离子方程式为: ;
因钠的密度比水小,比煤油大,钠与水接触时反应产生氢气,生成的气体将钠块带离水层,进入煤油层后,停止反应又下沉,如此往复,直至钠反应完全,反应过程中没有氧气,钠不可能燃烧,所以钠处于煤油和水的交界处上下浮动,生成氢气不溶于煤油和水,随反应的进行,形管右侧气体压强增大,煤油与胶塞处液面下降,左侧漏斗中液面上升;
故选:。
乙装置中漏斗在反应过程中的主要作用是储存反应过程中排出的水;
液体充满形管,反应过程中只产生氢气,点燃时不会发生爆炸,因而不需要检验氢气的纯度;
和反应产生的同时产生,可以和发生反应继续放出氢气,
,故产生的的体积较大。
19.【答案】发出耀眼的白光,产生大量热;铝粉与氧气反应:;
两支试管中,铝片均逐渐溶解,同时放出气泡;铝与盐酸、反应:、;
镁条剧烈燃烧,引发纸漏斗中反应,纸漏斗被烧穿,有熔融物落到盛有细沙的蒸发皿上;铝在高温条件下能还原铁的氧化物:。
【解析】略
第1页,共1页
