专题4《分子空间结构与物质性质》测试题(含解析)2022--2023学年下学期高二化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题4《分子空间结构与物质性质》测试题(含解析)2022--2023学年下学期高二化学苏教版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 480.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-23 00:00:00 | ||
图片预览




文档简介
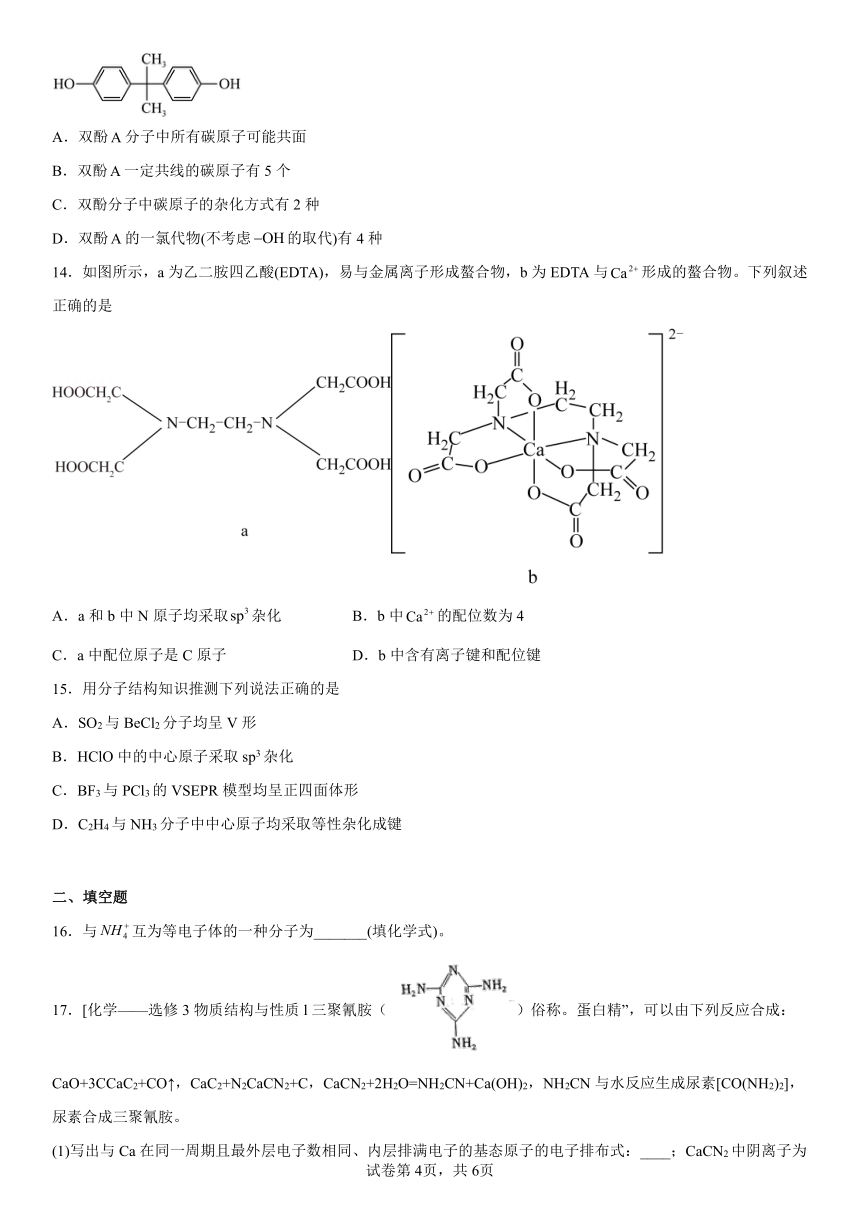
专题4《分子空间结构与物质性质》测试题
一、单选题
1.在氮气气氛保护下,向一定量的FeCl2溶液中逐滴加入一定量的NaBH4溶液,可制得纳米铁粉。下列有关说法正确的是
A.氮气的电子式为
B.中子数为20的氯原子可表示为Cl
C.基态Fe2+离子外围排布式为3d54s1
D.BH中的配位键由B原子提供空轨道
2.碳化硅晶体具有多种结构,其中一种晶体的晶胞(如图所示)与金刚石的类似。下列判断不正确的是
A.该晶体属于分子晶体 B.该晶体中只存在极性键
C.该晶体中Si的化合价为 D.该晶体中C的杂化类型为
3.硝基胍的结构简式如图所示(“→”是一种特殊的共价单键,属于σ键)。下列说法正确的是
A.硝基胍分子中只含极性键,不含非极性键
B.原子间只能形成σ键
C.硝基胍分子中σ键与π键的个数比是5:1
D.10.4g硝基胍中含有11×6.02×1023个原子
4.钠着火不能用水扑灭的原因是2Na+2H2O=2NaOH+H2↑,下列说法正确的是
A.NaOH中只有离子键 B.H2O为极性分子
C.O结构示意图为 D.NaOH电子式为
5.下列有关分子与晶体的说法正确的是
A.金刚石、氮化硼、C60熔化需克服的作用力类型相同
B.晶体中有阴离子,必有阳离子;反之晶体中有阳离子,也必有阴离子
C.钋单质为简单立方堆积,则晶胞中钋原子配位数为6
D.COS 与CO2互为等电子体,故COS 是直线形的非极性分子
6.下列说法中正确的是
A.C-H键比Si-H键的键长更短,故CH4比SiH4更稳定
B.只有非金属原子之间才能形成共价键
C.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混杂形成
D.分子中共价键的键能越大,分子的熔、沸点越高
7.化学式为的笼形包合物基本结构如图所示(H原子未画出)。与连接形成平面层,两个平面层通过分子连接,中间的空隙填充苯分子。下列说法正确的是
A.
B.该结构不是晶胞结构单元
C.结构中N原子均参与形成配位键
D.半数与C原子配位,且所有的配位数相同
8.在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这个碳原子称为“手性碳原子”凡是只有一个手性碳原子物质一定具有光学活性,物质 有光学活性,发生下列反应后无光学活性的是
A.与新制的Cu(OH)2作用 B.与甲酸发生酯化反应
C.与NaOH水溶液共热 D.在催化剂存在下与H2加成
9.我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)Cl(用R代表),经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。从结构角度分析,R中两种阳离子不同之处为
A.中心原子的VSEPR模型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型
10.科研人员研究发现、SO3、、HNO2、H2O等粒子参与雾霾粒中硫酸盐的生成过程。下列说法正确的是
A.基态硫原子核外电子有9种不同运动状态
B.SO3的空间构型是平面三角形
C.反应过程中既有非极性键的断裂也有非极性键的形成
D.HNO2中O-N-O键角为120°
11.下列说法不正确的是
①N2H4分子中既含极性键又含非极性键
②若R2-和M+的电子层结构相同,则原子序数:R>M
③F2、Cl2、Br2、I2熔点随相对分子质量的增大而升高
④NCl3、PCl3、CO2、CS2分子中各原子均达到8e-稳定结构
⑤固体熔化成液体的过程是物理变化,所以不会破坏化学键
⑥HF分子很稳定是由于HF分子之间能形成氢键
⑦由于非金属性:Cl>Br>I,所以酸性:HCl>HBr>HI
A.②⑤⑥⑦ B.①③⑤ C.②④⑤ D.③⑤⑦
12.连花清瘟胶囊用于治疗流行性感冒,其主要成分的结构简式如图。下列关于该有机物的说法错误的是
A.分子中有1个手性碳原子
B.1 mol该有机化合物消耗Na与NaOH的物质的量之比3∶2
C.键角:α<β
D.分子中共平面的碳原子最少有7个
13.双酚(如图)是制作粘合剂胶的主要原料之一、下列说法正确的是
A.双酚分子中所有碳原子可能共面
B.双酚一定共线的碳原子有5个
C.双酚分子中碳原子的杂化方式有2种
D.双酚的一氯代物(不考虑的取代)有4种
14.如图所示,a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物,b为EDTA与形成的螯合物。下列叙述正确的是
A.a和b中N原子均采取杂化 B.b中的配位数为4
C.a中配位原子是C原子 D.b中含有离子键和配位键
15.用分子结构知识推测下列说法正确的是
A.SO2与BeCl2分子均呈V形
B.HClO中的中心原子采取sp3杂化
C.BF3与PCl3的VSEPR模型均呈正四面体形
D.C2H4与NH3分子中中心原子均采取等性杂化成键
二、填空题
16.与互为等电子体的一种分子为_______(填化学式)。
17.[化学——选修3物质结构与性质l三聚氰胺()俗称。蛋白精”,可以由下列反应合成:CaO+3CCaC2+CO↑,CaC2+N2CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:____;CaCN2中阴离子为,与互为等电子体的分子有N2O和_____(填化学式),由此可以推知的空间构型为____。
(2)三聚氰胺中氮原子的杂化方式有__________ 。
(3)一些不法商家常在牛奶中加入三聚氰胺和三聚氰酸来提高“蛋白质”的含量,人在摄入三聚氰胺和三聚氰酸()后,两者之间易通过__________结合,在肾脏内易形成结石。
(4)钙的氧化物有CaO和CaO2两种,其晶胞结构如下图所示,CaO晶体中Ca2+的配位数为_____,Ca2+采取的堆积方式为______。已知CaO2密度是ρg·cm-3,晶胞结构如图所示,则CaO2晶胞中距离最近的两个钙离子间的距离为____cm(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(5)配位化合物K3[ Fe( CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n=__________。
18.As与N同主族,N原子之间可以形成π键,而As原子之间较难形成π键。从原子结构角度分析,其原因为_______。
19.原子结构与性质
(1)元素As与N同族。As的氢化物沸点比NH3的___(填“高”或“低”),其判断理由是______。
(2)铜原子在基态时的价电子排布式为______。
(3)Fe是人体需要补充的元素之一,试写出Fe2+的核外电子排布式:_____。与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能的大小关系____。某同学所画基态镁原子的核外电子排布图如图,该同学所画的电子排布图违背了______。
(4)K元素处于元素周期表的____区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级有____个。
20.①NH3 ②CO2 ③SiCl4 ④BF3 ⑤C2H4 ⑥H2O2 ⑦Cl2 ⑧P4 ⑨H2S
(1)含极性共价键的非极性分子___________(填序号,下同)
(2)含非极性共价键的非极性分子___________
(3)含极性共价键的极性分子___________
(4)①NH3中心原子杂化方式___________分子的空间构型___________
(5)④BF3中心原子杂化方式___________分子的空间构型___________
21.某物质可溶于水、乙醇,熔点为,其结构简式如图所示,根据该物质结构回答下列问题:
(1)元素在周期表的位置_______,原子的核外电子排布式为_______,元素位于周期表的_______区。
(2)图中结构中原子的杂化方式为_______;最外层达到电子稳定结构的原子有_______个;。键和键的个数比为_______
(3)该物质的晶体类型为_______,该有机物可溶于水的原因是_______。
22.已知下列数据:
物质 熔点/K 沸点/K 分解温度/K
NH3 195.3 239.7 1073
PH3 139.2 185.4 713.2
NH3的熔、沸点均高于PH3的原因是___________;PH3的分解温度高于其沸点,其原因是___________。
23.写出下列反应的化学方程式
(1)溶于氨水的反应_______
(2)苯与丙烯在催化剂作用下反应生成异丙苯:_______
24.A、B、C、D、E五种元素的原子序数依次增大,其中非金属元素A 的基态原子中成对电子数是未成时电子数的两倍,C元素在地壳中含量最高,D的单质是短周期中熔点最低的金属,E 的合金是我国使用最早的合金。
(1)E元素的基态原子电子排布式为___________。
(2)A 的某种氢化物A2H2分子中含有________个σ键和_____个π键。
(3)B 的最简单的氢化物的沸点比A 的最简单的氢化物的沸点高得多,其原因是_______。
(4) E 的最高价氧化物对应的水化物溶解于氨水中生成的复杂化合物的化学式是_______。
25.回答下列小题
(1)第四周期的元素的基态原子的电子排布中4s轨道只有1个电子的元素有_______(填元素名称)。
(2)写出Cr3+的价层电子排布式_______。
(3)Fe3+的化学性质比Fe2+稳定,其原因是_______。
(4)三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是_______,中心离子的配位数为_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.氮气的电子式为,A错误;
B.质量数等于质子数加中子数,故中子数为20的氯原子可表示为Cl,B错误;
C.基态Fe2+离子外围排布式为3d6,C错误;
D.BH中的配位键由B原子提供空轨道,H-提供孤电子对,D正确;
故答案为:D。
2.A
【详解】A.碳化硅晶体属于原子晶体,故A错误;
B.该晶体中只存在极性键(C-Si),故B正确;
C.C的非金属性大于Si,所以该晶体中Si的化合价为,故C正确;
D.该晶体中,每个C原子与4个Si原子形成4个σ键,C原子无孤电子对,C的杂化类型为,故D正确;
选A。
3.C
【详解】A.分子中键为非极性键,A错误;
B.N原子间可以形成键和键,B错误;
C.分子中含有4个键、1个键、1个键、2个键、1个键和1个键,键与键的个数比是,C正确;
D.硝基胍的分子式为,相对分子质量为104,该物质的物质的量为,含有个原子,D错误;
故选C。
4.B
【详解】A.NaOH中Na+与OH-之间为离子键,O与H之间为共价键,A错误;
B.水分子为V形结构,正负电荷中心不重合,为极性分子,B正确;
C.氧原子结构示意图为,C错误;
D.NaOH为离子化合物,Na+与OH-之间通过离子键结合,电子式为,D错误;
故选B。
5.C
【详解】A.金刚石、氮化硼是原子晶体,熔化时破坏共价键,C60是分子晶体,熔融时破坏分子间作用力,所以克服作用力类型不同,故A错误;
B.晶体中有阳离子,未必一定有阴离子,如在金属晶体中,存在金属阳离子和自由移动的电子,不存在阴离子,故B错误;
C.钋单质为简单立方堆积,晶胞图为,其配位数是6,故C正确;
D.COS 与CO2互为等电子体,COS分子电子式为,电荷的分布是不均匀、不对称的,正负电荷的重心不重合,是由极性键形成的极性分子,故D错误;
答案为C。
6.A
【详解】A.C与Si位于同一主族原子半径CB.AlCl3为分子晶体,Al为金属原子,B错误;
C.CH4分子中的sp3杂化轨道是中心原子C的2s轨道和C原子的3个2p轨道混杂形成,C错误;
D.分子中的共价键键能决定分子的稳定性,为化学性质,分子的熔沸点由分子间作用力决定,D错误;
故答案选A。
7.B
【详解】A.根据“均摊法”,该结构中的个数为,的个数为,的个数为1,则,A错误;
B.该结构前后、左右平置时,不能重复,故不是晶胞结构单元,B正确;
C.结构中中C原子提供孤电子对,与镍的空轨道形成配位键,中氮没有参与形成配位键,C错误;
D.由图可知,每个镍离子与4个形成配位键,但不是所有镍离子都与形成配位键,故不是所有的配位数相同,D错误;
故选B。
8.C
【详解】A.与新制的Cu(OH)2作用,醛基被氧化为羧基,C原子连接的4个原子或原子团不同,仍具有光学活性,A错误;
B.与甲酸发生酯化反应,生成-CH2OOCH,C原子连接的4个原子或原子团不同,仍具有光学活性,B错误;
C.与NaOH水溶液共热,酯基水解,得到2个- CH2OH,则不具有光学活性,C正确;
D.-CHO与氢气发生加成生成-CH2OH但是不连接在同一个C上,具有光学活性,D错误;
答案选C。
9.C
【详解】R中两种阳离子分别是H3O+、NH,二者的中心原子的VSEPR模型都是四面体形,中心原子的价层电子对数都是4,都是共价键,H3O+、NH的空间结构分别为三角锥形、正四面体形。
10.B
【详解】A.原子核外没有两个运动状态完全相同的电子,有几个电子就有几种运动状态,硫原子核外有16个电子,所以有16种不同状态,A项错误;
B.SO3中含有3个键,孤电子对数是0,所以价层电子对数是3,空间构型为平面三角形,B项正确;
C.非极性键由同种原子构成,这些粒子中均没有非极性键,因此反应过程中无非极性键的断裂,C项错误;
D.HNO2中,N原子的价层电子对数为2+=3,为sp2杂化类型且有一个孤电子对,由于孤电子对对成键电子对的排斥作用,导致键角小于120°,D项错误;
故选B。
11.A
【详解】①N2H4分子中N原子之间形成非极性共价键,N原子和H原子之间形成极性共价键,①正确;
②若R2-和M+的电子层结构相同,则M处于R的下一周期,所以原子序数:M>R,②错误;
③F2、Cl2、Br2、I2的组成和结构相似,熔点随相对分子质量的增大而升高,③正确;
④NCl3、PCl3、CO2、CS2分子中各原子均满足最外层电子数+|化合价|=8,则均达到8e-稳定结构,④正确;
⑤固体熔化成液体的过程是物理变化,但可能破坏化学键,例如氢氧化钠熔化时离子键被破坏,⑤错误;
⑥HF分子很稳定,是因为H-F键键能大,与分子间氢键无关,⑥错误;
⑦元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,但氢化物的酸性变化无此规律,酸性:HCl>HBr>HI,⑦错误。
综合以上分析,②⑤⑥⑦不正确,故选A。
12.C
【详解】A.连接四个不同原子或原子团的碳原子是手性碳原子,该分子中与苯环直接相连的碳原子是手性碳原子,就1个,A正确;
B.酚羟基、醇羟基和羧基均能与Na反应,酚羟基和羧基能与NaOH反应,故1 mol该有机化合物消耗3molNa,或消耗2molNaOH,二者物质的量之比3∶2,B正确;
C.该分子中,α角的C和β角的O都是sp3杂化,该C没有孤电子对,该O有2对孤电子对,由于孤电子对对成键电子对的排斥作用大于成键电子对与成键电子对的排斥,故键角:α>β,C错误;
D.苯环碳原子和取代苯环上的氢的碳原子在同一平面上,故该分子中共平面的碳原子最少有7个,D正确;
故选C。
13.C
【详解】A.与2个苯环相连的C为四面体结构,则所有碳不能共面,故A错误;
B.苯环是平面正六边形结构,饱和碳原子是四面体结构,则双酚一定共线的碳原子有3个,故B错误;
C.双酚分子中碳原子的杂化方式有2种,即苯环上碳原子是sp2杂化,饱和碳原子是sp3杂化,故C正确;
D.双酚结构对称,其一氯代物(不考虑的取代)有3种,其中苯环上两种,甲基上一种,故D错误;
故选C。
14.A
【详解】A.a中N原子有3对键电子对,1对孤电子对,b中N原子有4对键电子对,没有孤电子对,则a、b中N原子均采取杂化,A正确;
B.b为配离子,提供孤电子对的有2个N原子和4个O原子,所以的配位数为6,B错误;
C.a不是配合物,C错误;
D.与N、O之间形成配位键,其他原子之间形成共价键,b中不含离子键,D错误;
故选A。
15.B
【详解】A.BeCl2分子中,中心Be原子发生sp杂化,分子呈直线形,A不正确;
B.HClO的中心O原子价电子对数为4,采取sp3杂化,B正确;
C.BF3的中心B原子价电子对数为3,VSEPR模型呈平面三角形,C不正确;
D.C2H4的中心C原子形成3个σ键(sp2杂化轨道)和1个π键(轨道未参与杂化),NH3分子中心原子形成3个σ键(sp3杂化轨道)、另有1对所在轨道参与杂化的孤对电子,D不正确;
故选B。
16.CH4或SiH4
【详解】等电子题是指价电子数和原子数相同的分子、离子或原子团等,采用“同族替换,左右移位”的方法寻找等等电子体,所以与互为等电子体的分子是CH4或SiH4。
17.(1) 1s22s22p63s23p63d104s2或[Ar]3d104s2 CO2 直线型
(2)sp2、sp3
(3)分子间氢键
(4) 6 面心立方最密堆积
(5)6
【详解】(1)与Ca在同一周期且最外层电子数相同、内层排满电子的元素是30号元素Zn,其基态原子的电子排布式是1s22s22p63s23p63d104s2或[Ar]3d104s2;CaCN2中阴离子为,与互为等电子体的分子有N2O和CO2。由于等电子体结构相似,所以由此可以推知的空间构型为直线型。答案为1s22s22p63s23p63d104s2或[Ar]3d104s2;CO2;直线型;
(2)在三聚氰胺中氮原子的杂化方式有六元环上的N原子是sp2杂化;氨基的氮原子是sp3杂化。答案为sp2、sp3;
(3)由于N原子半径小,元素的非金属性强,分子内容易形成氢键;在肾脏内易形成结石。答案为分子间氢键;
(4)根据CaO的结构可知,早晶胞中每个Ca2+周围有6个O2-,配位数是6;根据晶体结构可知Ca2+采取的堆积方式为面心立方最密堆积;在CaO2晶体的一个晶胞中含有Ca2+:8×1/8+6×1/2=4;含有O22-:12×1/4+1=4。即一个晶胞中含有4个CaO2。晶胞中最近的两个Ca2+的距离为在晶胞面对角线的一半。假设晶胞的边长为a,则,所以,则晶胞中最近的两个Ca2+的距离为L=。答案为;
(5)配位化合物K3[ Fe( CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,铁原子的最外层电子数是2,一个配位体可提供2个电子,所以若铁原子和配体提供电子数之和为14,n=6。答案为6。
18.As原子半径大,形成的σ键长,p-p轨道肩并肩重叠很少或几乎不重叠
【详解】As原子半径大于N原子,则As原子与As原子形成的单键键长较长,导致p-p轨道形成肩并肩的电子云重叠很少或几乎不重叠,故不易形成键。
19. 低 氨气分子之间存在氢键,AsH3分子间为范德华力 3d104s1 1s22s22p63s23p63d6 Na<Al<Mg 能量最低原理 s 4
【分析】(1)氨气分子之间存在氢键,AsH3分子间为范德华力,氢键比较范德华力更强;
(2)核外电子排布式的书写要注意洪特规则的特例。Cu是29号元素;
(3)铁元素为26号元素,失去2电子后形成Fe2+;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,Na、Mg、Al属于同一周期元素;电子应优先排列在3s能级;
(4)K元素处于元素周期表的s 区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级为ns能级。
【详解】(1)氨气分子之间存在氢键,AsH3分子间为范德华力,氢键比较范德华力更强,故AsH3的沸点比较NH3的低;
(2)Cu是29号元素,核外电子排布时还要遵循洪特规则的特例,故价电子排布式是3d104s1;
(3)铁元素为26号元素,其核外电子排布为1s22s22p63s23p63d6 4s2,失去2电子后形成Fe2+,故Fe2+的核外电子排布为:1s22s22p63s23p63d6;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,故Na、Mg、Al基态原子第一电离能的大小关系是 Na<Al<Mg;电子应优先排列在3s能级,违反了能量最低原理;
(4)K元素处于元素周期表的s 区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级为ns能级,分别是1s、2s、3s、4s,即核外电子占据的电子云轮廓图为球形的能级有4个。
【点睛】常见易形成氢键的化合物:H2O、HF、NH3等,分子间氢键:①同种分子间使得物质的熔沸点升高;②不同种分子间:例如 NH3与H2O之间。所以这就导致了氨气在水中的惊人溶解度:1体积水中可溶解700体积氨气;分子内氢键:某些分子内,例如HNO3、邻硝基苯酚分子可以形成分子内氢键,分子内氢键使物质熔沸点降低。
20.(1)②③④⑤
(2)⑤⑦⑧
(3)①⑥⑨
(4) sp3 三角锥
(5) sp2 平面三角形
【分析】NH3中存在N-H键,CO2中存在C=O键,SiCl4中存在Si-Cl键,BF3中存在B-F键,C2H4中存在C=C非极性共价键和C-H键,H2O2中存在O-O非极性共价键和O-H键,Cl2中存在Cl-Cl非极性共价键,P4为正四面体结构存在P-P非极性共价键,H2S中存在H-S键,据此答题。
(1)
含极性共价键的非极性分子为CO2、SiCl4、BF3、C2H4,符合条件的非极性分子为②③④⑤;
(2)
含非极性共价键的非极性分子为C2H4、Cl2、P4,符合条件的含非极性共价键的非极性分子为⑤⑦⑧;
(3)
含极性共价键的极性分子为NH3、H2O2、H2S,符合条件的含极性共价键的极性分子为①⑥⑨;
(4)
①NH3中价层电子对数为4,孤电子对数为1,则NH3中心原子杂化方式sp3;
②由于受孤电子对的影响NH3分子的空间构型为三角锥形;
(5)
①BF3中价层电子对数为3,孤电子对数为0,则BF3中心原子杂化方式为sp2;
②孤电子对数为0,则BF3分子的空间构型为平面三角形。
21. 第周期第族 和杂化 分子晶体 分子中能与水形成分子间氢键
【详解】(1)元素在周期表的位置为第周期第族,原子的核外电子排布式为,元素位于周期表的区;
(2)形成键的原子的杂化方式为杂化,形成键的C原子的杂化方式为;该分子中,所有的N、C原子的最外层均达到电子稳定结构,共6个原子;两原子间形成的共价双键或三键,有且只有一个是键,则键和键的个数比为;
(3)该物质可溶于水、乙醇,熔点较低,则该物质的晶体类型为分子晶体,该有机物分子中能与水形成分子间氢键,故其可溶于水。
22. NH3分子之间能形成氢键 PH3分解需要破坏 P—H 键,PH3汽化需要破坏分子间作用力,而化学键比分子间作用力大得多,所以PH3的分解温度高于其沸点
【详解】NH3分子之间形成氢键,熔沸点高于PH3;PH3的分解温度高于其沸点,其原因是:PH3分解需要破坏 P—H 键,PH3汽化需要破坏分子间作用力,而化学键比分子间作用力大得多,所以PH3的分解温度高于其沸点。
23.(1)
(2)+CH2=CHCH3
【解析】(1)
溶于氨水生成氢氧化四氨合铜,故化学方程式为。
(2)
苯与丙烯在催化剂作用下发生加成反应生成异丙苯,化学方程式为+CH2=CHCH3。
24. ls22s22p63s23p63d104s1 3 2 氨分子间丁以形成氢键而甲烷分子间不能,所以氨的沸点比甲烷高 [Cu(NH3)4](OH)2
【详解】考查电子排布式的书写、化学键数目的判断、熔沸点高低的判断、配合物化学式的书写,非金属元素A 的基态原子中成对电子数是未成时电子数的两倍,基态A原子的电子排布式为1s22s22p2,即A为C,C元素在地壳中含量最高的,即C为O,因为原子序数依次增大,因此B为N,D的单质是短周期中熔点最低的金属,即D为Na,E的合金是我国使用最早的合金,即E为Cu,(1)Cu位于第四周期IB族,基态Cu原子电子排布式为ls22s22p63s23p63d104s1;(2)此分子式为C2H2,碳碳之间以叁键的形式结合,因此含有σ键个数为3个,π键个数为2;(3)B的简单氢化物是NH3,A的简单氢化物是CH4,NH3分子间存在氢键,CH4分子间不存在氢键,因此NH3的沸点比甲烷高;(4)Cu的最高价氧化物对应水化物是Cu(OH)2,溶解于氨水,生成[Cu(NH3)4](OH)2。
25.(1)钾、铬、铜
(2)3d3
(3)Fe3+的3d轨道填充了5个电子,为半充满状态
(4) N、O、Cl 6
【详解】(1)4s轨道只有1个电子,价电子排布为4s1或3d54s1、3d104s1,符合条件的元素有钾、铬、铜,故答案为:钾、铬、铜;
(2)Cr原子核外电子排布式为1s22s22p63s23p63d54s1,失去4s能级1个电子、3d能级2个电子形成Cr3+,基态Cr3+的价层电子电子排布式为3d3,故答案为:3d3;
(3)Fe3+的3d轨道填充了5个电子,为半充满状态,化学性质比Fe2+稳定,故答案为:Fe3+的3d轨道填充了5个电子,为半充满状态;
(4)[Cr(NH3)3(H2O)2Cl]2+中,N、O、Cl均含有孤电子对,均提供孤电子形成配位键,中心离子的配体是NH3、H2O,NH3、H2O、Cl的个数就是其配位数,所以配位数是6,故答案为:N、O、Cl;6。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.在氮气气氛保护下,向一定量的FeCl2溶液中逐滴加入一定量的NaBH4溶液,可制得纳米铁粉。下列有关说法正确的是
A.氮气的电子式为
B.中子数为20的氯原子可表示为Cl
C.基态Fe2+离子外围排布式为3d54s1
D.BH中的配位键由B原子提供空轨道
2.碳化硅晶体具有多种结构,其中一种晶体的晶胞(如图所示)与金刚石的类似。下列判断不正确的是
A.该晶体属于分子晶体 B.该晶体中只存在极性键
C.该晶体中Si的化合价为 D.该晶体中C的杂化类型为
3.硝基胍的结构简式如图所示(“→”是一种特殊的共价单键,属于σ键)。下列说法正确的是
A.硝基胍分子中只含极性键,不含非极性键
B.原子间只能形成σ键
C.硝基胍分子中σ键与π键的个数比是5:1
D.10.4g硝基胍中含有11×6.02×1023个原子
4.钠着火不能用水扑灭的原因是2Na+2H2O=2NaOH+H2↑,下列说法正确的是
A.NaOH中只有离子键 B.H2O为极性分子
C.O结构示意图为 D.NaOH电子式为
5.下列有关分子与晶体的说法正确的是
A.金刚石、氮化硼、C60熔化需克服的作用力类型相同
B.晶体中有阴离子,必有阳离子;反之晶体中有阳离子,也必有阴离子
C.钋单质为简单立方堆积,则晶胞中钋原子配位数为6
D.COS 与CO2互为等电子体,故COS 是直线形的非极性分子
6.下列说法中正确的是
A.C-H键比Si-H键的键长更短,故CH4比SiH4更稳定
B.只有非金属原子之间才能形成共价键
C.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混杂形成
D.分子中共价键的键能越大,分子的熔、沸点越高
7.化学式为的笼形包合物基本结构如图所示(H原子未画出)。与连接形成平面层,两个平面层通过分子连接,中间的空隙填充苯分子。下列说法正确的是
A.
B.该结构不是晶胞结构单元
C.结构中N原子均参与形成配位键
D.半数与C原子配位,且所有的配位数相同
8.在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这个碳原子称为“手性碳原子”凡是只有一个手性碳原子物质一定具有光学活性,物质 有光学活性,发生下列反应后无光学活性的是
A.与新制的Cu(OH)2作用 B.与甲酸发生酯化反应
C.与NaOH水溶液共热 D.在催化剂存在下与H2加成
9.我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)Cl(用R代表),经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。从结构角度分析,R中两种阳离子不同之处为
A.中心原子的VSEPR模型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型
10.科研人员研究发现、SO3、、HNO2、H2O等粒子参与雾霾粒中硫酸盐的生成过程。下列说法正确的是
A.基态硫原子核外电子有9种不同运动状态
B.SO3的空间构型是平面三角形
C.反应过程中既有非极性键的断裂也有非极性键的形成
D.HNO2中O-N-O键角为120°
11.下列说法不正确的是
①N2H4分子中既含极性键又含非极性键
②若R2-和M+的电子层结构相同,则原子序数:R>M
③F2、Cl2、Br2、I2熔点随相对分子质量的增大而升高
④NCl3、PCl3、CO2、CS2分子中各原子均达到8e-稳定结构
⑤固体熔化成液体的过程是物理变化,所以不会破坏化学键
⑥HF分子很稳定是由于HF分子之间能形成氢键
⑦由于非金属性:Cl>Br>I,所以酸性:HCl>HBr>HI
A.②⑤⑥⑦ B.①③⑤ C.②④⑤ D.③⑤⑦
12.连花清瘟胶囊用于治疗流行性感冒,其主要成分的结构简式如图。下列关于该有机物的说法错误的是
A.分子中有1个手性碳原子
B.1 mol该有机化合物消耗Na与NaOH的物质的量之比3∶2
C.键角:α<β
D.分子中共平面的碳原子最少有7个
13.双酚(如图)是制作粘合剂胶的主要原料之一、下列说法正确的是
A.双酚分子中所有碳原子可能共面
B.双酚一定共线的碳原子有5个
C.双酚分子中碳原子的杂化方式有2种
D.双酚的一氯代物(不考虑的取代)有4种
14.如图所示,a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物,b为EDTA与形成的螯合物。下列叙述正确的是
A.a和b中N原子均采取杂化 B.b中的配位数为4
C.a中配位原子是C原子 D.b中含有离子键和配位键
15.用分子结构知识推测下列说法正确的是
A.SO2与BeCl2分子均呈V形
B.HClO中的中心原子采取sp3杂化
C.BF3与PCl3的VSEPR模型均呈正四面体形
D.C2H4与NH3分子中中心原子均采取等性杂化成键
二、填空题
16.与互为等电子体的一种分子为_______(填化学式)。
17.[化学——选修3物质结构与性质l三聚氰胺()俗称。蛋白精”,可以由下列反应合成:CaO+3CCaC2+CO↑,CaC2+N2CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:____;CaCN2中阴离子为,与互为等电子体的分子有N2O和_____(填化学式),由此可以推知的空间构型为____。
(2)三聚氰胺中氮原子的杂化方式有__________ 。
(3)一些不法商家常在牛奶中加入三聚氰胺和三聚氰酸来提高“蛋白质”的含量,人在摄入三聚氰胺和三聚氰酸()后,两者之间易通过__________结合,在肾脏内易形成结石。
(4)钙的氧化物有CaO和CaO2两种,其晶胞结构如下图所示,CaO晶体中Ca2+的配位数为_____,Ca2+采取的堆积方式为______。已知CaO2密度是ρg·cm-3,晶胞结构如图所示,则CaO2晶胞中距离最近的两个钙离子间的距离为____cm(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(5)配位化合物K3[ Fe( CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n=__________。
18.As与N同主族,N原子之间可以形成π键,而As原子之间较难形成π键。从原子结构角度分析,其原因为_______。
19.原子结构与性质
(1)元素As与N同族。As的氢化物沸点比NH3的___(填“高”或“低”),其判断理由是______。
(2)铜原子在基态时的价电子排布式为______。
(3)Fe是人体需要补充的元素之一,试写出Fe2+的核外电子排布式:_____。与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能的大小关系____。某同学所画基态镁原子的核外电子排布图如图,该同学所画的电子排布图违背了______。
(4)K元素处于元素周期表的____区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级有____个。
20.①NH3 ②CO2 ③SiCl4 ④BF3 ⑤C2H4 ⑥H2O2 ⑦Cl2 ⑧P4 ⑨H2S
(1)含极性共价键的非极性分子___________(填序号,下同)
(2)含非极性共价键的非极性分子___________
(3)含极性共价键的极性分子___________
(4)①NH3中心原子杂化方式___________分子的空间构型___________
(5)④BF3中心原子杂化方式___________分子的空间构型___________
21.某物质可溶于水、乙醇,熔点为,其结构简式如图所示,根据该物质结构回答下列问题:
(1)元素在周期表的位置_______,原子的核外电子排布式为_______,元素位于周期表的_______区。
(2)图中结构中原子的杂化方式为_______;最外层达到电子稳定结构的原子有_______个;。键和键的个数比为_______
(3)该物质的晶体类型为_______,该有机物可溶于水的原因是_______。
22.已知下列数据:
物质 熔点/K 沸点/K 分解温度/K
NH3 195.3 239.7 1073
PH3 139.2 185.4 713.2
NH3的熔、沸点均高于PH3的原因是___________;PH3的分解温度高于其沸点,其原因是___________。
23.写出下列反应的化学方程式
(1)溶于氨水的反应_______
(2)苯与丙烯在催化剂作用下反应生成异丙苯:_______
24.A、B、C、D、E五种元素的原子序数依次增大,其中非金属元素A 的基态原子中成对电子数是未成时电子数的两倍,C元素在地壳中含量最高,D的单质是短周期中熔点最低的金属,E 的合金是我国使用最早的合金。
(1)E元素的基态原子电子排布式为___________。
(2)A 的某种氢化物A2H2分子中含有________个σ键和_____个π键。
(3)B 的最简单的氢化物的沸点比A 的最简单的氢化物的沸点高得多,其原因是_______。
(4) E 的最高价氧化物对应的水化物溶解于氨水中生成的复杂化合物的化学式是_______。
25.回答下列小题
(1)第四周期的元素的基态原子的电子排布中4s轨道只有1个电子的元素有_______(填元素名称)。
(2)写出Cr3+的价层电子排布式_______。
(3)Fe3+的化学性质比Fe2+稳定,其原因是_______。
(4)三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是_______,中心离子的配位数为_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.氮气的电子式为,A错误;
B.质量数等于质子数加中子数,故中子数为20的氯原子可表示为Cl,B错误;
C.基态Fe2+离子外围排布式为3d6,C错误;
D.BH中的配位键由B原子提供空轨道,H-提供孤电子对,D正确;
故答案为:D。
2.A
【详解】A.碳化硅晶体属于原子晶体,故A错误;
B.该晶体中只存在极性键(C-Si),故B正确;
C.C的非金属性大于Si,所以该晶体中Si的化合价为,故C正确;
D.该晶体中,每个C原子与4个Si原子形成4个σ键,C原子无孤电子对,C的杂化类型为,故D正确;
选A。
3.C
【详解】A.分子中键为非极性键,A错误;
B.N原子间可以形成键和键,B错误;
C.分子中含有4个键、1个键、1个键、2个键、1个键和1个键,键与键的个数比是,C正确;
D.硝基胍的分子式为,相对分子质量为104,该物质的物质的量为,含有个原子,D错误;
故选C。
4.B
【详解】A.NaOH中Na+与OH-之间为离子键,O与H之间为共价键,A错误;
B.水分子为V形结构,正负电荷中心不重合,为极性分子,B正确;
C.氧原子结构示意图为,C错误;
D.NaOH为离子化合物,Na+与OH-之间通过离子键结合,电子式为,D错误;
故选B。
5.C
【详解】A.金刚石、氮化硼是原子晶体,熔化时破坏共价键,C60是分子晶体,熔融时破坏分子间作用力,所以克服作用力类型不同,故A错误;
B.晶体中有阳离子,未必一定有阴离子,如在金属晶体中,存在金属阳离子和自由移动的电子,不存在阴离子,故B错误;
C.钋单质为简单立方堆积,晶胞图为,其配位数是6,故C正确;
D.COS 与CO2互为等电子体,COS分子电子式为,电荷的分布是不均匀、不对称的,正负电荷的重心不重合,是由极性键形成的极性分子,故D错误;
答案为C。
6.A
【详解】A.C与Si位于同一主族原子半径C
C.CH4分子中的sp3杂化轨道是中心原子C的2s轨道和C原子的3个2p轨道混杂形成,C错误;
D.分子中的共价键键能决定分子的稳定性,为化学性质,分子的熔沸点由分子间作用力决定,D错误;
故答案选A。
7.B
【详解】A.根据“均摊法”,该结构中的个数为,的个数为,的个数为1,则,A错误;
B.该结构前后、左右平置时,不能重复,故不是晶胞结构单元,B正确;
C.结构中中C原子提供孤电子对,与镍的空轨道形成配位键,中氮没有参与形成配位键,C错误;
D.由图可知,每个镍离子与4个形成配位键,但不是所有镍离子都与形成配位键,故不是所有的配位数相同,D错误;
故选B。
8.C
【详解】A.与新制的Cu(OH)2作用,醛基被氧化为羧基,C原子连接的4个原子或原子团不同,仍具有光学活性,A错误;
B.与甲酸发生酯化反应,生成-CH2OOCH,C原子连接的4个原子或原子团不同,仍具有光学活性,B错误;
C.与NaOH水溶液共热,酯基水解,得到2个- CH2OH,则不具有光学活性,C正确;
D.-CHO与氢气发生加成生成-CH2OH但是不连接在同一个C上,具有光学活性,D错误;
答案选C。
9.C
【详解】R中两种阳离子分别是H3O+、NH,二者的中心原子的VSEPR模型都是四面体形,中心原子的价层电子对数都是4,都是共价键,H3O+、NH的空间结构分别为三角锥形、正四面体形。
10.B
【详解】A.原子核外没有两个运动状态完全相同的电子,有几个电子就有几种运动状态,硫原子核外有16个电子,所以有16种不同状态,A项错误;
B.SO3中含有3个键,孤电子对数是0,所以价层电子对数是3,空间构型为平面三角形,B项正确;
C.非极性键由同种原子构成,这些粒子中均没有非极性键,因此反应过程中无非极性键的断裂,C项错误;
D.HNO2中,N原子的价层电子对数为2+=3,为sp2杂化类型且有一个孤电子对,由于孤电子对对成键电子对的排斥作用,导致键角小于120°,D项错误;
故选B。
11.A
【详解】①N2H4分子中N原子之间形成非极性共价键,N原子和H原子之间形成极性共价键,①正确;
②若R2-和M+的电子层结构相同,则M处于R的下一周期,所以原子序数:M>R,②错误;
③F2、Cl2、Br2、I2的组成和结构相似,熔点随相对分子质量的增大而升高,③正确;
④NCl3、PCl3、CO2、CS2分子中各原子均满足最外层电子数+|化合价|=8,则均达到8e-稳定结构,④正确;
⑤固体熔化成液体的过程是物理变化,但可能破坏化学键,例如氢氧化钠熔化时离子键被破坏,⑤错误;
⑥HF分子很稳定,是因为H-F键键能大,与分子间氢键无关,⑥错误;
⑦元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,但氢化物的酸性变化无此规律,酸性:HCl>HBr>HI,⑦错误。
综合以上分析,②⑤⑥⑦不正确,故选A。
12.C
【详解】A.连接四个不同原子或原子团的碳原子是手性碳原子,该分子中与苯环直接相连的碳原子是手性碳原子,就1个,A正确;
B.酚羟基、醇羟基和羧基均能与Na反应,酚羟基和羧基能与NaOH反应,故1 mol该有机化合物消耗3molNa,或消耗2molNaOH,二者物质的量之比3∶2,B正确;
C.该分子中,α角的C和β角的O都是sp3杂化,该C没有孤电子对,该O有2对孤电子对,由于孤电子对对成键电子对的排斥作用大于成键电子对与成键电子对的排斥,故键角:α>β,C错误;
D.苯环碳原子和取代苯环上的氢的碳原子在同一平面上,故该分子中共平面的碳原子最少有7个,D正确;
故选C。
13.C
【详解】A.与2个苯环相连的C为四面体结构,则所有碳不能共面,故A错误;
B.苯环是平面正六边形结构,饱和碳原子是四面体结构,则双酚一定共线的碳原子有3个,故B错误;
C.双酚分子中碳原子的杂化方式有2种,即苯环上碳原子是sp2杂化,饱和碳原子是sp3杂化,故C正确;
D.双酚结构对称,其一氯代物(不考虑的取代)有3种,其中苯环上两种,甲基上一种,故D错误;
故选C。
14.A
【详解】A.a中N原子有3对键电子对,1对孤电子对,b中N原子有4对键电子对,没有孤电子对,则a、b中N原子均采取杂化,A正确;
B.b为配离子,提供孤电子对的有2个N原子和4个O原子,所以的配位数为6,B错误;
C.a不是配合物,C错误;
D.与N、O之间形成配位键,其他原子之间形成共价键,b中不含离子键,D错误;
故选A。
15.B
【详解】A.BeCl2分子中,中心Be原子发生sp杂化,分子呈直线形,A不正确;
B.HClO的中心O原子价电子对数为4,采取sp3杂化,B正确;
C.BF3的中心B原子价电子对数为3,VSEPR模型呈平面三角形,C不正确;
D.C2H4的中心C原子形成3个σ键(sp2杂化轨道)和1个π键(轨道未参与杂化),NH3分子中心原子形成3个σ键(sp3杂化轨道)、另有1对所在轨道参与杂化的孤对电子,D不正确;
故选B。
16.CH4或SiH4
【详解】等电子题是指价电子数和原子数相同的分子、离子或原子团等,采用“同族替换,左右移位”的方法寻找等等电子体,所以与互为等电子体的分子是CH4或SiH4。
17.(1) 1s22s22p63s23p63d104s2或[Ar]3d104s2 CO2 直线型
(2)sp2、sp3
(3)分子间氢键
(4) 6 面心立方最密堆积
(5)6
【详解】(1)与Ca在同一周期且最外层电子数相同、内层排满电子的元素是30号元素Zn,其基态原子的电子排布式是1s22s22p63s23p63d104s2或[Ar]3d104s2;CaCN2中阴离子为,与互为等电子体的分子有N2O和CO2。由于等电子体结构相似,所以由此可以推知的空间构型为直线型。答案为1s22s22p63s23p63d104s2或[Ar]3d104s2;CO2;直线型;
(2)在三聚氰胺中氮原子的杂化方式有六元环上的N原子是sp2杂化;氨基的氮原子是sp3杂化。答案为sp2、sp3;
(3)由于N原子半径小,元素的非金属性强,分子内容易形成氢键;在肾脏内易形成结石。答案为分子间氢键;
(4)根据CaO的结构可知,早晶胞中每个Ca2+周围有6个O2-,配位数是6;根据晶体结构可知Ca2+采取的堆积方式为面心立方最密堆积;在CaO2晶体的一个晶胞中含有Ca2+:8×1/8+6×1/2=4;含有O22-:12×1/4+1=4。即一个晶胞中含有4个CaO2。晶胞中最近的两个Ca2+的距离为在晶胞面对角线的一半。假设晶胞的边长为a,则,所以,则晶胞中最近的两个Ca2+的距离为L=。答案为;
(5)配位化合物K3[ Fe( CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,铁原子的最外层电子数是2,一个配位体可提供2个电子,所以若铁原子和配体提供电子数之和为14,n=6。答案为6。
18.As原子半径大,形成的σ键长,p-p轨道肩并肩重叠很少或几乎不重叠
【详解】As原子半径大于N原子,则As原子与As原子形成的单键键长较长,导致p-p轨道形成肩并肩的电子云重叠很少或几乎不重叠,故不易形成键。
19. 低 氨气分子之间存在氢键,AsH3分子间为范德华力 3d104s1 1s22s22p63s23p63d6 Na<Al<Mg 能量最低原理 s 4
【分析】(1)氨气分子之间存在氢键,AsH3分子间为范德华力,氢键比较范德华力更强;
(2)核外电子排布式的书写要注意洪特规则的特例。Cu是29号元素;
(3)铁元素为26号元素,失去2电子后形成Fe2+;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,Na、Mg、Al属于同一周期元素;电子应优先排列在3s能级;
(4)K元素处于元素周期表的s 区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级为ns能级。
【详解】(1)氨气分子之间存在氢键,AsH3分子间为范德华力,氢键比较范德华力更强,故AsH3的沸点比较NH3的低;
(2)Cu是29号元素,核外电子排布时还要遵循洪特规则的特例,故价电子排布式是3d104s1;
(3)铁元素为26号元素,其核外电子排布为1s22s22p63s23p63d6 4s2,失去2电子后形成Fe2+,故Fe2+的核外电子排布为:1s22s22p63s23p63d6;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,故Na、Mg、Al基态原子第一电离能的大小关系是 Na<Al<Mg;电子应优先排列在3s能级,违反了能量最低原理;
(4)K元素处于元素周期表的s 区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级为ns能级,分别是1s、2s、3s、4s,即核外电子占据的电子云轮廓图为球形的能级有4个。
【点睛】常见易形成氢键的化合物:H2O、HF、NH3等,分子间氢键:①同种分子间使得物质的熔沸点升高;②不同种分子间:例如 NH3与H2O之间。所以这就导致了氨气在水中的惊人溶解度:1体积水中可溶解700体积氨气;分子内氢键:某些分子内,例如HNO3、邻硝基苯酚分子可以形成分子内氢键,分子内氢键使物质熔沸点降低。
20.(1)②③④⑤
(2)⑤⑦⑧
(3)①⑥⑨
(4) sp3 三角锥
(5) sp2 平面三角形
【分析】NH3中存在N-H键,CO2中存在C=O键,SiCl4中存在Si-Cl键,BF3中存在B-F键,C2H4中存在C=C非极性共价键和C-H键,H2O2中存在O-O非极性共价键和O-H键,Cl2中存在Cl-Cl非极性共价键,P4为正四面体结构存在P-P非极性共价键,H2S中存在H-S键,据此答题。
(1)
含极性共价键的非极性分子为CO2、SiCl4、BF3、C2H4,符合条件的非极性分子为②③④⑤;
(2)
含非极性共价键的非极性分子为C2H4、Cl2、P4,符合条件的含非极性共价键的非极性分子为⑤⑦⑧;
(3)
含极性共价键的极性分子为NH3、H2O2、H2S,符合条件的含极性共价键的极性分子为①⑥⑨;
(4)
①NH3中价层电子对数为4,孤电子对数为1,则NH3中心原子杂化方式sp3;
②由于受孤电子对的影响NH3分子的空间构型为三角锥形;
(5)
①BF3中价层电子对数为3,孤电子对数为0,则BF3中心原子杂化方式为sp2;
②孤电子对数为0,则BF3分子的空间构型为平面三角形。
21. 第周期第族 和杂化 分子晶体 分子中能与水形成分子间氢键
【详解】(1)元素在周期表的位置为第周期第族,原子的核外电子排布式为,元素位于周期表的区;
(2)形成键的原子的杂化方式为杂化,形成键的C原子的杂化方式为;该分子中,所有的N、C原子的最外层均达到电子稳定结构,共6个原子;两原子间形成的共价双键或三键,有且只有一个是键,则键和键的个数比为;
(3)该物质可溶于水、乙醇,熔点较低,则该物质的晶体类型为分子晶体,该有机物分子中能与水形成分子间氢键,故其可溶于水。
22. NH3分子之间能形成氢键 PH3分解需要破坏 P—H 键,PH3汽化需要破坏分子间作用力,而化学键比分子间作用力大得多,所以PH3的分解温度高于其沸点
【详解】NH3分子之间形成氢键,熔沸点高于PH3;PH3的分解温度高于其沸点,其原因是:PH3分解需要破坏 P—H 键,PH3汽化需要破坏分子间作用力,而化学键比分子间作用力大得多,所以PH3的分解温度高于其沸点。
23.(1)
(2)+CH2=CHCH3
【解析】(1)
溶于氨水生成氢氧化四氨合铜,故化学方程式为。
(2)
苯与丙烯在催化剂作用下发生加成反应生成异丙苯,化学方程式为+CH2=CHCH3。
24. ls22s22p63s23p63d104s1 3 2 氨分子间丁以形成氢键而甲烷分子间不能,所以氨的沸点比甲烷高 [Cu(NH3)4](OH)2
【详解】考查电子排布式的书写、化学键数目的判断、熔沸点高低的判断、配合物化学式的书写,非金属元素A 的基态原子中成对电子数是未成时电子数的两倍,基态A原子的电子排布式为1s22s22p2,即A为C,C元素在地壳中含量最高的,即C为O,因为原子序数依次增大,因此B为N,D的单质是短周期中熔点最低的金属,即D为Na,E的合金是我国使用最早的合金,即E为Cu,(1)Cu位于第四周期IB族,基态Cu原子电子排布式为ls22s22p63s23p63d104s1;(2)此分子式为C2H2,碳碳之间以叁键的形式结合,因此含有σ键个数为3个,π键个数为2;(3)B的简单氢化物是NH3,A的简单氢化物是CH4,NH3分子间存在氢键,CH4分子间不存在氢键,因此NH3的沸点比甲烷高;(4)Cu的最高价氧化物对应水化物是Cu(OH)2,溶解于氨水,生成[Cu(NH3)4](OH)2。
25.(1)钾、铬、铜
(2)3d3
(3)Fe3+的3d轨道填充了5个电子,为半充满状态
(4) N、O、Cl 6
【详解】(1)4s轨道只有1个电子,价电子排布为4s1或3d54s1、3d104s1,符合条件的元素有钾、铬、铜,故答案为:钾、铬、铜;
(2)Cr原子核外电子排布式为1s22s22p63s23p63d54s1,失去4s能级1个电子、3d能级2个电子形成Cr3+,基态Cr3+的价层电子电子排布式为3d3,故答案为:3d3;
(3)Fe3+的3d轨道填充了5个电子,为半充满状态,化学性质比Fe2+稳定,故答案为:Fe3+的3d轨道填充了5个电子,为半充满状态;
(4)[Cr(NH3)3(H2O)2Cl]2+中,N、O、Cl均含有孤电子对,均提供孤电子形成配位键,中心离子的配体是NH3、H2O,NH3、H2O、Cl的个数就是其配位数,所以配位数是6,故答案为:N、O、Cl;6。
答案第1页,共2页
答案第1页,共2页
