浙教版科学九上专题复习导学案二——酸碱盐探究
文档属性
| 名称 | 浙教版科学九上专题复习导学案二——酸碱盐探究 | 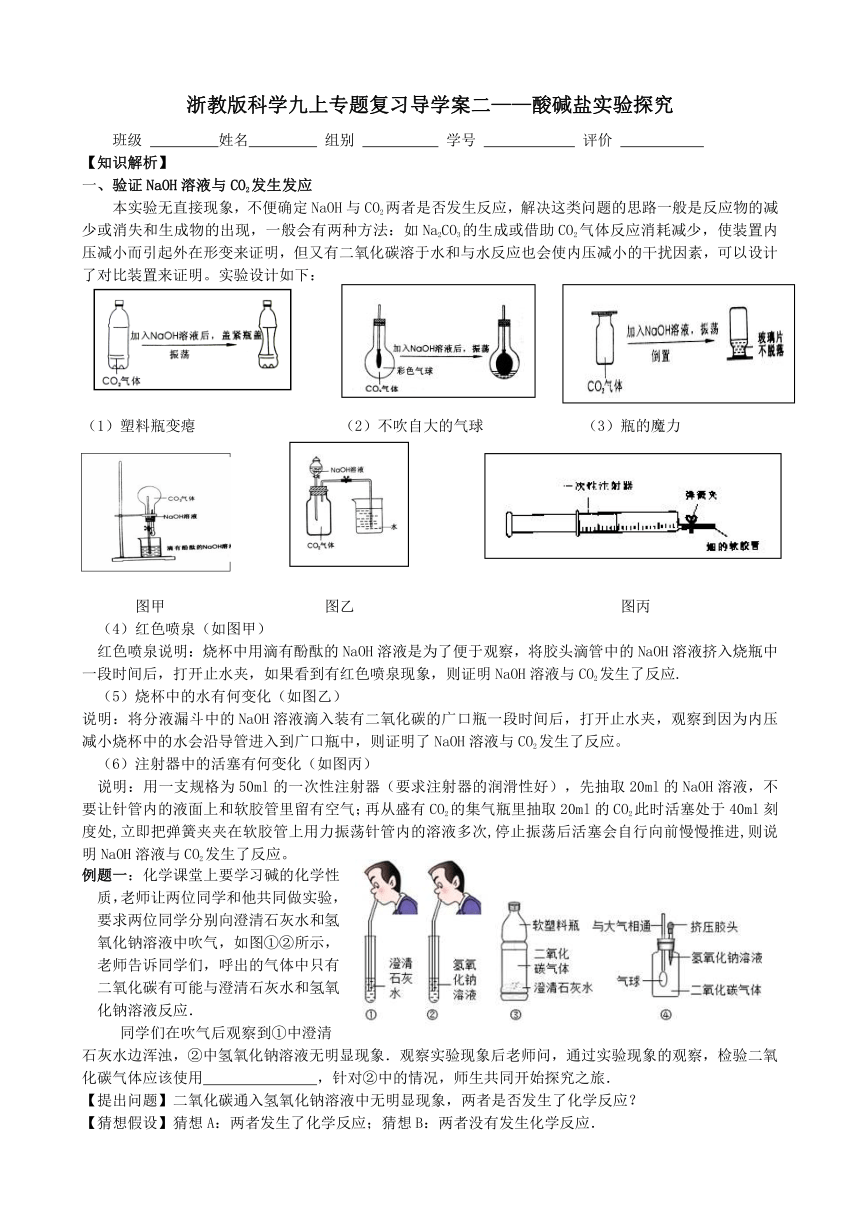 | |
| 格式 | zip | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2014-10-28 12:51:22 | ||
图片预览



文档简介
浙教版科学九上专题复习导学案二——酸碱盐实验探究
班级 姓名 组别 学号 评价
【知识解析】
一、验证NaOH溶液与CO2发生发应
本实验无直接现象,不便确定NaOH与CO2两者是否发生反应,解决这类问题的思路一般是反应物的减少或消失和生成物的出现,一般会有两种方法:如Na2CO3的生成或借助CO2气体反应消耗减少,使装置内压减小而引起外在形变来证明,但又有二氧化碳溶于水和与水反应也会使内压减小的干扰因素,可以设计了对比装置来证明。实验设计如下:
(1)塑料瓶变瘪 (2)不吹自大的气球 (3)瓶的魔力
图甲 图乙 图丙
(4)红色喷泉(如图甲)
红色喷泉说明:烧杯中用滴有酚酞的NaOH ( http: / / www.21cnjy.com )溶液是为了便于观察,将胶头滴管中的NaOH溶液挤入烧瓶中一段时间后,打开止水夹,如果看到有红色喷泉现象,则证明NaOH溶液与CO2发生了反应.
(5)烧杯中的水有何变化(如图乙)
说明:将分液漏斗中的NaOH溶液滴入装有二 ( http: / / www.21cnjy.com )氧化碳的广口瓶一段时间后,打开止水夹,观察到因为内压减小烧杯中的水会沿导管进入到广口瓶中,则证明了NaOH溶液与CO2发生了反应。
(6)注射器中的活塞有何变化(如图丙)
说明:用一支规格为50ml的一次性注射器( ( http: / / www.21cnjy.com )要求注射器的润滑性好),先抽取20ml的NaOH溶液,不要让针管内的液面上和软胶管里留有空气;再从盛有CO2的集气瓶里抽取20ml的CO2此时活塞处于40ml刻度处,立即把弹簧夹夹在软胶管上用力振荡针管内的溶液多次,停止振荡后活塞会自行向前慢慢推进,则说明NaOH溶液与CO2发生了反应。
例题一:化学课堂上要学习碱的化学性
质,老师让两位同学和他共同做实验,
要求两位同学分别向澄清石灰水和氢
氧化钠溶液中吹气,如图①②所示,
老师告诉同学们,呼出的气体中只有
二氧化碳有可能与澄清石灰水和氢氧
化钠溶液反应.
同学们在吹气后观察到①中澄 ( http: / / www.21cnjy.com )清石灰水边浑浊,②中氢氧化钠溶液无明显现象.观察实验现象后老师问,通过实验现象的观察,检验二氧化碳气体应该使用 ,针对②中的情况,师生共同开始探究之旅.
【提出问题】二氧化碳通入氢氧化钠溶液中无明显现象,两者是否发生了化学反应?
【猜想假设】猜想A:两者发生了化学反应;猜想B:两者没有发生化学反应.
【实验探究】
(1)小明设计了如图所示的③、④两个实验.
实验现象:③中的软塑料瓶变瘪,④中 .
(2)小亮认为小明的实验是可行的,其共 ( http: / / www.21cnjy.com )同原理是二氧化碳和氢氧化钠溶液反应,使容器内压强降低,小光同学却对此提出了质疑,他认为小明的实验不严谨,若仍利用该装置,需要补做的对比实验是 .
(3)小光设计的是通过检验生成物来验证猜想,请帮他填写实验报告:
实验步骤 实验现象 实验结论
取③实验后的溶液少许,再向其加入 ( ) 验证了二氧化碳和氢氧化钠溶液反应
【实验结论】二氧化碳和氢氧化钠溶液发生了化学反应.
【反思拓展】探究结束老师说,通过此探究实验我们发现,对于没有明显现象的化学反应,可以从不同的角度证明反应的发生,这些角度可以是:
①通过检验反应物减少证明反应发生;②通过 证明反应的发生.
变式一:(2014十堰)化学学习小 ( http: / / www.21cnjy.com )组的同学们在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.
探究一:二氧化碳是否与氢氧化钠发生了化学反应?
同学们取少量大试管中的液体于另一支试管中,滴加足量的稀盐酸,观察到
证明二氧化碳与氢氧化钠发生了反应.
探究二:反应后大试管中的溶液所含溶质的成分是什么?
【提出猜想】佳佳认为溶质是Na2CO3,贝贝认为溶质是Na2CO3和NaOH
【查阅资料】CaCl2溶液呈中性
【实验验证】贝贝为了验证自己的猜想,进行了如下实验,请你补充完整.
实验操作 实验现象 实验结论
①取一定量大试管中的溶液于试管中,加入足量CaCl2溶液,过滤②向滤液滴加适量 贝贝的猜想成立
【实验反思】同学们联想到了氢氧化钠 ( http: / / www.21cnjy.com )与稀硫酸发生中和反应也观察不到明显现象,为了确定其反应是否反生,有同学设计了如右图的实验方案:先用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀硫酸,边滴边测定混合溶液的pH,.请你分析上述方案中,为什么要“当测定pH小于或等于7,”才可证明发生反应了,其原因是 .
二、氢氧化钠的变质检验
1.原因:敞口放置,与空气中的二氧化碳反应,生成了碳酸钠。
2.检验氢氧化钠变质的方法:
①取少量样品于试管中,滴加稀盐酸(或稀硫酸),如果产生气泡,说明已变质。
②取少量样品于试管中,滴加氢氧化钙溶液(或氢氧化钡溶液),如果产生白色沉淀,说明已变质。
③取少量样品于试管中,滴加氯化钙溶液(或硝酸钙等其他可溶性钙盐、钡盐溶液),如果产生白色沉淀,说明已变质。
3.检验变质程度的方法:取少量样品于试管中, ( http: / / www.21cnjy.com )滴加足量的氯化钙溶液,有白色沉淀生成;静置,像上层清液滴加少量酚酞溶液,如果溶液变红色,说明溶液部分变质;如果溶液呈无色,说明氢氧化钠完全变质。
解释:碳酸钠溶液呈碱性 ( http: / / www.21cnjy.com ),它的存在会影响到氢氧化钠的检验,所以在检验氢氧化钠前必须把碳酸钠除去,除去碳酸钠时不能用酸,因为酸会与氢氧化钠反应;不能用碱,因为碱会与碳酸钠反应生成氢氧化钠,干扰原来氢氧化钠的检验。
例题二:(2014鄂州) ( http: / / www.21cnjy.com )化学兴趣小组的同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,小组内小明同学认为有两种可能:
猜想1:该溶液没有变质 猜想2:该溶液全部变质
(1)小组同学讨论后认为还有一种可能,请你补充出猜想3: 。
(2)为了验证猜想3,小红同学设计了如下实验方案,请你帮他完成实验报告的填写
实验步骤 实验现象 结论
1.取样, ,过滤 产生白色沉淀 猜想3成立
2.向上述滤液中滴加几滴无色酚酞溶液 酚酞溶液变红
(3)探究启示:氢氧化钠必须 保存。
变式二:实验室中的试剂一般要密封保存, ( http: / / www.21cnjy.com )否则可能会与空气接触而变质。某研究性学习小组发现一瓶未密闭的KOH固体,对其成分提出以下假设,并完成了实验探究。
假设1:只含KOH; 假设2:含KOH和K2CO3; 假设3:只含K2CO3
(1)成分中可能含有K2CO3的原因是(用化学方程式回答)________________________。
(2)取少量样品于试管中,加入足量稀盐酸,观察到_____________________,说明假设2或假设3成立。
(3)进一步探究的过程如下:
( http: / / www.21cnjy.com )
①“操作1”的名称是____________检验; ②“固体A”的化学式是___________;
③加入足量CaCl2溶液的作用是_______________________________。
(4)变质试剂也有利用价值,从KOH和K2CO3的组成和性质看,这瓶变质试剂的用途是________________(写出一条)。
三、有关酸碱反应是否发生
方法一:借助酸碱指示剂的颜色变化判断酸碱反应是否发生反应;
方法二:借助反应中的温度变化判断反应是否发生反应;
方法三:借助反应中溶液pH的变化是否发生反应。
例题三:(2014宜昌)数字化装备正逐步进入宜昌市的各个校园。在盐酸和
氢氧化钠反应的过程中,下图是利用数字化传感器得到的溶液pH变化图像。⑴反应的化学方程式为 ;
⑵当溶液呈中性时,所消耗氢氧化钠溶液的体积
是 mL;
⑶图中b点所示溶液中,含有的溶质是 。
变式三:(2014汕尾)某化学兴趣小组围绕“酸和碱的中和反应”的学习,进行了如下实验:
实验一:取5mL氢氧化钠溶液于烧杯中, ( http: / / www.21cnjy.com )滴入几滴酚酞溶液,可观察到现象为 _________ ,然后加入稀盐酸,用玻璃棒搅拌,溶液褪为无色,有关的反应方程式为 _________ .
实验二:对实验一反应后溶液中的溶质进行探究.
【提出猜想】
猜想一:只有NaCl 猜想二:有NaCl和NaOH 猜想三:有NaCl和HCl
你认为猜想 _________ 不合理,其理由是 _________ .
【设计实验】
实验操作 实验现象 实验结论
取反应后的溶液于试管中,加入 _________ _________ 猜想三成立
【拓展应用】我国土壤的酸碱性有“南酸北碱”之说法,你认为需向酸性土壤中加入 _________ 进行改良.
四、离子溶液的探究
该类试题解题时要注意每加一种试剂检验出一种离子,加入的试剂只能与一种离子结合,所以要知道离子之间检验的规律。
例题四:欲验证某溶液中含有较大量的Cl-、CO32-、SO42-三种离子,如果只取一次该溶液,分别用三种试剂将三种离子检验出来(要求每加入一种试剂能够检验出一种离子),假设所加试剂均为足量,则加入试剂的先后顺序为(写化学式):_____________、_____________、_____________。
AgNO3
变式四:食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
( http: / / www.21cnjy.com )
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液。
(1)①欲除去浊液I中的Ca2+、Mg2+、SO42—离子,选出A所代表的试剂,按滴加顺序依次为 (只填化学式),检验溶液中SO42—沉淀完全的操作为 。
②加盐酸的目的是 。
H++OH-═H2O,CO32-+2H+═H2O+CO2↑
③如果在实验室中完成下列过程,甲、乙两个过程均要用到玻璃棒,玻璃棒的作用分别是:甲 ,乙 。
搅拌
(2)工业上用惰性电极电解饱和食盐 ( http: / / www.21cnjy.com )水制取盐酸,写出电解饱和食盐水的化学方程式 ;用试纸检验电解食盐水阳极产物的方法是 。
【巩固练习】
1,某溶液中含有较大量的Cl-、CO32—、OH— 三种阴离子,如果只取一次该溶液就能够分别将三种离子依次
检验出来,下列实验操作的正确顺序是 。
A. 滴加足量的AgNO3溶液; B. 过滤;C. 滴加足量的Ba(NO3)2溶液;D. 滴加足量的Mg(NO3)2溶液
2. 在充满CO2的铝制易拉罐中加入过量NaOH溶液后封口,易拉罐立即变瘪,原因是________________;
一会儿易拉罐又鼓起,因Al与NaOH溶液反应生成H2和NaAlO2,该化学方程式为_ ___________。
3.(2014河南)NaOH是化学实验中常用的试剂.
(1)将某NaOH溶液逐滴滴人一定量的某盐酸中,右边图象合理的是 (填“甲”或“乙”).
(2)向长期敞口放置的NaOH溶液中滴加盐酸时,意外发现有气泡产生,请解释其原因.
(3)向足量某NaOH溶液中通入CO2, ( http: / / www.21cnjy.com )反应后溶液中的溶质可能只有Na2CO3,也可能还有NaOH,请设计实验检验溶质的成分,简要写出实验步骤、现象和结论.
(提示:Na2CO3溶液呈碱性)
4.(2014 南宁)在2014年南 ( http: / / www.21cnjy.com )宁市理化实验操作考试中.小刚同学选择了稀盐酸、氢氧化钠溶液、酚酞溶液三种试剂,按如图所示进行酸碱中和反应的实验.
请回答:
(1)试剂Ⅰ是 ,试剂Ⅱ是 .
(2)本实验中,常常选用酚酞酞溶液而不选用石蕊溶液做指示剂的原因是
.
(3)欲验证上述实验中稀盐酸和氢氧化钠 ( http: / / www.21cnjy.com )溶液是否恰好完全反应,不能选择的试剂是 . A.石蕊溶液 B.铜片 C.碳酸氢钠粉末.
5.(2014武威)某化学课堂 ( http: / / www.21cnjy.com )围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式 .
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是 .
【实验探究】(1)丙组同学取烧杯中的溶 ( http: / / www.21cnjy.com )液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有 .
(2)为了验证其余猜想,各学习小组利用烧杯 ( http: / / www.21cnjy.com )中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究.
实验方案 测溶液pH 滴加Na2CO3溶液 滴加BaCl2溶液
实验操作
实验现象 试纸变色,对比比色卡,pH<7 产生白色沉淀
实验结论 溶液中有H2SO4 溶液中有H2SO4 溶液中有H2SO4
【得出结论】通过探究,全班同学一致确定猜想二是正确的.
【评价反思】老师对同学们能用 ( http: / / www.21cnjy.com )多种方法进行探究,并且得出正确结论给予肯定.同时指出【实验探究】(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中的错误是 .
(2)实验方案中也有一个是错误的,错误的原因是 .
6.(2014年安徽省)某研究性学习小 ( http: / / www.21cnjy.com )组在验证“碱使酚酞试液变红”的实验时,发现一个意外现象:将酚酞试液滴人某NaOH溶液中,溶液变成了红色,可是过一会儿红色却消失了。
【提出问题】是什么原因导致滴有酚酞的NaOH溶液由红色褪为无色?
【猜想与假设】他们分别对这种意外现象作如下猜想:
甲同学:可能是酚酞与O2发生了反应;
乙同学:可能是NaOH溶液与空气中的CO2发生了反应;
丙同学:可能与NaOH溶液浓度大小有关;
你认为可能还与_________________________有关(写一条即可)。
【设计实验】三位同学分别设计实验验证自己的猜想:
(1)甲同学设计了如下实验,请你填写下表。
实验步骤 设计这一步骤的目的 实验现象 实验结论
1.将NaOH溶液加热煮沸 溶液变红,过一会儿红色消失 甲同学猜想___________(填“正确”或不正确”)
2.向冷却后的溶液中滴人酚酞,并滴一些植物油在其上方
(2)乙同学设计如图装置进行实验,一段时间后,试管中溶液的红色褪去,于是认定自己的猜想正确。请写出CO2与NaOH溶液反应的化学方程式:________________________。甲同学认为乙同学的实验不够严谨,理由是________________
7. 某同学用氢氧化钙溶液和盐酸进行酸 ( http: / / www.21cnjy.com )碱中和反应的实验时,向烧杯中的氢氧化钙溶液中滴加稀盐酸一会儿后,发现忘记了滴加指示剂.因此,他停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行了如下探究,请你和他一起完成探究活动.
【提出问题】溶液中的溶质是什么物质?
【作出猜想】猜想一:溶质只有氯化钙; 猜想二:可能是CaCl2和Ca(OH)2;
猜想三: _________ .
【查阅资料】氯化钙溶液呈中性.
【方案设计】
( http: / / www.21cnjy.com )
【方案评价】该同学与同学们通过讨论认为:
(1)方案一能证明猜想二正确,但不能证明猜想一正确.
(2)方案二可行.但该同学在记录时未记录完整,请你帮他将方案二补充完整.
【方案反思】方案一不能证明猜想一正确的理由是 _________ .
【拓展与应用】实验证明猜想三是正确的.要想使溶液中的溶质只有氯化钙,你认为应该进行的实验步骤是 _________ .
【结论】在分析化学反应后所得物质成分时,除考虑生成物外还需考虑 _________ .
8.(2014遂宁)某化学兴趣小组学习酸碱中和反应后,对稀盐酸与氢氧化钠溶液混合后的有关问题,进行了如下探究,请你一起参与他们的探究。
【提出问题】氢氧化钠溶液与稀盐酸混合后,所得溶液中溶质的成分是什么
【作出猜想】
甲同学猜想:溶质有NaCl、HCl、NaOH
乙同学猜想:溶质只有NaCl
丙同学猜想:溶质有NaCl、HCl
你的猜想:溶质有 .(填化学式)
乙同学认为甲同学的猜想是错误的,理由是 。
【实验设计及验证】请你将下列实验报告填写完整:
实验操作 实验现象 实验结论
取反应后的溶液于试管中,加入碳酸钠溶液 丙同学的猜想正确
有蓝色沉淀生成 你的猜想正确
参考答案
【知识解析】
一、验证NaOH溶液与CO2发生发应
例题一:澄清的石灰水;【实验探究】(1) ( http: / / www.21cnjy.com )气球变大(合理说法均可);(2)将氢氧化钠溶液换成等体积的水,与加入氢氧化钠溶液的实验现象进行对比;
(3)
实验步骤 实验现象 实验结论
取③实验后的溶液少许,再向其加入 稀盐酸(或氯化钙溶液等) 有气泡产生(或有白色沉淀生成等) 验证了二氧化碳和氢氧化钠溶液反应
【反思拓展】检验生成物.
变式一:探究一:有气泡冒出 【实验验证】酚酞,溶液变成红色;
【实验反思】排除因硫酸的加入,稀释氢氧化钠溶液而引起pH减小因素的干扰.
二、氢氧化钠的变质检验
例题二:(1)该溶液部分变质 (2)向其中滴加过量的CaCl2(或BaCl2)溶液 (3)密封
变式二:(1)2KOH+CO2=K2CO3+ ( http: / / www.21cnjy.com )H2O (2)有无色气泡产生 (3)①过滤 ②CaCO3 ③将碳酸钾完全反应掉,防止对接下来的实验干扰 (4)作钾肥(制取氯化钾等)
三、有关酸碱反应是否发生
例题三:⑴NaOH+HCl=NaCl+H2O ⑵10
⑶NaCl、NaOH(或氯化钠、氢氧化钠)
变式三:实验一:溶液变红,HCl+NaOH═NaCl+H2O;
实验二:二,此时溶液呈无色,而氢氧化钠能使酚酞试液变红;
设计实验:
实验操作 实验现象 实验结论
取反应后的溶液于试管中,加入 石蕊试液 溶液变红 猜想三成立
拓展应用:碱性物质.
四、离子溶液的探究
例题四: HNO3;HNO3;;;Ba(NO3)2Ba(NO3)2;AgNO3
变式四:(1)①NaOH、BaCl2 ( http: / / www.21cnjy.com )、Na2CO3或BaCl2、NaOH、Na2CO3或BaCl2、Na2CO3、NaOH;NaOH、BaCl2、Na2CO3或BaCl2、NaOH、Na2CO3或BaCl2、Na2CO3、NaOH2-1-c-n-j-y
稍待片刻,待沉淀沉降完毕,上层出现清液,向上层清液中继续滴加氯化钡溶液,无沉淀生成,则沉淀完全 ②除去过量的氢氧化钠和碳酸钠 ③搅拌;引流 (2)2NaCl+2H2O2NaOH+Cl2↑+H2↑;用湿润的KI淀粉试纸放在阳极区气体中,试纸变蓝色,证明有氯气生成稍待片刻,待沉淀沉降完毕,上层出现清液,向上层清液中继续滴加氯化钡溶液,无沉淀生成,则沉淀完全
【巩固练习】
1.CBDBA
2. C02气体能与NaOH溶液反应而被吸收,使罐内气压减小
2A1+2NaOH +2H2O == 2NaAlIO2 + 3H2 ↑
3.(1)乙.
(2)氢氧化钠和空气中的二氧化碳反应生成了碳酸钠,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳.
(3)取反应后的溶液,加入足量CaCl ( http: / / www.21cnjy.com )2溶液(或BaCl2溶液等),静置,取上层清液滴加酚酞溶液.若溶液变成红色,则溶质为Na2CO3和NaOH;若溶液没有变成红色,则溶质只有Na2CO3.
4.(1)酚酞溶液;稀盐酸;
(2)石蕊试液在碱性溶液中为蓝色,在中性溶液中为紫色,当恰好完全反应时的颜色变化不明显;
(3)B.
5.H2SO4+2NaOH═Na2SO4 +2H2O; 猜想四或四; NaOH或氢氧化钠;
有气泡产生; pH试纸浸入溶液中;
BaCl2与Na2SO4反应也会生成白色沉淀,不能证明一定有H2SO4存在(其他合理答案均可)
6. 仪器不干净,含有酸性物质(合理均可)
(1)
实验步骤 设计这一步骤的目的 实验现象 实验结论
1.将NaOH溶液加热煮沸 除去溶液中的氧气 溶液变红,过一会儿红色消失 甲同学猜想正确_
2.向冷却后的…… 隔绝氧气
(2)2NaOH+CO2 =Na2CO3+H2O 若制取的二氧化碳气体中混有氯化氢气体,试管中溶液的红色也能褪去
7.【做出猜想】盐酸和氯化钙
【方案设计】碳酸钠溶液,有气泡冒出
【方案反思】酚酞遇碱变红,在中性和酸性时都不变色,所以通过酚酞不变色就认定只有氯化钙不全面,还可能是含有盐酸和氯化钙;
【反思与拓展】向废液中加入碳酸钙,当不再产生气泡时,停止加入碳酸钙,过滤既得只含有氯化钙的废液
【结论】反应物是否过量
8. NaCl和NaOH;氢氧化钠 ( http: / / www.21cnjy.com )可以和稀盐酸反应,所以盐酸和氢氧化钠不能共存; 产生气泡; 取反应后的溶液于试管中,加入氯化铜溶液等铜盐溶液
NaOH溶液的体积/mL
b
pH
7
a
0 10 20
班级 姓名 组别 学号 评价
【知识解析】
一、验证NaOH溶液与CO2发生发应
本实验无直接现象,不便确定NaOH与CO2两者是否发生反应,解决这类问题的思路一般是反应物的减少或消失和生成物的出现,一般会有两种方法:如Na2CO3的生成或借助CO2气体反应消耗减少,使装置内压减小而引起外在形变来证明,但又有二氧化碳溶于水和与水反应也会使内压减小的干扰因素,可以设计了对比装置来证明。实验设计如下:
(1)塑料瓶变瘪 (2)不吹自大的气球 (3)瓶的魔力
图甲 图乙 图丙
(4)红色喷泉(如图甲)
红色喷泉说明:烧杯中用滴有酚酞的NaOH ( http: / / www.21cnjy.com )溶液是为了便于观察,将胶头滴管中的NaOH溶液挤入烧瓶中一段时间后,打开止水夹,如果看到有红色喷泉现象,则证明NaOH溶液与CO2发生了反应.
(5)烧杯中的水有何变化(如图乙)
说明:将分液漏斗中的NaOH溶液滴入装有二 ( http: / / www.21cnjy.com )氧化碳的广口瓶一段时间后,打开止水夹,观察到因为内压减小烧杯中的水会沿导管进入到广口瓶中,则证明了NaOH溶液与CO2发生了反应。
(6)注射器中的活塞有何变化(如图丙)
说明:用一支规格为50ml的一次性注射器( ( http: / / www.21cnjy.com )要求注射器的润滑性好),先抽取20ml的NaOH溶液,不要让针管内的液面上和软胶管里留有空气;再从盛有CO2的集气瓶里抽取20ml的CO2此时活塞处于40ml刻度处,立即把弹簧夹夹在软胶管上用力振荡针管内的溶液多次,停止振荡后活塞会自行向前慢慢推进,则说明NaOH溶液与CO2发生了反应。
例题一:化学课堂上要学习碱的化学性
质,老师让两位同学和他共同做实验,
要求两位同学分别向澄清石灰水和氢
氧化钠溶液中吹气,如图①②所示,
老师告诉同学们,呼出的气体中只有
二氧化碳有可能与澄清石灰水和氢氧
化钠溶液反应.
同学们在吹气后观察到①中澄 ( http: / / www.21cnjy.com )清石灰水边浑浊,②中氢氧化钠溶液无明显现象.观察实验现象后老师问,通过实验现象的观察,检验二氧化碳气体应该使用 ,针对②中的情况,师生共同开始探究之旅.
【提出问题】二氧化碳通入氢氧化钠溶液中无明显现象,两者是否发生了化学反应?
【猜想假设】猜想A:两者发生了化学反应;猜想B:两者没有发生化学反应.
【实验探究】
(1)小明设计了如图所示的③、④两个实验.
实验现象:③中的软塑料瓶变瘪,④中 .
(2)小亮认为小明的实验是可行的,其共 ( http: / / www.21cnjy.com )同原理是二氧化碳和氢氧化钠溶液反应,使容器内压强降低,小光同学却对此提出了质疑,他认为小明的实验不严谨,若仍利用该装置,需要补做的对比实验是 .
(3)小光设计的是通过检验生成物来验证猜想,请帮他填写实验报告:
实验步骤 实验现象 实验结论
取③实验后的溶液少许,再向其加入 ( ) 验证了二氧化碳和氢氧化钠溶液反应
【实验结论】二氧化碳和氢氧化钠溶液发生了化学反应.
【反思拓展】探究结束老师说,通过此探究实验我们发现,对于没有明显现象的化学反应,可以从不同的角度证明反应的发生,这些角度可以是:
①通过检验反应物减少证明反应发生;②通过 证明反应的发生.
变式一:(2014十堰)化学学习小 ( http: / / www.21cnjy.com )组的同学们在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.
探究一:二氧化碳是否与氢氧化钠发生了化学反应?
同学们取少量大试管中的液体于另一支试管中,滴加足量的稀盐酸,观察到
证明二氧化碳与氢氧化钠发生了反应.
探究二:反应后大试管中的溶液所含溶质的成分是什么?
【提出猜想】佳佳认为溶质是Na2CO3,贝贝认为溶质是Na2CO3和NaOH
【查阅资料】CaCl2溶液呈中性
【实验验证】贝贝为了验证自己的猜想,进行了如下实验,请你补充完整.
实验操作 实验现象 实验结论
①取一定量大试管中的溶液于试管中,加入足量CaCl2溶液,过滤②向滤液滴加适量 贝贝的猜想成立
【实验反思】同学们联想到了氢氧化钠 ( http: / / www.21cnjy.com )与稀硫酸发生中和反应也观察不到明显现象,为了确定其反应是否反生,有同学设计了如右图的实验方案:先用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀硫酸,边滴边测定混合溶液的pH,.请你分析上述方案中,为什么要“当测定pH小于或等于7,”才可证明发生反应了,其原因是 .
二、氢氧化钠的变质检验
1.原因:敞口放置,与空气中的二氧化碳反应,生成了碳酸钠。
2.检验氢氧化钠变质的方法:
①取少量样品于试管中,滴加稀盐酸(或稀硫酸),如果产生气泡,说明已变质。
②取少量样品于试管中,滴加氢氧化钙溶液(或氢氧化钡溶液),如果产生白色沉淀,说明已变质。
③取少量样品于试管中,滴加氯化钙溶液(或硝酸钙等其他可溶性钙盐、钡盐溶液),如果产生白色沉淀,说明已变质。
3.检验变质程度的方法:取少量样品于试管中, ( http: / / www.21cnjy.com )滴加足量的氯化钙溶液,有白色沉淀生成;静置,像上层清液滴加少量酚酞溶液,如果溶液变红色,说明溶液部分变质;如果溶液呈无色,说明氢氧化钠完全变质。
解释:碳酸钠溶液呈碱性 ( http: / / www.21cnjy.com ),它的存在会影响到氢氧化钠的检验,所以在检验氢氧化钠前必须把碳酸钠除去,除去碳酸钠时不能用酸,因为酸会与氢氧化钠反应;不能用碱,因为碱会与碳酸钠反应生成氢氧化钠,干扰原来氢氧化钠的检验。
例题二:(2014鄂州) ( http: / / www.21cnjy.com )化学兴趣小组的同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,小组内小明同学认为有两种可能:
猜想1:该溶液没有变质 猜想2:该溶液全部变质
(1)小组同学讨论后认为还有一种可能,请你补充出猜想3: 。
(2)为了验证猜想3,小红同学设计了如下实验方案,请你帮他完成实验报告的填写
实验步骤 实验现象 结论
1.取样, ,过滤 产生白色沉淀 猜想3成立
2.向上述滤液中滴加几滴无色酚酞溶液 酚酞溶液变红
(3)探究启示:氢氧化钠必须 保存。
变式二:实验室中的试剂一般要密封保存, ( http: / / www.21cnjy.com )否则可能会与空气接触而变质。某研究性学习小组发现一瓶未密闭的KOH固体,对其成分提出以下假设,并完成了实验探究。
假设1:只含KOH; 假设2:含KOH和K2CO3; 假设3:只含K2CO3
(1)成分中可能含有K2CO3的原因是(用化学方程式回答)________________________。
(2)取少量样品于试管中,加入足量稀盐酸,观察到_____________________,说明假设2或假设3成立。
(3)进一步探究的过程如下:
( http: / / www.21cnjy.com )
①“操作1”的名称是____________检验; ②“固体A”的化学式是___________;
③加入足量CaCl2溶液的作用是_______________________________。
(4)变质试剂也有利用价值,从KOH和K2CO3的组成和性质看,这瓶变质试剂的用途是________________(写出一条)。
三、有关酸碱反应是否发生
方法一:借助酸碱指示剂的颜色变化判断酸碱反应是否发生反应;
方法二:借助反应中的温度变化判断反应是否发生反应;
方法三:借助反应中溶液pH的变化是否发生反应。
例题三:(2014宜昌)数字化装备正逐步进入宜昌市的各个校园。在盐酸和
氢氧化钠反应的过程中,下图是利用数字化传感器得到的溶液pH变化图像。⑴反应的化学方程式为 ;
⑵当溶液呈中性时,所消耗氢氧化钠溶液的体积
是 mL;
⑶图中b点所示溶液中,含有的溶质是 。
变式三:(2014汕尾)某化学兴趣小组围绕“酸和碱的中和反应”的学习,进行了如下实验:
实验一:取5mL氢氧化钠溶液于烧杯中, ( http: / / www.21cnjy.com )滴入几滴酚酞溶液,可观察到现象为 _________ ,然后加入稀盐酸,用玻璃棒搅拌,溶液褪为无色,有关的反应方程式为 _________ .
实验二:对实验一反应后溶液中的溶质进行探究.
【提出猜想】
猜想一:只有NaCl 猜想二:有NaCl和NaOH 猜想三:有NaCl和HCl
你认为猜想 _________ 不合理,其理由是 _________ .
【设计实验】
实验操作 实验现象 实验结论
取反应后的溶液于试管中,加入 _________ _________ 猜想三成立
【拓展应用】我国土壤的酸碱性有“南酸北碱”之说法,你认为需向酸性土壤中加入 _________ 进行改良.
四、离子溶液的探究
该类试题解题时要注意每加一种试剂检验出一种离子,加入的试剂只能与一种离子结合,所以要知道离子之间检验的规律。
例题四:欲验证某溶液中含有较大量的Cl-、CO32-、SO42-三种离子,如果只取一次该溶液,分别用三种试剂将三种离子检验出来(要求每加入一种试剂能够检验出一种离子),假设所加试剂均为足量,则加入试剂的先后顺序为(写化学式):_____________、_____________、_____________。
AgNO3
变式四:食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
( http: / / www.21cnjy.com )
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液。
(1)①欲除去浊液I中的Ca2+、Mg2+、SO42—离子,选出A所代表的试剂,按滴加顺序依次为 (只填化学式),检验溶液中SO42—沉淀完全的操作为 。
②加盐酸的目的是 。
H++OH-═H2O,CO32-+2H+═H2O+CO2↑
③如果在实验室中完成下列过程,甲、乙两个过程均要用到玻璃棒,玻璃棒的作用分别是:甲 ,乙 。
搅拌
(2)工业上用惰性电极电解饱和食盐 ( http: / / www.21cnjy.com )水制取盐酸,写出电解饱和食盐水的化学方程式 ;用试纸检验电解食盐水阳极产物的方法是 。
【巩固练习】
1,某溶液中含有较大量的Cl-、CO32—、OH— 三种阴离子,如果只取一次该溶液就能够分别将三种离子依次
检验出来,下列实验操作的正确顺序是 。
A. 滴加足量的AgNO3溶液; B. 过滤;C. 滴加足量的Ba(NO3)2溶液;D. 滴加足量的Mg(NO3)2溶液
2. 在充满CO2的铝制易拉罐中加入过量NaOH溶液后封口,易拉罐立即变瘪,原因是________________;
一会儿易拉罐又鼓起,因Al与NaOH溶液反应生成H2和NaAlO2,该化学方程式为_ ___________。
3.(2014河南)NaOH是化学实验中常用的试剂.
(1)将某NaOH溶液逐滴滴人一定量的某盐酸中,右边图象合理的是 (填“甲”或“乙”).
(2)向长期敞口放置的NaOH溶液中滴加盐酸时,意外发现有气泡产生,请解释其原因.
(3)向足量某NaOH溶液中通入CO2, ( http: / / www.21cnjy.com )反应后溶液中的溶质可能只有Na2CO3,也可能还有NaOH,请设计实验检验溶质的成分,简要写出实验步骤、现象和结论.
(提示:Na2CO3溶液呈碱性)
4.(2014 南宁)在2014年南 ( http: / / www.21cnjy.com )宁市理化实验操作考试中.小刚同学选择了稀盐酸、氢氧化钠溶液、酚酞溶液三种试剂,按如图所示进行酸碱中和反应的实验.
请回答:
(1)试剂Ⅰ是 ,试剂Ⅱ是 .
(2)本实验中,常常选用酚酞酞溶液而不选用石蕊溶液做指示剂的原因是
.
(3)欲验证上述实验中稀盐酸和氢氧化钠 ( http: / / www.21cnjy.com )溶液是否恰好完全反应,不能选择的试剂是 . A.石蕊溶液 B.铜片 C.碳酸氢钠粉末.
5.(2014武威)某化学课堂 ( http: / / www.21cnjy.com )围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式 .
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是 .
【实验探究】(1)丙组同学取烧杯中的溶 ( http: / / www.21cnjy.com )液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有 .
(2)为了验证其余猜想,各学习小组利用烧杯 ( http: / / www.21cnjy.com )中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究.
实验方案 测溶液pH 滴加Na2CO3溶液 滴加BaCl2溶液
实验操作
实验现象 试纸变色,对比比色卡,pH<7 产生白色沉淀
实验结论 溶液中有H2SO4 溶液中有H2SO4 溶液中有H2SO4
【得出结论】通过探究,全班同学一致确定猜想二是正确的.
【评价反思】老师对同学们能用 ( http: / / www.21cnjy.com )多种方法进行探究,并且得出正确结论给予肯定.同时指出【实验探究】(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中的错误是 .
(2)实验方案中也有一个是错误的,错误的原因是 .
6.(2014年安徽省)某研究性学习小 ( http: / / www.21cnjy.com )组在验证“碱使酚酞试液变红”的实验时,发现一个意外现象:将酚酞试液滴人某NaOH溶液中,溶液变成了红色,可是过一会儿红色却消失了。
【提出问题】是什么原因导致滴有酚酞的NaOH溶液由红色褪为无色?
【猜想与假设】他们分别对这种意外现象作如下猜想:
甲同学:可能是酚酞与O2发生了反应;
乙同学:可能是NaOH溶液与空气中的CO2发生了反应;
丙同学:可能与NaOH溶液浓度大小有关;
你认为可能还与_________________________有关(写一条即可)。
【设计实验】三位同学分别设计实验验证自己的猜想:
(1)甲同学设计了如下实验,请你填写下表。
实验步骤 设计这一步骤的目的 实验现象 实验结论
1.将NaOH溶液加热煮沸 溶液变红,过一会儿红色消失 甲同学猜想___________(填“正确”或不正确”)
2.向冷却后的溶液中滴人酚酞,并滴一些植物油在其上方
(2)乙同学设计如图装置进行实验,一段时间后,试管中溶液的红色褪去,于是认定自己的猜想正确。请写出CO2与NaOH溶液反应的化学方程式:________________________。甲同学认为乙同学的实验不够严谨,理由是________________
7. 某同学用氢氧化钙溶液和盐酸进行酸 ( http: / / www.21cnjy.com )碱中和反应的实验时,向烧杯中的氢氧化钙溶液中滴加稀盐酸一会儿后,发现忘记了滴加指示剂.因此,他停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行了如下探究,请你和他一起完成探究活动.
【提出问题】溶液中的溶质是什么物质?
【作出猜想】猜想一:溶质只有氯化钙; 猜想二:可能是CaCl2和Ca(OH)2;
猜想三: _________ .
【查阅资料】氯化钙溶液呈中性.
【方案设计】
( http: / / www.21cnjy.com )
【方案评价】该同学与同学们通过讨论认为:
(1)方案一能证明猜想二正确,但不能证明猜想一正确.
(2)方案二可行.但该同学在记录时未记录完整,请你帮他将方案二补充完整.
【方案反思】方案一不能证明猜想一正确的理由是 _________ .
【拓展与应用】实验证明猜想三是正确的.要想使溶液中的溶质只有氯化钙,你认为应该进行的实验步骤是 _________ .
【结论】在分析化学反应后所得物质成分时,除考虑生成物外还需考虑 _________ .
8.(2014遂宁)某化学兴趣小组学习酸碱中和反应后,对稀盐酸与氢氧化钠溶液混合后的有关问题,进行了如下探究,请你一起参与他们的探究。
【提出问题】氢氧化钠溶液与稀盐酸混合后,所得溶液中溶质的成分是什么
【作出猜想】
甲同学猜想:溶质有NaCl、HCl、NaOH
乙同学猜想:溶质只有NaCl
丙同学猜想:溶质有NaCl、HCl
你的猜想:溶质有 .(填化学式)
乙同学认为甲同学的猜想是错误的,理由是 。
【实验设计及验证】请你将下列实验报告填写完整:
实验操作 实验现象 实验结论
取反应后的溶液于试管中,加入碳酸钠溶液 丙同学的猜想正确
有蓝色沉淀生成 你的猜想正确
参考答案
【知识解析】
一、验证NaOH溶液与CO2发生发应
例题一:澄清的石灰水;【实验探究】(1) ( http: / / www.21cnjy.com )气球变大(合理说法均可);(2)将氢氧化钠溶液换成等体积的水,与加入氢氧化钠溶液的实验现象进行对比;
(3)
实验步骤 实验现象 实验结论
取③实验后的溶液少许,再向其加入 稀盐酸(或氯化钙溶液等) 有气泡产生(或有白色沉淀生成等) 验证了二氧化碳和氢氧化钠溶液反应
【反思拓展】检验生成物.
变式一:探究一:有气泡冒出 【实验验证】酚酞,溶液变成红色;
【实验反思】排除因硫酸的加入,稀释氢氧化钠溶液而引起pH减小因素的干扰.
二、氢氧化钠的变质检验
例题二:(1)该溶液部分变质 (2)向其中滴加过量的CaCl2(或BaCl2)溶液 (3)密封
变式二:(1)2KOH+CO2=K2CO3+ ( http: / / www.21cnjy.com )H2O (2)有无色气泡产生 (3)①过滤 ②CaCO3 ③将碳酸钾完全反应掉,防止对接下来的实验干扰 (4)作钾肥(制取氯化钾等)
三、有关酸碱反应是否发生
例题三:⑴NaOH+HCl=NaCl+H2O ⑵10
⑶NaCl、NaOH(或氯化钠、氢氧化钠)
变式三:实验一:溶液变红,HCl+NaOH═NaCl+H2O;
实验二:二,此时溶液呈无色,而氢氧化钠能使酚酞试液变红;
设计实验:
实验操作 实验现象 实验结论
取反应后的溶液于试管中,加入 石蕊试液 溶液变红 猜想三成立
拓展应用:碱性物质.
四、离子溶液的探究
例题四: HNO3;HNO3;;;Ba(NO3)2Ba(NO3)2;AgNO3
变式四:(1)①NaOH、BaCl2 ( http: / / www.21cnjy.com )、Na2CO3或BaCl2、NaOH、Na2CO3或BaCl2、Na2CO3、NaOH;NaOH、BaCl2、Na2CO3或BaCl2、NaOH、Na2CO3或BaCl2、Na2CO3、NaOH2-1-c-n-j-y
稍待片刻,待沉淀沉降完毕,上层出现清液,向上层清液中继续滴加氯化钡溶液,无沉淀生成,则沉淀完全 ②除去过量的氢氧化钠和碳酸钠 ③搅拌;引流 (2)2NaCl+2H2O2NaOH+Cl2↑+H2↑;用湿润的KI淀粉试纸放在阳极区气体中,试纸变蓝色,证明有氯气生成稍待片刻,待沉淀沉降完毕,上层出现清液,向上层清液中继续滴加氯化钡溶液,无沉淀生成,则沉淀完全
【巩固练习】
1.CBDBA
2. C02气体能与NaOH溶液反应而被吸收,使罐内气压减小
2A1+2NaOH +2H2O == 2NaAlIO2 + 3H2 ↑
3.(1)乙.
(2)氢氧化钠和空气中的二氧化碳反应生成了碳酸钠,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳.
(3)取反应后的溶液,加入足量CaCl ( http: / / www.21cnjy.com )2溶液(或BaCl2溶液等),静置,取上层清液滴加酚酞溶液.若溶液变成红色,则溶质为Na2CO3和NaOH;若溶液没有变成红色,则溶质只有Na2CO3.
4.(1)酚酞溶液;稀盐酸;
(2)石蕊试液在碱性溶液中为蓝色,在中性溶液中为紫色,当恰好完全反应时的颜色变化不明显;
(3)B.
5.H2SO4+2NaOH═Na2SO4 +2H2O; 猜想四或四; NaOH或氢氧化钠;
有气泡产生; pH试纸浸入溶液中;
BaCl2与Na2SO4反应也会生成白色沉淀,不能证明一定有H2SO4存在(其他合理答案均可)
6. 仪器不干净,含有酸性物质(合理均可)
(1)
实验步骤 设计这一步骤的目的 实验现象 实验结论
1.将NaOH溶液加热煮沸 除去溶液中的氧气 溶液变红,过一会儿红色消失 甲同学猜想正确_
2.向冷却后的…… 隔绝氧气
(2)2NaOH+CO2 =Na2CO3+H2O 若制取的二氧化碳气体中混有氯化氢气体,试管中溶液的红色也能褪去
7.【做出猜想】盐酸和氯化钙
【方案设计】碳酸钠溶液,有气泡冒出
【方案反思】酚酞遇碱变红,在中性和酸性时都不变色,所以通过酚酞不变色就认定只有氯化钙不全面,还可能是含有盐酸和氯化钙;
【反思与拓展】向废液中加入碳酸钙,当不再产生气泡时,停止加入碳酸钙,过滤既得只含有氯化钙的废液
【结论】反应物是否过量
8. NaCl和NaOH;氢氧化钠 ( http: / / www.21cnjy.com )可以和稀盐酸反应,所以盐酸和氢氧化钠不能共存; 产生气泡; 取反应后的溶液于试管中,加入氯化铜溶液等铜盐溶液
NaOH溶液的体积/mL
b
pH
7
a
0 10 20
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
