专题1 物质的分类及计量 测试卷 (含解析)2022-2023学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题1 物质的分类及计量 测试卷 (含解析)2022-2023学年高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 209.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-23 08:17:34 | ||
图片预览




文档简介
专题1《物质的分类及计量》测试卷
一、单选题
1.在洗衣皂中掺入硅酸钠()可缓冲洗衣皂的碱性,减少洗衣皂在水中的损耗。关于硅酸钠的分类错误的是
A.化合物 B.酸 C.钠盐 D.硅酸盐
2.NA为阿伏加德罗常数的数值,下列叙述不正确的是
A.20℃时,1.01×105Pa,64gSO2中含有的原子数为3NA
B.0.1molMg变成镁离子时失去了0.2NA个电子
C.在标准状况下,11.2LH2O含有的分子数为0.5NA
D.16g氧气和16g臭氧所含的原子数均为NA
3.下列叙述中不正确的是
A.纯碱和烧碱都属于碱
B.氧气和臭氧互为同素异形体
C.二氧化碳和三氧化硫都属于酸性氧化物
D.熔融的能导电,所以是电解质
4.用NA表示阿伏加德罗常数,下列各选项中正确的是( )
A.2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
B.等质量的NO2和N2O4相比,前者原子数小
C.1L0.1mol/LNaHCO3溶液中含有氧原子数0.3NA
D.常温常压下,0.2molCO2的体积大于4.48L
5.下列物质中,属于电解质的是( )
A.水银 B.硝酸钾 C.酒精 D.蔗糖
6.下列关于物质分类都正确的一组是
选项 碱 酸 盐 碱性氧化物 酸性氧化物
A Na2CO3 H2SO4 NaHCO3 SiO2 CO2
B NaOH H2CO3 NaCl Na2O CO
C KOH CH3COOH NaAlO2 SO3 SO2
D Mg(OH)2 HNO3 CaCO3 CaO SiO2
A.A B.B C.C D.D
7.用表示阿伏加德罗常数的值,下列叙述正确的是
A.含有个氦原子的氦气在标准状况下的体积约为11.2L
B.32g和的混合气体所含原子数为
C.标准状况下,11.2L含有的原子数为
D.常温常压下,44g含有的电子数为
8.设NA为阿伏加德罗常数的值。下列判断不正确的是
A.N2和H2在密闭容器中反应生成0.1mol NH3时,转移电子数为0.3NA
B.14 g乙烯和环丙烷()的混合气体中含有的碳原子数为1.0NA
C.1 mol FeBr2和1 molCl2充分反应后,转移电子数为2NA
D.4.48LO2和O3的混合气体中含有氧原子数目为0.2NA
9.下列说法正确的是( )
A.9g水中含有的原子总数为1.5×6.02×1023
B.1.0mol·L-1氯化镁溶液中含有Cl-数为2.0×6.02×1023
C.标准状况下,11.2L四氯化碳中含有的分子数为0.5×6.02×1023
D.钠与水反应时,每反应0.1mol钠,转移电子数为0.2×6.02×1023
10.下列电离方程式书写正确的是
A.FeCl3=Fe2++3Cl- B.Ba(OH)2=Ba2++(OH-)2
C.H2SO4=2H++SO D.NaHCO3=Na++H++CO
11.NA表示阿伏加 德罗常数的值,下列说法正确的是( )
A.2 g H2所含的原子数目为NA
B.标准状况下,22.4 L水中含有水分子数为NA
C.常温下,1 L 0.1 mol·L―1的MgCl2溶液中含有的Cl―数为0.2 NA
D.常温常压下,11.2 L CH4中含有的氢原子数为2 NA
12.下列过程中,只包含物理过程的是()
A.蛋白质溶液中加入饱和(NH4)2SO4溶液 B.石灰粉刷的墙壁日久变硬
C.自来水生产时的“沉降”过程 D.用“氧立得”制取氧气
13.标准状况下,32g的甲烷(CH4)的体积为
A.5.6L B.22.4 L C.11.2 L D.44.8 L
14.下列物质中,所含分子数最多的是( )
A.10g H2 B.2mol Cl2
C.1.5NA CO2 D.22.4L O2(标准状况下)
15.某同学对胶体的有关认识正确的是( )
A.氯化钠注射液能产生丁达尔效应,属于胶体
B.通电时溶液中的溶质粒子向两极移动,而胶体分散质粒子向某一极移动
C.Fe(OH)3胶体具有吸附性,可用于净水
D.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
二、填空题
16.下列物质属于电解质的是______;能导电的是_____;属于弱电解质的是______(均填写序号)。
①醋酸溶液②乙醇③胆矾④熔融氯化钠⑤二氧化硫⑥氨水⑦硫酸钡⑧蔗糖⑨氢氧化铁⑩浓盐酸
17.下列物质中,能导电的是____,属于电解质的是____(填序号):
①Cu、②CO2、③氯化钠晶体、④硫酸溶液、⑤干冰、⑥BaSO4、⑦金刚石
三、实验题
18.现有甲、乙、丙三名同学分别进行胶体的制备实验。
甲同学:向的溶液中加少量NaOH溶液。
乙同学:向25mL沸水中逐滴加入5~6滴饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
丙同学:直接加热饱和溶液。
试回答下列问题
(1)其中操作正确的同学是_______,反应的化学方程式为_______。
(2)证明有胶体生成的方法是_______。
(3)将其装入U型管内,用石墨棒做电极,接通直流电源,通电一段时间后发现阴极附近颜色_______,这表明_______。
(4)向其中逐滴加入过量稀硫酸,现象是_______。
(5)可用如图所示的装置除去胶体中的杂质离子来提纯胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入溶液,若_______(填实验现象),则说明该胶体中的杂质离子已经完全除去。
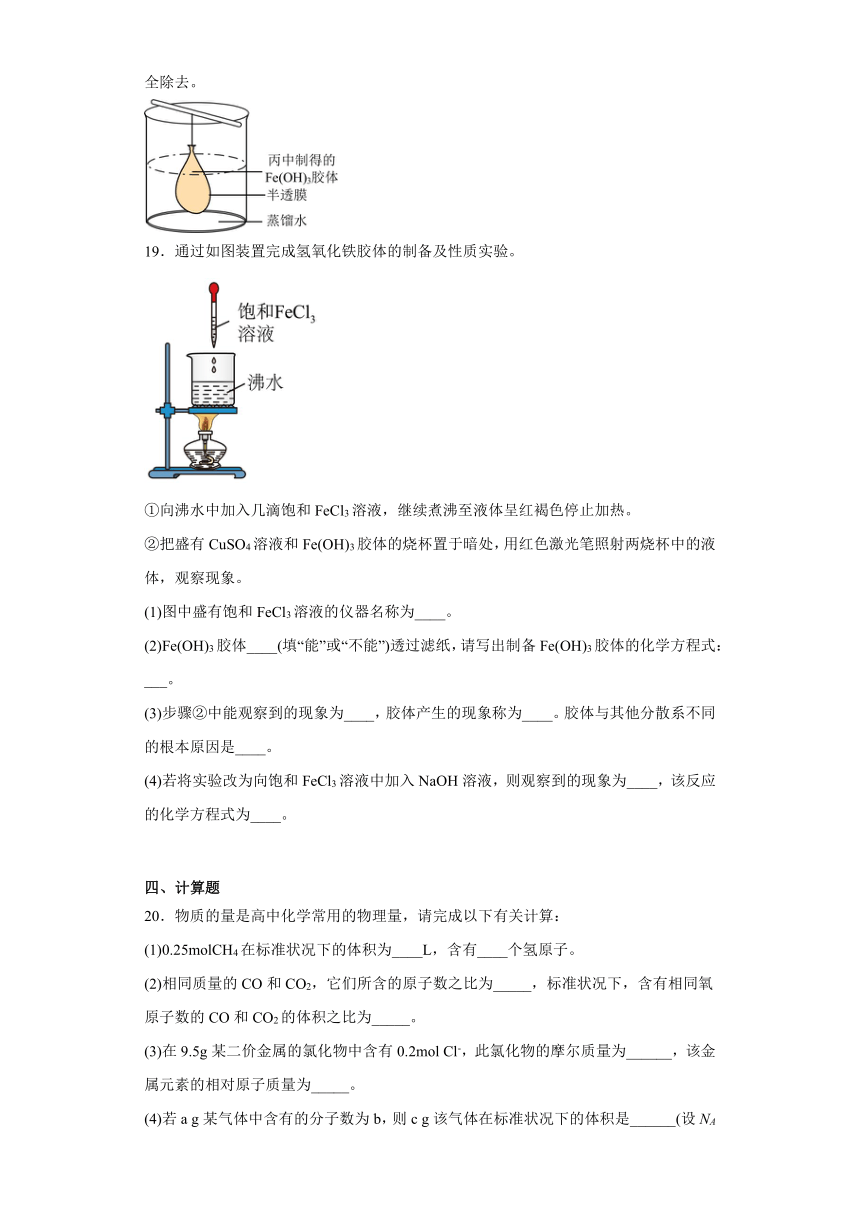
19.通过如图装置完成氢氧化铁胶体的制备及性质实验。
①向沸水中加入几滴饱和FeCl3溶液,继续煮沸至液体呈红褐色停止加热。
②把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处,用红色激光笔照射两烧杯中的液体,观察现象。
(1)图中盛有饱和FeCl3溶液的仪器名称为____。
(2)Fe(OH)3胶体____(填“能”或“不能”)透过滤纸,请写出制备Fe(OH)3胶体的化学方程式:___。
(3)步骤②中能观察到的现象为____,胶体产生的现象称为____。胶体与其他分散系不同的根本原因是____。
(4)若将实验改为向饱和FeCl3溶液中加入NaOH溶液,则观察到的现象为____,该反应的化学方程式为____。
四、计算题
20.物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)0.25molCH4在标准状况下的体积为____L,含有____个氢原子。
(2)相同质量的CO和CO2,它们所含的原子数之比为_____,标准状况下,含有相同氧原子数的CO和CO2的体积之比为_____。
(3)在9.5g某二价金属的氯化物中含有0.2mol Cl-,此氯化物的摩尔质量为______,该金属元素的相对原子质量为_____。
(4)若a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是______(设NA为阿伏加 德罗常数的值)。
(5)标准状况下有①0.112L水 ②0.5NA个HCl分子③25.6g SO2气体 ④0.2mol氨气⑤2mol Ne所含原子个数从大到小的顺序为____。
(6)6.72L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量为____g。
(7)某温度时,一定量的元素A的气态氢化物AH3,在恒温密闭容器中分解为两种气体单质,此时压强增加了75%,则AH3分解反应的化学方程式______。
21.化学计量在化学中占有重要的地位,请回答下列问题设表示阿伏加德罗常数的值。
(1)标准状况下,0.2molNH3的体积是__________L,其中含有的NH3分子数是__________个,含氢原子数是_______个,其中含有的电子数是__________个,其中含有的质子数是__________个。
(2)49g的H2SO4中含有______mol氧原子,能与______molNaOH恰好完全反应。
(3)已知16gA和20gB恰好完全反应生成0.04molC和31.7gD,则C的摩尔质量为_________g/mol。
试卷第2页,共5页
参考答案:
1.B
【详解】A.Na2SiO3的水溶液中能电离出钠离子和硅酸根离子,由三种元素组成的纯净物,属于化合物,选项A正确;
B.Na2SiO3的水溶液中能电离出钠离子和硅酸根离子,属于盐不属于酸,选项B错误;
C.Na2SiO3的水溶液中能电离出钠离子和硅酸根离子,属于钠盐,选项C正确;
D.Na2SiO3的水溶液中能电离出钠离子和硅酸根离子,属于硅酸盐,选项D正确;
答案选B。
2.C
【详解】A.二氧化硫含有3个原子,64g二氧化硫的物质的量为,含有3mol原子,含有的原子数为3NA,故A正确;
B.镁原子失去2个电子变成镁离子,0.1molMg变成镁离子时失去了0.2NA个电子,故B正确;
C.标况下,水不是气体,不能使用标况下的气体摩尔体积计算11.2L水的物质的量及分子数,故C错误;
D.16gO2的物质的量,故含有的氧原子数N=0.5mol×2×NA=NA;16gO3的物质的量 mol,故含有的氧原子数N=mol×3NA=NA,故D正确;
故选:C。
3.A
【详解】A.纯碱是碳酸钠,为盐类,A错误;
B.氧气和臭氧,均为由氧元素组成的单质,B正确;
C.二氧化碳和三氧化硫溶于水,只生成酸,故为酸性氧化物,C正确;
D.熔融状态下,氯化镁电离出镁离子和氯离子,有自由移动的离子,能导电,为电解质,D正确;
故答案为:A。
4.D
【详解】A.没有指明温度和压强,2.24LCO和CO2混合气体的物质的量不一定为0.1mol,所以含有的碳原子数目不一定为0.1NA,故A错误;
B.NO2和N2O4的最简式均为NO2,等质量的NO2和N2O4相比,最简式NO2的物质的量相同,则两者原子数相同,故B错误;
C.1L0.1mol/LNaHCO3溶液中,溶剂水中也含有O原子,氧原子数大于0.3NA,故C错误;
D.标准状况下,0.2molCO2的体积为4.48L,升高温度,气体体积膨胀,常温常压下,0.2molCO2的体积大于4.48L,故D正确;
故选D。
5.B
【详解】A.水银是单质不是化合物,所以水银不属于电解质,故A错误;
B.硝酸钾是在水溶液中或熔融状态下均能导电的化合物,属于电解质,故B正确;
C.酒精在水溶液中和熔融状态下均不能导电,属于非电解质,故C错误;
D.蔗糖在水溶液中和熔融状态下均不能导电,属于非电解质,故D错误;
故选B。
6.D
【详解】A.Na2CO3是盐,SiO2是酸性氧化物,A错误;
B.CO既不能和酸反应又不能和碱反应,CO是不成盐氧化物,B错误;
C.SO3是酸性氧化物,C错误;
D.Mg(OH)2是碱、HNO3是酸、CaCO3是盐、CaO是碱性氧化物、SiO2是酸性氧化物,D正确;
选D。
7.D
【详解】A.氦气为单原子分子,故含NA个氦原子的氦气的物质的量为1mol,故在标况下为22.4L,故A错误;
B.氧气和臭氧均由氧原子构成,故32g混合物中含有的氧原子的物质的量为2mol,个数为2NA个,故B错误;
C.标况下水为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D.44g二氧化碳的物质的量为1mol,而二氧化碳中含22个电子,故1mol二氧化碳中含22NA个原子,故D正确;
故选D。
8.D
【详解】A.N2和H2在密闭容器中反应生成0.1mol NH3时,转移电子数为=0.3NA,A正确;
B.乙烯和环丙烷()的最简式为“CH2”,14 g CH2中含C原子数为=1.0NA,B正确;
C.FeBr2和Cl2完全反应的离子方程式为4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2,1 mol FeBr2完全反应消耗1.5molCl2,故1 mol FeBr2和1 molCl2完全反应时Cl2不足量,其完全反应,所以转移电子数目为=2NA,C正确;
D.未指明是否是标准状况,所以无法准确计算4.48LO2和O3的混合气体的物质的量,D错误;
故选D。
9.A
【详解】A. 9g水中含有的原子总数为1.5×6.02×1023,故A正确;
B. 没有溶液体积,不能计算1.0mol·L-1氯化镁溶液中含有Cl-数目,故B错误;
C. 标准状况下,四氯化碳是液体,11.2L四氯化碳的物质的量不是0.5mol,故C错误;
D. 钠与水反应生成氢氧化钠和氢气,钠元素化合价由0变为+1,每反应0.1mol钠,转移电子数为0.1×6.02×1023,故D错误。
10.C
【详解】A.FeCl3在水溶液中电离出Fe3+、Cl-,电离方程式是FeCl3=Fe3++3Cl-,故A错误;
B.Ba(OH)2在水溶液中电离出Ba2+、OH-,电离方程式是Ba(OH)2=Ba2++2OH-,故B错误;
C.H2SO4在水溶液中电离出H+、SO,电离方程式是H2SO4=2H++SO,故C正确;
D.NaHCO3在水溶液中电离出Na+、HCO,电离方程式是NaHCO3= Na++HCO,故D错误;
选C。
11.C
【详解】A. 2 g H2的物质的量为1mol,所含的原子数为2 NA,A错误;
B. 标况下水为固液共存状态,无法使用气体摩尔体积进行计算,B错误;
C. 常温下,1 L 0.1 mol·L―1的MgCl2溶液中含有的Cl―数为0.2 NA,C正确;
D. 常温常压下气体摩尔体积不为22.4L/mol,D错误;
故答案选C。
【点睛】气体摩尔体积为22.4L/mol仅限标况下气体使用。
12.A
【详解】A.蛋白质溶液中加入饱和(NH4)2SO4溶液只发生蛋白质的盐析,该过程为物理过程,故A符合;
B.石灰粉刷的墙壁日久变硬是由于熟石灰吸收空气中的二氧化碳变成碳酸钙,为化学变化过程,故B符合;
C.自来水生产时的“沉降”过程包含铝离子的水解过程,为化学变化,故C不符合;
D.用“氧立得”制取氧气时发生氧化还原反应生成氧气,故D不符合;
故答案为A。
13.D
【详解】32g甲烷的物质的量为=2mol,标准状况下,气体的体积为2mol×22.4L/mol = 44.8L,故选D。
14.A
【详解】A、根据,10g H2的物质的量是5mol,H2分子数是5NA;
B、2mol Cl2,Cl2分子数是2NA;
C、CO2分子数是1.5NA;
D、根据, 22.4L O2(标准状况下)的物质的量是1mol,O2分子数是NA;
故选A。
【点睛】本题考查了物质的量和物质的质量、物质微粒数的换算关系,掌握概念实质和计算公式是解题关键。
15.C
【详解】A. 氯化钠注射液属于溶液,没有丁达尔效应,故A错误;
B. 通电时若溶液中溶质是电解质,则溶液中的溶质粒子向两极移动,若溶质为非电解质,则溶质离子不移动,故B错误;
C. Fe(OH)3胶体具有吸附性,可以吸附水中的悬浮物质,所以可用于净水,故C正确;
D. 向饱和FeCl3溶液中滴加过量氨水,反应生成Fe(OH)3沉淀,故D错误;
故选C。
16. ③④⑦⑨ ①④⑥⑩ ⑨
【分析】根据电解质、强电解质、弱电解质的概念分析,结合导电的物质要有能够自由移动的电子或离子分析。
【详解】①醋酸溶液是混合物,醋酸为弱电解质,醋酸在溶液中会部分电离才自由移动的离子,因此醋酸溶液导电;
②乙醇是由乙醇分子构成的物质,不能电离产生自由移动的离子,因此属于非电解质,不能导电;
③胆矾是硫酸铜晶体,在晶体中含有铜离子和硫酸根离子构成,固体没有自由移动的离子,所以不导电;在水溶液中或熔融状态下,能电离出自由移动的铜离子和硫酸根离子导电,胆矾是电解质;
④氯化钠是盐,由Na+和Cl-构成,是强电解质;熔融氯化钠中含有自由移动的钠离子和氯离子,能导电;它是化合物,属于电解质;
⑤二氧化硫是由分子构成的物质,不存在自由移动的离子,所以不能导电;二氧化硫在水溶液中与水反应生成亚硫酸,亚硫酸电离出自由移动的离子导电,二氧化硫自身不能电离,二氧化硫是非电解质;
⑥氨水是混合物,既不是电解质,也不是非电解质,在溶液中存在能自由移动的离子,能导电;
⑦硫酸钡是难溶性的盐,由离子构成,在熔融状态下电离产生Ba2+、SO42-,溶于水的硫酸钡完全电离产生自由移动的离子,属于强电解质,由于溶解度很小,自由移动的离子很小,不导电;
⑧蔗糖是由蔗糖分子构成的物质,没有自由移动的离子,所以不能导电;蔗糖是化合物,在水溶液中和熔融状态下只存在蔗糖分子,没有自由移动的离子,所以不能导电,属于非电解质;
⑨氢氧化铁是弱碱,没有自由移动的离子不导电;溶解于水的部分电离产生自由移动的离子,存在电离平衡,所以氢氧化铁属于弱电解质;
⑩浓盐酸是HCl的水溶液,属于混合物,不属于电解质,盐酸溶液中存在自由移动的离子,所以盐酸能导电。
故属于电解质的是③④⑦⑨;能导电的是①④⑥⑩;属于弱电解质的是⑨。
【点睛】本题考查了物质的分类及其判断,掌握电解质、非电解质、强电解质、弱电解质的概念是本题判断的依据,理解能够导电的物质不一定是电解质,电解质不一定能够导电,电解质发生电离作用后才能导电,电解质溶液导电能力强弱与电解质强弱无关,只与离子浓度和离子带有的电荷数目有关。
17. ①④ ③⑥
【分析】金属、电解质溶液或熔融态的电解质能导电,水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;
【详解】①Cu是能导电的金属,不是化合物,因此既不是电解质也不是非电解质;
②CO2分子构成的,不导电,二氧化碳溶于水后自身不能发生电离,属于非电解质;
③氯化钠晶体中的离子不能自由移动,因此不导电,氯化钠溶于水后自身能发生电离,属于电解质;
④硫酸溶液中含有自由移动的离子,可以导电,硫酸溶液是混合物,因此既不是电解质也不是非电解质;
⑤干冰是由二氧化碳分子构成的,不导电,二氧化碳溶于水后自身不能发生电离,属于非电解质;
⑥BaSO4中的离子不能自由移动,因此不导电,BaSO4在熔融状态下可以发生电离,因此属于电解质;
⑦金刚石是不导电的非金属单质,不是化合物,因此既不是电解质也不是非电解质;
能导电的是①④,属于电解质的是③⑥。
18.(1) 乙 FeCl3+3H2OFe(OH)3(胶体)+3HCl
(2)丁达尔效应
(3) 加深 Fe(OH)3胶体粒子带正电荷
(4)先出现红褐色沉淀,沉淀又逐渐溶解
(5)无白色沉淀生成
【解析】(1)
甲同学:向的溶液中加少量NaOH溶液,会发生复分解反应生成红褐色沉淀;
乙同学:向25mL沸水中逐滴加入5~6滴饱和溶液,继续煮沸至溶液呈红褐色,停止加热,可以制得胶体;
丙同学:直接加热饱和溶液,三价铁离子会水解生成红褐色沉淀;
Fe(OH)3胶体制备的化学方程式为:FeCl3+3H2OFe(OH)3(胶体)+3HCl。
(2)
丁达尔效应是胶体的特有性质,可用来鉴别胶体。
(3)
将其装入U型管内,用石墨棒做电极,接通直流电源,通电一段时间后发现阴极附近颜色加深,这表明Fe(OH)3胶体粒子带正电荷。
(4)
胶体溶液加入电解质溶液,会发生胶体的聚沉,然后氢氧化铁和硫酸发生化学反应溶解,则向其中逐滴加入过量稀硫酸,现象是先出现红褐色沉淀,沉淀又逐渐溶解。
(5)
银离子和氯离子反应生成氯化银沉淀,则提纯若干次后,加入溶液,若无白色沉淀生成,则说明该胶体中的杂质离子已经完全除去。
19.(1)胶头滴管
(2) 能 FeCl3+3H2OFe(OH)3(胶体)+3HCl
(3) 当光束通过氢氧化铁胶体时,可以看到一条光亮的“通路”,而光束通过硫酸铜溶液时,则看不到此现象 丁达尔效应 分散质粒子的直径大小不同
(4) 生成红褐色沉淀 FeCl3+3NaOH=Fe(OH)3↓+3NaCl
【分析】氢氧化铁胶体的制备原理为FeCl3+3H2OFe(OH)3(胶体)+3HCl,具体操作为向沸水中加入几滴饱和FeCl3溶液,继续煮沸至液体呈红褐色停止加热,得到的胶体可以产生丁达尔效应,据此分析解答。
【详解】(1)盛有饱和FeCl3溶液的仪器名称为胶头滴管;
(2)Fe(OH)胶体能透过滤纸,制备Fe(OH)3胶体的离子方程式为FeCl3+3H2OFe(OH)3(胶体)+3HCl;
(3)步骤2中能观察到的现象为当光束通过氢氧化铁胶体时,可以看到一条光亮的“通路”, 而光束通过硫酸铜溶液时,则看不到此现象,胶体产生的该现象称为丁达尔效应;胶体与其他分散系不同的根本原因是分散质粒子的直径不同;
(4)若将实验改为向饱和FeCl3溶液中加入NaOH溶液,则观察到的现象为生成红褐色沉淀,该反应的化学方程式为FeCl3+ 3NaOH= Fe(OH)3↓+3NaCl。
20. 5.6 6.02×1023(或NA) 22:21 2:1 95g.mol-1 24 L ①>⑤>③>②>④ 11.2 4AH3=A4+6H2
【详解】(1)标准状况下气体摩尔体积为22.4L/mol,0.25mol甲烷的体积V=n·Vm=0.25mol×22.4L/mol=5.6L;0.25mol甲烷中含有氢原子个数N=n·NA=0.25mol×4×6.02×1023=6.02×1023个;
(2)相同质量的CO和CO2,它们的物质的量比为=11:7,一个CO中含有2个原子,一个CO2中含有3个原子,则相同质量的CO和CO2,它们所含的原子数之比为11×2:7×3=22:21;含有相同氧原子数的CO和CO2,它们的物质的量的比为2:1,则他们的体积比为2×22.4L/mol:1×22.4L/mol=2:1;
(3)某二价金属的氯化物中含有0.2molCl-,其物质的量为0.1mol,又已知其质量m=9.5g,则该氯化物的摩尔质量M===95g·mol-1;物质的摩尔质量在数值上等于其相对分子质量,故该二价金属的相对原子质量Ar=95-2×35.5=24;
(4)若a g某气体中含有的分子数为b,则c g该气体含有的分子数为个,c g该气体的物质的量n==mol,则标况下c g该气体的体积V=n·Vm=L;
(5)标准状况下0.112L水的质量为112g,其物质的量n≈6.22mol,则含有的原子的个数N≈18.67NA个;0.5NA个HCl分子含有的原子个数N=NA个;25.6g SO2气体的物质的量n=0.4mol,则含有的原子的个数N=1.2NA个;0.2mol氨气含有的原子个数N=0.8NA个;Ne为单原子分子,则2mol Ne含有的原子个数N=2NA个,综上5中物质中原子个数从大到小的顺序为①>⑤>③>②>④;
(6)标准状况下6.72L CO的物质的量n===0.3mol,CO还原Fe2O3的化学方程式为3CO+Fe2O33CO2+2Fe,有化学方程式可知,0.3molCO还原一定量的Fe2O3可以生成0.2mol的Fe,则0.2mol Fe的质量m=n·M=0.2mol×56g/mol=11.2g;
(7)设A的单质为Am,则可将反应方程式写成2mAH3=2Am+3mH2,反应后压强增加的75%,根据阿伏伽德罗定律及其推论,压强比等于物质的量的比,则有=1+75%,解得m=4,故反应方程式为4AH3=A4+6H2。
21. 1
【详解】(1) 标准状况下,0.2molNH3的体积是V=nVm=0.2mol×22.4L/mol=4.48L;
其中含有的NH3分子数是N(NH3)=nNA=0.2mol×NA/mol=0.2NA;
含氢原子数是0.2NA×3=0.6NA个;
其中含有的电子数是0.2NA×10=2NA个;
其中含有的质子数是0.2NA×10=2NA个;
(2)49g H2SO4物质的量为=0.5mol,含有0.5 mol×4=2 mol氧原子;
1mol硫酸能与2molNaOH,则与0.5molH2SO4完全反应的NaOH为0.5mol×2=1mol;
(3)16g A和20g B 恰好完全反应生成0.04mol C 和31.76g D,由质量守恒可知m(C)=16g+20g-31.76g=4.24g,M(C)==106g/mol
一、单选题
1.在洗衣皂中掺入硅酸钠()可缓冲洗衣皂的碱性,减少洗衣皂在水中的损耗。关于硅酸钠的分类错误的是
A.化合物 B.酸 C.钠盐 D.硅酸盐
2.NA为阿伏加德罗常数的数值,下列叙述不正确的是
A.20℃时,1.01×105Pa,64gSO2中含有的原子数为3NA
B.0.1molMg变成镁离子时失去了0.2NA个电子
C.在标准状况下,11.2LH2O含有的分子数为0.5NA
D.16g氧气和16g臭氧所含的原子数均为NA
3.下列叙述中不正确的是
A.纯碱和烧碱都属于碱
B.氧气和臭氧互为同素异形体
C.二氧化碳和三氧化硫都属于酸性氧化物
D.熔融的能导电,所以是电解质
4.用NA表示阿伏加德罗常数,下列各选项中正确的是( )
A.2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
B.等质量的NO2和N2O4相比,前者原子数小
C.1L0.1mol/LNaHCO3溶液中含有氧原子数0.3NA
D.常温常压下,0.2molCO2的体积大于4.48L
5.下列物质中,属于电解质的是( )
A.水银 B.硝酸钾 C.酒精 D.蔗糖
6.下列关于物质分类都正确的一组是
选项 碱 酸 盐 碱性氧化物 酸性氧化物
A Na2CO3 H2SO4 NaHCO3 SiO2 CO2
B NaOH H2CO3 NaCl Na2O CO
C KOH CH3COOH NaAlO2 SO3 SO2
D Mg(OH)2 HNO3 CaCO3 CaO SiO2
A.A B.B C.C D.D
7.用表示阿伏加德罗常数的值,下列叙述正确的是
A.含有个氦原子的氦气在标准状况下的体积约为11.2L
B.32g和的混合气体所含原子数为
C.标准状况下,11.2L含有的原子数为
D.常温常压下,44g含有的电子数为
8.设NA为阿伏加德罗常数的值。下列判断不正确的是
A.N2和H2在密闭容器中反应生成0.1mol NH3时,转移电子数为0.3NA
B.14 g乙烯和环丙烷()的混合气体中含有的碳原子数为1.0NA
C.1 mol FeBr2和1 molCl2充分反应后,转移电子数为2NA
D.4.48LO2和O3的混合气体中含有氧原子数目为0.2NA
9.下列说法正确的是( )
A.9g水中含有的原子总数为1.5×6.02×1023
B.1.0mol·L-1氯化镁溶液中含有Cl-数为2.0×6.02×1023
C.标准状况下,11.2L四氯化碳中含有的分子数为0.5×6.02×1023
D.钠与水反应时,每反应0.1mol钠,转移电子数为0.2×6.02×1023
10.下列电离方程式书写正确的是
A.FeCl3=Fe2++3Cl- B.Ba(OH)2=Ba2++(OH-)2
C.H2SO4=2H++SO D.NaHCO3=Na++H++CO
11.NA表示阿伏加 德罗常数的值,下列说法正确的是( )
A.2 g H2所含的原子数目为NA
B.标准状况下,22.4 L水中含有水分子数为NA
C.常温下,1 L 0.1 mol·L―1的MgCl2溶液中含有的Cl―数为0.2 NA
D.常温常压下,11.2 L CH4中含有的氢原子数为2 NA
12.下列过程中,只包含物理过程的是()
A.蛋白质溶液中加入饱和(NH4)2SO4溶液 B.石灰粉刷的墙壁日久变硬
C.自来水生产时的“沉降”过程 D.用“氧立得”制取氧气
13.标准状况下,32g的甲烷(CH4)的体积为
A.5.6L B.22.4 L C.11.2 L D.44.8 L
14.下列物质中,所含分子数最多的是( )
A.10g H2 B.2mol Cl2
C.1.5NA CO2 D.22.4L O2(标准状况下)
15.某同学对胶体的有关认识正确的是( )
A.氯化钠注射液能产生丁达尔效应,属于胶体
B.通电时溶液中的溶质粒子向两极移动,而胶体分散质粒子向某一极移动
C.Fe(OH)3胶体具有吸附性,可用于净水
D.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
二、填空题
16.下列物质属于电解质的是______;能导电的是_____;属于弱电解质的是______(均填写序号)。
①醋酸溶液②乙醇③胆矾④熔融氯化钠⑤二氧化硫⑥氨水⑦硫酸钡⑧蔗糖⑨氢氧化铁⑩浓盐酸
17.下列物质中,能导电的是____,属于电解质的是____(填序号):
①Cu、②CO2、③氯化钠晶体、④硫酸溶液、⑤干冰、⑥BaSO4、⑦金刚石
三、实验题
18.现有甲、乙、丙三名同学分别进行胶体的制备实验。
甲同学:向的溶液中加少量NaOH溶液。
乙同学:向25mL沸水中逐滴加入5~6滴饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
丙同学:直接加热饱和溶液。
试回答下列问题
(1)其中操作正确的同学是_______,反应的化学方程式为_______。
(2)证明有胶体生成的方法是_______。
(3)将其装入U型管内,用石墨棒做电极,接通直流电源,通电一段时间后发现阴极附近颜色_______,这表明_______。
(4)向其中逐滴加入过量稀硫酸,现象是_______。
(5)可用如图所示的装置除去胶体中的杂质离子来提纯胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入溶液,若_______(填实验现象),则说明该胶体中的杂质离子已经完全除去。
19.通过如图装置完成氢氧化铁胶体的制备及性质实验。
①向沸水中加入几滴饱和FeCl3溶液,继续煮沸至液体呈红褐色停止加热。
②把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处,用红色激光笔照射两烧杯中的液体,观察现象。
(1)图中盛有饱和FeCl3溶液的仪器名称为____。
(2)Fe(OH)3胶体____(填“能”或“不能”)透过滤纸,请写出制备Fe(OH)3胶体的化学方程式:___。
(3)步骤②中能观察到的现象为____,胶体产生的现象称为____。胶体与其他分散系不同的根本原因是____。
(4)若将实验改为向饱和FeCl3溶液中加入NaOH溶液,则观察到的现象为____,该反应的化学方程式为____。
四、计算题
20.物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)0.25molCH4在标准状况下的体积为____L,含有____个氢原子。
(2)相同质量的CO和CO2,它们所含的原子数之比为_____,标准状况下,含有相同氧原子数的CO和CO2的体积之比为_____。
(3)在9.5g某二价金属的氯化物中含有0.2mol Cl-,此氯化物的摩尔质量为______,该金属元素的相对原子质量为_____。
(4)若a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是______(设NA为阿伏加 德罗常数的值)。
(5)标准状况下有①0.112L水 ②0.5NA个HCl分子③25.6g SO2气体 ④0.2mol氨气⑤2mol Ne所含原子个数从大到小的顺序为____。
(6)6.72L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量为____g。
(7)某温度时,一定量的元素A的气态氢化物AH3,在恒温密闭容器中分解为两种气体单质,此时压强增加了75%,则AH3分解反应的化学方程式______。
21.化学计量在化学中占有重要的地位,请回答下列问题设表示阿伏加德罗常数的值。
(1)标准状况下,0.2molNH3的体积是__________L,其中含有的NH3分子数是__________个,含氢原子数是_______个,其中含有的电子数是__________个,其中含有的质子数是__________个。
(2)49g的H2SO4中含有______mol氧原子,能与______molNaOH恰好完全反应。
(3)已知16gA和20gB恰好完全反应生成0.04molC和31.7gD,则C的摩尔质量为_________g/mol。
试卷第2页,共5页
参考答案:
1.B
【详解】A.Na2SiO3的水溶液中能电离出钠离子和硅酸根离子,由三种元素组成的纯净物,属于化合物,选项A正确;
B.Na2SiO3的水溶液中能电离出钠离子和硅酸根离子,属于盐不属于酸,选项B错误;
C.Na2SiO3的水溶液中能电离出钠离子和硅酸根离子,属于钠盐,选项C正确;
D.Na2SiO3的水溶液中能电离出钠离子和硅酸根离子,属于硅酸盐,选项D正确;
答案选B。
2.C
【详解】A.二氧化硫含有3个原子,64g二氧化硫的物质的量为,含有3mol原子,含有的原子数为3NA,故A正确;
B.镁原子失去2个电子变成镁离子,0.1molMg变成镁离子时失去了0.2NA个电子,故B正确;
C.标况下,水不是气体,不能使用标况下的气体摩尔体积计算11.2L水的物质的量及分子数,故C错误;
D.16gO2的物质的量,故含有的氧原子数N=0.5mol×2×NA=NA;16gO3的物质的量 mol,故含有的氧原子数N=mol×3NA=NA,故D正确;
故选:C。
3.A
【详解】A.纯碱是碳酸钠,为盐类,A错误;
B.氧气和臭氧,均为由氧元素组成的单质,B正确;
C.二氧化碳和三氧化硫溶于水,只生成酸,故为酸性氧化物,C正确;
D.熔融状态下,氯化镁电离出镁离子和氯离子,有自由移动的离子,能导电,为电解质,D正确;
故答案为:A。
4.D
【详解】A.没有指明温度和压强,2.24LCO和CO2混合气体的物质的量不一定为0.1mol,所以含有的碳原子数目不一定为0.1NA,故A错误;
B.NO2和N2O4的最简式均为NO2,等质量的NO2和N2O4相比,最简式NO2的物质的量相同,则两者原子数相同,故B错误;
C.1L0.1mol/LNaHCO3溶液中,溶剂水中也含有O原子,氧原子数大于0.3NA,故C错误;
D.标准状况下,0.2molCO2的体积为4.48L,升高温度,气体体积膨胀,常温常压下,0.2molCO2的体积大于4.48L,故D正确;
故选D。
5.B
【详解】A.水银是单质不是化合物,所以水银不属于电解质,故A错误;
B.硝酸钾是在水溶液中或熔融状态下均能导电的化合物,属于电解质,故B正确;
C.酒精在水溶液中和熔融状态下均不能导电,属于非电解质,故C错误;
D.蔗糖在水溶液中和熔融状态下均不能导电,属于非电解质,故D错误;
故选B。
6.D
【详解】A.Na2CO3是盐,SiO2是酸性氧化物,A错误;
B.CO既不能和酸反应又不能和碱反应,CO是不成盐氧化物,B错误;
C.SO3是酸性氧化物,C错误;
D.Mg(OH)2是碱、HNO3是酸、CaCO3是盐、CaO是碱性氧化物、SiO2是酸性氧化物,D正确;
选D。
7.D
【详解】A.氦气为单原子分子,故含NA个氦原子的氦气的物质的量为1mol,故在标况下为22.4L,故A错误;
B.氧气和臭氧均由氧原子构成,故32g混合物中含有的氧原子的物质的量为2mol,个数为2NA个,故B错误;
C.标况下水为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D.44g二氧化碳的物质的量为1mol,而二氧化碳中含22个电子,故1mol二氧化碳中含22NA个原子,故D正确;
故选D。
8.D
【详解】A.N2和H2在密闭容器中反应生成0.1mol NH3时,转移电子数为=0.3NA,A正确;
B.乙烯和环丙烷()的最简式为“CH2”,14 g CH2中含C原子数为=1.0NA,B正确;
C.FeBr2和Cl2完全反应的离子方程式为4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2,1 mol FeBr2完全反应消耗1.5molCl2,故1 mol FeBr2和1 molCl2完全反应时Cl2不足量,其完全反应,所以转移电子数目为=2NA,C正确;
D.未指明是否是标准状况,所以无法准确计算4.48LO2和O3的混合气体的物质的量,D错误;
故选D。
9.A
【详解】A. 9g水中含有的原子总数为1.5×6.02×1023,故A正确;
B. 没有溶液体积,不能计算1.0mol·L-1氯化镁溶液中含有Cl-数目,故B错误;
C. 标准状况下,四氯化碳是液体,11.2L四氯化碳的物质的量不是0.5mol,故C错误;
D. 钠与水反应生成氢氧化钠和氢气,钠元素化合价由0变为+1,每反应0.1mol钠,转移电子数为0.1×6.02×1023,故D错误。
10.C
【详解】A.FeCl3在水溶液中电离出Fe3+、Cl-,电离方程式是FeCl3=Fe3++3Cl-,故A错误;
B.Ba(OH)2在水溶液中电离出Ba2+、OH-,电离方程式是Ba(OH)2=Ba2++2OH-,故B错误;
C.H2SO4在水溶液中电离出H+、SO,电离方程式是H2SO4=2H++SO,故C正确;
D.NaHCO3在水溶液中电离出Na+、HCO,电离方程式是NaHCO3= Na++HCO,故D错误;
选C。
11.C
【详解】A. 2 g H2的物质的量为1mol,所含的原子数为2 NA,A错误;
B. 标况下水为固液共存状态,无法使用气体摩尔体积进行计算,B错误;
C. 常温下,1 L 0.1 mol·L―1的MgCl2溶液中含有的Cl―数为0.2 NA,C正确;
D. 常温常压下气体摩尔体积不为22.4L/mol,D错误;
故答案选C。
【点睛】气体摩尔体积为22.4L/mol仅限标况下气体使用。
12.A
【详解】A.蛋白质溶液中加入饱和(NH4)2SO4溶液只发生蛋白质的盐析,该过程为物理过程,故A符合;
B.石灰粉刷的墙壁日久变硬是由于熟石灰吸收空气中的二氧化碳变成碳酸钙,为化学变化过程,故B符合;
C.自来水生产时的“沉降”过程包含铝离子的水解过程,为化学变化,故C不符合;
D.用“氧立得”制取氧气时发生氧化还原反应生成氧气,故D不符合;
故答案为A。
13.D
【详解】32g甲烷的物质的量为=2mol,标准状况下,气体的体积为2mol×22.4L/mol = 44.8L,故选D。
14.A
【详解】A、根据,10g H2的物质的量是5mol,H2分子数是5NA;
B、2mol Cl2,Cl2分子数是2NA;
C、CO2分子数是1.5NA;
D、根据, 22.4L O2(标准状况下)的物质的量是1mol,O2分子数是NA;
故选A。
【点睛】本题考查了物质的量和物质的质量、物质微粒数的换算关系,掌握概念实质和计算公式是解题关键。
15.C
【详解】A. 氯化钠注射液属于溶液,没有丁达尔效应,故A错误;
B. 通电时若溶液中溶质是电解质,则溶液中的溶质粒子向两极移动,若溶质为非电解质,则溶质离子不移动,故B错误;
C. Fe(OH)3胶体具有吸附性,可以吸附水中的悬浮物质,所以可用于净水,故C正确;
D. 向饱和FeCl3溶液中滴加过量氨水,反应生成Fe(OH)3沉淀,故D错误;
故选C。
16. ③④⑦⑨ ①④⑥⑩ ⑨
【分析】根据电解质、强电解质、弱电解质的概念分析,结合导电的物质要有能够自由移动的电子或离子分析。
【详解】①醋酸溶液是混合物,醋酸为弱电解质,醋酸在溶液中会部分电离才自由移动的离子,因此醋酸溶液导电;
②乙醇是由乙醇分子构成的物质,不能电离产生自由移动的离子,因此属于非电解质,不能导电;
③胆矾是硫酸铜晶体,在晶体中含有铜离子和硫酸根离子构成,固体没有自由移动的离子,所以不导电;在水溶液中或熔融状态下,能电离出自由移动的铜离子和硫酸根离子导电,胆矾是电解质;
④氯化钠是盐,由Na+和Cl-构成,是强电解质;熔融氯化钠中含有自由移动的钠离子和氯离子,能导电;它是化合物,属于电解质;
⑤二氧化硫是由分子构成的物质,不存在自由移动的离子,所以不能导电;二氧化硫在水溶液中与水反应生成亚硫酸,亚硫酸电离出自由移动的离子导电,二氧化硫自身不能电离,二氧化硫是非电解质;
⑥氨水是混合物,既不是电解质,也不是非电解质,在溶液中存在能自由移动的离子,能导电;
⑦硫酸钡是难溶性的盐,由离子构成,在熔融状态下电离产生Ba2+、SO42-,溶于水的硫酸钡完全电离产生自由移动的离子,属于强电解质,由于溶解度很小,自由移动的离子很小,不导电;
⑧蔗糖是由蔗糖分子构成的物质,没有自由移动的离子,所以不能导电;蔗糖是化合物,在水溶液中和熔融状态下只存在蔗糖分子,没有自由移动的离子,所以不能导电,属于非电解质;
⑨氢氧化铁是弱碱,没有自由移动的离子不导电;溶解于水的部分电离产生自由移动的离子,存在电离平衡,所以氢氧化铁属于弱电解质;
⑩浓盐酸是HCl的水溶液,属于混合物,不属于电解质,盐酸溶液中存在自由移动的离子,所以盐酸能导电。
故属于电解质的是③④⑦⑨;能导电的是①④⑥⑩;属于弱电解质的是⑨。
【点睛】本题考查了物质的分类及其判断,掌握电解质、非电解质、强电解质、弱电解质的概念是本题判断的依据,理解能够导电的物质不一定是电解质,电解质不一定能够导电,电解质发生电离作用后才能导电,电解质溶液导电能力强弱与电解质强弱无关,只与离子浓度和离子带有的电荷数目有关。
17. ①④ ③⑥
【分析】金属、电解质溶液或熔融态的电解质能导电,水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;
【详解】①Cu是能导电的金属,不是化合物,因此既不是电解质也不是非电解质;
②CO2分子构成的,不导电,二氧化碳溶于水后自身不能发生电离,属于非电解质;
③氯化钠晶体中的离子不能自由移动,因此不导电,氯化钠溶于水后自身能发生电离,属于电解质;
④硫酸溶液中含有自由移动的离子,可以导电,硫酸溶液是混合物,因此既不是电解质也不是非电解质;
⑤干冰是由二氧化碳分子构成的,不导电,二氧化碳溶于水后自身不能发生电离,属于非电解质;
⑥BaSO4中的离子不能自由移动,因此不导电,BaSO4在熔融状态下可以发生电离,因此属于电解质;
⑦金刚石是不导电的非金属单质,不是化合物,因此既不是电解质也不是非电解质;
能导电的是①④,属于电解质的是③⑥。
18.(1) 乙 FeCl3+3H2OFe(OH)3(胶体)+3HCl
(2)丁达尔效应
(3) 加深 Fe(OH)3胶体粒子带正电荷
(4)先出现红褐色沉淀,沉淀又逐渐溶解
(5)无白色沉淀生成
【解析】(1)
甲同学:向的溶液中加少量NaOH溶液,会发生复分解反应生成红褐色沉淀;
乙同学:向25mL沸水中逐滴加入5~6滴饱和溶液,继续煮沸至溶液呈红褐色,停止加热,可以制得胶体;
丙同学:直接加热饱和溶液,三价铁离子会水解生成红褐色沉淀;
Fe(OH)3胶体制备的化学方程式为:FeCl3+3H2OFe(OH)3(胶体)+3HCl。
(2)
丁达尔效应是胶体的特有性质,可用来鉴别胶体。
(3)
将其装入U型管内,用石墨棒做电极,接通直流电源,通电一段时间后发现阴极附近颜色加深,这表明Fe(OH)3胶体粒子带正电荷。
(4)
胶体溶液加入电解质溶液,会发生胶体的聚沉,然后氢氧化铁和硫酸发生化学反应溶解,则向其中逐滴加入过量稀硫酸,现象是先出现红褐色沉淀,沉淀又逐渐溶解。
(5)
银离子和氯离子反应生成氯化银沉淀,则提纯若干次后,加入溶液,若无白色沉淀生成,则说明该胶体中的杂质离子已经完全除去。
19.(1)胶头滴管
(2) 能 FeCl3+3H2OFe(OH)3(胶体)+3HCl
(3) 当光束通过氢氧化铁胶体时,可以看到一条光亮的“通路”,而光束通过硫酸铜溶液时,则看不到此现象 丁达尔效应 分散质粒子的直径大小不同
(4) 生成红褐色沉淀 FeCl3+3NaOH=Fe(OH)3↓+3NaCl
【分析】氢氧化铁胶体的制备原理为FeCl3+3H2OFe(OH)3(胶体)+3HCl,具体操作为向沸水中加入几滴饱和FeCl3溶液,继续煮沸至液体呈红褐色停止加热,得到的胶体可以产生丁达尔效应,据此分析解答。
【详解】(1)盛有饱和FeCl3溶液的仪器名称为胶头滴管;
(2)Fe(OH)胶体能透过滤纸,制备Fe(OH)3胶体的离子方程式为FeCl3+3H2OFe(OH)3(胶体)+3HCl;
(3)步骤2中能观察到的现象为当光束通过氢氧化铁胶体时,可以看到一条光亮的“通路”, 而光束通过硫酸铜溶液时,则看不到此现象,胶体产生的该现象称为丁达尔效应;胶体与其他分散系不同的根本原因是分散质粒子的直径不同;
(4)若将实验改为向饱和FeCl3溶液中加入NaOH溶液,则观察到的现象为生成红褐色沉淀,该反应的化学方程式为FeCl3+ 3NaOH= Fe(OH)3↓+3NaCl。
20. 5.6 6.02×1023(或NA) 22:21 2:1 95g.mol-1 24 L ①>⑤>③>②>④ 11.2 4AH3=A4+6H2
【详解】(1)标准状况下气体摩尔体积为22.4L/mol,0.25mol甲烷的体积V=n·Vm=0.25mol×22.4L/mol=5.6L;0.25mol甲烷中含有氢原子个数N=n·NA=0.25mol×4×6.02×1023=6.02×1023个;
(2)相同质量的CO和CO2,它们的物质的量比为=11:7,一个CO中含有2个原子,一个CO2中含有3个原子,则相同质量的CO和CO2,它们所含的原子数之比为11×2:7×3=22:21;含有相同氧原子数的CO和CO2,它们的物质的量的比为2:1,则他们的体积比为2×22.4L/mol:1×22.4L/mol=2:1;
(3)某二价金属的氯化物中含有0.2molCl-,其物质的量为0.1mol,又已知其质量m=9.5g,则该氯化物的摩尔质量M===95g·mol-1;物质的摩尔质量在数值上等于其相对分子质量,故该二价金属的相对原子质量Ar=95-2×35.5=24;
(4)若a g某气体中含有的分子数为b,则c g该气体含有的分子数为个,c g该气体的物质的量n==mol,则标况下c g该气体的体积V=n·Vm=L;
(5)标准状况下0.112L水的质量为112g,其物质的量n≈6.22mol,则含有的原子的个数N≈18.67NA个;0.5NA个HCl分子含有的原子个数N=NA个;25.6g SO2气体的物质的量n=0.4mol,则含有的原子的个数N=1.2NA个;0.2mol氨气含有的原子个数N=0.8NA个;Ne为单原子分子,则2mol Ne含有的原子个数N=2NA个,综上5中物质中原子个数从大到小的顺序为①>⑤>③>②>④;
(6)标准状况下6.72L CO的物质的量n===0.3mol,CO还原Fe2O3的化学方程式为3CO+Fe2O33CO2+2Fe,有化学方程式可知,0.3molCO还原一定量的Fe2O3可以生成0.2mol的Fe,则0.2mol Fe的质量m=n·M=0.2mol×56g/mol=11.2g;
(7)设A的单质为Am,则可将反应方程式写成2mAH3=2Am+3mH2,反应后压强增加的75%,根据阿伏伽德罗定律及其推论,压强比等于物质的量的比,则有=1+75%,解得m=4,故反应方程式为4AH3=A4+6H2。
21. 1
【详解】(1) 标准状况下,0.2molNH3的体积是V=nVm=0.2mol×22.4L/mol=4.48L;
其中含有的NH3分子数是N(NH3)=nNA=0.2mol×NA/mol=0.2NA;
含氢原子数是0.2NA×3=0.6NA个;
其中含有的电子数是0.2NA×10=2NA个;
其中含有的质子数是0.2NA×10=2NA个;
(2)49g H2SO4物质的量为=0.5mol,含有0.5 mol×4=2 mol氧原子;
1mol硫酸能与2molNaOH,则与0.5molH2SO4完全反应的NaOH为0.5mol×2=1mol;
(3)16g A和20g B 恰好完全反应生成0.04mol C 和31.76g D,由质量守恒可知m(C)=16g+20g-31.76g=4.24g,M(C)==106g/mol
