第二章 分子结构与性质 测试题 (含解析)2022-2023学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 第二章 分子结构与性质 测试题 (含解析)2022-2023学年高二下学期化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 308.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-23 08:26:47 | ||
图片预览




文档简介
第二章 分子结构与性质 测试题
一、选择题
1.下列说法正确的是
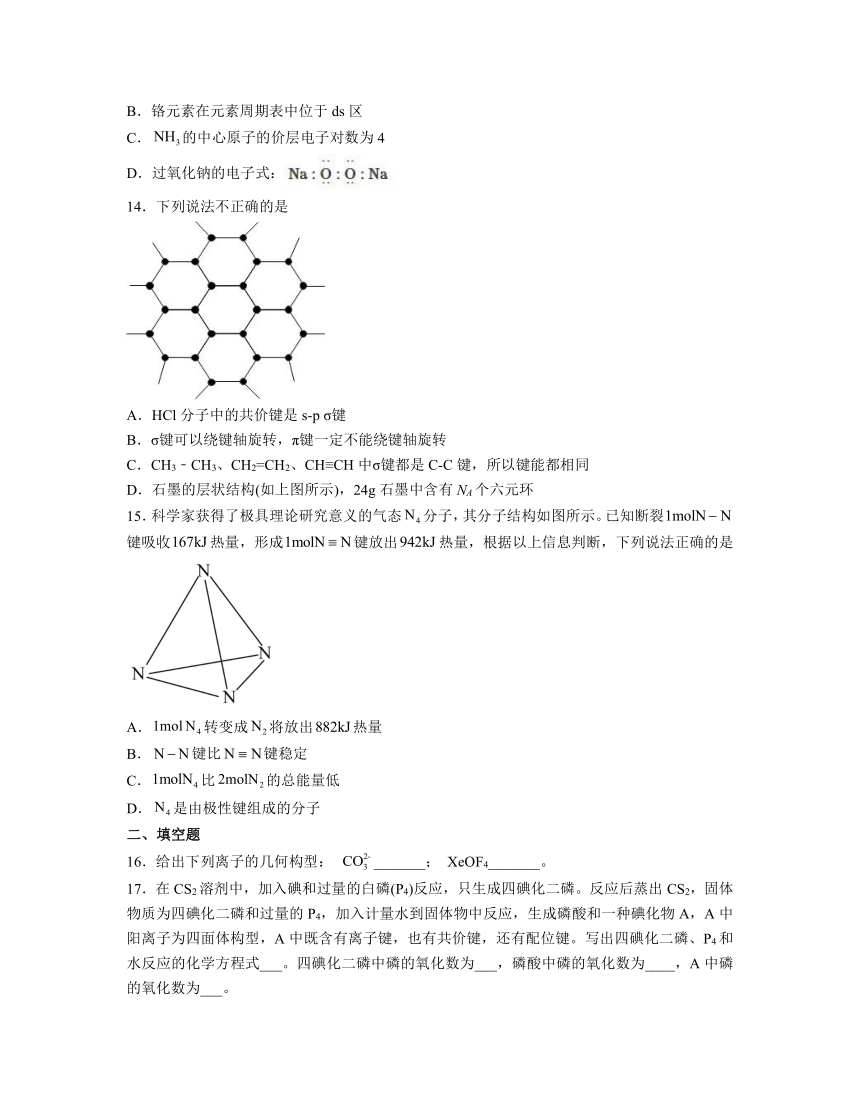
A.氢键是一种化学键
B.氢键使物质具有较高的熔、沸点
C.能与水分子形成氢键的物质在水中的溶解度增大
D.水结成冰体积膨胀与氢键无关
2.分子中存在π键,且碳原子全部以sp杂化轨道成键的是
A.乙烷 B.乙烯 C.乙炔 D.苯
3.下列说法不正确的是
A.某微粒空间构型为三角锥形,则该微粒一定是极性分子
B.有下列分子:①CO2②NO2③SO2④BF3⑤NH3,分子的VSEPR模型为平面三角形的是 ②③④
C.Ca2+、K+、Cl-、S2-四种离子的半径依次减小
D.核外电子数为偶数的基态原子,其原子轨道中可能含“未成对电子”
4.下列说法正确的是
A.硫酸溶于水时,只破坏了分子间作用力,并未破坏硫酸分子中的共价键。
B.蒸馏水中,水分子之间只存在氢键,不存在范德华力
C.分子组成相差一个或几个CH2原子团的有机物是同系物
D.在氢原子的电子概率分布图中,小黑点的疏密程度表示电子在该区域空间出现概率的大小
5.下列物质中,属于共价化合物的是
A.NaOH B.MgCl2 C.CH3CH2OH D.Na2O2
6.中科院国家纳米科学中心科研员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。下列有关氢键的说法中不正确的是
A.由于氢键的存在,冰能浮在水面上
B.由于氢键的存在,乙醇比甲醚更易溶于水
C.由于氢键的存在,沸点:HF>HCl>HBr>HI
D.氢键的存在影响了蛋白质分子独特的结构
7.如图1表示某种含氮有机化合物的结构简式,能识别某些离子或分子而形成超分子。该分子内4个氮原子分别位于正四面体的4个顶点(见图2)。分子内存在空腔,能嵌入某种离子或分子而形成4个氢键并予以识别。下列分子或离子中,能被该含氮有机化合物识别的是
A.CF4 B.NH C.CH4 D.H2O
8.下列说法不正确的是
A.碳碳双键、碳碳三键的键能分别是碳碳单键键能的两倍和三倍
B.丙烯(CH3CH=CH2)分子中有8个σ键,1个π键
C.丙烯分子中的π键不如σ键稳定
D.π键电子云形状为镜面对称
9.1,3-唑( )是淡黄色液体,常作为荧光增白剂。下列说法错误的是
A.第一电离能:N>O>C
B.基态氧原子核外电子有8种空间运动状态
C.1mol分子中含有8molσ键
D.分子中C、N原子的杂化方式均为sp2
10.下列化学用语表述正确的是
A.的空间构型:平面三角形
B.的键的电子云图形:
C.水晶的分子式:SiO2
D.基态铬原子的价电子轨道表示式:
11.下列表达方式或说法正确的是
A.NH3、H2O、CO2、HCl四分子中孤电子对最多的是CO2
B.氯化铵的电子式:
C.硫离子的核外电子排布式 1s22s22p63s23p4
D.基态到激发态产生的光谱是发射光谱
12.是一种常见的还原剂,可通过如下反应制备。下列说法错误的是
A.该反应在无水环境下进行
B.该反应是氧化还原反应
C.元素的第一电离能:
D.的空间构型为正四面体形
13.下列化学用语的应用或概念描述正确的是
A.醋酸的电离方程式:
B.铬元素在元素周期表中位于ds区
C.的中心原子的价层电子对数为4
D.过氧化钠的电子式:
14.下列说法不正确的是
A.HCl分子中的共价键是s-p σ键
B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转
C.CH3﹣CH3、CH2=CH2、CH≡CH中σ键都是C-C键,所以键能都相同
D.石墨的层状结构(如上图所示),24g石墨中含有NA个六元环
15.科学家获得了极具理论研究意义的气态分子,其分子结构如图所示。已知断裂键吸收热量,形成键放出热量,根据以上信息判断,下列说法正确的是
A.转变成将放出热量
B.键比键稳定
C.比的总能量低
D.是由极性键组成的分子
二、填空题
16.给出下列离子的几何构型: _______; XeOF4_______。
17.在CS2溶剂中,加入碘和过量的白磷(P4)反应,只生成四碘化二磷。反应后蒸出CS2,固体物质为四碘化二磷和过量的P4,加入计量水到固体物中反应,生成磷酸和一种碘化物A,A中阳离子为四面体构型,A中既含有离子键,也有共价键,还有配位键。写出四碘化二磷、P4和水反应的化学方程式___。四碘化二磷中磷的氧化数为___,磷酸中磷的氧化数为____,A中磷的氧化数为___。
18.CO2的有效利用可以缓解温室效应和能源短缺问题。
(1)CO2的电子式是_____,包含的化学键类型为____(填“非极性”或“极性”)共价键。
(2)在温度高于31.26 ℃、压强高于7.39×106 Pa时,CO2处于超临界状态,称为超临界CO2流体,可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,超临界CO2萃取的优点有_________(答出一点即可)。
(3)向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)CH3OH(l)+H2O(l),下列叙述能说明此反应达到平衡状态的是__(填字母)。
a.混合气体的平均相对分子质量保持不变
b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等
d.混合气体的密度保持不变
e.1 mol CO2生成的同时有3 mol H—H键断裂
19.按要求填空:
(1)柠檬酸的结构简式见图。1mol柠檬酸分子中碳原子与氧原子形成的键的数目为_________mol。
(2)CO2分子中存在_________个键和_________个键。
(3)N2分子中键与键的数目比 _________。
20.X是合成碳酸二苯酯的一种有效的氧化还原催化助剂,可由EDTA与Fe3+反应得到。
(1)基态Si原子的价层电子的运动状态有_______种,若其电子排布式表示为[Ne]3s2违背了_______。
(2)EDTA中碳原子杂化轨道类型为_______,EDTA中四种元素的电负性由小到大的顺序为_______。C、N、O第一电离能由小到大的顺序为_______。
(3)Fe3+基态价层电子排布式为_______。
(4)EDTA与正二十一烷的相对分子质量非常接近,但EDTA的沸点比正二十一烷的沸点高的原因是_______。
(5)设NA代表阿伏加德罗常数的值,1mol碳酸分子中含有σ键的数目为_______。
21.有U、V、W、X、Y、Z六种前四周期元素,原子序数依次增大,其相关信息如下表:
元素编号 相关信息比
U 所处的周期数、族序数分别与其原子序数相等
V 基态时,电子分布在三个能级上,且各能级中电子数相等
W 基态时, 2p 轨道处于半充满状态
X 自然界中含量最多
Y 是第四周期元素中未成对电子数最多的元素
请回答下列问题:
(1)W、X、V第一电离能由大到小顺序:________________________(用元素符号表示)
(2)V的最高价氧化物对应含氧酸中,酸根的立体构型为:_________,中心原子的杂化方式为:_______________;
(3)Y的基态原子的价电子排布图为____________________________;
(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有10个电子。两者沸点的关系为乙______丙(填“>”或“<”),原因是__________________________________________;
(5)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中属于____________晶体
22.已知A、B、C、D、E、F、G是原子序数依次增大的前四周期元素,其中A是最轻的元素;B元素基态原子的最外层有2个未成对电子;D元素原子的价层电子排布式为;E元素的原子只有两种形状的电子云,最外层只有一种自旋方向的电子;F元素原子有5个未成对电子:G元素基态的正三价离子的3d轨道为半充满状态。请回答下列问题:
(1)分子中B的杂化轨道用于形成的化学键有_______(填共价键类型,下同)键、_______键,没有杂化的轨道形成_______π键。
(2)比较熔沸点:BD_______(填“高于”“低于”或“等于”),原因是_______。
(3)基态E原子中电子占据的最高能级的原子轨道形状为_______,的空间结构为_______。
(4)F是正常机体必需的微量元素之一,它构成体内若干种有重要作用的酶。F在元素周期表中的位置为_______,气态再失去一个电子比气态再失去一个电子更难的原因是_______。
【参考答案】
一、选择题
1.C
解析:A.氢键不是化学键,而是一种分子间作用力,A错误;
B.分子间的氢键可以使物质的熔沸点升高,而分子内的氢键可以使物质的熔沸点降低,B错误;
C.物质与水分子形成氢键,能使溶质更好地被水分子包围,并分散到水中,使溶质的溶解度增大,C正确;
D.由于氢键具有一定的方向性,水结冰的过程中,形成更多的氢键,使水分子间的空隙变大,因此冰的体积膨胀,D错误;
故选C。
2.C
解析:A.乙烷分子中碳原子含有4个共价单键不含共价双键或三键,不存在π 键,且碳原子采用sp3杂化,A错误;
B.乙烯分子中每个碳原子含有3个σ键,1个碳碳双键,分子中含有一个π键,碳原子采用sp2杂化,B错误;
C.乙炔分子中每个碳原子含有2个σ键,含有碳碳三键,分子中含有2个π键,碳原子采用sp杂化,C正确;
D.苯分子中含有1个大π键,每个碳原子含有3个σ键,碳原子采用sp2杂化,D错误;
故选C。
3.C
解析:A.微粒中立体构型是三角锥型,说明中心原子A的价电子n=4且含有一个孤电子对,分子结构不对称,为极性分子,如PH3分子中价层电子对数=3+×(5-3×1)=4,且含有一个孤电子对,其空间构型是三角锥型,分子结构不对称,为极性分子,选项A正确;
B.CO2中C原子的价层电子对为2,VSEPR模型为直线型,NO2中N原子的价层电子对为=2.5,按3处理,VSEPR模型为平面三角形,SO2中S原子的价层电子对数为3,VSEPR模型为平面三角形,BF3中B原子的价层电子对为=3,VSEPR模型为平面三角形,NH3中N原子的价层电子对为=4,VSEPR模型为正四面体,分子的VSEPR模型为平面三角形的是 ②③④,选项B正确;
C.具有相同电子层结构的离子核电荷数越大半径越小,则离子半径Ca2+、K+、Cl-、S2-四种离子的半径大小为:S2->Cl->K+>Ca2+,选项C不正确;
D.核外电子数为偶数的基态原子,其原子轨道中可能含“未成对电子”,如C的价层电子排布式为2s22p4,2p轨道中存在2个未成对电子,选项D正确;
答案选C。
4.D
解析:A.硫酸溶于水时,H2SO4电离为H+和,破坏了共价键,A错误;
B.范德华力是普遍存在于分子之间的作用力,因此水分子间存在范德华力,B错误;
C.同系物是指结构相似、分子组成相差若干个“CH2”原子团的有机化合物,同系物的前提是结构相似,C错误;
D.在氢原子的基态电子的概率分布图中,小黑点的疏密程度表示电子在该区域空间出现机会的多少,即概率的大小,不表示电子,密的地方出现机会多、疏的地方出现机会少,D正确;
故选D。
5.C
解析:A.NaOH中存在金属阳离子和氢氧根离子间的离子键,属于离子化合物,选项A不符合;
B.MgCl2中含有活泼的金属元素和活泼的非金属元素,含有离子键,属于离子化合物,选项B不符合;
C.CH3CH2OH中只含有非金属元素与非金属元素形成的共价键,属于共价化合物,选项C符合;
D.Na2O2是活泼金属Na与活泼非金属元素O通过离子键形成的离子化合物,其中阴离子是O22-,选项D不符合。
答案选C。
6.C
解析:A.水分子间存在氢键,使水分子之间形成孔穴,造成冰的微观空间存在空隙,宏观上表现在冰的密度比水小,冰能浮在水面上,A项正确;
B.乙醇分子与水分子间能形成氢键,甲醚分子与水分子间不能形成氢键,所以乙醇比甲醚更易溶于水,B项正确;
C.HF分子间存在氢键,HCl、HBr、HI分子间不存在氢键,相对分子质量越大,分子间作用力越强,沸点越高,则有沸点:HF>HI>HBr>HCl,C项错误;
D.蛋白质上的氨基和羰基之间能形成氢键,从而影响了蛋白质分子独特的结构,D项正确;
答案选C。
7.B
解析:F、O、N电负性很大,与H元素形成的微粒之间可以形成氢键,正四面体顶点N原子与嵌入空腔的微粒形成4个氢键,该微粒应含有4个H原子,选项中只有NH符合。
故选B。
8.A
解析:A.碳碳三键含有1个σ键和2个π键,碳碳双键含有1个σ键和1个π键,由于碳原子之间σ键键能大于π键键能,故碳碳三键、碳碳双键的键能小于碳碳单键的3倍和2倍,A错误;
B.丙烯(CH3CH=CH2)分子除碳碳双键中含有1个π键外,其余8个都是σ键,B正确;
C.丙烯分子中的π键易断裂,不如σ键稳定,C正确;
D.两原子在成键时,原子轨道以 “肩并肩”的方式重叠形成的共价键为π键,每个π键的电子云由两块组成,它们互为镜像,D正确;
故选A。
9.B
解析:A.C、N、O为相邻的同周期元素,由于N的2p轨道半充满,所以其第一电离能比O大,从而得出第一电离能:N>O>C,A正确;
B.基态氧原子核外电子排布式为1s22s22p4,有1s、2s、三个2p轨道,共有5种空间运动状态,B错误;
C.1,3-唑分子中,含有3个C-Hσ键、2个C-Nσ键、1个C-Cσ键、2个C-Oσ键,则1mol分子中含有8molσ键,C正确;
D.1,3-唑分子中,C、N原子的价层电子对数都为3,所以均发生sp2杂化,D正确;
故选B。
10.A
解析:A.的中心C原子的价层电子对数为3,发生sp2杂化,且C原子的最外层不存在孤电子对,则其空间构型为平面三角形,A正确;
B.的键的电子云,应为两个3p轨道头对头发生重叠,B不正确;
C.水晶的主要成分为二氧化硅,属于共价晶体,其由Si、O原子构成,不存在分子式,C不正确;
D.基态铬原子的价电子排布式为3d54s1,则其轨道表示式: ,D不正确;
故选A。
11.A
解析:A.NH3分子中N原子有一对孤电子对,H2O分子中O原子有两对,HCl分子中Cl原子有3对,CO2分子中两个O原子共有2×2=4对,孤电子对最多的是CO2,A正确;
B.氯离子最外层有8个电子,电子式应为,B错误;
C.S2-核外有18个电子,核外电子排布式为1s22s22p63s23p6,C错误;
D.基态到激发态需要吸收能量,产生的光谱为吸收光谱,D错误;
综上所述答案为A。
12.B
解析:A.NaH会和水反应,故该反应在无水环境下进行,A正确;
B.该反应中不存在元素化合价的改变,不是氧化还原反应,B错误;
C.同一主族随原子序数变大,原子半径变大,第一电离能变小;同一周期随着原子序数变大,第一电离能变大,元素的第一电离能:,C正确;
D.中B形成4个共价键,为sp3杂化,空间构型为正四面体形,D正确;
故选B。
13.C
解析:A.醋酸属于弱酸,其电离方程式为CH3COOHCH3COO-+H+,故A错误;
B.铬元素的价电子排布式为3d54s1,位于d区,故B错误;
C.NH3的中心原子的价层电子对数为3+=4,故C正确;
D.过氧化钠为离子化合物,其电子式为,故D错误;
答案为C。
14.C
解析:A.HCl分子中的共价键是H原子的1s轨道与 Cl原子的3p轨道形成的s-p σ键,故A正确;
B.σ键为轴对称,π键为镜面对称,σ键可以绕键轴旋转,π键一定不能绕键轴旋转,故B正确;
C.CH3—CH3、CH2=CH2、CH≡CH中的σ键是碳氢单键和C-C键,故C错误;
D.石墨分子中1个六元环中含6个C原子,每个C原子由3个碳碳键共用,根据均摊法可知,1个六元环中含有的C原子个数为=2个,所以24g石墨中含有六元环的个数为=NA,故D正确;
故选C。
15.A
解析:A.转变成时断裂键,吸收热量,形成键,放出热量,故反应过程中放出的热量为,A正确;
B.由题给信息可知,键键能为,键键能为,键能越大,共价键越稳定,B错误;
C.反应转化为时放出的热量,说明比的总能量高,C错误;
D.中的键是同一元素的原子形成的共价键,属于非极性键,D错误;
答案选A。
二、填空题
16. 平面三角 四方锥
解析:中碳原子价层电子对个数=3+ (4+2-3×2)=3,且不含孤电子对,所以C原子采用sp2杂化,空间构型为平面三角形;
XeOF4分子中有6对电子对,Xe采用sp3d杂化,电子对构型为正八面体形。一个孤电子对占据一个八面体的顶点,XeOF4分子构型为四角锥形。
17. 10P2I4+13P4+128H2O=40PH4I+32H3PO4 +2 +5 -3
解析:略
18. 极性 萃取剂与溶质更易分离(或萃取剂更环保等) de
解析:(1)C原子最外层有4个电子,O原子最外层有6个电子,C原子的4个成单电子与2个O原子成单电子形成四对共用电子对,使分子中各原子都达到稳定结构,电子式是:;在CO2分子中存在的化学键是C=O,C=O是不同元素的原子之间形成的共价键属于极性键,所以CO2分子中含有极性键;
(2)物质的性质与用途不仅与组成和结构有关,还与物质所处的状态有关,由题目信息知超临界CO2流体可用作萃取剂,考虑其与有机萃取剂相比,其优点是:可以从萃取剂的绿色环保性、萃取后萃取剂与溶质更易分离;
(3)a.反应混合物中只有CO2和H2是气体,CO2和H2初始投入量之比和反应消耗量之比均为1:3,所以二者体积分数一直不变,气体平均相对分子质量也一直不变,因此不能据此判断反应是否处于平衡状态,a不符合题意;
b.反应混合物中只有CO2和H2是气体,CO2和H2初始投入量之比和反应消耗量之比均为1:3,所以反应体系中CO2和H2体积分数一直不变,不能据此判断反应是否处于平衡状态,b不符合题意;
c.反应混合物中只有CO2和H2是气体,CO2和H2初始投入量之比和反应消耗量之比均为1:3,所以反应体系中CO2和H2的转化率相同,c不符合题意;
d.容器的容积不变,反应正向进行,气体的质量逐渐减小,气体的密度也逐渐减小,当气体的质量不变时,气体的密度不变,反应达到平衡状态,d符合题意;
e.根据方程式可知:每有1 mol CO2生成,就会形成3 mol H-H键,同时断裂3 mol H-H键,则H2的浓度不变,反应处于平衡状态,e符合题意;
故合理选项是de。
19.(1)7
(2) 2 2
(3)
解析:(1)1个柠檬酸分子中有4个C-O键和3个C=O键,则1mol柠檬酸分子中碳原子与氧原子形成的键共7mol。
(2)CO2的结构式为O=C=O,则1个CO2分子中存在2个键和2个键。
(3)N2的结构式为,则。
20.(1) 4 洪特规则
(2) sp2和sp3 H(3)3d5
(4)EDTA分子间存在氢键
(5)5NA
解析:(1)基态Si原子价电子排布为3s23p2,把电子在原子核外的一个空间运动状态称为一个原子轨道,因而空间运动状态个数等于轨道数;而在同一原子轨道下最多可以有两个自旋方向不同的电子,自旋方向不同,运动状态也就不相同,即运动状态个数等于电子数,故基态Si原子的价层电子的运动状态有4种;洪特规则:在相同能量的原子轨道上,电子的排布将尽可能占据不同的轨道,而且自旋方向相同;若其电子排布式表示为[Ne]3s2违背了洪特规则;
(2)EDTA中羧基碳原子为sp2杂化、饱和碳原子为sp3杂化;EDTA中四种元素为C、N、O、H,同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;同主族由上而下,金属性增强,非金属性逐渐减弱,元素电负性减弱,故其电负性由小到大的顺序为H(3)Fe3+为铁原子失去3个电子后形成的离子,基态价层电子排布式为3d5;
(4)EDTA中含羧基,可以形成分子间氢键,导致沸点升高;
(5)单键均为σ键,双键中含有1个σ键1个π键;1个碳酸分子中存在5个σ键,则1mol碳酸分子中含有σ键的数目为5NA。
21. N>O>C 平面三角形 sp2 < 水分子间形成氢键 原子
【分析】U所处的周期数、族序数分别与其原子序数相等,故U为氢;
V基态时,电子分布在三个能级上,且各能级中电子数相等,则核外电子排布为1s22s22p2,则V为碳元素;
W基态时,2p 轨道处于半充满状态,核外电子排布为1s22s22p3,则W为氮元素;
X自然界中含量最多,故X为氧元素;
Y是第四周期元素中未成对电子数最多的元素,故Y为铬元素;
解析:(1)三种元素处于同一周期,N的2p能级处于半充满状态,第一电离能最大,W、X、V第一电离能由大到小顺序:N>O>C(用元素符号表示),故答案为:N>O>C;
(2)V为碳元素,V的最高价氧化物对应含氧酸中,C原子的价电子对=3+ =3,酸根的立体构型为:平面三角形,中心原子的杂化方式为:碳原子采取sp2杂化;故答案为:平面三角形;sp2;
(3)铬为24号元素,基态原子的核外电子排布式为[Ar]3d54s1,Y的基态原子的价电子排布图为,故答案为:;
(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有10个电子,乙和丙分别是CH4、H2O。两者沸点的关系为乙<丙(填“>”或“<”),水分子间形成氢键,增大分子间作用力,故答案为:<;水分子间形成氢键;
(5)V与W原子结合形成的V3W4晶体,化学式C3N4,其硬度比金刚石大,符合原子晶体的特征,则V3W4晶体中属于原子晶体,故答案为:原子。
22.(1) 或 或
(2) 高于 CO为极性分子,为非极性分子,分子极性越大,范德华力越大,熔沸点越高
(3) 球形 三角锥形
(4) 第四周期第ⅦB族 的价层电子排布为,3d轨道为半充满,比较稳定,的价层电子排布为,再失去一个电子即可达到3d轨道半充满的比较稳定状态
解析:A、B、C、D、E、F、G是原子序数依次增大的前四周期元素, A是最轻的元素,A是H元素;D元素原子的价层电子排布式为,n=2,D是O元素;B元素基态原子的最外层有2个未成对电子,B是C元素、C是N元素;E元素的原子只有两种形状的电子云,最外层只有一种自旋方向的电子,E是Na元素;F元素原子有5个未成对电子,F是Mn元素,G元素基态的正三价离子的3d轨道为半充满状态,G是Fe元素。
(1)分子的结构式为, C原子采用sp杂化,C的杂化轨道用和H于形成键、和另一个碳原子形成键,没有杂化的轨道形成π键;
(2)CO为极性分子,为非极性分子,分子极性越大,范德华力越大,熔沸点越高,所以熔沸点CO>N2;
(3)基态Na原子中电子占据的最高能级是3s,原子轨道形状为球形,H3O+中O原子的杂化轨道数是4,有1个孤电子对,空间结构为三角锥形。
(4)F是Mn元素,在元素周期表中的位置为第四周期第ⅦB族;的价层电子排布为,3d轨道为半充满,比较稳定,G是Fe元素,的价层电子排布为,再失去一个电子即可达到3d轨道半充满的比较稳定状态,所以气态再失去一个电子比气态再失去一个电子更难
一、选择题
1.下列说法正确的是
A.氢键是一种化学键
B.氢键使物质具有较高的熔、沸点
C.能与水分子形成氢键的物质在水中的溶解度增大
D.水结成冰体积膨胀与氢键无关
2.分子中存在π键,且碳原子全部以sp杂化轨道成键的是
A.乙烷 B.乙烯 C.乙炔 D.苯
3.下列说法不正确的是
A.某微粒空间构型为三角锥形,则该微粒一定是极性分子
B.有下列分子:①CO2②NO2③SO2④BF3⑤NH3,分子的VSEPR模型为平面三角形的是 ②③④
C.Ca2+、K+、Cl-、S2-四种离子的半径依次减小
D.核外电子数为偶数的基态原子,其原子轨道中可能含“未成对电子”
4.下列说法正确的是
A.硫酸溶于水时,只破坏了分子间作用力,并未破坏硫酸分子中的共价键。
B.蒸馏水中,水分子之间只存在氢键,不存在范德华力
C.分子组成相差一个或几个CH2原子团的有机物是同系物
D.在氢原子的电子概率分布图中,小黑点的疏密程度表示电子在该区域空间出现概率的大小
5.下列物质中,属于共价化合物的是
A.NaOH B.MgCl2 C.CH3CH2OH D.Na2O2
6.中科院国家纳米科学中心科研员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。下列有关氢键的说法中不正确的是
A.由于氢键的存在,冰能浮在水面上
B.由于氢键的存在,乙醇比甲醚更易溶于水
C.由于氢键的存在,沸点:HF>HCl>HBr>HI
D.氢键的存在影响了蛋白质分子独特的结构
7.如图1表示某种含氮有机化合物的结构简式,能识别某些离子或分子而形成超分子。该分子内4个氮原子分别位于正四面体的4个顶点(见图2)。分子内存在空腔,能嵌入某种离子或分子而形成4个氢键并予以识别。下列分子或离子中,能被该含氮有机化合物识别的是
A.CF4 B.NH C.CH4 D.H2O
8.下列说法不正确的是
A.碳碳双键、碳碳三键的键能分别是碳碳单键键能的两倍和三倍
B.丙烯(CH3CH=CH2)分子中有8个σ键,1个π键
C.丙烯分子中的π键不如σ键稳定
D.π键电子云形状为镜面对称
9.1,3-唑( )是淡黄色液体,常作为荧光增白剂。下列说法错误的是
A.第一电离能:N>O>C
B.基态氧原子核外电子有8种空间运动状态
C.1mol分子中含有8molσ键
D.分子中C、N原子的杂化方式均为sp2
10.下列化学用语表述正确的是
A.的空间构型:平面三角形
B.的键的电子云图形:
C.水晶的分子式:SiO2
D.基态铬原子的价电子轨道表示式:
11.下列表达方式或说法正确的是
A.NH3、H2O、CO2、HCl四分子中孤电子对最多的是CO2
B.氯化铵的电子式:
C.硫离子的核外电子排布式 1s22s22p63s23p4
D.基态到激发态产生的光谱是发射光谱
12.是一种常见的还原剂,可通过如下反应制备。下列说法错误的是
A.该反应在无水环境下进行
B.该反应是氧化还原反应
C.元素的第一电离能:
D.的空间构型为正四面体形
13.下列化学用语的应用或概念描述正确的是
A.醋酸的电离方程式:
B.铬元素在元素周期表中位于ds区
C.的中心原子的价层电子对数为4
D.过氧化钠的电子式:
14.下列说法不正确的是
A.HCl分子中的共价键是s-p σ键
B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转
C.CH3﹣CH3、CH2=CH2、CH≡CH中σ键都是C-C键,所以键能都相同
D.石墨的层状结构(如上图所示),24g石墨中含有NA个六元环
15.科学家获得了极具理论研究意义的气态分子,其分子结构如图所示。已知断裂键吸收热量,形成键放出热量,根据以上信息判断,下列说法正确的是
A.转变成将放出热量
B.键比键稳定
C.比的总能量低
D.是由极性键组成的分子
二、填空题
16.给出下列离子的几何构型: _______; XeOF4_______。
17.在CS2溶剂中,加入碘和过量的白磷(P4)反应,只生成四碘化二磷。反应后蒸出CS2,固体物质为四碘化二磷和过量的P4,加入计量水到固体物中反应,生成磷酸和一种碘化物A,A中阳离子为四面体构型,A中既含有离子键,也有共价键,还有配位键。写出四碘化二磷、P4和水反应的化学方程式___。四碘化二磷中磷的氧化数为___,磷酸中磷的氧化数为____,A中磷的氧化数为___。
18.CO2的有效利用可以缓解温室效应和能源短缺问题。
(1)CO2的电子式是_____,包含的化学键类型为____(填“非极性”或“极性”)共价键。
(2)在温度高于31.26 ℃、压强高于7.39×106 Pa时,CO2处于超临界状态,称为超临界CO2流体,可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,超临界CO2萃取的优点有_________(答出一点即可)。
(3)向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)CH3OH(l)+H2O(l),下列叙述能说明此反应达到平衡状态的是__(填字母)。
a.混合气体的平均相对分子质量保持不变
b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等
d.混合气体的密度保持不变
e.1 mol CO2生成的同时有3 mol H—H键断裂
19.按要求填空:
(1)柠檬酸的结构简式见图。1mol柠檬酸分子中碳原子与氧原子形成的键的数目为_________mol。
(2)CO2分子中存在_________个键和_________个键。
(3)N2分子中键与键的数目比 _________。
20.X是合成碳酸二苯酯的一种有效的氧化还原催化助剂,可由EDTA与Fe3+反应得到。
(1)基态Si原子的价层电子的运动状态有_______种,若其电子排布式表示为[Ne]3s2违背了_______。
(2)EDTA中碳原子杂化轨道类型为_______,EDTA中四种元素的电负性由小到大的顺序为_______。C、N、O第一电离能由小到大的顺序为_______。
(3)Fe3+基态价层电子排布式为_______。
(4)EDTA与正二十一烷的相对分子质量非常接近,但EDTA的沸点比正二十一烷的沸点高的原因是_______。
(5)设NA代表阿伏加德罗常数的值,1mol碳酸分子中含有σ键的数目为_______。
21.有U、V、W、X、Y、Z六种前四周期元素,原子序数依次增大,其相关信息如下表:
元素编号 相关信息比
U 所处的周期数、族序数分别与其原子序数相等
V 基态时,电子分布在三个能级上,且各能级中电子数相等
W 基态时, 2p 轨道处于半充满状态
X 自然界中含量最多
Y 是第四周期元素中未成对电子数最多的元素
请回答下列问题:
(1)W、X、V第一电离能由大到小顺序:________________________(用元素符号表示)
(2)V的最高价氧化物对应含氧酸中,酸根的立体构型为:_________,中心原子的杂化方式为:_______________;
(3)Y的基态原子的价电子排布图为____________________________;
(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有10个电子。两者沸点的关系为乙______丙(填“>”或“<”),原因是__________________________________________;
(5)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中属于____________晶体
22.已知A、B、C、D、E、F、G是原子序数依次增大的前四周期元素,其中A是最轻的元素;B元素基态原子的最外层有2个未成对电子;D元素原子的价层电子排布式为;E元素的原子只有两种形状的电子云,最外层只有一种自旋方向的电子;F元素原子有5个未成对电子:G元素基态的正三价离子的3d轨道为半充满状态。请回答下列问题:
(1)分子中B的杂化轨道用于形成的化学键有_______(填共价键类型,下同)键、_______键,没有杂化的轨道形成_______π键。
(2)比较熔沸点:BD_______(填“高于”“低于”或“等于”),原因是_______。
(3)基态E原子中电子占据的最高能级的原子轨道形状为_______,的空间结构为_______。
(4)F是正常机体必需的微量元素之一,它构成体内若干种有重要作用的酶。F在元素周期表中的位置为_______,气态再失去一个电子比气态再失去一个电子更难的原因是_______。
【参考答案】
一、选择题
1.C
解析:A.氢键不是化学键,而是一种分子间作用力,A错误;
B.分子间的氢键可以使物质的熔沸点升高,而分子内的氢键可以使物质的熔沸点降低,B错误;
C.物质与水分子形成氢键,能使溶质更好地被水分子包围,并分散到水中,使溶质的溶解度增大,C正确;
D.由于氢键具有一定的方向性,水结冰的过程中,形成更多的氢键,使水分子间的空隙变大,因此冰的体积膨胀,D错误;
故选C。
2.C
解析:A.乙烷分子中碳原子含有4个共价单键不含共价双键或三键,不存在π 键,且碳原子采用sp3杂化,A错误;
B.乙烯分子中每个碳原子含有3个σ键,1个碳碳双键,分子中含有一个π键,碳原子采用sp2杂化,B错误;
C.乙炔分子中每个碳原子含有2个σ键,含有碳碳三键,分子中含有2个π键,碳原子采用sp杂化,C正确;
D.苯分子中含有1个大π键,每个碳原子含有3个σ键,碳原子采用sp2杂化,D错误;
故选C。
3.C
解析:A.微粒中立体构型是三角锥型,说明中心原子A的价电子n=4且含有一个孤电子对,分子结构不对称,为极性分子,如PH3分子中价层电子对数=3+×(5-3×1)=4,且含有一个孤电子对,其空间构型是三角锥型,分子结构不对称,为极性分子,选项A正确;
B.CO2中C原子的价层电子对为2,VSEPR模型为直线型,NO2中N原子的价层电子对为=2.5,按3处理,VSEPR模型为平面三角形,SO2中S原子的价层电子对数为3,VSEPR模型为平面三角形,BF3中B原子的价层电子对为=3,VSEPR模型为平面三角形,NH3中N原子的价层电子对为=4,VSEPR模型为正四面体,分子的VSEPR模型为平面三角形的是 ②③④,选项B正确;
C.具有相同电子层结构的离子核电荷数越大半径越小,则离子半径Ca2+、K+、Cl-、S2-四种离子的半径大小为:S2->Cl->K+>Ca2+,选项C不正确;
D.核外电子数为偶数的基态原子,其原子轨道中可能含“未成对电子”,如C的价层电子排布式为2s22p4,2p轨道中存在2个未成对电子,选项D正确;
答案选C。
4.D
解析:A.硫酸溶于水时,H2SO4电离为H+和,破坏了共价键,A错误;
B.范德华力是普遍存在于分子之间的作用力,因此水分子间存在范德华力,B错误;
C.同系物是指结构相似、分子组成相差若干个“CH2”原子团的有机化合物,同系物的前提是结构相似,C错误;
D.在氢原子的基态电子的概率分布图中,小黑点的疏密程度表示电子在该区域空间出现机会的多少,即概率的大小,不表示电子,密的地方出现机会多、疏的地方出现机会少,D正确;
故选D。
5.C
解析:A.NaOH中存在金属阳离子和氢氧根离子间的离子键,属于离子化合物,选项A不符合;
B.MgCl2中含有活泼的金属元素和活泼的非金属元素,含有离子键,属于离子化合物,选项B不符合;
C.CH3CH2OH中只含有非金属元素与非金属元素形成的共价键,属于共价化合物,选项C符合;
D.Na2O2是活泼金属Na与活泼非金属元素O通过离子键形成的离子化合物,其中阴离子是O22-,选项D不符合。
答案选C。
6.C
解析:A.水分子间存在氢键,使水分子之间形成孔穴,造成冰的微观空间存在空隙,宏观上表现在冰的密度比水小,冰能浮在水面上,A项正确;
B.乙醇分子与水分子间能形成氢键,甲醚分子与水分子间不能形成氢键,所以乙醇比甲醚更易溶于水,B项正确;
C.HF分子间存在氢键,HCl、HBr、HI分子间不存在氢键,相对分子质量越大,分子间作用力越强,沸点越高,则有沸点:HF>HI>HBr>HCl,C项错误;
D.蛋白质上的氨基和羰基之间能形成氢键,从而影响了蛋白质分子独特的结构,D项正确;
答案选C。
7.B
解析:F、O、N电负性很大,与H元素形成的微粒之间可以形成氢键,正四面体顶点N原子与嵌入空腔的微粒形成4个氢键,该微粒应含有4个H原子,选项中只有NH符合。
故选B。
8.A
解析:A.碳碳三键含有1个σ键和2个π键,碳碳双键含有1个σ键和1个π键,由于碳原子之间σ键键能大于π键键能,故碳碳三键、碳碳双键的键能小于碳碳单键的3倍和2倍,A错误;
B.丙烯(CH3CH=CH2)分子除碳碳双键中含有1个π键外,其余8个都是σ键,B正确;
C.丙烯分子中的π键易断裂,不如σ键稳定,C正确;
D.两原子在成键时,原子轨道以 “肩并肩”的方式重叠形成的共价键为π键,每个π键的电子云由两块组成,它们互为镜像,D正确;
故选A。
9.B
解析:A.C、N、O为相邻的同周期元素,由于N的2p轨道半充满,所以其第一电离能比O大,从而得出第一电离能:N>O>C,A正确;
B.基态氧原子核外电子排布式为1s22s22p4,有1s、2s、三个2p轨道,共有5种空间运动状态,B错误;
C.1,3-唑分子中,含有3个C-Hσ键、2个C-Nσ键、1个C-Cσ键、2个C-Oσ键,则1mol分子中含有8molσ键,C正确;
D.1,3-唑分子中,C、N原子的价层电子对数都为3,所以均发生sp2杂化,D正确;
故选B。
10.A
解析:A.的中心C原子的价层电子对数为3,发生sp2杂化,且C原子的最外层不存在孤电子对,则其空间构型为平面三角形,A正确;
B.的键的电子云,应为两个3p轨道头对头发生重叠,B不正确;
C.水晶的主要成分为二氧化硅,属于共价晶体,其由Si、O原子构成,不存在分子式,C不正确;
D.基态铬原子的价电子排布式为3d54s1,则其轨道表示式: ,D不正确;
故选A。
11.A
解析:A.NH3分子中N原子有一对孤电子对,H2O分子中O原子有两对,HCl分子中Cl原子有3对,CO2分子中两个O原子共有2×2=4对,孤电子对最多的是CO2,A正确;
B.氯离子最外层有8个电子,电子式应为,B错误;
C.S2-核外有18个电子,核外电子排布式为1s22s22p63s23p6,C错误;
D.基态到激发态需要吸收能量,产生的光谱为吸收光谱,D错误;
综上所述答案为A。
12.B
解析:A.NaH会和水反应,故该反应在无水环境下进行,A正确;
B.该反应中不存在元素化合价的改变,不是氧化还原反应,B错误;
C.同一主族随原子序数变大,原子半径变大,第一电离能变小;同一周期随着原子序数变大,第一电离能变大,元素的第一电离能:,C正确;
D.中B形成4个共价键,为sp3杂化,空间构型为正四面体形,D正确;
故选B。
13.C
解析:A.醋酸属于弱酸,其电离方程式为CH3COOHCH3COO-+H+,故A错误;
B.铬元素的价电子排布式为3d54s1,位于d区,故B错误;
C.NH3的中心原子的价层电子对数为3+=4,故C正确;
D.过氧化钠为离子化合物,其电子式为,故D错误;
答案为C。
14.C
解析:A.HCl分子中的共价键是H原子的1s轨道与 Cl原子的3p轨道形成的s-p σ键,故A正确;
B.σ键为轴对称,π键为镜面对称,σ键可以绕键轴旋转,π键一定不能绕键轴旋转,故B正确;
C.CH3—CH3、CH2=CH2、CH≡CH中的σ键是碳氢单键和C-C键,故C错误;
D.石墨分子中1个六元环中含6个C原子,每个C原子由3个碳碳键共用,根据均摊法可知,1个六元环中含有的C原子个数为=2个,所以24g石墨中含有六元环的个数为=NA,故D正确;
故选C。
15.A
解析:A.转变成时断裂键,吸收热量,形成键,放出热量,故反应过程中放出的热量为,A正确;
B.由题给信息可知,键键能为,键键能为,键能越大,共价键越稳定,B错误;
C.反应转化为时放出的热量,说明比的总能量高,C错误;
D.中的键是同一元素的原子形成的共价键,属于非极性键,D错误;
答案选A。
二、填空题
16. 平面三角 四方锥
解析:中碳原子价层电子对个数=3+ (4+2-3×2)=3,且不含孤电子对,所以C原子采用sp2杂化,空间构型为平面三角形;
XeOF4分子中有6对电子对,Xe采用sp3d杂化,电子对构型为正八面体形。一个孤电子对占据一个八面体的顶点,XeOF4分子构型为四角锥形。
17. 10P2I4+13P4+128H2O=40PH4I+32H3PO4 +2 +5 -3
解析:略
18. 极性 萃取剂与溶质更易分离(或萃取剂更环保等) de
解析:(1)C原子最外层有4个电子,O原子最外层有6个电子,C原子的4个成单电子与2个O原子成单电子形成四对共用电子对,使分子中各原子都达到稳定结构,电子式是:;在CO2分子中存在的化学键是C=O,C=O是不同元素的原子之间形成的共价键属于极性键,所以CO2分子中含有极性键;
(2)物质的性质与用途不仅与组成和结构有关,还与物质所处的状态有关,由题目信息知超临界CO2流体可用作萃取剂,考虑其与有机萃取剂相比,其优点是:可以从萃取剂的绿色环保性、萃取后萃取剂与溶质更易分离;
(3)a.反应混合物中只有CO2和H2是气体,CO2和H2初始投入量之比和反应消耗量之比均为1:3,所以二者体积分数一直不变,气体平均相对分子质量也一直不变,因此不能据此判断反应是否处于平衡状态,a不符合题意;
b.反应混合物中只有CO2和H2是气体,CO2和H2初始投入量之比和反应消耗量之比均为1:3,所以反应体系中CO2和H2体积分数一直不变,不能据此判断反应是否处于平衡状态,b不符合题意;
c.反应混合物中只有CO2和H2是气体,CO2和H2初始投入量之比和反应消耗量之比均为1:3,所以反应体系中CO2和H2的转化率相同,c不符合题意;
d.容器的容积不变,反应正向进行,气体的质量逐渐减小,气体的密度也逐渐减小,当气体的质量不变时,气体的密度不变,反应达到平衡状态,d符合题意;
e.根据方程式可知:每有1 mol CO2生成,就会形成3 mol H-H键,同时断裂3 mol H-H键,则H2的浓度不变,反应处于平衡状态,e符合题意;
故合理选项是de。
19.(1)7
(2) 2 2
(3)
解析:(1)1个柠檬酸分子中有4个C-O键和3个C=O键,则1mol柠檬酸分子中碳原子与氧原子形成的键共7mol。
(2)CO2的结构式为O=C=O,则1个CO2分子中存在2个键和2个键。
(3)N2的结构式为,则。
20.(1) 4 洪特规则
(2) sp2和sp3 H
(4)EDTA分子间存在氢键
(5)5NA
解析:(1)基态Si原子价电子排布为3s23p2,把电子在原子核外的一个空间运动状态称为一个原子轨道,因而空间运动状态个数等于轨道数;而在同一原子轨道下最多可以有两个自旋方向不同的电子,自旋方向不同,运动状态也就不相同,即运动状态个数等于电子数,故基态Si原子的价层电子的运动状态有4种;洪特规则:在相同能量的原子轨道上,电子的排布将尽可能占据不同的轨道,而且自旋方向相同;若其电子排布式表示为[Ne]3s2违背了洪特规则;
(2)EDTA中羧基碳原子为sp2杂化、饱和碳原子为sp3杂化;EDTA中四种元素为C、N、O、H,同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;同主族由上而下,金属性增强,非金属性逐渐减弱,元素电负性减弱,故其电负性由小到大的顺序为H
(4)EDTA中含羧基,可以形成分子间氢键,导致沸点升高;
(5)单键均为σ键,双键中含有1个σ键1个π键;1个碳酸分子中存在5个σ键,则1mol碳酸分子中含有σ键的数目为5NA。
21. N>O>C 平面三角形 sp2 < 水分子间形成氢键 原子
【分析】U所处的周期数、族序数分别与其原子序数相等,故U为氢;
V基态时,电子分布在三个能级上,且各能级中电子数相等,则核外电子排布为1s22s22p2,则V为碳元素;
W基态时,2p 轨道处于半充满状态,核外电子排布为1s22s22p3,则W为氮元素;
X自然界中含量最多,故X为氧元素;
Y是第四周期元素中未成对电子数最多的元素,故Y为铬元素;
解析:(1)三种元素处于同一周期,N的2p能级处于半充满状态,第一电离能最大,W、X、V第一电离能由大到小顺序:N>O>C(用元素符号表示),故答案为:N>O>C;
(2)V为碳元素,V的最高价氧化物对应含氧酸中,C原子的价电子对=3+ =3,酸根的立体构型为:平面三角形,中心原子的杂化方式为:碳原子采取sp2杂化;故答案为:平面三角形;sp2;
(3)铬为24号元素,基态原子的核外电子排布式为[Ar]3d54s1,Y的基态原子的价电子排布图为,故答案为:;
(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有10个电子,乙和丙分别是CH4、H2O。两者沸点的关系为乙<丙(填“>”或“<”),水分子间形成氢键,增大分子间作用力,故答案为:<;水分子间形成氢键;
(5)V与W原子结合形成的V3W4晶体,化学式C3N4,其硬度比金刚石大,符合原子晶体的特征,则V3W4晶体中属于原子晶体,故答案为:原子。
22.(1) 或 或
(2) 高于 CO为极性分子,为非极性分子,分子极性越大,范德华力越大,熔沸点越高
(3) 球形 三角锥形
(4) 第四周期第ⅦB族 的价层电子排布为,3d轨道为半充满,比较稳定,的价层电子排布为,再失去一个电子即可达到3d轨道半充满的比较稳定状态
解析:A、B、C、D、E、F、G是原子序数依次增大的前四周期元素, A是最轻的元素,A是H元素;D元素原子的价层电子排布式为,n=2,D是O元素;B元素基态原子的最外层有2个未成对电子,B是C元素、C是N元素;E元素的原子只有两种形状的电子云,最外层只有一种自旋方向的电子,E是Na元素;F元素原子有5个未成对电子,F是Mn元素,G元素基态的正三价离子的3d轨道为半充满状态,G是Fe元素。
(1)分子的结构式为, C原子采用sp杂化,C的杂化轨道用和H于形成键、和另一个碳原子形成键,没有杂化的轨道形成π键;
(2)CO为极性分子,为非极性分子,分子极性越大,范德华力越大,熔沸点越高,所以熔沸点CO>N2;
(3)基态Na原子中电子占据的最高能级是3s,原子轨道形状为球形,H3O+中O原子的杂化轨道数是4,有1个孤电子对,空间结构为三角锥形。
(4)F是Mn元素,在元素周期表中的位置为第四周期第ⅦB族;的价层电子排布为,3d轨道为半充满,比较稳定,G是Fe元素,的价层电子排布为,再失去一个电子即可达到3d轨道半充满的比较稳定状态,所以气态再失去一个电子比气态再失去一个电子更难
