2023年中考化学复习 专题五 综合计算题课件(共50张PPT)
文档属性
| 名称 | 2023年中考化学复习 专题五 综合计算题课件(共50张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-23 09:54:41 | ||
图片预览










文档简介
(共50张PPT)
第二部分
专题复习
1
解题秘笈
2
分类突破
专题五 综合计算题
利用化学方程式的简单计算:
1.利用化学方程式的计算依据:质量守恒定律。
2.利用化学方程式的解题步骤:
设未知量→写出并配平化学反应方程式→写出相关物质的相对分子质量、已知量、未知量→列出比例式,求解→简明地写出答案。
注意:
(1)化学方程式是计算的依据。书写化学方程式时要抓住四个“准确”,即:准确书写化学方程式;准确配平化学方程式;准确书写反应条件;准确计算相应物质的相对分子质量。
(2)化学方程式反映的是纯净物之间的质量关系,因此,遇到不纯物时要先把不纯的反应物(或生成物)的质量换算成纯净物的质量;若是气体,体积需换算成质量方可进行计算。
气体的质量(g)=气体的体积(L)×气体的密度(g/L);
纯净物的质量(g)=不纯物质的质量(g)×纯度。
(3)解题时要把握好以下要领:步骤要完整;格式要规范;计算要准确。
3.对题目中所给的“适量”“足量”“过量”“恰好反应”“完全反应”“充分反应”等词语,要认真对待,正确理解,一般来说:
“适量”——两种(或多种)反应物之间按一定质量比恰好反应。
“足量”—— 一种反应物完全反应,无剩余;另一种反应物可能完全反 应,无剩余,也可能过量。
“过量”——完全反应后,有一种(或多种)反应物剩余。
“恰好反应”和“恰好完全反应” ——反应后,反应物无剩余。
“充分反应” 和“完全反应” ——同“足量”:至少有一种反应物反应完。
类型一
(2022·德阳)盐酸是一种重要的化工原料,但在使用前一般需测定其中HCl的质量分数。现取200 g未知溶质质量分数的盐酸溶液于锥形瓶中,然后向锥形瓶中滴加溶质质量分数为20%的氢氧化钠溶液至pH=7(常温)时消耗氢氧化钠溶液200 g,求盐酸中HCl的质量分数?
解:设盐酸溶液中HCl的质量为x。
HCl+NaOH===NaCl+H2O
36.5 40
x 200 g×20%
x=36.5 g
答:盐酸中HCl的质量分数为18.25 %。
【思路点拨】 根据参加反应的氢氧化钠溶液的质量、溶质质量分数,由反应的化学方程式列式计算出盐酸中HCl的质量,进而计算出盐酸中HCl的质量分数。
1.(2022·福建)氢能的清洁性备受关注,但电解法制氢也会因消耗电能而相当于有碳排放。
(1)甲烷燃烧的化学方程式为CH4+2O2 CO2+2H2O。计算64 g CH4完全燃烧生成CO2的质量。
点燃
对点训练
解:(1)设生成CO2的质量为x。
CH4+2O2CO2+2H2O
16 44
64 g x
(2)理论上,64 g CH4与耗电1 kW·h制得的H2燃烧放出的能量相当。某省电解制氢每耗电1 kW·h相当于排放500 g CO2,若该省使用电解法制得的H2替代甲烷作燃料, (填“有利于”或“不利于”)减少碳排放。
不利于
2.(2022·大庆)含氯消毒液是家庭常用的消毒用品,有效成分为次氯酸钠(NaClO)。工业制备原理为Cl2+2NaOH===NaClO+NaCl+H2O。现向质量分数为8.0%的NaOH溶液中通入氯气,制得质量分数为5.0%的NaClO消毒液(溶质为NaCl、NaClO和NaOH)2 980 g。
请回答下列问题:
(1)NaClO中氯元素的化合价为 。
(2)已知质量分数为0.05%的NaClO消毒液用于家居消毒效果较好。现用10 g质量分数为5.0%的NaClO消毒液,配制质量分数为0.05%的NaClO消毒液,需加入水的质量为 g。
+1
990
(3)请计算质量分数为5.0%的NaClO消毒液中NaOH的质量分数是多少?(写出计算过程,计算结果精确至0.1%)。
解:反应后次氯酸钠的质量是2980 g×5.0%=149 g
设反应的氯气质量是y,氢氧化钠质量是z。
Cl2+2NaOH===NaClO+NaCl+H2O
71 80 74.5
y z 149 g
y=142 g z=160 g
则氢氧化钠溶液的质量是2980 g-142 g=2838 g
原氢氧化钠溶液中氢氧化钠的质量为:2838 g×8.0%=227.04 g
则质量分数为5.0%的NaClO消毒液中NaOH的质量分数为: ×100%≈2.2%;
答:质量分数为5.0%的NaClO消毒液中NaOH的质量分数是2.2%。
类型二
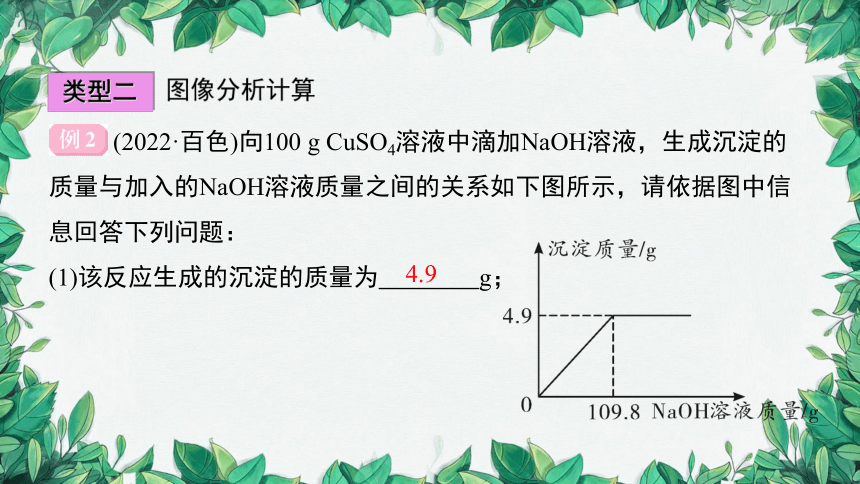
(2022·百色)向100 g CuSO4溶液中滴加NaOH溶液,生成沉淀的质量与加入的NaOH溶液质量之间的关系如下图所示,请依据图中信息回答下列问题:
(1)该反应生成的沉淀的质量为 g;
4.9
(2)求CuSO4溶液中溶质的质量分数(根据化学方程式计算)。
解:设CuSO4溶液中溶质的质量分数为x
CuSO4+2NaOH===Cu(OH)2↓+Na2SO4
160 98
100 g x 4.9 g
x=8%
答:CuSO4溶液中溶质的质量分数为8%
对点训练
3.(2022·江西)化学小组参与“铅蓄废电池中硫酸回收”的研学项目,回收时需要测定电池废液中硫酸的质量分数。向装有50 g废液的锥形瓶中加入质量分数为20%的氢氧化钠溶液,并充分搅拌,利用温度传感器等电子设备采集信息并绘制成如图,请据图回答相关问题。(杂质可溶但不参加反应)
(1)该反应是 (选填“吸热”或“放热”)反应。
(2)恰好完全反应时,溶液的温度为 ℃。
放热
t3
(3)计算废液中硫酸的质量分数。(写出计算过程)
解:设废液中硫酸的质量为x。
2NaOH+H2SO4===Na2SO4+2H2O
80 98
40g×20% x
x=9.8 g
废液中硫酸的质量分数为 ×100%=19.6%
答:废液中硫酸的质量分数为19.6%。
(4)配制上述实验所用的氢氧化钠溶液。
①氢氧化钠固体应放在玻璃器皿中称量的原因是________________
____________________________________________;
②用量筒量水时仰视读数,会导致测定废液中硫酸的质量分数结果
(选填“偏大”“偏小”或“不变”)。
氢氧化钠易于潮解、有强烈的腐蚀性
偏大
类型三
(2022·牡丹江)某化学兴趣小组测定假黄金(铜锌合金)的组成,称取25 g假黄金置于烧杯中,用80 g稀硫酸分4次加入,实验数据记录如下:
实验次数 第一次 第二次 第三次 第四次
稀硫酸的质量/g 20 20 20 20
残留金属的质量/g 21.75 18.5 15.25 15.25
试分析并计算:
(1)25 g假黄金中锌的质量是 g。
(2)当加入 g稀硫酸时,25 g假黄金中的锌恰好完全反应。
9.75
60
(3)求第二次实验后所得溶液的溶质质量分数。(精确到0.01%)
实验次数 第一次 第二次 第三次 第四次
稀硫酸的质量/g 20 20 20 20
残留金属的质量/g 21.75 18.5 15.25 15.25
解:设第二次实验后所得溶液中溶质硫酸锌的质量为x,
此时生成氢气的质量为y。
Zn+H2SO4=ZnSO4+H2↑
65 161 2
25 g-18.5 g x y
x=16.1 g y=0.2 g
第二次实验后所得溶液的溶质质量分数为:
×100%=34.77%
对点训练
4.Mg(OH)2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液。为确定混合溶液中镁的含量,取4份混合溶液各100 g,向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:
实验编号 ① ② ③ ④
NaOH溶液的质量/g 10.0 20.0 30.0 40.0
Mg(OH)2的质量/g 0.232 0.522 0.580 0.580
(1)实验 (填实验编号)中硫酸镁完全反应。
③④
(2)计算100g混合溶液中含MgSO4的质量(写出计算过程)。
实验编号 ① ② ③ ④
NaOH溶液
的质量/g 10.0 20.0 30.0 40.0
Mg(OH)2
的质量/g 0.232 0.522 0.580 0.580
解:设100混合溶液中含MgSO4的质量为x
2NaOH+MgSO4===Na2SO4+Mg(OH)2↓
120 58
x 0.580g
答:100混合溶液中含MgSO4的质量为1.2g
(3)分析实验数据,在图中,画出加入4% NaOH溶液质量0-30.0 g过程中,产生Mg(OH)2沉淀质量对应的变化图,并标注必要的数值。
解:如图:
5.(2022·包头)常温下,向盛有100g NaOH溶液的烧杯中逐滴加入溶质质量分数为3.65%的稀盐酸,测得反应过程中溶液的pH与加入稀盐酸的质量数据如下:
加入稀盐酸的质量/g 80 100 120
烧杯中溶液的pH 13.0 7.0 1.0
(1)当溶液为中性时,消耗稀盐酸的质量为 g。
100
(2)计算该NaOH溶液中溶质的质量分数。
解:设氢氧化钠质量为x,生成氯化钠质量为y,
100 g稀盐酸中氯化氢质量:100 g×3.65%=3.65 g,
NaOH+HCl===NaCl+H2O,
40 36.5 58.5
x 3.65 g y
答:所用NaOH溶液中的溶质质量分数是4%。
(3)计算恰好完全反应时,所得溶液的溶质质量分数。
解:恰好完全反应时所得到的NaCl溶液中溶质质量分数是
答:恰好完全反应时所得到的氯化钠溶液中溶质质量分数是2.925%。
类型四
同学们做甲、乙两个中和反应实验的探究(见下图)。
(1)甲实验恰好中和,则该溶液中的溶质是_________(填化学式)。
CaCl2
(2)取乙反应后的溶液60.0 g,滴加质量分数26.5%的Na2CO3溶液(见丙图),溶液pH的变化如图2所示。则与CaCl2反应的碳酸钠溶液的质量为 g;请计算该溶液中CaCl2的溶质质量分数(写出计算过程,精确到 0.1%)。
40
解:由图可知,碳酸钠溶液的量到70g
时,反应正好完成;氯化钙和碳酸钠
的反应生成碳酸钙和水,据题意,
设参加反应的CaCl2的质量为x,则
CaCl2+Na2CO3===CaCO3↓+2NaCl
111 106
x 40g×26.5%
解得:x=11.1g
(3)根据计算所得数据在下图中画出产生沉淀的曲线。
(4)乙组的中和反应实验设计存在的不足是_____________________。
解:如图
无法验证是否恰好中和
【思路点拨】 (1)根据盐酸和氢氧化钙的反应进行分析;(2)反应后的溶液是氯化钙溶液,和碳酸钠溶液反应生成碳酸钙沉淀,根据化学反应方程式进行分析计算;(3)根据计算数据绘制曲线图即可;(4)乙组的中和反应试验中没有加酚酞试液,无法验证是否恰好中和。
对点训练
6.(2021·潍坊) 用沉淀法可测定食用碱样品中碳酸钠质量分数。取11 g食用碱样品(有少量的杂质氯化钠),加水完全溶解制成100 g溶液,逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如下表:
请根据实验数据分析解析下列问题:
(1)表中数据M的值为 。
(2)请画出生成沉淀的质量随滴加氯化钙溶液
质量的变化关系图(标明恰好反应时点的坐标)。
实验次数 第1次 第2次 第3次 第4次 第5次 第6次
加入CaCl2溶液的质量/g 20.0 20.0 20.0 20.0 20.0 20.0
反应后溶液的总质量/g 118.0 136.0 154.0 M 191.0 211.0
172
解:如图
(3)计算该食用碱样品中碳酸钠的质量分数(写出过程,结果保留到0.1%)。
解:设该食用碱样品中碳酸钠的质量分数为z
CaCl2+Na2CO3===CaCO3↓+2NaCl
106 100
11 g z 9 g
答:该食用碱样品中碳酸钠的质量分数为86.7%。
类型五
(2022·绥化)化学兴趣小组收集到某水垢样品,其成分为氢氧化镁和碳酸钙。已知氢氧化镁受热易分解,化学方程式为Mg(OH)2
MgO+H2O。小组同学取22.9克该水垢样品进行实验,加热过程中剩余固体的质量随加热时间的变化关系如图所示。
(2)分析图象可知,开始加热到t1时,固体质
量没有发生变化的原因是_______________
_____________________________________。
(3)b点对应固体的成分是 。
请回答下列问题:
(1)容易产生水垢的水是 。(填“硬水”或“软水”)
硬水
没有达到固体受热分解的温度
氧化镁和碳酸钙(或MgO、CaCO3)
(4)样品中氢氧化镁的质量分数为 。(写出计算过程,结果保留一位小数)
12.7%
解:由图像分析可知,氢氧化镁反应生成水的质量=22.9 g-22.0 g=0.9 g。
设氢氧化镁质量为x,生成氧化镁质量为y
Mg(OH)2 MgO+H2O
58 40 18
x y 0.9g
答:样品中氢氧化镁的质量分数为12.7%。
(5)m的值是 。
13.2 g
对点训练
7.(2021·广东) 胆矾(CuSO4·5H2O,相对分子质量为250)广泛应用于生产生活中。
(1)农药波尔多液由胆矾和石灰乳等配制而成。不能用铁桶来配制波尔多液,因为铁的金属活动性比铜的 (填“强”或“弱”)。
强
(2)将25.0g胆矾放在坩埚内加热,固体质量
与成分随温度变化的曲线如图所示。
①加热至 ℃时,CuSO4开始分解。
②加热至1000℃时,CuO开始分解,生成Cu2O与一种能使带火星的木条复燃的气体,该气体为 ,CuO完全分解时产生该气体的质量为 g。
650
O2
0.8
③根据胆矾分解的化学方程式,计算“题图”中x的值 (写出计算过程)。
16
解:设完全分解生成硫酸铜质量为x。
CuSO4·5H2O CuSO4+5H2O
250 160
2.5 g x
④下列物质均可作为炼铜的原料,理论上,冶炼等质量的下列物质得到铜最多的是 (填字母序号)。
a.CuSO4·5H2O b.CuSO4
c.CuO d.Cu2O
d
类型六
2020年6月8日是第12个“世界海洋日”,海洋是巨大的资源宝库。某课题小组模拟工业海水提镁的流程,在实验室制取生产镁的原料氯化镁,设计方案如图所示:
【信息】①海水和苦卤中都含有NaCl、Na2SO4、MgCl2、CaCl2、KCl等。②苦卤是海水晒盐后剩余的溶液。 ③下表是某品牌不同碱的价格。
试剂 NaOH Ca(OH)2 Ba(OH)2 KOH
价格(元/吨) 2 400 850 5 300 5 500
请分析与计算。
(1)海水和苦卤都可以作为制取氯化镁的原料,甲同学提出选择苦卤更好,小组同学一致同意他的观点,理由是______________________。
苦卤中氯化镁含量高
(2)在工业生产中为了降低成本,试剂X最好选择表格中的 。
(3)该方案制取氯化镁时,要经历步骤Ⅰ和步骤Ⅱ两步转化,其主要目的是________________。
试剂 NaOH Ca(OH)2 Ba(OH)2 KOH
价格(元/吨) 2 400 850 5 300 5 500
氢氧化钙
富集氯化镁
(4)小组同学按上述方案进行了实验,并制得19.0 g干燥纯净的氯化镁固体。若步骤Ⅱ中溶质质量分数为10%的稀盐酸与氢氧化镁恰好完全反应,且步骤Ⅲ中氯化镁没有损失,求步骤Ⅱ中消耗稀盐酸的质量。
解:设反应的氯化氢质量为x,
Mg(OH)2+2HCl===MgCl2+2H2O,
73 95
x 19.0g
步骤Ⅱ中消耗稀盐酸的质量是:14.6g÷10%=146g。
【思路点拨】 (1)苦卤中氯化镁含量高;(2)根据物质的价格及其化学式可以比较判断相关方面的问题;(3)该方案制取氯化镁时,要经历步骤Ⅰ和步骤Ⅱ两步转化,其主要目的是富集氯化镁;(4)稀盐酸和氢氧化镁反应生成氯化镁和水,根据反应的化学方程式及其提供数据可以进行相关方面的计算。
对点训练
8.过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂以及鱼类运输时的制氧剂等。过氧化钙与水反应方程式为:2CaO2+2H2O===2Ca(OH)2+O2↑。
(1)若用150 g某过氧化钙工业样品可制得氧气32 g,请计算该过氧化钙样品的纯度。
解:设过氧化钙的质量为x,水的质量为y,
2CaO2+2H2O===2Ca(OH)2+O2↑
144 36 32
x y 32g
解得:x=144g,y=36g
(2)往150 g上述过氧化钙工业样品中逐渐加入水至过量,在下图中画出产生氧气的曲线图。
解:曲线图如图:
(3)下表为市面上某种过氧化钙和过氧化钠(化学式为Na2O2,化学性质与CaO2类似)样品的一些数据:
物质 相对分子质量 纯度 价格(元/kg)
Na2O2 78 98% 25
CaO2 72 94% 24
用3 000元购买样品制氧气,请通过计算说明购买哪种产品可制得更多的O2?(已知用3 000元购买过氧化钙样品可制得 26.1 kg O2)
物质 相对分子质量 纯度 价格(元/kg)
Na2O2 78 98% 25
CaO2 72 94% 24
解:3000元购买过氧化钠质量 =×98%=117.6kg
设过氧化钠产生的氧气质量为z
2Na2O2+2H2O===4NaOH+O2↑
156 32
117.6kg z
所以过氧化钙可制得更多的氧气。
第二部分
专题复习
1
解题秘笈
2
分类突破
专题五 综合计算题
利用化学方程式的简单计算:
1.利用化学方程式的计算依据:质量守恒定律。
2.利用化学方程式的解题步骤:
设未知量→写出并配平化学反应方程式→写出相关物质的相对分子质量、已知量、未知量→列出比例式,求解→简明地写出答案。
注意:
(1)化学方程式是计算的依据。书写化学方程式时要抓住四个“准确”,即:准确书写化学方程式;准确配平化学方程式;准确书写反应条件;准确计算相应物质的相对分子质量。
(2)化学方程式反映的是纯净物之间的质量关系,因此,遇到不纯物时要先把不纯的反应物(或生成物)的质量换算成纯净物的质量;若是气体,体积需换算成质量方可进行计算。
气体的质量(g)=气体的体积(L)×气体的密度(g/L);
纯净物的质量(g)=不纯物质的质量(g)×纯度。
(3)解题时要把握好以下要领:步骤要完整;格式要规范;计算要准确。
3.对题目中所给的“适量”“足量”“过量”“恰好反应”“完全反应”“充分反应”等词语,要认真对待,正确理解,一般来说:
“适量”——两种(或多种)反应物之间按一定质量比恰好反应。
“足量”—— 一种反应物完全反应,无剩余;另一种反应物可能完全反 应,无剩余,也可能过量。
“过量”——完全反应后,有一种(或多种)反应物剩余。
“恰好反应”和“恰好完全反应” ——反应后,反应物无剩余。
“充分反应” 和“完全反应” ——同“足量”:至少有一种反应物反应完。
类型一
(2022·德阳)盐酸是一种重要的化工原料,但在使用前一般需测定其中HCl的质量分数。现取200 g未知溶质质量分数的盐酸溶液于锥形瓶中,然后向锥形瓶中滴加溶质质量分数为20%的氢氧化钠溶液至pH=7(常温)时消耗氢氧化钠溶液200 g,求盐酸中HCl的质量分数?
解:设盐酸溶液中HCl的质量为x。
HCl+NaOH===NaCl+H2O
36.5 40
x 200 g×20%
x=36.5 g
答:盐酸中HCl的质量分数为18.25 %。
【思路点拨】 根据参加反应的氢氧化钠溶液的质量、溶质质量分数,由反应的化学方程式列式计算出盐酸中HCl的质量,进而计算出盐酸中HCl的质量分数。
1.(2022·福建)氢能的清洁性备受关注,但电解法制氢也会因消耗电能而相当于有碳排放。
(1)甲烷燃烧的化学方程式为CH4+2O2 CO2+2H2O。计算64 g CH4完全燃烧生成CO2的质量。
点燃
对点训练
解:(1)设生成CO2的质量为x。
CH4+2O2CO2+2H2O
16 44
64 g x
(2)理论上,64 g CH4与耗电1 kW·h制得的H2燃烧放出的能量相当。某省电解制氢每耗电1 kW·h相当于排放500 g CO2,若该省使用电解法制得的H2替代甲烷作燃料, (填“有利于”或“不利于”)减少碳排放。
不利于
2.(2022·大庆)含氯消毒液是家庭常用的消毒用品,有效成分为次氯酸钠(NaClO)。工业制备原理为Cl2+2NaOH===NaClO+NaCl+H2O。现向质量分数为8.0%的NaOH溶液中通入氯气,制得质量分数为5.0%的NaClO消毒液(溶质为NaCl、NaClO和NaOH)2 980 g。
请回答下列问题:
(1)NaClO中氯元素的化合价为 。
(2)已知质量分数为0.05%的NaClO消毒液用于家居消毒效果较好。现用10 g质量分数为5.0%的NaClO消毒液,配制质量分数为0.05%的NaClO消毒液,需加入水的质量为 g。
+1
990
(3)请计算质量分数为5.0%的NaClO消毒液中NaOH的质量分数是多少?(写出计算过程,计算结果精确至0.1%)。
解:反应后次氯酸钠的质量是2980 g×5.0%=149 g
设反应的氯气质量是y,氢氧化钠质量是z。
Cl2+2NaOH===NaClO+NaCl+H2O
71 80 74.5
y z 149 g
y=142 g z=160 g
则氢氧化钠溶液的质量是2980 g-142 g=2838 g
原氢氧化钠溶液中氢氧化钠的质量为:2838 g×8.0%=227.04 g
则质量分数为5.0%的NaClO消毒液中NaOH的质量分数为: ×100%≈2.2%;
答:质量分数为5.0%的NaClO消毒液中NaOH的质量分数是2.2%。
类型二
(2022·百色)向100 g CuSO4溶液中滴加NaOH溶液,生成沉淀的质量与加入的NaOH溶液质量之间的关系如下图所示,请依据图中信息回答下列问题:
(1)该反应生成的沉淀的质量为 g;
4.9
(2)求CuSO4溶液中溶质的质量分数(根据化学方程式计算)。
解:设CuSO4溶液中溶质的质量分数为x
CuSO4+2NaOH===Cu(OH)2↓+Na2SO4
160 98
100 g x 4.9 g
x=8%
答:CuSO4溶液中溶质的质量分数为8%
对点训练
3.(2022·江西)化学小组参与“铅蓄废电池中硫酸回收”的研学项目,回收时需要测定电池废液中硫酸的质量分数。向装有50 g废液的锥形瓶中加入质量分数为20%的氢氧化钠溶液,并充分搅拌,利用温度传感器等电子设备采集信息并绘制成如图,请据图回答相关问题。(杂质可溶但不参加反应)
(1)该反应是 (选填“吸热”或“放热”)反应。
(2)恰好完全反应时,溶液的温度为 ℃。
放热
t3
(3)计算废液中硫酸的质量分数。(写出计算过程)
解:设废液中硫酸的质量为x。
2NaOH+H2SO4===Na2SO4+2H2O
80 98
40g×20% x
x=9.8 g
废液中硫酸的质量分数为 ×100%=19.6%
答:废液中硫酸的质量分数为19.6%。
(4)配制上述实验所用的氢氧化钠溶液。
①氢氧化钠固体应放在玻璃器皿中称量的原因是________________
____________________________________________;
②用量筒量水时仰视读数,会导致测定废液中硫酸的质量分数结果
(选填“偏大”“偏小”或“不变”)。
氢氧化钠易于潮解、有强烈的腐蚀性
偏大
类型三
(2022·牡丹江)某化学兴趣小组测定假黄金(铜锌合金)的组成,称取25 g假黄金置于烧杯中,用80 g稀硫酸分4次加入,实验数据记录如下:
实验次数 第一次 第二次 第三次 第四次
稀硫酸的质量/g 20 20 20 20
残留金属的质量/g 21.75 18.5 15.25 15.25
试分析并计算:
(1)25 g假黄金中锌的质量是 g。
(2)当加入 g稀硫酸时,25 g假黄金中的锌恰好完全反应。
9.75
60
(3)求第二次实验后所得溶液的溶质质量分数。(精确到0.01%)
实验次数 第一次 第二次 第三次 第四次
稀硫酸的质量/g 20 20 20 20
残留金属的质量/g 21.75 18.5 15.25 15.25
解:设第二次实验后所得溶液中溶质硫酸锌的质量为x,
此时生成氢气的质量为y。
Zn+H2SO4=ZnSO4+H2↑
65 161 2
25 g-18.5 g x y
x=16.1 g y=0.2 g
第二次实验后所得溶液的溶质质量分数为:
×100%=34.77%
对点训练
4.Mg(OH)2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液。为确定混合溶液中镁的含量,取4份混合溶液各100 g,向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:
实验编号 ① ② ③ ④
NaOH溶液的质量/g 10.0 20.0 30.0 40.0
Mg(OH)2的质量/g 0.232 0.522 0.580 0.580
(1)实验 (填实验编号)中硫酸镁完全反应。
③④
(2)计算100g混合溶液中含MgSO4的质量(写出计算过程)。
实验编号 ① ② ③ ④
NaOH溶液
的质量/g 10.0 20.0 30.0 40.0
Mg(OH)2
的质量/g 0.232 0.522 0.580 0.580
解:设100混合溶液中含MgSO4的质量为x
2NaOH+MgSO4===Na2SO4+Mg(OH)2↓
120 58
x 0.580g
答:100混合溶液中含MgSO4的质量为1.2g
(3)分析实验数据,在图中,画出加入4% NaOH溶液质量0-30.0 g过程中,产生Mg(OH)2沉淀质量对应的变化图,并标注必要的数值。
解:如图:
5.(2022·包头)常温下,向盛有100g NaOH溶液的烧杯中逐滴加入溶质质量分数为3.65%的稀盐酸,测得反应过程中溶液的pH与加入稀盐酸的质量数据如下:
加入稀盐酸的质量/g 80 100 120
烧杯中溶液的pH 13.0 7.0 1.0
(1)当溶液为中性时,消耗稀盐酸的质量为 g。
100
(2)计算该NaOH溶液中溶质的质量分数。
解:设氢氧化钠质量为x,生成氯化钠质量为y,
100 g稀盐酸中氯化氢质量:100 g×3.65%=3.65 g,
NaOH+HCl===NaCl+H2O,
40 36.5 58.5
x 3.65 g y
答:所用NaOH溶液中的溶质质量分数是4%。
(3)计算恰好完全反应时,所得溶液的溶质质量分数。
解:恰好完全反应时所得到的NaCl溶液中溶质质量分数是
答:恰好完全反应时所得到的氯化钠溶液中溶质质量分数是2.925%。
类型四
同学们做甲、乙两个中和反应实验的探究(见下图)。
(1)甲实验恰好中和,则该溶液中的溶质是_________(填化学式)。
CaCl2
(2)取乙反应后的溶液60.0 g,滴加质量分数26.5%的Na2CO3溶液(见丙图),溶液pH的变化如图2所示。则与CaCl2反应的碳酸钠溶液的质量为 g;请计算该溶液中CaCl2的溶质质量分数(写出计算过程,精确到 0.1%)。
40
解:由图可知,碳酸钠溶液的量到70g
时,反应正好完成;氯化钙和碳酸钠
的反应生成碳酸钙和水,据题意,
设参加反应的CaCl2的质量为x,则
CaCl2+Na2CO3===CaCO3↓+2NaCl
111 106
x 40g×26.5%
解得:x=11.1g
(3)根据计算所得数据在下图中画出产生沉淀的曲线。
(4)乙组的中和反应实验设计存在的不足是_____________________。
解:如图
无法验证是否恰好中和
【思路点拨】 (1)根据盐酸和氢氧化钙的反应进行分析;(2)反应后的溶液是氯化钙溶液,和碳酸钠溶液反应生成碳酸钙沉淀,根据化学反应方程式进行分析计算;(3)根据计算数据绘制曲线图即可;(4)乙组的中和反应试验中没有加酚酞试液,无法验证是否恰好中和。
对点训练
6.(2021·潍坊) 用沉淀法可测定食用碱样品中碳酸钠质量分数。取11 g食用碱样品(有少量的杂质氯化钠),加水完全溶解制成100 g溶液,逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如下表:
请根据实验数据分析解析下列问题:
(1)表中数据M的值为 。
(2)请画出生成沉淀的质量随滴加氯化钙溶液
质量的变化关系图(标明恰好反应时点的坐标)。
实验次数 第1次 第2次 第3次 第4次 第5次 第6次
加入CaCl2溶液的质量/g 20.0 20.0 20.0 20.0 20.0 20.0
反应后溶液的总质量/g 118.0 136.0 154.0 M 191.0 211.0
172
解:如图
(3)计算该食用碱样品中碳酸钠的质量分数(写出过程,结果保留到0.1%)。
解:设该食用碱样品中碳酸钠的质量分数为z
CaCl2+Na2CO3===CaCO3↓+2NaCl
106 100
11 g z 9 g
答:该食用碱样品中碳酸钠的质量分数为86.7%。
类型五
(2022·绥化)化学兴趣小组收集到某水垢样品,其成分为氢氧化镁和碳酸钙。已知氢氧化镁受热易分解,化学方程式为Mg(OH)2
MgO+H2O。小组同学取22.9克该水垢样品进行实验,加热过程中剩余固体的质量随加热时间的变化关系如图所示。
(2)分析图象可知,开始加热到t1时,固体质
量没有发生变化的原因是_______________
_____________________________________。
(3)b点对应固体的成分是 。
请回答下列问题:
(1)容易产生水垢的水是 。(填“硬水”或“软水”)
硬水
没有达到固体受热分解的温度
氧化镁和碳酸钙(或MgO、CaCO3)
(4)样品中氢氧化镁的质量分数为 。(写出计算过程,结果保留一位小数)
12.7%
解:由图像分析可知,氢氧化镁反应生成水的质量=22.9 g-22.0 g=0.9 g。
设氢氧化镁质量为x,生成氧化镁质量为y
Mg(OH)2 MgO+H2O
58 40 18
x y 0.9g
答:样品中氢氧化镁的质量分数为12.7%。
(5)m的值是 。
13.2 g
对点训练
7.(2021·广东) 胆矾(CuSO4·5H2O,相对分子质量为250)广泛应用于生产生活中。
(1)农药波尔多液由胆矾和石灰乳等配制而成。不能用铁桶来配制波尔多液,因为铁的金属活动性比铜的 (填“强”或“弱”)。
强
(2)将25.0g胆矾放在坩埚内加热,固体质量
与成分随温度变化的曲线如图所示。
①加热至 ℃时,CuSO4开始分解。
②加热至1000℃时,CuO开始分解,生成Cu2O与一种能使带火星的木条复燃的气体,该气体为 ,CuO完全分解时产生该气体的质量为 g。
650
O2
0.8
③根据胆矾分解的化学方程式,计算“题图”中x的值 (写出计算过程)。
16
解:设完全分解生成硫酸铜质量为x。
CuSO4·5H2O CuSO4+5H2O
250 160
2.5 g x
④下列物质均可作为炼铜的原料,理论上,冶炼等质量的下列物质得到铜最多的是 (填字母序号)。
a.CuSO4·5H2O b.CuSO4
c.CuO d.Cu2O
d
类型六
2020年6月8日是第12个“世界海洋日”,海洋是巨大的资源宝库。某课题小组模拟工业海水提镁的流程,在实验室制取生产镁的原料氯化镁,设计方案如图所示:
【信息】①海水和苦卤中都含有NaCl、Na2SO4、MgCl2、CaCl2、KCl等。②苦卤是海水晒盐后剩余的溶液。 ③下表是某品牌不同碱的价格。
试剂 NaOH Ca(OH)2 Ba(OH)2 KOH
价格(元/吨) 2 400 850 5 300 5 500
请分析与计算。
(1)海水和苦卤都可以作为制取氯化镁的原料,甲同学提出选择苦卤更好,小组同学一致同意他的观点,理由是______________________。
苦卤中氯化镁含量高
(2)在工业生产中为了降低成本,试剂X最好选择表格中的 。
(3)该方案制取氯化镁时,要经历步骤Ⅰ和步骤Ⅱ两步转化,其主要目的是________________。
试剂 NaOH Ca(OH)2 Ba(OH)2 KOH
价格(元/吨) 2 400 850 5 300 5 500
氢氧化钙
富集氯化镁
(4)小组同学按上述方案进行了实验,并制得19.0 g干燥纯净的氯化镁固体。若步骤Ⅱ中溶质质量分数为10%的稀盐酸与氢氧化镁恰好完全反应,且步骤Ⅲ中氯化镁没有损失,求步骤Ⅱ中消耗稀盐酸的质量。
解:设反应的氯化氢质量为x,
Mg(OH)2+2HCl===MgCl2+2H2O,
73 95
x 19.0g
步骤Ⅱ中消耗稀盐酸的质量是:14.6g÷10%=146g。
【思路点拨】 (1)苦卤中氯化镁含量高;(2)根据物质的价格及其化学式可以比较判断相关方面的问题;(3)该方案制取氯化镁时,要经历步骤Ⅰ和步骤Ⅱ两步转化,其主要目的是富集氯化镁;(4)稀盐酸和氢氧化镁反应生成氯化镁和水,根据反应的化学方程式及其提供数据可以进行相关方面的计算。
对点训练
8.过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂以及鱼类运输时的制氧剂等。过氧化钙与水反应方程式为:2CaO2+2H2O===2Ca(OH)2+O2↑。
(1)若用150 g某过氧化钙工业样品可制得氧气32 g,请计算该过氧化钙样品的纯度。
解:设过氧化钙的质量为x,水的质量为y,
2CaO2+2H2O===2Ca(OH)2+O2↑
144 36 32
x y 32g
解得:x=144g,y=36g
(2)往150 g上述过氧化钙工业样品中逐渐加入水至过量,在下图中画出产生氧气的曲线图。
解:曲线图如图:
(3)下表为市面上某种过氧化钙和过氧化钠(化学式为Na2O2,化学性质与CaO2类似)样品的一些数据:
物质 相对分子质量 纯度 价格(元/kg)
Na2O2 78 98% 25
CaO2 72 94% 24
用3 000元购买样品制氧气,请通过计算说明购买哪种产品可制得更多的O2?(已知用3 000元购买过氧化钙样品可制得 26.1 kg O2)
物质 相对分子质量 纯度 价格(元/kg)
Na2O2 78 98% 25
CaO2 72 94% 24
解:3000元购买过氧化钠质量 =×98%=117.6kg
设过氧化钠产生的氧气质量为z
2Na2O2+2H2O===4NaOH+O2↑
156 32
117.6kg z
所以过氧化钙可制得更多的氧气。
同课章节目录
