专题5《药物合成的重要原料—卤代烃、胺、酰胺》单元检测题(含答案)2022-2023学年高二下学期化学苏教版(2019)选择性必修3
文档属性
| 名称 | 专题5《药物合成的重要原料—卤代烃、胺、酰胺》单元检测题(含答案)2022-2023学年高二下学期化学苏教版(2019)选择性必修3 |
|
|
| 格式 | docx | ||
| 文件大小 | 543.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-23 11:43:28 | ||
图片预览



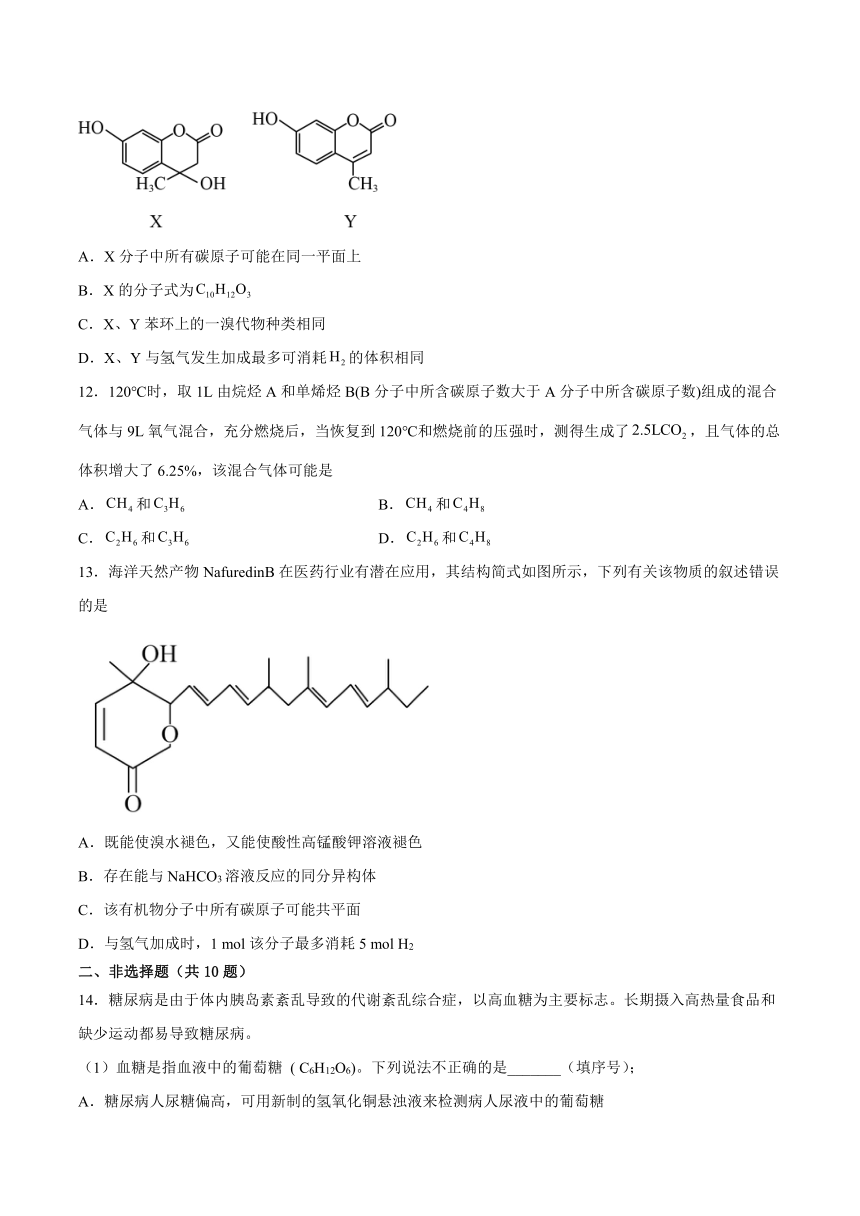

文档简介
专题5《药物合成的重要原料—卤代烃、胺、酰胺》单元检测题
一、单选题(共13题)
1.下列反应过程中有π键形成的是
A.乙酸与乙醇发生的酯化反应 B.乙烯使溴的四氯化碳溶液褪色
C.乙醛还原生成乙醇 D.溴乙烷与氢氧化钠醇溶液混合加热
2.由C、H、O三种元素组成的某化合物X的球棍模型如图所示。下列说法不正确的是
A.属于羧酸 B.分子式为
C.能发生加成反应和取代反应 D.可与溶液发生反应
3.青霉素是常用抗生素,不同品种的青霉素结构不同,其中一种的结构可以表示为:。下列关于这种青霉素分子的说法正确的是
A.分子式为C16H20N2O4S
B.青霉素分子属于芳香烃
C.1mol该分子与足量的金属钠最多能够生成1mol H2
D.这种青霉素分子显酸性
4.某物质的分子式为CxHyOz,取该物质ag在足量的O2中充分燃烧后,将产物全部通入过量的Na2O2中,若Na2O2固体的质量增加了bg,且aA.C2H4O B.C2H4O2 C.CH2O2 D.C2H4O3
5.根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 实验结论
向苯酚浊液中加入溶液,溶液变澄清 酸性:苯酚
无水乙醇与浓硫酸共热至,将产生的气体通入溴水中,溴水褪色 乙烯和溴水发生加成反应
氯乙烷与溶液共热后,滴加溶液,生成白色沉淀 氯乙烷已发生水解
在的溶液中先滴入几滴 溶液有白色沉淀生成,再滴入 溶液,又出现黑色沉淀
A. B. C. D.
6.有机物A是一种常用的内服止痛解热药。1molA水解得到1molB和1mol醋酸,A溶液具有酸性,不能使FeCl3溶液显色。A的相对分子质量不超过200。B分子中碳元素和氢元素的质量分数和为0.652。A、B都是有碳、氢、氧三种元素组成的芳香族化合物。则下列推断中,正确的是
A.A、B的相对分子质量之差为42
B.1个B分子中应当有2个氧原子
C.A的分子式是C7H6O3
D.B能与NaOH溶液、FeCl3溶液等物质反应,但不与溴水反应
7.环戊二烯(a)与丙烯醛(b)通过Diels-Alder反应制得双环[2,2,1]-5-庚烯-2-醛(c),反应如图所示。
下列说法正确的是( )
A.a分子所有原子均可共平面
B.a分子通过缩合聚合反应合成有机高分子
C.b分子中的共价键个数N(σ键)∶N(π键)=7:2
D.酸性高锰酸钾溶液能将c分子氧化成
8.依据下列实验的操作及现象,推测出的相应结论中正确的是
选项 实验操作 现象 结论
A 向溶液中通入 溶液变浑浊 酸性:
B 1-溴丙烷与NaOH的乙醇溶液共热,有气体逸出 该气体可使酸性高锰酸钾溶液褪色 1-溴丙烷在该条件下发生消去反应生成丙烯
C 向3mL1mol·L-1的NaOH溶液中滴加5滴1mol·L-1的MgCl2溶液,再滴加5滴1mol·L-1的FeCl3溶液 先产生白色沉淀,后转化为红褐色沉淀 溶度积常数:Mg(OH)2>Fe(OH)3
D 在酸性溶液中滴加溶液 溶液变黄色 氧化性:
A.A B.B C.C D.D
9.环氧树脂广泛应用于涂料和胶黏剂等领域,以下是一种新型环氧树脂前体(丁)的合成路线,下列有关说法正确的是
A.乙按系统命名法的名称为1-氯丙烯
B.丙的结构简式一定为HOCH2CHClCH2Cl
C.甲和乙均能使溴水或酸性KMnO4溶液褪色
D.丁的一溴代物的同分异构体有2种(不考虑立体异构)
10.异山梨醇和碳酸二甲酯合成碳酸酯其中的一步反应路线如图:
下列说法正确的是。
A.该反应的类型为加成反应 B.Y中的官能团有醚键和羧基
C.X在水中的溶解度小于Y D.该反应的副产物为甲醇
11.化合物X可用于合成Y.下列有关X、Y的说法正确的是
A.X分子中所有碳原子可能在同一平面上
B.X的分子式为
C.X、Y苯环上的一溴代物种类相同
D.X、Y与氢气发生加成最多可消耗的体积相同
12.120℃时,取1L由烷烃A和单烯烃B(B分子中所含碳原子数大于A分子中所含碳原子数)组成的混合气体与9L氧气混合,充分燃烧后,当恢复到120℃和燃烧前的压强时,测得生成了,且气体的总体积增大了6.25%,该混合气体可能是
A.和 B.和
C.和 D.和
13.海洋天然产物NafuredinB在医药行业有潜在应用,其结构简式如图所示,下列有关该物质的叙述错误的是
A.既能使溴水褪色,又能使酸性高锰酸钾溶液褪色
B.存在能与NaHCO3溶液反应的同分异构体
C.该有机物分子中所有碳原子可能共平面
D.与氢气加成时,1 mol该分子最多消耗5 mol H2
二、非选择题(共10题)
14.糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志。长期摄入高热量食品和缺少运动都易导致糖尿病。
(1)血糖是指血液中的葡萄糖 ( C6H12O6)。下列说法不正确的是_______(填序号);
A.糖尿病人尿糖偏高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
B.葡萄糖属于碳水化合物,分子可表示为 C6(H2O)6,则每个葡萄糖分子中含6个H2O
C.葡萄糖可用于制镜工业
D.淀粉水解的最终产物是葡萄糖
(2)含糖类丰富的农产品通过发酵法可以制取乙醇,但随着石油化工的发展,工业上主要是以乙烯为原料,在加热、加压和有催化剂存在的条件下跟水反应生成乙醇,这种方法叫做乙烯水化法。试写出该反应的化学方程式:__________________。
(3)烯烃加到溴水中能使溴水褪色,现将丙烯和溴水褪色后的有机物与氢氧化钠的醇溶液混合加热,又能得到一种烃类物质,该反应的化学方程式为:_______________________。
(4)卤代烃的一些数据如下表,分析表中数据可以得出的结论是(写出2条即可)_____________________________________________________________________。
烷 基 氟化物 氯化物 溴化物 碘化物
沸点℃ 沸点℃ 沸点℃ 沸点℃
CH3— -78.4 -24.2 3.6 42.4
CH3—CH2— -37.7 12.3 38.40 72.3
CH3—CH2—CH2— 2.5 46.60 71.0 102.4
(CH3)2—CH— -9.4 35.7 59.48 89.14
CH3—CH2—CH2—CH2— 32.5 78.44 101.6 130.5
(CH3)2—CH CH2— 16.0 68.7 91.7 120.4
(CH3)3C— 12.1 52 73.25 120.8
15.有下列几种物质:
①CH3COOH ②CH3C≡CCH3 ③ ④CH3OH ⑤ ⑥
(1)写出所含官能团的名称:①_______、②_______、③_______。
(2)写出①与④反应的化学方程式_______。
(3)写出③转化成2-丙醇的化学方程式:_______。
(4)向⑤的稀溶液中加入饱和溴水的反应的化学方程式是_______。
(5)⑥与银氨溶液反应的化学方程式为_______。
16.醛基
(1)醇的氧化反应
2CH3CH2OH+O2____。
(2)炔烃的加成反应
CH≡CH+H2O____。
三、实验题
17. Ⅰ.在实验室利用下列装置,可制备某些气体并验证其化学性质。
(1)完成下列表格:
序号 气体 装置连接顺序(填字母) 制备反应的化学方程式
① 乙烯 B→D→E _______
② 乙炔 _______ _______
(2)D装置中氢氧化钠溶液的作用_______。
Ⅱ.工业上用乙烯和氯气为原料,经下列各步合成聚氯乙烯(PVC):
乙烯甲乙PVC
(3)甲的结构简式是_______;反应(3)的化学方程式是_______。
18.某化学实验小组通过实验探究溴乙烷在不同溶剂中与NaOH反应的情况。
(1)若用如图所示装置进行实验,该实验的目的是_______,实验现象是_______,a试管的作用是_______。
(2)可以替代酸性高锰酸钾溶液的试剂是_______,此时如果去掉盛水的试管,对实验结果_______(填“有”或“无”)影响。
(3)在另一试管中取少量溴乙烷与NaOH溶液混合,充分反应后,向混合液中滴加AgNO3溶液,结果产生沉淀。化学实验小组的同学由此得出结论:溴乙烷与NaOH溶液发生取代反应,生成了溴化钠。该实验方案的错误之处是_______,原因是_______。
(4)用波谱的方法能方便地检验出溴乙烷发生取代反应的产物,使用波谱的名称是_______,波谱仪记录的结果是_______。
四、计算题
19.由A、B两种气态烃组成的混合气体,对H2的相对密度为17。常温常压下,取这种混合气体10mL与80mL氧气(过量)混合,当完全燃烧后恢复到原状态时,测得气体的体积为70mL。试求:
(1)混合气体的平均组成为___________________;
(2)若上述两种气体按体积1∶1混合时,则两种气态烃的可能组成为__________________。
20.现有0.2 mol有机物与0.9 mol氧气在一密闭容器中恰好完全反应,得产物为CO2、H2O。将产物依次通过浓硫酸和碱石灰,浓硫酸的质量增加14.4 g,碱石灰的质量增加了26.4 g。试求:
(1)计算确定有机物的分子式_________________。
(2)1 mol该有机物与足量的钠反应,可得到0.5 mol H2,写出该有机物可能的结构简式_________________________。
21.燃烧法是测定有机物分子式的一种重要方法。某烃蒸气密度是相同条件下氢气的29倍,完全燃烧5.8g此烃后,测得生成的二氧化碳为8.96 L(标准状况),生成的水为9.0g。请通过计算:
(1)推导该烃的分子式_____。
(2)写出它可能存在的全部结构简式_____。
22.物质F是一种芳香酯,常用作调香剂,其合成路线如下图所示:
已知E中含有两个甲基,请回答下列问题:
(1)物质A的名称是_______。
(2)各取1 mol物质D分别与足量Na、NaOH溶液、NaHCO3溶液反应,消耗的Na、NaOH、NaHCO3的物质的量之比为_______。
(3)物质A到F中除D以外含有手性碳原子的物质是_______(填标号)。
(4)B→C的反应方程式是_______。
(5)E的同分异构体中与其含有相同种类官能团的有_______种(不含E本身)。
23.理解和应用信息在有机合成中具有重要作用,请依据下列信息回答问题:
R-C≡C-H+(R、R′、R″为烃基或氢原子)
(1)该反应类型为_______。
(2)下列物质能发生上述反应的是_______。
A.CH3C≡CCH3与CH3CHO B.CH3C≡CH与CH3CHO C.CH3C≡CH与
(3)工业上制备有机化工原料A,并进一步制备下游产品1,3-丁二烯和四氢呋喃,如图所示:
①A的结构简式为_______。
②写出由B制取1,3-丁二烯的化学方程式_______。
③已知四氢呋喃是一种五元环,则四氢呋喃的结构简式为_______。
24.0.1 mol某烃在足量的氧气中完全燃烧,生成的CO2和水各0.6 mol。
(1)则该烃的分子式为 _________ 。若该烃不能使溴水或高锰酸钾溶液褪色,但在一定条件下,可以和溴蒸汽发生取代反应,其一溴取代物只有一种,则此烃属于_______ 烃,结构简式为 ____________,名称是____________。
(2)若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2,2—二甲基丁烷,则此烃属于______烃,结构简式为__________,名称是___________。
参考答案:
1.D 2.A 3.D 4.A 5.A 6.A 7.C 8.A 9.C 10.D 11.C 12.D 13.C
14.(1)B;
(2)CH2=CH2+H2OCH3CH2OH;
(3)+ 2NaOH+ 2NaBr +2 H2O;
(4)①卤代烷的沸点随碳原子数增加而升高②同一烷基的卤代物中,碘代烷的沸点最高,其次为溴代烷,最低的是氯代烷③同一卤代烷的同分异构体中,支链越多沸点越低,直连的沸点最高。
15.(1) 羧基 碳碳三键 碳溴键
(2)CH3COOH+CH3OHCH3COOCH3+H2O
(3)+NaOH+NaBr
(4)+3Br2→↓+3HBr
(5)+2Ag(NH3)2OH+2Ag↓+3NH3+H2O
16.(1)2CH3CHO+2H2O
(2)CH3—CHO
17.(1) CH3CH2OHCH2=CH2↑+H2O A→C→E CaC2+2H2O→CH≡CH↑+Ca(OH)2
(2)除去二氧化碳和二氧化硫
(3) CH2ClCH2Cl nCH2=CHCl
18.(1) 检验加热条件下溴乙烷在NaOH醇溶液中发生消去反应的产物是否为乙烯 酸性高锰酸钾溶液褪色 吸收挥发出的少量乙醇
(2) 溴的四氯化碳溶液 无
(3) 滴加AgNO3溶液前没有用稀硝酸中和过量的氢氧化钠溶液 氢氧化钠溶液会和AgNO3溶液反应生成沉淀
(4) 核磁共振氢谱 有三组峰且峰面积之比为3∶2∶1
19.(1)C2.5H4
(2)C2H4和C3H4或CH4和C4H4或C2H2和C3H6
20. C3H8O CH3CH2CH2OH CH3CH(OH)CH3
21.(1)C4H10
(2)CH3CH2CH2CH3,CH3CH(CH3)CH3
22. 2-甲基-1-丁烯 2:1:1 BC 7
23. 加成反应 BC HOCH2C≡CCH2OH HOCH2C H2CH2CH2OHCH2=CH-CH=CH2 +2H2O
24. C6H12 环烷 环己烷 烯 (CH3)3C-CH=CH2 3,3-二甲基-1-丁烯
一、单选题(共13题)
1.下列反应过程中有π键形成的是
A.乙酸与乙醇发生的酯化反应 B.乙烯使溴的四氯化碳溶液褪色
C.乙醛还原生成乙醇 D.溴乙烷与氢氧化钠醇溶液混合加热
2.由C、H、O三种元素组成的某化合物X的球棍模型如图所示。下列说法不正确的是
A.属于羧酸 B.分子式为
C.能发生加成反应和取代反应 D.可与溶液发生反应
3.青霉素是常用抗生素,不同品种的青霉素结构不同,其中一种的结构可以表示为:。下列关于这种青霉素分子的说法正确的是
A.分子式为C16H20N2O4S
B.青霉素分子属于芳香烃
C.1mol该分子与足量的金属钠最多能够生成1mol H2
D.这种青霉素分子显酸性
4.某物质的分子式为CxHyOz,取该物质ag在足量的O2中充分燃烧后,将产物全部通入过量的Na2O2中,若Na2O2固体的质量增加了bg,且a
5.根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 实验结论
向苯酚浊液中加入溶液,溶液变澄清 酸性:苯酚
无水乙醇与浓硫酸共热至,将产生的气体通入溴水中,溴水褪色 乙烯和溴水发生加成反应
氯乙烷与溶液共热后,滴加溶液,生成白色沉淀 氯乙烷已发生水解
在的溶液中先滴入几滴 溶液有白色沉淀生成,再滴入 溶液,又出现黑色沉淀
A. B. C. D.
6.有机物A是一种常用的内服止痛解热药。1molA水解得到1molB和1mol醋酸,A溶液具有酸性,不能使FeCl3溶液显色。A的相对分子质量不超过200。B分子中碳元素和氢元素的质量分数和为0.652。A、B都是有碳、氢、氧三种元素组成的芳香族化合物。则下列推断中,正确的是
A.A、B的相对分子质量之差为42
B.1个B分子中应当有2个氧原子
C.A的分子式是C7H6O3
D.B能与NaOH溶液、FeCl3溶液等物质反应,但不与溴水反应
7.环戊二烯(a)与丙烯醛(b)通过Diels-Alder反应制得双环[2,2,1]-5-庚烯-2-醛(c),反应如图所示。
下列说法正确的是( )
A.a分子所有原子均可共平面
B.a分子通过缩合聚合反应合成有机高分子
C.b分子中的共价键个数N(σ键)∶N(π键)=7:2
D.酸性高锰酸钾溶液能将c分子氧化成
8.依据下列实验的操作及现象,推测出的相应结论中正确的是
选项 实验操作 现象 结论
A 向溶液中通入 溶液变浑浊 酸性:
B 1-溴丙烷与NaOH的乙醇溶液共热,有气体逸出 该气体可使酸性高锰酸钾溶液褪色 1-溴丙烷在该条件下发生消去反应生成丙烯
C 向3mL1mol·L-1的NaOH溶液中滴加5滴1mol·L-1的MgCl2溶液,再滴加5滴1mol·L-1的FeCl3溶液 先产生白色沉淀,后转化为红褐色沉淀 溶度积常数:Mg(OH)2>Fe(OH)3
D 在酸性溶液中滴加溶液 溶液变黄色 氧化性:
A.A B.B C.C D.D
9.环氧树脂广泛应用于涂料和胶黏剂等领域,以下是一种新型环氧树脂前体(丁)的合成路线,下列有关说法正确的是
A.乙按系统命名法的名称为1-氯丙烯
B.丙的结构简式一定为HOCH2CHClCH2Cl
C.甲和乙均能使溴水或酸性KMnO4溶液褪色
D.丁的一溴代物的同分异构体有2种(不考虑立体异构)
10.异山梨醇和碳酸二甲酯合成碳酸酯其中的一步反应路线如图:
下列说法正确的是。
A.该反应的类型为加成反应 B.Y中的官能团有醚键和羧基
C.X在水中的溶解度小于Y D.该反应的副产物为甲醇
11.化合物X可用于合成Y.下列有关X、Y的说法正确的是
A.X分子中所有碳原子可能在同一平面上
B.X的分子式为
C.X、Y苯环上的一溴代物种类相同
D.X、Y与氢气发生加成最多可消耗的体积相同
12.120℃时,取1L由烷烃A和单烯烃B(B分子中所含碳原子数大于A分子中所含碳原子数)组成的混合气体与9L氧气混合,充分燃烧后,当恢复到120℃和燃烧前的压强时,测得生成了,且气体的总体积增大了6.25%,该混合气体可能是
A.和 B.和
C.和 D.和
13.海洋天然产物NafuredinB在医药行业有潜在应用,其结构简式如图所示,下列有关该物质的叙述错误的是
A.既能使溴水褪色,又能使酸性高锰酸钾溶液褪色
B.存在能与NaHCO3溶液反应的同分异构体
C.该有机物分子中所有碳原子可能共平面
D.与氢气加成时,1 mol该分子最多消耗5 mol H2
二、非选择题(共10题)
14.糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志。长期摄入高热量食品和缺少运动都易导致糖尿病。
(1)血糖是指血液中的葡萄糖 ( C6H12O6)。下列说法不正确的是_______(填序号);
A.糖尿病人尿糖偏高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
B.葡萄糖属于碳水化合物,分子可表示为 C6(H2O)6,则每个葡萄糖分子中含6个H2O
C.葡萄糖可用于制镜工业
D.淀粉水解的最终产物是葡萄糖
(2)含糖类丰富的农产品通过发酵法可以制取乙醇,但随着石油化工的发展,工业上主要是以乙烯为原料,在加热、加压和有催化剂存在的条件下跟水反应生成乙醇,这种方法叫做乙烯水化法。试写出该反应的化学方程式:__________________。
(3)烯烃加到溴水中能使溴水褪色,现将丙烯和溴水褪色后的有机物与氢氧化钠的醇溶液混合加热,又能得到一种烃类物质,该反应的化学方程式为:_______________________。
(4)卤代烃的一些数据如下表,分析表中数据可以得出的结论是(写出2条即可)_____________________________________________________________________。
烷 基 氟化物 氯化物 溴化物 碘化物
沸点℃ 沸点℃ 沸点℃ 沸点℃
CH3— -78.4 -24.2 3.6 42.4
CH3—CH2— -37.7 12.3 38.40 72.3
CH3—CH2—CH2— 2.5 46.60 71.0 102.4
(CH3)2—CH— -9.4 35.7 59.48 89.14
CH3—CH2—CH2—CH2— 32.5 78.44 101.6 130.5
(CH3)2—CH CH2— 16.0 68.7 91.7 120.4
(CH3)3C— 12.1 52 73.25 120.8
15.有下列几种物质:
①CH3COOH ②CH3C≡CCH3 ③ ④CH3OH ⑤ ⑥
(1)写出所含官能团的名称:①_______、②_______、③_______。
(2)写出①与④反应的化学方程式_______。
(3)写出③转化成2-丙醇的化学方程式:_______。
(4)向⑤的稀溶液中加入饱和溴水的反应的化学方程式是_______。
(5)⑥与银氨溶液反应的化学方程式为_______。
16.醛基
(1)醇的氧化反应
2CH3CH2OH+O2____。
(2)炔烃的加成反应
CH≡CH+H2O____。
三、实验题
17. Ⅰ.在实验室利用下列装置,可制备某些气体并验证其化学性质。
(1)完成下列表格:
序号 气体 装置连接顺序(填字母) 制备反应的化学方程式
① 乙烯 B→D→E _______
② 乙炔 _______ _______
(2)D装置中氢氧化钠溶液的作用_______。
Ⅱ.工业上用乙烯和氯气为原料,经下列各步合成聚氯乙烯(PVC):
乙烯甲乙PVC
(3)甲的结构简式是_______;反应(3)的化学方程式是_______。
18.某化学实验小组通过实验探究溴乙烷在不同溶剂中与NaOH反应的情况。
(1)若用如图所示装置进行实验,该实验的目的是_______,实验现象是_______,a试管的作用是_______。
(2)可以替代酸性高锰酸钾溶液的试剂是_______,此时如果去掉盛水的试管,对实验结果_______(填“有”或“无”)影响。
(3)在另一试管中取少量溴乙烷与NaOH溶液混合,充分反应后,向混合液中滴加AgNO3溶液,结果产生沉淀。化学实验小组的同学由此得出结论:溴乙烷与NaOH溶液发生取代反应,生成了溴化钠。该实验方案的错误之处是_______,原因是_______。
(4)用波谱的方法能方便地检验出溴乙烷发生取代反应的产物,使用波谱的名称是_______,波谱仪记录的结果是_______。
四、计算题
19.由A、B两种气态烃组成的混合气体,对H2的相对密度为17。常温常压下,取这种混合气体10mL与80mL氧气(过量)混合,当完全燃烧后恢复到原状态时,测得气体的体积为70mL。试求:
(1)混合气体的平均组成为___________________;
(2)若上述两种气体按体积1∶1混合时,则两种气态烃的可能组成为__________________。
20.现有0.2 mol有机物与0.9 mol氧气在一密闭容器中恰好完全反应,得产物为CO2、H2O。将产物依次通过浓硫酸和碱石灰,浓硫酸的质量增加14.4 g,碱石灰的质量增加了26.4 g。试求:
(1)计算确定有机物的分子式_________________。
(2)1 mol该有机物与足量的钠反应,可得到0.5 mol H2,写出该有机物可能的结构简式_________________________。
21.燃烧法是测定有机物分子式的一种重要方法。某烃蒸气密度是相同条件下氢气的29倍,完全燃烧5.8g此烃后,测得生成的二氧化碳为8.96 L(标准状况),生成的水为9.0g。请通过计算:
(1)推导该烃的分子式_____。
(2)写出它可能存在的全部结构简式_____。
22.物质F是一种芳香酯,常用作调香剂,其合成路线如下图所示:
已知E中含有两个甲基,请回答下列问题:
(1)物质A的名称是_______。
(2)各取1 mol物质D分别与足量Na、NaOH溶液、NaHCO3溶液反应,消耗的Na、NaOH、NaHCO3的物质的量之比为_______。
(3)物质A到F中除D以外含有手性碳原子的物质是_______(填标号)。
(4)B→C的反应方程式是_______。
(5)E的同分异构体中与其含有相同种类官能团的有_______种(不含E本身)。
23.理解和应用信息在有机合成中具有重要作用,请依据下列信息回答问题:
R-C≡C-H+(R、R′、R″为烃基或氢原子)
(1)该反应类型为_______。
(2)下列物质能发生上述反应的是_______。
A.CH3C≡CCH3与CH3CHO B.CH3C≡CH与CH3CHO C.CH3C≡CH与
(3)工业上制备有机化工原料A,并进一步制备下游产品1,3-丁二烯和四氢呋喃,如图所示:
①A的结构简式为_______。
②写出由B制取1,3-丁二烯的化学方程式_______。
③已知四氢呋喃是一种五元环,则四氢呋喃的结构简式为_______。
24.0.1 mol某烃在足量的氧气中完全燃烧,生成的CO2和水各0.6 mol。
(1)则该烃的分子式为 _________ 。若该烃不能使溴水或高锰酸钾溶液褪色,但在一定条件下,可以和溴蒸汽发生取代反应,其一溴取代物只有一种,则此烃属于_______ 烃,结构简式为 ____________,名称是____________。
(2)若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2,2—二甲基丁烷,则此烃属于______烃,结构简式为__________,名称是___________。
参考答案:
1.D 2.A 3.D 4.A 5.A 6.A 7.C 8.A 9.C 10.D 11.C 12.D 13.C
14.(1)B;
(2)CH2=CH2+H2OCH3CH2OH;
(3)+ 2NaOH+ 2NaBr +2 H2O;
(4)①卤代烷的沸点随碳原子数增加而升高②同一烷基的卤代物中,碘代烷的沸点最高,其次为溴代烷,最低的是氯代烷③同一卤代烷的同分异构体中,支链越多沸点越低,直连的沸点最高。
15.(1) 羧基 碳碳三键 碳溴键
(2)CH3COOH+CH3OHCH3COOCH3+H2O
(3)+NaOH+NaBr
(4)+3Br2→↓+3HBr
(5)+2Ag(NH3)2OH+2Ag↓+3NH3+H2O
16.(1)2CH3CHO+2H2O
(2)CH3—CHO
17.(1) CH3CH2OHCH2=CH2↑+H2O A→C→E CaC2+2H2O→CH≡CH↑+Ca(OH)2
(2)除去二氧化碳和二氧化硫
(3) CH2ClCH2Cl nCH2=CHCl
18.(1) 检验加热条件下溴乙烷在NaOH醇溶液中发生消去反应的产物是否为乙烯 酸性高锰酸钾溶液褪色 吸收挥发出的少量乙醇
(2) 溴的四氯化碳溶液 无
(3) 滴加AgNO3溶液前没有用稀硝酸中和过量的氢氧化钠溶液 氢氧化钠溶液会和AgNO3溶液反应生成沉淀
(4) 核磁共振氢谱 有三组峰且峰面积之比为3∶2∶1
19.(1)C2.5H4
(2)C2H4和C3H4或CH4和C4H4或C2H2和C3H6
20. C3H8O CH3CH2CH2OH CH3CH(OH)CH3
21.(1)C4H10
(2)CH3CH2CH2CH3,CH3CH(CH3)CH3
22. 2-甲基-1-丁烯 2:1:1 BC 7
23. 加成反应 BC HOCH2C≡CCH2OH HOCH2C H2CH2CH2OHCH2=CH-CH=CH2 +2H2O
24. C6H12 环烷 环己烷 烯 (CH3)3C-CH=CH2 3,3-二甲基-1-丁烯
