第1章 原子结构 元素周期律 检测题(含答案) 2022-2023学年高一下学期化学鲁科版(2019)必修第二册
文档属性
| 名称 | 第1章 原子结构 元素周期律 检测题(含答案) 2022-2023学年高一下学期化学鲁科版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 322.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-23 11:53:40 | ||
图片预览




文档简介
第1章《原子结构 元素周期律》检测题
一、单选题(共13题)
1.研究表明,可以衰变为,则可用来比较这两种元素金属性强弱的方法是
A.比较这两种元素的单质的熔点
B.向氯化铝和氯化镁的溶液中分别滴加过量的氨水
C.将打磨过的镁带和铝片分别与试管中的热水作用,并滴入酚酞溶液
D.将打磨过的铝片和镁带分别投入氢氧化钠溶液中,Al能与溶液反应放出氢气,而Mg不能
2.短周期元素X、Y、Z中,其中X、Y位于同一主族,Y、Z位于同一周期。X是地壳中含量最高的元素,Z原子的核外电子数比Y原子少1个,下列比较正确的是
A.原子半径: B.元素非金属性:
C.气态氢化物的稳定性: D.最高价氧化物水化物的酸性:
3.设为阿伏加德罗常数的值。下列说法正确的是
A.7.8g 中的离子总数为0.4
B.1mol 晶体中含有的共价键为2
C.1mol (甲基碳正离子)所含质子总数为8
D.0.6g 与的混合物中所含质子数为0.3
4.下列各组中,互为同位素的是
A.金刚石、石墨 B.O、O C.H2O、D2O D.白磷、红磷
5.利用自然资源制备相关化学物质,下列化学工艺不可行的是
A.提取食盐后母液含Br2的液体粗溴纯溴
B.石英砂粗硅粗四氯化硅高纯硅
C.FeS2SO2H2SO3H2SO4
D.铝土矿Na[Al(OH)4]溶液Al(OH)3Al2O3铝
6.原子通过得电子或失电子形成与Ar原子相同电子层结构的是( )
A.Li B.Na C.O D.Cl
7.下列实验操作与现象均正确的是
选项 实验操作 现象
A 将Cl2和H2混合并光照 气体安静燃烧,产生苍白色火焰
B 用碘化钾试纸检验Cl2 试纸变蓝
C 用酒精萃取碘水中的碘 溶液分层,上层是紫红色
D 向FeSO4溶液中滴入NaOH溶液 产生白色絮状沉淀,迅速变为灰绿色,最后变为红褐色
A.A B.B C.C D.D
8.短周期主族元素X、Y、Z、W的原子序数依次增大,且分别占三个不同的周期。Y原子的最外层电子数是其内层电子数的3倍,Y与W 同主族,Z的主族序数等于其周期数。下列说法正确的是
A.W的原子半径比Z的大
B.X、Y只能形成一种化合物
C.Y的简单气态氢化物的热稳定性比W的弱
D.Z、W的最高价氧化物对应的水化物能发生反应
9.Ne是最早发现的Ne元素的稳定同位素,汤姆逊(J.J.Thomson)和阿斯通(F.W.Aston)在1913年发现了Ne。下列有关说法正确的是( )
A.Ne和Ne是同分异构体 B.Ne和Ne属于不同的核素
C.Ne和Ne的性质完全相同 D.Ne转变为Ne为化学变化
10.青石棉(cricidolite)是世界卫生组织确认的一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,青石棉的化学式为:Na2Fe5Si8O22(OH)2,青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法中正确的是
A.青石棉是一种易燃品,且易溶于水
B.青石棉的化学组成用氧化物的形式可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O
C.1mol Na2Fe5Si8O22(OH)2与足量的硝酸作用,至少需消耗8.5 L 2 mol/L HNO3溶液
D.Na2Fe5Si8O22(OH)2不能和氢氟酸作用
11.已知:P4(s,白磷)=4P(s,红磷) △H=-29.2kJ mol-1,下列说法正确的是
A.1mol P4(s,白憐)的能量比4mol P(s,红鱗)的能量高29.2kJ
B.白磷与红磷间的转化是物理变化
C.红磷和白磷的结构相同
D.红磷可能比白磷易自燃
12.短周期主族元素X、Y、Z、W的原子序数依次增大,X的一种单质可以供给生物呼吸,Y原子的最外层有1个电子,Z是地壳中含量最多的金属元素,W与X位于同一主族。下列说法正确的是
A.原子半径:
B.由X、Y组成的化合物是共价化合物
C.W的简单气态氢化物的热稳定性比X的强
D.Z的最高价氧化物对应水化物的碱性比Y的强
13.2020年12月17日,嫦娥五号返回器携带月球土壤样品着陆地球,实现了中国首次月球无人采样返回,助力月球成因和演化历史等科学研究。2021年2月22日,嫦娥五号带回的月壤在人民大会堂首次公开亮相。据科学家预测,月球的土壤中吸附着数百万吨的3He,而在地球上元素则主要以4He的形式存在。下列说法正确的是
A.4He原子核内含有4个质子
B.3He与4He互为同位素
C.3He与4He的电子数不同
D.4He的最外层电子数为2,故4He易失去最外层电子
二、非选择题(共10题)
14.在生产生活中,我们会遇到各种各样的化学反应。请按要求回答下列问题:
(1)焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、N2、Fe2O3、Fe、FeCl3和X。
①根据题意,可判断出X是_____________(写化学式)
②写出并配平该反应的化学方程式,并用双线桥标出电子转移的方向和数目:______。
(2)铝元素是自然界中含量最多的的金属元素,应用广泛。金属铝既能与酸反应又能与强碱反应,请写出铝与强碱反应的离子方程式____________________________________。
(3)Na2O2可用作呼吸面具的供氧剂,发生反应的化学方程式为____________________。
(4)“水玻璃”长期暴露在空气中会变质,这是因为“水玻璃”与空气中少量二氧化碳接触,生成了乳白色的凝胶状沉淀的缘故。写出反应的离子方程式_________________________________。
(5)小苏打可作胃药,请写出其中和胃酸时的离子方程式______________________。
(6)在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,被氧化的元素是____________,当有5mol水反应时,由H2O还原的BrF3为______________mol。
15.在原子序数1—18号元素中,按要求用合适的化学用语填空
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属单质是_____________。
(3)原子半径最小的元素是_____________。
(4)气态氢化物最稳定的化学式是_____________。
(5)最高价氧化物对应水化物的酸性最强的化学式是_____________。
(6)电子数为10的分子(写5个)________
三、实验题
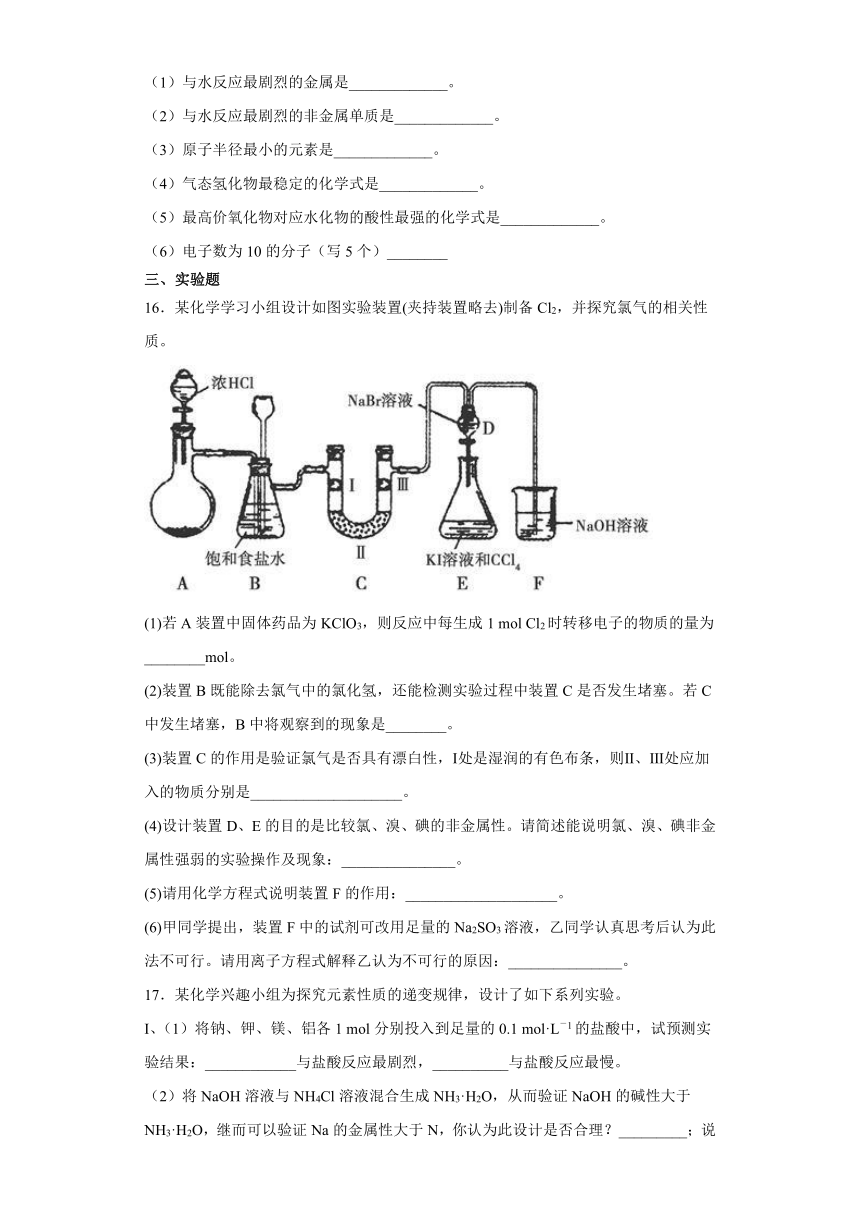
16.某化学学习小组设计如图实验装置(夹持装置略去)制备Cl2,并探究氯气的相关性质。
(1)若A装置中固体药品为KClO3,则反应中每生成1 mol Cl2时转移电子的物质的量为________mol。
(2)装置B既能除去氯气中的氯化氢,还能检测实验过程中装置C是否发生堵塞。若C中发生堵塞,B中将观察到的现象是________。
(3)装置C的作用是验证氯气是否具有漂白性,Ⅰ处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是____________________。
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。请简述能说明氯、溴、碘非金属性强弱的实验操作及现象:_______________。
(5)请用化学方程式说明装置F的作用:____________________。
(6)甲同学提出,装置F中的试剂可改用足量的Na2SO3溶液,乙同学认真思考后认为此法不可行。请用离子方程式解释乙认为不可行的原因:_______________。
17.某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ、(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:____________与盐酸反应最剧烈,__________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?_________;说明理由:___________。
Ⅱ、利用下图装置可以验证非金属性的变化规律。
(3)仪器A的名称为________,干燥管D的作用是_____________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请在其中选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、_______、______,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为____________________________。
(5)已知C中是硅酸钠溶液,如要证明非金属性:C > Si,请选择相应的试剂,则A中加________、B中加________。
18.如图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质的实验装置。其中D瓶中放有干燥的红色布条;E中为铜网,E右端出气管口附近为棉球。试回答:
(1)A中发生反应的化学方程式为______。
(2)为得到干燥纯净的氯气,一般在B瓶中加入_____,其作用是_____。
(3)C中盛放的试剂为_______。
(4)E中所发生反应的化学方程式为_________。
(5)F中应加入的试剂为______,其作用是_____。
(6)若A中有14.6g HCl被氧化,将产生的氯气通入足量的KI溶液中能产生单质碘的质量为____g。
四、计算题
19.化学学科中由于物质种类和反应的多样性,通过类别思想和价态规律来分析物质的性质成为重要的学习思路,同时需要将定性和学科知识进行定量的计算。结合所学完成下面问题。
(1)与标准状况下5.6L所含氧原子数目相同的水的质量是_______。
(2)12.4g含0.4mol,则的摩尔质量为_______。
(3)某密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左侧A中充入1mol,右侧B中充入CO和的混合气体共8g时,隔板处于如图位置(左、右两侧温度,相同),右侧B中CO与分子数之比为_______。
(4),每生成8g氧气,反应中转移电子的物质的量为_______。
(5)某元素的核素,1.11g该核素的氯化物配成的溶液需用20 mL 1 的溶液才能把完全沉淀下来,已知此核素中质子数与中子数相等,则:
①的质量数A是_______。
②37g 中所含质子数的物质的量为_______。
(6)密闭容器中装有1mol 和0.6mol ,充分加热待完全反应后,容器内残留固体的成分为_______。
20.回答下列问题:
(1)自然界中的铀元素主要以三种同位素的形式存在,三种同位素的原子百分含量分别为:为0.005%,为0.72%,为99.275%。请计算铀元素的相对原子质量(结果保留至小数点后第二位)_______。
(2)与CO的混合气体中,的质量百分含量为75%,混合气体的平均摩尔质量为_______。
21.有X、Y、Z、T四种短周期元素。X、Y、Z三元素在周期表中的位置如图所示,三元素的原子序数之和是41。X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)常见的两种化合物。
X
Y Z
(1)各元素的符号是X______,Y________,Z________、T___________。
(2)Y原子的结构示意图为______________________________________________。
(3)用电子式表示Y与T组成的化合物的形成过程:_____________________。
(4)X和Y的氢化物的稳定性_________(用化学式表示)。
22.a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2∶3,b的最外层电子数比e的最外层电子数少1;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1)e的元素符号是____。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示)____;b的氢化物和b的最高价氧化物对应的水化物反应生成Z,则Z的化学式为____;d、e形成化合物的电子式为____。
(3)一定量的d2c2与ac2反应后的固体物质,恰好与0.8mol稀盐酸完全反应,并收集到0.25mol气体,则用物质的量表示该固体物质的组成为____。
23.下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
A R
B C D E F T
G H I J K L
M N O
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X高温下反应的化学方程式______。
(2)D的简单气态氢化物的VSEPR模型的名称为______。
(3)由A、C、D形成的ACD分子中,σ键和π键个数=______。
(4)元素M的化合物(ME2L2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是______(填“极性”或“非极性”)分子。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为______。
(5)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是______(填m、n、x或y)。
参考答案:
1.C 2.C 3.D 4.B 5.C 6.D 7.D 8.D 9.B 10.B 11.A 12.A 13.B
14.(1) H2O
(2)2Al+2OH-+2H2O=2+3H2↑
(3)2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑
(4)
(5)
(6) O、Br
15. Na F2 H HF HClO4 CH4、NH3、H2O、HF、Ne
16.(1)
(2)B中长颈漏斗中液面上升,形成液柱
(3)无水氯化钙(硅胶、P2O5)、干燥的有色布条
(4)打开A中分液漏斗活塞,一段时间后,D中的无色溶液变为橙色(橙红色或黄色),说明氯的非金属性大于溴;打开D中活塞,将D中少量溶液放入装置E中,振荡,下层为紫红色,说明溴的非金属性大于碘
(5)Cl2+2NaOH=NaCl+NaClO+H2O
(6)+Cl2+H2O=+2Cl-+2H+、+2H+=SO2↑+H2O
17. 钾 铝 不合理 用碱性强弱比较金属性强弱时,一定要用元素最高价氧化物对应水化物的碱性强弱比较,NH3·H2O不是N元素最高价氧化物对应的水化物 分液漏斗 防止倒吸 浓盐酸 KMnO4 Na2S S2-+Cl2= S↓+2Cl- 硫酸 Na2CO3 溶液
18. 饱和食盐水 吸收HCl气体 浓H2SO4 碱液 吸收多余的氯气 50.8
19.(1)9g
(2)62g/mol
(3)3∶1
(4)2.5mol
(5) 40 18mol
(6) NaOH
20.(1)237.98
(2)38.5
21. O S Cl Na H2O>H2S
22.(1)S
(2) CH4<NH3<H2O NH4NO3
(3)0.3molNa2O2、0.1molNa2CO3
23. 8Al+3Fe3O44Al2O3+9Fe 四面体 1:1 非极性 m
一、单选题(共13题)
1.研究表明,可以衰变为,则可用来比较这两种元素金属性强弱的方法是
A.比较这两种元素的单质的熔点
B.向氯化铝和氯化镁的溶液中分别滴加过量的氨水
C.将打磨过的镁带和铝片分别与试管中的热水作用,并滴入酚酞溶液
D.将打磨过的铝片和镁带分别投入氢氧化钠溶液中,Al能与溶液反应放出氢气,而Mg不能
2.短周期元素X、Y、Z中,其中X、Y位于同一主族,Y、Z位于同一周期。X是地壳中含量最高的元素,Z原子的核外电子数比Y原子少1个,下列比较正确的是
A.原子半径: B.元素非金属性:
C.气态氢化物的稳定性: D.最高价氧化物水化物的酸性:
3.设为阿伏加德罗常数的值。下列说法正确的是
A.7.8g 中的离子总数为0.4
B.1mol 晶体中含有的共价键为2
C.1mol (甲基碳正离子)所含质子总数为8
D.0.6g 与的混合物中所含质子数为0.3
4.下列各组中,互为同位素的是
A.金刚石、石墨 B.O、O C.H2O、D2O D.白磷、红磷
5.利用自然资源制备相关化学物质,下列化学工艺不可行的是
A.提取食盐后母液含Br2的液体粗溴纯溴
B.石英砂粗硅粗四氯化硅高纯硅
C.FeS2SO2H2SO3H2SO4
D.铝土矿Na[Al(OH)4]溶液Al(OH)3Al2O3铝
6.原子通过得电子或失电子形成与Ar原子相同电子层结构的是( )
A.Li B.Na C.O D.Cl
7.下列实验操作与现象均正确的是
选项 实验操作 现象
A 将Cl2和H2混合并光照 气体安静燃烧,产生苍白色火焰
B 用碘化钾试纸检验Cl2 试纸变蓝
C 用酒精萃取碘水中的碘 溶液分层,上层是紫红色
D 向FeSO4溶液中滴入NaOH溶液 产生白色絮状沉淀,迅速变为灰绿色,最后变为红褐色
A.A B.B C.C D.D
8.短周期主族元素X、Y、Z、W的原子序数依次增大,且分别占三个不同的周期。Y原子的最外层电子数是其内层电子数的3倍,Y与W 同主族,Z的主族序数等于其周期数。下列说法正确的是
A.W的原子半径比Z的大
B.X、Y只能形成一种化合物
C.Y的简单气态氢化物的热稳定性比W的弱
D.Z、W的最高价氧化物对应的水化物能发生反应
9.Ne是最早发现的Ne元素的稳定同位素,汤姆逊(J.J.Thomson)和阿斯通(F.W.Aston)在1913年发现了Ne。下列有关说法正确的是( )
A.Ne和Ne是同分异构体 B.Ne和Ne属于不同的核素
C.Ne和Ne的性质完全相同 D.Ne转变为Ne为化学变化
10.青石棉(cricidolite)是世界卫生组织确认的一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,青石棉的化学式为:Na2Fe5Si8O22(OH)2,青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法中正确的是
A.青石棉是一种易燃品,且易溶于水
B.青石棉的化学组成用氧化物的形式可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O
C.1mol Na2Fe5Si8O22(OH)2与足量的硝酸作用,至少需消耗8.5 L 2 mol/L HNO3溶液
D.Na2Fe5Si8O22(OH)2不能和氢氟酸作用
11.已知:P4(s,白磷)=4P(s,红磷) △H=-29.2kJ mol-1,下列说法正确的是
A.1mol P4(s,白憐)的能量比4mol P(s,红鱗)的能量高29.2kJ
B.白磷与红磷间的转化是物理变化
C.红磷和白磷的结构相同
D.红磷可能比白磷易自燃
12.短周期主族元素X、Y、Z、W的原子序数依次增大,X的一种单质可以供给生物呼吸,Y原子的最外层有1个电子,Z是地壳中含量最多的金属元素,W与X位于同一主族。下列说法正确的是
A.原子半径:
B.由X、Y组成的化合物是共价化合物
C.W的简单气态氢化物的热稳定性比X的强
D.Z的最高价氧化物对应水化物的碱性比Y的强
13.2020年12月17日,嫦娥五号返回器携带月球土壤样品着陆地球,实现了中国首次月球无人采样返回,助力月球成因和演化历史等科学研究。2021年2月22日,嫦娥五号带回的月壤在人民大会堂首次公开亮相。据科学家预测,月球的土壤中吸附着数百万吨的3He,而在地球上元素则主要以4He的形式存在。下列说法正确的是
A.4He原子核内含有4个质子
B.3He与4He互为同位素
C.3He与4He的电子数不同
D.4He的最外层电子数为2,故4He易失去最外层电子
二、非选择题(共10题)
14.在生产生活中,我们会遇到各种各样的化学反应。请按要求回答下列问题:
(1)焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、N2、Fe2O3、Fe、FeCl3和X。
①根据题意,可判断出X是_____________(写化学式)
②写出并配平该反应的化学方程式,并用双线桥标出电子转移的方向和数目:______。
(2)铝元素是自然界中含量最多的的金属元素,应用广泛。金属铝既能与酸反应又能与强碱反应,请写出铝与强碱反应的离子方程式____________________________________。
(3)Na2O2可用作呼吸面具的供氧剂,发生反应的化学方程式为____________________。
(4)“水玻璃”长期暴露在空气中会变质,这是因为“水玻璃”与空气中少量二氧化碳接触,生成了乳白色的凝胶状沉淀的缘故。写出反应的离子方程式_________________________________。
(5)小苏打可作胃药,请写出其中和胃酸时的离子方程式______________________。
(6)在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,被氧化的元素是____________,当有5mol水反应时,由H2O还原的BrF3为______________mol。
15.在原子序数1—18号元素中,按要求用合适的化学用语填空
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属单质是_____________。
(3)原子半径最小的元素是_____________。
(4)气态氢化物最稳定的化学式是_____________。
(5)最高价氧化物对应水化物的酸性最强的化学式是_____________。
(6)电子数为10的分子(写5个)________
三、实验题
16.某化学学习小组设计如图实验装置(夹持装置略去)制备Cl2,并探究氯气的相关性质。
(1)若A装置中固体药品为KClO3,则反应中每生成1 mol Cl2时转移电子的物质的量为________mol。
(2)装置B既能除去氯气中的氯化氢,还能检测实验过程中装置C是否发生堵塞。若C中发生堵塞,B中将观察到的现象是________。
(3)装置C的作用是验证氯气是否具有漂白性,Ⅰ处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是____________________。
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。请简述能说明氯、溴、碘非金属性强弱的实验操作及现象:_______________。
(5)请用化学方程式说明装置F的作用:____________________。
(6)甲同学提出,装置F中的试剂可改用足量的Na2SO3溶液,乙同学认真思考后认为此法不可行。请用离子方程式解释乙认为不可行的原因:_______________。
17.某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ、(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:____________与盐酸反应最剧烈,__________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?_________;说明理由:___________。
Ⅱ、利用下图装置可以验证非金属性的变化规律。
(3)仪器A的名称为________,干燥管D的作用是_____________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请在其中选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、_______、______,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为____________________________。
(5)已知C中是硅酸钠溶液,如要证明非金属性:C > Si,请选择相应的试剂,则A中加________、B中加________。
18.如图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质的实验装置。其中D瓶中放有干燥的红色布条;E中为铜网,E右端出气管口附近为棉球。试回答:
(1)A中发生反应的化学方程式为______。
(2)为得到干燥纯净的氯气,一般在B瓶中加入_____,其作用是_____。
(3)C中盛放的试剂为_______。
(4)E中所发生反应的化学方程式为_________。
(5)F中应加入的试剂为______,其作用是_____。
(6)若A中有14.6g HCl被氧化,将产生的氯气通入足量的KI溶液中能产生单质碘的质量为____g。
四、计算题
19.化学学科中由于物质种类和反应的多样性,通过类别思想和价态规律来分析物质的性质成为重要的学习思路,同时需要将定性和学科知识进行定量的计算。结合所学完成下面问题。
(1)与标准状况下5.6L所含氧原子数目相同的水的质量是_______。
(2)12.4g含0.4mol,则的摩尔质量为_______。
(3)某密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左侧A中充入1mol,右侧B中充入CO和的混合气体共8g时,隔板处于如图位置(左、右两侧温度,相同),右侧B中CO与分子数之比为_______。
(4),每生成8g氧气,反应中转移电子的物质的量为_______。
(5)某元素的核素,1.11g该核素的氯化物配成的溶液需用20 mL 1 的溶液才能把完全沉淀下来,已知此核素中质子数与中子数相等,则:
①的质量数A是_______。
②37g 中所含质子数的物质的量为_______。
(6)密闭容器中装有1mol 和0.6mol ,充分加热待完全反应后,容器内残留固体的成分为_______。
20.回答下列问题:
(1)自然界中的铀元素主要以三种同位素的形式存在,三种同位素的原子百分含量分别为:为0.005%,为0.72%,为99.275%。请计算铀元素的相对原子质量(结果保留至小数点后第二位)_______。
(2)与CO的混合气体中,的质量百分含量为75%,混合气体的平均摩尔质量为_______。
21.有X、Y、Z、T四种短周期元素。X、Y、Z三元素在周期表中的位置如图所示,三元素的原子序数之和是41。X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)常见的两种化合物。
X
Y Z
(1)各元素的符号是X______,Y________,Z________、T___________。
(2)Y原子的结构示意图为______________________________________________。
(3)用电子式表示Y与T组成的化合物的形成过程:_____________________。
(4)X和Y的氢化物的稳定性_________(用化学式表示)。
22.a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2∶3,b的最外层电子数比e的最外层电子数少1;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1)e的元素符号是____。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示)____;b的氢化物和b的最高价氧化物对应的水化物反应生成Z,则Z的化学式为____;d、e形成化合物的电子式为____。
(3)一定量的d2c2与ac2反应后的固体物质,恰好与0.8mol稀盐酸完全反应,并收集到0.25mol气体,则用物质的量表示该固体物质的组成为____。
23.下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
A R
B C D E F T
G H I J K L
M N O
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X高温下反应的化学方程式______。
(2)D的简单气态氢化物的VSEPR模型的名称为______。
(3)由A、C、D形成的ACD分子中,σ键和π键个数=______。
(4)元素M的化合物(ME2L2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是______(填“极性”或“非极性”)分子。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为______。
(5)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是______(填m、n、x或y)。
参考答案:
1.C 2.C 3.D 4.B 5.C 6.D 7.D 8.D 9.B 10.B 11.A 12.A 13.B
14.(1) H2O
(2)2Al+2OH-+2H2O=2+3H2↑
(3)2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑
(4)
(5)
(6) O、Br
15. Na F2 H HF HClO4 CH4、NH3、H2O、HF、Ne
16.(1)
(2)B中长颈漏斗中液面上升,形成液柱
(3)无水氯化钙(硅胶、P2O5)、干燥的有色布条
(4)打开A中分液漏斗活塞,一段时间后,D中的无色溶液变为橙色(橙红色或黄色),说明氯的非金属性大于溴;打开D中活塞,将D中少量溶液放入装置E中,振荡,下层为紫红色,说明溴的非金属性大于碘
(5)Cl2+2NaOH=NaCl+NaClO+H2O
(6)+Cl2+H2O=+2Cl-+2H+、+2H+=SO2↑+H2O
17. 钾 铝 不合理 用碱性强弱比较金属性强弱时,一定要用元素最高价氧化物对应水化物的碱性强弱比较,NH3·H2O不是N元素最高价氧化物对应的水化物 分液漏斗 防止倒吸 浓盐酸 KMnO4 Na2S S2-+Cl2= S↓+2Cl- 硫酸 Na2CO3 溶液
18. 饱和食盐水 吸收HCl气体 浓H2SO4 碱液 吸收多余的氯气 50.8
19.(1)9g
(2)62g/mol
(3)3∶1
(4)2.5mol
(5) 40 18mol
(6) NaOH
20.(1)237.98
(2)38.5
21. O S Cl Na H2O>H2S
22.(1)S
(2) CH4<NH3<H2O NH4NO3
(3)0.3molNa2O2、0.1molNa2CO3
23. 8Al+3Fe3O44Al2O3+9Fe 四面体 1:1 非极性 m
