5.1 化学反应中的质量守恒 课件(共35张PPT)-初中化学鲁教版九年级上册
文档属性
| 名称 | 5.1 化学反应中的质量守恒 课件(共35张PPT)-初中化学鲁教版九年级上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-23 15:08:12 | ||
图片预览








文档简介
(共35张PPT)
第五单元 定量研究化学反应
第一节 化学反应中的质量守恒
初中化学
九年级上 鲁教版
目
录
CONTENTS
1
学习目标
新课导入
2
新课讲解
3
课堂小结
4
当堂小练
5
课后习题
6
学习目标
返回
1. 理解质量守恒定律以及守恒的原因。
2. 通过对化学反应实质的分析及质量守恒原因的分析,培养研究问题能力和逻辑推理能力。
3. 激发对现实生活中化学现象的好奇心和探究欲,激发学习化学的兴趣。
新课导入
我们已经知道,化学反应的结果是反应物转化为生成物。那么,在化学反应过程中,反应物和生成物的质量是如何变化的呢
返回
一、质量守恒定律
新课讲解
提出问题:参加反应的各物质质量总和与反应生成的各物质质量总和相比较,是否发生了变化?
新课讲解
猜想与假设:
1.发生了变化,反应生成的各物质的质量总和大于参加反应的各物质的质量总和。
2.发生了变化,反应生成的各物质的质量总和小于参加反应的各物质的质量总和。
3.发生了变化,反应生成的各物质的质量总和等于参加反应的各物质的质量总和。
...........
新课讲解
进行实验:
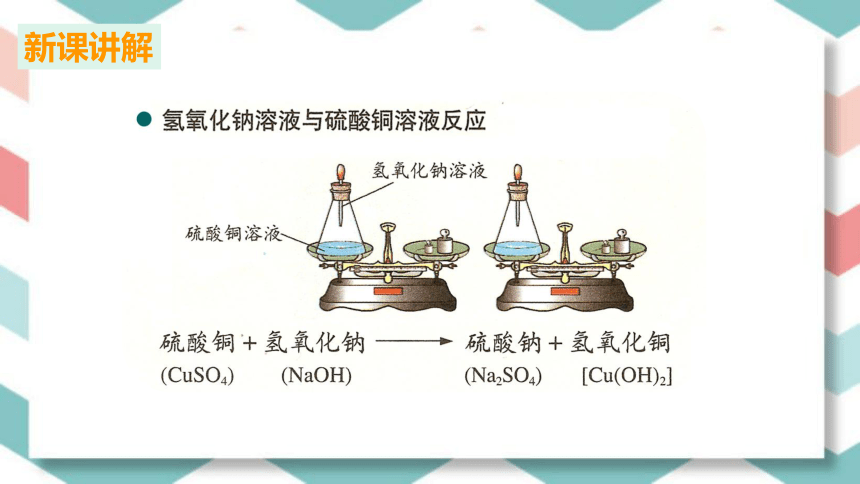
实验1:氢氧化钠溶液跟硫酸铜溶液反应前后质量的测定
⑴在锥形瓶中加入蓝色硫酸铜溶液,胶头滴管是氢氧化钠溶液。
⑵称量锥形瓶内物质的总质量为M1。
⑶挤压胶头滴管里的氢氧化钠溶液,使二者反应,观察现象。
⑷称量锥形瓶内物质的总质量,为M2。
新课讲解
新课讲解
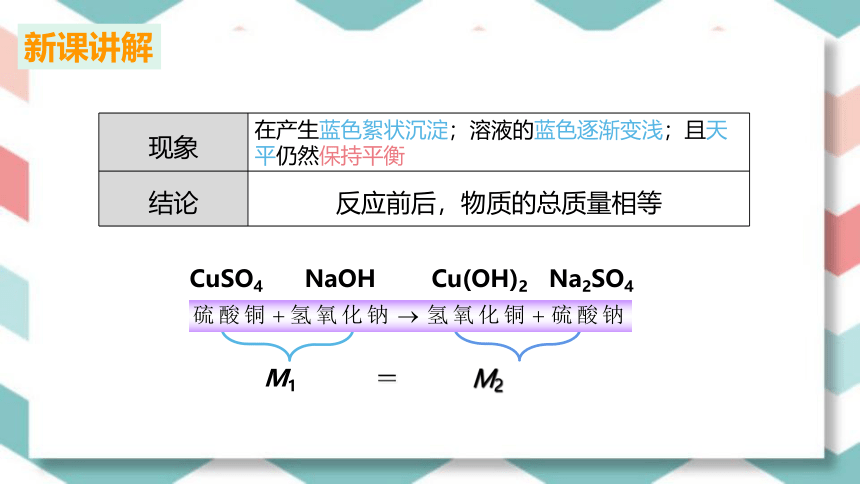
现象 在产生蓝色絮状沉淀;溶液的蓝色逐渐变浅;且天平仍然保持平衡
结论
反应前后,物质的总质量相等
M1 = M2
CuSO4 NaOH Cu(OH)2 Na2SO4
新课讲解
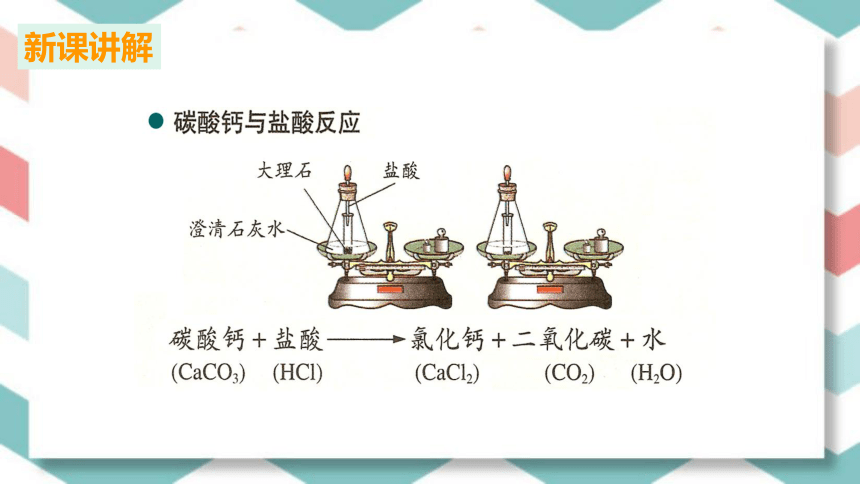
实验2:石灰石与稀盐酸反应
实验步骤:在锥形瓶中加入适量的石灰石,在试管里装入适量稀盐酸,将其放在在天平左盘里,然后颠倒使其混合反应,观察现象。
新课讲解
新课讲解
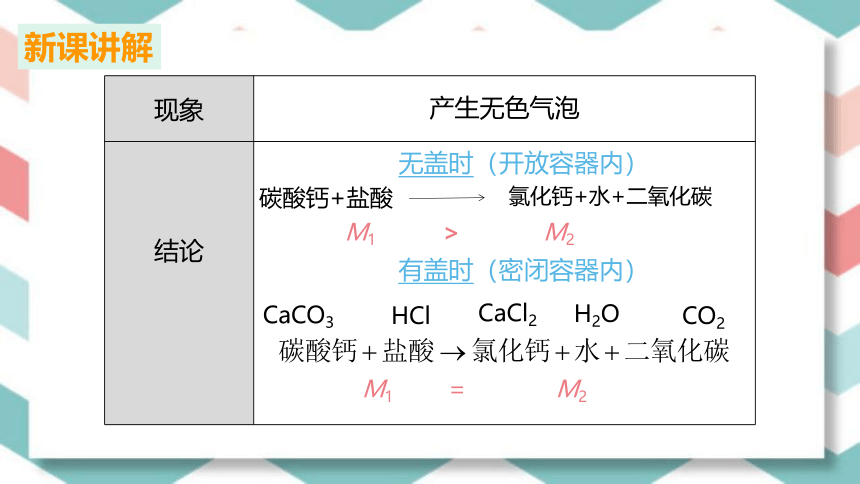
现象
产生无色气泡
结论
M1 > M2
氯化钙+水+二氧化碳
碳酸钙+盐酸
无盖时(开放容器内)
有盖时(密闭容器内)
CaCO3
CaCl2
HCl
CO2
H2O
M1 = M2
新课讲解
实验3:白磷燃烧前后质量的测定
实验步骤:
(1)在锥形瓶中先放一层细砂并放一小块白磷;
(2)称量锥形瓶内物质的总质量 (3)点燃白磷,观察产生的现象;
新课讲解
现象
白磷燃烧产生大量白烟,放出热量
结论 反应前后天平平衡,因此化学反应前后的各物质质量总和,等于反应后生成的各物质质量总和
磷 + 氧气 五氧化二磷
点燃
m1 = m2
新课讲解
参加化学反应的各物质M1=反应后生成的各物质M2
归 纳
通过上述实验,你有什么认识?
参加反应的各物质的质量总和
生成的各物质的质量总和
质量守恒定律注意要点
1.质量守恒定律的“守恒”指的是质量守恒,其他方面如体积等不一定守恒。
2.是指“参加反应的各物质”的质量总和,没有参加反应的物质不包括在内。例如“1 g氢气和9 g氧气反应生成10 g水”是错误的。不是任意数值的简单加和而是各反应物间按一定质量比反应的。
新课讲解
3.“反应生成的物质”仅指该反应过程中新生成的物质质量,在反应之前已经存在的质量不计算在内。如1 g氢气在盛有9 g氧气的水中(水的质量为2 g)反应生成12 g水。
4.质量守恒定律只适用于一切化学反应,不涉及物理变化。如“10 g冰加热后变成了10 g水蒸气”符合质量守恒定律也是错误的。
新课讲解
新课讲解
某同学定量研究化学反应,发现木炭燃烧后质量减小了;铁钉生锈后质量却增加了。这些现象与质量守恒定律有矛盾吗
思 考
结合水分子分解示意图,说说化学变化的实质是什么?
化学变化是分子分成原子,原子重新结合的过程
新课讲解
以金属镁与氧气反应为例,你能根据构成物质的微粒在化学反应中的变化对质量守恒定律作出解释吗?
+
2Mg + O2 2MgO
点燃
氧原子:2
原子数
镁原子:2
相对质量
24×2+16×2=80
氧原子:2
镁原子:2
2×(24+16)=80
新课讲解
在化学变化中:
反应前后原子种类和数目不变、原子质量不变
元素种类、元素质量不变
物质质量总和不变
【质量守恒定律原因】
质量守恒
所有化学变化都遵循质量守恒定律
新课讲解
原子数目
原子质量
原子种类
微观
元素质量
元素种类
不 变
物质的种类
分子的种类
改变
宏观
可能
改变
分子数目
物质的总质量
元素的化合价
新课讲解
【质量守恒定律的应用】
(1)解释问题
(2)确定反应物或生成物的质量
(3)确定物质的元素组成
(4)确定反应物或生成物的化学式
(5)确定某物质的相对分子质量(或相对原子质量)
(6)确定化学反应的类型
新课讲解
返回
下列说法正确的是( )
A.根据质量守恒定律,1 L氢气和1 L氧气反应能生成2 L水
B.蜡烛完全燃烧后,蜡烛没有了,违背了质量守恒定律
C.只有固体、液体间反应才遵循质量守恒定律
D.铁在氧气中燃烧,生成四氧化三铁的质量等于参加反应的铁丝与氧气质量之和
新课讲解
典例分析
例
D
新课讲解
解析:只要是化学变化都遵循质量守恒定律,如果质量减少了,说明有物质逸散到空气中了;如果质量增加了,说明有别的物质参加了反应。
返回
课堂小结
返回
化
学反应中的质量守恒
质量守恒定律的原因
质量守恒内容
质量守恒定律的应用
1. 下列有关托盘天平的使用的说法不正确的是( )
A.可用托盘天平称取3.2g的高锰酸钾
B.称取2.5g某固体药品发现指针向右偏转时,应减少砝码
C.称某小烧杯的质量发现指针向左偏转时,应添加砝码
D.在添加砝码时,应先添加质量大的砝码,后添加质量小的砝码
D
当堂小练
B
2.将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下表,下列说法正确的是( )
A.a和b是反应物
B.x=2.0
C.该反应是分解反应
D.d可能是催化剂
D
当堂小练
D
3. 如图是四种物质a、b、c、d在化学反应过程中的微观示意图,下列说法中正确的是 ( )
A.生成物中c与d的分子个数比为1:2
B.反应不符合质量守恒定律
C.反应前后原子的种类改变
D.物质c可能是一氧化碳
D
当堂小练
A
返回
1.某同学做了两个实验:一是氧化汞受热分解生成汞和氧气;二是镁条在氧气中燃烧生成固体氧化镁。他将反应的生成物全部收集起来,并准确称量了这些反应物和生成物的质量,发现反应后的生成物质量都发生了变化。你认为这两个反应是否符合质量守恒定律 为什么
课后习题
答案:符合质量守恒定律。氧化汞受热分解生成汞和氧气,氧化汞的质量与生成的汞和逸出氧气的质量总和相等,因此汞的质量小于氧化汞的质量;镁条在氧气中燃烧生成氧化镁,氧化镁的质量与镁条和参加反应的氧气的质量总和相等,因此氧化镁的质量大于镁条的质量。这两个反应都符合质量守恒定律。
课后习题
2.如果用 表示二氧化碳,请你用图式表示出二氧化碳与碳反应生成一氧化碳的变化。
答案:
课后习题
3.某物质在空气中燃烧,生成水和二氧化碳,则该物质中一定含有 和 元素,可能含有 元素。
答案:氢 碳 氧
解析:物质在空气中燃烧,空气中的氧气只提供氧元素,生成水和二氧化碳,则证明物质中一-定含有氢和碳两种元素,可能含有氧元素。
课后习题
4.蜡烛燃烧后生成二氧化碳和水。下列关于该化学反应的叙述正确的是( ) 。
A.燃烧前后蜡烛质量不变
B.蜡烛减少的质量等于生成的二氧化碳和水的质量
C.蜡烛燃烧后生成物的质量之和等于蜡烛减少的质量与消耗氧气的质量之和
D.燃烧前蜡烛的质量与消耗氧气质量之和等于生成的二氧化碳与水的质量之和
课后习题
答案:C
解析:蜡烛燃烧生成水和二氧化碳,生成的水和二氧化碳的质量总和应该等于参加反应的蜡烛和消耗的氧气的质量之和。
课后习题
第五单元 定量研究化学反应
第一节 化学反应中的质量守恒
初中化学
九年级上 鲁教版
目
录
CONTENTS
1
学习目标
新课导入
2
新课讲解
3
课堂小结
4
当堂小练
5
课后习题
6
学习目标
返回
1. 理解质量守恒定律以及守恒的原因。
2. 通过对化学反应实质的分析及质量守恒原因的分析,培养研究问题能力和逻辑推理能力。
3. 激发对现实生活中化学现象的好奇心和探究欲,激发学习化学的兴趣。
新课导入
我们已经知道,化学反应的结果是反应物转化为生成物。那么,在化学反应过程中,反应物和生成物的质量是如何变化的呢
返回
一、质量守恒定律
新课讲解
提出问题:参加反应的各物质质量总和与反应生成的各物质质量总和相比较,是否发生了变化?
新课讲解
猜想与假设:
1.发生了变化,反应生成的各物质的质量总和大于参加反应的各物质的质量总和。
2.发生了变化,反应生成的各物质的质量总和小于参加反应的各物质的质量总和。
3.发生了变化,反应生成的各物质的质量总和等于参加反应的各物质的质量总和。
...........
新课讲解
进行实验:
实验1:氢氧化钠溶液跟硫酸铜溶液反应前后质量的测定
⑴在锥形瓶中加入蓝色硫酸铜溶液,胶头滴管是氢氧化钠溶液。
⑵称量锥形瓶内物质的总质量为M1。
⑶挤压胶头滴管里的氢氧化钠溶液,使二者反应,观察现象。
⑷称量锥形瓶内物质的总质量,为M2。
新课讲解
新课讲解
现象 在产生蓝色絮状沉淀;溶液的蓝色逐渐变浅;且天平仍然保持平衡
结论
反应前后,物质的总质量相等
M1 = M2
CuSO4 NaOH Cu(OH)2 Na2SO4
新课讲解
实验2:石灰石与稀盐酸反应
实验步骤:在锥形瓶中加入适量的石灰石,在试管里装入适量稀盐酸,将其放在在天平左盘里,然后颠倒使其混合反应,观察现象。
新课讲解
新课讲解
现象
产生无色气泡
结论
M1 > M2
氯化钙+水+二氧化碳
碳酸钙+盐酸
无盖时(开放容器内)
有盖时(密闭容器内)
CaCO3
CaCl2
HCl
CO2
H2O
M1 = M2
新课讲解
实验3:白磷燃烧前后质量的测定
实验步骤:
(1)在锥形瓶中先放一层细砂并放一小块白磷;
(2)称量锥形瓶内物质的总质量 (3)点燃白磷,观察产生的现象;
新课讲解
现象
白磷燃烧产生大量白烟,放出热量
结论 反应前后天平平衡,因此化学反应前后的各物质质量总和,等于反应后生成的各物质质量总和
磷 + 氧气 五氧化二磷
点燃
m1 = m2
新课讲解
参加化学反应的各物质M1=反应后生成的各物质M2
归 纳
通过上述实验,你有什么认识?
参加反应的各物质的质量总和
生成的各物质的质量总和
质量守恒定律注意要点
1.质量守恒定律的“守恒”指的是质量守恒,其他方面如体积等不一定守恒。
2.是指“参加反应的各物质”的质量总和,没有参加反应的物质不包括在内。例如“1 g氢气和9 g氧气反应生成10 g水”是错误的。不是任意数值的简单加和而是各反应物间按一定质量比反应的。
新课讲解
3.“反应生成的物质”仅指该反应过程中新生成的物质质量,在反应之前已经存在的质量不计算在内。如1 g氢气在盛有9 g氧气的水中(水的质量为2 g)反应生成12 g水。
4.质量守恒定律只适用于一切化学反应,不涉及物理变化。如“10 g冰加热后变成了10 g水蒸气”符合质量守恒定律也是错误的。
新课讲解
新课讲解
某同学定量研究化学反应,发现木炭燃烧后质量减小了;铁钉生锈后质量却增加了。这些现象与质量守恒定律有矛盾吗
思 考
结合水分子分解示意图,说说化学变化的实质是什么?
化学变化是分子分成原子,原子重新结合的过程
新课讲解
以金属镁与氧气反应为例,你能根据构成物质的微粒在化学反应中的变化对质量守恒定律作出解释吗?
+
2Mg + O2 2MgO
点燃
氧原子:2
原子数
镁原子:2
相对质量
24×2+16×2=80
氧原子:2
镁原子:2
2×(24+16)=80
新课讲解
在化学变化中:
反应前后原子种类和数目不变、原子质量不变
元素种类、元素质量不变
物质质量总和不变
【质量守恒定律原因】
质量守恒
所有化学变化都遵循质量守恒定律
新课讲解
原子数目
原子质量
原子种类
微观
元素质量
元素种类
不 变
物质的种类
分子的种类
改变
宏观
可能
改变
分子数目
物质的总质量
元素的化合价
新课讲解
【质量守恒定律的应用】
(1)解释问题
(2)确定反应物或生成物的质量
(3)确定物质的元素组成
(4)确定反应物或生成物的化学式
(5)确定某物质的相对分子质量(或相对原子质量)
(6)确定化学反应的类型
新课讲解
返回
下列说法正确的是( )
A.根据质量守恒定律,1 L氢气和1 L氧气反应能生成2 L水
B.蜡烛完全燃烧后,蜡烛没有了,违背了质量守恒定律
C.只有固体、液体间反应才遵循质量守恒定律
D.铁在氧气中燃烧,生成四氧化三铁的质量等于参加反应的铁丝与氧气质量之和
新课讲解
典例分析
例
D
新课讲解
解析:只要是化学变化都遵循质量守恒定律,如果质量减少了,说明有物质逸散到空气中了;如果质量增加了,说明有别的物质参加了反应。
返回
课堂小结
返回
化
学反应中的质量守恒
质量守恒定律的原因
质量守恒内容
质量守恒定律的应用
1. 下列有关托盘天平的使用的说法不正确的是( )
A.可用托盘天平称取3.2g的高锰酸钾
B.称取2.5g某固体药品发现指针向右偏转时,应减少砝码
C.称某小烧杯的质量发现指针向左偏转时,应添加砝码
D.在添加砝码时,应先添加质量大的砝码,后添加质量小的砝码
D
当堂小练
B
2.将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下表,下列说法正确的是( )
A.a和b是反应物
B.x=2.0
C.该反应是分解反应
D.d可能是催化剂
D
当堂小练
D
3. 如图是四种物质a、b、c、d在化学反应过程中的微观示意图,下列说法中正确的是 ( )
A.生成物中c与d的分子个数比为1:2
B.反应不符合质量守恒定律
C.反应前后原子的种类改变
D.物质c可能是一氧化碳
D
当堂小练
A
返回
1.某同学做了两个实验:一是氧化汞受热分解生成汞和氧气;二是镁条在氧气中燃烧生成固体氧化镁。他将反应的生成物全部收集起来,并准确称量了这些反应物和生成物的质量,发现反应后的生成物质量都发生了变化。你认为这两个反应是否符合质量守恒定律 为什么
课后习题
答案:符合质量守恒定律。氧化汞受热分解生成汞和氧气,氧化汞的质量与生成的汞和逸出氧气的质量总和相等,因此汞的质量小于氧化汞的质量;镁条在氧气中燃烧生成氧化镁,氧化镁的质量与镁条和参加反应的氧气的质量总和相等,因此氧化镁的质量大于镁条的质量。这两个反应都符合质量守恒定律。
课后习题
2.如果用 表示二氧化碳,请你用图式表示出二氧化碳与碳反应生成一氧化碳的变化。
答案:
课后习题
3.某物质在空气中燃烧,生成水和二氧化碳,则该物质中一定含有 和 元素,可能含有 元素。
答案:氢 碳 氧
解析:物质在空气中燃烧,空气中的氧气只提供氧元素,生成水和二氧化碳,则证明物质中一-定含有氢和碳两种元素,可能含有氧元素。
课后习题
4.蜡烛燃烧后生成二氧化碳和水。下列关于该化学反应的叙述正确的是( ) 。
A.燃烧前后蜡烛质量不变
B.蜡烛减少的质量等于生成的二氧化碳和水的质量
C.蜡烛燃烧后生成物的质量之和等于蜡烛减少的质量与消耗氧气的质量之和
D.燃烧前蜡烛的质量与消耗氧气质量之和等于生成的二氧化碳与水的质量之和
课后习题
答案:C
解析:蜡烛燃烧生成水和二氧化碳,生成的水和二氧化碳的质量总和应该等于参加反应的蜡烛和消耗的氧气的质量之和。
课后习题
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
