5.3 化学方程式中的有关计算 课件(共28张PPT)-初中化学鲁教版九年级上册
文档属性
| 名称 | 5.3 化学方程式中的有关计算 课件(共28张PPT)-初中化学鲁教版九年级上册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-23 15:11:46 | ||
图片预览








文档简介
(共28张PPT)
初中化学
九年级上 鲁教版
第五单元 定量研究化学反应
第三节 化学反应中的有关计算
目
录
CONTENTS
1
学习目标
新课导入
2
新课讲解
3
课堂小结
4
当堂小练
5
课后习题
6
学习目标
返回
1. 能根据化学方程式进行简单计算。
2. 规范用化学方程式进行计算的解题格式
新课导入
之前我们学习过化学方程式的配平等内容,知道化学反应方程式是如何书写的,今天我们一起学习有关化学方程式计算的知识!
返回
一、根据化学方程式计算的依据
新课讲解
(1) 理论依据:质量守恒定律
(2)计算依据:
化学方程式表示反应前后各物质的质量关系,即各物质之间的质量比等于各物质的相对分子(原子)质量与化学计量数的乘积之比。
已知1kg氢气能供一辆功率为50KW的氢能源汽车行驶约100km,要想知道18kg水分解产生的氢气能供该汽车行驶多少千米,就需要知道18kg水能分解产生多少氢气
怎么算?
新课讲解
写出氢气在氧气中燃烧的化学方程式,并标出各物质的质量比可表示为:
2H2 + O2 ====== 2 H2O
2×2 : 32 : 2×18
4 : 32 : 36
若: 4克 : ( )克 : ( )克
点燃
若: 克 : ( )克 : 18克
32
36
2
练一练
16
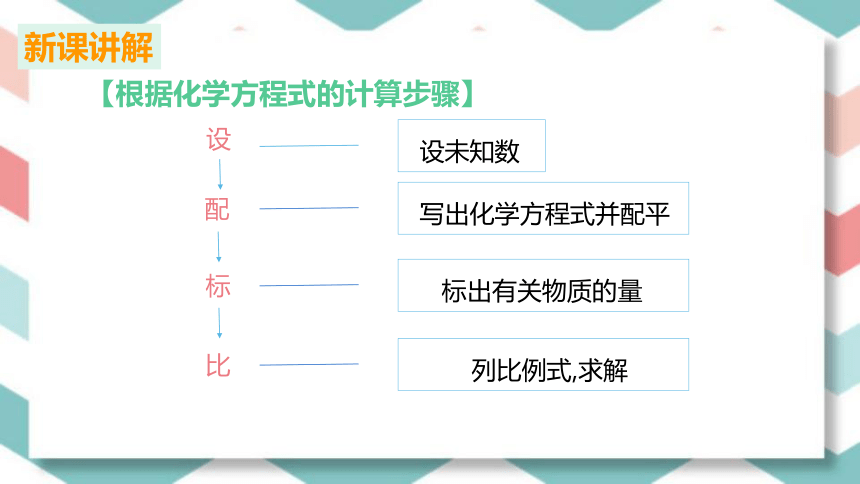
新课讲解
设未知数
写出化学方程式并配平
标出有关物质的量
设
配
标
【根据化学方程式的计算步骤】
新课讲解
列比例式,求解
比
练习:工业上高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳,如果要制取10t氧化钙,需要碳酸钙多少吨
解:设需要碳酸钙的质量为x
CaCO3 CaO+CO2↑
100
56
x
10t
=
解得:x = 18t
答:需要碳酸钙18t
新课讲解
【有关化学方程式的常见题型】
1.含杂质(杂质不参与反应)物质计算
纯物质的质量 = 不纯物质的质量×纯度(质量分数)
2.由一种纯净物的反应物的质量求生成物的质量
新课讲解
把4.5克含杂质(杂质不与盐酸反应)的锌粒和足量的稀盐酸反应,待反应停止后,烧杯中物质的质量减少了0.1g。求:
(Zn+2HCl===ZnCl2 + H2↑)
①参加反应的锌的质量
②这种锌粒中含锌的质量分数。
练一练
新课讲解
解:设参加反应的Zn的质量为x
根据题意:
反应生成氢气的质量为0.1g
Zn+2HCl===ZnCl2 + H2↑
2
0.1g
65
x
65
x
=
2
0.1g
x=3.25g
答:参加反应的锌的质量为3.25g
新课讲解
解:设参加反应的Zn的质量为x
根据题意:
反应生成氢气的质量为0.1g
Zn+2HCl===ZnCl2 + H2↑
2
0.1g
65
3.25g
该锌粒中
Zn%=
4.5g
3.25g
×100%
= 72%
答:这种锌粒中锌的质量分数为72%。
新课讲解
化学方程式计算注意要点
(重检查:①各物质的化学式是否正确;②化学方程式是否符合质量守恒定律即是否配平)。
(3)正确计算出反应中已知物质和待求物质的质量比。
(这是正确解题的关键)
(4)进行准确、熟练的数学运算(这是解题正确的保证)。
(5)要有完整的解题步骤和规范的书写格式。
(这是解题规范的必需)
新课讲解
归 纳
通过上述计算例题,你有什么认识?
三个要领:
(1)步骤要完整(设、写、算、标、列、解、答)
(2)格式要规范;
(3)得数要准确(保留两位小数);
三个关键:
(1)准确书写化学方程式;
(2)准确计算相对分子质量;
(3)代入量均指纯净物的质量(单位要代入计算过程);
新课讲解
某校化学兴趣小组为测定空气中二氧化硫的含量,用NaOH溶液吸收后,反应方程式如下:2NaOH + SO2 === Na2SO3 + H2O,用NaOH溶液吸收1000L已除去CO2的空气样品,溶液质量增重了0.64g,也就是说被吸收的SO2的质量为0.64g 。已知此时空气的密度约为1.3 g / L,求:
(1)发生反应的NaOH的质量。
(2)空气中SO2的质量分数(计算结果精确到0.01%)
新课讲解
典例分析
例
新课讲解
(1)溶液质量增重了0.64g,即被吸收的SO2 质量是0.64g
(2)设发生反应的NaOH的质量为x,则:
2NaOH + SO2 ====Na 2 SO 3 + H 2 O
80 64
X 0.64 g
解得x=0.8 g
(3)空气中SO2 的质量分数= ×100%=0.05%
返回
课堂小结
返回
化学反应中的有关计算
一、化学方程式计算的步骤:
1.设;
2.方;
3.标;
4.比;
5.答。
二、化学方程式计算的有关题型
1. 大家知道食盐是常见的调味品,但你知道吗?它还是一种重要的化工原料。利用食盐可以来制取氢氧化钠、氢气和氯气等,化学反应方程式为:
2NaCl+ 2H2O ===Cl2 + H2 + 2NaOH
若某厂每天生产氯气71kg,问:
(1)该厂每天至少需要氯化钠固体多少千克?
(2)同时能生产氢氧化钠多少千克?
D
当堂小练
通电
当堂小练
解:设该厂每天至少需氯化钠固体的质量为x,同时能生产氢氧化钠为y
答:该厂每天至少需氯化钠固体117kg;能生产氢氧化钠80kg
返回
1.已知锌和稀硫酸(H2SO4)反应生成氢气和硫酸锌( ZnSO4)。实验室制取2g氢气,需要多少克锌
答案:解:设需要锌的质量为。
答:需要锌的质量为65 g。
解析:本题是根据化学方程式的简单计算题,正确书写化学方程式是关键。
课后习题
2.实验室中用分解过氧化氢(H2O2)的方法制取氧气。76g过氧化氢完全分解,可以生成多少克氧气
答案:解:设可以生成氧气的质量为。
答:可以生成氧气的质量为35.8 g。
解析:本题要求根据反应物的质量求生成物的质量,解答时注意要正确列出比例式。
课后习题
3. 48g镁与32g氧气完全反应,能生成80g氧化镁。36g镁与30g氧气充分反应,能否生成66g氧化镁呢
答案:不能。
解析:依据 ,反应中镁、氧气和氧化镁的质量比为48:32:80,即3:2:5。
题中镁与氧气的质量比为36:30,即18:15,小于3:2,所以氧气过量,不能生成66 g氧化镁。
课后习题
解:设最多能生成氧化镁的质量为。
所以最多能生成氧化镁的质量为60 g。
课后习题
4.某同学在学习了化学反应的定量计算方法后,独立完成了一道计算题。请你认真阅读,完成以下两个任务。
( 1)对该同学的解题过程进行评价,并对发现的错误进行改正。
(2)通过与大家交流,请你反思总结:在进行有关化学反应的定量计算时,应该注意哪些问题
题目: 15.5g红磷在氧气中充分燃烧,可生成五氧化二磷多少克
课后习题
解:设可生成g五氧化二磷。
答:可生成五氧化二磷71g。
课后习题
答案:(1)错误:化学方程式未配平; 后面有单位g;15.5后无g; 中间无等号; =71无单位。
正确的计算过程为:
解:设可生成五氧化二磷的质量为。
答:可生成五氧化二磷35.5g。
课后习题
(2)在进行有关化学方程式的定量计算时要注意正确书写化学方程式、正确设未知量。注意用于计算的反应物或生成物的质量必须是参加反应的质量(其他合理问题也可)。
课后习题
初中化学
九年级上 鲁教版
第五单元 定量研究化学反应
第三节 化学反应中的有关计算
目
录
CONTENTS
1
学习目标
新课导入
2
新课讲解
3
课堂小结
4
当堂小练
5
课后习题
6
学习目标
返回
1. 能根据化学方程式进行简单计算。
2. 规范用化学方程式进行计算的解题格式
新课导入
之前我们学习过化学方程式的配平等内容,知道化学反应方程式是如何书写的,今天我们一起学习有关化学方程式计算的知识!
返回
一、根据化学方程式计算的依据
新课讲解
(1) 理论依据:质量守恒定律
(2)计算依据:
化学方程式表示反应前后各物质的质量关系,即各物质之间的质量比等于各物质的相对分子(原子)质量与化学计量数的乘积之比。
已知1kg氢气能供一辆功率为50KW的氢能源汽车行驶约100km,要想知道18kg水分解产生的氢气能供该汽车行驶多少千米,就需要知道18kg水能分解产生多少氢气
怎么算?
新课讲解
写出氢气在氧气中燃烧的化学方程式,并标出各物质的质量比可表示为:
2H2 + O2 ====== 2 H2O
2×2 : 32 : 2×18
4 : 32 : 36
若: 4克 : ( )克 : ( )克
点燃
若: 克 : ( )克 : 18克
32
36
2
练一练
16
新课讲解
设未知数
写出化学方程式并配平
标出有关物质的量
设
配
标
【根据化学方程式的计算步骤】
新课讲解
列比例式,求解
比
练习:工业上高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳,如果要制取10t氧化钙,需要碳酸钙多少吨
解:设需要碳酸钙的质量为x
CaCO3 CaO+CO2↑
100
56
x
10t
=
解得:x = 18t
答:需要碳酸钙18t
新课讲解
【有关化学方程式的常见题型】
1.含杂质(杂质不参与反应)物质计算
纯物质的质量 = 不纯物质的质量×纯度(质量分数)
2.由一种纯净物的反应物的质量求生成物的质量
新课讲解
把4.5克含杂质(杂质不与盐酸反应)的锌粒和足量的稀盐酸反应,待反应停止后,烧杯中物质的质量减少了0.1g。求:
(Zn+2HCl===ZnCl2 + H2↑)
①参加反应的锌的质量
②这种锌粒中含锌的质量分数。
练一练
新课讲解
解:设参加反应的Zn的质量为x
根据题意:
反应生成氢气的质量为0.1g
Zn+2HCl===ZnCl2 + H2↑
2
0.1g
65
x
65
x
=
2
0.1g
x=3.25g
答:参加反应的锌的质量为3.25g
新课讲解
解:设参加反应的Zn的质量为x
根据题意:
反应生成氢气的质量为0.1g
Zn+2HCl===ZnCl2 + H2↑
2
0.1g
65
3.25g
该锌粒中
Zn%=
4.5g
3.25g
×100%
= 72%
答:这种锌粒中锌的质量分数为72%。
新课讲解
化学方程式计算注意要点
(重检查:①各物质的化学式是否正确;②化学方程式是否符合质量守恒定律即是否配平)。
(3)正确计算出反应中已知物质和待求物质的质量比。
(这是正确解题的关键)
(4)进行准确、熟练的数学运算(这是解题正确的保证)。
(5)要有完整的解题步骤和规范的书写格式。
(这是解题规范的必需)
新课讲解
归 纳
通过上述计算例题,你有什么认识?
三个要领:
(1)步骤要完整(设、写、算、标、列、解、答)
(2)格式要规范;
(3)得数要准确(保留两位小数);
三个关键:
(1)准确书写化学方程式;
(2)准确计算相对分子质量;
(3)代入量均指纯净物的质量(单位要代入计算过程);
新课讲解
某校化学兴趣小组为测定空气中二氧化硫的含量,用NaOH溶液吸收后,反应方程式如下:2NaOH + SO2 === Na2SO3 + H2O,用NaOH溶液吸收1000L已除去CO2的空气样品,溶液质量增重了0.64g,也就是说被吸收的SO2的质量为0.64g 。已知此时空气的密度约为1.3 g / L,求:
(1)发生反应的NaOH的质量。
(2)空气中SO2的质量分数(计算结果精确到0.01%)
新课讲解
典例分析
例
新课讲解
(1)溶液质量增重了0.64g,即被吸收的SO2 质量是0.64g
(2)设发生反应的NaOH的质量为x,则:
2NaOH + SO2 ====Na 2 SO 3 + H 2 O
80 64
X 0.64 g
解得x=0.8 g
(3)空气中SO2 的质量分数= ×100%=0.05%
返回
课堂小结
返回
化学反应中的有关计算
一、化学方程式计算的步骤:
1.设;
2.方;
3.标;
4.比;
5.答。
二、化学方程式计算的有关题型
1. 大家知道食盐是常见的调味品,但你知道吗?它还是一种重要的化工原料。利用食盐可以来制取氢氧化钠、氢气和氯气等,化学反应方程式为:
2NaCl+ 2H2O ===Cl2 + H2 + 2NaOH
若某厂每天生产氯气71kg,问:
(1)该厂每天至少需要氯化钠固体多少千克?
(2)同时能生产氢氧化钠多少千克?
D
当堂小练
通电
当堂小练
解:设该厂每天至少需氯化钠固体的质量为x,同时能生产氢氧化钠为y
答:该厂每天至少需氯化钠固体117kg;能生产氢氧化钠80kg
返回
1.已知锌和稀硫酸(H2SO4)反应生成氢气和硫酸锌( ZnSO4)。实验室制取2g氢气,需要多少克锌
答案:解:设需要锌的质量为。
答:需要锌的质量为65 g。
解析:本题是根据化学方程式的简单计算题,正确书写化学方程式是关键。
课后习题
2.实验室中用分解过氧化氢(H2O2)的方法制取氧气。76g过氧化氢完全分解,可以生成多少克氧气
答案:解:设可以生成氧气的质量为。
答:可以生成氧气的质量为35.8 g。
解析:本题要求根据反应物的质量求生成物的质量,解答时注意要正确列出比例式。
课后习题
3. 48g镁与32g氧气完全反应,能生成80g氧化镁。36g镁与30g氧气充分反应,能否生成66g氧化镁呢
答案:不能。
解析:依据 ,反应中镁、氧气和氧化镁的质量比为48:32:80,即3:2:5。
题中镁与氧气的质量比为36:30,即18:15,小于3:2,所以氧气过量,不能生成66 g氧化镁。
课后习题
解:设最多能生成氧化镁的质量为。
所以最多能生成氧化镁的质量为60 g。
课后习题
4.某同学在学习了化学反应的定量计算方法后,独立完成了一道计算题。请你认真阅读,完成以下两个任务。
( 1)对该同学的解题过程进行评价,并对发现的错误进行改正。
(2)通过与大家交流,请你反思总结:在进行有关化学反应的定量计算时,应该注意哪些问题
题目: 15.5g红磷在氧气中充分燃烧,可生成五氧化二磷多少克
课后习题
解:设可生成g五氧化二磷。
答:可生成五氧化二磷71g。
课后习题
答案:(1)错误:化学方程式未配平; 后面有单位g;15.5后无g; 中间无等号; =71无单位。
正确的计算过程为:
解:设可生成五氧化二磷的质量为。
答:可生成五氧化二磷35.5g。
课后习题
(2)在进行有关化学方程式的定量计算时要注意正确书写化学方程式、正确设未知量。注意用于计算的反应物或生成物的质量必须是参加反应的质量(其他合理问题也可)。
课后习题
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
