吉林省长春市朝阳区2022-2023学年高一下学期6月月考化学试题(含答案)
文档属性
| 名称 | 吉林省长春市朝阳区2022-2023学年高一下学期6月月考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-23 15:02:35 | ||
图片预览

文档简介
长春市朝阳区2022-2023学年高一下学期6月月考
化学试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共5页。考试结束后,将答题卡交回。
注意事项:
1.答题前,考生先将自己的姓名、准考证号填写清楚,将条形码准确粘贴在考生信
息条形码粘贴区。
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书
写,字体工整、笔迹清楚。
3.请按照题号顺序在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量: Cu-64 Zn-65
第Ⅰ卷
选择题
1.下列说法正确的是
A.氯化镁、亚硝酸钠、山梨酸钠、三聚氰胺均不能用作食品添加剂
B.不合理施用化肥会影响土壤的酸碱性和土壤结构
C.果蔬汁(浆)类饮料中的添加剂苯甲酸及其钠盐属于抗氧化剂
D.长期服用阿司匹林可预防某些疾病,没有副作用
2.化石燃料是由古代生物的遗骸经过一系列复杂变化而形成的,是不可再生资源。下列关于化石燃料的说法不正确的是
A.甲烷是天然气的主要成分,它是一种高效而洁净的燃料
B.石油的分馏是化学变化
C.石油通过催化裂化过程可获得汽油、煤油等轻质油
D.煤的气化是把煤转化为可燃性气体的过程,该过程属于化学变化
3.海带中含有碘元素,可通过以下步骤提取碘单质:①灼烧;②溶解;③过滤;④氧化;⑤萃取分液等。以上步骤不需要用到的仪器是
A. B. C. D.
4. “端午节”是我国传统节日之一,节日活动有吃粽子、赛龙舟及喝雄黄酒等。制作粽子的主要原料有糯米、粽叶,还有蛋黄、猪肉等馅料。下列有关说法正确的是
A.糯米也是酿酒原料,酿酒加入的“酒曲”起催化作用
B.赛龙舟时,挥舞的龙旗是用涤纶制作,涤纶属于天然纤维
C.蛋黄、猪肉富含油脂和蛋白质,油脂和蛋白质均属于高分子化合物
D.糯米的主要成分是淀粉,粽叶的主要成分是纤维素,淀粉和纤维素的分子式都是(C6H10O5)n,互为同分异构体
5.下列关于金属冶炼的说法中错误的是
A.电解法获得镁时,不可在CO2或N2中降温冷却
B.热还原法常用的还原剂有CO、H2、C、Al等
C.金属Na、Mg、Al均能通过电解熔融氯化物的方法获得
D.人类历史上金属被发现的顺序与金属的活泼性有关
6.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可知( )
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为化学能
C.醋酸与NH4HCO3发生了复分解反应,该反应为吸热反应
D.该反应的离子方程式为:CO+2H+=CO2↑+H2O
7.常温下,1 mol某烷烃在光照条件下与氯气发生取代反应,若在适当的条件下完全取代需要消耗6 mol Cl2,则下列判断正确的是
A.该烷烃的四氯代物有2种
B.反应所生成的有机产物能直接与AgNO3溶液反应
C.该烷烃的分子式为C5H12
D.反应容器中,有机产物中的一氯代物所占的物质的量分数最大
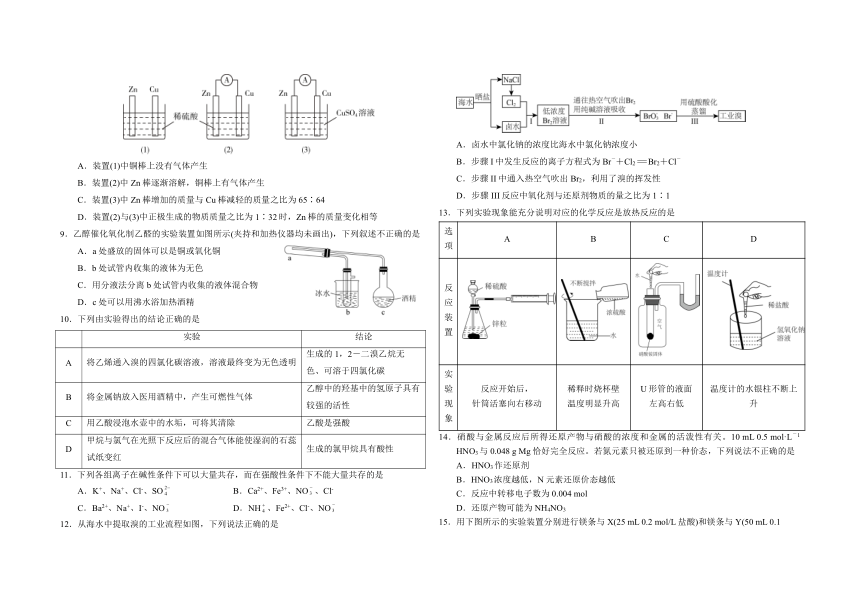
8.某学生用如图所示装置研究原电池的原理,下列说法错误的是
A.装置(1)中铜棒上没有气体产生
B.装置(2)中Zn棒逐渐溶解,铜棒上有气体产生
C.装置(3)中Zn棒增加的质量与Cu棒减轻的质量之比为65∶64
D.装置(2)与(3)中正极生成的物质质量之比为1∶32时,Zn棒的质量变化相等
9.乙醇催化氧化制乙醛的实验装置如图所示(夹持和加热仪器均未画出),下列叙述不正确的是
A.a处盛放的固体可以是铜或氧化铜
B.b处试管内收集的液体为无色
C.用分液法分离b处试管内收集的液体混合物
D.c处可以用沸水浴加热酒精
10.下列由实验得出的结论正确的是
实验 结论
A 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 生成的1,2-二溴乙烷无色、可溶于四氯化碳
B 将金属钠放入医用酒精中,产生可燃性气体 乙醇中的羟基中的氢原子具有较强的活性
C 用乙酸浸泡水壶中的水垢,可将其清除 乙酸是强酸
D 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 生成的氯甲烷具有酸性
11.下列各组离子在碱性条件下可以大量共存,而在强酸性条件下不能大量共存的是
A.K+、Na+、Cl-、SO B.Ca2+、Fe3+、NO、Cl-
C.Ba2+、Na+、I-、NO D.NH、Fe2+、Cl-、NO
12.从海水中提取溴的工业流程如图,下列说法正确的是
A.卤水中氯化钠的浓度比海水中氯化钠浓度小
B.步骤I中发生反应的离子方程式为Br-+Cl2=Br2+Cl-
C.步骤II中通入热空气吹出Br2,利用了溴的挥发性
D.步骤III反应中氧化剂与还原剂物质的量之比为1∶1
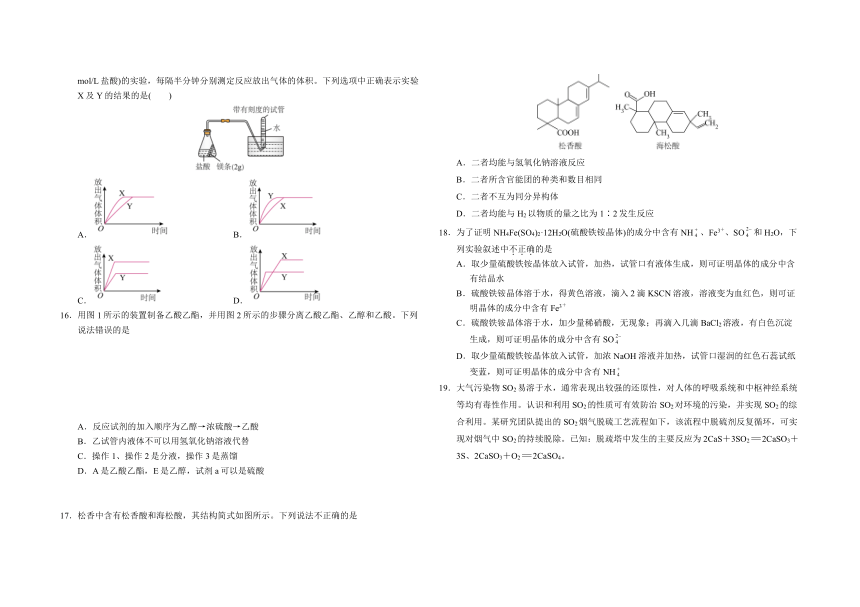
13.下列实验现象能充分说明对应的化学反应是放热反应的是
选项 A B C D
反应装置
实验现象 反应开始后, 针筒活塞向右移动 稀释时烧杯壁 温度明显升高 U形管的液面 左高右低 温度计的水银柱不断上升
14.硝酸与金属反应后所得还原产物与硝酸的浓度和金属的活泼性有关。10 mL 0.5 mol·L-1 HNO3与0.048 g Mg恰好完全反应。若氮元素只被还原到一种价态,下列说法不正确的是
A.HNO3作还原剂
B.HNO3浓度越低,N元素还原价态越低
C.反应中转移电子数为0.004 mol
D.还原产物可能为NH4NO3
15.用下图所示的实验装置分别进行镁条与X(25 mL 0.2 mol/L盐酸)和镁条与Y(50 mL 0.1 mol/L盐酸)的实验,每隔半分钟分别测定反应放出气体的体积。下列选项中正确表示实验X及Y的结果的是( )
A. B.
C. D.
16.用图1所示的装置制备乙酸乙酯,并用图2所示的步骤分离乙酸乙酯、乙醇和乙酸。下列说法错误的是
A.反应试剂的加入顺序为乙醇→浓硫酸→乙酸
B.乙试管内液体不可以用氢氧化钠溶液代替
C.操作1、操作2是分液,操作3是蒸馏
D.A是乙酸乙酯,E是乙醇,试剂a可以是硫酸
17.松香中含有松香酸和海松酸,其结构简式如图所示。下列说法不正确的是
A.二者均能与氢氧化钠溶液反应
B.二者所含官能团的种类和数目相同
C.二者不互为同分异构体
D.二者均能与H2以物质的量之比为1∶2发生反应
18.为了证明NH4Fe(SO4)2·12H2O(硫酸铁铵晶体)的成分中含有NH、Fe3+、SO和 H2O,下列实验叙述中不正确的是
A.取少量硫酸铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水
B.硫酸铁铵晶体溶于水,得黄色溶液,滴入2滴KSCN溶液,溶液变为血红色,则可证明晶体的成分中含有Fe3+
C.硫酸铁铵晶体溶于水,加少量稀硝酸,无现象;再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO
D.取少量硫酸铁铵晶体放入试管,加浓NaOH溶液并加热,试管口湿润的红色石蕊试纸变蓝,则可证明晶体的成分中含有NH
19.大气污染物SO2易溶于水,通常表现出较强的还原性,对人体的呼吸系统和中枢神经系统等均有毒性作用。认识和利用SO2的性质可有效防治SO2对环境的污染,并实现SO2的综合利用。某研究团队提出的SO2烟气脱硫工艺流程如下,该流程中脱硫剂反复循环,可实现对烟气中SO2的持续脱除。已知:脱疏塔中发生的主要反应为2CaS+3SO2=2CaSO3+3S、2CaSO3+O2=2CaSO4。
下列有关说法正确的是
A.脱硫塔中反应生成的S为还原产物
B.经冷凝器得到的几种单质S2、S4、S6和S8互为同位素
C.将CaSO4和煤粉碎混合,再投入再生塔,有利于反应充分进行
D.再生塔中得到的X主要成分为CaSO3
20.一定条件下,A、B、C三种气体在某恒容密闭容器中发生反应,各气体的浓度随时间变化的曲线如图所示。0~2 min内该反应共吸收了a(a>0)kJ能量。下列说法正确的是
已知:键能指每断裂或形成1 mol某化学键时吸收或放出的能量。
A.该条件下,0.8 mol A(g)的总能量小于0.4 mol B(g)和1.2 mol C(g)的总能量
B.反应的化学方程式为3C(g)+B(g) 5A(g)
C.由图可知,2 min后,B的正反应速率v正(B)=0
D.该条件下,2 mol A(g)的键能小于1 mol (g)和3 mol (g)的键能总和
第Ⅱ卷
二、填空题
21.(16分)化学反应的过程,既有物质的转化过程,也有化学能与热能或其他能量的转化过程。已知反应3A(g)+B(g)2C(g)+D(g)的能量变化如图所示。
(1)该反应_______(填“吸收”或“释放”)_______(用含、的式子表示)kJ能量。
(2)断开3 mol 和1 mol 中的化学键吸收的能量_______(填“>”、“<”或“=”)形成2 mol 和1 mol 中的化学键释放的能量。
(3)恒温下,在2 L恒容密闭容器中加入3 mol A、2 mol B,2 min末测得 mol·L。
①2 min末,B的物质的量浓度为_______。
②下列说法正确的是_______(填标号)。
A.向容器中通入少量的He(不参与反应),正反应速率减慢
B.总压强保持不变时,反应达到平衡状态
C.从容器中抽走部分D,正反应速率加快,逆反应速率减慢
(4)以反应为原理设计成燃料电池,其利用率高,装置如图所示。
①A处加入的是_______,a处的电极反应式是_______。
②当消耗标准状况下3.36 L O2时,导线上转移的电子的物质的量是_______mol。
22.(18分)硫酸是重要的化工原料,某兴趣小组对浓硫酸的性质进行如下探究。
(1)棉布上滴浓H2SO4后破洞。体现了浓H2SO4的_______(填“脱水”“吸水”或“强氧化”、下同)性;在冷的浓H2SO4中放入铁片无明显现象,体现了浓H2SO4的__________性。
为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊。(已知淀粉溶液遇I2变蓝)
(2)装置A中发生反应的化学方程式为_____________________________________。
(3)实验时,装置C中的现象为___________________________________。
(4)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,正确的操作顺序是_______________(填序号)。
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b
③打开止水夹a和c,关闭止水夹b
(5)若要检验浓硫酸与木炭在加热条件下生成的水蒸气,可在装置__________之间加上一个盛有无水CuSO4的硬质玻璃管。
(6)当D中产生_______________________________现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;写出D中发生反应的化学方程式________________________。
(7)当D中反应转移电子0.3 mol时,参加反应的气体体积(标准状况下)为_______L。
23.(12分)镁及其合金是用途很广的金属材料。工业上冶炼镁的方法有两种,电解法和皮江法。电解法是电解熔融的MgCl2,皮江法是Si在高温下还原MgO。
已知:相关各物质熔点见下表:
物质 MgO MgCl2 Mg Si
熔点 2852 714 649 1410
Ⅰ.电解法冶炼镁。
化工厂利用卤水(主要成分为NaCl和MgCl2)生产金属镁的一种工艺流程如图所示:
(1)Y与Z反应后的产物溶于水可得X溶液,从而实现了Y的再利用,则Z的化学式为_______________。
(2)“沉淀”中除Mg(OH)2外,还可能含有的杂质为___________(填化学式)。
(3)工业上不用电解MgO制金属镁的原因为______________________________________。
Ⅱ.皮江法冶炼镁,工业流程如下:
(4)气体a为_________(填化学式)。
(5)白云石煅烧前粉碎的目的为_________________________________________。
(6)还原炉需控制温度为1200℃左右,并抽空气到近似真空。还原炉中发生的主要反应有_________________________、SiO2+CaO = CaSiO3。
24.(14分)工业上可利用地沟油作为原料制备乙醇,乙醇可再加工制备多种化工材料(已知:CH3CH2OHCH2=CH2↑+H2O)。
(1)反应②实现了官能团的转化,由醇羟基转化为_______(写名称)。
(2)反应②的类型是_______________;反应④的类型是_______________。
(3)请写出反应②的化学方程式___________________________________________。
(4)请写出反应④的化学方程式___________________________________________。
(5)请写出反应⑥的化学方程式___________________________________________。
(6)关于乙二醇又称甘醇,是常用的一种有机溶剂,关于乙二醇HOCH2-CH2OH性质预测正确的是_______(填字母)。
A.乙二醇能溶于水
B.乙二醇能燃烧,充分燃烧其产物是CO2和水
C.向紫色的酸性高锰酸钾溶液中加入乙二醇溶液,可观察到紫色溶液褪色
D.乙二醇与乙醇互为同系物
参考答案
1-20 BBAAC BACCA CCDAA CCCCA
21(1) 吸收
(2)>
(3) 0.75 mol·L B
(4) 0.6
22(1)脱水性 强氧化性(1分)
(2)2H2SO4(浓)+C = 2SO2↑+CO2↑+2H2O (2分)
(3)品红溶液褪色(1分)
(4)③①②(1分)
(5)A、B或B、C(1分)
(6)进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变(1分) 2H2O+SO2+I2=2HI+H2SO4 (2分)
(7)3.36 L(2分)
23(1)H2(1分) (2)Ca(OH)2(1分) (3)MgO熔点很高(2852℃),而MgCl2熔点相对较低(714℃),熔融MgO时会耗费大量的能量而增加生产成本(2分) (4)CO2(1分) (5)增大固体表面积,提高化学反应速率(1分) (6)2MgO+Si = 2Mg+SiO2(2分)
24(1)醛基(1分)
(2)氧化反应(1分) 加成反应(1分)
(3)+O2+2H2O (2分)
(4)CH2=CH2+Cl2―→CH2ClCH2Cl(2分)
(5)nCH2=CHCl(2分)
(6)ABC(2分)
化学试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共5页。考试结束后,将答题卡交回。
注意事项:
1.答题前,考生先将自己的姓名、准考证号填写清楚,将条形码准确粘贴在考生信
息条形码粘贴区。
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书
写,字体工整、笔迹清楚。
3.请按照题号顺序在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量: Cu-64 Zn-65
第Ⅰ卷
选择题
1.下列说法正确的是
A.氯化镁、亚硝酸钠、山梨酸钠、三聚氰胺均不能用作食品添加剂
B.不合理施用化肥会影响土壤的酸碱性和土壤结构
C.果蔬汁(浆)类饮料中的添加剂苯甲酸及其钠盐属于抗氧化剂
D.长期服用阿司匹林可预防某些疾病,没有副作用
2.化石燃料是由古代生物的遗骸经过一系列复杂变化而形成的,是不可再生资源。下列关于化石燃料的说法不正确的是
A.甲烷是天然气的主要成分,它是一种高效而洁净的燃料
B.石油的分馏是化学变化
C.石油通过催化裂化过程可获得汽油、煤油等轻质油
D.煤的气化是把煤转化为可燃性气体的过程,该过程属于化学变化
3.海带中含有碘元素,可通过以下步骤提取碘单质:①灼烧;②溶解;③过滤;④氧化;⑤萃取分液等。以上步骤不需要用到的仪器是
A. B. C. D.
4. “端午节”是我国传统节日之一,节日活动有吃粽子、赛龙舟及喝雄黄酒等。制作粽子的主要原料有糯米、粽叶,还有蛋黄、猪肉等馅料。下列有关说法正确的是
A.糯米也是酿酒原料,酿酒加入的“酒曲”起催化作用
B.赛龙舟时,挥舞的龙旗是用涤纶制作,涤纶属于天然纤维
C.蛋黄、猪肉富含油脂和蛋白质,油脂和蛋白质均属于高分子化合物
D.糯米的主要成分是淀粉,粽叶的主要成分是纤维素,淀粉和纤维素的分子式都是(C6H10O5)n,互为同分异构体
5.下列关于金属冶炼的说法中错误的是
A.电解法获得镁时,不可在CO2或N2中降温冷却
B.热还原法常用的还原剂有CO、H2、C、Al等
C.金属Na、Mg、Al均能通过电解熔融氯化物的方法获得
D.人类历史上金属被发现的顺序与金属的活泼性有关
6.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可知( )
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为化学能
C.醋酸与NH4HCO3发生了复分解反应,该反应为吸热反应
D.该反应的离子方程式为:CO+2H+=CO2↑+H2O
7.常温下,1 mol某烷烃在光照条件下与氯气发生取代反应,若在适当的条件下完全取代需要消耗6 mol Cl2,则下列判断正确的是
A.该烷烃的四氯代物有2种
B.反应所生成的有机产物能直接与AgNO3溶液反应
C.该烷烃的分子式为C5H12
D.反应容器中,有机产物中的一氯代物所占的物质的量分数最大
8.某学生用如图所示装置研究原电池的原理,下列说法错误的是
A.装置(1)中铜棒上没有气体产生
B.装置(2)中Zn棒逐渐溶解,铜棒上有气体产生
C.装置(3)中Zn棒增加的质量与Cu棒减轻的质量之比为65∶64
D.装置(2)与(3)中正极生成的物质质量之比为1∶32时,Zn棒的质量变化相等
9.乙醇催化氧化制乙醛的实验装置如图所示(夹持和加热仪器均未画出),下列叙述不正确的是
A.a处盛放的固体可以是铜或氧化铜
B.b处试管内收集的液体为无色
C.用分液法分离b处试管内收集的液体混合物
D.c处可以用沸水浴加热酒精
10.下列由实验得出的结论正确的是
实验 结论
A 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 生成的1,2-二溴乙烷无色、可溶于四氯化碳
B 将金属钠放入医用酒精中,产生可燃性气体 乙醇中的羟基中的氢原子具有较强的活性
C 用乙酸浸泡水壶中的水垢,可将其清除 乙酸是强酸
D 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 生成的氯甲烷具有酸性
11.下列各组离子在碱性条件下可以大量共存,而在强酸性条件下不能大量共存的是
A.K+、Na+、Cl-、SO B.Ca2+、Fe3+、NO、Cl-
C.Ba2+、Na+、I-、NO D.NH、Fe2+、Cl-、NO
12.从海水中提取溴的工业流程如图,下列说法正确的是
A.卤水中氯化钠的浓度比海水中氯化钠浓度小
B.步骤I中发生反应的离子方程式为Br-+Cl2=Br2+Cl-
C.步骤II中通入热空气吹出Br2,利用了溴的挥发性
D.步骤III反应中氧化剂与还原剂物质的量之比为1∶1
13.下列实验现象能充分说明对应的化学反应是放热反应的是
选项 A B C D
反应装置
实验现象 反应开始后, 针筒活塞向右移动 稀释时烧杯壁 温度明显升高 U形管的液面 左高右低 温度计的水银柱不断上升
14.硝酸与金属反应后所得还原产物与硝酸的浓度和金属的活泼性有关。10 mL 0.5 mol·L-1 HNO3与0.048 g Mg恰好完全反应。若氮元素只被还原到一种价态,下列说法不正确的是
A.HNO3作还原剂
B.HNO3浓度越低,N元素还原价态越低
C.反应中转移电子数为0.004 mol
D.还原产物可能为NH4NO3
15.用下图所示的实验装置分别进行镁条与X(25 mL 0.2 mol/L盐酸)和镁条与Y(50 mL 0.1 mol/L盐酸)的实验,每隔半分钟分别测定反应放出气体的体积。下列选项中正确表示实验X及Y的结果的是( )
A. B.
C. D.
16.用图1所示的装置制备乙酸乙酯,并用图2所示的步骤分离乙酸乙酯、乙醇和乙酸。下列说法错误的是
A.反应试剂的加入顺序为乙醇→浓硫酸→乙酸
B.乙试管内液体不可以用氢氧化钠溶液代替
C.操作1、操作2是分液,操作3是蒸馏
D.A是乙酸乙酯,E是乙醇,试剂a可以是硫酸
17.松香中含有松香酸和海松酸,其结构简式如图所示。下列说法不正确的是
A.二者均能与氢氧化钠溶液反应
B.二者所含官能团的种类和数目相同
C.二者不互为同分异构体
D.二者均能与H2以物质的量之比为1∶2发生反应
18.为了证明NH4Fe(SO4)2·12H2O(硫酸铁铵晶体)的成分中含有NH、Fe3+、SO和 H2O,下列实验叙述中不正确的是
A.取少量硫酸铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水
B.硫酸铁铵晶体溶于水,得黄色溶液,滴入2滴KSCN溶液,溶液变为血红色,则可证明晶体的成分中含有Fe3+
C.硫酸铁铵晶体溶于水,加少量稀硝酸,无现象;再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO
D.取少量硫酸铁铵晶体放入试管,加浓NaOH溶液并加热,试管口湿润的红色石蕊试纸变蓝,则可证明晶体的成分中含有NH
19.大气污染物SO2易溶于水,通常表现出较强的还原性,对人体的呼吸系统和中枢神经系统等均有毒性作用。认识和利用SO2的性质可有效防治SO2对环境的污染,并实现SO2的综合利用。某研究团队提出的SO2烟气脱硫工艺流程如下,该流程中脱硫剂反复循环,可实现对烟气中SO2的持续脱除。已知:脱疏塔中发生的主要反应为2CaS+3SO2=2CaSO3+3S、2CaSO3+O2=2CaSO4。
下列有关说法正确的是
A.脱硫塔中反应生成的S为还原产物
B.经冷凝器得到的几种单质S2、S4、S6和S8互为同位素
C.将CaSO4和煤粉碎混合,再投入再生塔,有利于反应充分进行
D.再生塔中得到的X主要成分为CaSO3
20.一定条件下,A、B、C三种气体在某恒容密闭容器中发生反应,各气体的浓度随时间变化的曲线如图所示。0~2 min内该反应共吸收了a(a>0)kJ能量。下列说法正确的是
已知:键能指每断裂或形成1 mol某化学键时吸收或放出的能量。
A.该条件下,0.8 mol A(g)的总能量小于0.4 mol B(g)和1.2 mol C(g)的总能量
B.反应的化学方程式为3C(g)+B(g) 5A(g)
C.由图可知,2 min后,B的正反应速率v正(B)=0
D.该条件下,2 mol A(g)的键能小于1 mol (g)和3 mol (g)的键能总和
第Ⅱ卷
二、填空题
21.(16分)化学反应的过程,既有物质的转化过程,也有化学能与热能或其他能量的转化过程。已知反应3A(g)+B(g)2C(g)+D(g)的能量变化如图所示。
(1)该反应_______(填“吸收”或“释放”)_______(用含、的式子表示)kJ能量。
(2)断开3 mol 和1 mol 中的化学键吸收的能量_______(填“>”、“<”或“=”)形成2 mol 和1 mol 中的化学键释放的能量。
(3)恒温下,在2 L恒容密闭容器中加入3 mol A、2 mol B,2 min末测得 mol·L。
①2 min末,B的物质的量浓度为_______。
②下列说法正确的是_______(填标号)。
A.向容器中通入少量的He(不参与反应),正反应速率减慢
B.总压强保持不变时,反应达到平衡状态
C.从容器中抽走部分D,正反应速率加快,逆反应速率减慢
(4)以反应为原理设计成燃料电池,其利用率高,装置如图所示。
①A处加入的是_______,a处的电极反应式是_______。
②当消耗标准状况下3.36 L O2时,导线上转移的电子的物质的量是_______mol。
22.(18分)硫酸是重要的化工原料,某兴趣小组对浓硫酸的性质进行如下探究。
(1)棉布上滴浓H2SO4后破洞。体现了浓H2SO4的_______(填“脱水”“吸水”或“强氧化”、下同)性;在冷的浓H2SO4中放入铁片无明显现象,体现了浓H2SO4的__________性。
为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊。(已知淀粉溶液遇I2变蓝)
(2)装置A中发生反应的化学方程式为_____________________________________。
(3)实验时,装置C中的现象为___________________________________。
(4)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,正确的操作顺序是_______________(填序号)。
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b
③打开止水夹a和c,关闭止水夹b
(5)若要检验浓硫酸与木炭在加热条件下生成的水蒸气,可在装置__________之间加上一个盛有无水CuSO4的硬质玻璃管。
(6)当D中产生_______________________________现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;写出D中发生反应的化学方程式________________________。
(7)当D中反应转移电子0.3 mol时,参加反应的气体体积(标准状况下)为_______L。
23.(12分)镁及其合金是用途很广的金属材料。工业上冶炼镁的方法有两种,电解法和皮江法。电解法是电解熔融的MgCl2,皮江法是Si在高温下还原MgO。
已知:相关各物质熔点见下表:
物质 MgO MgCl2 Mg Si
熔点 2852 714 649 1410
Ⅰ.电解法冶炼镁。
化工厂利用卤水(主要成分为NaCl和MgCl2)生产金属镁的一种工艺流程如图所示:
(1)Y与Z反应后的产物溶于水可得X溶液,从而实现了Y的再利用,则Z的化学式为_______________。
(2)“沉淀”中除Mg(OH)2外,还可能含有的杂质为___________(填化学式)。
(3)工业上不用电解MgO制金属镁的原因为______________________________________。
Ⅱ.皮江法冶炼镁,工业流程如下:
(4)气体a为_________(填化学式)。
(5)白云石煅烧前粉碎的目的为_________________________________________。
(6)还原炉需控制温度为1200℃左右,并抽空气到近似真空。还原炉中发生的主要反应有_________________________、SiO2+CaO = CaSiO3。
24.(14分)工业上可利用地沟油作为原料制备乙醇,乙醇可再加工制备多种化工材料(已知:CH3CH2OHCH2=CH2↑+H2O)。
(1)反应②实现了官能团的转化,由醇羟基转化为_______(写名称)。
(2)反应②的类型是_______________;反应④的类型是_______________。
(3)请写出反应②的化学方程式___________________________________________。
(4)请写出反应④的化学方程式___________________________________________。
(5)请写出反应⑥的化学方程式___________________________________________。
(6)关于乙二醇又称甘醇,是常用的一种有机溶剂,关于乙二醇HOCH2-CH2OH性质预测正确的是_______(填字母)。
A.乙二醇能溶于水
B.乙二醇能燃烧,充分燃烧其产物是CO2和水
C.向紫色的酸性高锰酸钾溶液中加入乙二醇溶液,可观察到紫色溶液褪色
D.乙二醇与乙醇互为同系物
参考答案
1-20 BBAAC BACCA CCDAA CCCCA
21(1) 吸收
(2)>
(3) 0.75 mol·L B
(4) 0.6
22(1)脱水性 强氧化性(1分)
(2)2H2SO4(浓)+C = 2SO2↑+CO2↑+2H2O (2分)
(3)品红溶液褪色(1分)
(4)③①②(1分)
(5)A、B或B、C(1分)
(6)进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变(1分) 2H2O+SO2+I2=2HI+H2SO4 (2分)
(7)3.36 L(2分)
23(1)H2(1分) (2)Ca(OH)2(1分) (3)MgO熔点很高(2852℃),而MgCl2熔点相对较低(714℃),熔融MgO时会耗费大量的能量而增加生产成本(2分) (4)CO2(1分) (5)增大固体表面积,提高化学反应速率(1分) (6)2MgO+Si = 2Mg+SiO2(2分)
24(1)醛基(1分)
(2)氧化反应(1分) 加成反应(1分)
(3)+O2+2H2O (2分)
(4)CH2=CH2+Cl2―→CH2ClCH2Cl(2分)
(5)nCH2=CHCl(2分)
(6)ABC(2分)
同课章节目录
