第七章、第八章阶段复习训练(含解析)2022——2023学年下学期高一化学人教版(2019)必修第二册
文档属性
| 名称 | 第七章、第八章阶段复习训练(含解析)2022——2023学年下学期高一化学人教版(2019)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 674.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-24 07:53:39 | ||
图片预览



文档简介
第七章、第八章阶段复习训练
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.淀粉溶液是一种胶体,并且淀粉遇到碘单质,可以出现明显的蓝色特征。现将淀粉和稀Na2SO4溶液混合,装在半透膜袋中,浸泡在盛蒸馏水的烧杯内,过一段时间后,取烧杯中液体进行实验,能证明半透膜完好无损的是
A.加入BaCl2溶液产生白色沉淀 B.加入碘水不变蓝
C.加入BaCl2溶液没有白色沉淀产生 D.加入碘水变蓝
2.以下关于甲烷的说法中,正确的是
①一氯甲烷分子具有四面体结构
②二氯甲烷有两种同分异构体
③甲烷与发生光照取代,取代需
④甲烷分子中四个键,任意两个之间的键角均相等
A.②③④ B.②③ C.①④ D.①③
3.下列关于CH4、CH3CH3和的叙述正确的是
A.均能用通式CnH2n+2来表示
B.与所有烷烃互为同素异形体
C.它们都是烷烃,结构中都既有极性共价键又有非极性共价键
D.它们的性质完全相同
4.下列有关甲烷的取代反应的叙述正确的是
A.甲烷与氯气以物质的量之比为1∶4混合时只生成CCl4
B.甲烷与氯气反应生成的产物中CH3Cl的量最多
C.甲烷与氯气的取代反应生成的产物为混合物
D.1mol甲烷生成CH2Cl2最多消耗1mol氯气
5.在下列物质中,不能与发生化学反应的是
①CH3CH2OH(酸催化) ②CH3CH2CH2CH3 ③Na ④CH3COOH(酸催化)
A.①② B.①④ C.只有② D.③④
6.乌头酸的结构简式如图所示,下列关于乌头酸的说法错误的是
A.化学式为C6H6O6
B.乌头酸能发生水解反应和加成反应
C.乌头酸能使酸性高锰酸钾溶液褪色
D.含1mol乌头酸的溶液最多可消耗3molNaOH
7.某学生设计了如下实验方案用以检验淀粉水解的情况:
下列结论中正确的是
A.淀粉尚有部分未水解
B.淀粉已完全水解
C.淀粉没有水解
D.淀粉已发生水解,但不知是否完全水解
8.四氯乙烯()是一种衣物干洗剂,聚四氟乙烯()是家用不粘锅内侧涂层的主要成分。下列关于四氯乙烯和聚四氟乙烯的叙述正确的是
A.它们都可以由乙烯发生加成反应得到
B.它们的分子中都不含氢原子
C.四氯乙烯对油脂有较好的溶解作用,聚四氟乙烯的化学性质比较活泼
D.它们都能发生加成反应,都能使酸性高锰酸钾溶液褪色
9.废水中的氨氮(NH3、NH)采用微生物脱氮法、化学沉淀法均可除去,具体原理如下:
①微生物脱氮法:NHNON2
②化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,生成MgNH4PO4 6H2O沉淀从而去除氨氮。
下列有关说法正确的是
A.步骤a发生反应:NH+O2=NO+H2O+H+
B.含氨氮的废水直接大量排放,对水体的影响不大
C.化学沉淀法脱氯时,溶液的碱性过强,氨氮的去除率将下降
D.微生物脱氮可在高温条件下进行,以加快脱氮的速率
10.加碘食盐中的碘以碘酸钾(KIO3)的形式存在。已知在溶液中IO与I-可发生反应:,根据上述反应,可用试纸和一些常见试剂进行实验,证明食盐中存在IO。可供选用的物质有:①蒸馏水 ②蓝色石蕊试纸 ③碘化钾淀粉试纸 ④淀粉 ⑤蔗糖 ⑥乙酸 ⑦乙醇
进行上述实验时必须使用的物质是
A.①③ B.①③⑥ C.②④⑥ D.①②④⑤⑦
11.“煤制油”的关键技术是煤的气化,目前煤的气化主要是煤中的碳和水蒸气的反应:。该反应是吸热反应,反应所需能量由间歇进行的碳的燃烧(氧气用空气代替)来提供:。下列关于该过程的说法不正确的是
A.第一个反应需要吸热,所以煤的气化从能量角度来看,得不偿失
B.煤的气化可以减少煤直接燃烧对环境造成的粉尘污染
C.煤气化后作为燃料,燃烧充分,热利用率高
D.上述两个反应后的混合气体中除去、后主要是合成氨的两种原料气
12.中央经济工作会议将碳达峰和碳中和列为主要任务之一,在此背景下,“新能源”、“低碳”、“节能减排”、“绿色化学”等概念愈来愈受到人们的重视。下列说法不正确的是
A.太阳能、地热能、氢能均属于“新能源”
B.“低碳”是指采用含碳量低的烃类作为燃料
C.图中HCl的循环使用体现了“节能减排”思想
D.用乙烷和氯气光照制取氯乙烷不是最理想的“原子经济性反应”
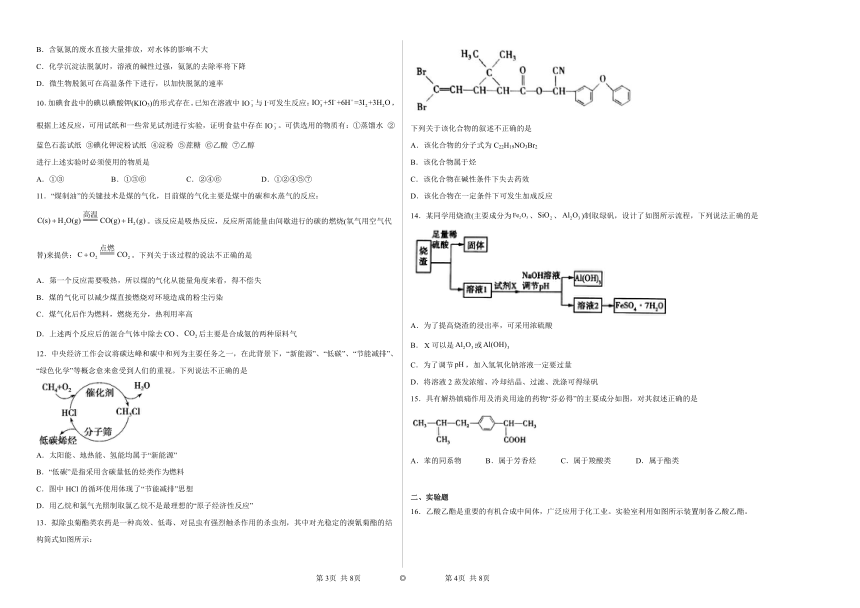
13.拟除虫菊酯类农药是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图所示:
下列关于该化合物的叙述不正确的是
A.该化合物的分子式为C22H19NO3Br2
B.该化合物属于烃
C.该化合物在碱性条件下失去药效
D.该化合物在一定条件下可发生加成反应
14.某同学用烧渣(主要成分为、、)制取绿矾,设计了如图所示流程,下列说法正确的是
A.为了提高烧渣的浸出率,可采用浓硫酸
B.可以是或
C.为了调节,加入氢氧化钠溶液一定要过量
D.将溶液2蒸发浓缩、冷却结晶、过滤、洗涤可得绿矾
15.具有解热镇痛作用及消炎用途的药物“芬必得”的主要成分如图,对其叙述正确的是
A.苯的同系物 B.属于芳香烃 C.属于羧酸类 D.属于酯类
二、实验题
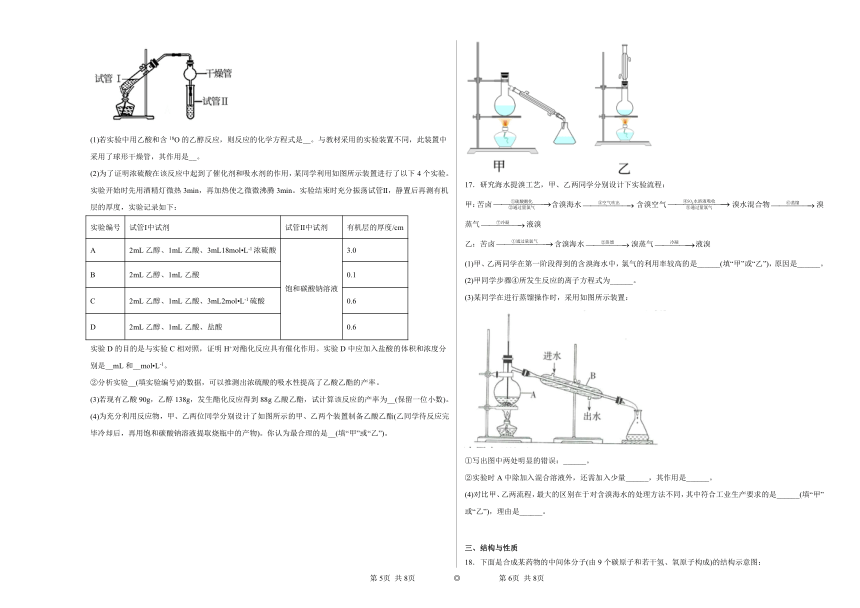
16.乙酸乙酯是重要的有机合成中间体,广泛应用于化工业。实验室利用如图所示装置制备乙酸乙酯。
(1)若实验中用乙酸和含18O的乙醇反应,则反应的化学方程式是__。与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是__。
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验。实验开始时先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束时充分振荡试管Ⅱ,静置后再测有机层的厚度,实验记录如下:
实验编号 试管Ⅰ中试剂 试管Ⅱ中试剂 有机层的厚度/cm
A 2mL乙醇、1mL乙酸、3mL18mol L-1浓硫酸 饱和碳酸钠溶液 3.0
B 2mL乙醇、1mL乙酸 0.1
C 2mL乙醇、1mL乙酸、3mL2mol L-1硫酸 0.6
D 2mL乙醇、1mL乙酸、盐酸 0.6
实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是__mL和__mol L-1。
②分析实验__(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。
(3)若现有乙酸90g,乙醇138g,发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为__(保留一位小数)。
(4)为充分利用反应物,甲、乙两位同学分别设计了如图所示的甲、乙两个装置制备乙酸乙酯(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物)。你认为最合理的是__(填“甲”或“乙”)。
17.研究海水提溴工艺,甲、乙两同学分别设计下实验流程:
甲:苦卤含溴海水含溴空气溴水混合物溴蒸气液溴
乙:苦卤含溴海水溴蒸气液溴
(1)甲、乙两同学在第一阶段得到的含溴海水中,氯气的利用率较高的是______(填“甲”或“乙”),原因是______。
(2)甲同学步骤④所发生反应的离子方程式为______。
(3)某同学在进行蒸馏操作时,采用如图所示装置:
①写出图中两处明显的错误:______。
②实验时A中除加入混合溶液外,还需加入少量______,其作用是______。
(4)对比甲、乙两流程,最大的区别在于对含溴海水的处理方法不同,其中符合工业生产要求的是______(填“甲”或“乙”),理由是______。
三、结构与性质
18.下面是合成某药物的中间体分子(由9个碳原子和若干氢、氧原子构成)的结构示意图:
试回答下列问题:
(1)通过对比上面的结构简式与立体模型,请指出结构简式中的“Et”表示的基团是(写结构简式)_____;该药物中间体的分子式为________。
(2)该分子中含有_________个不饱和碳原子。
(3)该药物中间体中含氧官能团的名称为___________。
(4)该药物中间体分子中与碳原子结合的氢原子被溴原子取代,所得的一溴代物有______种。
四、有机推断题
19.几年前,央视《每周质量报告》曝光河北一些企业,用生石灰处理皮革废料,熬制成工业明胶,卖给绍兴新昌一些企业制成药用胶囊,国家相关部门得到消息后要求立即暂停购入和使用相关企业生产的所有胶囊剂药品。皮革废料发生水解后得到一种被称为脯氨酸()的有机物,脯氨酸是人体所需的氨基酸之一,工业上可用α-氨基戊二酸合成,其合成路线如下:
(1)α-氨基戊二酸中含有的官能团名称为_________。
(2)反应①的反应类型为_____________。
(3)反应可看作两步,其中间产物的分子式为,且结构中含有五元环。写出由B反应生成中间产物的化学方程式:_________。
(4)合成路线中设计反应③、④的目的是___________。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】淀粉溶液属于胶体,如果半透膜完好无损,则淀粉分子就不会通过半透膜,烧杯中便没有淀粉,加入碘水不变蓝,但是硫酸钠可以透过半透膜,加入BaCl2溶液一定产生白色沉淀,不能以此作为判断依据,答案选B。
2.C
【详解】①一氯甲烷分子为甲烷中一个H原子被Cl取代,C为sp3杂化,但CH3Cl的结构不对称,为四面体结构,故①正确;
②甲烷为正四面体结构,为立体结构,所以二氯甲烷只有一种,故②错误;
③甲烷与氯气发生一氯取代的方程式为:CH4+Cl2→CH3Cl+HCl,取代1molH需要1mol氯气,故③错误;
④甲烷分子中四个碳氢键完全相同,四个C-H键的任意两个之间的键角均相等,故④正确;
故选:C。
3.A
【详解】A.CH3CH3的分子式为C2H6,的分子式为C4H10,三者均可以用通式CnH2n+2来表示,A正确;
B.由同种元素组成的不同的单质互为同素异形体,三者均为化合物,其他烷烃也为化合物,不互为同素异形体,B错误;
C.三者都是烷烃,但甲烷中只含C-H极性共价键,不含非极性共价键,C错误;
D.三者都是烷烃,化学性质相似,但熔、沸点等物理性质不相同,D错误;
答案选A。
4.C
【详解】A.甲烷与氯气一旦发生取代反应就不会停止在某一步,四种有机物都会产生,故得不到纯净的CH3Cl,A错误;
B.甲烷与氯气的反应中每取代1 mol氢原子,消耗1 mol氯气,生成1 mol HCl,故产物中HCl最多,B错误;
C.由A分析可知,甲烷与氯气的取代反应生成的产物为混合物,C正确;
D.1 mol甲烷生成CH2Cl2最多消耗2mol氯气,D错误。
故选C。
5.C
【详解】根据有机物的结构简式可知,含有的官能团为醇羟基、羧基,含有苯环;
①含有羧基,可与CH3CH2OH(酸催化)发生酯化反应,不符合题意;
②有机物不与CH3CH2CH2CH3发生化学反应,符合题意;
③含有的羟基与羧基均可与Na发生化学反应,不符合题意;
④含有羟基可与CH3COOH(酸催化)发生酯化反应,不符合题意;
答案选C。
6.B
【详解】A.根据乌头酸的结构简式可知其化学式为C6H6O6,A正确;
B.乌头酸中所含官能团为羧基和碳碳双键,可以发生加成,不能发生水解反应,B错误;
C.乌头酸中含有碳碳双键,能使酸性高锰酸钾溶液褪色,C正确;
D.1mol乌头酸中含有3mol羧基,最多可消耗3molNaOH,D正确;
故选B。
7.D
【分析】淀粉为多糖,遇到碘变蓝色,在酸性环境下水解生成葡萄糖,葡萄糖含有醛基,能够与新制备的氢氧化铜发生氧化反应,生成氧化亚铜砖红色沉淀,碘能够与氢氧化钠反应,据此分析判断。
【详解】淀粉为多糖,遇到碘变蓝色,淀粉在酸性环境下发生水解生成葡萄糖水解液,加入氢氧化钠溶液调节溶液呈碱性,再加入碘水,因为碘水能够与氢氧化钠反应,通过该实验不能判断溶液中是否含有淀粉;在碱性环境下加入新制备的氢氧化铜,产生砖红色沉淀,说明水解液中含有葡萄糖,说明淀粉已经水解,所以通过上述实验能够证明淀粉已经水解,但无法确定是否水解完全,故选D。
8.B
【详解】A.. 四氟乙烯可由乙炔发生加成反应得到,聚四氟乙烯是由四氟乙烯发生加聚反应得到,所以二者都不能用乙烯发生加成反应得到,故A错误;
B.二者都只含C和卤族元素,所以二者都不含氢原子,故B正确;
C.聚四氟乙烯中不含碳碳不饱和键,性质较稳定,所以聚四氟乙烯中化学性质不活泼,故C错误;
D.碳碳不饱和键能发生加成反应,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,四氯乙烯含有碳碳不饱和键而能发生加成反应,能使酸性高锰酸钾溶液褪色,聚四氟乙烯不含碳碳双键而不能发生加成反应、不能使酸性高锰酸钾溶液褪色,故D错误;
故答案为B。
9.C
【详解】A. 步骤a中铵根离子被氧化,发生反应:NH+2O2=NO+H2O+2H+,故A错误;
B. 含氨氮的废水直接大量排放,可使水中藻类植物大量繁殖,造成水体污染,故B错误;
C. 化学沉淀法脱氯时,溶液的碱性过强,镁离子转化为氢氧化镁沉淀,则氨氮的去除率将下降,故C正确;
D. 高温下微生物发生变性,不利用脱氮,故D错误;
故选C。
10.B
【详解】食盐中的碘以碘酸钾形式存在,根据反应原理,可将食盐用蒸馏水溶解,在溶液中加入I-和H+,是否生成I2可用淀粉进行检验;淀粉碘化钾试纸可以提供I-和淀粉,H+可由乙酸来提供,再结合I2的特性(遇淀粉变蓝),则可证明食盐中存在IO,故选①③⑥,答案选B。
11.A
【详解】A.虽然在煤的气化过程中会有一部分煤的潜在能量受到损失,但因为加工后得到的气态燃料的热利用率高,而且比较清洁,因此从总体来看将煤气化后再使用还是比较合理的,A错误;
B.CO、H2属于清洁能源,燃烧无污染,煤的气化可以减少煤直接燃烧对环境造成的粉尘污染,B正确;
C.气态燃料比固态煤更易充分燃烧,因此煤气化后作为燃料燃烧充分,热利用率高,C正确;
D.因为反应中的氧气是用空气代替的,所以经过两个反应后的混合气体中有N2、CO2、CO和H2等,除去CO、CO2后主要是合成氨的两种原料气N2和H2,D正确;
故选A。
12.B
【详解】A.太阳能、地热能、氢能、生物能以及核能均属于“新能源”,故A正确;
B.“低碳”主要是指二氧化碳的排放量,故B错;
C.图中HCl的循环利用,排除的水无污染,符合“节能减排”思想,故C正确;
D.用乙烷和氯气光照制取氯乙烷,会有副反应发生,生成二氯乙烷等副产物,所以导致C原子利用率低,即用乙烷和氯气光照制取氯乙烷不是最理想的“原子经济性反应”,而应用乙烯与氯化氢加成制取,故D正确;
答案选B。
13.B
【详解】A.根据结构简式,该化合物的分子式为C22H19NO3Br2,A叙述正确;
B.溴氰菊酯中除含有碳、氢元素外,还含有氮、氧、溴元素,不属于烃,B叙述错误;
C.该化合物中含有酯基,具有酯的性质,在碱性条件下水解而失去药效,C叙述正确;
D.该化合物中含有碳碳双键,能发生加成反应:D叙述正确;
答案为B。
14.D
【解析】烧渣(主要成分为、、)加入足量稀硫酸,不溶,Fe2O3、Al2O3转化为硫酸铁和硫酸铝,试剂应选用,铁与硫酸铁反应生成硫酸亚铁,同时铁与剩余的稀硫酸反应,再加入NaOH溶液调节溶液pH,使溶液中的Al3+转化为氢氧化铝沉淀,过滤后溶液2蒸发浓缩、冷却结晶、过滤、洗涤可得绿矾。
【详解】A.浓硫酸中硫酸主要以分子形式存在,浓度低,烧渣的浸出率反而降低,故A错误;
B.试剂选用和得不到,试剂应选用,铁与硫酸铁反应生成硫酸亚铁,同时铁与剩余的稀硫酸反应,则离子方程式为、,故B错误;
C.加入过量的氢氧化钠溶液,可能沉淀,同时也会溶解,故C错误;
D.由溶液得到结晶水合物的实验操作是蒸发浓缩、冷却结晶、过滤、洗涤等,故D正确;
答案选D。
15.C
【解析】由结构可知,分子中含有苯环,羧基,由此分析。
【详解】A.苯的同系物中只含有C、H元素,该分子结构简式中含“”,不是苯的同系物,故A不符合题意;
B.芳香烃中只含C、H元素,该分子结构简式中含“”,不属于芳香烃,故B不符合题意;
C.该分子结构简式中含“”, 属于羧酸类,故C符合题意;
D.该分子不含酯基,不是酯类,故D不符合题意;
答案选C。
16. CH3COOH+CH3CH218OHCH3CO18OCH2CH3+H2O 冷凝和防止倒吸 3 4 A、C 66.7% 乙
【分析】实验室制取乙酸乙酯是由乙酸和乙醇在浓硫酸作催化剂加热的条件下发生反应制取乙酸乙酯,实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。C、D中氢离子浓度应该相等。A、C加入不同浓度的硫酸,分析实验A、C的数据,判断提高了乙酸乙酯的产率的措施。利用实际产物的质量除以理论产量得到产率。图甲、乙两个装置,图乙装置的原料利用率较高,据此分析。
【详解】(1)若实验中用乙酸和含18O的乙醇反应,则该反应的化学方程式为CH3COOH+CH3CH218OHCH3CO18OCH2CH3+H2O;与教材采用的实验装置不同,此装置中采用了球形干燥管,其容积较大,有利于乙酸乙酯充分与空气进行热交换,起到冷凝作用,也可防止倒吸;
(2)①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。由于在实验C中使用了3mL 2mol/L硫酸,为了使H+的浓度和反应物的总体积与实验C相同,应在实验D中加入盐酸的体积和浓度分别是3mL和4mol/L;
②分析实验A、C可知其他条件相同而只有硫酸的浓度不同,使用浓硫酸时,反应产生的乙酸乙酯较多,说明浓硫酸的吸水性提高了乙酸乙酯的产率;
(3)n(乙酸)=1.5mol,n(乙醇)=3mol,由于乙醇过量,所以应该按照乙酸的量来计算理论上得到的乙酸乙酯的物质的量,理论上得到乙酸乙酯的物质的量为1.5mol,实际上得到乙酸乙酯的物质的量为=1mol,则该反应的产率为×100%≈66.7%;
(4)甲中有部分未发生反应的乙酸和乙醇随着产生的乙酸乙酯挥发出去,物质的利用率较低;而乙中挥发出的乙酸和乙醇通过冷凝又回流到反应装置,继续参与反应,物质的利用率大大提高,所以最合理的是乙。
17. 甲 酸化后可抑制Cl2、Br2与H2O反应,减少Cl2的消耗,提高Cl2的利用率 温度计水银球插入了液体中,冷却水上进下出 碎瓷片 防止暴沸 甲 含溴海水中溴的浓度低,直接蒸馏成本高,甲流程中③④⑤步实际上是溴的富集过程,可提高溴的浓度,减少能源消耗,降低成本
【详解】(1)Cl2、Br2都能与H2O发生可逆反应,酸化后可抑制Cl2、Br2与H2O反应,减少Cl2的消耗,提高Cl2的利用率,氯气利用率较高的是甲;故答案为甲;酸化后可抑制Cl2、Br2与H2O反应,减少Cl2的消耗,提高Cl2的利用率;
(2)Br2具有强氧化性,SO2以还原性为主,Br2与SO2水溶液反应生成HBr和H2SO4,HBr和H2SO4都是强酸,其离子方程式为Br2+SO2+2H2O=4H++2Br-+;故答案为Br2+SO2+2H2O=4H++2Br-+;
(3)①该装置为蒸馏装置,温度计用来测量馏分的温度,温度计的水银球应在蒸馏烧瓶的支管口处;为了提高冷凝效果,冷却水应下口进上口出;故答案为温度计水银球插入了液体中,冷却水上进下出;
②为了防止暴沸,应在烧瓶中加几片碎瓷片或沸石;故答案为碎瓷片或沸石;防止暴沸;
(4)含溴海水中,Br2的浓度低,直接蒸馏将消耗大量能源,因此需要先富集,甲同学中③④⑤是富集溴元素,甲同学的设计符合工业生产;故答案为甲;含溴海水中溴的浓度低,直接蒸馏成本高,甲流程中③④⑤步实际上是溴的富集过程,可提高溴的浓度,减少能源消耗,降低成本。
18. CH3CH2- C9H12O3 2 酯基、羰基 7
【分析】立体模型中有两种大球,根据C的成键特点可以形成4个单键可知哪种黑球为C原子,小球为氢原子,所以)“Et”表示乙基。
【详解】(1)对比结构简式与立体模型可知Et为CH3CH2-,由立体模型得其分子式为C9H12O3,
故答案为:CH3CH2-;C9H12O3;
(2)该分子中有两个碳氧双键,其他碳原子均为碳碳单键或碳氢单键,故不饱和碳原子有两个,故答案为2;
(3)含氧官能团有两种,酯基和羰基,故答案为:酯基、羰基;
(4)碳环中含有一个,结构不对称,所以H原子有7种,被Br原子取代后得7种一溴代物,故答案为:7。
19. 氨基和羧基 取代(或酯化)反应 →+CH3CH2OH 提纯脯氨酸
【分析】根据合成路线分析可知,物质A与乙醇在浓硫酸加热的条件下发生酯化反应,生成物质B,B在经过一系列反应得到C(脯氨酸),再经过③④两个过程对脯氨酸进行除杂提纯,从而得到纯净的脯氨酸,据此结合题干可分析解答问题。
【详解】(1)根据α-氨基戊二酸的结构简式可知,该有机物中含有(氨基)和(羧基)两种官能团,故答案为:氨基和羧基;
(2)反应①是物质A与乙醇在浓硫酸加热的条件下发生酯化反应,生成物质B,反应类型为取代(或酯化)反应,故答案为:取代(或酯化)反应;
(3)反应可看作两步,其中间产物的分子式为,且结构中含有五元环,则中间产物的结构简式为,故答案为:→+CH3CH2OH;
(4)合成路线中设计的反应③是五氯酚与脯氨酸反应,反应④是反应③生成的产物脱去五氯酚,故反应③④的目的是提纯脯氨酸,故答案为:提纯脯氨酸。
【点睛】本题的难点是(3),对照分子式可知另一生成物是C2H5OH。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.淀粉溶液是一种胶体,并且淀粉遇到碘单质,可以出现明显的蓝色特征。现将淀粉和稀Na2SO4溶液混合,装在半透膜袋中,浸泡在盛蒸馏水的烧杯内,过一段时间后,取烧杯中液体进行实验,能证明半透膜完好无损的是
A.加入BaCl2溶液产生白色沉淀 B.加入碘水不变蓝
C.加入BaCl2溶液没有白色沉淀产生 D.加入碘水变蓝
2.以下关于甲烷的说法中,正确的是
①一氯甲烷分子具有四面体结构
②二氯甲烷有两种同分异构体
③甲烷与发生光照取代,取代需
④甲烷分子中四个键,任意两个之间的键角均相等
A.②③④ B.②③ C.①④ D.①③
3.下列关于CH4、CH3CH3和的叙述正确的是
A.均能用通式CnH2n+2来表示
B.与所有烷烃互为同素异形体
C.它们都是烷烃,结构中都既有极性共价键又有非极性共价键
D.它们的性质完全相同
4.下列有关甲烷的取代反应的叙述正确的是
A.甲烷与氯气以物质的量之比为1∶4混合时只生成CCl4
B.甲烷与氯气反应生成的产物中CH3Cl的量最多
C.甲烷与氯气的取代反应生成的产物为混合物
D.1mol甲烷生成CH2Cl2最多消耗1mol氯气
5.在下列物质中,不能与发生化学反应的是
①CH3CH2OH(酸催化) ②CH3CH2CH2CH3 ③Na ④CH3COOH(酸催化)
A.①② B.①④ C.只有② D.③④
6.乌头酸的结构简式如图所示,下列关于乌头酸的说法错误的是
A.化学式为C6H6O6
B.乌头酸能发生水解反应和加成反应
C.乌头酸能使酸性高锰酸钾溶液褪色
D.含1mol乌头酸的溶液最多可消耗3molNaOH
7.某学生设计了如下实验方案用以检验淀粉水解的情况:
下列结论中正确的是
A.淀粉尚有部分未水解
B.淀粉已完全水解
C.淀粉没有水解
D.淀粉已发生水解,但不知是否完全水解
8.四氯乙烯()是一种衣物干洗剂,聚四氟乙烯()是家用不粘锅内侧涂层的主要成分。下列关于四氯乙烯和聚四氟乙烯的叙述正确的是
A.它们都可以由乙烯发生加成反应得到
B.它们的分子中都不含氢原子
C.四氯乙烯对油脂有较好的溶解作用,聚四氟乙烯的化学性质比较活泼
D.它们都能发生加成反应,都能使酸性高锰酸钾溶液褪色
9.废水中的氨氮(NH3、NH)采用微生物脱氮法、化学沉淀法均可除去,具体原理如下:
①微生物脱氮法:NHNON2
②化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,生成MgNH4PO4 6H2O沉淀从而去除氨氮。
下列有关说法正确的是
A.步骤a发生反应:NH+O2=NO+H2O+H+
B.含氨氮的废水直接大量排放,对水体的影响不大
C.化学沉淀法脱氯时,溶液的碱性过强,氨氮的去除率将下降
D.微生物脱氮可在高温条件下进行,以加快脱氮的速率
10.加碘食盐中的碘以碘酸钾(KIO3)的形式存在。已知在溶液中IO与I-可发生反应:,根据上述反应,可用试纸和一些常见试剂进行实验,证明食盐中存在IO。可供选用的物质有:①蒸馏水 ②蓝色石蕊试纸 ③碘化钾淀粉试纸 ④淀粉 ⑤蔗糖 ⑥乙酸 ⑦乙醇
进行上述实验时必须使用的物质是
A.①③ B.①③⑥ C.②④⑥ D.①②④⑤⑦
11.“煤制油”的关键技术是煤的气化,目前煤的气化主要是煤中的碳和水蒸气的反应:。该反应是吸热反应,反应所需能量由间歇进行的碳的燃烧(氧气用空气代替)来提供:。下列关于该过程的说法不正确的是
A.第一个反应需要吸热,所以煤的气化从能量角度来看,得不偿失
B.煤的气化可以减少煤直接燃烧对环境造成的粉尘污染
C.煤气化后作为燃料,燃烧充分,热利用率高
D.上述两个反应后的混合气体中除去、后主要是合成氨的两种原料气
12.中央经济工作会议将碳达峰和碳中和列为主要任务之一,在此背景下,“新能源”、“低碳”、“节能减排”、“绿色化学”等概念愈来愈受到人们的重视。下列说法不正确的是
A.太阳能、地热能、氢能均属于“新能源”
B.“低碳”是指采用含碳量低的烃类作为燃料
C.图中HCl的循环使用体现了“节能减排”思想
D.用乙烷和氯气光照制取氯乙烷不是最理想的“原子经济性反应”
13.拟除虫菊酯类农药是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图所示:
下列关于该化合物的叙述不正确的是
A.该化合物的分子式为C22H19NO3Br2
B.该化合物属于烃
C.该化合物在碱性条件下失去药效
D.该化合物在一定条件下可发生加成反应
14.某同学用烧渣(主要成分为、、)制取绿矾,设计了如图所示流程,下列说法正确的是
A.为了提高烧渣的浸出率,可采用浓硫酸
B.可以是或
C.为了调节,加入氢氧化钠溶液一定要过量
D.将溶液2蒸发浓缩、冷却结晶、过滤、洗涤可得绿矾
15.具有解热镇痛作用及消炎用途的药物“芬必得”的主要成分如图,对其叙述正确的是
A.苯的同系物 B.属于芳香烃 C.属于羧酸类 D.属于酯类
二、实验题
16.乙酸乙酯是重要的有机合成中间体,广泛应用于化工业。实验室利用如图所示装置制备乙酸乙酯。
(1)若实验中用乙酸和含18O的乙醇反应,则反应的化学方程式是__。与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是__。
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验。实验开始时先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束时充分振荡试管Ⅱ,静置后再测有机层的厚度,实验记录如下:
实验编号 试管Ⅰ中试剂 试管Ⅱ中试剂 有机层的厚度/cm
A 2mL乙醇、1mL乙酸、3mL18mol L-1浓硫酸 饱和碳酸钠溶液 3.0
B 2mL乙醇、1mL乙酸 0.1
C 2mL乙醇、1mL乙酸、3mL2mol L-1硫酸 0.6
D 2mL乙醇、1mL乙酸、盐酸 0.6
实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是__mL和__mol L-1。
②分析实验__(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。
(3)若现有乙酸90g,乙醇138g,发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为__(保留一位小数)。
(4)为充分利用反应物,甲、乙两位同学分别设计了如图所示的甲、乙两个装置制备乙酸乙酯(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物)。你认为最合理的是__(填“甲”或“乙”)。
17.研究海水提溴工艺,甲、乙两同学分别设计下实验流程:
甲:苦卤含溴海水含溴空气溴水混合物溴蒸气液溴
乙:苦卤含溴海水溴蒸气液溴
(1)甲、乙两同学在第一阶段得到的含溴海水中,氯气的利用率较高的是______(填“甲”或“乙”),原因是______。
(2)甲同学步骤④所发生反应的离子方程式为______。
(3)某同学在进行蒸馏操作时,采用如图所示装置:
①写出图中两处明显的错误:______。
②实验时A中除加入混合溶液外,还需加入少量______,其作用是______。
(4)对比甲、乙两流程,最大的区别在于对含溴海水的处理方法不同,其中符合工业生产要求的是______(填“甲”或“乙”),理由是______。
三、结构与性质
18.下面是合成某药物的中间体分子(由9个碳原子和若干氢、氧原子构成)的结构示意图:
试回答下列问题:
(1)通过对比上面的结构简式与立体模型,请指出结构简式中的“Et”表示的基团是(写结构简式)_____;该药物中间体的分子式为________。
(2)该分子中含有_________个不饱和碳原子。
(3)该药物中间体中含氧官能团的名称为___________。
(4)该药物中间体分子中与碳原子结合的氢原子被溴原子取代,所得的一溴代物有______种。
四、有机推断题
19.几年前,央视《每周质量报告》曝光河北一些企业,用生石灰处理皮革废料,熬制成工业明胶,卖给绍兴新昌一些企业制成药用胶囊,国家相关部门得到消息后要求立即暂停购入和使用相关企业生产的所有胶囊剂药品。皮革废料发生水解后得到一种被称为脯氨酸()的有机物,脯氨酸是人体所需的氨基酸之一,工业上可用α-氨基戊二酸合成,其合成路线如下:
(1)α-氨基戊二酸中含有的官能团名称为_________。
(2)反应①的反应类型为_____________。
(3)反应可看作两步,其中间产物的分子式为,且结构中含有五元环。写出由B反应生成中间产物的化学方程式:_________。
(4)合成路线中设计反应③、④的目的是___________。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】淀粉溶液属于胶体,如果半透膜完好无损,则淀粉分子就不会通过半透膜,烧杯中便没有淀粉,加入碘水不变蓝,但是硫酸钠可以透过半透膜,加入BaCl2溶液一定产生白色沉淀,不能以此作为判断依据,答案选B。
2.C
【详解】①一氯甲烷分子为甲烷中一个H原子被Cl取代,C为sp3杂化,但CH3Cl的结构不对称,为四面体结构,故①正确;
②甲烷为正四面体结构,为立体结构,所以二氯甲烷只有一种,故②错误;
③甲烷与氯气发生一氯取代的方程式为:CH4+Cl2→CH3Cl+HCl,取代1molH需要1mol氯气,故③错误;
④甲烷分子中四个碳氢键完全相同,四个C-H键的任意两个之间的键角均相等,故④正确;
故选:C。
3.A
【详解】A.CH3CH3的分子式为C2H6,的分子式为C4H10,三者均可以用通式CnH2n+2来表示,A正确;
B.由同种元素组成的不同的单质互为同素异形体,三者均为化合物,其他烷烃也为化合物,不互为同素异形体,B错误;
C.三者都是烷烃,但甲烷中只含C-H极性共价键,不含非极性共价键,C错误;
D.三者都是烷烃,化学性质相似,但熔、沸点等物理性质不相同,D错误;
答案选A。
4.C
【详解】A.甲烷与氯气一旦发生取代反应就不会停止在某一步,四种有机物都会产生,故得不到纯净的CH3Cl,A错误;
B.甲烷与氯气的反应中每取代1 mol氢原子,消耗1 mol氯气,生成1 mol HCl,故产物中HCl最多,B错误;
C.由A分析可知,甲烷与氯气的取代反应生成的产物为混合物,C正确;
D.1 mol甲烷生成CH2Cl2最多消耗2mol氯气,D错误。
故选C。
5.C
【详解】根据有机物的结构简式可知,含有的官能团为醇羟基、羧基,含有苯环;
①含有羧基,可与CH3CH2OH(酸催化)发生酯化反应,不符合题意;
②有机物不与CH3CH2CH2CH3发生化学反应,符合题意;
③含有的羟基与羧基均可与Na发生化学反应,不符合题意;
④含有羟基可与CH3COOH(酸催化)发生酯化反应,不符合题意;
答案选C。
6.B
【详解】A.根据乌头酸的结构简式可知其化学式为C6H6O6,A正确;
B.乌头酸中所含官能团为羧基和碳碳双键,可以发生加成,不能发生水解反应,B错误;
C.乌头酸中含有碳碳双键,能使酸性高锰酸钾溶液褪色,C正确;
D.1mol乌头酸中含有3mol羧基,最多可消耗3molNaOH,D正确;
故选B。
7.D
【分析】淀粉为多糖,遇到碘变蓝色,在酸性环境下水解生成葡萄糖,葡萄糖含有醛基,能够与新制备的氢氧化铜发生氧化反应,生成氧化亚铜砖红色沉淀,碘能够与氢氧化钠反应,据此分析判断。
【详解】淀粉为多糖,遇到碘变蓝色,淀粉在酸性环境下发生水解生成葡萄糖水解液,加入氢氧化钠溶液调节溶液呈碱性,再加入碘水,因为碘水能够与氢氧化钠反应,通过该实验不能判断溶液中是否含有淀粉;在碱性环境下加入新制备的氢氧化铜,产生砖红色沉淀,说明水解液中含有葡萄糖,说明淀粉已经水解,所以通过上述实验能够证明淀粉已经水解,但无法确定是否水解完全,故选D。
8.B
【详解】A.. 四氟乙烯可由乙炔发生加成反应得到,聚四氟乙烯是由四氟乙烯发生加聚反应得到,所以二者都不能用乙烯发生加成反应得到,故A错误;
B.二者都只含C和卤族元素,所以二者都不含氢原子,故B正确;
C.聚四氟乙烯中不含碳碳不饱和键,性质较稳定,所以聚四氟乙烯中化学性质不活泼,故C错误;
D.碳碳不饱和键能发生加成反应,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,四氯乙烯含有碳碳不饱和键而能发生加成反应,能使酸性高锰酸钾溶液褪色,聚四氟乙烯不含碳碳双键而不能发生加成反应、不能使酸性高锰酸钾溶液褪色,故D错误;
故答案为B。
9.C
【详解】A. 步骤a中铵根离子被氧化,发生反应:NH+2O2=NO+H2O+2H+,故A错误;
B. 含氨氮的废水直接大量排放,可使水中藻类植物大量繁殖,造成水体污染,故B错误;
C. 化学沉淀法脱氯时,溶液的碱性过强,镁离子转化为氢氧化镁沉淀,则氨氮的去除率将下降,故C正确;
D. 高温下微生物发生变性,不利用脱氮,故D错误;
故选C。
10.B
【详解】食盐中的碘以碘酸钾形式存在,根据反应原理,可将食盐用蒸馏水溶解,在溶液中加入I-和H+,是否生成I2可用淀粉进行检验;淀粉碘化钾试纸可以提供I-和淀粉,H+可由乙酸来提供,再结合I2的特性(遇淀粉变蓝),则可证明食盐中存在IO,故选①③⑥,答案选B。
11.A
【详解】A.虽然在煤的气化过程中会有一部分煤的潜在能量受到损失,但因为加工后得到的气态燃料的热利用率高,而且比较清洁,因此从总体来看将煤气化后再使用还是比较合理的,A错误;
B.CO、H2属于清洁能源,燃烧无污染,煤的气化可以减少煤直接燃烧对环境造成的粉尘污染,B正确;
C.气态燃料比固态煤更易充分燃烧,因此煤气化后作为燃料燃烧充分,热利用率高,C正确;
D.因为反应中的氧气是用空气代替的,所以经过两个反应后的混合气体中有N2、CO2、CO和H2等,除去CO、CO2后主要是合成氨的两种原料气N2和H2,D正确;
故选A。
12.B
【详解】A.太阳能、地热能、氢能、生物能以及核能均属于“新能源”,故A正确;
B.“低碳”主要是指二氧化碳的排放量,故B错;
C.图中HCl的循环利用,排除的水无污染,符合“节能减排”思想,故C正确;
D.用乙烷和氯气光照制取氯乙烷,会有副反应发生,生成二氯乙烷等副产物,所以导致C原子利用率低,即用乙烷和氯气光照制取氯乙烷不是最理想的“原子经济性反应”,而应用乙烯与氯化氢加成制取,故D正确;
答案选B。
13.B
【详解】A.根据结构简式,该化合物的分子式为C22H19NO3Br2,A叙述正确;
B.溴氰菊酯中除含有碳、氢元素外,还含有氮、氧、溴元素,不属于烃,B叙述错误;
C.该化合物中含有酯基,具有酯的性质,在碱性条件下水解而失去药效,C叙述正确;
D.该化合物中含有碳碳双键,能发生加成反应:D叙述正确;
答案为B。
14.D
【解析】烧渣(主要成分为、、)加入足量稀硫酸,不溶,Fe2O3、Al2O3转化为硫酸铁和硫酸铝,试剂应选用,铁与硫酸铁反应生成硫酸亚铁,同时铁与剩余的稀硫酸反应,再加入NaOH溶液调节溶液pH,使溶液中的Al3+转化为氢氧化铝沉淀,过滤后溶液2蒸发浓缩、冷却结晶、过滤、洗涤可得绿矾。
【详解】A.浓硫酸中硫酸主要以分子形式存在,浓度低,烧渣的浸出率反而降低,故A错误;
B.试剂选用和得不到,试剂应选用,铁与硫酸铁反应生成硫酸亚铁,同时铁与剩余的稀硫酸反应,则离子方程式为、,故B错误;
C.加入过量的氢氧化钠溶液,可能沉淀,同时也会溶解,故C错误;
D.由溶液得到结晶水合物的实验操作是蒸发浓缩、冷却结晶、过滤、洗涤等,故D正确;
答案选D。
15.C
【解析】由结构可知,分子中含有苯环,羧基,由此分析。
【详解】A.苯的同系物中只含有C、H元素,该分子结构简式中含“”,不是苯的同系物,故A不符合题意;
B.芳香烃中只含C、H元素,该分子结构简式中含“”,不属于芳香烃,故B不符合题意;
C.该分子结构简式中含“”, 属于羧酸类,故C符合题意;
D.该分子不含酯基,不是酯类,故D不符合题意;
答案选C。
16. CH3COOH+CH3CH218OHCH3CO18OCH2CH3+H2O 冷凝和防止倒吸 3 4 A、C 66.7% 乙
【分析】实验室制取乙酸乙酯是由乙酸和乙醇在浓硫酸作催化剂加热的条件下发生反应制取乙酸乙酯,实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。C、D中氢离子浓度应该相等。A、C加入不同浓度的硫酸,分析实验A、C的数据,判断提高了乙酸乙酯的产率的措施。利用实际产物的质量除以理论产量得到产率。图甲、乙两个装置,图乙装置的原料利用率较高,据此分析。
【详解】(1)若实验中用乙酸和含18O的乙醇反应,则该反应的化学方程式为CH3COOH+CH3CH218OHCH3CO18OCH2CH3+H2O;与教材采用的实验装置不同,此装置中采用了球形干燥管,其容积较大,有利于乙酸乙酯充分与空气进行热交换,起到冷凝作用,也可防止倒吸;
(2)①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。由于在实验C中使用了3mL 2mol/L硫酸,为了使H+的浓度和反应物的总体积与实验C相同,应在实验D中加入盐酸的体积和浓度分别是3mL和4mol/L;
②分析实验A、C可知其他条件相同而只有硫酸的浓度不同,使用浓硫酸时,反应产生的乙酸乙酯较多,说明浓硫酸的吸水性提高了乙酸乙酯的产率;
(3)n(乙酸)=1.5mol,n(乙醇)=3mol,由于乙醇过量,所以应该按照乙酸的量来计算理论上得到的乙酸乙酯的物质的量,理论上得到乙酸乙酯的物质的量为1.5mol,实际上得到乙酸乙酯的物质的量为=1mol,则该反应的产率为×100%≈66.7%;
(4)甲中有部分未发生反应的乙酸和乙醇随着产生的乙酸乙酯挥发出去,物质的利用率较低;而乙中挥发出的乙酸和乙醇通过冷凝又回流到反应装置,继续参与反应,物质的利用率大大提高,所以最合理的是乙。
17. 甲 酸化后可抑制Cl2、Br2与H2O反应,减少Cl2的消耗,提高Cl2的利用率 温度计水银球插入了液体中,冷却水上进下出 碎瓷片 防止暴沸 甲 含溴海水中溴的浓度低,直接蒸馏成本高,甲流程中③④⑤步实际上是溴的富集过程,可提高溴的浓度,减少能源消耗,降低成本
【详解】(1)Cl2、Br2都能与H2O发生可逆反应,酸化后可抑制Cl2、Br2与H2O反应,减少Cl2的消耗,提高Cl2的利用率,氯气利用率较高的是甲;故答案为甲;酸化后可抑制Cl2、Br2与H2O反应,减少Cl2的消耗,提高Cl2的利用率;
(2)Br2具有强氧化性,SO2以还原性为主,Br2与SO2水溶液反应生成HBr和H2SO4,HBr和H2SO4都是强酸,其离子方程式为Br2+SO2+2H2O=4H++2Br-+;故答案为Br2+SO2+2H2O=4H++2Br-+;
(3)①该装置为蒸馏装置,温度计用来测量馏分的温度,温度计的水银球应在蒸馏烧瓶的支管口处;为了提高冷凝效果,冷却水应下口进上口出;故答案为温度计水银球插入了液体中,冷却水上进下出;
②为了防止暴沸,应在烧瓶中加几片碎瓷片或沸石;故答案为碎瓷片或沸石;防止暴沸;
(4)含溴海水中,Br2的浓度低,直接蒸馏将消耗大量能源,因此需要先富集,甲同学中③④⑤是富集溴元素,甲同学的设计符合工业生产;故答案为甲;含溴海水中溴的浓度低,直接蒸馏成本高,甲流程中③④⑤步实际上是溴的富集过程,可提高溴的浓度,减少能源消耗,降低成本。
18. CH3CH2- C9H12O3 2 酯基、羰基 7
【分析】立体模型中有两种大球,根据C的成键特点可以形成4个单键可知哪种黑球为C原子,小球为氢原子,所以)“Et”表示乙基。
【详解】(1)对比结构简式与立体模型可知Et为CH3CH2-,由立体模型得其分子式为C9H12O3,
故答案为:CH3CH2-;C9H12O3;
(2)该分子中有两个碳氧双键,其他碳原子均为碳碳单键或碳氢单键,故不饱和碳原子有两个,故答案为2;
(3)含氧官能团有两种,酯基和羰基,故答案为:酯基、羰基;
(4)碳环中含有一个,结构不对称,所以H原子有7种,被Br原子取代后得7种一溴代物,故答案为:7。
19. 氨基和羧基 取代(或酯化)反应 →+CH3CH2OH 提纯脯氨酸
【分析】根据合成路线分析可知,物质A与乙醇在浓硫酸加热的条件下发生酯化反应,生成物质B,B在经过一系列反应得到C(脯氨酸),再经过③④两个过程对脯氨酸进行除杂提纯,从而得到纯净的脯氨酸,据此结合题干可分析解答问题。
【详解】(1)根据α-氨基戊二酸的结构简式可知,该有机物中含有(氨基)和(羧基)两种官能团,故答案为:氨基和羧基;
(2)反应①是物质A与乙醇在浓硫酸加热的条件下发生酯化反应,生成物质B,反应类型为取代(或酯化)反应,故答案为:取代(或酯化)反应;
(3)反应可看作两步,其中间产物的分子式为,且结构中含有五元环,则中间产物的结构简式为,故答案为:→+CH3CH2OH;
(4)合成路线中设计的反应③是五氯酚与脯氨酸反应,反应④是反应③生成的产物脱去五氯酚,故反应③④的目的是提纯脯氨酸,故答案为:提纯脯氨酸。
【点睛】本题的难点是(3),对照分子式可知另一生成物是C2H5OH。
答案第1页,共2页
答案第1页,共2页
同课章节目录
