2.4化学反应的调控同步练习题(含解析)高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.4化学反应的调控同步练习题(含解析)高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 878.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-24 09:45:40 | ||
图片预览




文档简介
2.4化学反应的调控同步练习题
一、选择题
1.一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g) COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 温度/℃ 起始物质的量/mol 平衡物质的量/mol
CO Cl2 COCl2 COCl2
Ⅰ 500 1.0 1.0 0 0.8
Ⅱ 500 1.0 a 0 0.5
Ⅲ 600 0.5 0.5 0.5 0.7
下列说法中正确的是
A.容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B.该反应正反应为吸热反应
C.容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D.若起始时向容器Ⅰ中加入CO 0.8mol、Cl2 0.8mol,达到平衡时CO转化率大于80%
2.某温度下,恒容密闭容器中反应:H2(g)+CO2(g)H2O(g)+CO(g)+Q(Q<0)。已知H2(g)和CO2(g)初始浓度均为0.1mol·L-1,平衡时测得H2浓度为0.04mol·L-1,下列说法错误的是
A.该反应的体系压强始终保持不变
B.v(CO2)保持不变可作为该可逆反应达到平衡状态的标志
C.若平衡时移走CO2,则平衡向逆反应方向移动,逆反应速率减慢
D.若H2(g)、CO2(g)、H2O(g)、CO(g)初始浓度均为0.1mol·L-1,则反应逆向进行
3.下列关于硫酸工业的叙述正确的是
A.从燃烧炉出来的炉气不一定要净化
B.SO2转化为SO3时采用高温,不仅能加快反应速率还能提高SO2的转化率
C.SO2转化为SO3时采用常压,是因为增大压强不会提高SO2的转化率
D.从上图中A口逸出气体的主要成分是:SO2、SO3、O2
4.一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g) pC(g)达到平衡时,维持温度不变,将气体体积缩小到原来的1/2,当达到新的平衡时,气体C的浓度变为原平衡时的2.1倍,则下列说法不正确的是
A.m+n>p B.m+n<p C.平衡向正反应方向移动 D.C的质量分数增加
5.化学与生活密切相关,下列说法错误的是
A.废旧电池中含汞、镉、铅等重金属,不能就地填埋
B.可以用勒夏特列原理解释钠与氯化钾共融制备钾:Na(l)+KCl(l) K(g)+NaCl(l)
C.燃烧木柴时,采用较细木柴并架空有利于燃烧
D.风能、氢能、地热和天然气都是清洁的新能源
6.为实现碳达峰、碳中和,CO2综合利用的技术不断创新。某实验小组研究CO2和CH4反应得到合成气的原理为CO2(g)+CH4(g) 2CO(g)+2H2(g);向2L的恒容密闭容器中充入1mol CH4和1 mol CO2,反应过程中CO2的平衡转化率与温度、压强的关系如图所示。下列有关说法正确的是
A.该反应的ΔH<0
B.压强:p2>p1
C.1100 ℃时,该反应的平衡常数为12.96
D.维持X点温度不变,向容器内再充入0.1mol CH4、0.1mol CO2、0.2 molCO和0.2mol H2,此时,v正 < v逆
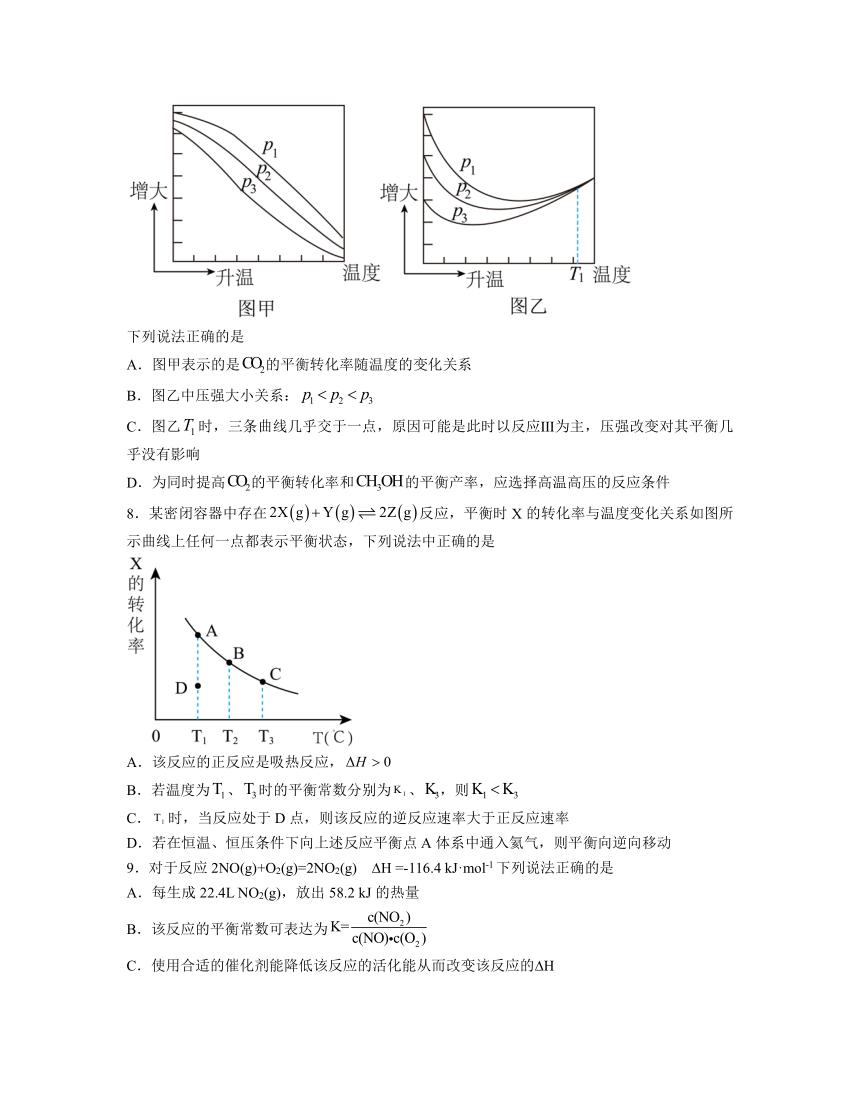
7.以、为原料合成涉及的主要反应如下:
Ⅰ.
Ⅱ.
Ⅲ.
不同压强下,按照投料,实验测定的平衡转化率和的平衡产率随温度的变化关系如图所示。
下列说法正确的是
A.图甲表示的是的平衡转化率随温度的变化关系
B.图乙中压强大小关系:
C.图乙时,三条曲线几乎交于一点,原因可能是此时以反应Ⅲ为主,压强改变对其平衡几乎没有影响
D.为同时提高的平衡转化率和的平衡产率,应选择高温高压的反应条件
8.某密闭容器中存在反应,平衡时X的转化率与温度变化关系如图所示曲线上任何一点都表示平衡状态,下列说法中正确的是
A.该反应的正反应是吸热反应,
B.若温度为、时的平衡常数分别为、,则
C.时,当反应处于D点,则该反应的逆反应速率大于正反应速率
D.若在恒温、恒压条件下向上述反应平衡点A体系中通入氦气,则平衡向逆向移动
9.对于反应2NO(g)+O2(g)=2NO2(g) H =-116.4 kJ·mol-1下列说法正确的是
A.每生成22.4L NO2(g),放出58.2 kJ的热量
B.该反应的平衡常数可表达为
C.使用合适的催化剂能降低该反应的活化能从而改变该反应的 H
D.其他条件相同,增大,则平衡时 NO的转化率升高
10.某温度下,恒容密闭容器内发生反应: ,该温度下,。某时刻,测得容器内、、HI的浓度依次为0.01 mol L、0.01 mol L、0.02 mol L。一段时间后,下列情况与事实相符的是
A.混合气体颜色变深
B.混合气体密度变大
C.氢气的体积分数变小
D.体系从环境中获得热量使反应体系能量升高
11.对于反应CO2(g)+2NH3(g) CO(NH2)2(s)+H2O ,在不同条件的影响下,水蒸气含量随反应时间变化的趋势如下图:
下列判断正确的是
A. B.
C. D.
12.将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经2s后测得SO3的浓度为0.6mol·L-1,下列说法中正确的是
①用O2表示的反应的平均速率为0.6mol·L-1·s-1
②用SO2表示的反应的平均速率为0.3mol·L-1·s-1
③2s时SO2的转化率为15%
④2s时O2的浓度为0.7mol·L-1
A.①③ B.①④ C.②③ D.②④
13.在相同的温度下,已知反应:①N2(g)+O2(g)2NO(g)的平衡常数K=3.84×10-31;②2SO2(g)+O2(g)2SO3(g)的平衡常数K=3.10×1024。则在该温度下,两个化学反应的反应程度之间的关系为
A.①>② B.①<② C.①=② D.不能确定
14.温度为T℃时,向容积为2L的恒容密闭容器中充入一定量和,发生反应:,有关数据如下表所示。下列说法正确的是
反应物 CO
起始时的物质的量/mol 1.2 0.6
平衡时的物质的量/mol 0.9 0.3
A.平衡时,CO和的转化率相等 B.平衡时,反应放出的热量为
C.平衡时,CO的浓度是CO2浓度的3倍 D.T℃时。该反应的平衡常数
15.2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g)2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是
A.v(C)=0.2 mol·L-1·s-1
B.z=3
C.B的转化率为75%
D.反应前后压强之比为7:8
二、填空题
16.在一小烧杯里混合10ml 0.01mol/L FeC13溶液和10ml 0.01mol/L KSCN溶液,溶液立即变为红色。
(1)写出反应的化学方程式:____________。
(2)再向溶液中滴入1mol/LFeC13溶液,现象_______________,平衡向_______反应方向移动,KSCN浓度会________________。
(3)在烧杯中加入KC1固体,颜色___________________,平衡_______移动。
17.氮、碳氧化物的无害化处理是研究的热点。一定条件下发生如下反应:
Ⅰ.
Ⅱ.
完成下列填空:
(1)反应Ⅰ平衡常数的表达式K=_______。
(2)某温度下,反应Ⅰ的,该温度下,测得容器中、、的浓度分别为、、,此时,反应Ⅰ是否处于平衡状态?若不是,预测反应的方向。_______
(3)甲为10L的恒温容器。盛有和1mol CO,发生反应Ⅰ和反应Ⅱ,5min时,测得CO转化率为60%,,则_______mol;0~5min,的平均反应速率_______。
(4)乙为10L的绝热容器。向其中充入和1mol CO,发生反应Ⅰ和反应Ⅱ,乙中反应达到平衡的时间_______甲;此时乙中比甲中_______(以上两空选填“>”“<”或“=”),理由是:_______。
(5)不同压强的密闭容器中,分别充入和1mol CO,发生反应Ⅰ和反应Ⅱ,测得的平衡转化率与温度的关系如图所示。
P1、P2、P3由小到大的顺序为_______;温度高于T0℃时,容器内发生的主要反应为_______(填“Ⅰ”“Ⅱ”或“Ⅰ和Ⅱ”)。
18.在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s 0 1 2 3 4
n(NO)/mol 0.020 0.010 0.008 0.007 0.007
(1)800 ℃,反应达到平衡时,NO的物质的量浓度是_______;升高温度,NO的浓度增大,则该反应是_______(填“放热”或“吸热”)反应。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是_______(填字母)。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
三、计算题
19.把6 molA气体和5 molB气体混合放入4L恒容密闭容器中。在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC.又知在此时D的平均速率为0.15mol L-1 min-1.(要求写出计算过程)
求:
(1)平衡时A的物质的量浓度____;
(2)B的转化率____;
(3)x的值____;
(4)平衡时D的物质的量分数____;
(5)反应前后压强比(分数表示) ____
(6)平衡常数K____
20.某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A、B、C均为气体)
(1)该反应的化学方程式为__________________。
(2)2分钟内A的平均速率__________。
(3)平衡时B的转化率__________。
四、实验题
21.氢化铝锂(LiAlH4)是一种极强的还原剂,在干燥空气中较稳定,在潮湿的空气中会发生剧烈水解,释放大量的H2并燃烧。某实验小组采用LiH和AlCl3的乙醚溶液进行反应,温度控制在28~31 ℃,反应完全后过滤氯化锂沉淀,再将过滤后的氢化铝锂乙醚溶液加苯蒸馏,得到氢化铝锂产品,实验装置如图1所示。已知:乙醚(沸点:34.6 ℃)在空气的作用下能被氧化成过氧化物、醛和乙酸,当乙醚中含有过氧化物时,蒸发后所分离残留的过氧化物加热到100 ℃以上时能引起强烈爆炸。
(1)仪器a的名称是_______。制取LiAlH4的实验原理_______(用化学方程式表示)。
(2)反应温度控制在28~31℃的原因是_______。
(3)制备LiAlH4要在非水溶液中进行,原因是_______(用化学方程式表示)。
(4)指出该实验装置可能存在的缺点:_______。
(5)氢化铝锂(不含氢化锂)纯度的测定:称取a g LiAlH4样品,按图2所示的装置组装好仪器,倾斜Y形管,将蒸馏水(掺有四氢呋喃)全部注入样品中,在标准状况下,反应前量气管(由碱式滴定管改装而成)读数为V1 mL,反应完毕冷却后,读出量气管读数的操作是_______。假设反应完毕后量气管读数为V2 mL,该样品的纯度为_______(用含a、V1、V2的代数式表示)。
【参考答案】
一、选择题
1.C
解析:A.容器Ⅰ中,5 min时达到平衡状态,则5 min内的平均反应速率为v(CO)==0.32 mol·L-1·min-1,则前5 min的平均反应速率v(CO)>0.32 mol·L-1·min-1,A不正确;
B.采用一边倒,容器Ⅲ中若COCl2的起始物质的量为0,则CO、Cl2的起始量都为1mol,比较容器Ⅰ与Ⅲ,Ⅲ相当于Ⅰ升温,而平衡时COCl2的物质的量减小,则平衡逆向移动,该反应正反应为放热反应,B不正确;
C.容器Ⅱ与容器Ⅰ温度相同,平衡常数相同,容器Ⅰ中,K==10,则容器Ⅱ中,K=,a=0.55mol,从而得出Ⅱ中起始时Cl2的物质的量为0.55 mol,C正确;
D.表中容器Ⅰ达平衡时,CO的转化率为80%,若起始时向容器Ⅰ中加入CO 0.8mol、Cl2 0.8mol,相当于表中的容器Ⅰ中平衡体系减小压强,则平衡逆向移动,达到平衡时CO转化率小于80%,D不正确;
故选C。
2.D
解析:A.反应为气体分子数不变的反应,反应的体系压强始终保持不变,A正确;
B.v(CO2)保持不变,说明平衡不再移动,可作为该可逆反应达到平衡状态的标志,B正确;
C.若平衡时移走CO2,则平衡向逆反应方向移动,物质浓度减小,逆反应速率减慢,C正确;
D.
则K=,若H2(g)、CO2(g)、H2O(g)、CO(g)初始浓度均为0.1mol·L-1,则Q=1故选D。
3.A
解析:A.若以黄铁矿为原料生产SO2,因为所含的杂质会使催化剂中毒,所以必须要净化炉气,若以硫磺为原料生产SO2,因为其中所含的杂质很少,不需要净化,故A正确;
B.SO2转化为SO3是放热反应,SO2转化为SO3时采用高温,平衡会逆向移动,降低了SO2的转化率,故B错误;
C.SO2转化为SO3时增大压强,平衡将正向移动,会提高SO2的转化率,故C错误,之所以SO2转化为SO3时采用常压,是因为高压条件比较苛刻,一般不采用。故C错误;
D.从上图中A口逸出气体的主要成分是:SO2、O2,故D错误;
答案为A。
4.B
【分析】平衡后将气体体积缩小到原来的1/2,压强增大,如果平衡不移动,则达到平衡时C的浓度为原来的2倍,而此时C的浓度为原来的2.1倍,说明增大压强平衡向正反应反应方向移动,正反应方向是气体体积减小的反应,据此分析解答。
解析:A.正反应方向是气体体积减小的反应,则m+n>p,A正确;
B.根据A的分析可知,m+n>p,,B错误;
C.根据上述分析,增大压强平衡向正反应方向移动,C正确;
D.平衡向正反应方向移动,C的质量分数增加,D正确;
故答案选B。
5.D
解析:A. 废旧电池中含汞、镉、铅等重金属,不能就地填埋,否则会污染环境,故A正确;
B. 钠与氯化钾共融制备钾:Na(l)+KCl(l) K(g)+NaCl(l)是可逆反应,存在平衡,则可用勒夏特列原理解释,故B正确;
C. 燃烧木柴时,采用较细木柴并架空有利于空气流通,更有利于燃烧,故C正确;
D. 风能、氢能、地热是清洁的新能源,但天然气不是新能源,是常规能源,故D错误;
答案D。
6.D
解析:A.根据图像,其他条件不变时,升高温度,的转化率增大,平衡正向移动,正反应为吸热反应,A错误;
B.根据反应前后气体分子数增大,其他条件不变时,增大压强,平衡逆向移动,的转化率减小,,B错误;
C.根据三段式: ,,C错误;
D.X点温度不变,向容器内再充入,,反应逆向进行,,D正确;
故选D。
7.C
解析:A.图甲表示温度升高,的平衡产率降低,A项错误;
B.相同温度下,压强越大,的平衡产率越高,因此,B项错误;
C.反应Ⅲ气体体积不变,改变压强不影响的平衡转化率,C项正确;
D.由图甲、乙可知,为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压的反应条件,D项错误;
故选C。
8.D
解析:A.升高温度,一氧化氮的转化率降低,所以平衡向逆反应方向移动,则正反应为放热反应,故A错误;
B.升高温度平衡向逆反应方向移动,平衡常数减小,则K1>K3,故B错误;
C.T1时,当反应处于D点,该反应没有达到平衡状态,NO转化率小于同温度平衡时转化率,要使该反应达到平衡状态,则反应向正反应方向移动,则该反应的正反应速率大于逆反应速率,故C错误;
D.恒温、恒压条件下向上述反应平衡点A体系中通入氦气,体积增大,平衡向逆反应方向移动,故D正确;
故选D。
9.D
解析:A.未注明是否为标准状况,无法确定22.4L NO2的物质的量,A错误;
B.根据平衡常数的定义可知,B错误;
C.催化剂可以降低活化能,但不能改变焓变,C错误;
D.增大,相当于NO不变,增加氧气的量,平衡正向移动,NO的平衡转化率增大,D正确;
综上所述答案为D。
10.C
【分析】某时刻,测得容器内H2、I2、HI的浓度依次为0.01 mol/L、0.01mol/L、0.02mol/L,则<21,即Q<K,所以平衡会正向移动。
解析:A. 由分析可知,平衡正向移动,碘单质会转化成碘化氢,紫红色的碘蒸气浓度减小,所以混合气体的颜色会变浅,故A错误;
B.根据质量守恒定律可知,反应前后气体的质量保持不变,又该反应在恒容密闭容器中进行,由密度定义可知,密度保持不变,故B错误;
C. 由分析可知,平衡正向移动,所以氢气会消耗,体积分数会减小,故C正确;
D. 由题干知,该反应放热,则体系向环境释放热量使,故D错误;
答案为C。
11.B
解析:先拐先平条件高,.升高温度,水蒸气含量降低,平衡逆向移动,逆反应为吸热反应,正反应为放热反应,.答案选B。
12.D
解析:2SO2+O2 2SO3
起始浓度 2 1 0
转化浓度 0.6 0.3 0.6
平衡浓度 1.4 0.7 0.6
①用O2表示的反应的平均速率为0.15mol·L-1·s-1
②用SO2表示的反应的平均速率为0.3mol·L-1·s-1
③2s时SO2的转化率为30%
④2s时O2的浓度为0.7mol·L-1
②、④正确,故选D
13.B
解析:对于一个可逆反应,平衡常数越大,表明反应进行的程度越大。已知反应:①N2(g)+O2(g)2NO(g)的平衡常数K=3.84×10-31;②2SO2(g)+O2(g)2SO3(g)的平衡常数K=3.10×1024,因为3.84×10-31<3.10×1024,所以反应②进行的程度大,故选B。
14.C
解析:A.起始时CO和物质的量不相等,平衡时两者消耗的物质的量相等,因此平衡时,CO和的转化率不相等,故A错误;
B.根据方程式分析消耗1molCO,反应放出41kJ的热量,平衡时,消耗0.3molCO,则反应放出的热量为12.3kJ,故B错误;
C.根据改变量之比等于计量系数之比,消耗CO物质的量为0.3mol,因此生成二氧化碳物质的量为0.3mol,则平衡时CO物质的量是CO2物质的量的3倍,因此平衡时CO浓度是CO2浓度的3倍,故C正确;
D.T℃时,平衡时CO和物质的量分别为0.9mol、0.3mol,生成的二氧化碳和氢气物质的量都为0.3mol,则反应的平衡常数,故D错误。
综上所述,答案为C。
15.C
解析:A.若2 s后,A的转化率为50%,则A的浓度变化量为0.5mol/L,v(A)==0.25 mol·L-1·s-1,根据速率与系数成正比,则v(C)=0.25 mol·L-1·s-1,A项错误;
B.根据速率与系数成正比,,则z=2,B项错误;
C.A的浓度变化量为0.5mol/L,则B转化了1.5mol,则,转化率是75%,C项正确;
D.若2 s后,A、B、、C、D剩余物质的量是1mol、0.5mol、1mol、1mol。同温同体积下,体系压强与气体总物质的量成正比,,D项错误;
故答案选C。
二、填空题
16. FeC13+3KSCN Fe(SCN)3+3KC1 溶液颜色加深 正 减小 不变 不
解析:氯化铁溶液和硫氰化钾溶液反应,溶液立即变为红色,生成了红色的硫氰合铁络合物,加入氯化铁,平衡向正向移动,而加入氯化钾固体,对平衡没有影响,
(1)氯化铁溶液和硫氰化钾溶液反应,溶液立即变为红色,生成了红色的硫氰合铁络合物,化学方程式为FeC13+3KSCN Fe(SCN)3+3KC1,而离子方程式为Fe3++3SCN- Fe(SCN)3;答案为FeC13+3KSCN Fe(SCN)3+3KC1
(2)再向溶液中滴入1mol/LFeC13溶液,增加了反应物的浓度,平衡向正反应方向移动,溶液颜色加深, 平衡移动后KSCN浓度会减小;答案为溶液颜色加深; 正 减小
(3)平衡为Fe3++3SCN- Fe(SCN)3,加入KC1固体,对存在平衡的离子浓度不影响,平衡不移动,溶液颜色不变;答案为不变 不
17.(1)
(2)反应I没有达到平衡状态,因为此时浓度商Qc=0.25>K,生成物偏多,反应向逆反应方向进行
(3) 0.2 2×10-3
(4) < > 反应I和反应II的正反应均为放热反应,乙容器由于处于绝热环境,随着反应的进行乙容器温度高于甲容器,升高温度,平衡向吸热反应方向移动,所以乙容器平衡较甲容器平衡,乙向逆向吸热方向进行程度大,乙容器中N2O的浓度比甲容器中的大,即乙>甲
(5) P1解析:(1)根据化学平衡常数的定义式可得反应的平衡常数表达式为K=;
(2)此时体系内的浓度商Qc=,0.25>0.16,反应I未达到平衡状态,生成物偏多,反应向逆反应方向进行;
(3)设反应I中N2O减少2xmol,反应I的各物质末态量作为反应II对应物质的起始量,CO在反应II中的转化率为60%为已知量,则可列出:,, 解得x=0.1,则n(N2O)=0.4-2×0.1=0.2mol;5min内v(O2)=;
(4)反应I和反应II的正反应均为放热反应,在乙容器中由于处于绝热环境,随着反应的进行乙容器温度高于甲容器,反应速率乙比甲快,达到平衡时间乙比甲用时少,即乙<甲;升高温度,平衡向吸热反应方向移动,因为乙容器温度高于甲容器,所以乙容器平衡较甲容器平衡,乙向逆向吸热方向进行程度大,乙容器中N2O的浓度比甲容器中的大,即乙>甲;
(5)反应I是正反应气体体积增大的反应,当温度一定时,增大压强,反应I平衡向逆反应气体体积减小方向移动,N2O的转化率降低,因此三者压强由小到大的关系是P118. (1) 0.003 5 mol·L-1 放热
(2)c
解析:(1)平衡时,n(NO)=0.007 mol,c(NO)==0.0035 mol·L-1。升高温度,c(NO)增大,则平衡左移,正反应是放热反应。
(2)分离出NO2气体,反应速率减慢,加入催化剂,平衡不移动,升高温度平衡向逆反应方向移动,所以a、b、d均错误。增大反应物O2的浓度,反应速率增大,平衡向正反应方向移动,c正确。
三、计算题
19.75mol/L 20% 3 25% 0.25 mol/L
解析:(1) 由方程式可知每产生2mol的C,反应会消耗3mol的A。由于反应经过5 min后达到化学平衡,此时生成2 molC,则反应消耗了3mol的A,此时还有3molA。则c(A)== 0.75 mol/L,故答案为:0.75mol/L;
(2) 由方程式可知若A反应3mol,则B反应了1mol,所以B的转化率==20%,故答案为:20%;
(3) (3)v(D)= 0.15 mol/( L·min),n(D)= v(D)×△t=0.15 mol/( L·min) ×4L ×5 min=3mol,2: x=2:3.所以x=3,故答案为:3;
(4)由化学方程式可知,
平衡时,,,, ,所以平衡时D的物质的量分数为,故答案为:25%;
(5) 恒容密闭容器中,,所以反应前后压强比为,故答案为:;
(6)由化学反应方程式可知, 平衡时各物质浓度为,,,,,故答案为:0.25 mol/L。
20. 2A(g)+B(g)2C(g) 0.2 mol/(L·min) 50%
解析:(1)由图可知,反应时A、B的物质的量减少,为反应的反应物,C物质的量增大,为反应的生成物,2分钟时A、B、C的物质的量不变,说明反应达到平衡,该反应为可逆反应,0~2分钟内A、B、C的物质的量改变量分别为2mol、1mol、2mol,则该反应的化学方程式为2A(g)+B(g) 2C(g),故答案为:2A(g)+B(g)2C(g);
(2)由图可知,0~2分钟内A的物质的量变化量为2mol,则A的平均速率为0.2 mol/(L·min),故答案为:0.2 mol/(L·min);
(3)由图可知,B的起始物质的量为2mol,平衡时B的物质的量的变化量为1mol,则平衡时B的转化率×100%=50%,故答案为:50%。
四、实验题
21.(1)恒压分液漏斗 4LiH+AlCl3LiAlH4+3LiC1↓
(2)温度过低,反应速率过慢,温度过高会导致乙醚挥发
(3)LiAlH4+4H2O=Al(OH)3↓+LiOH+4H2↑
(4)冷凝管直接与空气相通,会造成空气中的水蒸气进入反应装置,导致安全事故发生
(5) 调节水准管与量气筒至液面相平,平视量气管内凹液面的最低处
解析:温度控制在28~31 ℃,LiH和AlCl3的乙醚溶液进行反应生成LiCl沉淀和LiAlH4,过滤后,LiAlH4乙醚溶液加苯蒸馏得到LiAlH4。
(1)根据仪器a的结构特点知,仪器a的名称为恒压分液漏斗;温度控制在28~31 ℃,LiH和AlCl3的乙醚溶液进行反应生成LiCl沉淀和LiAlH4,反应的化学方程式为4LiH+AlCl3LiAlH4+3LiC1↓;答案为:恒压分液漏斗;4LiH+AlCl3LiAlH4+3LiC1↓。
(2)乙醚的沸点为34.6℃,故反应温度控制在28~31℃的原因是温度过低,反应速率过慢,温度过高会导致乙醚挥发;答案为:温度过低,反应速率过慢,温度过高会导致乙醚挥发。
(3)氢化铝锂(LiAlH4)是一种极强的还原剂,在干燥空气中较稳定,在潮湿的空气中会发生剧烈水解,释放大量的H2并燃烧,LiAlH4与H2O反应放出H2,反应的化学方程式为LiAlH4+4H2O=Al(OH)3↓+LiOH+4H2↑,为防止LiAlH4与H2O反应,制备LiAlH4要在非水溶液中进行;答案为:LiAlH4+4H2O=Al(OH)3↓+LiOH+4H2↑。
(4)LiAlH4在干燥空气中较稳定,在潮湿的空气中会发生剧烈水解,释放大量的H2并燃烧,故蒸个装置需在无水环境中进行,该实验装置可能存在的缺点是冷凝管直接与空气相通,会造成空气中的水蒸气进入反应装置,导致安全事故发生;答案为:冷凝管直接与空气相通,会造成空气中的水蒸气进入反应装置,导致安全事故发生。
(5)本实验通过测定LiAlH4与H2O反应生成H2的体积计算LiAlH4的纯度,测量H2体积的同时还必须测量实验室的温度和压强,为确保H2的温度与实验室温度和压强一致,反应完毕冷却后,读出量气管读数的操作是调节水准管与量气筒至液面相平,平视量气管内凹液面的最低处;该实验在标准状况下,反应前量气管的读数为V1 mL,反应完毕后量气管读数为V2 mL,则收集的H2的体积为(V2-V1)mL,收集H2物质的量为mol,根据反应LiAlH4+4H2O=Al(OH)3↓+LiOH+4H2↑,LiAlH4物质的量为mol,则该样品的纯度为=;答案为:调节水准管与量气筒至液面相平,平视量气管内凹液面的最低处;。
一、选择题
1.一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g) COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 温度/℃ 起始物质的量/mol 平衡物质的量/mol
CO Cl2 COCl2 COCl2
Ⅰ 500 1.0 1.0 0 0.8
Ⅱ 500 1.0 a 0 0.5
Ⅲ 600 0.5 0.5 0.5 0.7
下列说法中正确的是
A.容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B.该反应正反应为吸热反应
C.容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D.若起始时向容器Ⅰ中加入CO 0.8mol、Cl2 0.8mol,达到平衡时CO转化率大于80%
2.某温度下,恒容密闭容器中反应:H2(g)+CO2(g)H2O(g)+CO(g)+Q(Q<0)。已知H2(g)和CO2(g)初始浓度均为0.1mol·L-1,平衡时测得H2浓度为0.04mol·L-1,下列说法错误的是
A.该反应的体系压强始终保持不变
B.v(CO2)保持不变可作为该可逆反应达到平衡状态的标志
C.若平衡时移走CO2,则平衡向逆反应方向移动,逆反应速率减慢
D.若H2(g)、CO2(g)、H2O(g)、CO(g)初始浓度均为0.1mol·L-1,则反应逆向进行
3.下列关于硫酸工业的叙述正确的是
A.从燃烧炉出来的炉气不一定要净化
B.SO2转化为SO3时采用高温,不仅能加快反应速率还能提高SO2的转化率
C.SO2转化为SO3时采用常压,是因为增大压强不会提高SO2的转化率
D.从上图中A口逸出气体的主要成分是:SO2、SO3、O2
4.一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g) pC(g)达到平衡时,维持温度不变,将气体体积缩小到原来的1/2,当达到新的平衡时,气体C的浓度变为原平衡时的2.1倍,则下列说法不正确的是
A.m+n>p B.m+n<p C.平衡向正反应方向移动 D.C的质量分数增加
5.化学与生活密切相关,下列说法错误的是
A.废旧电池中含汞、镉、铅等重金属,不能就地填埋
B.可以用勒夏特列原理解释钠与氯化钾共融制备钾:Na(l)+KCl(l) K(g)+NaCl(l)
C.燃烧木柴时,采用较细木柴并架空有利于燃烧
D.风能、氢能、地热和天然气都是清洁的新能源
6.为实现碳达峰、碳中和,CO2综合利用的技术不断创新。某实验小组研究CO2和CH4反应得到合成气的原理为CO2(g)+CH4(g) 2CO(g)+2H2(g);向2L的恒容密闭容器中充入1mol CH4和1 mol CO2,反应过程中CO2的平衡转化率与温度、压强的关系如图所示。下列有关说法正确的是
A.该反应的ΔH<0
B.压强:p2>p1
C.1100 ℃时,该反应的平衡常数为12.96
D.维持X点温度不变,向容器内再充入0.1mol CH4、0.1mol CO2、0.2 molCO和0.2mol H2,此时,v正 < v逆
7.以、为原料合成涉及的主要反应如下:
Ⅰ.
Ⅱ.
Ⅲ.
不同压强下,按照投料,实验测定的平衡转化率和的平衡产率随温度的变化关系如图所示。
下列说法正确的是
A.图甲表示的是的平衡转化率随温度的变化关系
B.图乙中压强大小关系:
C.图乙时,三条曲线几乎交于一点,原因可能是此时以反应Ⅲ为主,压强改变对其平衡几乎没有影响
D.为同时提高的平衡转化率和的平衡产率,应选择高温高压的反应条件
8.某密闭容器中存在反应,平衡时X的转化率与温度变化关系如图所示曲线上任何一点都表示平衡状态,下列说法中正确的是
A.该反应的正反应是吸热反应,
B.若温度为、时的平衡常数分别为、,则
C.时,当反应处于D点,则该反应的逆反应速率大于正反应速率
D.若在恒温、恒压条件下向上述反应平衡点A体系中通入氦气,则平衡向逆向移动
9.对于反应2NO(g)+O2(g)=2NO2(g) H =-116.4 kJ·mol-1下列说法正确的是
A.每生成22.4L NO2(g),放出58.2 kJ的热量
B.该反应的平衡常数可表达为
C.使用合适的催化剂能降低该反应的活化能从而改变该反应的 H
D.其他条件相同,增大,则平衡时 NO的转化率升高
10.某温度下,恒容密闭容器内发生反应: ,该温度下,。某时刻,测得容器内、、HI的浓度依次为0.01 mol L、0.01 mol L、0.02 mol L。一段时间后,下列情况与事实相符的是
A.混合气体颜色变深
B.混合气体密度变大
C.氢气的体积分数变小
D.体系从环境中获得热量使反应体系能量升高
11.对于反应CO2(g)+2NH3(g) CO(NH2)2(s)+H2O ,在不同条件的影响下,水蒸气含量随反应时间变化的趋势如下图:
下列判断正确的是
A. B.
C. D.
12.将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经2s后测得SO3的浓度为0.6mol·L-1,下列说法中正确的是
①用O2表示的反应的平均速率为0.6mol·L-1·s-1
②用SO2表示的反应的平均速率为0.3mol·L-1·s-1
③2s时SO2的转化率为15%
④2s时O2的浓度为0.7mol·L-1
A.①③ B.①④ C.②③ D.②④
13.在相同的温度下,已知反应:①N2(g)+O2(g)2NO(g)的平衡常数K=3.84×10-31;②2SO2(g)+O2(g)2SO3(g)的平衡常数K=3.10×1024。则在该温度下,两个化学反应的反应程度之间的关系为
A.①>② B.①<② C.①=② D.不能确定
14.温度为T℃时,向容积为2L的恒容密闭容器中充入一定量和,发生反应:,有关数据如下表所示。下列说法正确的是
反应物 CO
起始时的物质的量/mol 1.2 0.6
平衡时的物质的量/mol 0.9 0.3
A.平衡时,CO和的转化率相等 B.平衡时,反应放出的热量为
C.平衡时,CO的浓度是CO2浓度的3倍 D.T℃时。该反应的平衡常数
15.2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g)2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是
A.v(C)=0.2 mol·L-1·s-1
B.z=3
C.B的转化率为75%
D.反应前后压强之比为7:8
二、填空题
16.在一小烧杯里混合10ml 0.01mol/L FeC13溶液和10ml 0.01mol/L KSCN溶液,溶液立即变为红色。
(1)写出反应的化学方程式:____________。
(2)再向溶液中滴入1mol/LFeC13溶液,现象_______________,平衡向_______反应方向移动,KSCN浓度会________________。
(3)在烧杯中加入KC1固体,颜色___________________,平衡_______移动。
17.氮、碳氧化物的无害化处理是研究的热点。一定条件下发生如下反应:
Ⅰ.
Ⅱ.
完成下列填空:
(1)反应Ⅰ平衡常数的表达式K=_______。
(2)某温度下,反应Ⅰ的,该温度下,测得容器中、、的浓度分别为、、,此时,反应Ⅰ是否处于平衡状态?若不是,预测反应的方向。_______
(3)甲为10L的恒温容器。盛有和1mol CO,发生反应Ⅰ和反应Ⅱ,5min时,测得CO转化率为60%,,则_______mol;0~5min,的平均反应速率_______。
(4)乙为10L的绝热容器。向其中充入和1mol CO,发生反应Ⅰ和反应Ⅱ,乙中反应达到平衡的时间_______甲;此时乙中比甲中_______(以上两空选填“>”“<”或“=”),理由是:_______。
(5)不同压强的密闭容器中,分别充入和1mol CO,发生反应Ⅰ和反应Ⅱ,测得的平衡转化率与温度的关系如图所示。
P1、P2、P3由小到大的顺序为_______;温度高于T0℃时,容器内发生的主要反应为_______(填“Ⅰ”“Ⅱ”或“Ⅰ和Ⅱ”)。
18.在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s 0 1 2 3 4
n(NO)/mol 0.020 0.010 0.008 0.007 0.007
(1)800 ℃,反应达到平衡时,NO的物质的量浓度是_______;升高温度,NO的浓度增大,则该反应是_______(填“放热”或“吸热”)反应。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是_______(填字母)。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
三、计算题
19.把6 molA气体和5 molB气体混合放入4L恒容密闭容器中。在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC.又知在此时D的平均速率为0.15mol L-1 min-1.(要求写出计算过程)
求:
(1)平衡时A的物质的量浓度____;
(2)B的转化率____;
(3)x的值____;
(4)平衡时D的物质的量分数____;
(5)反应前后压强比(分数表示) ____
(6)平衡常数K____
20.某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A、B、C均为气体)
(1)该反应的化学方程式为__________________。
(2)2分钟内A的平均速率__________。
(3)平衡时B的转化率__________。
四、实验题
21.氢化铝锂(LiAlH4)是一种极强的还原剂,在干燥空气中较稳定,在潮湿的空气中会发生剧烈水解,释放大量的H2并燃烧。某实验小组采用LiH和AlCl3的乙醚溶液进行反应,温度控制在28~31 ℃,反应完全后过滤氯化锂沉淀,再将过滤后的氢化铝锂乙醚溶液加苯蒸馏,得到氢化铝锂产品,实验装置如图1所示。已知:乙醚(沸点:34.6 ℃)在空气的作用下能被氧化成过氧化物、醛和乙酸,当乙醚中含有过氧化物时,蒸发后所分离残留的过氧化物加热到100 ℃以上时能引起强烈爆炸。
(1)仪器a的名称是_______。制取LiAlH4的实验原理_______(用化学方程式表示)。
(2)反应温度控制在28~31℃的原因是_______。
(3)制备LiAlH4要在非水溶液中进行,原因是_______(用化学方程式表示)。
(4)指出该实验装置可能存在的缺点:_______。
(5)氢化铝锂(不含氢化锂)纯度的测定:称取a g LiAlH4样品,按图2所示的装置组装好仪器,倾斜Y形管,将蒸馏水(掺有四氢呋喃)全部注入样品中,在标准状况下,反应前量气管(由碱式滴定管改装而成)读数为V1 mL,反应完毕冷却后,读出量气管读数的操作是_______。假设反应完毕后量气管读数为V2 mL,该样品的纯度为_______(用含a、V1、V2的代数式表示)。
【参考答案】
一、选择题
1.C
解析:A.容器Ⅰ中,5 min时达到平衡状态,则5 min内的平均反应速率为v(CO)==0.32 mol·L-1·min-1,则前5 min的平均反应速率v(CO)>0.32 mol·L-1·min-1,A不正确;
B.采用一边倒,容器Ⅲ中若COCl2的起始物质的量为0,则CO、Cl2的起始量都为1mol,比较容器Ⅰ与Ⅲ,Ⅲ相当于Ⅰ升温,而平衡时COCl2的物质的量减小,则平衡逆向移动,该反应正反应为放热反应,B不正确;
C.容器Ⅱ与容器Ⅰ温度相同,平衡常数相同,容器Ⅰ中,K==10,则容器Ⅱ中,K=,a=0.55mol,从而得出Ⅱ中起始时Cl2的物质的量为0.55 mol,C正确;
D.表中容器Ⅰ达平衡时,CO的转化率为80%,若起始时向容器Ⅰ中加入CO 0.8mol、Cl2 0.8mol,相当于表中的容器Ⅰ中平衡体系减小压强,则平衡逆向移动,达到平衡时CO转化率小于80%,D不正确;
故选C。
2.D
解析:A.反应为气体分子数不变的反应,反应的体系压强始终保持不变,A正确;
B.v(CO2)保持不变,说明平衡不再移动,可作为该可逆反应达到平衡状态的标志,B正确;
C.若平衡时移走CO2,则平衡向逆反应方向移动,物质浓度减小,逆反应速率减慢,C正确;
D.
则K=,若H2(g)、CO2(g)、H2O(g)、CO(g)初始浓度均为0.1mol·L-1,则Q=1
3.A
解析:A.若以黄铁矿为原料生产SO2,因为所含的杂质会使催化剂中毒,所以必须要净化炉气,若以硫磺为原料生产SO2,因为其中所含的杂质很少,不需要净化,故A正确;
B.SO2转化为SO3是放热反应,SO2转化为SO3时采用高温,平衡会逆向移动,降低了SO2的转化率,故B错误;
C.SO2转化为SO3时增大压强,平衡将正向移动,会提高SO2的转化率,故C错误,之所以SO2转化为SO3时采用常压,是因为高压条件比较苛刻,一般不采用。故C错误;
D.从上图中A口逸出气体的主要成分是:SO2、O2,故D错误;
答案为A。
4.B
【分析】平衡后将气体体积缩小到原来的1/2,压强增大,如果平衡不移动,则达到平衡时C的浓度为原来的2倍,而此时C的浓度为原来的2.1倍,说明增大压强平衡向正反应反应方向移动,正反应方向是气体体积减小的反应,据此分析解答。
解析:A.正反应方向是气体体积减小的反应,则m+n>p,A正确;
B.根据A的分析可知,m+n>p,,B错误;
C.根据上述分析,增大压强平衡向正反应方向移动,C正确;
D.平衡向正反应方向移动,C的质量分数增加,D正确;
故答案选B。
5.D
解析:A. 废旧电池中含汞、镉、铅等重金属,不能就地填埋,否则会污染环境,故A正确;
B. 钠与氯化钾共融制备钾:Na(l)+KCl(l) K(g)+NaCl(l)是可逆反应,存在平衡,则可用勒夏特列原理解释,故B正确;
C. 燃烧木柴时,采用较细木柴并架空有利于空气流通,更有利于燃烧,故C正确;
D. 风能、氢能、地热是清洁的新能源,但天然气不是新能源,是常规能源,故D错误;
答案D。
6.D
解析:A.根据图像,其他条件不变时,升高温度,的转化率增大,平衡正向移动,正反应为吸热反应,A错误;
B.根据反应前后气体分子数增大,其他条件不变时,增大压强,平衡逆向移动,的转化率减小,,B错误;
C.根据三段式: ,,C错误;
D.X点温度不变,向容器内再充入,,反应逆向进行,,D正确;
故选D。
7.C
解析:A.图甲表示温度升高,的平衡产率降低,A项错误;
B.相同温度下,压强越大,的平衡产率越高,因此,B项错误;
C.反应Ⅲ气体体积不变,改变压强不影响的平衡转化率,C项正确;
D.由图甲、乙可知,为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压的反应条件,D项错误;
故选C。
8.D
解析:A.升高温度,一氧化氮的转化率降低,所以平衡向逆反应方向移动,则正反应为放热反应,故A错误;
B.升高温度平衡向逆反应方向移动,平衡常数减小,则K1>K3,故B错误;
C.T1时,当反应处于D点,该反应没有达到平衡状态,NO转化率小于同温度平衡时转化率,要使该反应达到平衡状态,则反应向正反应方向移动,则该反应的正反应速率大于逆反应速率,故C错误;
D.恒温、恒压条件下向上述反应平衡点A体系中通入氦气,体积增大,平衡向逆反应方向移动,故D正确;
故选D。
9.D
解析:A.未注明是否为标准状况,无法确定22.4L NO2的物质的量,A错误;
B.根据平衡常数的定义可知,B错误;
C.催化剂可以降低活化能,但不能改变焓变,C错误;
D.增大,相当于NO不变,增加氧气的量,平衡正向移动,NO的平衡转化率增大,D正确;
综上所述答案为D。
10.C
【分析】某时刻,测得容器内H2、I2、HI的浓度依次为0.01 mol/L、0.01mol/L、0.02mol/L,则<21,即Q<K,所以平衡会正向移动。
解析:A. 由分析可知,平衡正向移动,碘单质会转化成碘化氢,紫红色的碘蒸气浓度减小,所以混合气体的颜色会变浅,故A错误;
B.根据质量守恒定律可知,反应前后气体的质量保持不变,又该反应在恒容密闭容器中进行,由密度定义可知,密度保持不变,故B错误;
C. 由分析可知,平衡正向移动,所以氢气会消耗,体积分数会减小,故C正确;
D. 由题干知,该反应放热,则体系向环境释放热量使,故D错误;
答案为C。
11.B
解析:先拐先平条件高,.升高温度,水蒸气含量降低,平衡逆向移动,逆反应为吸热反应,正反应为放热反应,.答案选B。
12.D
解析:2SO2+O2 2SO3
起始浓度 2 1 0
转化浓度 0.6 0.3 0.6
平衡浓度 1.4 0.7 0.6
①用O2表示的反应的平均速率为0.15mol·L-1·s-1
②用SO2表示的反应的平均速率为0.3mol·L-1·s-1
③2s时SO2的转化率为30%
④2s时O2的浓度为0.7mol·L-1
②、④正确,故选D
13.B
解析:对于一个可逆反应,平衡常数越大,表明反应进行的程度越大。已知反应:①N2(g)+O2(g)2NO(g)的平衡常数K=3.84×10-31;②2SO2(g)+O2(g)2SO3(g)的平衡常数K=3.10×1024,因为3.84×10-31<3.10×1024,所以反应②进行的程度大,故选B。
14.C
解析:A.起始时CO和物质的量不相等,平衡时两者消耗的物质的量相等,因此平衡时,CO和的转化率不相等,故A错误;
B.根据方程式分析消耗1molCO,反应放出41kJ的热量,平衡时,消耗0.3molCO,则反应放出的热量为12.3kJ,故B错误;
C.根据改变量之比等于计量系数之比,消耗CO物质的量为0.3mol,因此生成二氧化碳物质的量为0.3mol,则平衡时CO物质的量是CO2物质的量的3倍,因此平衡时CO浓度是CO2浓度的3倍,故C正确;
D.T℃时,平衡时CO和物质的量分别为0.9mol、0.3mol,生成的二氧化碳和氢气物质的量都为0.3mol,则反应的平衡常数,故D错误。
综上所述,答案为C。
15.C
解析:A.若2 s后,A的转化率为50%,则A的浓度变化量为0.5mol/L,v(A)==0.25 mol·L-1·s-1,根据速率与系数成正比,则v(C)=0.25 mol·L-1·s-1,A项错误;
B.根据速率与系数成正比,,则z=2,B项错误;
C.A的浓度变化量为0.5mol/L,则B转化了1.5mol,则,转化率是75%,C项正确;
D.若2 s后,A、B、、C、D剩余物质的量是1mol、0.5mol、1mol、1mol。同温同体积下,体系压强与气体总物质的量成正比,,D项错误;
故答案选C。
二、填空题
16. FeC13+3KSCN Fe(SCN)3+3KC1 溶液颜色加深 正 减小 不变 不
解析:氯化铁溶液和硫氰化钾溶液反应,溶液立即变为红色,生成了红色的硫氰合铁络合物,加入氯化铁,平衡向正向移动,而加入氯化钾固体,对平衡没有影响,
(1)氯化铁溶液和硫氰化钾溶液反应,溶液立即变为红色,生成了红色的硫氰合铁络合物,化学方程式为FeC13+3KSCN Fe(SCN)3+3KC1,而离子方程式为Fe3++3SCN- Fe(SCN)3;答案为FeC13+3KSCN Fe(SCN)3+3KC1
(2)再向溶液中滴入1mol/LFeC13溶液,增加了反应物的浓度,平衡向正反应方向移动,溶液颜色加深, 平衡移动后KSCN浓度会减小;答案为溶液颜色加深; 正 减小
(3)平衡为Fe3++3SCN- Fe(SCN)3,加入KC1固体,对存在平衡的离子浓度不影响,平衡不移动,溶液颜色不变;答案为不变 不
17.(1)
(2)反应I没有达到平衡状态,因为此时浓度商Qc=0.25>K,生成物偏多,反应向逆反应方向进行
(3) 0.2 2×10-3
(4) < > 反应I和反应II的正反应均为放热反应,乙容器由于处于绝热环境,随着反应的进行乙容器温度高于甲容器,升高温度,平衡向吸热反应方向移动,所以乙容器平衡较甲容器平衡,乙向逆向吸热方向进行程度大,乙容器中N2O的浓度比甲容器中的大,即乙>甲
(5) P1
(2)此时体系内的浓度商Qc=,0.25>0.16,反应I未达到平衡状态,生成物偏多,反应向逆反应方向进行;
(3)设反应I中N2O减少2xmol,反应I的各物质末态量作为反应II对应物质的起始量,CO在反应II中的转化率为60%为已知量,则可列出:,, 解得x=0.1,则n(N2O)=0.4-2×0.1=0.2mol;5min内v(O2)=;
(4)反应I和反应II的正反应均为放热反应,在乙容器中由于处于绝热环境,随着反应的进行乙容器温度高于甲容器,反应速率乙比甲快,达到平衡时间乙比甲用时少,即乙<甲;升高温度,平衡向吸热反应方向移动,因为乙容器温度高于甲容器,所以乙容器平衡较甲容器平衡,乙向逆向吸热方向进行程度大,乙容器中N2O的浓度比甲容器中的大,即乙>甲;
(5)反应I是正反应气体体积增大的反应,当温度一定时,增大压强,反应I平衡向逆反应气体体积减小方向移动,N2O的转化率降低,因此三者压强由小到大的关系是P1
(2)c
解析:(1)平衡时,n(NO)=0.007 mol,c(NO)==0.0035 mol·L-1。升高温度,c(NO)增大,则平衡左移,正反应是放热反应。
(2)分离出NO2气体,反应速率减慢,加入催化剂,平衡不移动,升高温度平衡向逆反应方向移动,所以a、b、d均错误。增大反应物O2的浓度,反应速率增大,平衡向正反应方向移动,c正确。
三、计算题
19.75mol/L 20% 3 25% 0.25 mol/L
解析:(1) 由方程式可知每产生2mol的C,反应会消耗3mol的A。由于反应经过5 min后达到化学平衡,此时生成2 molC,则反应消耗了3mol的A,此时还有3molA。则c(A)== 0.75 mol/L,故答案为:0.75mol/L;
(2) 由方程式可知若A反应3mol,则B反应了1mol,所以B的转化率==20%,故答案为:20%;
(3) (3)v(D)= 0.15 mol/( L·min),n(D)= v(D)×△t=0.15 mol/( L·min) ×4L ×5 min=3mol,2: x=2:3.所以x=3,故答案为:3;
(4)由化学方程式可知,
平衡时,,,, ,所以平衡时D的物质的量分数为,故答案为:25%;
(5) 恒容密闭容器中,,所以反应前后压强比为,故答案为:;
(6)由化学反应方程式可知, 平衡时各物质浓度为,,,,,故答案为:0.25 mol/L。
20. 2A(g)+B(g)2C(g) 0.2 mol/(L·min) 50%
解析:(1)由图可知,反应时A、B的物质的量减少,为反应的反应物,C物质的量增大,为反应的生成物,2分钟时A、B、C的物质的量不变,说明反应达到平衡,该反应为可逆反应,0~2分钟内A、B、C的物质的量改变量分别为2mol、1mol、2mol,则该反应的化学方程式为2A(g)+B(g) 2C(g),故答案为:2A(g)+B(g)2C(g);
(2)由图可知,0~2分钟内A的物质的量变化量为2mol,则A的平均速率为0.2 mol/(L·min),故答案为:0.2 mol/(L·min);
(3)由图可知,B的起始物质的量为2mol,平衡时B的物质的量的变化量为1mol,则平衡时B的转化率×100%=50%,故答案为:50%。
四、实验题
21.(1)恒压分液漏斗 4LiH+AlCl3LiAlH4+3LiC1↓
(2)温度过低,反应速率过慢,温度过高会导致乙醚挥发
(3)LiAlH4+4H2O=Al(OH)3↓+LiOH+4H2↑
(4)冷凝管直接与空气相通,会造成空气中的水蒸气进入反应装置,导致安全事故发生
(5) 调节水准管与量气筒至液面相平,平视量气管内凹液面的最低处
解析:温度控制在28~31 ℃,LiH和AlCl3的乙醚溶液进行反应生成LiCl沉淀和LiAlH4,过滤后,LiAlH4乙醚溶液加苯蒸馏得到LiAlH4。
(1)根据仪器a的结构特点知,仪器a的名称为恒压分液漏斗;温度控制在28~31 ℃,LiH和AlCl3的乙醚溶液进行反应生成LiCl沉淀和LiAlH4,反应的化学方程式为4LiH+AlCl3LiAlH4+3LiC1↓;答案为:恒压分液漏斗;4LiH+AlCl3LiAlH4+3LiC1↓。
(2)乙醚的沸点为34.6℃,故反应温度控制在28~31℃的原因是温度过低,反应速率过慢,温度过高会导致乙醚挥发;答案为:温度过低,反应速率过慢,温度过高会导致乙醚挥发。
(3)氢化铝锂(LiAlH4)是一种极强的还原剂,在干燥空气中较稳定,在潮湿的空气中会发生剧烈水解,释放大量的H2并燃烧,LiAlH4与H2O反应放出H2,反应的化学方程式为LiAlH4+4H2O=Al(OH)3↓+LiOH+4H2↑,为防止LiAlH4与H2O反应,制备LiAlH4要在非水溶液中进行;答案为:LiAlH4+4H2O=Al(OH)3↓+LiOH+4H2↑。
(4)LiAlH4在干燥空气中较稳定,在潮湿的空气中会发生剧烈水解,释放大量的H2并燃烧,故蒸个装置需在无水环境中进行,该实验装置可能存在的缺点是冷凝管直接与空气相通,会造成空气中的水蒸气进入反应装置,导致安全事故发生;答案为:冷凝管直接与空气相通,会造成空气中的水蒸气进入反应装置,导致安全事故发生。
(5)本实验通过测定LiAlH4与H2O反应生成H2的体积计算LiAlH4的纯度,测量H2体积的同时还必须测量实验室的温度和压强,为确保H2的温度与实验室温度和压强一致,反应完毕冷却后,读出量气管读数的操作是调节水准管与量气筒至液面相平,平视量气管内凹液面的最低处;该实验在标准状况下,反应前量气管的读数为V1 mL,反应完毕后量气管读数为V2 mL,则收集的H2的体积为(V2-V1)mL,收集H2物质的量为mol,根据反应LiAlH4+4H2O=Al(OH)3↓+LiOH+4H2↑,LiAlH4物质的量为mol,则该样品的纯度为=;答案为:调节水准管与量气筒至液面相平,平视量气管内凹液面的最低处;。
