第三章《晶体结构与性质》测试题(含解析)高二下学期人教版(2019)化学选择性必修2
文档属性
| 名称 | 第三章《晶体结构与性质》测试题(含解析)高二下学期人教版(2019)化学选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-24 09:54:24 | ||
图片预览



文档简介
第三章《晶体结构与性质》测试题
一、单选题(共12题)
1.下列性质适合于离子晶体的是
A.熔点1070℃,易溶于水,水溶液能导电
B.熔点10.31℃,液态不导电,水溶液能导电
C.熔点97.81℃,质软,导电,密度0.97g·cm-3
D.熔点3900℃,硬度很大,不导电
2.氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法,正确的是
A.立方相氮化硼含有σ键和π键,所以硬度大
B.六方相氮化硼层结构与石墨相似却不导电,原因是层状结构中没有自由移动的电子
C.两种晶体中的B原子的杂化类型相同
D.两种晶体均为分子晶体
3.向CuSO4溶液中加入稀氨水至沉淀刚好溶解,若所得溶液中只有一种溶质,该溶质是( )
A.[Cu(H2O)4]SO4 B.Cu(OH)2 C.[Cu(NH3)4](OH)2 D.[Cu(NH3)4]SO4
4.氮氧化铝(AlON)是一种透明高硬度防弹材料,硬度为石英玻璃的 4 倍,可耐 120 摄氏度的高温。下列描述错误的是( )
A.AlON 和石英的化学键类型相同 B.AlON 和石英晶体类型相同
C.AlON 和 NaCl 的化学键类型不同 D.AlON 和 NaCl 晶体类型相同
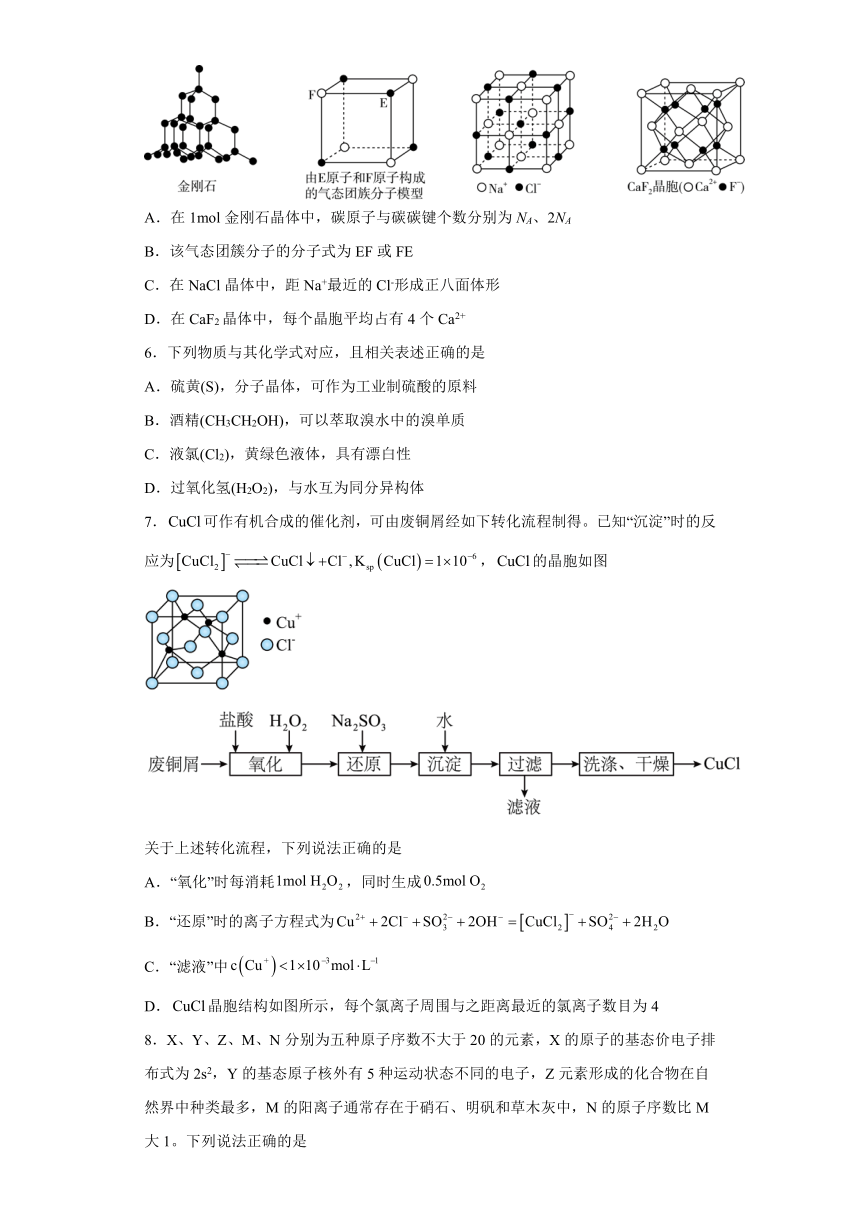
5.NA表示阿伏加德罗常数,有关晶体的结构如图所示,下列说法中不正确的是
A.在1mol金刚石晶体中,碳原子与碳碳键个数分别为NA、2NA
B.该气态团簇分子的分子式为EF或FE
C.在NaCl晶体中,距Na+最近的Cl-形成正八面体形
D.在CaF2晶体中,每个晶胞平均占有4个Ca2+
6.下列物质与其化学式对应,且相关表述正确的是
A.硫黄(S),分子晶体,可作为工业制硫酸的原料
B.酒精(CH3CH2OH),可以萃取溴水中的溴单质
C.液氯(Cl2),黄绿色液体,具有漂白性
D.过氧化氢(H2O2),与水互为同分异构体
7.可作有机合成的催化剂,可由废铜屑经如下转化流程制得。已知“沉淀”时的反应为,的晶胞如图
关于上述转化流程,下列说法正确的是
A.“氧化”时每消耗,同时生成
B.“还原”时的离子方程式为
C.“滤液”中
D.晶胞结构如图所示,每个氯离子周围与之距离最近的氯离子数目为4
8.X、Y、Z、M、N分别为五种原子序数不大于20的元素,X的原子的基态价电子排布式为2s2,Y的基态原子核外有5种运动状态不同的电子,Z元素形成的化合物在自然界中种类最多,M的阳离子通常存在于硝石、明矾和草木灰中,N的原子序数比M大1。下列说法正确的是
A.熔点:Y4Z晶体低于单质Z
B.X与Al的某些化学性质相似,XO是两性氧化物
C.M的阳离子半径是同周期主族元素的简单离子中半径最大的
D.NZ2仅含离子键,可用于制备乙炔
9.的晶胞结构如图所示。下列说法不正确的是
A.属于离子晶体
B.每个晶胞中平均含有4个和4个
C.每个周围有6个紧邻的和6个紧邻的
D.和间存在较强的离子键,因此具有较高的熔点
10.下列关于物质结构的说法正确的是
A.氯化钠晶体是由钠离子和氯离子构成的,常温下能够导电
B.白磷分子为正四面体结构,分子相当稳定,不容易发生反应
C.金刚石与石墨结构、性质不同,互为同素异形体
D.与互为同位素
11.下列固体熔化时,需要破坏共价键的是
A.金刚石 B.冰 C.氢氧化钠 D.金属铜
12.下列晶体的分类正确的一组是
选项 离子晶体 原子晶体 分子晶体 金属晶体
A 石墨 Ar Hg
B 金刚石 Ag
C SiC Mg
D Si NaH
A.A B.B C.C D.D
二、非选择题(共10题)
13.足球烯(footballene,C60)分子形成的晶体是人们发现的又一种碳的单质形态,其晶体结构如图所示。C60与金刚石、石墨等都是碳的_______。C60晶体与金刚石相比,金刚石的熔点较高,理由是________。
14.填空。
(1)工业上电解制取单质铝,常利用冰晶石降低的熔点。冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在_______(填字母)。
a.离子键 b.极性键 c.配位键 d.范德华力
(2)的晶体结构如下图所示,其中原子坐标参数A为,B为,则C原子坐标参数为_______。
15.数十亿年来,地球上的物质不断地发生变化,大气的成分也发生了很大变化。下表是原始大气和目前空气的成分:
空气的成分 N2、O2、CO2、水蒸气及稀有气体He、Ne等
原始大气 的成分 CH4、NH3、CO、CO2等
用上表所涉及的分子填写下列空白。
(1)含有10个电子的化学式有(填化学式,下同)________。
(2)由极性键构成的非极性分子有________。
(3)与H+可直接形成配位键的分子有________。
(4)分子中不含孤电子对的分子(除稀有气体外)有_______,它的立体构型为______。
(5)CO的结构可表示为OC,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
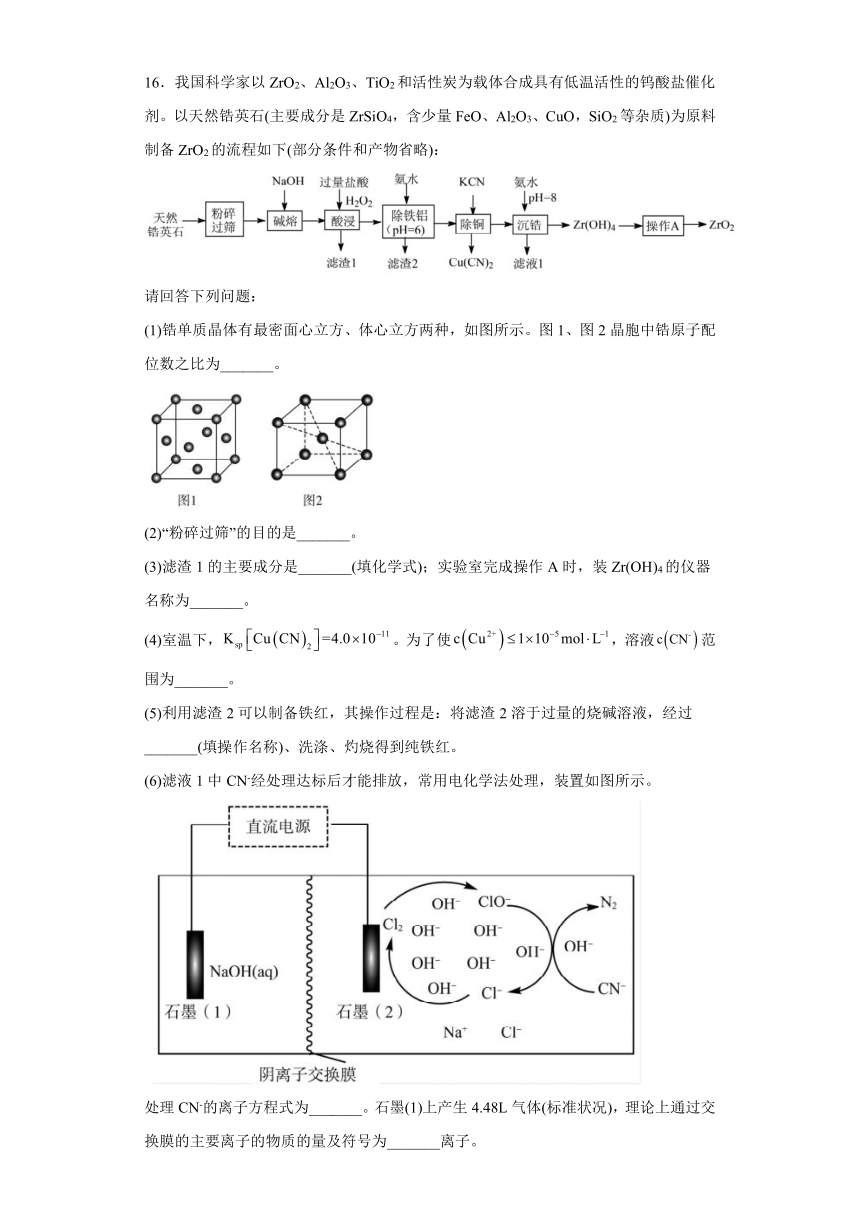
16.我国科学家以ZrO2、Al2O3、TiO2和活性炭为载体合成具有低温活性的钨酸盐催化剂。以天然锆英石(主要成分是ZrSiO4,含少量FeO、Al2O3、CuO,SiO2等杂质)为原料制备ZrO2的流程如下(部分条件和产物省略):
请回答下列问题:
(1)锆单质晶体有最密面心立方、体心立方两种,如图所示。图1、图2晶胞中锆原子配位数之比为_______。
(2)“粉碎过筛”的目的是_______。
(3)滤渣1的主要成分是_______(填化学式);实验室完成操作A时,装Zr(OH)4的仪器名称为_______。
(4)室温下,。为了使,溶液范围为_______。
(5)利用滤渣2可以制备铁红,其操作过程是:将滤渣2溶于过量的烧碱溶液,经过_______(填操作名称)、洗涤、灼烧得到纯铁红。
(6)滤液1中CN-经处理达标后才能排放,常用电化学法处理,装置如图所示。
处理CN-的离子方程式为_______。石墨(1)上产生4.48L气体(标准状况),理论上通过交换膜的主要离子的物质的量及符号为_______离子。
17.铁的常见化合价有+2、+3,在很强的氧化剂作用下也可形成不稳定的+6价高铁酸盐。
Ⅰ.实验室以为原料制备高密度磁记录材料Fe/复合物,装置如图所示。在氩气气氛中,向装有50mL的三颈烧瓶中逐滴加入100mL,100℃下搅拌回流3h,得到成分为Fe和的黑色沉淀。
待三颈烧瓶中的混合物冷却后,过滤,再依次用沸水和乙醇洗涤,40℃干燥后焙烧3h,得到Fe/复合物产品3.24g。
完成下列填空:
(1)三颈烧瓶内发生反应的离子方程式为_______;检验反应是否进行完全的操作是_______。
(2)焙烧需在隔绝空气条件下进行,原因是_______,实验所得产品的产率为_______。
Ⅱ.已知:为共价化合物,熔点是306℃,易水解:
的平衡常数。
(3)的晶体类型属于_______。
(4)向中加入以除去杂质,为使溶液中c(Fe3+)≤10-6mol/L,则溶液中c(OH-)≥_____mol/L。用平衡移动原理解释除杂原理。_______。
18.TiO2-aNb、Cu(In1-xGaxSe2)是常见的光学活性物质。请回答下列问题:TiO2通过氮掺杂反应生成TiO2-aNb,表示如图。
①立方晶系TiO2晶胞参数如图甲所示,其晶体的密度为_______g·cm-3。
②图乙TiO2-aNb晶体中a:b=_______。
19.填空。
(1)某镍铜合金的立方晶胞结构如图所示。若该晶胞的棱长为anm(1nm=1×10-7cm),ρ=_______g·cm-3(NA表示阿伏加德罗常数,列出计算式)。
(2)已知室温时,Ksp[Mg(OH)2]=4.0×10 11.在0.1mol/L的MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时,溶液的pH是_______(已知lg2=0.3)。(已知:当溶液中离子浓度小于1×10-5mol/L时认为沉淀完全)
20.据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成碳的含氧衍生物,钴晶胞、白铜(铜镍合金)晶胞如图所示,请回答下列问题:
①钴晶胞堆积方式的名称为_______。
②已知白铜晶胞的密度为dg·cm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为_______pm(只列出计算式)。
21.羟基亚乙基二磷酸(HEDPA,结构式如下,可简写为H4L)可在较宽的pH范围内与金属离子或原子形成稳定的配合物,是一种常用的配体,主要用作工业循环冷却水的缓蚀阻垢剂和无氰电镀的络合剂,与188Re所形成的188Re-HEDPA可用于治疗转移性骨癌。HEDPA和Mn2+可在一定的pH值和Mn2+/HEDPA配比下形成配合物A,将该配合物加热,在250°C以上样品失重25.80%,脱水结束后对残余物之进行元素分析,配合物A的元素含量为:Mn(15.74%)、C(6.88%)、H(4.62%)、O(55.01%)、P(17.77%)。
(1)根据元素分析数据,推证配合物A的分子式为____。
(2)画出该配合物的结构示意图,并在图上注明HEDPA中哪些原子可为配位原子?(用*表示)____。
(3)实验测得配合物A的磁矩为6.12μ0,配合物未成对电子数为___,中心原子的杂化轨道类型是____。
(4)如何将合成A的条件作修改,可得到多核配合物___,写出2种该多核配合物的分子式__。
(5)已知配合物[Mn(H2O)6]2+的d-d跃迁在400nm-550nm范围内有弱的吸收,配合物呈肉粉色,在水溶液中形成配合物后,中心离子的晶体场分裂能将发生怎样的变化____。观察配合物的颜色明显加深,为什么?___。
22.元素周期表中的六种元素X、Y、Z、W、M、N的原子序数依次增大,其中前五种均为短周期主族元素。X原子只有一个自旋电子,Y在同周期元素中含有的未成对电子数最多,元素Z的原子最外层电子数是其内层电子数的3倍,元素W基态原子的3p轨道上有4个电子,N为27号元素。回答下列问题:
(1)的基态原子的电子排布式为___________。
(2)的电子式为___________,其晶体类型为___________。
(3)是制备杀虫剂的中间体,其结构与相似,为___________(填“极性”或“非极性”)分子。
(4)、、可作为配合物的配体。
①在配合物中,提供空轨道的是___________(写离子符号),1mol该配合物中含有的σ键数目为___________。
②在配合物中,配体为___________(填化学式)。
③在配合物中,N的化合价为___________价,0.1mol该配合物与足量溶液反应,可以得到沉淀的质量为___________g。
参考答案:
1.A
A.熔点1070℃,易溶于水,水溶液能导电,属于离子晶体的特点,A项选;
B.熔点为10.31°C,熔点低,符合分子晶体的特点,液态不导电,是由于液态时,只存在分子,没有离子,水溶液能导电,溶于水后,分子在水分子的作用下,电离出自由移动的离子,属于分子晶体的特点,B项不选;
C.熔点97.81℃,质软,导电,密度0.97g·cm-3,为金属晶体的特点,C项不选;
D.熔点为3900°C,硬度很大,不导电,熔点高,硬度大,属于原子晶体的特点,D项不选;
答案选A。
2.B
A.由晶体结构可知,立方相氮化硼为空间网状结构与金刚石类似,所以硬度大,立方相氮化硼中不存在π键,故A错误;
B.晶体中存在可以自由移动的电子能导电,六方相氮化硼晶体中没有可以自由移动的电子,所以不导电,故B正确;
C.立方氮化硼晶体中每个硼原子形成4个σ键,所以硼原子的杂化轨道类型为sp3,而六方相氮化硼中硼原子的杂化轨道类型为sp2,所以B原子的杂化类型不相同,故C错误;
D.六方相氮化硼中存在共价键和分子间作用力,与石墨类似属于混合晶体,而立方相氮化硼属于原子晶体,故D错误。
故选:B。
3.D
向盛有硫酸铜水溶液的试管里加入氨水,氨水与硫酸铜溶液反应生成蓝色的氢氧化铜沉淀,继续添加氨水,过量的氨水与氢氧化铜反应生成深蓝色的四氨合铜离子,反应的化学方程式为CuSO4+4NH3 H2O═[Cu(NH3)4]SO4+4H2O,则所得溶液中的溶质为[Cu(NH3)4]SO4;
故选D。
4.D
氮氧化铝(AlON)属原子晶体,石英(SiO2)属于原子晶体,Al2O3属于离子晶体,结合选项来解答。
A.二者均属于原子晶体,均只含有共价键,故A正确;
B.根据分析,二者均属于原子晶体,故B正确;
C.AlON属于原子晶体,只含有共价键,而Al2O3属于离子晶体,只含有离子键,故C正确;
D.AlON属于原子晶体,而Al2O3属于离子晶体,晶体类型不同,故D错误;
答案选D。
【点睛】根据物质的熔点,硬度,可以推测出物质具有原子晶体的性质。
5.B
A.金刚石中每个C原子形成4个共价键,每个共价键被两个碳原子共用,所以每个碳原子具有2个共价键,即碳原子与碳碳键个数的比为1:2,所以在1 mol金刚石晶体中,碳原子与碳碳键个数分别为NA、2NA,A正确;
B.气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子,4个F原子,则分子式为E4F4或F4E4,B错误;
C.在NaCl晶体中,距Na+最近的Cl-有6个,距Cl-最近的Na+有6个,这6个离子构成一个正八面体,C正确;
D.Ca2+位于晶胞的顶点和面心,根据均摊法,个数为=4,D正确;
答案选B。
6.A
A.硫黄指硫单质,属于分子晶体,可作为工业制硫酸的原料,A正确;
B.酒精是乙醇的俗称,与水互溶,故不能作萃取溴水中溴单质的萃取剂,B错误;
C.Cl2本身没有漂白性,所以液氯也没有漂白性,C错误;
D.同分异构体指分子式相同而结构不同的化合物,过氧化氢(H2O2)与水(H2O)分子式不同,二者不是同分异构体,D错误;
故选A。
7.C
铜和双氧水、盐酸反应生成氯化铜和水,铜离子被亚硫酸根离子还原为,加水稀释时发生反应,生成沉淀,过滤、洗涤、干燥得。
A.“氧化”时铜和双氧水、盐酸反应生成氯化铜和水,反应不生成氧气,故A错误;
B.“还原”时,铜离子被亚硫酸根离子还原为,根据得失电子守恒,反应的离子方程式为,故B错误;
C.,饱和溶液中c(Cu+)= c(Cl-)=, “滤液”含有电离出的氯离子,所以c(Cl-)>,则,故C正确;
D.根据图示,每个氯离子周围与之距离最近的氯离子数目为12,故D错误;
选C。
8.B
X的原子的基态价电子排布式为2s2,则X为Be;
Y的基态原子核外有5种运动状态不同的电子,则Y为B;
Z元素形成的化合物在自然界中种类最多,则Z为C;
M的阳离子通常存在于硝石、明矾和草木灰中,则M为K;
N的原子序数比M大1,则N为Ca;
综上所述,X、Y、Z、M、N分别为Be、B、C、K、Ca,结合元素周期表、元素周期律和相关知识解答。
A.Y4Z(B4C)熔点可能高于Z(C)单质的熔点,C的单质有金刚石、石墨、C60等,如B4C熔点为2350℃,C60属于分子晶体,其熔点接近280℃,B4C的熔点高于C60的熔点,A错误;
B.Be和Al处于对角线位置,某些化学性质与Al相似,如BeO是两性氧化物,B正确;
C.K+的半径小于同周期简单阴离子半径,C错误;
D.CaC2既含离子键,又含非极性共价键,D错误;
答案选B。
9.C
A.NaCl 由钠离子和氯离子构成,以离子键结合,属于离子晶体,A正确;
B.每个晶胞中平均含有个 Na+ 和个 Cl ,B正确;
C.每个 Na+ 周围有6个紧邻的 Cl 和12个紧邻的 Na+,C错误;
D.Na+ 和 Cl 以离子键结合,因此 NaCl 具有较高的熔点,D正确;
故选C。
10.C
A.氯化钠晶体中的钠离子和氯离子在常温下是不能自由移动的,不能导电,A错误;
B.白磷不稳定,在空气中易自燃,B错误;
C.金刚石与石墨是由碳元素两种单质,结构、性质不同,为同素异形体,C正确;
D.与是不同种元素的原子,不是同位素,D错误;
故选C。
11.A
A.金刚石是原子晶体,熔化时破坏的是共价键,A符合题意;
B.冰是分子晶体,熔化时破坏的是分子间作用力,B不符合题意;
C.氢氧化钠是离子晶体,熔化时破坏的是离子键,C不符合题意;
D.铜为金属晶体,熔化时破坏的是金属键,D不符合题意;
综上所述答案为A。
12.B
由阴阳离子构成的晶体为离子晶体;由原子通过共价键形成的空间网状晶体为共价晶体;由分子通过分子间作用力形成的为分子晶体;由金属阳离子与自由电子通过金属键形成的为金属晶体,据此分析解答。
A.石墨的层与层之间是分子间作用力,而碳原子间是共价键,石墨之中也会有自由电子在层与层间移动,石墨属于混合晶体,故A不选;
B.氯化铵为离子晶体,金刚石为共价晶体,乙醇为分子晶体,银为金属晶体,故B选;
C.醋酸是由分子构成的分子晶体,故C不选;
D.氢化钠是由离子构成的离子晶体,故D不选;
故选B。
13. 同素异形体 C60晶体为分子晶体,金刚石为共价晶体,共价晶体的熔点高于分子晶体
C60与金刚石、石墨等都是碳元素形成的不同单质,为同素异形体;C60晶体为分子晶体,金刚石为共价晶体,分子晶体熔化时破坏分子间作用力,共价晶体熔化时破坏共价键,共价键强度远远大于分子间作用力,所以共价晶体的熔点高于分子晶体,金刚石晶体熔点高于C60晶体。
14.(1)abc
(2)
【解析】(1)
冰晶石的晶体不导电,但熔融时能导电,说明属于离子化合物,含有离子键,由构成,中含有配位键,也属于极性键,故选abc;
(2)
若的晶体原子坐标参数A为,B为,C的位置为面心,由题图可以看出C原子坐标参数为。
15. H2O、Ne、CH4、NH3 CH4、CO2 NH3、H2O CH4 正四面体形 N2 不相同 配位键
(1)10e-分子可以用氖(Ne)作为标准,依次找出与氖同周期的元素与氢形成的化合物,有HF、H2O、NH3、CH4,题干要求用表中分子填空,不应填写HF。
(2)由极性键构成的非极性分子应是含有极性键且分子有对称结构的,应是CH4和CO2。
(3)H+有空轨道,与它形成配位键的分子应有孤电子对,据知,NH3和H2O可以和H+以配位键结合分别形成NH和H3O+。
(4)甲烷电子式为,不存在孤电子对,且中心碳原子采用sp3杂化,故其立体构型为正四面体形。
(5)根据信息OC知,C和O之间存在三个共价键,氮气中两个原子间也是三个共价键,与CO结构相似。但C和O电负性不同,共价键是极性键,而N2中两个氮原子形成的键是非极性键,OC中“→”表示氧原子单方提供电子对,是配位键。
16.(1)3:2
(2)增大固体接触面,提高反应速率
(3) H2SiO3 坩埚
(4)
(5)过滤
(6) 0.4molOH-
天然锆英石加入氢氧化钠碱熔后,再加入过量盐酸和过氧化氢,硅元素生成硅酸沉淀,二价铁转化为三价铁,分离出滤渣后铁、铝、铜、锆元素进入滤液,加入氨水调节pH值,铁、铝元素转化为沉淀过滤,滤液加入KCN生成铜的沉淀过滤,滤液中含有锆元素,加入氨水调节pH得到锆的沉淀,灼烧Zr(OH)4最终生成ZrO2。
(1)
图1是面心立方晶胞,配位数为12;图2是体心立方晶胞,配位数为8;配位数之比为3:2。
(2)
固体反应速率与接触面有关,粉碎过筛的目的是增大固体接触面,加快反应。
(3)
二氧化硅在碱熔时转化成硅酸钠,酸浸过程中硅酸钠和盐酸生成成硅酸沉淀H2SiO3。
操作A为灼烧,装固体的仪器是坩埚。
(4)
根据溶度积计算,。
(5)
氢氧化铁不溶氢氧化钠溶液,氢氧化铝与氢氧化钠溶液反应形成溶液,过滤分离出固体,得到氢氧化铁。
(6)
观察图示知,在碱性条件下,次氯酸根离子氧化氰根离子生成氮气和碳酸根离子,本身被还原成氯离子,反应为。
石墨(2)电极氯离子发生氧化反应生产氯气,为阳极,则石墨(1)电极为阴极,发生还原反应,电极反应式为,,向阳极区迁移0.4molOH-离子。
17.(1) 取少量反应后溶液加入KSCN溶液,溶液不变色,再加入新制氯水,溶液没有变红色,说明反应已经完全
(2) 铁容易被空气中氧气氧化
(3)分子晶体
(4) 3.42×10-11 溶液中加入溶液,氢氧根离子浓度增大,平衡向生成氢氧化铁沉淀的方向移动
在氩气气氛中,在碱性条件下,100℃搅拌回流3h,得到成分为Fe和的黑色沉淀,过滤后洗涤、烘干、焙烧得到复合物产品;
(1)在氩气气氛中,在碱性条件下,100℃搅拌回流3h,得到成分为Fe和的黑色沉淀,则三颈烧瓶内发生反应的离子方程式为;检验反应是否进行完全,就是检验反应后亚铁离子是否过量,故操作可以为:取少量反应后溶液加入KSCN溶液,溶液不变色,再加入新制氯水,溶液没有变红色,说明反应已经完全;
(2)铁容易被空气中氧气氧化,故焙烧需在隔绝空气条件下进行;50mL中氯化亚铁为0.05mol,根据化学方程式可知,生成Fe和各0.0125mol,总质量为0.0125mol×(56g/mol+232g/mol)=3.6g,故实验所得产品的产率为;
(3)已知:为共价化合物,熔点是306℃,则的晶体类型属于分子晶体;
(4),3.42×10-11mol/L,故使溶液中c(Fe3+)≤10-6mol/L,则溶液中c(OH-)≥3.42×10-11mol/L。溶液中加入溶液,氢氧根离子浓度增大,平衡向生成氢氧化铁沉淀的方向移动,从而将铁离子除去。
18. 7:2
①根据TiO2晶胞结构,Ti原子在晶胞的8个顶点、4个面心和1个在体内,1个晶胞中含有Ti的个数为8×+4×+1=4,O原子8个在棱上、8个在面上、2个在体内,1个晶胞中含有O的个数为8×+8×+2==8,则1mol晶胞的质量为48×4+16×8g=320g,1mol晶胞的体积为NA×a2c×10-30cm3,所以密度ρ==g/cm3,故答案为:;
②由晶胞结构示意图可知,TiO2-aNb晶胞中N原子数为1×=,O原子数为7×+7×+1=,Ti原子数为4,故b=×=,2 a=×,解得a=,a:b=:=7:2,故答案为:7:2。
19.(1)
(2)11.3
(1)由晶胞结构可知,晶胞中位于顶点的镍原子个数为8×=1,位于面心的铜原子个数为6×=3,则晶胞的化学式为Cu3Ni,由晶胞的质量公式可得:=(a×10—7)3ρ,解得ρ=,故答案为:;
(2)由溶度积可知,镁离子完全沉淀时,溶液中氢氧根离子浓度为=2.0×—3,则溶液的pH为14—3+lg2=11.3,故答案为:11.3。
20. 六方最密堆积 ×
根据图1判断钴晶胞的堆积方式;根据图2,面心6个Cu原子构成正八面体,棱上2个Cu原子与体心连线形成等腰直角三角形,该等腰直角三角形的斜边长即为两个面心上铜原子最短核间距,由几何知识可知两个面心上铜原子最短核间距=直角边长度的倍,而等腰直角三角形的直角边长等于晶胞棱长的,结合均摊法计算解答。
①由图1可知,钴晶胞的堆积方式是六方最密堆积,故答案为:六方最密堆积;
②面心6个Cu原子构成正八面体,正八面体棱上的2个Cu原子与体心连线形成等腰直角三角形,该等腰直角三角形的斜边长为两个面心上铜原子最短核间距,等腰直角三角形的直角边为晶胞棱长的。设晶胞棱长为a pm,晶胞中Cu原子数为6×=3,Ni原子数位8× =1,晶胞质量=g,设晶胞棱长为 a pm,则dg cm-3×(a×10-10 cm)3=g,解得a=,故两个面心上铜原子最短核间距=×pm×=×pm,故答案为:×。
21.(1)MnC2H6O7P2·5H2O
(2)
(3) 5 sp3d2
(4) 当n(Mn2+)》n(H4L)时,可形成多核配合物 [(H2O)5Mn-H2L-Mn(H2O)5]2+等
(5) 由于HEDPA中磷酸基上的氧比水分子中的氧更易给出孤电子对,对中心离子d轨道的影响更大,因此形成配合物后,中心离子的晶体场分裂能将增加 由于水合离子的摩尔吸收率一般都很低,因此水合配合物的颜色常常较浅,当形成配合物后,d-d跃迁禁阻部分解除,摩尔吸收率增加,吸收颜色加深
(1)设配合物A的质量为100g,由配合物A的元素含量为Mn(15.74%)、C(6.88%)、H(4.62%)、O(55.01%)、P(17.77%)可知,A中锰、碳、氢、氧、磷的原子个数比为::::≈1:2:16:12:2,则A的化学式为MnC2H16O12P2,由在250°C以上样品失重25.80%可知,A中结晶水的数目为≈5,则A的化学式为MnC2H6O7P2·5H2O,故答案为:MnC2H6O7P2·5H2O;
(2)由A的化学式可知,配合物中锰离子为中心离子,水分子和C2H6O7P为配体,配合物的结构示意图为,其中用*表示的原子为HEDPA中提供孤对电子的配位原子,故答案为:;
(3)由μ= [n(n+2)]1/2μ0=6.12μ0可得:μ=[n(n+2)] ×=6.12,解得配合物未成对电子数为n≈5;由锰离子的配位数为6可知,配合物中中心原子的杂化轨道类型为sp3d2,故答案为:5;sp3d2;
(4)将合成A的条件作修改,当锰离子的物质的量大于等于HEDPA时,可形成化学式为[(H2O)5Mn-H2L-Mn(H2O)5]2+等多核配合物,故答案为:当n(Mn2+)》n(H4L)时,可形成多核配合物;[(H2O)5Mn-H2L-Mn(H2O)5]2+等;
(5)由于HEDPA中磷酸基上的氧比水分子中的氧更易给出孤电子对,对中心离子d轨道的影响更大,因此形成配合物II后,中心离子的晶体场分裂能将增加,由于水合离子的摩尔吸收率一般都很低,因此水合配合物的颜色常常较浅,当形成配合物II后,d-d跃迁禁阻部分解除,摩尔吸收率增加,吸收颜色加深,故答案为:由于HEDPA中磷酸基上的氧比水分子中的氧更易给出孤电子对,对中心离子d轨道的影响更大,因此形成配合物II后,中心离子的晶体场分裂能将增加;由于水合离子的摩尔吸收率一般都很低,因此水合配合物的颜色常常较浅,当形成配合物II后,d-d跃迁禁阻部分解除,摩尔吸收率增加,吸收颜色加深。
22.(1)或
(2) 离子晶体
(3)极性
(4) 24 、 +3 28.7
X原子只有一个自旋电子,则X为H;Y在同周期元素中含有的未成对电子数最多,结合短周期元素可知Yp轨道含3个电子,Y为N或P;元素Z的原子最外层电子数是其内层电子数的3倍,则Z为O,Y只能为P;元素W基态原子的3p轨道上有4个电子,则W为S;W为Cl,N为27号元素,N为Co,据此解答。
(1)Co 的核外电子排布式为:或,故答案为:或;
(2)为氯化铵,由铵根离子和氯离子通过离子键结合而成, 其电子式为:,属于离子化合物,其晶体为离子晶体,故答案为:;离子晶体;
(3)与相似,为折线结构,正负电荷中心不重合,为极性分子,则也为极性分子,故答案为:极性;
(4)①为,其中氨分子为0价,Cl为-1价,则Co为+3价,与形成配位键,中N原子提供孤电子对,提供空轨道;1mol中含6mol,中含3个σ键,配位键也属于σ键,则1mol中含24molσ键,数目为:24NA,故答案为:;24;
②为,中心离子为,配体为和,故答案为:、;
③为,Co的化合价为+3价,其中外界可电离出氯离子,1mol该物质能电离出2mol氯离子,则0.1mol该配合物与足量溶液反应,生成0.2molAgCl沉淀,质量为28.7g,故答案为:+3;28.7。
一、单选题(共12题)
1.下列性质适合于离子晶体的是
A.熔点1070℃,易溶于水,水溶液能导电
B.熔点10.31℃,液态不导电,水溶液能导电
C.熔点97.81℃,质软,导电,密度0.97g·cm-3
D.熔点3900℃,硬度很大,不导电
2.氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法,正确的是
A.立方相氮化硼含有σ键和π键,所以硬度大
B.六方相氮化硼层结构与石墨相似却不导电,原因是层状结构中没有自由移动的电子
C.两种晶体中的B原子的杂化类型相同
D.两种晶体均为分子晶体
3.向CuSO4溶液中加入稀氨水至沉淀刚好溶解,若所得溶液中只有一种溶质,该溶质是( )
A.[Cu(H2O)4]SO4 B.Cu(OH)2 C.[Cu(NH3)4](OH)2 D.[Cu(NH3)4]SO4
4.氮氧化铝(AlON)是一种透明高硬度防弹材料,硬度为石英玻璃的 4 倍,可耐 120 摄氏度的高温。下列描述错误的是( )
A.AlON 和石英的化学键类型相同 B.AlON 和石英晶体类型相同
C.AlON 和 NaCl 的化学键类型不同 D.AlON 和 NaCl 晶体类型相同
5.NA表示阿伏加德罗常数,有关晶体的结构如图所示,下列说法中不正确的是
A.在1mol金刚石晶体中,碳原子与碳碳键个数分别为NA、2NA
B.该气态团簇分子的分子式为EF或FE
C.在NaCl晶体中,距Na+最近的Cl-形成正八面体形
D.在CaF2晶体中,每个晶胞平均占有4个Ca2+
6.下列物质与其化学式对应,且相关表述正确的是
A.硫黄(S),分子晶体,可作为工业制硫酸的原料
B.酒精(CH3CH2OH),可以萃取溴水中的溴单质
C.液氯(Cl2),黄绿色液体,具有漂白性
D.过氧化氢(H2O2),与水互为同分异构体
7.可作有机合成的催化剂,可由废铜屑经如下转化流程制得。已知“沉淀”时的反应为,的晶胞如图
关于上述转化流程,下列说法正确的是
A.“氧化”时每消耗,同时生成
B.“还原”时的离子方程式为
C.“滤液”中
D.晶胞结构如图所示,每个氯离子周围与之距离最近的氯离子数目为4
8.X、Y、Z、M、N分别为五种原子序数不大于20的元素,X的原子的基态价电子排布式为2s2,Y的基态原子核外有5种运动状态不同的电子,Z元素形成的化合物在自然界中种类最多,M的阳离子通常存在于硝石、明矾和草木灰中,N的原子序数比M大1。下列说法正确的是
A.熔点:Y4Z晶体低于单质Z
B.X与Al的某些化学性质相似,XO是两性氧化物
C.M的阳离子半径是同周期主族元素的简单离子中半径最大的
D.NZ2仅含离子键,可用于制备乙炔
9.的晶胞结构如图所示。下列说法不正确的是
A.属于离子晶体
B.每个晶胞中平均含有4个和4个
C.每个周围有6个紧邻的和6个紧邻的
D.和间存在较强的离子键,因此具有较高的熔点
10.下列关于物质结构的说法正确的是
A.氯化钠晶体是由钠离子和氯离子构成的,常温下能够导电
B.白磷分子为正四面体结构,分子相当稳定,不容易发生反应
C.金刚石与石墨结构、性质不同,互为同素异形体
D.与互为同位素
11.下列固体熔化时,需要破坏共价键的是
A.金刚石 B.冰 C.氢氧化钠 D.金属铜
12.下列晶体的分类正确的一组是
选项 离子晶体 原子晶体 分子晶体 金属晶体
A 石墨 Ar Hg
B 金刚石 Ag
C SiC Mg
D Si NaH
A.A B.B C.C D.D
二、非选择题(共10题)
13.足球烯(footballene,C60)分子形成的晶体是人们发现的又一种碳的单质形态,其晶体结构如图所示。C60与金刚石、石墨等都是碳的_______。C60晶体与金刚石相比,金刚石的熔点较高,理由是________。
14.填空。
(1)工业上电解制取单质铝,常利用冰晶石降低的熔点。冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在_______(填字母)。
a.离子键 b.极性键 c.配位键 d.范德华力
(2)的晶体结构如下图所示,其中原子坐标参数A为,B为,则C原子坐标参数为_______。
15.数十亿年来,地球上的物质不断地发生变化,大气的成分也发生了很大变化。下表是原始大气和目前空气的成分:
空气的成分 N2、O2、CO2、水蒸气及稀有气体He、Ne等
原始大气 的成分 CH4、NH3、CO、CO2等
用上表所涉及的分子填写下列空白。
(1)含有10个电子的化学式有(填化学式,下同)________。
(2)由极性键构成的非极性分子有________。
(3)与H+可直接形成配位键的分子有________。
(4)分子中不含孤电子对的分子(除稀有气体外)有_______,它的立体构型为______。
(5)CO的结构可表示为OC,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
16.我国科学家以ZrO2、Al2O3、TiO2和活性炭为载体合成具有低温活性的钨酸盐催化剂。以天然锆英石(主要成分是ZrSiO4,含少量FeO、Al2O3、CuO,SiO2等杂质)为原料制备ZrO2的流程如下(部分条件和产物省略):
请回答下列问题:
(1)锆单质晶体有最密面心立方、体心立方两种,如图所示。图1、图2晶胞中锆原子配位数之比为_______。
(2)“粉碎过筛”的目的是_______。
(3)滤渣1的主要成分是_______(填化学式);实验室完成操作A时,装Zr(OH)4的仪器名称为_______。
(4)室温下,。为了使,溶液范围为_______。
(5)利用滤渣2可以制备铁红,其操作过程是:将滤渣2溶于过量的烧碱溶液,经过_______(填操作名称)、洗涤、灼烧得到纯铁红。
(6)滤液1中CN-经处理达标后才能排放,常用电化学法处理,装置如图所示。
处理CN-的离子方程式为_______。石墨(1)上产生4.48L气体(标准状况),理论上通过交换膜的主要离子的物质的量及符号为_______离子。
17.铁的常见化合价有+2、+3,在很强的氧化剂作用下也可形成不稳定的+6价高铁酸盐。
Ⅰ.实验室以为原料制备高密度磁记录材料Fe/复合物,装置如图所示。在氩气气氛中,向装有50mL的三颈烧瓶中逐滴加入100mL,100℃下搅拌回流3h,得到成分为Fe和的黑色沉淀。
待三颈烧瓶中的混合物冷却后,过滤,再依次用沸水和乙醇洗涤,40℃干燥后焙烧3h,得到Fe/复合物产品3.24g。
完成下列填空:
(1)三颈烧瓶内发生反应的离子方程式为_______;检验反应是否进行完全的操作是_______。
(2)焙烧需在隔绝空气条件下进行,原因是_______,实验所得产品的产率为_______。
Ⅱ.已知:为共价化合物,熔点是306℃,易水解:
的平衡常数。
(3)的晶体类型属于_______。
(4)向中加入以除去杂质,为使溶液中c(Fe3+)≤10-6mol/L,则溶液中c(OH-)≥_____mol/L。用平衡移动原理解释除杂原理。_______。
18.TiO2-aNb、Cu(In1-xGaxSe2)是常见的光学活性物质。请回答下列问题:TiO2通过氮掺杂反应生成TiO2-aNb,表示如图。
①立方晶系TiO2晶胞参数如图甲所示,其晶体的密度为_______g·cm-3。
②图乙TiO2-aNb晶体中a:b=_______。
19.填空。
(1)某镍铜合金的立方晶胞结构如图所示。若该晶胞的棱长为anm(1nm=1×10-7cm),ρ=_______g·cm-3(NA表示阿伏加德罗常数,列出计算式)。
(2)已知室温时,Ksp[Mg(OH)2]=4.0×10 11.在0.1mol/L的MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时,溶液的pH是_______(已知lg2=0.3)。(已知:当溶液中离子浓度小于1×10-5mol/L时认为沉淀完全)
20.据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成碳的含氧衍生物,钴晶胞、白铜(铜镍合金)晶胞如图所示,请回答下列问题:
①钴晶胞堆积方式的名称为_______。
②已知白铜晶胞的密度为dg·cm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为_______pm(只列出计算式)。
21.羟基亚乙基二磷酸(HEDPA,结构式如下,可简写为H4L)可在较宽的pH范围内与金属离子或原子形成稳定的配合物,是一种常用的配体,主要用作工业循环冷却水的缓蚀阻垢剂和无氰电镀的络合剂,与188Re所形成的188Re-HEDPA可用于治疗转移性骨癌。HEDPA和Mn2+可在一定的pH值和Mn2+/HEDPA配比下形成配合物A,将该配合物加热,在250°C以上样品失重25.80%,脱水结束后对残余物之进行元素分析,配合物A的元素含量为:Mn(15.74%)、C(6.88%)、H(4.62%)、O(55.01%)、P(17.77%)。
(1)根据元素分析数据,推证配合物A的分子式为____。
(2)画出该配合物的结构示意图,并在图上注明HEDPA中哪些原子可为配位原子?(用*表示)____。
(3)实验测得配合物A的磁矩为6.12μ0,配合物未成对电子数为___,中心原子的杂化轨道类型是____。
(4)如何将合成A的条件作修改,可得到多核配合物___,写出2种该多核配合物的分子式__。
(5)已知配合物[Mn(H2O)6]2+的d-d跃迁在400nm-550nm范围内有弱的吸收,配合物呈肉粉色,在水溶液中形成配合物后,中心离子的晶体场分裂能将发生怎样的变化____。观察配合物的颜色明显加深,为什么?___。
22.元素周期表中的六种元素X、Y、Z、W、M、N的原子序数依次增大,其中前五种均为短周期主族元素。X原子只有一个自旋电子,Y在同周期元素中含有的未成对电子数最多,元素Z的原子最外层电子数是其内层电子数的3倍,元素W基态原子的3p轨道上有4个电子,N为27号元素。回答下列问题:
(1)的基态原子的电子排布式为___________。
(2)的电子式为___________,其晶体类型为___________。
(3)是制备杀虫剂的中间体,其结构与相似,为___________(填“极性”或“非极性”)分子。
(4)、、可作为配合物的配体。
①在配合物中,提供空轨道的是___________(写离子符号),1mol该配合物中含有的σ键数目为___________。
②在配合物中,配体为___________(填化学式)。
③在配合物中,N的化合价为___________价,0.1mol该配合物与足量溶液反应,可以得到沉淀的质量为___________g。
参考答案:
1.A
A.熔点1070℃,易溶于水,水溶液能导电,属于离子晶体的特点,A项选;
B.熔点为10.31°C,熔点低,符合分子晶体的特点,液态不导电,是由于液态时,只存在分子,没有离子,水溶液能导电,溶于水后,分子在水分子的作用下,电离出自由移动的离子,属于分子晶体的特点,B项不选;
C.熔点97.81℃,质软,导电,密度0.97g·cm-3,为金属晶体的特点,C项不选;
D.熔点为3900°C,硬度很大,不导电,熔点高,硬度大,属于原子晶体的特点,D项不选;
答案选A。
2.B
A.由晶体结构可知,立方相氮化硼为空间网状结构与金刚石类似,所以硬度大,立方相氮化硼中不存在π键,故A错误;
B.晶体中存在可以自由移动的电子能导电,六方相氮化硼晶体中没有可以自由移动的电子,所以不导电,故B正确;
C.立方氮化硼晶体中每个硼原子形成4个σ键,所以硼原子的杂化轨道类型为sp3,而六方相氮化硼中硼原子的杂化轨道类型为sp2,所以B原子的杂化类型不相同,故C错误;
D.六方相氮化硼中存在共价键和分子间作用力,与石墨类似属于混合晶体,而立方相氮化硼属于原子晶体,故D错误。
故选:B。
3.D
向盛有硫酸铜水溶液的试管里加入氨水,氨水与硫酸铜溶液反应生成蓝色的氢氧化铜沉淀,继续添加氨水,过量的氨水与氢氧化铜反应生成深蓝色的四氨合铜离子,反应的化学方程式为CuSO4+4NH3 H2O═[Cu(NH3)4]SO4+4H2O,则所得溶液中的溶质为[Cu(NH3)4]SO4;
故选D。
4.D
氮氧化铝(AlON)属原子晶体,石英(SiO2)属于原子晶体,Al2O3属于离子晶体,结合选项来解答。
A.二者均属于原子晶体,均只含有共价键,故A正确;
B.根据分析,二者均属于原子晶体,故B正确;
C.AlON属于原子晶体,只含有共价键,而Al2O3属于离子晶体,只含有离子键,故C正确;
D.AlON属于原子晶体,而Al2O3属于离子晶体,晶体类型不同,故D错误;
答案选D。
【点睛】根据物质的熔点,硬度,可以推测出物质具有原子晶体的性质。
5.B
A.金刚石中每个C原子形成4个共价键,每个共价键被两个碳原子共用,所以每个碳原子具有2个共价键,即碳原子与碳碳键个数的比为1:2,所以在1 mol金刚石晶体中,碳原子与碳碳键个数分别为NA、2NA,A正确;
B.气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子,4个F原子,则分子式为E4F4或F4E4,B错误;
C.在NaCl晶体中,距Na+最近的Cl-有6个,距Cl-最近的Na+有6个,这6个离子构成一个正八面体,C正确;
D.Ca2+位于晶胞的顶点和面心,根据均摊法,个数为=4,D正确;
答案选B。
6.A
A.硫黄指硫单质,属于分子晶体,可作为工业制硫酸的原料,A正确;
B.酒精是乙醇的俗称,与水互溶,故不能作萃取溴水中溴单质的萃取剂,B错误;
C.Cl2本身没有漂白性,所以液氯也没有漂白性,C错误;
D.同分异构体指分子式相同而结构不同的化合物,过氧化氢(H2O2)与水(H2O)分子式不同,二者不是同分异构体,D错误;
故选A。
7.C
铜和双氧水、盐酸反应生成氯化铜和水,铜离子被亚硫酸根离子还原为,加水稀释时发生反应,生成沉淀,过滤、洗涤、干燥得。
A.“氧化”时铜和双氧水、盐酸反应生成氯化铜和水,反应不生成氧气,故A错误;
B.“还原”时,铜离子被亚硫酸根离子还原为,根据得失电子守恒,反应的离子方程式为,故B错误;
C.,饱和溶液中c(Cu+)= c(Cl-)=, “滤液”含有电离出的氯离子,所以c(Cl-)>,则,故C正确;
D.根据图示,每个氯离子周围与之距离最近的氯离子数目为12,故D错误;
选C。
8.B
X的原子的基态价电子排布式为2s2,则X为Be;
Y的基态原子核外有5种运动状态不同的电子,则Y为B;
Z元素形成的化合物在自然界中种类最多,则Z为C;
M的阳离子通常存在于硝石、明矾和草木灰中,则M为K;
N的原子序数比M大1,则N为Ca;
综上所述,X、Y、Z、M、N分别为Be、B、C、K、Ca,结合元素周期表、元素周期律和相关知识解答。
A.Y4Z(B4C)熔点可能高于Z(C)单质的熔点,C的单质有金刚石、石墨、C60等,如B4C熔点为2350℃,C60属于分子晶体,其熔点接近280℃,B4C的熔点高于C60的熔点,A错误;
B.Be和Al处于对角线位置,某些化学性质与Al相似,如BeO是两性氧化物,B正确;
C.K+的半径小于同周期简单阴离子半径,C错误;
D.CaC2既含离子键,又含非极性共价键,D错误;
答案选B。
9.C
A.NaCl 由钠离子和氯离子构成,以离子键结合,属于离子晶体,A正确;
B.每个晶胞中平均含有个 Na+ 和个 Cl ,B正确;
C.每个 Na+ 周围有6个紧邻的 Cl 和12个紧邻的 Na+,C错误;
D.Na+ 和 Cl 以离子键结合,因此 NaCl 具有较高的熔点,D正确;
故选C。
10.C
A.氯化钠晶体中的钠离子和氯离子在常温下是不能自由移动的,不能导电,A错误;
B.白磷不稳定,在空气中易自燃,B错误;
C.金刚石与石墨是由碳元素两种单质,结构、性质不同,为同素异形体,C正确;
D.与是不同种元素的原子,不是同位素,D错误;
故选C。
11.A
A.金刚石是原子晶体,熔化时破坏的是共价键,A符合题意;
B.冰是分子晶体,熔化时破坏的是分子间作用力,B不符合题意;
C.氢氧化钠是离子晶体,熔化时破坏的是离子键,C不符合题意;
D.铜为金属晶体,熔化时破坏的是金属键,D不符合题意;
综上所述答案为A。
12.B
由阴阳离子构成的晶体为离子晶体;由原子通过共价键形成的空间网状晶体为共价晶体;由分子通过分子间作用力形成的为分子晶体;由金属阳离子与自由电子通过金属键形成的为金属晶体,据此分析解答。
A.石墨的层与层之间是分子间作用力,而碳原子间是共价键,石墨之中也会有自由电子在层与层间移动,石墨属于混合晶体,故A不选;
B.氯化铵为离子晶体,金刚石为共价晶体,乙醇为分子晶体,银为金属晶体,故B选;
C.醋酸是由分子构成的分子晶体,故C不选;
D.氢化钠是由离子构成的离子晶体,故D不选;
故选B。
13. 同素异形体 C60晶体为分子晶体,金刚石为共价晶体,共价晶体的熔点高于分子晶体
C60与金刚石、石墨等都是碳元素形成的不同单质,为同素异形体;C60晶体为分子晶体,金刚石为共价晶体,分子晶体熔化时破坏分子间作用力,共价晶体熔化时破坏共价键,共价键强度远远大于分子间作用力,所以共价晶体的熔点高于分子晶体,金刚石晶体熔点高于C60晶体。
14.(1)abc
(2)
【解析】(1)
冰晶石的晶体不导电,但熔融时能导电,说明属于离子化合物,含有离子键,由构成,中含有配位键,也属于极性键,故选abc;
(2)
若的晶体原子坐标参数A为,B为,C的位置为面心,由题图可以看出C原子坐标参数为。
15. H2O、Ne、CH4、NH3 CH4、CO2 NH3、H2O CH4 正四面体形 N2 不相同 配位键
(1)10e-分子可以用氖(Ne)作为标准,依次找出与氖同周期的元素与氢形成的化合物,有HF、H2O、NH3、CH4,题干要求用表中分子填空,不应填写HF。
(2)由极性键构成的非极性分子应是含有极性键且分子有对称结构的,应是CH4和CO2。
(3)H+有空轨道,与它形成配位键的分子应有孤电子对,据知,NH3和H2O可以和H+以配位键结合分别形成NH和H3O+。
(4)甲烷电子式为,不存在孤电子对,且中心碳原子采用sp3杂化,故其立体构型为正四面体形。
(5)根据信息OC知,C和O之间存在三个共价键,氮气中两个原子间也是三个共价键,与CO结构相似。但C和O电负性不同,共价键是极性键,而N2中两个氮原子形成的键是非极性键,OC中“→”表示氧原子单方提供电子对,是配位键。
16.(1)3:2
(2)增大固体接触面,提高反应速率
(3) H2SiO3 坩埚
(4)
(5)过滤
(6) 0.4molOH-
天然锆英石加入氢氧化钠碱熔后,再加入过量盐酸和过氧化氢,硅元素生成硅酸沉淀,二价铁转化为三价铁,分离出滤渣后铁、铝、铜、锆元素进入滤液,加入氨水调节pH值,铁、铝元素转化为沉淀过滤,滤液加入KCN生成铜的沉淀过滤,滤液中含有锆元素,加入氨水调节pH得到锆的沉淀,灼烧Zr(OH)4最终生成ZrO2。
(1)
图1是面心立方晶胞,配位数为12;图2是体心立方晶胞,配位数为8;配位数之比为3:2。
(2)
固体反应速率与接触面有关,粉碎过筛的目的是增大固体接触面,加快反应。
(3)
二氧化硅在碱熔时转化成硅酸钠,酸浸过程中硅酸钠和盐酸生成成硅酸沉淀H2SiO3。
操作A为灼烧,装固体的仪器是坩埚。
(4)
根据溶度积计算,。
(5)
氢氧化铁不溶氢氧化钠溶液,氢氧化铝与氢氧化钠溶液反应形成溶液,过滤分离出固体,得到氢氧化铁。
(6)
观察图示知,在碱性条件下,次氯酸根离子氧化氰根离子生成氮气和碳酸根离子,本身被还原成氯离子,反应为。
石墨(2)电极氯离子发生氧化反应生产氯气,为阳极,则石墨(1)电极为阴极,发生还原反应,电极反应式为,,向阳极区迁移0.4molOH-离子。
17.(1) 取少量反应后溶液加入KSCN溶液,溶液不变色,再加入新制氯水,溶液没有变红色,说明反应已经完全
(2) 铁容易被空气中氧气氧化
(3)分子晶体
(4) 3.42×10-11 溶液中加入溶液,氢氧根离子浓度增大,平衡向生成氢氧化铁沉淀的方向移动
在氩气气氛中,在碱性条件下,100℃搅拌回流3h,得到成分为Fe和的黑色沉淀,过滤后洗涤、烘干、焙烧得到复合物产品;
(1)在氩气气氛中,在碱性条件下,100℃搅拌回流3h,得到成分为Fe和的黑色沉淀,则三颈烧瓶内发生反应的离子方程式为;检验反应是否进行完全,就是检验反应后亚铁离子是否过量,故操作可以为:取少量反应后溶液加入KSCN溶液,溶液不变色,再加入新制氯水,溶液没有变红色,说明反应已经完全;
(2)铁容易被空气中氧气氧化,故焙烧需在隔绝空气条件下进行;50mL中氯化亚铁为0.05mol,根据化学方程式可知,生成Fe和各0.0125mol,总质量为0.0125mol×(56g/mol+232g/mol)=3.6g,故实验所得产品的产率为;
(3)已知:为共价化合物,熔点是306℃,则的晶体类型属于分子晶体;
(4),3.42×10-11mol/L,故使溶液中c(Fe3+)≤10-6mol/L,则溶液中c(OH-)≥3.42×10-11mol/L。溶液中加入溶液,氢氧根离子浓度增大,平衡向生成氢氧化铁沉淀的方向移动,从而将铁离子除去。
18. 7:2
①根据TiO2晶胞结构,Ti原子在晶胞的8个顶点、4个面心和1个在体内,1个晶胞中含有Ti的个数为8×+4×+1=4,O原子8个在棱上、8个在面上、2个在体内,1个晶胞中含有O的个数为8×+8×+2==8,则1mol晶胞的质量为48×4+16×8g=320g,1mol晶胞的体积为NA×a2c×10-30cm3,所以密度ρ==g/cm3,故答案为:;
②由晶胞结构示意图可知,TiO2-aNb晶胞中N原子数为1×=,O原子数为7×+7×+1=,Ti原子数为4,故b=×=,2 a=×,解得a=,a:b=:=7:2,故答案为:7:2。
19.(1)
(2)11.3
(1)由晶胞结构可知,晶胞中位于顶点的镍原子个数为8×=1,位于面心的铜原子个数为6×=3,则晶胞的化学式为Cu3Ni,由晶胞的质量公式可得:=(a×10—7)3ρ,解得ρ=,故答案为:;
(2)由溶度积可知,镁离子完全沉淀时,溶液中氢氧根离子浓度为=2.0×—3,则溶液的pH为14—3+lg2=11.3,故答案为:11.3。
20. 六方最密堆积 ×
根据图1判断钴晶胞的堆积方式;根据图2,面心6个Cu原子构成正八面体,棱上2个Cu原子与体心连线形成等腰直角三角形,该等腰直角三角形的斜边长即为两个面心上铜原子最短核间距,由几何知识可知两个面心上铜原子最短核间距=直角边长度的倍,而等腰直角三角形的直角边长等于晶胞棱长的,结合均摊法计算解答。
①由图1可知,钴晶胞的堆积方式是六方最密堆积,故答案为:六方最密堆积;
②面心6个Cu原子构成正八面体,正八面体棱上的2个Cu原子与体心连线形成等腰直角三角形,该等腰直角三角形的斜边长为两个面心上铜原子最短核间距,等腰直角三角形的直角边为晶胞棱长的。设晶胞棱长为a pm,晶胞中Cu原子数为6×=3,Ni原子数位8× =1,晶胞质量=g,设晶胞棱长为 a pm,则dg cm-3×(a×10-10 cm)3=g,解得a=,故两个面心上铜原子最短核间距=×pm×=×pm,故答案为:×。
21.(1)MnC2H6O7P2·5H2O
(2)
(3) 5 sp3d2
(4) 当n(Mn2+)》n(H4L)时,可形成多核配合物 [(H2O)5Mn-H2L-Mn(H2O)5]2+等
(5) 由于HEDPA中磷酸基上的氧比水分子中的氧更易给出孤电子对,对中心离子d轨道的影响更大,因此形成配合物后,中心离子的晶体场分裂能将增加 由于水合离子的摩尔吸收率一般都很低,因此水合配合物的颜色常常较浅,当形成配合物后,d-d跃迁禁阻部分解除,摩尔吸收率增加,吸收颜色加深
(1)设配合物A的质量为100g,由配合物A的元素含量为Mn(15.74%)、C(6.88%)、H(4.62%)、O(55.01%)、P(17.77%)可知,A中锰、碳、氢、氧、磷的原子个数比为::::≈1:2:16:12:2,则A的化学式为MnC2H16O12P2,由在250°C以上样品失重25.80%可知,A中结晶水的数目为≈5,则A的化学式为MnC2H6O7P2·5H2O,故答案为:MnC2H6O7P2·5H2O;
(2)由A的化学式可知,配合物中锰离子为中心离子,水分子和C2H6O7P为配体,配合物的结构示意图为,其中用*表示的原子为HEDPA中提供孤对电子的配位原子,故答案为:;
(3)由μ= [n(n+2)]1/2μ0=6.12μ0可得:μ=[n(n+2)] ×=6.12,解得配合物未成对电子数为n≈5;由锰离子的配位数为6可知,配合物中中心原子的杂化轨道类型为sp3d2,故答案为:5;sp3d2;
(4)将合成A的条件作修改,当锰离子的物质的量大于等于HEDPA时,可形成化学式为[(H2O)5Mn-H2L-Mn(H2O)5]2+等多核配合物,故答案为:当n(Mn2+)》n(H4L)时,可形成多核配合物;[(H2O)5Mn-H2L-Mn(H2O)5]2+等;
(5)由于HEDPA中磷酸基上的氧比水分子中的氧更易给出孤电子对,对中心离子d轨道的影响更大,因此形成配合物II后,中心离子的晶体场分裂能将增加,由于水合离子的摩尔吸收率一般都很低,因此水合配合物的颜色常常较浅,当形成配合物II后,d-d跃迁禁阻部分解除,摩尔吸收率增加,吸收颜色加深,故答案为:由于HEDPA中磷酸基上的氧比水分子中的氧更易给出孤电子对,对中心离子d轨道的影响更大,因此形成配合物II后,中心离子的晶体场分裂能将增加;由于水合离子的摩尔吸收率一般都很低,因此水合配合物的颜色常常较浅,当形成配合物II后,d-d跃迁禁阻部分解除,摩尔吸收率增加,吸收颜色加深。
22.(1)或
(2) 离子晶体
(3)极性
(4) 24 、 +3 28.7
X原子只有一个自旋电子,则X为H;Y在同周期元素中含有的未成对电子数最多,结合短周期元素可知Yp轨道含3个电子,Y为N或P;元素Z的原子最外层电子数是其内层电子数的3倍,则Z为O,Y只能为P;元素W基态原子的3p轨道上有4个电子,则W为S;W为Cl,N为27号元素,N为Co,据此解答。
(1)Co 的核外电子排布式为:或,故答案为:或;
(2)为氯化铵,由铵根离子和氯离子通过离子键结合而成, 其电子式为:,属于离子化合物,其晶体为离子晶体,故答案为:;离子晶体;
(3)与相似,为折线结构,正负电荷中心不重合,为极性分子,则也为极性分子,故答案为:极性;
(4)①为,其中氨分子为0价,Cl为-1价,则Co为+3价,与形成配位键,中N原子提供孤电子对,提供空轨道;1mol中含6mol,中含3个σ键,配位键也属于σ键,则1mol中含24molσ键,数目为:24NA,故答案为:;24;
②为,中心离子为,配体为和,故答案为:、;
③为,Co的化合价为+3价,其中外界可电离出氯离子,1mol该物质能电离出2mol氯离子,则0.1mol该配合物与足量溶液反应,生成0.2molAgCl沉淀,质量为28.7g,故答案为:+3;28.7。
