专题3《水溶液中的离子反应》单元检测题(含解析)2022---2023学年上学期高二苏教版(2019)高中化学选择性必修1
文档属性
| 名称 | 专题3《水溶液中的离子反应》单元检测题(含解析)2022---2023学年上学期高二苏教版(2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 988.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-24 10:25:56 | ||
图片预览



文档简介
专题3《水溶液中的离子反应》单元检测题
一、单选题
1.下列溶液一定显酸性的是
A. B.含有 C. D.酚酞变红
2.常温下,用0.10 mol/L的盐酸分别滴定20.00 mL浓度均为0.10 mol/L 的CH3COONa溶液和NaCN溶液,所得滴定曲线如图所示(忽略溶液体积变化)。下列说法正确的是
A.溶液中阳离子的物质的量浓度之和:点②等于点③
B.点①所示溶液中:c(CN-)+c(HCN)>2c(C1-)
C.点②所示溶液中:c(Na+)>c(Cl-)>c (CH3COO-)>c(CH3COOH)
D.点④所示溶液中:c (Na+)+c(CH3COOH)+c (H+)>0.10 mol/L
3.下列叙述正确的是
A.0.1 mol·L-1NH4Cl溶液:c()=c(Cl-)
B.在25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7
C.0.1 mol·L-1与0.2 mol·L-1氨水溶液中c(OH-)之比为1︰2
D.中和pH与体积都相同的氨水和Ba(OH)2溶液,消耗HCl的物质的量之比是1:2
4.常温下,下列各组离子在指定溶液中能大量共存的是
A.无色透明溶液中:、、、
B.弱酸性溶液中:、、、
C.使酚酞变红色的溶液中:、、、
D.的溶液中:、、、
5.关于钠及其化合物的化学用语正确的是
A.钠原子的结构示意图:
B.过氧化钠的电子式:
C.碳酸氢钠的电离方程式:NaHCO3 =Na+ + H+ + CO
D.碳酸钠水溶液呈碱性:CO + H2O HCO + OH-
6.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1mol L-1的(NH4)2SO4溶液中:Na+、Cu2+、Cl-、OH-
B.=10-12的溶液中:Na+、NO、[Al(OH)4]-、CO
C.水电离的c(H+)=1×10-13mol L-1溶液中:Na+、K+、NO、HCO
D.0.1mol L-1的FeCl3溶液中:K+、Mg2+、SO、SCN-
7.水的电离平衡如图两条曲线所示,曲线中的点都符合c(H+)·c(OH-)=常数,下列说法错误的是
A.图中温度T1>T2
B.图中五点Kw间的关系:B>C>A=D=E
C.点A、B、C均是纯水的电离情况
D.T1时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液显碱性
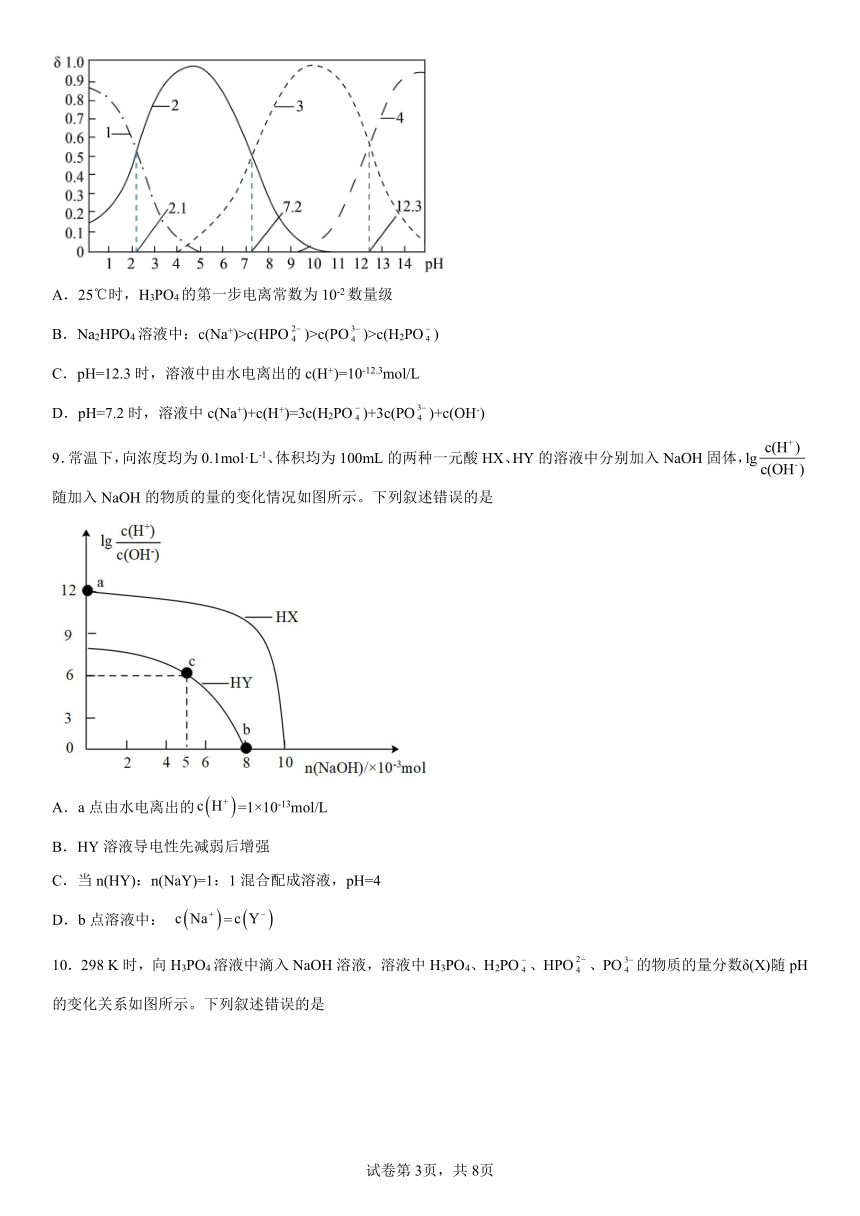
8.25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒(H3PO4、H2PO、HPO、PO)的分布分数δ(平衡时某微粒的浓度与各微粒浓度和的比值)随溶液pH的变化曲线如下图所示。下列说法正确的是
A.25℃时,H3PO4的第一步电离常数为10-2数量级
B.Na2HPO4溶液中:c(Na+)>c(HPO)>c(PO)>c(H2PO)
C.pH=12.3时,溶液中由水电离出的c(H+)=10-12.3mol/L
D.pH=7.2时,溶液中c(Na+)+c(H+)=3c(H2PO)+3c(PO)+c(OH-)
9.常温下,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY的溶液中分别加入NaOH固体,lg随加入NaOH的物质的量的变化情况如图所示。下列叙述错误的是
A.a点由水电离出的=1×10-13mol/L
B.HY溶液导电性先减弱后增强
C.当n(HY):n(NaY)=1:1混合配成溶液,pH=4
D.b点溶液中: =
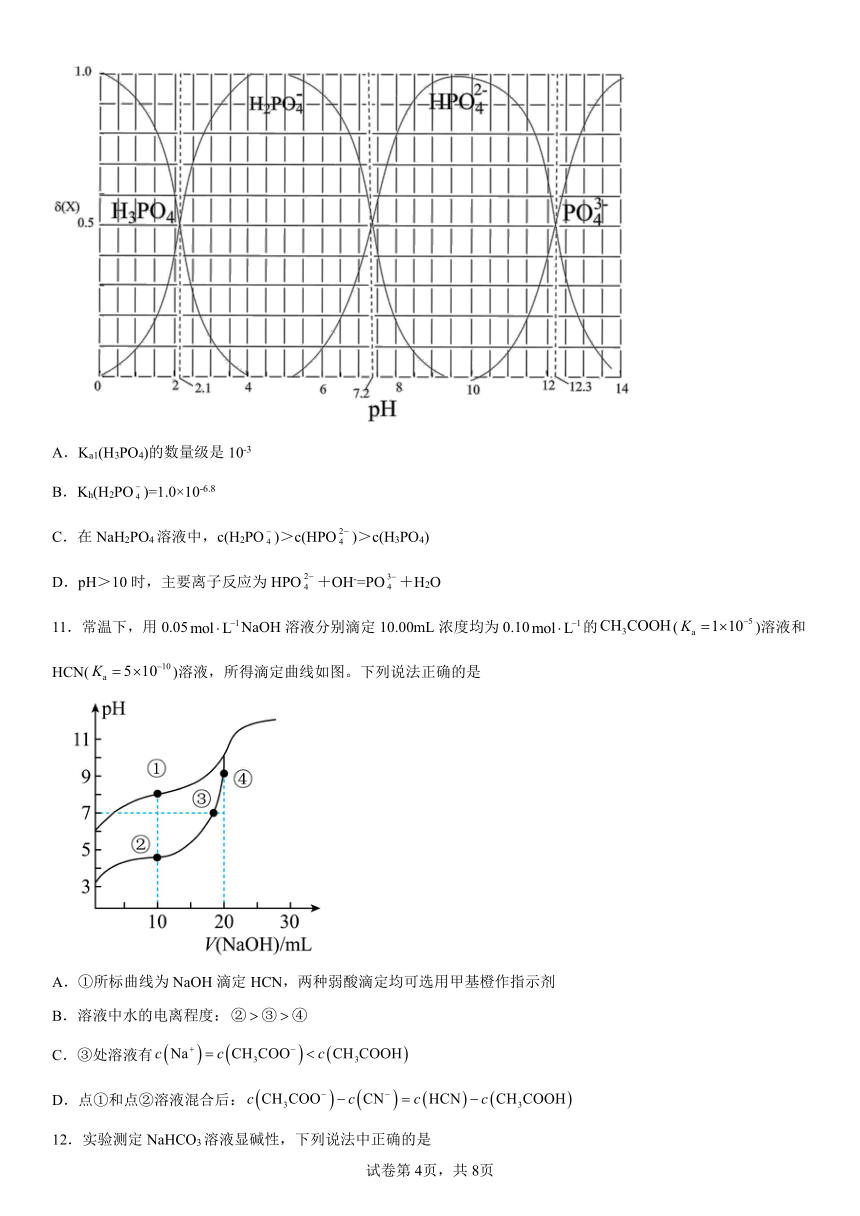
10.298 K时,向H3PO4溶液中滴入NaOH溶液,溶液中H3PO4、H2PO、HPO、PO的物质的量分数δ(X)随pH的变化关系如图所示。下列叙述错误的是
A.Ka1(H3PO4)的数量级是10-3
B.Kh(H2PO)=1.0×10-6.8
C.在NaH2PO4溶液中,c(H2PO)>c(HPO)>c(H3PO4)
D.pH>10时,主要离子反应为HPO+OH-=PO+H2O
11.常温下,用0.05NaOH溶液分别滴定10.00mL浓度均为0.10的()溶液和HCN()溶液,所得滴定曲线如图。下列说法正确的是
A.①所标曲线为NaOH滴定HCN,两种弱酸滴定均可选用甲基橙作指示剂
B.溶液中水的电离程度:
C.③处溶液有
D.点①和点②溶液混合后:
12.实验测定NaHCO3溶液显碱性,下列说法中正确的是
A.在水溶液中,HCO3 仅发生水解
B.在水溶液中,HCO3 仅发生电离
C.在水溶液中,HCO3 的电离程度要大于水解程度
D.在水溶液中,HCO3 的水解程度要大于电离程度
二、填空题
13.已知如表数据。
化学式 电离平衡常数(25℃)
HCN Ka=4.93×10-10
CH3COOH Ka=1.76×10-5
H2CO3 Ka1=4.30×10-7Ka2=5.61×10-11
NH3·H2O Kb=1.77×10-5
(1)25℃时,pH=11的NaCN溶液中水电离出的c(OH-)=_____mol L-1。
(2)25℃时,等浓度的NaCN、Na2CO3溶液、CH3COONa三种溶液的pH值由大到小的顺序为_____。
(3)0.100mol L-1NH4HCO3溶液中物质的量浓度最大的离子是_____(填化学式)。
(4)向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_____。
(5)25℃1.10mol L-1CH3COOH溶液中,CH3COOH的电离度约为_____。
(6)25℃时等体积等浓度的NaCl与NaCN两溶液中,离子总数NaCl_____NaCN(填“大于”、“小于”或“等于”);
(7)HCN与NaOH反应后的溶液中存在:c(Na+)=c(CN-),该溶液呈_____性(填“酸”“碱”或“中”)。
14.现有相同物质的量浓度的三种钠盐NaX、NaY、NaZ的溶液,测得它们的pH分别为7、8、9,请将它们对应的酸按酸性由强到弱的顺序排列_______,并说明理由_______。
15.已知,常温下几种物质的电离常数如下:
化学式 H2CO3 CH3COOH NH3·H2O H2SO3 HClO
电离平衡常数 Ka1=4.5×10-7Ka2=4.7×10-11 Ka=1.8×10-5 Kb=1.8×10-5 Ka1=1.4×10-2Ka2=6.0×10-8
(1)(NH4)2CO3溶液的pH_______(填“大于”或“小于”)7
(2)物质的量浓度均为0.1mol·L-1的4种溶液:①、②、③、④,按要求从大到小排序。:_______;:_______。(用序号填空)
①少量通入到过量的溶液中:_______。
②少量通入到过量的NaClO溶液中:_______。
(3)25℃时,若氨水的浓度为2.0mol·L-1,溶液中的c(OH )=_______mol·L 1。将SO2通入该氨水中,当c(OH )降至1.0×10 7mol·L 1时,溶液中的=_______。SO2可用足量小苏打溶液吸收,反应的离子方程式是_______。
16.现有如下物质:
①石墨②溶液③稀盐酸④铜⑤溶液⑥⑦⑧冰醋酸
请回答下列问题:
(1)能导电的是___________(填序号,下同),属于电解质的是___________。
(2)NaClO溶液呈碱性,请用离子方程式表示该溶液呈碱性的原因:___________。
(3)若向溶液②中逐滴滴加溶液③,实验过程中的现象为___________;溶液②中离子浓度由大到小的顺序为___________。
(4)已知,向溶液⑤中加入等体积溶液③,混合后溶液中的___________。
三、计算题
17.(1)在25℃下,向浓度均为0.1 mol L 1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_______沉淀(填化学式),生成该沉淀的离子方程式为_______。(已知25℃时,Ksp[Mg(OH)2]=1.8×10 11,Ksp[Cu(OH)2]=2.2×10 20)
(2)相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol L 1盐酸、③0.1 mol L 1氯化镁溶液、④0.1 mol L 1硝酸银溶液中,c(Ag+)由大到小的顺序为:_______
(3)已知:Ksp(AgBr)=5.4×10 13,Ksp(AgCl)=1.8×10 10,向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,=_______。
(4)已知在25℃时,Ksp[Mg(OH)2]=3.2×10 11。25℃时,向0.02 mol L 1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为_______mol L 1。
(5)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是_______
A.加入Na2SO4可使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.b点有BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
18.过氧化钙晶体(CaO2·8H2O)可用于改善地表水质、处理含重金属粒子废水、应急供氧等。
(1)已知:I2+2=2I-+,测定制备的过氧化钙晶体中CaO2的含量的实验步骤如下:
第一步:准确称取a g产品放入锥形瓶中,再加入过量的b g KI晶体,加入适量蒸馏水溶解,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。第二步:向上述锥形瓶中加入几滴淀粉溶液。第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液发生反应,滴定达到终点时出现的现象是___________。若滴定消耗Na2S2O3溶液V mL,则样品中CaO2的质量分数为___________(用字母表示)。
(2)已知过氧化钙加热至350 ℃左右开始分解放出氧气。将过氧化钙晶体(CaO2·8H2O)在坩埚中加热逐渐升高温度,测得样品质量随温度的变化如图所示,则350 ℃左右所得固体物质的化学式为___________。
四、工业流程题
19.铍是航天航空、火箭导弹和原子能工业不可替代的材料,有“超级金属”之称。素有“中国铍业”之称的某厂改进国外以绿柱石[Be3Al2(SiO3)6]为原料制备金属铍的工艺,以硅铍石(主要成分为 )为原料提取铍,具体流程如图:
已知:①铍和铝在元素周期表中处于对角线位置,其单质及化合物的结构与性质具有相似性。
②熔融可离子化(生成铍氯配离子)。
③铝铵矾在不同温度下的溶解度如下表:
温度/℃ 0 10 20 30 40 60
溶解度/含 2.10 5.00 7.74 10.9 14.9 26.7
回答下列问题:
(1)绿柱石[Be3Al2(SiO3)6]用氧化物形式表示为_______;流程中“系列操作”为_______。
(2)将“中和液”沉淀时,调节溶液的pH不能过大或过小。pH过大时发生反应的离子方程式为_______。
(3)已知 若 浓度为 的中和液开始沉淀时,溶液中 c(Al3+)=_______mol/L
(4)若在实验室洗涤粗 操作为_______。
(5)氧化铍转化为氯化铍的化学方程式为_______。
(6)的电子式为_______;工业上电解 熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应为_______电解时需加入氯化钠的作用是_______。
20.以硫化铜精矿为原料生产CuCl的工艺过程如下:
已知CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化,海绵铜中含少量CuO等。
(1)经测定氧化酸浸过程有单质S生成,写出此过程中的化学方程式_____________
(2)步骤①中得到的氧化产物是____________,溶解温度应控制在60—70℃,原因是_____________。
(3)写出步骤③中主要反应的离子方程式_____________。
(4)步骤③先加NH4Cl、再加入亚硫酸铵时无沉淀,加水稀释就产生大量白色沉淀,其原因_____________。
(5)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_____________(写名称)。
(6)上述工艺中,步骤⑥不能省略,理由是_____________。
(7)上述浓缩液中含有Iˉ、CIˉ等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中中为_____________。(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.c(H+)>c(OH-),说明溶液显酸性,A正确;
B.任何水溶液中,都含有H+,故含有H+的溶液不一定显酸性,B错误;
C.在100℃时,水的离子积KW=10-12,即水中c(H+)=c(OH-)=10-6mol/L,pH=6<7,此时溶液呈中性,故pH<7的溶液不一定显酸性,C错误;
D.使酚酞变红的溶液显碱性,D错误;
故选A。
2.D
【详解】A.根据电荷守恒,点②中存在c(CH3COO-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),点③中存在c(CN-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),由于两点的溶液体积不等,溶液的pH相等,则c(Na+)不等,c(H+)分别相等,因此阳离子的物质的量浓度之和不等,A错误;
B.点①所示溶液中含有等物质的量浓度的NaCN、HCN和NaCl,存在物料守恒,c(CN-)+c(HCN)=2c(Cl-),B错误;
C.点②所示溶液中含有CH3COONa、CH3COOH和NaCl,其中CH3COONa的浓度略大于CH3COOH和NaCl,溶液的pH=5,说明以醋酸的电离为主,因此c(CH3COO-)>c(Cl-),C错误;
D.点④所示溶液为等物质的量浓度的醋酸和氯化钠,浓度均为0.05 mol·L-1,则c(Na+)= c(Cl-)=0.05 mol·L-1,c(CH3COO-)+c(CH3COOH)=0.05 mol·L-1,根据电荷守恒,c(CH3COO-)+c(OH-)+c(Cl—)=c(Na+)+c(H+),因此c(CH3COO-)=c(H+)-c(OH-),则c(Na+)+c(CH3COOH)+c(H+)=0.05 mol·L-1+0.05 mol·L-1-c(CH3COO-)+c(H+)=0.10 mol·L-1- c(H+)+c(OH-)+c(H+)=0.10 mol·L-1+c(OH-)>0.10 mol·L-1,D正确;
故答案选D。
3.B
【详解】A.NH4Cl溶液中水解,所以c()B.因为氨水是弱电解质,pH=10的氨水溶液的浓度大于10—4mol/L,所以反应后氨水过量,溶液显碱性,B正确;
C.弱电解质浓度越稀电离程度越大,所以0.1 mol·L-1与0.2 mol·L-1氨水溶液中c(OH-)之比大于1:2,C错误;
D.pH相同时,弱碱氨水的浓度比氢氧化钡要大很多,中和消耗的盐酸也比氢氧化钡要多,D错误;
答案选B。
4.B
【详解】A.和水解相互促进,反应完全,不能大量共存,A错误;
B.弱酸性溶液中,、、、均可大量共存,B正确;
C.使酚酞变红色的溶液呈碱性,、会生成沉淀,不能大量共存,C错误;
D.的溶液呈酸性,发生歧化反应生成硫单质和二氧化硫,不能大量共存,D错误;
故选B。
5.D
【详解】A.钠原子核外电子数与质子数相同,钠离子的结构示意图为,A用语错误;
B.过氧化钠为离子化合物,其电子式为,B用语错误;
C.碳酸氢钠为强电解质,其电离方程式为NaHCO3=Na++,C用语错误;
D.碳酸钠为强碱弱酸盐,水溶液中碳酸根离子水解导致溶液呈碱性,水解方程式为CO +H2OHCO+OH-,D用语正确;
答案为D。
6.B
【详解】A.硫酸铵溶液中电离产生,与氢氧根离子不共存,与氢氧根离子不共存,A项错误;
B.<1,此时溶液为碱性,溶液中的离子共存,B项正确;
C.室温下,水电离的c(H+)=1×10-13mol L-1溶液中,pH为13或者pH为1,HCO在pH=13和pH=1的溶液中均不共存,C项错误;
D.铁离子与SCN-发生络合反应溶液变为红色,则与不共存,D项错误;
答案选B。
7.C
【分析】根据题中所给信息,曲线上的点都符合c(H+)·c(OH-)=Kw,水的离子积只受温度的影响,水的电离是吸热过程,升高温度,促进电离,水的离子积增大,即T1>T2,据此分析
【详解】A.曲线上的点都符合c(H+)·c(OH-)=Kw,水的离子积只受温度的影响,升高温度,促进水的电离,水的离子积增大,根据图像可知,T1>T2,故A说法正确;
B.根据上述分析可知,五点温度:B>C>A=E=D,温度升高,水的离子积增大,图中五点水的离子积之间的关系:B>C>A=E=D,故B说法正确;
C.点A、B、C三点溶液中c(H+)=c(OH-),溶液显中性,三点不一定是纯水的电离情况,可以是NaCl、Na2SO4等中性溶液,故C说法错误;
D.T1时,水的离子积为10-12mol/L,pH=2的硫酸溶液中c(H+)=10-2mol/L,pH=12的KOH溶液中c(OH-)=1mol/L,两者等体积混合,KOH过量,溶液显碱性,故D说法正确;
答案为C。
8.D
【详解】A.某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒依次为H3PO4、H2PO、HPO、PO,H3PO4的第一步电离常数为,pH=2.1时,,所以,为10-3数量级,故A错误;
B. Na2HPO4溶液中, 的电离平衡常数, 又因,所以的水解平衡常数为,所以的水解大于电离,所以c(Na+)>c(HPO)>c(H2PO)>c(PO),故B错误;
C. pH=12.3时,溶液中的溶质是Na3PO4和Na2HPO4, Na3PO4是强碱弱酸盐会水解,由B分析可知Na2HPO4水解大于电离,所以混合液中水的电离被促进,由水电离出的c(H+)>10-7mol/L,故C错误;
D. pH=7.2时,溶液中的溶质是NaH2PO4和Na2HPO4,且,由电荷守恒知c(Na+)+c(H+)= +c(H2PO)+3c(PO)+c(OH-),所以c(Na+)+c(H+)=3c(H2PO)+3c(PO)+c(OH-),故D正确;
故答案为:D。
9.B
【分析】由图可知,未加入氢氧化钠固体时,a点HX溶液中lg为12,0.1mol/LHX溶液中氢离子浓度为 mol/L =0.1mol/L,则HX为强酸、HY为弱酸,b点HY溶液中lg为0,溶液中氢离子浓度与氢氧根离子浓度相等,所得HY和NaY的混合溶液呈中性,c点为等物质的量的HY和NaY的混合溶液,溶液呈酸性。
【详解】A.由分析可知,a点HX溶液中lg为12,0.1mol/LHX溶液中氢离子浓度为0.1mol/L,则水电离出的氢离子浓度为=1×10-13mol/L,故A正确;
B.由分析可知,HY为弱酸,向HY溶液中加入氢氧化钠固体,溶液中的离子浓度增大,溶液的导电性增强,故B错误;
C.由图可知,c点为等物质的量的HY和NaY的混合溶液,溶液中lg为6,溶液中氢离子浓度为 mol/L =10—4mol/L,溶液pH为4,则当n(HY):n(NaY)=1:1混合配成溶液,溶液pH=4,故C正确;
D.由分析可知,b点HY溶液中lg为0,溶液中氢离子浓度与氢氧根离子浓度相等,所得HY和NaY的混合溶液呈中性,由电荷守恒可知c(Na+)+ c(H+)=c(Y—)+ c(OH—),溶液中c(Na+)= c(Y—),故D正确;
故选B。
10.B
【详解】A.多元弱酸的电离是分步的,Ka1(H3PO4)=,根据图象可知,当c(H2PO)=c(H3PO4)时,Ka1(H3PO4)=c(H+)=1.0×10-2.1=7.9×10-3,故A正确;
B.Kh(H2PO)==1.0×10-11.9,故B错误;
C.根据图象可知当H2PO的物质的量分数δ(X)近似为1时溶液显酸性,这说明H2PO的电离程度大于其水解程度,又因为H2PO的水解和电离都是微弱的,则在NaH2PO4溶液中,c(H2PO)>c(HPO)>c(H3PO4),故C正确;
D.根据图象可知pH>10时HPO转化为PO,则主要离子反应为HPO+OH-=PO+H2O,故D正确;
故选B。
11.D
【详解】A.两种酸浓度相同,由于HCN酸性更弱,故其pH更大,①所标曲线为NaOH滴定HCN,恰好反应生成NaCN,显碱性,由于甲基橙的变色范围是pH在3.1到4.4之间,因此滴定HCN时,不宜用甲基橙作为指示剂,A错误;
B.②处溶液,溶液呈酸性,醋酸电离为主,抑制水的电离,③处溶液,此时存在和少量的,④处为滴定终点,溶液中恰好生成,水解促进水的电离,因此溶液中水的电离程度:②<③<④,B错误;
C.③处溶液的,溶液呈中性,溶液中,对于所滴定的醋酸溶液,根据电荷守恒,,由于,则,此时滴加NaOH的体积不到20mL,因此溶液中还存在极少量的,则浓度关系应为,C错误;
D.点①的溶液中存在和,根据物料守恒,,点②溶液中存在NaCN和HCN,根据物料守恒,,两溶液混合,则有,即,故D正确;
故选:D。
12.D
【详解】碳酸钠溶液中的碳酸根离子应该存在电离和水解,因为溶液显碱性,说明其电离一定大于水解(因为电离得到氢离子,水解得到氢氧根);
所以选项D正确。
13. 10-3 Na2CO3>NaCN>CH3COONa NH4+ NaCN+H2O+CO2=NaHCO3+HCN 0.4% 大于 中
【分析】根据溶液的pH及水的离子积计算溶液中水电离的氢离子浓度;根据电离常数的大小分析比较溶液的酸碱性;根据盐类水解原理分析解答;根据弱酸的电离平衡常数计算电离度;根据溶液中守恒关系分析比较离子浓度大小。
【详解】(1)pH=11的NaCN溶液,c(H+)=10-11mol L-1,Kw=c(H+)×c(OH-)=10-14,故c(OH-)=10-3mol L-1,氢氧根离子来源于水的电离,故c(OH-)水=10-3mol L-1,故答案为:10-3;
(2)根据图表数据分析,电离常数:醋酸>HCN>碳酸氢根离子,所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的pH:Na2CO3溶液>NaCN溶液>CH3COONa溶液;故答案为:Na2CO3>NaCN>CH3COONa;
(3)铵根离子水解而导致其溶液呈酸性,碳酸氢根离子水解使溶液呈碱性,根据电离常数可知碳酸氢根离子的水解能力大于铵根离子, NH4HCO3溶液呈碱性;碳酸氢根离子水解程度大于铵根离子,故溶液中离子浓度最大的是NH4+,故答案为: NH4+;
(4)向NaCN溶液中通入少量CO2,由于酸性:H2CO3>HCN>HCO3-,故反应生成HCN和碳酸氢钠,不能生成碳酸钠,故反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3,故答案为:NaCN+H2O+CO2=HCN+NaHCO3;
(5)1.10mol/L的CH3COOH溶液中,CH3COOH的电离常数Ka= ,醋酸根离子和氢离子浓度相等,所以,CH3COOH的电离度约,故答案为:0.4%;
(6)根据电荷守恒分析知,等体积等浓度的NaCl与NaCN两溶液中,离子总数都等于阳离子总数的二倍,两溶液中的钠离子不水解,所以数目相同,NaCl溶液呈中性,则c(H+)=10-7mol/L,NaCN溶液呈碱性,则c(H+)<10-7mol/L,则离子总数NaCl大于NaCN,故答案为:大于;
(7)HCN与NaOH反应后的溶液中存在电荷守恒:c(Na+)+ c(H+)=c(CN-)+c(OH-),若c(Na+)=c(CN-),则c(H+)= c(OH-),该溶液呈中性,故答案为:中。
14. HX>HY>HZ NaX溶液显中性,为强碱强酸盐;NaY、NaZ的溶液均显碱性,则均为强碱弱酸盐,根据越弱越水解原理可知,它们对应的酸按酸性由强到弱的顺序为HX>HY>HZ
【详解】NaX溶液显中性,为强碱强酸盐;NaY、NaZ的溶液均显碱性,则均为强碱弱酸盐,根据越弱越水解原理可知,它们对应的酸按酸性由强到弱的顺序为HX>HY>HZ。
15.(1)大于
(2) ④③①② ②①③④
(3) 6.010-3 mol·L-1 0.6 SO2+HCO=HSO+ CO2
【解析】(1)
由图表可知,NH3·H2O与H2CO3相比较,Kb> Ka2,则碳酸根离子水解程度大于铵根离子,故溶液显碱性,pH大于7;
(2)
①为强酸弱碱盐,溶液显酸性,②中完全电离出铵根离子、氢离子、硫酸根离子,酸性比①强;③为弱酸弱碱盐,Ka= Kb,故显中性;④为弱碱,溶液显碱性;故由大到小的顺序为④③①②;
①②③为强电解质,完全电离,④为弱电解质,铵根离子浓度最小;①中铵根离子部分水水解,②中铵根离子水解受到抑制,③中铵根离子和醋酸根离子相互促进水解;故由大到小的顺序为②①③④;
①HClO的电离常数大于碳酸的二级电离但小于其一级电离,故少量通入到过量的溶液中生成碳酸氢根离子和次氯酸根离子、氯离子:;
②少量通入到过量的NaClO溶液中生成次氯酸和碳酸氢根离子:;
(3)
25℃时,NH3·H2O的Kb=1.8×10-5,若氨水的浓度为2.0mol·L-1,,氨水的电离程度很小,认为=2.0mol·L-1,因为,则=6.010-3 mol·L-1;
将SO2通入该氨水中,当c(OH )降至1.0×10 7mol·L 1时,则c(H+)=1.0×10 7mol·L 1,H2SO3
的Ka2==6.0×10-8,则溶液中的=;
SO2可用足量小苏打溶液吸收,反应生成二氧化碳和亚硫酸氢根离子,离子方程式是SO2+HCO=HSO+ CO2。
16.(1) ①②③④⑤ ⑥⑧
(2)
(3) 无明显现象
(4)
【解析】(1)
能导电物质有石墨、金属、电解质的水溶液或熔融状态,能导电的有①②③④⑤;电解质有酸、碱、多数盐、多数金属氧化物和水,属于电解质的有⑥⑧;故答案为①②③④⑤;⑥⑧;
(2)
NaClO属于强碱弱酸盐,ClO-在水中发生水解,水解方程式为ClO-+H2OHClO+OH-,溶液中c(OH-)>c(H+),溶液显碱性;故答案为ClO-+H2OHClO+OH-;
(3)
碳酸钠和稀盐酸的物质的量相等,发生Na2CO3+HCl=NaHCO3+NaCl,溶液无现象;Na2CO3为强碱弱酸盐,CO发生水解:CO+H2OHCO+OH-、HCO+H2OH2CO3+OH-,水属于弱电解质,其电离方程式为H2OH++OH-,盐类水解程度微弱,离子浓度大小顺序是c(Na+)>c(CO)>c(OH-)>c((HCO)>c(H+);故答案为溶液无现象;c(Na+)>c(CO)>c(OH-)>c((HCO)>c(H+);
(4)
AgNO3与HCl反应AgNO3+HCl=AgCl↓+HNO3,根据题中所给数据,盐酸过量,反应后c(Cl-)==1×10-3mol·L-1,c(Ag+)=mol/L=1.8×10-7mol·L-1;故答案为1.8×10-7。
17. Cu(OH)2 2NH3·H2O+Cu2+ =Cu(OH)2↓+2NH ④>①>②>③ 3×10 3 4×10 5 C
【详解】(1)在25℃下,向浓度均为0.1 mol L 1的MgCl2和CuCl2混合溶液中逐滴加入氨水,沉淀镁离子需要的氢氧根浓度,沉淀铜离子需要的氢氧根浓度,氢氧根浓度最先满足沉淀铜离子所需浓度,因此先生成Cu(OH)2沉淀,生成该沉淀的离子方程式为2NH3·H2O+Cu2+ =Cu(OH)2↓+2NH;故答案为:Cu(OH)2;2NH3·H2O+Cu2+ =Cu(OH)2↓+2NH。
(2)相同温度下,氯化银溶解平衡AgCl(s)Ag+(aq)+Cl-(aq),将足量氯化银固体分别放入相同体积的①蒸馏水,平衡正向移动,但银离子浓度不变;②0.1 mol L 1盐酸,氯离子浓度增大,平衡逆向移动;③0.1 mol L 1氯化镁溶液,氯离子浓度增大,比②中氯离子浓度大,平衡逆向移动比②更多,银离子浓度比②中银离子浓度小;④0.1 mol L 1硝酸银溶液,平衡逆向移动,但银离子浓度比原来大,因此c(Ag+)由大到小的顺序为:④>①>②>③;故答案为:④>①>②>③。
(3)已知:Ksp(AgBr)=5.4×10 13,Ksp(AgCl)=1.8×10 10,向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,;故答案为:3×10 3。
(4)已知在25℃时,Ksp[Mg(OH)2]=3.2×10 11。25℃时,向0.02 mol L 1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小,则c(OH-)=4×10 5mol L 1;故答案为:4×10 5。
(5)A.加入Na2SO4,硫酸根浓度增大,硫酸钡溶解平衡逆向移动,钡离子浓度减小,曲线从a点往c点移动,故A错误;B.d点蒸发溶剂,溶液体积减小,钡离子浓度、硫酸根浓度同时增大,c点与b点硫酸根浓度不变,钡离子浓度增大,因此蒸发溶液不可能由d点变到c点,故B错误;C.b点浓度积大于Ksp,因此有BaSO4沉淀生成,故C正确;D.ac曲线是硫酸钡的溶度积常数变化曲线,因此a点对应的Ksp等于c点对应的Ksp,故D错误;综上所述,答案为C。
18. 溶液由蓝色变无色,且30 s内不恢复蓝色 % CaO
【分析】碘遇淀粉变蓝色,根据电子转移守恒及题中反应方程式,可得关系式:CaO2~I2~2,据此列式计算;固体由2.16g加热到350℃时变为0.56g,在加热过程中固体中钙元素的量不变,据此计算剩余固体中Ca、O元素的质量,进而确定化学式。
【详解】(1)碘遇淀粉变蓝色,滴入最后一滴Na2S2O3溶液,溶液由蓝色变成无色,且30s内不出现蓝色,说明滴定到达终点;根据电子转移守恒及题中反应方程式,可得关系式:CaO2~I2~2,设样品中CaO2的质量分数为x,则有=,解得x=%,故答案为:溶液由蓝色变成无色,且30s内不出现蓝色;%;
(2)固体由2.16g加热到350℃时变为0.56g,在加热过程中固体中钙元素的量不变,剩余固体中n(Ca)=n(CaO2 8H2O)==0.01mol,m(Ca)=0.01mol×40g/mol=0.4g,则剩余固体中m(O)=0.56g-0.4g=0.16g,故n(O)==0.01mol,故n(Ca):n(O)=1:1,剩余固体的化学式为CaO,故答案为:CaO。
19.(1) 3BeO Al2O3 6SiO2 蒸发浓缩、降温结晶、过滤
(2)
(3)4.0×10-3
(4)向过滤器中加入NaOH溶液至浸没沉淀,将溶液滤出,重复操作2~3次
(5)BeO+C+Cl2=BeCl2+CO
(6) Be2++2e-=Be 增强导电性或BeCl2为共价化合物,加入NaCl使BeCl2转化为气体含铍的离子化合物
【分析】硅铍石经过原料预处理后用硫酸酸浸,浸出液中有Be2+、Al3+、Fe2+、Fe3+、H+、,SiO2形成浸出渣分离,浸出液加入硫酸铵,经过蒸发浓缩、降温结晶、过滤分离出铝铵矾晶体,净化液加入氧化剂将Fe2+氧化为Fe3+然后加氨水调pH除去铁,过滤后往中和液中加入碱性物质继续调pH使Be2+完全沉淀,洗涤后的Be(OH)2高温煅烧分解生成BeO,后加入氯气和过量的碳反应生成氯化铍:BeO+C+Cl2=BeCl2+CO,氯化铍为共价化合物,需要加入氯化钠转化为离子化合物,然后电解得到铍单质;
(1)
绿柱石[Be3Al2(SiO3)6]用氧化物形式表示为3BeO Al2O3 6SiO2;根据铝铵矾在不同温度下的溶解度数据可知,铝铵矾随着温度的降低而减小,所以要从溶液中获得铝铵矾晶体进行的‘系列操作’为蒸发浓缩、降温结晶、过滤;
(2)
将“中和液”沉淀时,形成Be(OH)2,已知铍和铝在元素周期表中处于对角线位置,其单质及化合物的结构与性质具有相似性,Be(OH)2同Al(OH)3类似,会与强碱溶液反应,所以pH过大时发生反应的离子方程式为;
(3)
Ksp[Be(OH)2]=4.0×10-21=c(Be2+) c3(OH-),c(Be2+)=0.40mol/L,则c(OH-)=,由Ksp[Al(OH)3]=4.0×10-33=c(Al3+) c3(OH-),则c(Al3+)=;
(4)
实验室洗涤粗Be(OH)2的操作是向过滤器中加入NaOH溶液至浸没沉淀,将溶液滤出,重复操作2~3次;
(5)
氧化铍与氯气和过量的碳反应生成氯化铍,根据质量守恒和得失电子守恒可知反应方程式为BeO+C+Cl2=BeCl2+CO;
(6)
铍和铝电负性相近,所以氯化铍为共价化合物,则BeCl2的电子式为,电解时阴极上铍离子得电子生成铍单质,电极反应式为Be2++2e-=Be;氯化钠的作用为增强导电性或BeCl2为共价化合物,加入NaCl使BeCl2转化为气体含铍的离子化合物。
20. 2CuS+2H2SO4+O2=2CuSO4+2S+2H2O CuSO4或Cu2+ 温度低溶解速度慢,温度过高铵盐分解 2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+ 步骤3先加NH4Cl,氯离子浓度较大,产生的氯化亚铜能溶于氯离子浓度较大的体系;氯化亚铜难溶于水,所以加水稀释就产生大量白色沉淀 硫酸 醇洗有利于加快去除CuCl表面水分防止其水解氧化 4.72×10-7
【详解】(1)由题意知氧化酸浸过程有单质S、CuSO4和H2O生成,所以此反应的化学方程式2CuS+2H2SO4+O2=2CuSO4+2S+2H2O。
(2)由于酸性条件下硝酸根离子具有强氧化性,可氧化Cu生成CuSO4或Cu2+。溶解温度应控制在60-70℃,原因是温度太低溶解速度慢,温度过高铵盐分解。故答案为CuSO4或Cu2+;温度低溶解速度慢,温度过高铵盐分解。
(3)酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生反应的离子方程式为:2Cu2++ SO32-+2Cl-+H2O=2CuCl+ SO42-+2H+。答案: 2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+。
(4)CuCl难溶于醇和水,可溶于氯离子浓度较大的体系。所以步骤3先加NH4Cl,氯离子浓度较大,产生的氯化亚铜能溶于氯离子浓度较大的体系;氯化亚铜难溶于水,所以加水稀释就产生大量白色沉淀。
(5)因为在潮湿空气中CuCl易水解、氧化,为了防止CuCl溶解氧化引入新杂质,所以应加入硫酸,不能加入硝酸等氧化性酸,因为CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,所以也不能加入盐酸。答案:硫酸。
(6)步骤⑥为醇洗,因乙醇沸点低,易挥发, CuCl又难溶于醇,所以用乙醇洗涤,可快速除去固体表面的水分,防止CuCl水解、氧化,故答案为醇洗有利于加快去除CuCl表面水分防止其水解氧化。
(7)根据沉淀溶解平衡常数:溶液中=[c(Ag+)/c(Ag+))]= Ksp(AgI)/ Ksp(AgCl) =(8.5×10-17) / (1.8×10-10)= 4.72×10-7答案:4.72×10-7。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列溶液一定显酸性的是
A. B.含有 C. D.酚酞变红
2.常温下,用0.10 mol/L的盐酸分别滴定20.00 mL浓度均为0.10 mol/L 的CH3COONa溶液和NaCN溶液,所得滴定曲线如图所示(忽略溶液体积变化)。下列说法正确的是
A.溶液中阳离子的物质的量浓度之和:点②等于点③
B.点①所示溶液中:c(CN-)+c(HCN)>2c(C1-)
C.点②所示溶液中:c(Na+)>c(Cl-)>c (CH3COO-)>c(CH3COOH)
D.点④所示溶液中:c (Na+)+c(CH3COOH)+c (H+)>0.10 mol/L
3.下列叙述正确的是
A.0.1 mol·L-1NH4Cl溶液:c()=c(Cl-)
B.在25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7
C.0.1 mol·L-1与0.2 mol·L-1氨水溶液中c(OH-)之比为1︰2
D.中和pH与体积都相同的氨水和Ba(OH)2溶液,消耗HCl的物质的量之比是1:2
4.常温下,下列各组离子在指定溶液中能大量共存的是
A.无色透明溶液中:、、、
B.弱酸性溶液中:、、、
C.使酚酞变红色的溶液中:、、、
D.的溶液中:、、、
5.关于钠及其化合物的化学用语正确的是
A.钠原子的结构示意图:
B.过氧化钠的电子式:
C.碳酸氢钠的电离方程式:NaHCO3 =Na+ + H+ + CO
D.碳酸钠水溶液呈碱性:CO + H2O HCO + OH-
6.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1mol L-1的(NH4)2SO4溶液中:Na+、Cu2+、Cl-、OH-
B.=10-12的溶液中:Na+、NO、[Al(OH)4]-、CO
C.水电离的c(H+)=1×10-13mol L-1溶液中:Na+、K+、NO、HCO
D.0.1mol L-1的FeCl3溶液中:K+、Mg2+、SO、SCN-
7.水的电离平衡如图两条曲线所示,曲线中的点都符合c(H+)·c(OH-)=常数,下列说法错误的是
A.图中温度T1>T2
B.图中五点Kw间的关系:B>C>A=D=E
C.点A、B、C均是纯水的电离情况
D.T1时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液显碱性
8.25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒(H3PO4、H2PO、HPO、PO)的分布分数δ(平衡时某微粒的浓度与各微粒浓度和的比值)随溶液pH的变化曲线如下图所示。下列说法正确的是
A.25℃时,H3PO4的第一步电离常数为10-2数量级
B.Na2HPO4溶液中:c(Na+)>c(HPO)>c(PO)>c(H2PO)
C.pH=12.3时,溶液中由水电离出的c(H+)=10-12.3mol/L
D.pH=7.2时,溶液中c(Na+)+c(H+)=3c(H2PO)+3c(PO)+c(OH-)
9.常温下,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY的溶液中分别加入NaOH固体,lg随加入NaOH的物质的量的变化情况如图所示。下列叙述错误的是
A.a点由水电离出的=1×10-13mol/L
B.HY溶液导电性先减弱后增强
C.当n(HY):n(NaY)=1:1混合配成溶液,pH=4
D.b点溶液中: =
10.298 K时,向H3PO4溶液中滴入NaOH溶液,溶液中H3PO4、H2PO、HPO、PO的物质的量分数δ(X)随pH的变化关系如图所示。下列叙述错误的是
A.Ka1(H3PO4)的数量级是10-3
B.Kh(H2PO)=1.0×10-6.8
C.在NaH2PO4溶液中,c(H2PO)>c(HPO)>c(H3PO4)
D.pH>10时,主要离子反应为HPO+OH-=PO+H2O
11.常温下,用0.05NaOH溶液分别滴定10.00mL浓度均为0.10的()溶液和HCN()溶液,所得滴定曲线如图。下列说法正确的是
A.①所标曲线为NaOH滴定HCN,两种弱酸滴定均可选用甲基橙作指示剂
B.溶液中水的电离程度:
C.③处溶液有
D.点①和点②溶液混合后:
12.实验测定NaHCO3溶液显碱性,下列说法中正确的是
A.在水溶液中,HCO3 仅发生水解
B.在水溶液中,HCO3 仅发生电离
C.在水溶液中,HCO3 的电离程度要大于水解程度
D.在水溶液中,HCO3 的水解程度要大于电离程度
二、填空题
13.已知如表数据。
化学式 电离平衡常数(25℃)
HCN Ka=4.93×10-10
CH3COOH Ka=1.76×10-5
H2CO3 Ka1=4.30×10-7Ka2=5.61×10-11
NH3·H2O Kb=1.77×10-5
(1)25℃时,pH=11的NaCN溶液中水电离出的c(OH-)=_____mol L-1。
(2)25℃时,等浓度的NaCN、Na2CO3溶液、CH3COONa三种溶液的pH值由大到小的顺序为_____。
(3)0.100mol L-1NH4HCO3溶液中物质的量浓度最大的离子是_____(填化学式)。
(4)向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_____。
(5)25℃1.10mol L-1CH3COOH溶液中,CH3COOH的电离度约为_____。
(6)25℃时等体积等浓度的NaCl与NaCN两溶液中,离子总数NaCl_____NaCN(填“大于”、“小于”或“等于”);
(7)HCN与NaOH反应后的溶液中存在:c(Na+)=c(CN-),该溶液呈_____性(填“酸”“碱”或“中”)。
14.现有相同物质的量浓度的三种钠盐NaX、NaY、NaZ的溶液,测得它们的pH分别为7、8、9,请将它们对应的酸按酸性由强到弱的顺序排列_______,并说明理由_______。
15.已知,常温下几种物质的电离常数如下:
化学式 H2CO3 CH3COOH NH3·H2O H2SO3 HClO
电离平衡常数 Ka1=4.5×10-7Ka2=4.7×10-11 Ka=1.8×10-5 Kb=1.8×10-5 Ka1=1.4×10-2Ka2=6.0×10-8
(1)(NH4)2CO3溶液的pH_______(填“大于”或“小于”)7
(2)物质的量浓度均为0.1mol·L-1的4种溶液:①、②、③、④,按要求从大到小排序。:_______;:_______。(用序号填空)
①少量通入到过量的溶液中:_______。
②少量通入到过量的NaClO溶液中:_______。
(3)25℃时,若氨水的浓度为2.0mol·L-1,溶液中的c(OH )=_______mol·L 1。将SO2通入该氨水中,当c(OH )降至1.0×10 7mol·L 1时,溶液中的=_______。SO2可用足量小苏打溶液吸收,反应的离子方程式是_______。
16.现有如下物质:
①石墨②溶液③稀盐酸④铜⑤溶液⑥⑦⑧冰醋酸
请回答下列问题:
(1)能导电的是___________(填序号,下同),属于电解质的是___________。
(2)NaClO溶液呈碱性,请用离子方程式表示该溶液呈碱性的原因:___________。
(3)若向溶液②中逐滴滴加溶液③,实验过程中的现象为___________;溶液②中离子浓度由大到小的顺序为___________。
(4)已知,向溶液⑤中加入等体积溶液③,混合后溶液中的___________。
三、计算题
17.(1)在25℃下,向浓度均为0.1 mol L 1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_______沉淀(填化学式),生成该沉淀的离子方程式为_______。(已知25℃时,Ksp[Mg(OH)2]=1.8×10 11,Ksp[Cu(OH)2]=2.2×10 20)
(2)相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol L 1盐酸、③0.1 mol L 1氯化镁溶液、④0.1 mol L 1硝酸银溶液中,c(Ag+)由大到小的顺序为:_______
(3)已知:Ksp(AgBr)=5.4×10 13,Ksp(AgCl)=1.8×10 10,向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,=_______。
(4)已知在25℃时,Ksp[Mg(OH)2]=3.2×10 11。25℃时,向0.02 mol L 1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为_______mol L 1。
(5)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是_______
A.加入Na2SO4可使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.b点有BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
18.过氧化钙晶体(CaO2·8H2O)可用于改善地表水质、处理含重金属粒子废水、应急供氧等。
(1)已知:I2+2=2I-+,测定制备的过氧化钙晶体中CaO2的含量的实验步骤如下:
第一步:准确称取a g产品放入锥形瓶中,再加入过量的b g KI晶体,加入适量蒸馏水溶解,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。第二步:向上述锥形瓶中加入几滴淀粉溶液。第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液发生反应,滴定达到终点时出现的现象是___________。若滴定消耗Na2S2O3溶液V mL,则样品中CaO2的质量分数为___________(用字母表示)。
(2)已知过氧化钙加热至350 ℃左右开始分解放出氧气。将过氧化钙晶体(CaO2·8H2O)在坩埚中加热逐渐升高温度,测得样品质量随温度的变化如图所示,则350 ℃左右所得固体物质的化学式为___________。
四、工业流程题
19.铍是航天航空、火箭导弹和原子能工业不可替代的材料,有“超级金属”之称。素有“中国铍业”之称的某厂改进国外以绿柱石[Be3Al2(SiO3)6]为原料制备金属铍的工艺,以硅铍石(主要成分为 )为原料提取铍,具体流程如图:
已知:①铍和铝在元素周期表中处于对角线位置,其单质及化合物的结构与性质具有相似性。
②熔融可离子化(生成铍氯配离子)。
③铝铵矾在不同温度下的溶解度如下表:
温度/℃ 0 10 20 30 40 60
溶解度/含 2.10 5.00 7.74 10.9 14.9 26.7
回答下列问题:
(1)绿柱石[Be3Al2(SiO3)6]用氧化物形式表示为_______;流程中“系列操作”为_______。
(2)将“中和液”沉淀时,调节溶液的pH不能过大或过小。pH过大时发生反应的离子方程式为_______。
(3)已知 若 浓度为 的中和液开始沉淀时,溶液中 c(Al3+)=_______mol/L
(4)若在实验室洗涤粗 操作为_______。
(5)氧化铍转化为氯化铍的化学方程式为_______。
(6)的电子式为_______;工业上电解 熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应为_______电解时需加入氯化钠的作用是_______。
20.以硫化铜精矿为原料生产CuCl的工艺过程如下:
已知CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化,海绵铜中含少量CuO等。
(1)经测定氧化酸浸过程有单质S生成,写出此过程中的化学方程式_____________
(2)步骤①中得到的氧化产物是____________,溶解温度应控制在60—70℃,原因是_____________。
(3)写出步骤③中主要反应的离子方程式_____________。
(4)步骤③先加NH4Cl、再加入亚硫酸铵时无沉淀,加水稀释就产生大量白色沉淀,其原因_____________。
(5)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_____________(写名称)。
(6)上述工艺中,步骤⑥不能省略,理由是_____________。
(7)上述浓缩液中含有Iˉ、CIˉ等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中中为_____________。(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.c(H+)>c(OH-),说明溶液显酸性,A正确;
B.任何水溶液中,都含有H+,故含有H+的溶液不一定显酸性,B错误;
C.在100℃时,水的离子积KW=10-12,即水中c(H+)=c(OH-)=10-6mol/L,pH=6<7,此时溶液呈中性,故pH<7的溶液不一定显酸性,C错误;
D.使酚酞变红的溶液显碱性,D错误;
故选A。
2.D
【详解】A.根据电荷守恒,点②中存在c(CH3COO-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),点③中存在c(CN-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),由于两点的溶液体积不等,溶液的pH相等,则c(Na+)不等,c(H+)分别相等,因此阳离子的物质的量浓度之和不等,A错误;
B.点①所示溶液中含有等物质的量浓度的NaCN、HCN和NaCl,存在物料守恒,c(CN-)+c(HCN)=2c(Cl-),B错误;
C.点②所示溶液中含有CH3COONa、CH3COOH和NaCl,其中CH3COONa的浓度略大于CH3COOH和NaCl,溶液的pH=5,说明以醋酸的电离为主,因此c(CH3COO-)>c(Cl-),C错误;
D.点④所示溶液为等物质的量浓度的醋酸和氯化钠,浓度均为0.05 mol·L-1,则c(Na+)= c(Cl-)=0.05 mol·L-1,c(CH3COO-)+c(CH3COOH)=0.05 mol·L-1,根据电荷守恒,c(CH3COO-)+c(OH-)+c(Cl—)=c(Na+)+c(H+),因此c(CH3COO-)=c(H+)-c(OH-),则c(Na+)+c(CH3COOH)+c(H+)=0.05 mol·L-1+0.05 mol·L-1-c(CH3COO-)+c(H+)=0.10 mol·L-1- c(H+)+c(OH-)+c(H+)=0.10 mol·L-1+c(OH-)>0.10 mol·L-1,D正确;
故答案选D。
3.B
【详解】A.NH4Cl溶液中水解,所以c()
C.弱电解质浓度越稀电离程度越大,所以0.1 mol·L-1与0.2 mol·L-1氨水溶液中c(OH-)之比大于1:2,C错误;
D.pH相同时,弱碱氨水的浓度比氢氧化钡要大很多,中和消耗的盐酸也比氢氧化钡要多,D错误;
答案选B。
4.B
【详解】A.和水解相互促进,反应完全,不能大量共存,A错误;
B.弱酸性溶液中,、、、均可大量共存,B正确;
C.使酚酞变红色的溶液呈碱性,、会生成沉淀,不能大量共存,C错误;
D.的溶液呈酸性,发生歧化反应生成硫单质和二氧化硫,不能大量共存,D错误;
故选B。
5.D
【详解】A.钠原子核外电子数与质子数相同,钠离子的结构示意图为,A用语错误;
B.过氧化钠为离子化合物,其电子式为,B用语错误;
C.碳酸氢钠为强电解质,其电离方程式为NaHCO3=Na++,C用语错误;
D.碳酸钠为强碱弱酸盐,水溶液中碳酸根离子水解导致溶液呈碱性,水解方程式为CO +H2OHCO+OH-,D用语正确;
答案为D。
6.B
【详解】A.硫酸铵溶液中电离产生,与氢氧根离子不共存,与氢氧根离子不共存,A项错误;
B.<1,此时溶液为碱性,溶液中的离子共存,B项正确;
C.室温下,水电离的c(H+)=1×10-13mol L-1溶液中,pH为13或者pH为1,HCO在pH=13和pH=1的溶液中均不共存,C项错误;
D.铁离子与SCN-发生络合反应溶液变为红色,则与不共存,D项错误;
答案选B。
7.C
【分析】根据题中所给信息,曲线上的点都符合c(H+)·c(OH-)=Kw,水的离子积只受温度的影响,水的电离是吸热过程,升高温度,促进电离,水的离子积增大,即T1>T2,据此分析
【详解】A.曲线上的点都符合c(H+)·c(OH-)=Kw,水的离子积只受温度的影响,升高温度,促进水的电离,水的离子积增大,根据图像可知,T1>T2,故A说法正确;
B.根据上述分析可知,五点温度:B>C>A=E=D,温度升高,水的离子积增大,图中五点水的离子积之间的关系:B>C>A=E=D,故B说法正确;
C.点A、B、C三点溶液中c(H+)=c(OH-),溶液显中性,三点不一定是纯水的电离情况,可以是NaCl、Na2SO4等中性溶液,故C说法错误;
D.T1时,水的离子积为10-12mol/L,pH=2的硫酸溶液中c(H+)=10-2mol/L,pH=12的KOH溶液中c(OH-)=1mol/L,两者等体积混合,KOH过量,溶液显碱性,故D说法正确;
答案为C。
8.D
【详解】A.某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒依次为H3PO4、H2PO、HPO、PO,H3PO4的第一步电离常数为,pH=2.1时,,所以,为10-3数量级,故A错误;
B. Na2HPO4溶液中, 的电离平衡常数, 又因,所以的水解平衡常数为,所以的水解大于电离,所以c(Na+)>c(HPO)>c(H2PO)>c(PO),故B错误;
C. pH=12.3时,溶液中的溶质是Na3PO4和Na2HPO4, Na3PO4是强碱弱酸盐会水解,由B分析可知Na2HPO4水解大于电离,所以混合液中水的电离被促进,由水电离出的c(H+)>10-7mol/L,故C错误;
D. pH=7.2时,溶液中的溶质是NaH2PO4和Na2HPO4,且,由电荷守恒知c(Na+)+c(H+)= +c(H2PO)+3c(PO)+c(OH-),所以c(Na+)+c(H+)=3c(H2PO)+3c(PO)+c(OH-),故D正确;
故答案为:D。
9.B
【分析】由图可知,未加入氢氧化钠固体时,a点HX溶液中lg为12,0.1mol/LHX溶液中氢离子浓度为 mol/L =0.1mol/L,则HX为强酸、HY为弱酸,b点HY溶液中lg为0,溶液中氢离子浓度与氢氧根离子浓度相等,所得HY和NaY的混合溶液呈中性,c点为等物质的量的HY和NaY的混合溶液,溶液呈酸性。
【详解】A.由分析可知,a点HX溶液中lg为12,0.1mol/LHX溶液中氢离子浓度为0.1mol/L,则水电离出的氢离子浓度为=1×10-13mol/L,故A正确;
B.由分析可知,HY为弱酸,向HY溶液中加入氢氧化钠固体,溶液中的离子浓度增大,溶液的导电性增强,故B错误;
C.由图可知,c点为等物质的量的HY和NaY的混合溶液,溶液中lg为6,溶液中氢离子浓度为 mol/L =10—4mol/L,溶液pH为4,则当n(HY):n(NaY)=1:1混合配成溶液,溶液pH=4,故C正确;
D.由分析可知,b点HY溶液中lg为0,溶液中氢离子浓度与氢氧根离子浓度相等,所得HY和NaY的混合溶液呈中性,由电荷守恒可知c(Na+)+ c(H+)=c(Y—)+ c(OH—),溶液中c(Na+)= c(Y—),故D正确;
故选B。
10.B
【详解】A.多元弱酸的电离是分步的,Ka1(H3PO4)=,根据图象可知,当c(H2PO)=c(H3PO4)时,Ka1(H3PO4)=c(H+)=1.0×10-2.1=7.9×10-3,故A正确;
B.Kh(H2PO)==1.0×10-11.9,故B错误;
C.根据图象可知当H2PO的物质的量分数δ(X)近似为1时溶液显酸性,这说明H2PO的电离程度大于其水解程度,又因为H2PO的水解和电离都是微弱的,则在NaH2PO4溶液中,c(H2PO)>c(HPO)>c(H3PO4),故C正确;
D.根据图象可知pH>10时HPO转化为PO,则主要离子反应为HPO+OH-=PO+H2O,故D正确;
故选B。
11.D
【详解】A.两种酸浓度相同,由于HCN酸性更弱,故其pH更大,①所标曲线为NaOH滴定HCN,恰好反应生成NaCN,显碱性,由于甲基橙的变色范围是pH在3.1到4.4之间,因此滴定HCN时,不宜用甲基橙作为指示剂,A错误;
B.②处溶液,溶液呈酸性,醋酸电离为主,抑制水的电离,③处溶液,此时存在和少量的,④处为滴定终点,溶液中恰好生成,水解促进水的电离,因此溶液中水的电离程度:②<③<④,B错误;
C.③处溶液的,溶液呈中性,溶液中,对于所滴定的醋酸溶液,根据电荷守恒,,由于,则,此时滴加NaOH的体积不到20mL,因此溶液中还存在极少量的,则浓度关系应为,C错误;
D.点①的溶液中存在和,根据物料守恒,,点②溶液中存在NaCN和HCN,根据物料守恒,,两溶液混合,则有,即,故D正确;
故选:D。
12.D
【详解】碳酸钠溶液中的碳酸根离子应该存在电离和水解,因为溶液显碱性,说明其电离一定大于水解(因为电离得到氢离子,水解得到氢氧根);
所以选项D正确。
13. 10-3 Na2CO3>NaCN>CH3COONa NH4+ NaCN+H2O+CO2=NaHCO3+HCN 0.4% 大于 中
【分析】根据溶液的pH及水的离子积计算溶液中水电离的氢离子浓度;根据电离常数的大小分析比较溶液的酸碱性;根据盐类水解原理分析解答;根据弱酸的电离平衡常数计算电离度;根据溶液中守恒关系分析比较离子浓度大小。
【详解】(1)pH=11的NaCN溶液,c(H+)=10-11mol L-1,Kw=c(H+)×c(OH-)=10-14,故c(OH-)=10-3mol L-1,氢氧根离子来源于水的电离,故c(OH-)水=10-3mol L-1,故答案为:10-3;
(2)根据图表数据分析,电离常数:醋酸>HCN>碳酸氢根离子,所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的pH:Na2CO3溶液>NaCN溶液>CH3COONa溶液;故答案为:Na2CO3>NaCN>CH3COONa;
(3)铵根离子水解而导致其溶液呈酸性,碳酸氢根离子水解使溶液呈碱性,根据电离常数可知碳酸氢根离子的水解能力大于铵根离子, NH4HCO3溶液呈碱性;碳酸氢根离子水解程度大于铵根离子,故溶液中离子浓度最大的是NH4+,故答案为: NH4+;
(4)向NaCN溶液中通入少量CO2,由于酸性:H2CO3>HCN>HCO3-,故反应生成HCN和碳酸氢钠,不能生成碳酸钠,故反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3,故答案为:NaCN+H2O+CO2=HCN+NaHCO3;
(5)1.10mol/L的CH3COOH溶液中,CH3COOH的电离常数Ka= ,醋酸根离子和氢离子浓度相等,所以,CH3COOH的电离度约,故答案为:0.4%;
(6)根据电荷守恒分析知,等体积等浓度的NaCl与NaCN两溶液中,离子总数都等于阳离子总数的二倍,两溶液中的钠离子不水解,所以数目相同,NaCl溶液呈中性,则c(H+)=10-7mol/L,NaCN溶液呈碱性,则c(H+)<10-7mol/L,则离子总数NaCl大于NaCN,故答案为:大于;
(7)HCN与NaOH反应后的溶液中存在电荷守恒:c(Na+)+ c(H+)=c(CN-)+c(OH-),若c(Na+)=c(CN-),则c(H+)= c(OH-),该溶液呈中性,故答案为:中。
14. HX>HY>HZ NaX溶液显中性,为强碱强酸盐;NaY、NaZ的溶液均显碱性,则均为强碱弱酸盐,根据越弱越水解原理可知,它们对应的酸按酸性由强到弱的顺序为HX>HY>HZ
【详解】NaX溶液显中性,为强碱强酸盐;NaY、NaZ的溶液均显碱性,则均为强碱弱酸盐,根据越弱越水解原理可知,它们对应的酸按酸性由强到弱的顺序为HX>HY>HZ。
15.(1)大于
(2) ④③①② ②①③④
(3) 6.010-3 mol·L-1 0.6 SO2+HCO=HSO+ CO2
【解析】(1)
由图表可知,NH3·H2O与H2CO3相比较,Kb> Ka2,则碳酸根离子水解程度大于铵根离子,故溶液显碱性,pH大于7;
(2)
①为强酸弱碱盐,溶液显酸性,②中完全电离出铵根离子、氢离子、硫酸根离子,酸性比①强;③为弱酸弱碱盐,Ka= Kb,故显中性;④为弱碱,溶液显碱性;故由大到小的顺序为④③①②;
①②③为强电解质,完全电离,④为弱电解质,铵根离子浓度最小;①中铵根离子部分水水解,②中铵根离子水解受到抑制,③中铵根离子和醋酸根离子相互促进水解;故由大到小的顺序为②①③④;
①HClO的电离常数大于碳酸的二级电离但小于其一级电离,故少量通入到过量的溶液中生成碳酸氢根离子和次氯酸根离子、氯离子:;
②少量通入到过量的NaClO溶液中生成次氯酸和碳酸氢根离子:;
(3)
25℃时,NH3·H2O的Kb=1.8×10-5,若氨水的浓度为2.0mol·L-1,,氨水的电离程度很小,认为=2.0mol·L-1,因为,则=6.010-3 mol·L-1;
将SO2通入该氨水中,当c(OH )降至1.0×10 7mol·L 1时,则c(H+)=1.0×10 7mol·L 1,H2SO3
的Ka2==6.0×10-8,则溶液中的=;
SO2可用足量小苏打溶液吸收,反应生成二氧化碳和亚硫酸氢根离子,离子方程式是SO2+HCO=HSO+ CO2。
16.(1) ①②③④⑤ ⑥⑧
(2)
(3) 无明显现象
(4)
【解析】(1)
能导电物质有石墨、金属、电解质的水溶液或熔融状态,能导电的有①②③④⑤;电解质有酸、碱、多数盐、多数金属氧化物和水,属于电解质的有⑥⑧;故答案为①②③④⑤;⑥⑧;
(2)
NaClO属于强碱弱酸盐,ClO-在水中发生水解,水解方程式为ClO-+H2OHClO+OH-,溶液中c(OH-)>c(H+),溶液显碱性;故答案为ClO-+H2OHClO+OH-;
(3)
碳酸钠和稀盐酸的物质的量相等,发生Na2CO3+HCl=NaHCO3+NaCl,溶液无现象;Na2CO3为强碱弱酸盐,CO发生水解:CO+H2OHCO+OH-、HCO+H2OH2CO3+OH-,水属于弱电解质,其电离方程式为H2OH++OH-,盐类水解程度微弱,离子浓度大小顺序是c(Na+)>c(CO)>c(OH-)>c((HCO)>c(H+);故答案为溶液无现象;c(Na+)>c(CO)>c(OH-)>c((HCO)>c(H+);
(4)
AgNO3与HCl反应AgNO3+HCl=AgCl↓+HNO3,根据题中所给数据,盐酸过量,反应后c(Cl-)==1×10-3mol·L-1,c(Ag+)=mol/L=1.8×10-7mol·L-1;故答案为1.8×10-7。
17. Cu(OH)2 2NH3·H2O+Cu2+ =Cu(OH)2↓+2NH ④>①>②>③ 3×10 3 4×10 5 C
【详解】(1)在25℃下,向浓度均为0.1 mol L 1的MgCl2和CuCl2混合溶液中逐滴加入氨水,沉淀镁离子需要的氢氧根浓度,沉淀铜离子需要的氢氧根浓度,氢氧根浓度最先满足沉淀铜离子所需浓度,因此先生成Cu(OH)2沉淀,生成该沉淀的离子方程式为2NH3·H2O+Cu2+ =Cu(OH)2↓+2NH;故答案为:Cu(OH)2;2NH3·H2O+Cu2+ =Cu(OH)2↓+2NH。
(2)相同温度下,氯化银溶解平衡AgCl(s)Ag+(aq)+Cl-(aq),将足量氯化银固体分别放入相同体积的①蒸馏水,平衡正向移动,但银离子浓度不变;②0.1 mol L 1盐酸,氯离子浓度增大,平衡逆向移动;③0.1 mol L 1氯化镁溶液,氯离子浓度增大,比②中氯离子浓度大,平衡逆向移动比②更多,银离子浓度比②中银离子浓度小;④0.1 mol L 1硝酸银溶液,平衡逆向移动,但银离子浓度比原来大,因此c(Ag+)由大到小的顺序为:④>①>②>③;故答案为:④>①>②>③。
(3)已知:Ksp(AgBr)=5.4×10 13,Ksp(AgCl)=1.8×10 10,向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,;故答案为:3×10 3。
(4)已知在25℃时,Ksp[Mg(OH)2]=3.2×10 11。25℃时,向0.02 mol L 1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小,则c(OH-)=4×10 5mol L 1;故答案为:4×10 5。
(5)A.加入Na2SO4,硫酸根浓度增大,硫酸钡溶解平衡逆向移动,钡离子浓度减小,曲线从a点往c点移动,故A错误;B.d点蒸发溶剂,溶液体积减小,钡离子浓度、硫酸根浓度同时增大,c点与b点硫酸根浓度不变,钡离子浓度增大,因此蒸发溶液不可能由d点变到c点,故B错误;C.b点浓度积大于Ksp,因此有BaSO4沉淀生成,故C正确;D.ac曲线是硫酸钡的溶度积常数变化曲线,因此a点对应的Ksp等于c点对应的Ksp,故D错误;综上所述,答案为C。
18. 溶液由蓝色变无色,且30 s内不恢复蓝色 % CaO
【分析】碘遇淀粉变蓝色,根据电子转移守恒及题中反应方程式,可得关系式:CaO2~I2~2,据此列式计算;固体由2.16g加热到350℃时变为0.56g,在加热过程中固体中钙元素的量不变,据此计算剩余固体中Ca、O元素的质量,进而确定化学式。
【详解】(1)碘遇淀粉变蓝色,滴入最后一滴Na2S2O3溶液,溶液由蓝色变成无色,且30s内不出现蓝色,说明滴定到达终点;根据电子转移守恒及题中反应方程式,可得关系式:CaO2~I2~2,设样品中CaO2的质量分数为x,则有=,解得x=%,故答案为:溶液由蓝色变成无色,且30s内不出现蓝色;%;
(2)固体由2.16g加热到350℃时变为0.56g,在加热过程中固体中钙元素的量不变,剩余固体中n(Ca)=n(CaO2 8H2O)==0.01mol,m(Ca)=0.01mol×40g/mol=0.4g,则剩余固体中m(O)=0.56g-0.4g=0.16g,故n(O)==0.01mol,故n(Ca):n(O)=1:1,剩余固体的化学式为CaO,故答案为:CaO。
19.(1) 3BeO Al2O3 6SiO2 蒸发浓缩、降温结晶、过滤
(2)
(3)4.0×10-3
(4)向过滤器中加入NaOH溶液至浸没沉淀,将溶液滤出,重复操作2~3次
(5)BeO+C+Cl2=BeCl2+CO
(6) Be2++2e-=Be 增强导电性或BeCl2为共价化合物,加入NaCl使BeCl2转化为气体含铍的离子化合物
【分析】硅铍石经过原料预处理后用硫酸酸浸,浸出液中有Be2+、Al3+、Fe2+、Fe3+、H+、,SiO2形成浸出渣分离,浸出液加入硫酸铵,经过蒸发浓缩、降温结晶、过滤分离出铝铵矾晶体,净化液加入氧化剂将Fe2+氧化为Fe3+然后加氨水调pH除去铁,过滤后往中和液中加入碱性物质继续调pH使Be2+完全沉淀,洗涤后的Be(OH)2高温煅烧分解生成BeO,后加入氯气和过量的碳反应生成氯化铍:BeO+C+Cl2=BeCl2+CO,氯化铍为共价化合物,需要加入氯化钠转化为离子化合物,然后电解得到铍单质;
(1)
绿柱石[Be3Al2(SiO3)6]用氧化物形式表示为3BeO Al2O3 6SiO2;根据铝铵矾在不同温度下的溶解度数据可知,铝铵矾随着温度的降低而减小,所以要从溶液中获得铝铵矾晶体进行的‘系列操作’为蒸发浓缩、降温结晶、过滤;
(2)
将“中和液”沉淀时,形成Be(OH)2,已知铍和铝在元素周期表中处于对角线位置,其单质及化合物的结构与性质具有相似性,Be(OH)2同Al(OH)3类似,会与强碱溶液反应,所以pH过大时发生反应的离子方程式为;
(3)
Ksp[Be(OH)2]=4.0×10-21=c(Be2+) c3(OH-),c(Be2+)=0.40mol/L,则c(OH-)=,由Ksp[Al(OH)3]=4.0×10-33=c(Al3+) c3(OH-),则c(Al3+)=;
(4)
实验室洗涤粗Be(OH)2的操作是向过滤器中加入NaOH溶液至浸没沉淀,将溶液滤出,重复操作2~3次;
(5)
氧化铍与氯气和过量的碳反应生成氯化铍,根据质量守恒和得失电子守恒可知反应方程式为BeO+C+Cl2=BeCl2+CO;
(6)
铍和铝电负性相近,所以氯化铍为共价化合物,则BeCl2的电子式为,电解时阴极上铍离子得电子生成铍单质,电极反应式为Be2++2e-=Be;氯化钠的作用为增强导电性或BeCl2为共价化合物,加入NaCl使BeCl2转化为气体含铍的离子化合物。
20. 2CuS+2H2SO4+O2=2CuSO4+2S+2H2O CuSO4或Cu2+ 温度低溶解速度慢,温度过高铵盐分解 2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+ 步骤3先加NH4Cl,氯离子浓度较大,产生的氯化亚铜能溶于氯离子浓度较大的体系;氯化亚铜难溶于水,所以加水稀释就产生大量白色沉淀 硫酸 醇洗有利于加快去除CuCl表面水分防止其水解氧化 4.72×10-7
【详解】(1)由题意知氧化酸浸过程有单质S、CuSO4和H2O生成,所以此反应的化学方程式2CuS+2H2SO4+O2=2CuSO4+2S+2H2O。
(2)由于酸性条件下硝酸根离子具有强氧化性,可氧化Cu生成CuSO4或Cu2+。溶解温度应控制在60-70℃,原因是温度太低溶解速度慢,温度过高铵盐分解。故答案为CuSO4或Cu2+;温度低溶解速度慢,温度过高铵盐分解。
(3)酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生反应的离子方程式为:2Cu2++ SO32-+2Cl-+H2O=2CuCl+ SO42-+2H+。答案: 2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+。
(4)CuCl难溶于醇和水,可溶于氯离子浓度较大的体系。所以步骤3先加NH4Cl,氯离子浓度较大,产生的氯化亚铜能溶于氯离子浓度较大的体系;氯化亚铜难溶于水,所以加水稀释就产生大量白色沉淀。
(5)因为在潮湿空气中CuCl易水解、氧化,为了防止CuCl溶解氧化引入新杂质,所以应加入硫酸,不能加入硝酸等氧化性酸,因为CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,所以也不能加入盐酸。答案:硫酸。
(6)步骤⑥为醇洗,因乙醇沸点低,易挥发, CuCl又难溶于醇,所以用乙醇洗涤,可快速除去固体表面的水分,防止CuCl水解、氧化,故答案为醇洗有利于加快去除CuCl表面水分防止其水解氧化。
(7)根据沉淀溶解平衡常数:溶液中=[c(Ag+)/c(Ag+))]= Ksp(AgI)/ Ksp(AgCl) =(8.5×10-17) / (1.8×10-10)= 4.72×10-7答案:4.72×10-7。
答案第1页,共2页
答案第1页,共2页
