第二章第一节钠及其化合物同步练习(含解析)二高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第二章第一节钠及其化合物同步练习(含解析)二高一上学期化学人教版(2019)必修第一册 |
|
|
| 格式 | docx | ||
| 文件大小 | 712.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-24 10:33:01 | ||
图片预览




文档简介
人教版(2019) 必修一 第二章 第一节 钠及其化合物
同步练习二
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1、钠在自然界中最主要的存在形式是( )
A.游离态 B.氯化钠 C.硫酸钠 D.硝酸钠
2、Na与酸、水、氧气、氯气等均能反应,下列说法中正确的是( )
A.将Na投入盐酸中,Na先与水反应,生成的NaOH再与HCl反应
B.Na与氧气在常温下反应生成,加热时二者反应生成
C.Na虽然能与氯气反应生成NaCl,但不能在氯气中燃烧
D.常温下,Na可以与水反应,证明Na比Fe更活泼
3、某兴趣小组用下列装置探究Na与的反应产物,已知。下列说法正确的是( )
A.为了避免生成的中混有HCl,最好用稀硫酸代替稀盐酸
B.装置Ⅲ的目的是除去HCl
C.实验时先点燃酒精灯,再打开活塞a
D.装置Ⅴ中出现黑色沉淀,则装置Ⅳ中发生反应
4、如图所示。将一小块金属钠投入盛有液体的烧杯中。下列说法错误的是(夹持装置已略去)( )
A.—段时间后,烧杯底部有红色难溶物生成
B.若观察到金属钠被煤油浸没。则金属钠的密度比煤油大
C.该实验进行过程中可观察到有气泡产生
D.反应进行一段时间(反应未结束),此时温度计的读数大于起始时的读数
5、将金属钠放入盛有下列溶液的小烧杯中,既有气体产生,又有沉淀产生的是( )
①溶液
②溶液
③溶液
④饱和澄清石灰水
⑤溶液
A.①③④ B.②⑤ C.①④ D.全部
6、金属钠着火时,适用于灭火的是( )
A.水
B.煤油
C.泡沫灭火器
D.干燥沙土
7、和具有的相似性质是( )
A.颜色 B.水溶液的酸碱性
C.氧化性 D.漂白性
8、取甲、乙两个相同的小烧杯,分别加入6.2g固体和7.8g固体,再加入等体积的蒸馏水使其完全溶解。下列有关叙述正确的是( )
A.两烧杯中反应的类型相同
B.两烧杯中均有气体产生
C.反应后溶液的质量:甲<乙
D.反应后溶质的质量:甲=乙
9、 下列关于和的对比中,错误的是( )
A. 阴阳离子个数比均为 B. 在空气中加热时比更稳定
C. 均为碱性氧化物 D. 加入到硫酸铜溶液中均有沉淀产生
10、如图装置,试管中盛有水,气球a中盛有干燥的粉末,U形管中注有红色的墨水。将气球用橡皮筋紧缚在试管口。实验时将气球中的粉末抖落到试管b中的水中,将发生的现象是( )
A.U形管内红色墨水褪色 B.试管内溶液变红
C.气球a被吹大 D.U形管水位:c>d
11、下列说法正确的是( )
①钠燃烧时发出黄色的火焰
②过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物
③过氢化钠能与水反应,所以过氧化钠可以作气体的干燥剂
④过氧化钠中阴阳离子个数比为1:1
⑤钠是一种很强的还原剂,钠可以把锆、铌等金属从它们的化合物的水溶液中置换出来
⑥分别与水及反应产生相同量的时,需要水和的质量相等
⑦可用水来确定某粉末中是否含有
⑧将足量的、分别加到酚酞试液中,最终溶液均为红色
A.①②⑤⑦ B.①⑧ C.①②⑤⑧ D.①⑦
12、已知乙烯()在燃烧时与甲烷类似,现有14g充分燃烧后,将生成的所有物质与78g过氧化钠混合,充分反应后,残留的固体物质是( )
A. B.
C. D.
13、下列对的叙述中不正确的是( )
A. 该物质属于盐类
B. 该物质既含金属元素又含非金属元素
C. 该物质不能发生化合反应
D. 该物质有时候能和NaOH划为一类
14、甲、乙、丙、丁四个烧杯中分别盛有一定量NaOH溶液,向其中分别通入不同量的,再向所得溶液中分别滴加相同浓度的稀盐酸至过量,加热溶液,甲、乙、丙、丁四个烧杯中产生的质量与加入盐酸的体积关系如图Ⅰ~Ⅳ所示(忽略的溶解和HCl的挥发):
则下列分析正确的是( )
A.Ⅰ图对应溶液中的溶质为
B.Ⅱ图a~b段生成的质量与之前通入乙烧杯NaOH溶液中的质量相等
C.Ⅲ图对应溶液中的溶质为NaOH和
D.Ⅳ图段离子方程式为
15、某学生用和组成的某混合物与盐酸反应,测得如表数据(盐酸逐滴滴加,物质的量浓度相等且不考虑HCl的挥发)下列有关的说法中,正确的是( )
实验序号 ① ② ③ ④
盐酸体积/mL 50 50 50 50
固体质量/g 3.06 6.12 9.18 12.24
生成气体体积/L(标况) 0.672 1.344 1.568 1.344
A.盐酸的物质的量浓度为2
B.原混合物样品中
C.实验③中,固体与盐酸恰好完全反应
D.实验④反应后,至少需继续加入40 mL的该盐酸才能把12.24 g的混合物全部反应
二、填空题
16、溶液不仅在受热时能分解放出,而且在室温时亦能分解。
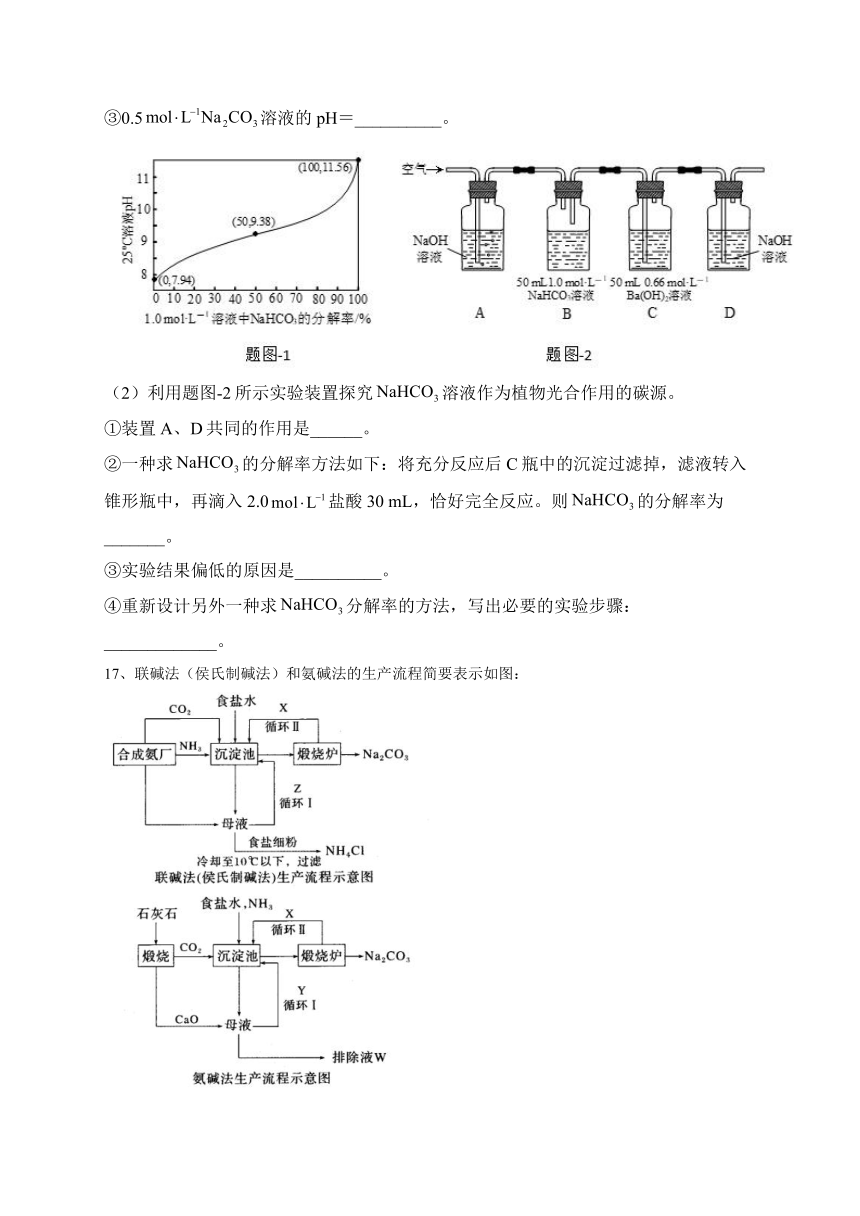
(1)25℃时,溶液pH随分解率的变化曲线如题图-1所示。
①溶液分解反应的离子方程式为________。
②等物质的量浓度的和溶液相比,前者碱性______(填“强”或“弱”)。
③0.5溶液的pH=__________。
(2)利用题图-2所示实验装置探究溶液作为植物光合作用的碳源。
①装置A、D共同的作用是______。
②一种求的分解率方法如下:将充分反应后C瓶中的沉淀过滤掉,滤液转入锥形瓶中,再滴入2.0盐酸30 mL,恰好完全反应。则的分解率为_______。
③实验结果偏低的原因是__________。
④重新设计另外一种求分解率的方法,写出必要的实验步骤:_____________。
17、联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如图:
(1)沉淀池中发生反应的离子方程式为__________。
(2)X是__________,Y是__________(填化学式)。
(3)Z中除了溶解的氨气、食盐外,其他溶质还有__________;排出液W中的溶质除了氢氧化钙外,还有__________。
(4)从理论上分析,在氨碱法生产过程中__________(填“需要”或“不需要”)补充氨气。
(5)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确的是__________(填字母)。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高的浓度,促进碳酸氢钠结晶析出
18、维生素C泡腾片可以为人体补充维生素C,增强机体抵抗力。维生素C泡腾片的主料为维生素C,辅料为阿朴胡萝卜醛、橘味香精、橙味香精、维生素B、糖精钠、碳酸氢钠、氯化钠、蔗糖和酒石酸晶体。将维生素C泡腾片放入一杯水中,药片会不断溶解,同时产生大量气泡,片刻后即成为一杯鲜甜的饮品。请回答以下问题:
(1)维生素C泡腾片放入水中后,产生的气泡是 气体,产生气泡的主要原因是 。
(2)维生素C泡腾片在投人水中以前不产生气体的原因是 。
(3)维生素C泡腾片的贮藏除要求低温、避光外,还要求干燥,其原因是 。
19、现有两份与的混合物X和Y。
已知受热难分解,而受热易分解:。
(1)现取500g混合物X,充分加热后混合物质量减少了0.31g,则原混合物中碳酸钠的质量为_______。
(2)现取500g混合物Y,充分加热至恒重,把放出的气体通入足量澄清石灰水中,生成2.00g沉淀,则原混合物中碳酸氢钠的质量分数为_______。
20、和是两种重要的钠盐。
(1)探究、的稳定性
如图所示,在加热过程中能观察到产生白色沉淀的烧杯是___________(填“Ⅰ”或“Ⅱ”),该烧杯中发生反应的离子方程式是___________,通过该实验可比较出___________(填“”或“”)更稳定。
(2)探究、溶液分别与盐酸反应过程的热量变化
步骤1:分别取等浓度的、溶液,测量温度为;
步骤2:分别加入密度约为的盐酸(20℃),搅拌,测量温度为;
步骤3:数据记录:
温度 试剂
20.0 23.7
20.0 20.8
步骤4:实验分析。甲同学分析上述数据认为两个反应都放出热量,乙同学认为甲同学的分析不严谨,应该补做如下实验:向盛有水(20℃)的烧杯中加入___________,搅拌,测量温度为,再比较和的大小。若___________,说明溶液与盐酸的反应吸收热量,而与盐酸的反应放出热量。
(3)除去粉末中混有的少量的方法是___________,所涉及反应的化学方程式为___________。
三、实验题
21、某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做以下实验,如图所示。
(1)写出Ⅰ中与盐酸发生反应的化学方程式。
①:__________________________________________________________,
②:_____________________________________________________________,
③由此可知此装置__________(填“能”或“不能”)鉴别和。
(2)Ⅱ装置能鉴别和的现象是_________________________________。
(3)Ⅲ、Ⅳ装置均利用了和________性的区别。有关化学方程式为__________________________________________________________________。
(4)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是____________(填化学式)。有的同学在盛的导管口观察到开始加热时也有气泡产生,据此此同学认为加热也能分解。你认为此观点________(填“正确”或“错误”)。分析此现象的原因为_________。
(5)除了以上方法,请你再举出一例鉴别二者的方法:________________________________。
22、
某小组的同学对放置已久的过氧化钠的成分进行探究,请回答下列问题:
(1)反应2Na2O2+2H2O===4NaOH+O2↑的还原剂是________(写化学式);反应2Na2O2+2CO2===2Na2CO3+O2中,每生成1 mol O2转移________mol电子。
(2)进行探究:
①提出假设。
假设1:全部是Na2O2
假设2:全部是Na2CO3
假设3:________________
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、1 mol·L-1 H2SO4溶液、澄清石灰水、淀粉-KI溶液、酚酞溶液、火柴、试管、小烧杯、胶头滴管。
实验步骤 预期现象和结论
步骤1:取少量固体样品于试管中,滴加足量1 mol·L-1 H2SO4溶液,然后将内壁附有澄清石灰水的烧杯罩于试管口 若澄清石灰水未见浑浊,则假设1成立;
若澄清石灰水变浑浊,则______________________
步骤2:
步骤3:
参考答案
1、答案:B
解析:A.钠的性质非常活泼,所以在自然界存在的主要形式是以化合物的形式存在,故A错误; B.海水中含有氯化钠、井盐、糊盐、岩盐都含有氯化钠,所以氯化钠为钠在自然界中最主要的存在形式,故B正确; C.硫酸钠是钠元素在自然界中存在形式之,但不是最主要存在形式,故C错误; D.硝酸钠是钠元素在自然界中存在形式之,但不是最主要存在形式,故D错误;故选B。
2、答案:D
解析:将Na投入盐酸中,Na先与酸反应,A错误;Na与氧气在常温下反应生成,加热时二者反应生成,B错误;钠在氯气中燃烧,生成NaCl,C错误;常温下,Na可以与水反应,但Fe不能,证明Na比Fe更活泼,D正确。
3、答案:D
解析:Ⅰ为制备的装置,Ⅱ中用饱和溶液除去中的HCl杂质,Ⅲ用浓硫酸干燥,Ⅳ中Na与在加热时反应,Ⅴ用于检验是否有CO生成。与反应生成微溶物,覆盖在表面,能阻止反应的发生,则不能用稀硫酸代替稀盐酸,A项错误;装置Ⅲ的目的是干燥气体,B项错误;实验时先打开活塞a制备,利用排出装置中的空气,再点燃酒精灯使Na与反应,C项错误;装置Ⅴ中出现黑色沉淀,说明装置Ⅳ中有CO生成,则装置Ⅳ中发生的反应为,D项正确。
4、答案:A
解析:Na与溶液中的水反应,不会有Cu单质生成,A项错误。
5、答案:C
解析:略
6、答案:D
解析:钠着火时,生成过氧化钠,过氧化钠与二氧化碳、水都反应放出氧气。泡沫灭火器喷出的物质中含有二氧化碳和水,因此不能用泡沫灭火器和水灭火,故A、C错误;煤油是易燃物,加入煤油,可谓“火上浇油”,不能起到灭火作用,故B错误;可用干燥沙土掩盖钠,从而隔绝空气,起到灭火的作用,故D正确。
7、答案:B
解析:氧化钠是白色固体,而过氧化钠是淡黄色固体,A项错误;氧化钠和水反应生成氢氧化钠,过氧化钠和水反应生成氢氧化钠和氧气,水溶液均呈碱性,B项正确;氧化钠无氧化性,过氧化钠具有强氧化性,C项错误;氧化钠无漂白性,过氧化钠具有漂白性,D项错误。
8、答案:D
解析:氧化钠和水反应生成氢氧化钠,属于化合反应,反应过程中元素化合价未发生变化,不是氧化还原反应,过氧化钠和水反应生成氢氧化钠和氧气,属于氧化还原反应,二者反应类型不同,A错误;氧化钠与水反应没有气体生成,B错误;6.2g氧化钠反应生成8g氢氧化钠,溶液质量为加入的水的质量加上氧化钠的质量(6.2g),7.8g过氧化钠与反应生成8g氢氧化钠和1.6g氧气,反应后溶液质量为加入的水的质量加上过氧化钠的质量(7.8g),再减去生成氧气的质量,即7.8g-1.6g=6.2g,反应后溶液的质量与溶质的质量均相同,C错误、D正确。
9、答案:C
解析:略
10、答案:C
解析:A.和水反应放热,广口瓶内受热气体膨胀,U形管内c端液面下降、d端液面上升,U形管内红色墨水不褪色,A错误;
B.和水反应生成氢氧化钠和氧气,试管内溶液不变色,B错误;
C.和水反应生成氢氧化钠和氧气,生成气体,气球a膨胀,C正确;
D.和水反应放热,广口瓶内气体膨胀,U形管内c端液面下降、d端液面上升,U形管水位:d>c,D错误;
答案选C。
11、答案:D
解析:①钠的焰色反应为黄色,钠燃烧时发出黄色的火焰,故①正确;
②与酸反应不仅生成盐和水,还生成,故不是碱性氧化物,故②错误;
③与水反应生成,会引入新的杂质,故③错误;
④过氧化钠中含有阳离子为、阴离子为,则过氧化钠中阴阳离子比1:2,故④错误;
⑤钠和钛锆等金属盐溶液的反应是先和其中的水反应置换出氢气,不会置换出金属,故⑤错误;
⑥分别与水及反应产生相同量的时,消耗的水和二氧化碳的物质的量相同,水和的质量不同,故⑥错误;
⑦氧化钠和水反应生成氢氧化钠,过氧化钠和水反应生成氢氧化钠和氧气,粉末放入水中有气泡生成,可确定粉末中含有,故⑦正确;
⑧氧化钠加入酚酞试液中,反应生成的氢氧化钠是可溶性碱,溶液变红色,而过氧化钠加入酚酞溶液中,生成氢氧化钠和氧气,氢氧化钠是碱使酚酞变红色,过氧化钠具有强氧化性能使红色溶液褪去,即溶液先变红色后褪色,故⑧错误;
①⑦正确,故答案为D。
12、答案:A
解析:由题意可知,充分燃烧后生成和,根据原子守恒,1分子完全燃烧生成2分子和2分子,则14g完全燃烧后生成18g和44g;先与反应,78g与44g恰好完全反应,所以最后残留的固体是,答案选A。
13、答案:C
解析:既含金属元素又含非金属元素(酸根离子),属于盐类,与NaOH具有相同的阳离子。能和水、二氧化碳发生化合反应生成。
14、答案:B
解析:Ⅰ图加入盐酸立即生成,溶液中的溶质只能为,发生反应,A项错误;结合Ⅱ图可知a~b段消耗的盐酸是段的2倍,说明溶液中存在等物质的量的,反应后最终生成NaCl和,生成的质量与通入NaOH溶液中的质量相等,B项正确;结合Ⅲ图可知溶液中对应溶质为,C项错误;结合Ⅳ图可知,段先是酸碱中和,然后转化为,离子方程式依次为和,D项错误。
15、答案:A
解析:盐酸先与发生反应:,然后发生反应:。实验②固体质量是实验①的2倍,而实验②生成气体的体积也等于实验①的2倍,说明实验①中盐酸有剩余、实验②中固体完全反应。实验③中固体质量比实验②中多,生成的气体也增大,说明实验②中盐酸有剩余。实验③中若
9.18g固体完全反应,则生成气体体积,说明实验③中盐酸不足,盐酸将碳酸钠转化为碳酸氢钠后,剩余的盐酸只能部分与碳酸氢盐反应。
A.设3.06g固体混合物中为xmol、为ymol,生成二氧化碳为0.672L÷22.4L/mol=0.03mol,则:,解得x=0.01,y=0.02,故9.18g固体,,发生,消耗HCl为0.03mol,生成二氧化碳为1.568L÷22.4L/mol=0.07mol,发生反应:,消耗HCl为0.07mol,故HCl总物质的量为0.03mol+0.07mol=0.1mol,则c(HCl)=0.1mol÷0.05L=2mol/L,故A正确; B.由A中计算可知原混合物样品中;C.分析可知,实验③中盐酸不足,故C错误;D.12.24g混合物中,,恰好反应时消耗盐酸最少,此时溶液中溶质为NaCl、KCl,根据钠离子、钾离子、氯离子守恒,可知,故需要盐酸总体积为0.16L÷2mol/L=0.08L,即80mL,故需要加入盐酸体积最少为80mL-50mL=30mL,故D错误。故选:A。
16、答案:(1)①;②强;③11.56
(2)①排除空气中二氧化碳的干扰;②12%;③B瓶中有残留的;④充分反应后,将C瓶中的沉淀过滤、洗涤、干燥、称重(计算)
解析:略
17、答案:(1)
(2);
(3);
(4)不需要
(5)b
解析:(1)依据流程图分析可知,联碱法和氨碱法生产流程沉淀池中发生的反应是氨气、二氧化碳、水、氯化钠反应生成碳酸氢钠晶体和氯化铵,且析出的均是,反应的化学方程式是,则离子方程式为。
(2)两种方法中煅烧炉内发生反应的化学方程式均是,可循环的X是;氨碱法生产中的母液中含有,加入CaO后,CaO和反应生成,与反应生成可循环利用,故Y是。
(3)联碱法中,母液中含有(少量),则Z中除了含有溶解的氨气、食盐外,还含有;氨碱法中,母液中含有(少量),向母液中加入CaO后,生成,与反应生成可循环利用,排出液W中主要含有、NaCl。
(4)从理论上分析,氨碱法生产过程中,母液中加入氧化钙反应生成的氢氧化钙会和铵盐生成氨气,反应过程中氨气转化为铵盐,铵盐转化为氨气,氨气循环使用,不需要补充氨气。
(5)常温时氯化铵的溶解度比氯化钠大,故a错误;通氨气使的浓度增大,使更多地析出,故b正确;加入食盐细粉的目的是提高的浓度,促进氯化铵结晶析出,故c错误。
18、答案:(1)二氧化碳;碳酸氢钠与酒石酸晶体溶于水后发生反应
(2)投入水中以前,维生素C泡腾片的酒石酸晶体和碳酸氢钠是以固体形式存在的,两者不发生反应
(3)水的存在会使碳酸氢钠和酒石酸晶体发生反应
解析:略
(1)分析题中维生素C泡腾片的成分,结合已学知识可知,此时产生的气体只可能是,且应该来自碳酸氢钠与较强的酸(只可能是辅料中的酒石酸晶体溶于水所得,因为其他成分都不是酸)的反应。
(2)因为碳酸氢钠与酸的反应属于典型的离子反应,而在投入水中以前,维生素C泡腾片中的酒石酸晶体和碳酸氢钠是以固体形式存在的,几乎没有可自由移动的离子,因此这两种物质在固态时几乎没有反应发生,所以维生素C泡腾片在投入水中以前没有气体产生。
(3)由(2)的原因可知,如果有水的存在,会发生反应。
19、答案:(1)4.16g
(2)67.2%
解析:(1)
,解得,则原混合物中的质量为5.00g-0.84g=4.16g。
(2),,由此得关系式,则:,解得。
20、
(1)答案:Ⅱ;;
解析:碳酸氢钠的热稳定性不如碳酸钠,碳酸氢钠固体受热分解生成碳酸钠、水和二氧化碳;探究碳酸钠、碳酸氢钠与盐酸的反应是否放热,应充分考虑钠盐溶液与酸混合反应时各种变化的热效应,包括盐酸被水稀释时有热效应,据此分析;加热到较低温度下碳酸氢钠即会分解,而碳酸钠加热到较高温度也不分解,则在加热过程中能观察到产生白色沉淀的烧杯是Ⅱ,该烧杯中二氧化碳和澄清石灰水反应生成碳酸钙和水,发生反应的离子方程式是:,通过该实验可比较出更稳定。
(2)答案:10mL密度约为的盐酸(20℃);
解析:步骤4:实验分析。盐酸加入水稀释时会有热效应,因此要向10ml水的烧杯中加入实验中使用的10mL密度约为的盐酸(20℃)做对照实验、看温度变化,若盐酸加入水中的温度大于,则说明在碳酸氢钠溶液与盐酸反应中,盐酸溶于水放出的热量被吸收、也就是说明溶液与盐酸反应为吸热反应。
(3)答案:加热混合物;
解析:碳酸氢钠固体受热分解生成碳酸钠、水和二氧化碳,则除去粉末中混有的少量的方法是加热混合物。所涉及的化学方程式为:。
21、答案:(1)①
② ③不能
(2)盛的装置反应比盛的装置剧烈,气球膨胀的快
(3)热稳定;、
(4) ;错误;大试管中空气受热膨胀时逸出
(5)把二者分别配成溶液后滴加试剂,有白色沉淀生成的为,无现象的为
解析: 鉴别和是利用二者性质的差别,Ⅰ中二者均能与盐酸反应产生,现象相同,不能鉴别;Ⅱ中、加入等浓度的盐酸中,反应剧烈,产生的气体多,气球膨胀的快;不稳定,受热分解,而稳定,受热不分解,Ⅳ中的试管B在试管A内部,不能直接接触到火焰,温度相对较低,故试管B中装入的固体是易分解的,受热分解产生的使澄清石灰水变浑浊;鉴别Na2CO3和还可利用其在溶液中电离出的阴离子的不同性质选择试剂,与或反应生成白色沉淀,不反应。
22、答案:(1)Na2O2 2
(2)①Na2O2与Na2CO3的混合物
②假设2或假设3成立 步骤2:另取少量固体样品于试管中,滴加适量蒸馏水,将带火星的火柴放在试管口 若带火星的火柴复燃,则假设3成立;若带火星的火柴不复燃,则假设2成立
解析: (1)Na2O2与H2O反应时,Na2O2既是氧化剂又是还原剂;Na2O2与CO2反应时,每生成1 mol O2转移2 mol电子。
(2)Na2O2在空气中与CO2和H2O反应分别生成Na2CO3、NaOH,NaOH在空气中与CO2反应最终也生成Na2CO3,所以不可能有NaOH,故有三种假设情况。
同步练习二
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1、钠在自然界中最主要的存在形式是( )
A.游离态 B.氯化钠 C.硫酸钠 D.硝酸钠
2、Na与酸、水、氧气、氯气等均能反应,下列说法中正确的是( )
A.将Na投入盐酸中,Na先与水反应,生成的NaOH再与HCl反应
B.Na与氧气在常温下反应生成,加热时二者反应生成
C.Na虽然能与氯气反应生成NaCl,但不能在氯气中燃烧
D.常温下,Na可以与水反应,证明Na比Fe更活泼
3、某兴趣小组用下列装置探究Na与的反应产物,已知。下列说法正确的是( )
A.为了避免生成的中混有HCl,最好用稀硫酸代替稀盐酸
B.装置Ⅲ的目的是除去HCl
C.实验时先点燃酒精灯,再打开活塞a
D.装置Ⅴ中出现黑色沉淀,则装置Ⅳ中发生反应
4、如图所示。将一小块金属钠投入盛有液体的烧杯中。下列说法错误的是(夹持装置已略去)( )
A.—段时间后,烧杯底部有红色难溶物生成
B.若观察到金属钠被煤油浸没。则金属钠的密度比煤油大
C.该实验进行过程中可观察到有气泡产生
D.反应进行一段时间(反应未结束),此时温度计的读数大于起始时的读数
5、将金属钠放入盛有下列溶液的小烧杯中,既有气体产生,又有沉淀产生的是( )
①溶液
②溶液
③溶液
④饱和澄清石灰水
⑤溶液
A.①③④ B.②⑤ C.①④ D.全部
6、金属钠着火时,适用于灭火的是( )
A.水
B.煤油
C.泡沫灭火器
D.干燥沙土
7、和具有的相似性质是( )
A.颜色 B.水溶液的酸碱性
C.氧化性 D.漂白性
8、取甲、乙两个相同的小烧杯,分别加入6.2g固体和7.8g固体,再加入等体积的蒸馏水使其完全溶解。下列有关叙述正确的是( )
A.两烧杯中反应的类型相同
B.两烧杯中均有气体产生
C.反应后溶液的质量:甲<乙
D.反应后溶质的质量:甲=乙
9、 下列关于和的对比中,错误的是( )
A. 阴阳离子个数比均为 B. 在空气中加热时比更稳定
C. 均为碱性氧化物 D. 加入到硫酸铜溶液中均有沉淀产生
10、如图装置,试管中盛有水,气球a中盛有干燥的粉末,U形管中注有红色的墨水。将气球用橡皮筋紧缚在试管口。实验时将气球中的粉末抖落到试管b中的水中,将发生的现象是( )
A.U形管内红色墨水褪色 B.试管内溶液变红
C.气球a被吹大 D.U形管水位:c>d
11、下列说法正确的是( )
①钠燃烧时发出黄色的火焰
②过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物
③过氢化钠能与水反应,所以过氧化钠可以作气体的干燥剂
④过氧化钠中阴阳离子个数比为1:1
⑤钠是一种很强的还原剂,钠可以把锆、铌等金属从它们的化合物的水溶液中置换出来
⑥分别与水及反应产生相同量的时,需要水和的质量相等
⑦可用水来确定某粉末中是否含有
⑧将足量的、分别加到酚酞试液中,最终溶液均为红色
A.①②⑤⑦ B.①⑧ C.①②⑤⑧ D.①⑦
12、已知乙烯()在燃烧时与甲烷类似,现有14g充分燃烧后,将生成的所有物质与78g过氧化钠混合,充分反应后,残留的固体物质是( )
A. B.
C. D.
13、下列对的叙述中不正确的是( )
A. 该物质属于盐类
B. 该物质既含金属元素又含非金属元素
C. 该物质不能发生化合反应
D. 该物质有时候能和NaOH划为一类
14、甲、乙、丙、丁四个烧杯中分别盛有一定量NaOH溶液,向其中分别通入不同量的,再向所得溶液中分别滴加相同浓度的稀盐酸至过量,加热溶液,甲、乙、丙、丁四个烧杯中产生的质量与加入盐酸的体积关系如图Ⅰ~Ⅳ所示(忽略的溶解和HCl的挥发):
则下列分析正确的是( )
A.Ⅰ图对应溶液中的溶质为
B.Ⅱ图a~b段生成的质量与之前通入乙烧杯NaOH溶液中的质量相等
C.Ⅲ图对应溶液中的溶质为NaOH和
D.Ⅳ图段离子方程式为
15、某学生用和组成的某混合物与盐酸反应,测得如表数据(盐酸逐滴滴加,物质的量浓度相等且不考虑HCl的挥发)下列有关的说法中,正确的是( )
实验序号 ① ② ③ ④
盐酸体积/mL 50 50 50 50
固体质量/g 3.06 6.12 9.18 12.24
生成气体体积/L(标况) 0.672 1.344 1.568 1.344
A.盐酸的物质的量浓度为2
B.原混合物样品中
C.实验③中,固体与盐酸恰好完全反应
D.实验④反应后,至少需继续加入40 mL的该盐酸才能把12.24 g的混合物全部反应
二、填空题
16、溶液不仅在受热时能分解放出,而且在室温时亦能分解。
(1)25℃时,溶液pH随分解率的变化曲线如题图-1所示。
①溶液分解反应的离子方程式为________。
②等物质的量浓度的和溶液相比,前者碱性______(填“强”或“弱”)。
③0.5溶液的pH=__________。
(2)利用题图-2所示实验装置探究溶液作为植物光合作用的碳源。
①装置A、D共同的作用是______。
②一种求的分解率方法如下:将充分反应后C瓶中的沉淀过滤掉,滤液转入锥形瓶中,再滴入2.0盐酸30 mL,恰好完全反应。则的分解率为_______。
③实验结果偏低的原因是__________。
④重新设计另外一种求分解率的方法,写出必要的实验步骤:_____________。
17、联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如图:
(1)沉淀池中发生反应的离子方程式为__________。
(2)X是__________,Y是__________(填化学式)。
(3)Z中除了溶解的氨气、食盐外,其他溶质还有__________;排出液W中的溶质除了氢氧化钙外,还有__________。
(4)从理论上分析,在氨碱法生产过程中__________(填“需要”或“不需要”)补充氨气。
(5)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确的是__________(填字母)。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高的浓度,促进碳酸氢钠结晶析出
18、维生素C泡腾片可以为人体补充维生素C,增强机体抵抗力。维生素C泡腾片的主料为维生素C,辅料为阿朴胡萝卜醛、橘味香精、橙味香精、维生素B、糖精钠、碳酸氢钠、氯化钠、蔗糖和酒石酸晶体。将维生素C泡腾片放入一杯水中,药片会不断溶解,同时产生大量气泡,片刻后即成为一杯鲜甜的饮品。请回答以下问题:
(1)维生素C泡腾片放入水中后,产生的气泡是 气体,产生气泡的主要原因是 。
(2)维生素C泡腾片在投人水中以前不产生气体的原因是 。
(3)维生素C泡腾片的贮藏除要求低温、避光外,还要求干燥,其原因是 。
19、现有两份与的混合物X和Y。
已知受热难分解,而受热易分解:。
(1)现取500g混合物X,充分加热后混合物质量减少了0.31g,则原混合物中碳酸钠的质量为_______。
(2)现取500g混合物Y,充分加热至恒重,把放出的气体通入足量澄清石灰水中,生成2.00g沉淀,则原混合物中碳酸氢钠的质量分数为_______。
20、和是两种重要的钠盐。
(1)探究、的稳定性
如图所示,在加热过程中能观察到产生白色沉淀的烧杯是___________(填“Ⅰ”或“Ⅱ”),该烧杯中发生反应的离子方程式是___________,通过该实验可比较出___________(填“”或“”)更稳定。
(2)探究、溶液分别与盐酸反应过程的热量变化
步骤1:分别取等浓度的、溶液,测量温度为;
步骤2:分别加入密度约为的盐酸(20℃),搅拌,测量温度为;
步骤3:数据记录:
温度 试剂
20.0 23.7
20.0 20.8
步骤4:实验分析。甲同学分析上述数据认为两个反应都放出热量,乙同学认为甲同学的分析不严谨,应该补做如下实验:向盛有水(20℃)的烧杯中加入___________,搅拌,测量温度为,再比较和的大小。若___________,说明溶液与盐酸的反应吸收热量,而与盐酸的反应放出热量。
(3)除去粉末中混有的少量的方法是___________,所涉及反应的化学方程式为___________。
三、实验题
21、某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做以下实验,如图所示。
(1)写出Ⅰ中与盐酸发生反应的化学方程式。
①:__________________________________________________________,
②:_____________________________________________________________,
③由此可知此装置__________(填“能”或“不能”)鉴别和。
(2)Ⅱ装置能鉴别和的现象是_________________________________。
(3)Ⅲ、Ⅳ装置均利用了和________性的区别。有关化学方程式为__________________________________________________________________。
(4)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是____________(填化学式)。有的同学在盛的导管口观察到开始加热时也有气泡产生,据此此同学认为加热也能分解。你认为此观点________(填“正确”或“错误”)。分析此现象的原因为_________。
(5)除了以上方法,请你再举出一例鉴别二者的方法:________________________________。
22、
某小组的同学对放置已久的过氧化钠的成分进行探究,请回答下列问题:
(1)反应2Na2O2+2H2O===4NaOH+O2↑的还原剂是________(写化学式);反应2Na2O2+2CO2===2Na2CO3+O2中,每生成1 mol O2转移________mol电子。
(2)进行探究:
①提出假设。
假设1:全部是Na2O2
假设2:全部是Na2CO3
假设3:________________
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、1 mol·L-1 H2SO4溶液、澄清石灰水、淀粉-KI溶液、酚酞溶液、火柴、试管、小烧杯、胶头滴管。
实验步骤 预期现象和结论
步骤1:取少量固体样品于试管中,滴加足量1 mol·L-1 H2SO4溶液,然后将内壁附有澄清石灰水的烧杯罩于试管口 若澄清石灰水未见浑浊,则假设1成立;
若澄清石灰水变浑浊,则______________________
步骤2:
步骤3:
参考答案
1、答案:B
解析:A.钠的性质非常活泼,所以在自然界存在的主要形式是以化合物的形式存在,故A错误; B.海水中含有氯化钠、井盐、糊盐、岩盐都含有氯化钠,所以氯化钠为钠在自然界中最主要的存在形式,故B正确; C.硫酸钠是钠元素在自然界中存在形式之,但不是最主要存在形式,故C错误; D.硝酸钠是钠元素在自然界中存在形式之,但不是最主要存在形式,故D错误;故选B。
2、答案:D
解析:将Na投入盐酸中,Na先与酸反应,A错误;Na与氧气在常温下反应生成,加热时二者反应生成,B错误;钠在氯气中燃烧,生成NaCl,C错误;常温下,Na可以与水反应,但Fe不能,证明Na比Fe更活泼,D正确。
3、答案:D
解析:Ⅰ为制备的装置,Ⅱ中用饱和溶液除去中的HCl杂质,Ⅲ用浓硫酸干燥,Ⅳ中Na与在加热时反应,Ⅴ用于检验是否有CO生成。与反应生成微溶物,覆盖在表面,能阻止反应的发生,则不能用稀硫酸代替稀盐酸,A项错误;装置Ⅲ的目的是干燥气体,B项错误;实验时先打开活塞a制备,利用排出装置中的空气,再点燃酒精灯使Na与反应,C项错误;装置Ⅴ中出现黑色沉淀,说明装置Ⅳ中有CO生成,则装置Ⅳ中发生的反应为,D项正确。
4、答案:A
解析:Na与溶液中的水反应,不会有Cu单质生成,A项错误。
5、答案:C
解析:略
6、答案:D
解析:钠着火时,生成过氧化钠,过氧化钠与二氧化碳、水都反应放出氧气。泡沫灭火器喷出的物质中含有二氧化碳和水,因此不能用泡沫灭火器和水灭火,故A、C错误;煤油是易燃物,加入煤油,可谓“火上浇油”,不能起到灭火作用,故B错误;可用干燥沙土掩盖钠,从而隔绝空气,起到灭火的作用,故D正确。
7、答案:B
解析:氧化钠是白色固体,而过氧化钠是淡黄色固体,A项错误;氧化钠和水反应生成氢氧化钠,过氧化钠和水反应生成氢氧化钠和氧气,水溶液均呈碱性,B项正确;氧化钠无氧化性,过氧化钠具有强氧化性,C项错误;氧化钠无漂白性,过氧化钠具有漂白性,D项错误。
8、答案:D
解析:氧化钠和水反应生成氢氧化钠,属于化合反应,反应过程中元素化合价未发生变化,不是氧化还原反应,过氧化钠和水反应生成氢氧化钠和氧气,属于氧化还原反应,二者反应类型不同,A错误;氧化钠与水反应没有气体生成,B错误;6.2g氧化钠反应生成8g氢氧化钠,溶液质量为加入的水的质量加上氧化钠的质量(6.2g),7.8g过氧化钠与反应生成8g氢氧化钠和1.6g氧气,反应后溶液质量为加入的水的质量加上过氧化钠的质量(7.8g),再减去生成氧气的质量,即7.8g-1.6g=6.2g,反应后溶液的质量与溶质的质量均相同,C错误、D正确。
9、答案:C
解析:略
10、答案:C
解析:A.和水反应放热,广口瓶内受热气体膨胀,U形管内c端液面下降、d端液面上升,U形管内红色墨水不褪色,A错误;
B.和水反应生成氢氧化钠和氧气,试管内溶液不变色,B错误;
C.和水反应生成氢氧化钠和氧气,生成气体,气球a膨胀,C正确;
D.和水反应放热,广口瓶内气体膨胀,U形管内c端液面下降、d端液面上升,U形管水位:d>c,D错误;
答案选C。
11、答案:D
解析:①钠的焰色反应为黄色,钠燃烧时发出黄色的火焰,故①正确;
②与酸反应不仅生成盐和水,还生成,故不是碱性氧化物,故②错误;
③与水反应生成,会引入新的杂质,故③错误;
④过氧化钠中含有阳离子为、阴离子为,则过氧化钠中阴阳离子比1:2,故④错误;
⑤钠和钛锆等金属盐溶液的反应是先和其中的水反应置换出氢气,不会置换出金属,故⑤错误;
⑥分别与水及反应产生相同量的时,消耗的水和二氧化碳的物质的量相同,水和的质量不同,故⑥错误;
⑦氧化钠和水反应生成氢氧化钠,过氧化钠和水反应生成氢氧化钠和氧气,粉末放入水中有气泡生成,可确定粉末中含有,故⑦正确;
⑧氧化钠加入酚酞试液中,反应生成的氢氧化钠是可溶性碱,溶液变红色,而过氧化钠加入酚酞溶液中,生成氢氧化钠和氧气,氢氧化钠是碱使酚酞变红色,过氧化钠具有强氧化性能使红色溶液褪去,即溶液先变红色后褪色,故⑧错误;
①⑦正确,故答案为D。
12、答案:A
解析:由题意可知,充分燃烧后生成和,根据原子守恒,1分子完全燃烧生成2分子和2分子,则14g完全燃烧后生成18g和44g;先与反应,78g与44g恰好完全反应,所以最后残留的固体是,答案选A。
13、答案:C
解析:既含金属元素又含非金属元素(酸根离子),属于盐类,与NaOH具有相同的阳离子。能和水、二氧化碳发生化合反应生成。
14、答案:B
解析:Ⅰ图加入盐酸立即生成,溶液中的溶质只能为,发生反应,A项错误;结合Ⅱ图可知a~b段消耗的盐酸是段的2倍,说明溶液中存在等物质的量的,反应后最终生成NaCl和,生成的质量与通入NaOH溶液中的质量相等,B项正确;结合Ⅲ图可知溶液中对应溶质为,C项错误;结合Ⅳ图可知,段先是酸碱中和,然后转化为,离子方程式依次为和,D项错误。
15、答案:A
解析:盐酸先与发生反应:,然后发生反应:。实验②固体质量是实验①的2倍,而实验②生成气体的体积也等于实验①的2倍,说明实验①中盐酸有剩余、实验②中固体完全反应。实验③中固体质量比实验②中多,生成的气体也增大,说明实验②中盐酸有剩余。实验③中若
9.18g固体完全反应,则生成气体体积,说明实验③中盐酸不足,盐酸将碳酸钠转化为碳酸氢钠后,剩余的盐酸只能部分与碳酸氢盐反应。
A.设3.06g固体混合物中为xmol、为ymol,生成二氧化碳为0.672L÷22.4L/mol=0.03mol,则:,解得x=0.01,y=0.02,故9.18g固体,,发生,消耗HCl为0.03mol,生成二氧化碳为1.568L÷22.4L/mol=0.07mol,发生反应:,消耗HCl为0.07mol,故HCl总物质的量为0.03mol+0.07mol=0.1mol,则c(HCl)=0.1mol÷0.05L=2mol/L,故A正确; B.由A中计算可知原混合物样品中;C.分析可知,实验③中盐酸不足,故C错误;D.12.24g混合物中,,恰好反应时消耗盐酸最少,此时溶液中溶质为NaCl、KCl,根据钠离子、钾离子、氯离子守恒,可知,故需要盐酸总体积为0.16L÷2mol/L=0.08L,即80mL,故需要加入盐酸体积最少为80mL-50mL=30mL,故D错误。故选:A。
16、答案:(1)①;②强;③11.56
(2)①排除空气中二氧化碳的干扰;②12%;③B瓶中有残留的;④充分反应后,将C瓶中的沉淀过滤、洗涤、干燥、称重(计算)
解析:略
17、答案:(1)
(2);
(3);
(4)不需要
(5)b
解析:(1)依据流程图分析可知,联碱法和氨碱法生产流程沉淀池中发生的反应是氨气、二氧化碳、水、氯化钠反应生成碳酸氢钠晶体和氯化铵,且析出的均是,反应的化学方程式是,则离子方程式为。
(2)两种方法中煅烧炉内发生反应的化学方程式均是,可循环的X是;氨碱法生产中的母液中含有,加入CaO后,CaO和反应生成,与反应生成可循环利用,故Y是。
(3)联碱法中,母液中含有(少量),则Z中除了含有溶解的氨气、食盐外,还含有;氨碱法中,母液中含有(少量),向母液中加入CaO后,生成,与反应生成可循环利用,排出液W中主要含有、NaCl。
(4)从理论上分析,氨碱法生产过程中,母液中加入氧化钙反应生成的氢氧化钙会和铵盐生成氨气,反应过程中氨气转化为铵盐,铵盐转化为氨气,氨气循环使用,不需要补充氨气。
(5)常温时氯化铵的溶解度比氯化钠大,故a错误;通氨气使的浓度增大,使更多地析出,故b正确;加入食盐细粉的目的是提高的浓度,促进氯化铵结晶析出,故c错误。
18、答案:(1)二氧化碳;碳酸氢钠与酒石酸晶体溶于水后发生反应
(2)投入水中以前,维生素C泡腾片的酒石酸晶体和碳酸氢钠是以固体形式存在的,两者不发生反应
(3)水的存在会使碳酸氢钠和酒石酸晶体发生反应
解析:略
(1)分析题中维生素C泡腾片的成分,结合已学知识可知,此时产生的气体只可能是,且应该来自碳酸氢钠与较强的酸(只可能是辅料中的酒石酸晶体溶于水所得,因为其他成分都不是酸)的反应。
(2)因为碳酸氢钠与酸的反应属于典型的离子反应,而在投入水中以前,维生素C泡腾片中的酒石酸晶体和碳酸氢钠是以固体形式存在的,几乎没有可自由移动的离子,因此这两种物质在固态时几乎没有反应发生,所以维生素C泡腾片在投入水中以前没有气体产生。
(3)由(2)的原因可知,如果有水的存在,会发生反应。
19、答案:(1)4.16g
(2)67.2%
解析:(1)
,解得,则原混合物中的质量为5.00g-0.84g=4.16g。
(2),,由此得关系式,则:,解得。
20、
(1)答案:Ⅱ;;
解析:碳酸氢钠的热稳定性不如碳酸钠,碳酸氢钠固体受热分解生成碳酸钠、水和二氧化碳;探究碳酸钠、碳酸氢钠与盐酸的反应是否放热,应充分考虑钠盐溶液与酸混合反应时各种变化的热效应,包括盐酸被水稀释时有热效应,据此分析;加热到较低温度下碳酸氢钠即会分解,而碳酸钠加热到较高温度也不分解,则在加热过程中能观察到产生白色沉淀的烧杯是Ⅱ,该烧杯中二氧化碳和澄清石灰水反应生成碳酸钙和水,发生反应的离子方程式是:,通过该实验可比较出更稳定。
(2)答案:10mL密度约为的盐酸(20℃);
解析:步骤4:实验分析。盐酸加入水稀释时会有热效应,因此要向10ml水的烧杯中加入实验中使用的10mL密度约为的盐酸(20℃)做对照实验、看温度变化,若盐酸加入水中的温度大于,则说明在碳酸氢钠溶液与盐酸反应中,盐酸溶于水放出的热量被吸收、也就是说明溶液与盐酸反应为吸热反应。
(3)答案:加热混合物;
解析:碳酸氢钠固体受热分解生成碳酸钠、水和二氧化碳,则除去粉末中混有的少量的方法是加热混合物。所涉及的化学方程式为:。
21、答案:(1)①
② ③不能
(2)盛的装置反应比盛的装置剧烈,气球膨胀的快
(3)热稳定;、
(4) ;错误;大试管中空气受热膨胀时逸出
(5)把二者分别配成溶液后滴加试剂,有白色沉淀生成的为,无现象的为
解析: 鉴别和是利用二者性质的差别,Ⅰ中二者均能与盐酸反应产生,现象相同,不能鉴别;Ⅱ中、加入等浓度的盐酸中,反应剧烈,产生的气体多,气球膨胀的快;不稳定,受热分解,而稳定,受热不分解,Ⅳ中的试管B在试管A内部,不能直接接触到火焰,温度相对较低,故试管B中装入的固体是易分解的,受热分解产生的使澄清石灰水变浑浊;鉴别Na2CO3和还可利用其在溶液中电离出的阴离子的不同性质选择试剂,与或反应生成白色沉淀,不反应。
22、答案:(1)Na2O2 2
(2)①Na2O2与Na2CO3的混合物
②假设2或假设3成立 步骤2:另取少量固体样品于试管中,滴加适量蒸馏水,将带火星的火柴放在试管口 若带火星的火柴复燃,则假设3成立;若带火星的火柴不复燃,则假设2成立
解析: (1)Na2O2与H2O反应时,Na2O2既是氧化剂又是还原剂;Na2O2与CO2反应时,每生成1 mol O2转移2 mol电子。
(2)Na2O2在空气中与CO2和H2O反应分别生成Na2CO3、NaOH,NaOH在空气中与CO2反应最终也生成Na2CO3,所以不可能有NaOH,故有三种假设情况。
