5.3+无机非金属材料 课时练习(含解析) 高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.3+无机非金属材料 课时练习(含解析) 高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 206.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-24 10:37:34 | ||
图片预览




文档简介
5.3 无机非金属材料 课时练习 2022—2023学年下学期高一化学人教版(2019)必修二
一、单选题
1.中华文化源远流长、博大精深,下列文物主要是由硅酸盐材料制成的是( )
A.新石器时代鸡形陶壶 B.商代的司母戊鼎
C.北宋的清明上河图 D.西汉的素纱禅衣
2.2023年,我国具有独立知识产权的“龙芯”21岁了。下列对硅单质及其化合物的有关叙述正确的是( )
A.石英可以用来生产玻璃
B.二氧化硅具有半导体性能,常用于制作光导纤维
C.硅的化学性质不活泼,常温下不与任何物质反应
D.可用作黏合剂、木材防火剂的原料,实验室保存溶液应用玻璃塞
3.下列有关氧化物的性质与用途具有对应关系的是( )
A.CaO具有吸水性,常用于食品干燥剂
B.是黄绿色气体,可用于自来水消毒
C.MgO是碱性氧化物,可作为耐高温材料
D.熔点高,可用来制造通讯光缆
4.含硅元素的物质有很多用途,下列说法错误的是( )
A.硅晶片是生产芯片的基础材料,其主要成分为
B.高压输电线路使用的陶瓷绝缘材料属于硅酸盐材料
C.水玻璃是硅酸钠的水溶液,可用作木材防火剂的原料
D.高温超导陶瓷具有超导性,可应用于电力和交通领域
5.硅是信息技术的关键材料,下列产品不是以硅为主要材料制成的是( )
A.光导纤维 B.计算机芯片
C.光电池 D.半导体晶体管
6.下列关于二氧化硅的说法错误的是( )
A.二氧化硅是一种非金属氧化物
B.二氧化硅不存在单个的分子
C.二氧化硅中硅元素与氧元素的质量比为7∶8
D.二氧化硅分子由一个硅原子和两个氧原子构成
7.下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有( )
序号 X Y Z W
① Si Na2SiO3 H2SiO3 SiO2
② Na NaOH Na2CO3 NaCl
③ Cl2 Ca(ClO)2 HClO HCl
④ Fe FeCl3 FeCl2 Fe(OH)2
A.②③ B.①③④ C.①④ D.①②③
8.下列解释事实的方程式中,正确的是( )
A.工业制粗硅:SiO2+C Si+CO2↑
B.向铜粉中滴加稀硝酸产生气体:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
C.浓硝酸通常显黄色:4HNO3 4NO2↑+O2↑+2H2O
D.硫在纯氧中点燃发出蓝紫色火焰:2S+3O2 2SO3
二、综合题
9.硅在自然界中主要以二氧化硅和硅酸盐的形式存在。回答下列问题:
(1)Si是良好的半导体材料,试写出硅单质的一种用途: 。
(2)SiO2是玻璃的主要成分之一,烧碱溶液对玻璃有腐蚀性,写出SiO2与烧碱溶液反应的离子方程式为 。
(3)Na2SiO3溶液俗称 ,往Na2SiO3溶液中通入足量CO2气体发生的现象是: 。
(4)工业上常用焦炭和二氧化硅在高温条件下制备粗硅,该反应的化学方程式为 。
10.硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)SiO2是玻璃的成分之一,SiO2与氢氧化钠溶液反应的化学方程式为 ,工艺师常用 (填物质名称或化学式)来雕刻玻璃。
(2)用Na2SiO3溶液浸泡过的棉花不易燃烧,体现Na2SiO3的用途可作 的原料。
(3)工业上常用2C+SiO2 Si+2CO↑制备硅单质,该反应中有元素化合价升高的物质是 (填化学式,下同),氧化剂是 。
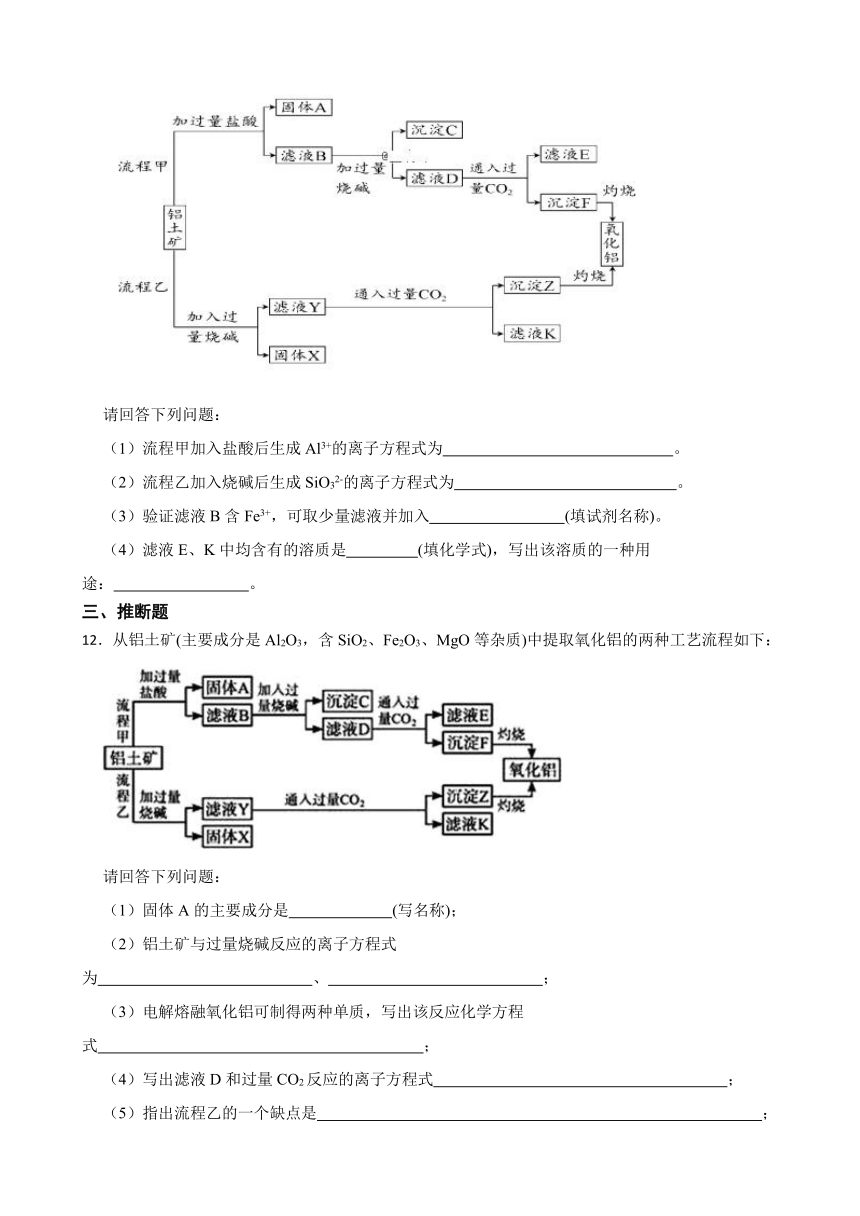
11.从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为 。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为 。
(3)验证滤液B含Fe3+,可取少量滤液并加入 (填试剂名称)。
(4)滤液E、K中均含有的溶质是 (填化学式),写出该溶质的一种用途: 。
三、推断题
12.从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
请回答下列问题:
(1)固体A的主要成分是 (写名称);
(2)铝土矿与过量烧碱反应的离子方程式为 、 ;
(3)电解熔融氧化铝可制得两种单质,写出该反应化学方程式 ;
(4)写出滤液D和过量CO2反应的离子方程式 ;
(5)指出流程乙的一个缺点是 ;
(6)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X.已知每转移6.02×1023个电子,有0.5mol化合物X生成,此反应的化学方程式 。
四、实验探究题
13.某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
(1)Ⅰ.将大小、形状相同的钠、钾、镁、铝各0.01mol分别投入足量的0.1mol·L-1的盐酸中,写出与盐酸反应最快的金属发生反应的离子方程式: 。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理 (填“合理”或“不合理”),说明理由: 。
(3)Ⅱ.利用如图所示装置可以验证非金属性的变化规律。
实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,选择合适药品设计实验验证氯的非金属性大于硫:装置B中所装药品为 ,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为 。
(4)若要证明非金属性:C>Si,则A中加 .B中加Na2CO3,C中加Na2SiO3溶液,观察到C中的实验现象为有白色沉淀物生成,C中发生反应的离子方程式为 (假设所通气体是过量的)。
14.用SiHCl3在加热条件下与过量H2反应制备纯硅的装置如图(热源及夹持装置略去):
已知:SiHCl3沸点为33℃,能与和H2O强烈反应,在空气中易自燃;
请问答:
(1)依次连接的合理顺序为 。
(2)操作时应先打开装置 (选填“C”或“D”)中分液漏斗的旋塞,理由是 。
答案解析部分
1.【答案】A
【解析】【解答】A.新石器时代鸡形陶壶属于陶器,玻璃、水泥、陶瓷都属于硅酸盐产品,A符合题意;
B.商代的司母戊鼎属于青铜器,青铜是合金,属于金属材料,B不符合题意;
C.清明上河图绘制在绢帛上,绢帛是动物源的天然纤维,主要成分是蛋白质,C不符合题意;
D.西汉的素纱禅衣是蚕丝制品,主要成分是蛋白质,D不符合题意;
故答案为:A。
【分析】A.玻璃、水泥、陶瓷都属于硅酸盐产品;
B.合金属于金属材料;
C.天然纤维主要成分是蛋白质;
D.蚕丝主要成分是蛋白质。
2.【答案】A
【解析】【解答】A.玻璃的主要成分为二氧化硅,石英的主要成分为二氧化硅,故石英可以用来生产玻璃,A符合题意;
B.二氧化硅是制备半导体材料硅的原料,本身不具备半导体性能,B不符合题意;
C.常温下,硅可与强碱、HF反应,C不符合题意;
D.具有粘性,使用玻璃塞会使瓶塞与瓶身粘住,所以实验室保存溶液应用橡胶塞,D不符合题意;
故答案为:A。
【分析】A、二氧化硅可以制取玻璃;
B、二氧化硅可以制作光导纤维;
C、硅可以和强碱和氟化氢反应;
D、硅酸钠的保存应该用橡胶塞,否则会使瓶身和瓶塞粘住。
3.【答案】A
【解析】【解答】A.CaO具有吸水性能和水反应,常用于食品干燥,A符合题意;
B.具有强氧化性,可用于自来水消毒,B不符合题意;
C.MgO熔点高、耐高温,可作为耐高温材料,C不符合题意;
D.做成的纤维具有良好的透光性,可用来制造通讯光缆,D不符合题意;
故答案为:A。
【分析】A.利用CaO具有吸水性能和水反应;
B.利用具有强氧化性,与颜色无关;
C.利用MgO熔点高;
D.利用具有良好的透光性。
4.【答案】A
【解析】【解答】A. 硅晶片主要成分为Si,光导纤维的主要成分为 ,A符合题意;
B. 玻璃、陶瓷和水泥属于硅酸盐材料,B不符合题意;
C. 水玻璃是硅酸钠的水溶液,用水玻璃浸泡过的木材不容易着火,可用作木材防火剂的原料,C不符合题意;
D. 高温超导陶瓷是一种新型陶瓷,耐高温具有超导性,可应用于电力和交通领域,D不符合题意;
故答案为:A。
【分析】生产芯片的是硅单质,而制备光导纤维的是二氧化硅,其他均正确
5.【答案】A
【解析】【解答】A.光导纤维的成分是SiO2,故选A;
B.计算机芯片的成分是晶体硅,故不选B;
C.光电池的成分是晶体硅,故不选C;
D.半导体晶体管的成分是高纯度的晶体硅,故不选D;
故答案为:A
【分析】光导纤维的原材料是二氧化硅,硅的用途是太阳能电池板、计算机芯片、以及半导体材料
6.【答案】D
【解析】【解答】A. 二氧化硅是由Si和O两种元素组成的氧化物,Si是非金属元素,因此是一种非金属氧化物,A不符合题意;
B. 二氧化硅属于原子晶体,不存在单个的分子,B不符合题意;
C. 二氧化硅的化学式为SiO2,其中硅元素与氧元素的质量比为28∶32=7∶8,C不符合题意;
D. 二氧化硅属于原子晶体,不存在分子,D符合题意。
故答案为:D。
【分析】选项B和D是解答的难点,注意C和Si虽然处于同一主族,但二氧化碳和二氧化硅的性质以及结构差别很大。二氧化碳形成的是分子晶体,存在二氧化碳分子。二氧化硅晶体中,硅原子的4个价电子与4个氧原子形成4个共价键,硅原子位于正四面体的中心,4个氧原子位于正四面体的4个顶角上,“SiO2”只能表示化学式,不能表示分子式。
7.【答案】D
【解析】【解答】①Si Na2SiO3 H2SiO3 SiO2 Si,满足表中图示物质在一定条件下一步转化关系;
②Na NaOH Na2CO3 NaCl Na,满足表中图示物质在一定条件下一步转化关系;
③Cl2 Ca(ClO)2 HClO HCl Cl2,满足表中图示物质在一定条件下一步转化关系;
④Fe与Cl2反应可生成FeCl3,FeCl3与Fe反应可得到FeCl2,FeCl2与氢氧化钠生成氢氧化亚铁,氢氧化亚铁得不到Fe,故不满足题意;
故答案为:D。
【分析】①硅与氢氧化钠生成硅酸钠,与盐酸反应生成硅酸,受热分解成二氧化硅,与碳共热反应生成硅单质;
②钠与水生成氢氧化钠,通二氧化碳生成碳酸钠,与盐酸反应生成氯化钠,电解成钠;
③氯气与熟石灰生成次氯酸钙,与二氧化碳生成次氯酸,见光分解成氯化氢气体,二氧化锰反应生成氯气;
④铁与氯气生成氯化铁,溶液种与铁单质生成氯化亚铁,与氢氧化钠反应生成氢氧化亚铁;
8.【答案】C
【解析】【解答】A.碳与二氧化硅反应只能生成一氧化碳,故A不符合题意
B.稀硝酸的氧化产物是NO,故B不符合题意
C.浓硝酸显黄色的原因是由于见光分解生成了二氧化氮故C符合题意
D.硫在氧气中燃烧得到的是二氧化硫,故D不符合题意
故答案为:C
【分析】浓硝酸呈黄色的原因为浓硝酸分解,生成了二氧化氮,从而使溶液颜色变黄
9.【答案】(1)做计算机的芯片或太阳能电池
(2)SiO2+2OH-=SiO+H2O
(3)水玻璃;有白色不溶物生成
(4)2C+SiO2Si+2CO ↑
【解析】【解答】(1)Si是良好的半导体材料,故硅单质可用于做计算机的芯片或太阳能电池。
(2)SiO2是酸性氧化物,可以与等碱溶液反应发生盐和水, SiO2与烧碱溶液反应的离子方程式为SiO2+2OH-=SiO+H2O。
(3)Na2SiO3溶液俗称水玻璃。硅酸的酸性小于碳酸,往Na2SiO3溶液中通入足量CO2气体生成硅酸沉淀和碳酸氢钠,发生的现象是:有白色不溶物生成。
(4)焦炭和二氧化硅在高温条件下反应得到CO和硅,该反应的化学方程式为2C+SiO2Si+2CO ↑。
【分析】(1)根据硅是良好的半导体进行分析。
(2)注意SiO2难溶于水,不可拆;Na2SiO3能溶于水,要拆成离子形式。
(3)CO2与Na2SiO3反应生成难溶物H2SiO3,注意由于CO2足量,所以另一产物是NaHCO3,而不是Na2CO3。
(4)注意反应条件及产物中气体箭头的标注。
10.【答案】(1)2NaOH+SiO2=Na2SiO3+H2O;氢氟酸
(2)防火剂
(3)C;SiO2
【解析】【解答】(1)SiO2是酸性氧化物,能与NaOH反应生成硅酸钠和水,方程式为2NaOH+SiO2=Na2SiO3+H2O;HF能腐蚀玻璃,常用其溶液雕刻玻璃;(2)Na2SiO3溶液浸泡过的棉花不易燃烧,可用作防火剂;(3)反应中C的化合价由0价变为+2价,碳作还原剂;Si的化合价由+4变为0价,二氧化硅作氧化剂。
【分析】(1)SiO2是酸性氧化物,能与NaOH反应生成硅酸钠和水;(2)Na2SiO3溶液浸泡过的棉花不易燃烧,可用作防火剂;(3)反应中C的化合价由0价变为+2价,作还原剂;Si的化合价由+4变为0价,作氧化剂。
11.【答案】(1)Al2O3+6H+ =2Al3++3H2O
(2)SiO2+20H-=SiO32-+H2O
(3)硫氰化钾溶液
(4)NaHCO3;治疗胃酸过多
【解析】【解答】根据以上分析可知A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,C为氢氧化铁、氢氧化镁,D含有氢氧化钠、偏铝酸钠、氯化钠,E中含有NaCl、NaHCO3,F为Al(OH)3,X为Fe2O3、MgO等,Y为氢氧化钠、偏铝酸钠,Z为Al(OH)3,K中含有NaHCO3,则:(1)Al2O3与盐酸反应生成氯化铝和水,氧化物不能拆,离子方程式为:Al2O3+6H+ =2Al3++3H2O;(2)二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,二氧化硅不能拆,故离子反应方程式为:SiO2+20H-=SiO32-+H2O;(3)Fe3+与硫氰化钾溶液反应,使溶液变红色,检验滤液B中是否含Fe3+离子的方法为:取少量滤液B,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+;(4)根据以上分析可知滤液E、K中均含有的溶质是碳酸氢钠,碳酸氢钠可用于治疗胃酸过多、制纯碱或做发酵粉等。
【分析】由工艺流程甲可知,铝土矿与盐酸反应得固体A和滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有氢氧化钠、偏铝酸钠、氯化钠,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为氢氧化钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为Al(OH)3,滤液K中含有NaHCO3,据此判断。
12.【答案】(1)二氧化硅
(2)SiO2+2OH-= +H2O;Al2O3+2OH-= +H2O
(3)2Al2O3(熔融) 4Al+ 3O2↑
(4) +CO2+2H2O=Al(OH)3↓+
(5)沉淀Z中混有H2SiO3,灼烧后,氧化铝中含有二氧化硅杂质
(6)Al2O3+N2+3C 2AlN+3CO
【解析】【解答】(1)根据分析,固体A的主要成分是二氧化硅;(2)铝土矿中Al2O3、SiO2均与强碱反应,生成偏铝酸盐和硅酸盐,反应的离子方程式分别为:Al2O3+2OH-= +H2O、SiO2+2OH-= +H2O;(3)电解熔融氧化铝可制得金属铝和氧气,反应化学方程式2Al2O3(熔融) 4Al+ 3O2↑;(4)向滤液D中通入足量的二氧化碳气体,生成了Al(OH)3沉淀,反应的离子方程式为 +CO2+2H2O=Al(OH)3↓+ ;(5)SiO2、Al2O3均与强碱反应生成硅酸钠和偏铝酸钠,过滤,滤液中通入足量的二氧化碳,反应生成了Al(OH)3沉淀和硅酸,灼烧后,得到氧化铝和二氧化硅,即氧化铝中含有二氧化硅杂质;(6)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X,根据元素守恒可以知道X中应含有氧元素和碳元素,已知每转移6.02×1023个电子即1mol电子,有0.5mol化合物X生成,由电子转移守恒,可得在X中C的化合价为 =2,所以X是CO,所以该反应的化学方程式为Al2O3+N2+3C 2AlN+3CO。
【分析】流程甲:铝土矿中加入过量的稀盐酸,SiO2与盐酸不反应,Al2O3、Fe2O3、MgO均可与盐酸反应生成相应的氯化物,反应的离子方程式为Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O;MgO+2H+=Mg2++H2O;反应液中加入过量烧碱,Al3+变为 ,Mg2+、Fe3+变为Mg(OH)2和Fe(OH)3沉淀,过滤后,滤液中通入足量的二氧化碳气体,生成了Al(OH)3沉淀;反应方程式为 +CO2+2H2O=Al(OH)3↓+ 。流程乙:铝土矿中加入过量的氢氧化钠溶液,Fe2O3、MgO与氢氧化钠不反应,SiO2、Al2O3均与强碱反应生成硅酸钠和偏铝酸钠,过滤,滤液中通入足量的二氧化碳,反应生成了Al(OH)3沉淀和硅酸。
13.【答案】(1)2K+2H+=2K++H2↑
(2)不合理;用碱性强弱比较金属性强弱时,一定要比较元素最高价氧化物对应水化物的碱性强弱,NH3·H2O不是N元素的最高价氧化物对应的水化物
(3)KMnO4;S2-+Cl2=S↓+2Cl-
(4)稀硫酸(或“稀H2SO4”);SiO +2CO2+2H2O=H2SiO3↓+2HCO
【解析】【解答】(1)金属活动性:K>Na>Mg>Al,因此反应最快的金属为K,其反应的离子方程式为:2K+2H+=2K++H2 ↑ ;
(2)不合理; 用碱性强弱比较金属性强弱时,一定要比较元素最高价氧化物对应水化物的碱性强弱,NH3·H2O不是N元素的最高价氧化物对应的水化物;
(3)欲证明氯的非金属性大于硫,可通过Cl2与Na2S的置换反应进行验证,因此A、B装置应反应产生Cl2,故B装置中所装药品为KMnO4,A装置所装药品为浓盐酸,二者反应产生Cl2;C装置所装药品为Na2S溶液,Cl2与Na2S溶液反应生成淡黄色固体硫,该反应的离子方程式为:Cl2+S2-=2Cl-+S↓;
(4)欲证明非金属C>Si,则可通过H2CO3与Na2SiO3溶液反应生成H2SiO3沉淀进行验证,因此A装置中应加稀硫酸,与B中的Na2CO3反应生成CO2,CO2进入C装置中,与Na2SiO3溶液反应,产生H2SiO3沉淀,该反应的离子方程式为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-;
【分析】(1)根据金属活动性确定反应最快的金属,从而写出反应的离子方程式;
(2)由碱性强弱得出金属性强弱时,应用最高价氧化物对应水化物的碱性进行比较;
(3)欲证明氯的非金属性大于硫,可通过Cl2与Na2S的置换反应进行验证;
(4)欲证明非金属C>Si,可通过“强酸制弱酸”原理进行实验;
14.【答案】(1)DBCAE或DBCABE
(2)D;SiHCl3在空气中易自燃,实验时先通一段时间氢气排除装置内空气
【解析】【解答】⑴先是氢气发生装置,再是干燥装置,再是将汽化装置,再是反应装置,再是尾气处理装置,也可以先干燥后再处理尾气,因此依次连接的合理顺序为DBCAE或DBCABE;故答案为:DBCAE或DBCABE。⑵由于SiHCl3沸点为33℃,能与和H2O强烈反应,在空气中易自燃,整个装置需要先排除装置内空气,因此操作时应先打开装置D中分液漏斗的旋塞,理由是SiHCl3在空气中易自燃,实验时先通一段时间氢气排除装置内空气;故答案为:D;SiHCl3在空气中易自燃,实验时先通一段时间氢气排除装置内空气。
【分析】A装置主要是SiHCl3与过量H2在加热条件下反应制备纯硅,B主要是干燥气体,C主要是将SiHCl3转变为气体在A中反应,D是氢气发生装置,E尾气处理装置。
一、单选题
1.中华文化源远流长、博大精深,下列文物主要是由硅酸盐材料制成的是( )
A.新石器时代鸡形陶壶 B.商代的司母戊鼎
C.北宋的清明上河图 D.西汉的素纱禅衣
2.2023年,我国具有独立知识产权的“龙芯”21岁了。下列对硅单质及其化合物的有关叙述正确的是( )
A.石英可以用来生产玻璃
B.二氧化硅具有半导体性能,常用于制作光导纤维
C.硅的化学性质不活泼,常温下不与任何物质反应
D.可用作黏合剂、木材防火剂的原料,实验室保存溶液应用玻璃塞
3.下列有关氧化物的性质与用途具有对应关系的是( )
A.CaO具有吸水性,常用于食品干燥剂
B.是黄绿色气体,可用于自来水消毒
C.MgO是碱性氧化物,可作为耐高温材料
D.熔点高,可用来制造通讯光缆
4.含硅元素的物质有很多用途,下列说法错误的是( )
A.硅晶片是生产芯片的基础材料,其主要成分为
B.高压输电线路使用的陶瓷绝缘材料属于硅酸盐材料
C.水玻璃是硅酸钠的水溶液,可用作木材防火剂的原料
D.高温超导陶瓷具有超导性,可应用于电力和交通领域
5.硅是信息技术的关键材料,下列产品不是以硅为主要材料制成的是( )
A.光导纤维 B.计算机芯片
C.光电池 D.半导体晶体管
6.下列关于二氧化硅的说法错误的是( )
A.二氧化硅是一种非金属氧化物
B.二氧化硅不存在单个的分子
C.二氧化硅中硅元素与氧元素的质量比为7∶8
D.二氧化硅分子由一个硅原子和两个氧原子构成
7.下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有( )
序号 X Y Z W
① Si Na2SiO3 H2SiO3 SiO2
② Na NaOH Na2CO3 NaCl
③ Cl2 Ca(ClO)2 HClO HCl
④ Fe FeCl3 FeCl2 Fe(OH)2
A.②③ B.①③④ C.①④ D.①②③
8.下列解释事实的方程式中,正确的是( )
A.工业制粗硅:SiO2+C Si+CO2↑
B.向铜粉中滴加稀硝酸产生气体:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
C.浓硝酸通常显黄色:4HNO3 4NO2↑+O2↑+2H2O
D.硫在纯氧中点燃发出蓝紫色火焰:2S+3O2 2SO3
二、综合题
9.硅在自然界中主要以二氧化硅和硅酸盐的形式存在。回答下列问题:
(1)Si是良好的半导体材料,试写出硅单质的一种用途: 。
(2)SiO2是玻璃的主要成分之一,烧碱溶液对玻璃有腐蚀性,写出SiO2与烧碱溶液反应的离子方程式为 。
(3)Na2SiO3溶液俗称 ,往Na2SiO3溶液中通入足量CO2气体发生的现象是: 。
(4)工业上常用焦炭和二氧化硅在高温条件下制备粗硅,该反应的化学方程式为 。
10.硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)SiO2是玻璃的成分之一,SiO2与氢氧化钠溶液反应的化学方程式为 ,工艺师常用 (填物质名称或化学式)来雕刻玻璃。
(2)用Na2SiO3溶液浸泡过的棉花不易燃烧,体现Na2SiO3的用途可作 的原料。
(3)工业上常用2C+SiO2 Si+2CO↑制备硅单质,该反应中有元素化合价升高的物质是 (填化学式,下同),氧化剂是 。
11.从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为 。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为 。
(3)验证滤液B含Fe3+,可取少量滤液并加入 (填试剂名称)。
(4)滤液E、K中均含有的溶质是 (填化学式),写出该溶质的一种用途: 。
三、推断题
12.从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
请回答下列问题:
(1)固体A的主要成分是 (写名称);
(2)铝土矿与过量烧碱反应的离子方程式为 、 ;
(3)电解熔融氧化铝可制得两种单质,写出该反应化学方程式 ;
(4)写出滤液D和过量CO2反应的离子方程式 ;
(5)指出流程乙的一个缺点是 ;
(6)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X.已知每转移6.02×1023个电子,有0.5mol化合物X生成,此反应的化学方程式 。
四、实验探究题
13.某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
(1)Ⅰ.将大小、形状相同的钠、钾、镁、铝各0.01mol分别投入足量的0.1mol·L-1的盐酸中,写出与盐酸反应最快的金属发生反应的离子方程式: 。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理 (填“合理”或“不合理”),说明理由: 。
(3)Ⅱ.利用如图所示装置可以验证非金属性的变化规律。
实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,选择合适药品设计实验验证氯的非金属性大于硫:装置B中所装药品为 ,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为 。
(4)若要证明非金属性:C>Si,则A中加 .B中加Na2CO3,C中加Na2SiO3溶液,观察到C中的实验现象为有白色沉淀物生成,C中发生反应的离子方程式为 (假设所通气体是过量的)。
14.用SiHCl3在加热条件下与过量H2反应制备纯硅的装置如图(热源及夹持装置略去):
已知:SiHCl3沸点为33℃,能与和H2O强烈反应,在空气中易自燃;
请问答:
(1)依次连接的合理顺序为 。
(2)操作时应先打开装置 (选填“C”或“D”)中分液漏斗的旋塞,理由是 。
答案解析部分
1.【答案】A
【解析】【解答】A.新石器时代鸡形陶壶属于陶器,玻璃、水泥、陶瓷都属于硅酸盐产品,A符合题意;
B.商代的司母戊鼎属于青铜器,青铜是合金,属于金属材料,B不符合题意;
C.清明上河图绘制在绢帛上,绢帛是动物源的天然纤维,主要成分是蛋白质,C不符合题意;
D.西汉的素纱禅衣是蚕丝制品,主要成分是蛋白质,D不符合题意;
故答案为:A。
【分析】A.玻璃、水泥、陶瓷都属于硅酸盐产品;
B.合金属于金属材料;
C.天然纤维主要成分是蛋白质;
D.蚕丝主要成分是蛋白质。
2.【答案】A
【解析】【解答】A.玻璃的主要成分为二氧化硅,石英的主要成分为二氧化硅,故石英可以用来生产玻璃,A符合题意;
B.二氧化硅是制备半导体材料硅的原料,本身不具备半导体性能,B不符合题意;
C.常温下,硅可与强碱、HF反应,C不符合题意;
D.具有粘性,使用玻璃塞会使瓶塞与瓶身粘住,所以实验室保存溶液应用橡胶塞,D不符合题意;
故答案为:A。
【分析】A、二氧化硅可以制取玻璃;
B、二氧化硅可以制作光导纤维;
C、硅可以和强碱和氟化氢反应;
D、硅酸钠的保存应该用橡胶塞,否则会使瓶身和瓶塞粘住。
3.【答案】A
【解析】【解答】A.CaO具有吸水性能和水反应,常用于食品干燥,A符合题意;
B.具有强氧化性,可用于自来水消毒,B不符合题意;
C.MgO熔点高、耐高温,可作为耐高温材料,C不符合题意;
D.做成的纤维具有良好的透光性,可用来制造通讯光缆,D不符合题意;
故答案为:A。
【分析】A.利用CaO具有吸水性能和水反应;
B.利用具有强氧化性,与颜色无关;
C.利用MgO熔点高;
D.利用具有良好的透光性。
4.【答案】A
【解析】【解答】A. 硅晶片主要成分为Si,光导纤维的主要成分为 ,A符合题意;
B. 玻璃、陶瓷和水泥属于硅酸盐材料,B不符合题意;
C. 水玻璃是硅酸钠的水溶液,用水玻璃浸泡过的木材不容易着火,可用作木材防火剂的原料,C不符合题意;
D. 高温超导陶瓷是一种新型陶瓷,耐高温具有超导性,可应用于电力和交通领域,D不符合题意;
故答案为:A。
【分析】生产芯片的是硅单质,而制备光导纤维的是二氧化硅,其他均正确
5.【答案】A
【解析】【解答】A.光导纤维的成分是SiO2,故选A;
B.计算机芯片的成分是晶体硅,故不选B;
C.光电池的成分是晶体硅,故不选C;
D.半导体晶体管的成分是高纯度的晶体硅,故不选D;
故答案为:A
【分析】光导纤维的原材料是二氧化硅,硅的用途是太阳能电池板、计算机芯片、以及半导体材料
6.【答案】D
【解析】【解答】A. 二氧化硅是由Si和O两种元素组成的氧化物,Si是非金属元素,因此是一种非金属氧化物,A不符合题意;
B. 二氧化硅属于原子晶体,不存在单个的分子,B不符合题意;
C. 二氧化硅的化学式为SiO2,其中硅元素与氧元素的质量比为28∶32=7∶8,C不符合题意;
D. 二氧化硅属于原子晶体,不存在分子,D符合题意。
故答案为:D。
【分析】选项B和D是解答的难点,注意C和Si虽然处于同一主族,但二氧化碳和二氧化硅的性质以及结构差别很大。二氧化碳形成的是分子晶体,存在二氧化碳分子。二氧化硅晶体中,硅原子的4个价电子与4个氧原子形成4个共价键,硅原子位于正四面体的中心,4个氧原子位于正四面体的4个顶角上,“SiO2”只能表示化学式,不能表示分子式。
7.【答案】D
【解析】【解答】①Si Na2SiO3 H2SiO3 SiO2 Si,满足表中图示物质在一定条件下一步转化关系;
②Na NaOH Na2CO3 NaCl Na,满足表中图示物质在一定条件下一步转化关系;
③Cl2 Ca(ClO)2 HClO HCl Cl2,满足表中图示物质在一定条件下一步转化关系;
④Fe与Cl2反应可生成FeCl3,FeCl3与Fe反应可得到FeCl2,FeCl2与氢氧化钠生成氢氧化亚铁,氢氧化亚铁得不到Fe,故不满足题意;
故答案为:D。
【分析】①硅与氢氧化钠生成硅酸钠,与盐酸反应生成硅酸,受热分解成二氧化硅,与碳共热反应生成硅单质;
②钠与水生成氢氧化钠,通二氧化碳生成碳酸钠,与盐酸反应生成氯化钠,电解成钠;
③氯气与熟石灰生成次氯酸钙,与二氧化碳生成次氯酸,见光分解成氯化氢气体,二氧化锰反应生成氯气;
④铁与氯气生成氯化铁,溶液种与铁单质生成氯化亚铁,与氢氧化钠反应生成氢氧化亚铁;
8.【答案】C
【解析】【解答】A.碳与二氧化硅反应只能生成一氧化碳,故A不符合题意
B.稀硝酸的氧化产物是NO,故B不符合题意
C.浓硝酸显黄色的原因是由于见光分解生成了二氧化氮故C符合题意
D.硫在氧气中燃烧得到的是二氧化硫,故D不符合题意
故答案为:C
【分析】浓硝酸呈黄色的原因为浓硝酸分解,生成了二氧化氮,从而使溶液颜色变黄
9.【答案】(1)做计算机的芯片或太阳能电池
(2)SiO2+2OH-=SiO+H2O
(3)水玻璃;有白色不溶物生成
(4)2C+SiO2Si+2CO ↑
【解析】【解答】(1)Si是良好的半导体材料,故硅单质可用于做计算机的芯片或太阳能电池。
(2)SiO2是酸性氧化物,可以与等碱溶液反应发生盐和水, SiO2与烧碱溶液反应的离子方程式为SiO2+2OH-=SiO+H2O。
(3)Na2SiO3溶液俗称水玻璃。硅酸的酸性小于碳酸,往Na2SiO3溶液中通入足量CO2气体生成硅酸沉淀和碳酸氢钠,发生的现象是:有白色不溶物生成。
(4)焦炭和二氧化硅在高温条件下反应得到CO和硅,该反应的化学方程式为2C+SiO2Si+2CO ↑。
【分析】(1)根据硅是良好的半导体进行分析。
(2)注意SiO2难溶于水,不可拆;Na2SiO3能溶于水,要拆成离子形式。
(3)CO2与Na2SiO3反应生成难溶物H2SiO3,注意由于CO2足量,所以另一产物是NaHCO3,而不是Na2CO3。
(4)注意反应条件及产物中气体箭头的标注。
10.【答案】(1)2NaOH+SiO2=Na2SiO3+H2O;氢氟酸
(2)防火剂
(3)C;SiO2
【解析】【解答】(1)SiO2是酸性氧化物,能与NaOH反应生成硅酸钠和水,方程式为2NaOH+SiO2=Na2SiO3+H2O;HF能腐蚀玻璃,常用其溶液雕刻玻璃;(2)Na2SiO3溶液浸泡过的棉花不易燃烧,可用作防火剂;(3)反应中C的化合价由0价变为+2价,碳作还原剂;Si的化合价由+4变为0价,二氧化硅作氧化剂。
【分析】(1)SiO2是酸性氧化物,能与NaOH反应生成硅酸钠和水;(2)Na2SiO3溶液浸泡过的棉花不易燃烧,可用作防火剂;(3)反应中C的化合价由0价变为+2价,作还原剂;Si的化合价由+4变为0价,作氧化剂。
11.【答案】(1)Al2O3+6H+ =2Al3++3H2O
(2)SiO2+20H-=SiO32-+H2O
(3)硫氰化钾溶液
(4)NaHCO3;治疗胃酸过多
【解析】【解答】根据以上分析可知A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,C为氢氧化铁、氢氧化镁,D含有氢氧化钠、偏铝酸钠、氯化钠,E中含有NaCl、NaHCO3,F为Al(OH)3,X为Fe2O3、MgO等,Y为氢氧化钠、偏铝酸钠,Z为Al(OH)3,K中含有NaHCO3,则:(1)Al2O3与盐酸反应生成氯化铝和水,氧化物不能拆,离子方程式为:Al2O3+6H+ =2Al3++3H2O;(2)二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,二氧化硅不能拆,故离子反应方程式为:SiO2+20H-=SiO32-+H2O;(3)Fe3+与硫氰化钾溶液反应,使溶液变红色,检验滤液B中是否含Fe3+离子的方法为:取少量滤液B,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+;(4)根据以上分析可知滤液E、K中均含有的溶质是碳酸氢钠,碳酸氢钠可用于治疗胃酸过多、制纯碱或做发酵粉等。
【分析】由工艺流程甲可知,铝土矿与盐酸反应得固体A和滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有氢氧化钠、偏铝酸钠、氯化钠,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为氢氧化钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为Al(OH)3,滤液K中含有NaHCO3,据此判断。
12.【答案】(1)二氧化硅
(2)SiO2+2OH-= +H2O;Al2O3+2OH-= +H2O
(3)2Al2O3(熔融) 4Al+ 3O2↑
(4) +CO2+2H2O=Al(OH)3↓+
(5)沉淀Z中混有H2SiO3,灼烧后,氧化铝中含有二氧化硅杂质
(6)Al2O3+N2+3C 2AlN+3CO
【解析】【解答】(1)根据分析,固体A的主要成分是二氧化硅;(2)铝土矿中Al2O3、SiO2均与强碱反应,生成偏铝酸盐和硅酸盐,反应的离子方程式分别为:Al2O3+2OH-= +H2O、SiO2+2OH-= +H2O;(3)电解熔融氧化铝可制得金属铝和氧气,反应化学方程式2Al2O3(熔融) 4Al+ 3O2↑;(4)向滤液D中通入足量的二氧化碳气体,生成了Al(OH)3沉淀,反应的离子方程式为 +CO2+2H2O=Al(OH)3↓+ ;(5)SiO2、Al2O3均与强碱反应生成硅酸钠和偏铝酸钠,过滤,滤液中通入足量的二氧化碳,反应生成了Al(OH)3沉淀和硅酸,灼烧后,得到氧化铝和二氧化硅,即氧化铝中含有二氧化硅杂质;(6)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X,根据元素守恒可以知道X中应含有氧元素和碳元素,已知每转移6.02×1023个电子即1mol电子,有0.5mol化合物X生成,由电子转移守恒,可得在X中C的化合价为 =2,所以X是CO,所以该反应的化学方程式为Al2O3+N2+3C 2AlN+3CO。
【分析】流程甲:铝土矿中加入过量的稀盐酸,SiO2与盐酸不反应,Al2O3、Fe2O3、MgO均可与盐酸反应生成相应的氯化物,反应的离子方程式为Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O;MgO+2H+=Mg2++H2O;反应液中加入过量烧碱,Al3+变为 ,Mg2+、Fe3+变为Mg(OH)2和Fe(OH)3沉淀,过滤后,滤液中通入足量的二氧化碳气体,生成了Al(OH)3沉淀;反应方程式为 +CO2+2H2O=Al(OH)3↓+ 。流程乙:铝土矿中加入过量的氢氧化钠溶液,Fe2O3、MgO与氢氧化钠不反应,SiO2、Al2O3均与强碱反应生成硅酸钠和偏铝酸钠,过滤,滤液中通入足量的二氧化碳,反应生成了Al(OH)3沉淀和硅酸。
13.【答案】(1)2K+2H+=2K++H2↑
(2)不合理;用碱性强弱比较金属性强弱时,一定要比较元素最高价氧化物对应水化物的碱性强弱,NH3·H2O不是N元素的最高价氧化物对应的水化物
(3)KMnO4;S2-+Cl2=S↓+2Cl-
(4)稀硫酸(或“稀H2SO4”);SiO +2CO2+2H2O=H2SiO3↓+2HCO
【解析】【解答】(1)金属活动性:K>Na>Mg>Al,因此反应最快的金属为K,其反应的离子方程式为:2K+2H+=2K++H2 ↑ ;
(2)不合理; 用碱性强弱比较金属性强弱时,一定要比较元素最高价氧化物对应水化物的碱性强弱,NH3·H2O不是N元素的最高价氧化物对应的水化物;
(3)欲证明氯的非金属性大于硫,可通过Cl2与Na2S的置换反应进行验证,因此A、B装置应反应产生Cl2,故B装置中所装药品为KMnO4,A装置所装药品为浓盐酸,二者反应产生Cl2;C装置所装药品为Na2S溶液,Cl2与Na2S溶液反应生成淡黄色固体硫,该反应的离子方程式为:Cl2+S2-=2Cl-+S↓;
(4)欲证明非金属C>Si,则可通过H2CO3与Na2SiO3溶液反应生成H2SiO3沉淀进行验证,因此A装置中应加稀硫酸,与B中的Na2CO3反应生成CO2,CO2进入C装置中,与Na2SiO3溶液反应,产生H2SiO3沉淀,该反应的离子方程式为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-;
【分析】(1)根据金属活动性确定反应最快的金属,从而写出反应的离子方程式;
(2)由碱性强弱得出金属性强弱时,应用最高价氧化物对应水化物的碱性进行比较;
(3)欲证明氯的非金属性大于硫,可通过Cl2与Na2S的置换反应进行验证;
(4)欲证明非金属C>Si,可通过“强酸制弱酸”原理进行实验;
14.【答案】(1)DBCAE或DBCABE
(2)D;SiHCl3在空气中易自燃,实验时先通一段时间氢气排除装置内空气
【解析】【解答】⑴先是氢气发生装置,再是干燥装置,再是将汽化装置,再是反应装置,再是尾气处理装置,也可以先干燥后再处理尾气,因此依次连接的合理顺序为DBCAE或DBCABE;故答案为:DBCAE或DBCABE。⑵由于SiHCl3沸点为33℃,能与和H2O强烈反应,在空气中易自燃,整个装置需要先排除装置内空气,因此操作时应先打开装置D中分液漏斗的旋塞,理由是SiHCl3在空气中易自燃,实验时先通一段时间氢气排除装置内空气;故答案为:D;SiHCl3在空气中易自燃,实验时先通一段时间氢气排除装置内空气。
【分析】A装置主要是SiHCl3与过量H2在加热条件下反应制备纯硅,B主要是干燥气体,C主要是将SiHCl3转变为气体在A中反应,D是氢气发生装置,E尾气处理装置。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
