1.2离子反应-点对点训练 第三课时(含解析) 高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2离子反应-点对点训练 第三课时(含解析) 高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 417.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-24 10:38:24 | ||
图片预览




文档简介
1.2离子反应-点对点训练第三课时 人教版(2019)必修第一册高中化学
学校:___________姓名:___________班级:___________考号:___________
知识点一:离子反应概念
1.下列叙述正确的是
A.凡是离子化合物,在离子方程式中都要以离子形式表示
B.电解质在溶液中的反应实质是离子之间的反应
C.酸碱中和反应的实质是与结合生成水,故酸碱中和反应都可以用表示
D.复分解反应必须具备离子反应发生的三个条件才能进行
2.下列说法正确的是
A.在水溶液里或熔融状态下能导电的物质是电解质
B.溶液、胶体和浊液最本质的区别是分散质粒子直径的大小不同
C.离子方程式只能表示一个化学反应
D.能电离出的化合物一定就是酸
3.下列反应能用2H+ + CO = CO2↑ +H2O表示的是
A.盐酸与MgCO3溶液反应 B.醋酸与Na2CO3溶液反应
C.HNO3溶液与NaHCO3溶液反应 D.稀硫酸与(NH4)2CO3溶液反应
4.一定温度下,溶液导电能力(I)变化如图所示,下列说法错误的是
A.图①表示:向澄清石灰水中不断通入CO2
B.图②表示:向AgNO3溶液中通入少量HCl
C.图③表示:向NaOH溶液中通入少量Cl2
D.图④表示:向H2SO4溶液中逐滴滴加Ba(OH)2溶液至中性
5.向某可能含有、、、、的溶液中逐滴加入NaOH溶液,产生沉淀的物质的量随所加NaOH溶液的体积的变化图像如图所示。图中各点对应的溶液中离子可以大量共存的是
A.a点:、、 B.b点:、、
C.c点:、、 D.d点:、、
知识点二:离子反应的发生及书写
6.滴加BaCl2溶液后,原Na2SO4溶液中离子数目明显减少的是
A.Na+ B. C.H+ D.OH-
7.下列化学反应的离子方程式书写正确的是
A.盐酸与铁屑反应: 2Fe + 6H+ = 2Fe3+ + 3H2↑
B.金属铜投入硝酸银溶液中: Cu + Ag+ = Cu2+ + Ag
C.氢氧化铜固体投入稀硝酸: Cu(OH)2 + 2H+ = Cu2+ + 2H2O
D.大理石与盐酸反应: CO+ 2H+ = CO2↑+ H2O
8.能正确表示下列化学反应的离子方程式正确的是
A.氢氧化镁与盐酸的反应:H+ + OH- = H2O
B.硫酸铜溶液与氢氢化钡溶液混合:Ba2+ + SO= BaSO4 ↓
C.碳酸氢钠溶液与稀硫酸反应:HCO + H+= CO2 ↑ + H2O
D.石灰石溶于醋酸中:CaCO3 + 2H+ = CO2↑+ H2O + Ca2+
9.下列离子方程式书写正确的是
A.向溶液中加入过量氨水:
B.醋酸与反应:
C.向溶液中加入少量的HI溶液:
D.常温下,铝遇到浓硝酸:
10.在强碱性溶液中,下列离子组能大最共存的是
A.、、、 B.、、、
C.、、、 D.、、、
知识点三:离子反应的发生条件
11.下列离子方程式书写正确的是
A.向饱和氯化钠溶液中依次通入足量NH3和CO2:NH3+H2O+CO2=HCO+NH
B.用醋酸除去水壶中的水垢:CaCO3+2H+=Ca2++CO2↑+H2O
C.熔融状态下NaHSO4的电离:NaHSO4=Na++SO+H+
D.盛放氢氧化钠溶液的试剂瓶不能用磨口玻璃塞的原因:SiO2+2OH-=SiO+H2O
12.下列各组物质相互混合后,不会发生离子反应的是
A.NaOH和硫酸 B.Zn和盐酸
C.NaOH溶液和Fe2(SO4)3溶液 D.H2SO4溶液和MgCl2溶液
13.下列离子方程式错误的是
A.CuO+2H+=Cu2++H2O B.CaCO3+2H+=Ca2++CO2↑+H2O
C.2Fe+6H+=2Fe3++3H2↑ D.BaO+2H+=Ba2++H2O
14.下列反应能用离子方程式H+ + OH—=H2O表示的是
A.H2SO4与Mg(OH)2反应 B.H2SO4与Ba(OH)2反应
C.HNO3与NaOH反应 D.H2SO4与Fe(OH)3反应
15.下列离子方程式书写正确的是
A.在溶液中滴入溶液至恰好中和:
B.溶液腐蚀印刷电路铜板:
C.向溶液中滴入少量澄清石灰水:
D.醋酸腐蚀大理石台面:
能力提升
16.下列反应的离子方程式不正确的是_______。
A.(2021·全国乙卷)过量铁粉加入稀硝酸中:3Fe2++4H++NO=3Fe3++2H2O+NO↑
B.(2021·全国乙卷)硫酸铝溶液中滴加少量氢氧化钾溶液:Al3++4OH-=AlO+2H2O
C.(2022·浙江6月选考)Na2CO3溶液中通入过量SO2:CO+2SO2+2H2O=2HSO+CO2
D.(2022·全国甲卷)明矾溶液与过量氨水湿合:Al3++4NH3+4H2O=AlO+4NH
E. (2021·湖北省选择考)向次氯酸钙溶液中通入少量二氧化碳气体:ClO-+CO2+H2O=HClO+HCO
F. (2020·天津等级考)NaOH溶液与过量H2C2O4溶液反应:H2C2O4+2OH-=C2O+2H2O
G. (2020·天津等级考)C6H5ONa溶液中通入少量CO2:2C6H5O-+CO2+H2O=2C6H5OH+CO
H. (2020·江苏高考)0.1mol·L-1AgNO3溶液中加入过量浓氨水:Ag++NH3+H2O=AgOH↓+NH
I. (2020·全国Ⅲ卷)用Na2SO3溶液吸收少量Cl2:3SO+Cl2+H2O=2HSO+2Cl-+SO
J. (2020·浙江7月选考) (NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应:SO+Ba2+=BaSO4↓
K. (2018·浙江4月学考真题)漂白粉溶液吸收少量二氧化硫气体:SO2+H2O+ClOˉ=SO+Clˉ+2H+
L. (2015·四川高考)CuSO4溶液与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O=Cu(OH)2↓+2NH
17.下列反应的离子方程式不正确的是_______。
A.(2022·全国甲卷)将等物质的量浓度的Ba(OH)2和NH4HSO4溶液以体积比1∶2混合:Ba2++2OH-+2H++SO=BaSO4↓+2H2O
B.(2020·全国Ⅲ卷)同浓度同体积NH4HSO4溶液与NaOH溶液混合:NH+OH-=NH3·H2O
C.(2014·大纲版全国卷)等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-=Mg(OH)2↓
D.1mol/L的NaAlO2溶液与2.5mol/L的HCl溶液等体积混合2AlO+5H+=Al3++Al(OH)3↓+H2O
E.将等浓度的Ba(OH)2溶液与NaHSO4液按体积比2∶3混合:2Ba2++3OH-+3H++2SO=2BaSO4↓+3H2O
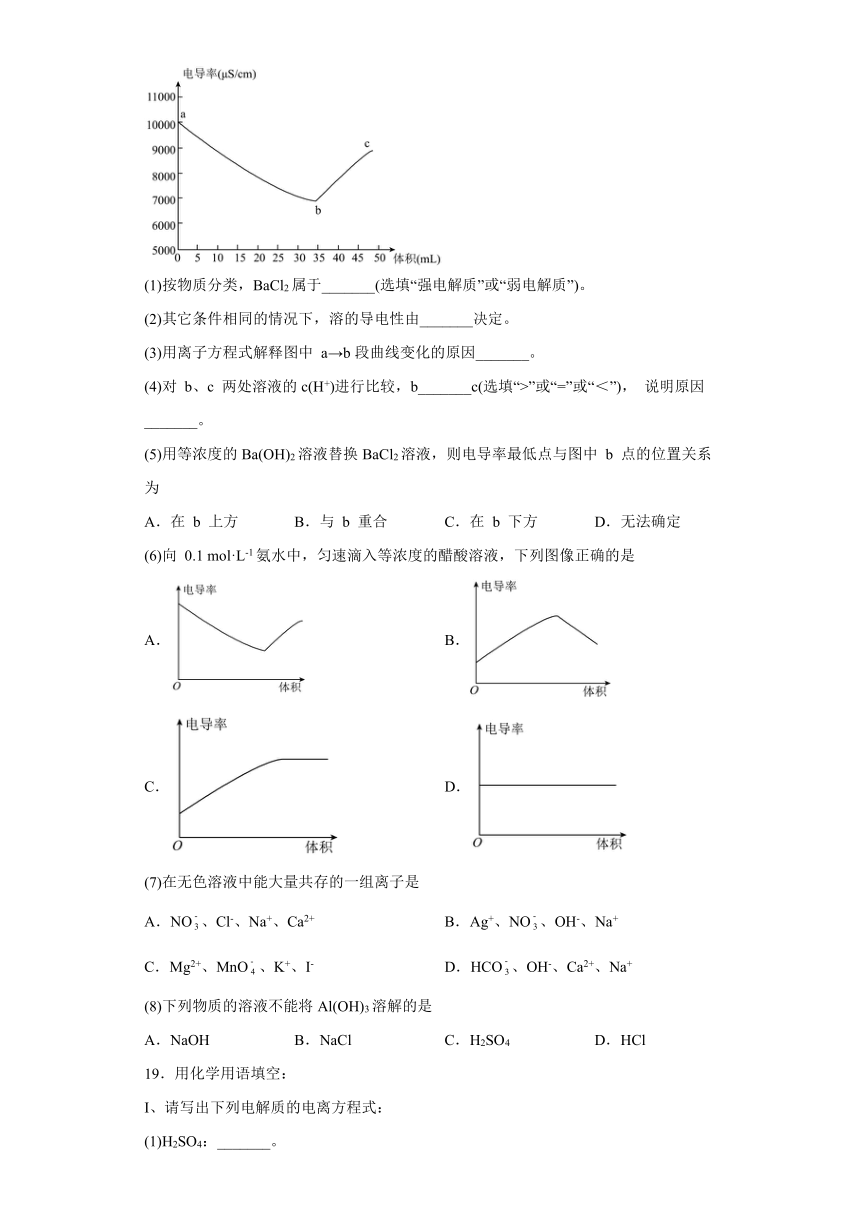
18.数字化实验是化学研究的重要手段。实验小组将电导率传感器插入20.00mL 0.1mol·L-1 H2SO4溶液中,向溶液中匀速滴入等浓度的BaCl2溶液,电导率与溶液体积图像如图所示。 (已知溶液导电性越强,电导率值越大),请回答下列问题。
(1)按物质分类,BaCl2属于_______(选填“强电解质”或“弱电解质”)。
(2)其它条件相同的情况下,溶的导电性由_______决定。
(3)用离子方程式解释图中 a→b段曲线变化的原因_______。
(4)对 b、c 两处溶液的c(H+)进行比较,b_______c(选填“>”或“=”或“<”), 说明原因_______。
(5)用等浓度的Ba(OH)2溶液替换BaCl2溶液,则电导率最低点与图中 b 点的位置关系为
A.在 b 上方 B.与 b 重合 C.在 b 下方 D.无法确定
(6)向 0.1 mol·L-1氨水中,匀速滴入等浓度的醋酸溶液,下列图像正确的是
A. B.
C. D.
(7)在无色溶液中能大量共存的一组离子是
A.NO、Cl-、Na+、Ca2+ B.Ag+、NO、OH-、Na+
C.Mg2+、MnO、K+、I- D.HCO、OH-、Ca2+、Na+
(8)下列物质的溶液不能将Al(OH)3溶解的是
A.NaOH B.NaCl C.H2SO4 D.HCl
19.用化学用语填空:
I、请写出下列电解质的电离方程式:
(1)H2SO4:_______。
(2)NaHCO3:_______。
(3)Fe2(SO4)3:_______。
II、请写出下列反应的离子方程式:
(4)氢氧化钠溶液与硫酸混合_______;
(5)氢氧化钡溶液与硫酸铜溶液混合_______;
(6)稀盐酸与碳酸钙反应_______
20.离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在_______(填序号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)将两种化合物一起溶于水得到一种无色透明溶液,溶液中可能含有下列离子中的某些离子:、、、、、、和。取该溶液进行如下实验:
Ⅰ.取少许原溶液,滴入紫色石蕊溶液,溶液呈蓝色。
Ⅱ.取少许原溶液,滴入溶液,无白色沉淀产生。
Ⅲ.取少许原溶液先滴加稀硝酸,再滴入溶液,产生白色沉淀。
Ⅳ.取少许原溶液,滴入少量溶液,有白色沉淀产生。
①根据以上现象判断,原溶液中肯定不存在的离子是_______;肯定存在的离子是_______。
②若原溶液中各种离子的浓度相等,确定该溶液中_______(填“有”或“无”),判断依据是_______。
③若原溶液中各离子的浓度相等,取一定量该溶液,加入等体积的稀硫酸(其中硫酸根浓度与原溶液中各离子浓度相等),写出发生反应的离子方程式:_______。
参考答案:
1.B
【详解】A.只有可溶性盐在离子方程式中才可以写成离子形式, 故A错误;
B.电解质溶于水后,电离成为自由移动的离子,因此,电解质在溶液中的反应一定与离子有关。电解质在溶液中的反应实质上是离子之间的反应,故B正确;
C.表示的是强酸和强碱反应且没有沉淀生成,如稀硫酸和氢氧化钡溶液的反应为,故B错误;
D.复分解反应只要具备①有弱电解质生成;②有气体生成;③有难溶盐生成;三个条件中的任何一个就可以发生,故D错误;
故选B。
2.B
【详解】A.电解质是在水溶液中或熔融状态下能够导电的化合物,故A项错误;
B.分散系根据分散质粒子直径大小来分类:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),所以溶液、胶体和浊液这三种分散系的本质的区别在于分散质粒子直径大小,故B项正确;
C.可表示大部分的易溶强碱与可溶铜盐反应,故C项错误;
D.电离时生成的阳离子全部是氢离子(H )的化合物叫做酸,能电离出H+的不一定为酸,如NaHSO4属于盐,但在水中能电离出H+,故D项错误;
综上所述,正确的是B项。
3.D
【详解】A.MgCO3为微溶物,MgCO3的非澄清溶液在离子方程式中不能拆分,因此不能用2H+ + CO = CO2↑ +H2O表示,故A项不选;
B.醋酸为弱酸,在离子方程式中不能拆分,因此不能用2H+ + CO = CO2↑ +H2O表示,故B项不选;
C.NaHCO3在水中电离出Na+和,与HNO3溶液中H+能发生复分解反应生成CO2和H2O,因此不能用2H+ + CO = CO2↑ +H2O表示,故C项不选;
D.(NH4)2CO3在水中电离出和,与稀硫酸中H+能发生复分解反应生成CO2和H2O,反应离子方程式为2H+ + CO = CO2↑ +H2O,故D项选;
综上所述,答案为D。
4.B
【详解】A.向澄清石灰水中不断通入CO2,发生反应Ca(OH)2+CO2=CaCO3↓+H2O,当二者完全反应时,溶液中离子浓度接近为0,导电性为0,继续通入CO2,CO2与水反应生成弱电解质碳酸,溶液的导电性增强,A正确;
B.向AgNO3溶液中通入少量HCl,发生反应AgNO3+HCl=AgCl↓+HNO3,AgNO3和HNO3均为强电解质,溶液的导电性几乎不变,B错误;
C.向NaOH溶液中通入少量Cl2,发生反应2OH-+Cl2=Cl-+ClO-+H2O,溶液中离子浓度不变,溶液的导电性不变,C正确;
D.向H2SO4溶液中逐滴滴加Ba(OH)2溶液至中性,发生反应H2SO4+Ba(OH)2=BaSO4↓+2H2O,此时溶液中离子浓度接近为0,导电性为0,D正确;
综上所述答案为B。
5.C
【分析】向某可能含有、、、、的溶液中逐滴加入NaOH溶液,开始没有沉淀生成,说明含有氢离子;生成沉淀后部分溶解,说明含有铝离子、镁离子;不确定是否含有铵根离子、硝酸根离子;
【详解】A.由分析可知,a点溶液含有氢离子,和碳酸根离子不共存,A错误;
B.b点氢离子完全反应,生成了沉淀,Fe3+不能共存,B错误;
C.c点氢离子、铝离子、镁离子均恰好反应,溶液呈碱性,硝酸根离子不会和碘离子发生氧化还原反应,可以共存,C正确;
D.d点氢氧化钠过量,和碳酸氢根离子生成水和碳酸根离子,不共存,D错误;
故选C。
6.B
【详解】BaCl2溶液与Na2SO4溶液反应生成硫酸钡沉淀:,则滴加BaCl2溶液后原Na2SO4溶液中离子数目明显减少;
选B。
7.C
【详解】A.盐酸与铁屑反应生成氯化亚铁和氢气:Fe + 2H+=Fe2+ + H2↑,A错误;
B.金属铜投入硝酸银溶液中发生置换反应:Cu +2Ag+=Cu2+ +2Ag,B错误;
C.氢氧化铜固体投入稀硝酸中生成硝酸铜和水:Cu(OH)2 + 2H+=Cu2+ + 2H2O,C正确;
D.大理石难溶,与盐酸反应:CaCO3+ 2H+=Ca2+ +CO2↑+ H2O,D错误;
答案选C。
8.C
【详解】A.氢氧化镁难溶于水,书写离子方程式时不拆写,正确的是Mg(OH)2+2H+=Mg2++2H2O,故A错误;
B.缺少Cu2+与OH-反应,正确的是Cu2++SO+Ba2++2OH-=Cu(OH)2↓+BaSO4↓,故B错误;
C.碳酸氢钠属于盐,与稀硫酸反应生成二氧化碳和水,其离子方程式为HCO+H+=CO2↑+H2O,故C正确;
D.石灰石主要成分是CaCO3,碳酸钙难溶于水,醋酸为弱酸,不应拆写,正确的是CaCO3+2CH3COOH=Ca2++2CH3COO-+ CO2↑+H2O,故D错误;
答案为C。
9.A
【详解】A.Al(OH)3不与过量氨水反应,A正确;
B.醋酸是弱电解质,不能拆,应为,B错误;
C.电荷不守恒,应为,C错误;
D.常温下,铝与浓硝酸会钝化,不能反应生成NO2,加热条件下会发生反应,D错误;
故选A。
10.A
【详解】A.、、、在强碱溶液中不反应,可大量共存,故A选;
B.强碱溶液中不能大量存在Cu2+,故B不选;
C.、、OH-结合生成沉淀,不能共存,故C不选;
D.和会反应生成碳酸钡沉淀,不能大量共存,故D不选;
故选A。
11.D
【详解】A.离子方程式为,A项错误;
B.醋酸是弱电解质不能拆,B项错误;
C.熔融状态下的电离方程式为,C项错误;
D.盛放氢氧化钠溶液的试剂瓶不能用磨口玻璃塞的原因是玻璃成分为二氧化硅和氢氧化钠发生反应,离子方程式书写正确,D项正确;
答案选D。
12.D
【详解】A.NaOH和硫酸混合,有水生成,能够发生离子反应,A不符合题意;
B. Zn和盐酸混合,生成氯化锌和氢气,能够发生离子反应,B不符合题意;
C. NaOH溶液和Fe2(SO4)3溶液混合,有氢氧化铁沉淀生成,能够发生离子反应,C不符合题意;
D. H2SO4溶液和MgCl2溶液混合,既无沉淀、气体生成,也无弱电解质生成,不会发生离子反应,D符合题意;
答案选D
13.C
【详解】A.由离子方程式可知,CuO+2H+=Cu2++H2O可表示为氧化铜与强酸溶液反应生成可溶性铜盐和水,故A正确;
B.由离子方程式可知,CaCO3+2H+=Ca2++CO2↑+H2O可表示为碳酸钙与强酸反应生成可溶性钙盐、二氧化碳和水,故B正确;
C.铁与非氧化性强酸反应生成亚铁离子和氢气,反应的离子方程式为Fe+2H+=Fe2++H2↑,故C错误;
D.由离子方程式可知,BaO+2H+=Ba2++H2O可表示为氧化钡与强酸强酸溶液反应生成可溶性钡盐和水,故D正确;
故选C。
14.C
【详解】A.稀硫酸与难溶的氢氧化镁反应生成硫酸镁和水,不能用离子方程式H+ + OH—=H2O表示,故A错误;
B.稀硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水,不能用离子方程式H+ + OH—=H2O表示,故B错误;
C.稀硝酸与氢氧化钠溶液反应生成硝酸钠和水,能用离子方程式H+ + OH—=H2O表示,故C正确;
D.稀硫酸与难溶的氢氧化铁反应生成硫酸铁和水,不能用离子方程式H+ + OH—=H2O表示,故D错误;
故选C。
15.A
【详解】A.在溶液中滴入溶液至恰好中和:,A正确;
B.溶液腐蚀印刷电路铜板,离子方程式为:,B错误;
C.向溶液中滴入少量澄清石灰水,离子方程式为:,C错误;
D.醋酸腐蚀大理石台面,离子方程式为:2CH3COOH+CaCO3=Ca2++CO2+H2O+2CHCOO-,D错误;
故选A。
16.ABDEFGHJKL
【详解】A.过量铁粉能够和Fe3+反应生成Fe2+,A错误;
B.硫酸铝溶液中和少量氢氧化钾溶液反应生成Al(OH)3沉淀,B错误;
C.亚硫酸的酸性强于碳酸,因此,Na2CO3溶液中通入过量SO2发生离子反应生成亚硫酸氢钠和二氧化碳,该反应的离子方程式为CO+2SO2+2H2O=2HSO+CO2,C正确;
D.明矾在水中可以电离出Al3+,可以与氨水中电离出的OH-发生反应生成Al(OH)3,但由于氨水的碱性较弱,生成的Al(OH)3不能继续与弱碱发生反应,故反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH,D错误;
E.向次氯酸钙溶液中通入少量CO2气体,发生反应生成CaCO3和HClO:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO,E错误;
F.NaOH溶液与过量H2C2O4溶液反应生成NaHC2O4和水,离子方程式为OH-+H2C2O4=HC2O+H2O,F错误;
G.酸性:H2CO3>苯酚>HCO,C6H5ONa溶液中通入少量CO2,生成苯酚钠和NaHCO3,离子方程式为C6H5O-+CO2+H2O=C6H5OH+HCO,G错误。
H.AgOH会溶于过量的浓氨水,生成Ag(NH3)2OH,H错误;
I.Na2SO3溶液吸收少量Cl2的反应可分为两步:先发生氧化还原反应:SO+Cl2+H2O=2H++2Cl-+SO,然后发生:H++SO=HSO,由二者可得3SO+Cl2+H2O=2HSO+2Cl-+SO,I正确;
J.(NH4)2Fe(SO4)2可以写成(NH4)2SO4·FeSO4,(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应,OH-先与Fe2+反应,再和NH反应,由于Ba(OH)2较少,NH不会参与反应,离子方程式为Fe2++SO+Ba2++2OH-=Fe(OH)2↓+BaSO4↓,J错误;
K.因为SO2少量,所以产物中应有未反应完的ClO-,会与H+结合成HClO,K错误;
L.氨水过量,Cu(OH)2沉淀继续和氨水反应形成络合物,离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,L错误;
故选ABDEFGHJKL。
17.BC
【详解】A.将等物质的量浓度的Ba(OH)2与NH4HSO4溶液以体积比1∶2混合,Ba(OH)2电离出的OH-与NH4HSO4电离出的H+反应生成水,Ba(OH)2电离出的Ba2+与NH4HSO4电离出的SO反应生成BaSO4沉淀,反应的离子方程为为Ba2++2OH-+2H++SOBaSO4↓+2H2O,A正确;
B.NH4HSO4溶液中含有NH和H+,二者均可与OH-反应,且反应的先后顺序为H+、NH,所以同浓度同体积NH4HSO4溶液与NaOH溶液混合时反应的离子方程式为H++OH-H2O,B错误;
C.缺少H++OH-H2O,其反应的离子方程式应为Mg2++2H++4OH-Mg(OH)2↓+2H2O,C错误;
D.1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合,设溶液体积为1L,偏铝酸钠和HCl的物质的量分别为1mol、2.5mol,1mol偏铝酸钠消耗1molHCl生成1mol氢氧化铝,剩余的1.5molHCl能够溶解0.5mol氢氧化铝,反应的离子方程式为:2AlO+5H+Al3++Al(OH)3↓+H2O,D正确;
E.等浓度的Ba(OH)2溶液与NaHSO4溶液按体积比2∶3,则两者物质的量之比为2∶3,两者混合后,2molBa2+消耗2molSO42-,3molH+消耗3molOH-,反应的离子反应方程式为:2Ba2++3OH-+3H++2SO42-2BaSO4↓+3H2O,E正确;
故选BC。
18.(1)强电解质
(2)离子浓度大小
(3)SO+Ba2+=BaSO4↓
(4) > 过量的BaCl2溶液中的水使溶液中的H+浓度减小
(5)C
(6)B
(7)A
(8)B
【详解】(1)BaCl2在水溶液完全电离产生自由移动的离子,因此属于强电解质;
(2)在其它条件相同的情况下,溶的导电性由溶液中自由移动的离子浓度大小决定,离子浓度越大,溶液的导电能力就越强;
(3)向H2SO4溶液中滴入BaCl2溶液,二者会发生复分解反应:H2SO4+BaCl2=BaSO4↓+2HCl,反应产生BaSO4白色沉淀,该反应的离子方程式为SO+Ba2+=BaSO4↓,虽然离子带有电荷数目不变,但由于BaCl2溶液的水导致溶液体积变大,溶液中自由移动的离子浓度减小,故溶液的电导率减小;
(4)b点恰好发生反应H2SO4+BaCl2=BaSO4↓+2HCl,b点后BaCl2溶液过量,但HCl的物质的量不变,溶液的体积增大,导致溶液中c(H+)会逐渐减小,故c(H+):b>c;
(5)若使用等浓度的Ba(OH)2溶液替换BaCl2溶液,会发生反应:H2SO4+Ba(OH)2=BaSO4↓+2H2O,该反应的离子方程式为:2H+++Ba2++2OH-=BaSO4↓+2H2O,在二者恰好反应时,溶液中几乎不存在自由移动的离子,电导率几乎为0,故电导率最低点在图中 b点的下方,故合理选项是C;
(6)氨水中的NH3 H2O是弱电解质,只能微弱电离产生自由移动的、OH-,溶液的电导率不大。向其中加入弱酸醋酸溶液时,二者发生反应产生可溶性强电解质CH3COONH4,使溶液中自由移动的离子浓度增大,溶液的电导率增强,当恰好反应时,离子浓度最大,此时电导率达到最大值,后来醋酸溶液过量,过量的醋酸溶液对CH3COONH4起稀释作用,导致溶液中自由移动的离子浓度逐渐减少,溶液的电导率逐渐降低,故加入醋酸溶液时电导率变化曲线是B;
(7)A.选项水溶液显无色,且离子之间不能发生任何反应,可以大量共存,A符合题意;
B.Ag+与OH-会发生反应产生Ag2O、H2O,不能大量共存,B不符合题意;
C.MnO的水溶液显紫色,在无色溶液中不能电离存在;且与I-会发生氧化还原反应,也不能大量共存,C不符合题意;
D.HCO、OH-、Ca2+会发生离子反应产生CaCO3沉淀、H2O,不能大量共存,D不符合题意;
故合理选项是A;
(8)A.NaOH是强碱,能够与Al(OH)3发生反应产生NaAlO2、H2O,A不符合题意;
B.NaCl与Al(OH)3不能发生反应,因此不能溶解Al(OH)3,B符合题意;
C.H2SO4是二元强酸,能够与Al(OH)3发生反应产生Al2(SO4)3、H2O,C不符合题意;
D.HCl是一元强酸,能够与Al(OH)3发生反应产生AlCl3、H2O,D不符合题意;
故合理选项是B。
19.(1)H2SO4=2H++SO
(2)NaHCO3=Na++HCO
(3)Fe2(SO4)3=2Fe3++3SO
(4)OH-+H+=H2O
(5)Ba2++2OH-+Cu2++SO=BaSO4↓+Cu(OH)2↓
(6)CaCO3+2H+=Ca2++H2O+CO2↑
【详解】(1)硫酸是强电解质,完全电离产生硫酸根离子和氢离子,电离方程式为H2SO4=2H++。
(2)碳酸氢钠为强电解质,完全电离产生钠离子和碳酸氢根离子,电离方程式为NaHCO3=Na++。
(3)硫酸铁为强电解质,完全电离产生铁离子和硫酸根离子,电离方程式为Fe2(SO4)3=2Fe3++3。
(4)氢氧化钠与硫酸反应,生成硫酸钠和水,离子方程式为OH-+H+=H2O。
(5)氢氧化钡与硫酸铜反应,生成硫酸钡和氢氧化铜,离子方程式为Ba2++2OH-+Cu2++=BaSO4↓+Cu(OH)2↓。
(6)稀盐酸和碳酸钙反应,生成氯化钙、水和二氧化碳,离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑。
20.(1)③⑤
(2) 、、、 、、 无 溶液中一定有、、,浓度相等时电荷守恒,所以无
【详解】(1)有离子参与的化学反应是离子反应,在发生离子反应的反应物或生成物中,一定存在电解质,电解质一定是化合物,选③⑤。
(2)Ⅰ.取少许原溶液,滴入紫色石蕊溶液,溶液呈蓝色,说明溶液呈碱性,原溶液一定含有;、与不共存,所以一定不含、。
Ⅱ.取少许原溶液,滴入溶液,无白色沉淀产生,原溶液不含、。
Ⅲ.取少许原溶液先滴加稀硝酸,再滴入溶液,产生白色沉淀,说明原溶液含有。
Ⅳ.取少许原溶液,滴入少量溶液,有白色沉淀产生,说明原溶液含有;
①根据以上分析,原溶液中肯定不存在的离子是;肯定存在的离子是、、、。
②原溶液中一定含有、和,若原溶液中各种离子的浓度相等,根据电荷守恒,该溶液中无。
③若原溶液中各离子的浓度相等,取一定量该溶液,加入等体积的稀硫酸(其中硫酸根浓度与原溶液中各离子浓度相等),反应生成硫酸钡沉淀、水和盐酸,发生反应的离子方程式:。
学校:___________姓名:___________班级:___________考号:___________
知识点一:离子反应概念
1.下列叙述正确的是
A.凡是离子化合物,在离子方程式中都要以离子形式表示
B.电解质在溶液中的反应实质是离子之间的反应
C.酸碱中和反应的实质是与结合生成水,故酸碱中和反应都可以用表示
D.复分解反应必须具备离子反应发生的三个条件才能进行
2.下列说法正确的是
A.在水溶液里或熔融状态下能导电的物质是电解质
B.溶液、胶体和浊液最本质的区别是分散质粒子直径的大小不同
C.离子方程式只能表示一个化学反应
D.能电离出的化合物一定就是酸
3.下列反应能用2H+ + CO = CO2↑ +H2O表示的是
A.盐酸与MgCO3溶液反应 B.醋酸与Na2CO3溶液反应
C.HNO3溶液与NaHCO3溶液反应 D.稀硫酸与(NH4)2CO3溶液反应
4.一定温度下,溶液导电能力(I)变化如图所示,下列说法错误的是
A.图①表示:向澄清石灰水中不断通入CO2
B.图②表示:向AgNO3溶液中通入少量HCl
C.图③表示:向NaOH溶液中通入少量Cl2
D.图④表示:向H2SO4溶液中逐滴滴加Ba(OH)2溶液至中性
5.向某可能含有、、、、的溶液中逐滴加入NaOH溶液,产生沉淀的物质的量随所加NaOH溶液的体积的变化图像如图所示。图中各点对应的溶液中离子可以大量共存的是
A.a点:、、 B.b点:、、
C.c点:、、 D.d点:、、
知识点二:离子反应的发生及书写
6.滴加BaCl2溶液后,原Na2SO4溶液中离子数目明显减少的是
A.Na+ B. C.H+ D.OH-
7.下列化学反应的离子方程式书写正确的是
A.盐酸与铁屑反应: 2Fe + 6H+ = 2Fe3+ + 3H2↑
B.金属铜投入硝酸银溶液中: Cu + Ag+ = Cu2+ + Ag
C.氢氧化铜固体投入稀硝酸: Cu(OH)2 + 2H+ = Cu2+ + 2H2O
D.大理石与盐酸反应: CO+ 2H+ = CO2↑+ H2O
8.能正确表示下列化学反应的离子方程式正确的是
A.氢氧化镁与盐酸的反应:H+ + OH- = H2O
B.硫酸铜溶液与氢氢化钡溶液混合:Ba2+ + SO= BaSO4 ↓
C.碳酸氢钠溶液与稀硫酸反应:HCO + H+= CO2 ↑ + H2O
D.石灰石溶于醋酸中:CaCO3 + 2H+ = CO2↑+ H2O + Ca2+
9.下列离子方程式书写正确的是
A.向溶液中加入过量氨水:
B.醋酸与反应:
C.向溶液中加入少量的HI溶液:
D.常温下,铝遇到浓硝酸:
10.在强碱性溶液中,下列离子组能大最共存的是
A.、、、 B.、、、
C.、、、 D.、、、
知识点三:离子反应的发生条件
11.下列离子方程式书写正确的是
A.向饱和氯化钠溶液中依次通入足量NH3和CO2:NH3+H2O+CO2=HCO+NH
B.用醋酸除去水壶中的水垢:CaCO3+2H+=Ca2++CO2↑+H2O
C.熔融状态下NaHSO4的电离:NaHSO4=Na++SO+H+
D.盛放氢氧化钠溶液的试剂瓶不能用磨口玻璃塞的原因:SiO2+2OH-=SiO+H2O
12.下列各组物质相互混合后,不会发生离子反应的是
A.NaOH和硫酸 B.Zn和盐酸
C.NaOH溶液和Fe2(SO4)3溶液 D.H2SO4溶液和MgCl2溶液
13.下列离子方程式错误的是
A.CuO+2H+=Cu2++H2O B.CaCO3+2H+=Ca2++CO2↑+H2O
C.2Fe+6H+=2Fe3++3H2↑ D.BaO+2H+=Ba2++H2O
14.下列反应能用离子方程式H+ + OH—=H2O表示的是
A.H2SO4与Mg(OH)2反应 B.H2SO4与Ba(OH)2反应
C.HNO3与NaOH反应 D.H2SO4与Fe(OH)3反应
15.下列离子方程式书写正确的是
A.在溶液中滴入溶液至恰好中和:
B.溶液腐蚀印刷电路铜板:
C.向溶液中滴入少量澄清石灰水:
D.醋酸腐蚀大理石台面:
能力提升
16.下列反应的离子方程式不正确的是_______。
A.(2021·全国乙卷)过量铁粉加入稀硝酸中:3Fe2++4H++NO=3Fe3++2H2O+NO↑
B.(2021·全国乙卷)硫酸铝溶液中滴加少量氢氧化钾溶液:Al3++4OH-=AlO+2H2O
C.(2022·浙江6月选考)Na2CO3溶液中通入过量SO2:CO+2SO2+2H2O=2HSO+CO2
D.(2022·全国甲卷)明矾溶液与过量氨水湿合:Al3++4NH3+4H2O=AlO+4NH
E. (2021·湖北省选择考)向次氯酸钙溶液中通入少量二氧化碳气体:ClO-+CO2+H2O=HClO+HCO
F. (2020·天津等级考)NaOH溶液与过量H2C2O4溶液反应:H2C2O4+2OH-=C2O+2H2O
G. (2020·天津等级考)C6H5ONa溶液中通入少量CO2:2C6H5O-+CO2+H2O=2C6H5OH+CO
H. (2020·江苏高考)0.1mol·L-1AgNO3溶液中加入过量浓氨水:Ag++NH3+H2O=AgOH↓+NH
I. (2020·全国Ⅲ卷)用Na2SO3溶液吸收少量Cl2:3SO+Cl2+H2O=2HSO+2Cl-+SO
J. (2020·浙江7月选考) (NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应:SO+Ba2+=BaSO4↓
K. (2018·浙江4月学考真题)漂白粉溶液吸收少量二氧化硫气体:SO2+H2O+ClOˉ=SO+Clˉ+2H+
L. (2015·四川高考)CuSO4溶液与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O=Cu(OH)2↓+2NH
17.下列反应的离子方程式不正确的是_______。
A.(2022·全国甲卷)将等物质的量浓度的Ba(OH)2和NH4HSO4溶液以体积比1∶2混合:Ba2++2OH-+2H++SO=BaSO4↓+2H2O
B.(2020·全国Ⅲ卷)同浓度同体积NH4HSO4溶液与NaOH溶液混合:NH+OH-=NH3·H2O
C.(2014·大纲版全国卷)等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-=Mg(OH)2↓
D.1mol/L的NaAlO2溶液与2.5mol/L的HCl溶液等体积混合2AlO+5H+=Al3++Al(OH)3↓+H2O
E.将等浓度的Ba(OH)2溶液与NaHSO4液按体积比2∶3混合:2Ba2++3OH-+3H++2SO=2BaSO4↓+3H2O
18.数字化实验是化学研究的重要手段。实验小组将电导率传感器插入20.00mL 0.1mol·L-1 H2SO4溶液中,向溶液中匀速滴入等浓度的BaCl2溶液,电导率与溶液体积图像如图所示。 (已知溶液导电性越强,电导率值越大),请回答下列问题。
(1)按物质分类,BaCl2属于_______(选填“强电解质”或“弱电解质”)。
(2)其它条件相同的情况下,溶的导电性由_______决定。
(3)用离子方程式解释图中 a→b段曲线变化的原因_______。
(4)对 b、c 两处溶液的c(H+)进行比较,b_______c(选填“>”或“=”或“<”), 说明原因_______。
(5)用等浓度的Ba(OH)2溶液替换BaCl2溶液,则电导率最低点与图中 b 点的位置关系为
A.在 b 上方 B.与 b 重合 C.在 b 下方 D.无法确定
(6)向 0.1 mol·L-1氨水中,匀速滴入等浓度的醋酸溶液,下列图像正确的是
A. B.
C. D.
(7)在无色溶液中能大量共存的一组离子是
A.NO、Cl-、Na+、Ca2+ B.Ag+、NO、OH-、Na+
C.Mg2+、MnO、K+、I- D.HCO、OH-、Ca2+、Na+
(8)下列物质的溶液不能将Al(OH)3溶解的是
A.NaOH B.NaCl C.H2SO4 D.HCl
19.用化学用语填空:
I、请写出下列电解质的电离方程式:
(1)H2SO4:_______。
(2)NaHCO3:_______。
(3)Fe2(SO4)3:_______。
II、请写出下列反应的离子方程式:
(4)氢氧化钠溶液与硫酸混合_______;
(5)氢氧化钡溶液与硫酸铜溶液混合_______;
(6)稀盐酸与碳酸钙反应_______
20.离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在_______(填序号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)将两种化合物一起溶于水得到一种无色透明溶液,溶液中可能含有下列离子中的某些离子:、、、、、、和。取该溶液进行如下实验:
Ⅰ.取少许原溶液,滴入紫色石蕊溶液,溶液呈蓝色。
Ⅱ.取少许原溶液,滴入溶液,无白色沉淀产生。
Ⅲ.取少许原溶液先滴加稀硝酸,再滴入溶液,产生白色沉淀。
Ⅳ.取少许原溶液,滴入少量溶液,有白色沉淀产生。
①根据以上现象判断,原溶液中肯定不存在的离子是_______;肯定存在的离子是_______。
②若原溶液中各种离子的浓度相等,确定该溶液中_______(填“有”或“无”),判断依据是_______。
③若原溶液中各离子的浓度相等,取一定量该溶液,加入等体积的稀硫酸(其中硫酸根浓度与原溶液中各离子浓度相等),写出发生反应的离子方程式:_______。
参考答案:
1.B
【详解】A.只有可溶性盐在离子方程式中才可以写成离子形式, 故A错误;
B.电解质溶于水后,电离成为自由移动的离子,因此,电解质在溶液中的反应一定与离子有关。电解质在溶液中的反应实质上是离子之间的反应,故B正确;
C.表示的是强酸和强碱反应且没有沉淀生成,如稀硫酸和氢氧化钡溶液的反应为,故B错误;
D.复分解反应只要具备①有弱电解质生成;②有气体生成;③有难溶盐生成;三个条件中的任何一个就可以发生,故D错误;
故选B。
2.B
【详解】A.电解质是在水溶液中或熔融状态下能够导电的化合物,故A项错误;
B.分散系根据分散质粒子直径大小来分类:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),所以溶液、胶体和浊液这三种分散系的本质的区别在于分散质粒子直径大小,故B项正确;
C.可表示大部分的易溶强碱与可溶铜盐反应,故C项错误;
D.电离时生成的阳离子全部是氢离子(H )的化合物叫做酸,能电离出H+的不一定为酸,如NaHSO4属于盐,但在水中能电离出H+,故D项错误;
综上所述,正确的是B项。
3.D
【详解】A.MgCO3为微溶物,MgCO3的非澄清溶液在离子方程式中不能拆分,因此不能用2H+ + CO = CO2↑ +H2O表示,故A项不选;
B.醋酸为弱酸,在离子方程式中不能拆分,因此不能用2H+ + CO = CO2↑ +H2O表示,故B项不选;
C.NaHCO3在水中电离出Na+和,与HNO3溶液中H+能发生复分解反应生成CO2和H2O,因此不能用2H+ + CO = CO2↑ +H2O表示,故C项不选;
D.(NH4)2CO3在水中电离出和,与稀硫酸中H+能发生复分解反应生成CO2和H2O,反应离子方程式为2H+ + CO = CO2↑ +H2O,故D项选;
综上所述,答案为D。
4.B
【详解】A.向澄清石灰水中不断通入CO2,发生反应Ca(OH)2+CO2=CaCO3↓+H2O,当二者完全反应时,溶液中离子浓度接近为0,导电性为0,继续通入CO2,CO2与水反应生成弱电解质碳酸,溶液的导电性增强,A正确;
B.向AgNO3溶液中通入少量HCl,发生反应AgNO3+HCl=AgCl↓+HNO3,AgNO3和HNO3均为强电解质,溶液的导电性几乎不变,B错误;
C.向NaOH溶液中通入少量Cl2,发生反应2OH-+Cl2=Cl-+ClO-+H2O,溶液中离子浓度不变,溶液的导电性不变,C正确;
D.向H2SO4溶液中逐滴滴加Ba(OH)2溶液至中性,发生反应H2SO4+Ba(OH)2=BaSO4↓+2H2O,此时溶液中离子浓度接近为0,导电性为0,D正确;
综上所述答案为B。
5.C
【分析】向某可能含有、、、、的溶液中逐滴加入NaOH溶液,开始没有沉淀生成,说明含有氢离子;生成沉淀后部分溶解,说明含有铝离子、镁离子;不确定是否含有铵根离子、硝酸根离子;
【详解】A.由分析可知,a点溶液含有氢离子,和碳酸根离子不共存,A错误;
B.b点氢离子完全反应,生成了沉淀,Fe3+不能共存,B错误;
C.c点氢离子、铝离子、镁离子均恰好反应,溶液呈碱性,硝酸根离子不会和碘离子发生氧化还原反应,可以共存,C正确;
D.d点氢氧化钠过量,和碳酸氢根离子生成水和碳酸根离子,不共存,D错误;
故选C。
6.B
【详解】BaCl2溶液与Na2SO4溶液反应生成硫酸钡沉淀:,则滴加BaCl2溶液后原Na2SO4溶液中离子数目明显减少;
选B。
7.C
【详解】A.盐酸与铁屑反应生成氯化亚铁和氢气:Fe + 2H+=Fe2+ + H2↑,A错误;
B.金属铜投入硝酸银溶液中发生置换反应:Cu +2Ag+=Cu2+ +2Ag,B错误;
C.氢氧化铜固体投入稀硝酸中生成硝酸铜和水:Cu(OH)2 + 2H+=Cu2+ + 2H2O,C正确;
D.大理石难溶,与盐酸反应:CaCO3+ 2H+=Ca2+ +CO2↑+ H2O,D错误;
答案选C。
8.C
【详解】A.氢氧化镁难溶于水,书写离子方程式时不拆写,正确的是Mg(OH)2+2H+=Mg2++2H2O,故A错误;
B.缺少Cu2+与OH-反应,正确的是Cu2++SO+Ba2++2OH-=Cu(OH)2↓+BaSO4↓,故B错误;
C.碳酸氢钠属于盐,与稀硫酸反应生成二氧化碳和水,其离子方程式为HCO+H+=CO2↑+H2O,故C正确;
D.石灰石主要成分是CaCO3,碳酸钙难溶于水,醋酸为弱酸,不应拆写,正确的是CaCO3+2CH3COOH=Ca2++2CH3COO-+ CO2↑+H2O,故D错误;
答案为C。
9.A
【详解】A.Al(OH)3不与过量氨水反应,A正确;
B.醋酸是弱电解质,不能拆,应为,B错误;
C.电荷不守恒,应为,C错误;
D.常温下,铝与浓硝酸会钝化,不能反应生成NO2,加热条件下会发生反应,D错误;
故选A。
10.A
【详解】A.、、、在强碱溶液中不反应,可大量共存,故A选;
B.强碱溶液中不能大量存在Cu2+,故B不选;
C.、、OH-结合生成沉淀,不能共存,故C不选;
D.和会反应生成碳酸钡沉淀,不能大量共存,故D不选;
故选A。
11.D
【详解】A.离子方程式为,A项错误;
B.醋酸是弱电解质不能拆,B项错误;
C.熔融状态下的电离方程式为,C项错误;
D.盛放氢氧化钠溶液的试剂瓶不能用磨口玻璃塞的原因是玻璃成分为二氧化硅和氢氧化钠发生反应,离子方程式书写正确,D项正确;
答案选D。
12.D
【详解】A.NaOH和硫酸混合,有水生成,能够发生离子反应,A不符合题意;
B. Zn和盐酸混合,生成氯化锌和氢气,能够发生离子反应,B不符合题意;
C. NaOH溶液和Fe2(SO4)3溶液混合,有氢氧化铁沉淀生成,能够发生离子反应,C不符合题意;
D. H2SO4溶液和MgCl2溶液混合,既无沉淀、气体生成,也无弱电解质生成,不会发生离子反应,D符合题意;
答案选D
13.C
【详解】A.由离子方程式可知,CuO+2H+=Cu2++H2O可表示为氧化铜与强酸溶液反应生成可溶性铜盐和水,故A正确;
B.由离子方程式可知,CaCO3+2H+=Ca2++CO2↑+H2O可表示为碳酸钙与强酸反应生成可溶性钙盐、二氧化碳和水,故B正确;
C.铁与非氧化性强酸反应生成亚铁离子和氢气,反应的离子方程式为Fe+2H+=Fe2++H2↑,故C错误;
D.由离子方程式可知,BaO+2H+=Ba2++H2O可表示为氧化钡与强酸强酸溶液反应生成可溶性钡盐和水,故D正确;
故选C。
14.C
【详解】A.稀硫酸与难溶的氢氧化镁反应生成硫酸镁和水,不能用离子方程式H+ + OH—=H2O表示,故A错误;
B.稀硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水,不能用离子方程式H+ + OH—=H2O表示,故B错误;
C.稀硝酸与氢氧化钠溶液反应生成硝酸钠和水,能用离子方程式H+ + OH—=H2O表示,故C正确;
D.稀硫酸与难溶的氢氧化铁反应生成硫酸铁和水,不能用离子方程式H+ + OH—=H2O表示,故D错误;
故选C。
15.A
【详解】A.在溶液中滴入溶液至恰好中和:,A正确;
B.溶液腐蚀印刷电路铜板,离子方程式为:,B错误;
C.向溶液中滴入少量澄清石灰水,离子方程式为:,C错误;
D.醋酸腐蚀大理石台面,离子方程式为:2CH3COOH+CaCO3=Ca2++CO2+H2O+2CHCOO-,D错误;
故选A。
16.ABDEFGHJKL
【详解】A.过量铁粉能够和Fe3+反应生成Fe2+,A错误;
B.硫酸铝溶液中和少量氢氧化钾溶液反应生成Al(OH)3沉淀,B错误;
C.亚硫酸的酸性强于碳酸,因此,Na2CO3溶液中通入过量SO2发生离子反应生成亚硫酸氢钠和二氧化碳,该反应的离子方程式为CO+2SO2+2H2O=2HSO+CO2,C正确;
D.明矾在水中可以电离出Al3+,可以与氨水中电离出的OH-发生反应生成Al(OH)3,但由于氨水的碱性较弱,生成的Al(OH)3不能继续与弱碱发生反应,故反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH,D错误;
E.向次氯酸钙溶液中通入少量CO2气体,发生反应生成CaCO3和HClO:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO,E错误;
F.NaOH溶液与过量H2C2O4溶液反应生成NaHC2O4和水,离子方程式为OH-+H2C2O4=HC2O+H2O,F错误;
G.酸性:H2CO3>苯酚>HCO,C6H5ONa溶液中通入少量CO2,生成苯酚钠和NaHCO3,离子方程式为C6H5O-+CO2+H2O=C6H5OH+HCO,G错误。
H.AgOH会溶于过量的浓氨水,生成Ag(NH3)2OH,H错误;
I.Na2SO3溶液吸收少量Cl2的反应可分为两步:先发生氧化还原反应:SO+Cl2+H2O=2H++2Cl-+SO,然后发生:H++SO=HSO,由二者可得3SO+Cl2+H2O=2HSO+2Cl-+SO,I正确;
J.(NH4)2Fe(SO4)2可以写成(NH4)2SO4·FeSO4,(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应,OH-先与Fe2+反应,再和NH反应,由于Ba(OH)2较少,NH不会参与反应,离子方程式为Fe2++SO+Ba2++2OH-=Fe(OH)2↓+BaSO4↓,J错误;
K.因为SO2少量,所以产物中应有未反应完的ClO-,会与H+结合成HClO,K错误;
L.氨水过量,Cu(OH)2沉淀继续和氨水反应形成络合物,离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,L错误;
故选ABDEFGHJKL。
17.BC
【详解】A.将等物质的量浓度的Ba(OH)2与NH4HSO4溶液以体积比1∶2混合,Ba(OH)2电离出的OH-与NH4HSO4电离出的H+反应生成水,Ba(OH)2电离出的Ba2+与NH4HSO4电离出的SO反应生成BaSO4沉淀,反应的离子方程为为Ba2++2OH-+2H++SOBaSO4↓+2H2O,A正确;
B.NH4HSO4溶液中含有NH和H+,二者均可与OH-反应,且反应的先后顺序为H+、NH,所以同浓度同体积NH4HSO4溶液与NaOH溶液混合时反应的离子方程式为H++OH-H2O,B错误;
C.缺少H++OH-H2O,其反应的离子方程式应为Mg2++2H++4OH-Mg(OH)2↓+2H2O,C错误;
D.1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合,设溶液体积为1L,偏铝酸钠和HCl的物质的量分别为1mol、2.5mol,1mol偏铝酸钠消耗1molHCl生成1mol氢氧化铝,剩余的1.5molHCl能够溶解0.5mol氢氧化铝,反应的离子方程式为:2AlO+5H+Al3++Al(OH)3↓+H2O,D正确;
E.等浓度的Ba(OH)2溶液与NaHSO4溶液按体积比2∶3,则两者物质的量之比为2∶3,两者混合后,2molBa2+消耗2molSO42-,3molH+消耗3molOH-,反应的离子反应方程式为:2Ba2++3OH-+3H++2SO42-2BaSO4↓+3H2O,E正确;
故选BC。
18.(1)强电解质
(2)离子浓度大小
(3)SO+Ba2+=BaSO4↓
(4) > 过量的BaCl2溶液中的水使溶液中的H+浓度减小
(5)C
(6)B
(7)A
(8)B
【详解】(1)BaCl2在水溶液完全电离产生自由移动的离子,因此属于强电解质;
(2)在其它条件相同的情况下,溶的导电性由溶液中自由移动的离子浓度大小决定,离子浓度越大,溶液的导电能力就越强;
(3)向H2SO4溶液中滴入BaCl2溶液,二者会发生复分解反应:H2SO4+BaCl2=BaSO4↓+2HCl,反应产生BaSO4白色沉淀,该反应的离子方程式为SO+Ba2+=BaSO4↓,虽然离子带有电荷数目不变,但由于BaCl2溶液的水导致溶液体积变大,溶液中自由移动的离子浓度减小,故溶液的电导率减小;
(4)b点恰好发生反应H2SO4+BaCl2=BaSO4↓+2HCl,b点后BaCl2溶液过量,但HCl的物质的量不变,溶液的体积增大,导致溶液中c(H+)会逐渐减小,故c(H+):b>c;
(5)若使用等浓度的Ba(OH)2溶液替换BaCl2溶液,会发生反应:H2SO4+Ba(OH)2=BaSO4↓+2H2O,该反应的离子方程式为:2H+++Ba2++2OH-=BaSO4↓+2H2O,在二者恰好反应时,溶液中几乎不存在自由移动的离子,电导率几乎为0,故电导率最低点在图中 b点的下方,故合理选项是C;
(6)氨水中的NH3 H2O是弱电解质,只能微弱电离产生自由移动的、OH-,溶液的电导率不大。向其中加入弱酸醋酸溶液时,二者发生反应产生可溶性强电解质CH3COONH4,使溶液中自由移动的离子浓度增大,溶液的电导率增强,当恰好反应时,离子浓度最大,此时电导率达到最大值,后来醋酸溶液过量,过量的醋酸溶液对CH3COONH4起稀释作用,导致溶液中自由移动的离子浓度逐渐减少,溶液的电导率逐渐降低,故加入醋酸溶液时电导率变化曲线是B;
(7)A.选项水溶液显无色,且离子之间不能发生任何反应,可以大量共存,A符合题意;
B.Ag+与OH-会发生反应产生Ag2O、H2O,不能大量共存,B不符合题意;
C.MnO的水溶液显紫色,在无色溶液中不能电离存在;且与I-会发生氧化还原反应,也不能大量共存,C不符合题意;
D.HCO、OH-、Ca2+会发生离子反应产生CaCO3沉淀、H2O,不能大量共存,D不符合题意;
故合理选项是A;
(8)A.NaOH是强碱,能够与Al(OH)3发生反应产生NaAlO2、H2O,A不符合题意;
B.NaCl与Al(OH)3不能发生反应,因此不能溶解Al(OH)3,B符合题意;
C.H2SO4是二元强酸,能够与Al(OH)3发生反应产生Al2(SO4)3、H2O,C不符合题意;
D.HCl是一元强酸,能够与Al(OH)3发生反应产生AlCl3、H2O,D不符合题意;
故合理选项是B。
19.(1)H2SO4=2H++SO
(2)NaHCO3=Na++HCO
(3)Fe2(SO4)3=2Fe3++3SO
(4)OH-+H+=H2O
(5)Ba2++2OH-+Cu2++SO=BaSO4↓+Cu(OH)2↓
(6)CaCO3+2H+=Ca2++H2O+CO2↑
【详解】(1)硫酸是强电解质,完全电离产生硫酸根离子和氢离子,电离方程式为H2SO4=2H++。
(2)碳酸氢钠为强电解质,完全电离产生钠离子和碳酸氢根离子,电离方程式为NaHCO3=Na++。
(3)硫酸铁为强电解质,完全电离产生铁离子和硫酸根离子,电离方程式为Fe2(SO4)3=2Fe3++3。
(4)氢氧化钠与硫酸反应,生成硫酸钠和水,离子方程式为OH-+H+=H2O。
(5)氢氧化钡与硫酸铜反应,生成硫酸钡和氢氧化铜,离子方程式为Ba2++2OH-+Cu2++=BaSO4↓+Cu(OH)2↓。
(6)稀盐酸和碳酸钙反应,生成氯化钙、水和二氧化碳,离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑。
20.(1)③⑤
(2) 、、、 、、 无 溶液中一定有、、,浓度相等时电荷守恒,所以无
【详解】(1)有离子参与的化学反应是离子反应,在发生离子反应的反应物或生成物中,一定存在电解质,电解质一定是化合物,选③⑤。
(2)Ⅰ.取少许原溶液,滴入紫色石蕊溶液,溶液呈蓝色,说明溶液呈碱性,原溶液一定含有;、与不共存,所以一定不含、。
Ⅱ.取少许原溶液,滴入溶液,无白色沉淀产生,原溶液不含、。
Ⅲ.取少许原溶液先滴加稀硝酸,再滴入溶液,产生白色沉淀,说明原溶液含有。
Ⅳ.取少许原溶液,滴入少量溶液,有白色沉淀产生,说明原溶液含有;
①根据以上分析,原溶液中肯定不存在的离子是;肯定存在的离子是、、、。
②原溶液中一定含有、和,若原溶液中各种离子的浓度相等,根据电荷守恒,该溶液中无。
③若原溶液中各离子的浓度相等,取一定量该溶液,加入等体积的稀硫酸(其中硫酸根浓度与原溶液中各离子浓度相等),反应生成硫酸钡沉淀、水和盐酸,发生反应的离子方程式:。
