第四章第二节电解池同步练习 (含解析)2022——2023学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 第四章第二节电解池同步练习 (含解析)2022——2023学年上学期高二化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-24 10:55:48 | ||
图片预览


文档简介
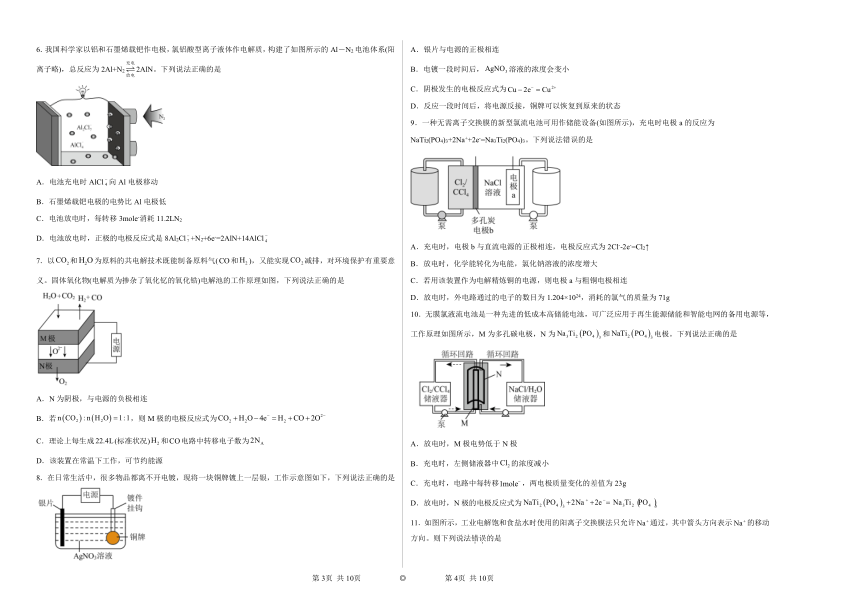
第四章第二节电解池同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.氯碱工业的一种节能新工艺是将电解池与燃料电池相连,相关物料的传输及转化关系如图所示(电极未标出)。下列说法错误的是
A.图中的X是,Y是
B.燃料电池的负极反应式为
C.电解池中产生时,理论上燃料电池中消耗
D.、、的大小关系为
2.下图是一个用石墨作电极,电解稀Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液。下列有关叙述正确的是
A.A极生成的气体无色无味,B极生成的气体有刺激性气味
B.收集B极产生的气体,该气体能使带火星的木条复燃
C.A极附近呈红色,B极附近呈蓝色
D.电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈碱性
3.在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下。下列说法错误的是
A.碳纳米电极为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.精制饱和NaCl溶液从b处进,NaOH溶液从c处出
D.迁移过交换膜的数量等于导线上通过电子的数量
4.厨房垃圾发酵液通过电渗析法处理同时得到乳酸的原理如图所示(图中HA表示乳酸分子,表示乳酸根离子)。下列有关说法中正确的是
A.交换膜I为阴离子交换膜,从浓缩室通过向阳极移动
B.交换膜II为阳离子交换膜,从浓缩室通过向阴极移动
C.阳极的电极反应式为
D.400mL 0.1mol/L乳酸溶液通电一段时间后,浓度上升到0.6mol/L,则阴极上产生的的体积为2.24L
5.是一种极为活泼的卤素气体,在制冷、化学工业中有着广泛应用。可通过电解的无水HF溶液制备,该过程有两种气体生成。下列说法正确的是
A.该反应生成了、
B.电解一段时间后,阴、阳两极生成的气体质量之比为1∶19
C.电解过程中转移1mol电子时,生成的气体体积为22.4L
D.一段时间后,加入一定量的固体,可使电解液恢复到电解前的状态
6.我国科学家以铝和石墨烯载钯作电极,氯铝酸型离子液体作电解质,构建了如图所示的Al-N2电池体系(阳离子略),总反应为2Al+N22AlN。下列说法正确的是
A.电池充电时AlCl向Al电极移动
B.石墨烯载钯电极的电势比Al电极低
C.电池放电时,每转移3mole-消耗11.2LN2
D.电池放电时,正极的电极反应式是8Al2Cl+N2+6e-=2AlN+14AlCl
7.以和为原料的共电解技术既能制备原料气(和),又能实现减排,对环境保护有重要意义。固体氧化物(电解质为掺杂了氧化钇的氧化锆)电解池的工作原理如图,下列说法正确的是
A.N为阴极,与电源的负极相连
B.若,则M极的电极反应式为
C.理论上每生成(标准状况)和电路中转移电子数为
D.该装置在常温下工作,可节约能源
8.在日常生活中,很多物品都离不开电镀,现将一块铜牌镀上一层银,工作示意图如下,下列说法正确的是
A.银片与电源的正极相连
B.电镀一段时间后,溶液的浓度会变小
C.阴极发生的电极反应式为
D.反应一段时间后,将电源反接,铜牌可以恢复到原来的状态
9.一种无需离子交换膜的新型氯流电池可用作储能设备(如图所示),充电时电极a的反应为NaTi2(PO4)3+2Na++2e-=Na3Ti2(PO4)3。下列说法错误的是
A.充电时,电极b与直流电源的正极相连,电极反应式为2Cl--2e-=Cl2↑
B.放电时,化学能转化为电能,氯化钠溶液的浓度增大
C.若用该装置作为电解精炼铜的电源,则电极a与粗铜电极相连
D.放电时,外电路通过的电子的数目为1.204×1024,消耗的氯气的质量为71g
10.无膜氯液流电池是一种先进的低成本高储能电池,可广泛应用于再生能源储能和智能电网的备用电源等,工作原理如图所示,M为多孔碳电极,N为和电极。下列说法正确的是
A.放电时,M极电势低于N极
B.充电时,左侧储液器中的浓度减小
C.充电时,电路中每转移,两电极质量变化的差值为23g
D.放电时,N极的电极反应式为
11.如图所示,工业电解饱和食盐水时使用的阳离子交换膜法只允许通过,其中箭头方向表示的移动方向。则下列说法错误的是
A.电极a为电源负极 B.电极B可使用铁棒
C.2为氢气 D.5为饱和食盐水
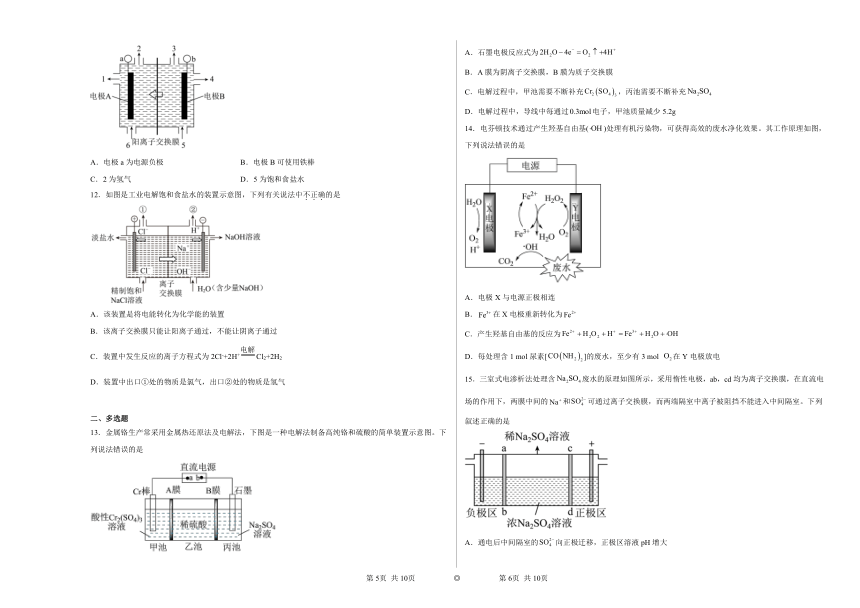
12.如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是
A.该装置是将电能转化为化学能的装置
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为2Cl-+2H+Cl2+2H2
D.装置中出口①处的物质是氯气,出口②处的物质是氢气
二、多选题
13.金属铬生产常采用金属热还原法及电解法,下图是一种电解法制备高纯铬和硫酸的简单装置示意图。下列说法错误的是
A.石墨电极反应式为
B.A膜为阴离子交换膜,B膜为质子交换膜
C.电解过程中,甲池需要不断补充,丙池需要不断补充
D.电解过程中,导线中每通过电子,甲池质量减少5.2g
14.电芬顿技术通过产生羟基自由基()处理有机污染物,可获得高效的废水净化效果。其工作原理如图,下列说法错误的是
A.电极X与电源正极相连
B.在X电极重新转化为
C.产生羟基自由基的反应为
D.每处理含1 mol尿素[]的废水,至少有3 mol 在Y电极放电
15.三室式电渗析法处理含废水的原理如图所示,采用惰性电极,ab,cd均为离子交换膜,在直流电场的作用下,两膜中间的和可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
A.通电后中间隔室的向正极迁移,正极区溶液pH增大
B.该法在处理含废水时可以得到NaOH和产品
C.负极反应为,负极区溶液pH增大
D.当电路中通过1mol电子的电量时,会有0.5mol的生成
三、填空题
16.粗铜提纯
(1)原理图
(2)电极材料:阳极为___________;阴极为___________。
(3)电解质溶液:___________。
(4)电极反应:
阳极:___________、___________;
阴极:___________;
(5)特点:当电路中转移2 mol电子时,阳极质量减少不等于64 g,阴极质量增加64 g,电解液的浓度铜离子减小。
17.电镀
(1)原理图
(2)含义:利用电解原理在某些金属表面再镀上一层其他金属或合金,增强金属的抗腐蚀、表面硬度或美观目的。
(3)电镀池构成:
①电极材料:待镀件作___________极,镀层金属作___________极。
②电解质溶液:___________。
(4)电极反应:阳极:X—ne—=Xn+;阴极:Ym++me-=Y。
(5)特点:当电路中转移1mol电子时,阳极质量减少质量与阴极质量增加质量相等,电镀液的浓度基本不变。
四、工业流程题
18.铅用途广泛,是电气工业部门制造蓄电池、汽油添加剂和电缆的原材料。工业上常用铅精矿(主要成分是PbS以及少量Zn、Fe、SiO2、MgO、Al2O3)通过如图所示工业流程制取铅。
已知:①PbS在稀硫酸中不会溶解
②常温下,相关金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Fe2+ Fe3+ Zn2+ Mg2+ Al3+
开始沉淀pH 6.5 2.2 5.4 9.5 3.5
完全沉淀(c=1.0×10-5mol/L)的pH 9.7 3.2 6.4 11.1 4.7
回答下列问题:
(1)滤渣1的成分是___________。酸浸后的分离操作是___________。
(2)已知溶液3的焰色反应透过蓝色钴玻璃是紫色,反应2的化学方程式为___________。
(3)已知溶液4的溶质是化合物且为绿色氧化剂,写出反应3的化学方程式___________。
(4)硫酸铅是铅蓄电池的放电过程中的主要产物,硫酸铅可以通过电解的方式在___________(选填“正”“负”“阴”“阳”)极得到铅。铅蓄电池在放电过程中,正极的电极反应是___________,电解质溶液的密度___________(填“增大”“减小”或者“不变”)。
(5)由“分步沉淀”的条件可知,常温下,Fe(OH)3的Ksp的数量级为___________;滤液1中的c(Zn2+)=___________mol/L(沉淀剂对溶液体积无影响)。
五、原理综合题
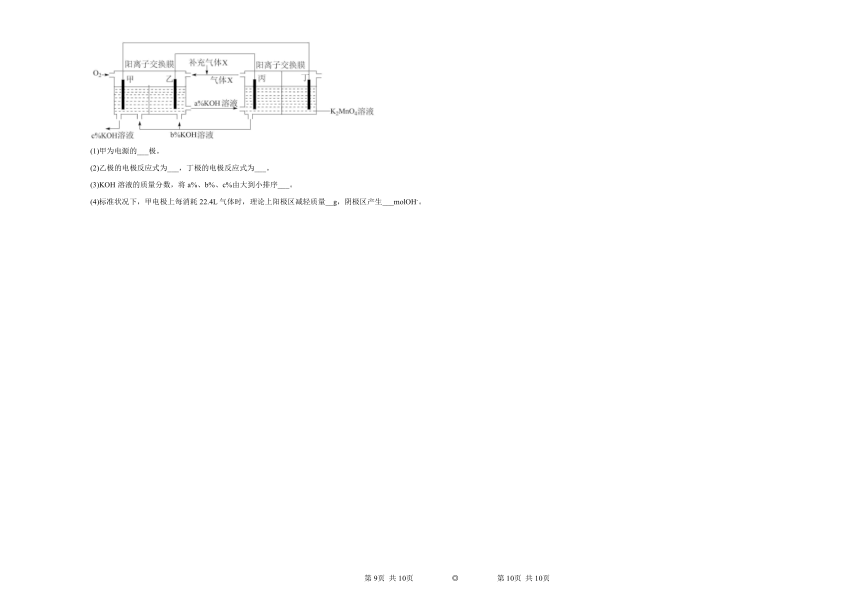
19.一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。回答下列问题:
(1)甲为电源的___极。
(2)乙极的电极反应式为___,丁极的电极反应式为___。
(3)KOH溶液的质量分数,将a%、b%、c%由大到小排序___。
(4)标准状况下,甲电极上每消耗22.4L气体时,理论上阳极区减轻质量__g,阴极区产生___molOH-。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【详解】A.在燃料电池中,在正极放电,所以通入空气的一极是燃料电池的正极,通入燃料的一极是燃料电池的负极,即产生Y的一极是电解池的阴极,所产生的是,在电解池中阳极产生的X是,A正确;
B.燃料电池的负极,失电子发生氧化反应,即,B正确;
C.由整个电路中得失电子守恒可知,电解池中产生,理论上转移,又燃料电池的正极反应式为,则燃料电池中消耗,C正确;
D.燃料电池中,负极消耗,则,正极生成,则,所以,a、b、c的大小关系是,D错误;
故选D。
2.B
【分析】该装置为电解池,与电源正极相连的B极作阳极,电极反应式为;与电源负极相连的A极作阴极,电极反应式为;据此分析解答。
【详解】A.A、B电极反应式分别为、, A电极生成的H2与B电极生成的O2都是无色,无味的,A错误;
B.根据分析,B极作阳极,电极反应式为,阳极上生成O2,O2能使带火星的木条复燃,B正确;
C.由电极反应式知,A电极附近溶液呈碱性,B电极附近溶液呈酸性,则A电极溶液呈蓝色,B电极溶液呈红色,C错误;
D.惰性电极电解稀Na2SO4溶液,实际是电解水,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈中性。
故选B。
3.D
【详解】A.电解饱和食盐时氯离子在阳极放电生成氯气,所以碳纳米电极为阳极,发生氧化反应生成氯气,故A正确;
B.为防止阳极生成的氯气与阴极生成的H2、NaOH发生反应,所以离子交换膜为阳离子交换膜,故B正确;
C.Cl2在阳极,依据装置图分析可知精制饱和食盐水从阳极进入,即b处进,NaOH在阴极生成,NaOH溶液的从c处出,故C正确;
D.由B可知,离子交换膜为阳离子交换膜,不迁移,钠离子迁移,故D错误;
故选:D。
4.C
【分析】根据图示可知,该电解池左端电极与电源正极相连,右端电极与电源负极相连,则左端惰性电极为阳极,右端惰性电极为阴极,阳极上是OH-放电,电极反应式为:2H2O-4e-═4H++O2↑,H+从阳极通过交换膜Ⅰ进入浓缩室,阴极上电极反应式为2H2O+2e-=H2↑+2OH-,A-从右侧通过交换膜II进入浓缩室。
【详解】A.左边电极上电极反应式为2H2O 4e ═4H++O2↑,生成的H+通过交换膜I进入浓缩室,所以交换膜I为阳离子交换膜,A 从阴极通过交换膜II移向浓缩室移动,则交换膜II为阴离子交换膜,故A错误;
B.右边电极反应式为2H2O+2e ═2OH +H2↑,溶液中A 从右侧通过交换膜II进入浓缩室,所以交换膜II为阴离子交换膜,H+从阳极通过阳离子交换膜进入浓缩室,故B错误;
C.阳极上水失电子生成氢离子和氧气,电极反应式为2H2O 4e ═4H++O2↑,故C正确;
D.400mL 0.1mol·L-1乳酸溶液通电一段时间后,浓度上升到 0.6mol·L-1,则生成的乳酸物质的量=0.4L×(0.6 0.1)mol/L=0.2mol,转移n(H+)等于生成n(HA)为0.2mol,同时转移电子物质的量为0.2mol,根据2H2O+2e ═2OH +H2↑知,生成氢气的物质的量为0.1mol,在标况下的体积是2.24L,但题中并未告知产生的H2是否处于标况,故D错误;
答案选C。
5.B
【详解】A.电解的无水HF溶液,反应应生成、,溶液中不含氧元素,无生成,A错误;
B.阴极产生氢气,电极反应式为,阳极产生氟气,电极反应式为,则转移的电子,生成的氢气和氟气的物质的量相等,阴、阳两极生成的气体质量之比等于其摩尔质量之比为1∶19,B正确;
C.未指明气体所处状态,无法计算其体积,C错误;
D.阴极产生氢气,阳极产生氟气,则通入气体,可使电解液恢复到电解前的状态,D错误;
故选B。
6.D
【分析】由电池总反应,可知放电时铝电极为负极,负极反应式为,其逆过程就是充电时的阴极反应;正极为石墨烯载钯电极,其电极反应式为,其逆过程就是充电时的阳极反应。
【详解】A.电池充电时向阳极石墨烯载钯电极移动,A项错误;
B.放电时铝电极为负极,石墨烯载钯电极为正极,正极电势高于负极,因此石墨烯载钯电极的电势比铝电极高,B项错误;
C.未指明所处的状态是否为标准状况,无法计算的体积,C项错误;
D.根据上述分析可知,电池放电时,正极的电极反应式是8Al2Cl+N2+6e-=2AlN+14AlCl,D项正确;
答案选D。
7.C
【分析】该电解池中,O2-离子移向N极、失去电子发生氧化反应生成O2,则N极为阳极,N极与电源正极相连,M极是阴极、与电源负极相连,M极上发生还原反应;
【详解】A. 据分析,M为阴极,与电源的负极相连,A错误;
B. 据分析:M极上发生还原反应,若,则M极的电极反应式为,B错误;
C.存在关系式:,每生成(标准状况) 电路中转移电子数为,,每生成(标准状况)电路中转移电子数为,则理论上每生成(标准状况)和电路中转移电子数为,C正确;
D.常温下固体氧化物(电解质为掺杂了氧化钇的氧化锆)中离子不能自由移动,高温下熔融离子可自由移动,则该装置在不能在常温下工作, D错误;
答案选C。
8.A
【分析】本图为在铜牌表面镀银,银作阳极,与电源正极相连,铜作阴极,与电源负极相连,电镀过程中电镀液浓度不变。
【详解】A.银片与电源的正极相连,A正确;
B.电镀过程中溶液的浓度不变,B错误;
C.铜作阴极,阴极发生的电极反应式为,C错误;
D.Cu活泼性比Ag强,将电源反接,铜牌作阳极,发生的电极反应式为,即Cu会溶于溶液中,铜牌不能恢复到原来的状态,D错误;
故选A。
9.C
【详解】A.由题中信息充电时电极a得电子可知,电极a为阴极,则电极b为阳极,电极b与直流电源的正极相连,电极反应式为2Cl--2e-=Cl2↑,A正确;
B.放电时,化学能转化为电能,电极a 反应Na3Ti2(PO4)3-2e-= NaTi2(PO4)3+2Na+,电极b反应Cl2+2e-=2Cl-,氯化钠溶液的浓度增大,B正确;
C.若用该装置作为电解精炼铜的电源,电极a为负极,电极b为正极,则电极b与粗铜电极相连,C错误;
D.放电时,电极b反应Cl2+2e-=2Cl-,外电路通过的电子的数目为1.204×1024即2mol,消耗氯气1mol,质量为71g,D正确;
故答案选C。
10.C
【分析】该装置为二次电池,由信息可知放电时M极氯气得电子,发生还原反应,M为正极,N为负极,充电时M为阳极,N为阴极。
【详解】A.放电时,M极为正极,N极为负极,M极电势高于N极,A错误;
B.充电时,充电时, M为阳极,电极反应2Cl—-2e-=Cl2↑,左侧储液器中的浓度增大,B错误;
C.充电时, M为阳极,电极反应2Cl—-2e-=Cl2↑,N为阴极,电极反应,电路中每转移时,M电极质量不变,N电极质量增加23g,两电极质量变化的差值为23g,C正确;
D.放电时,N极为负极,发生失电子的氧化反应,电极反应式为,D错误;
故答案选C。
11.B
【分析】电解池中阳离子向阴极移动,由钠离子移动方向可知,A为阴极、B为阳极;
【详解】A.A为阴极,连接电源的负极,则电极a为电源负极,A正确;
B.电极B为阳极,需要选择惰性电极,不可使用铁棒,B错误;
C.A为阴极,水放电生成氢气和氢氧根离子,故2为氢气,C正确;
D.B为阳极,氯离子放电生成氯气,故5为饱和食盐水,D正确;
故选B。
12.C
【分析】装置是电解饱和食盐水,将电能转化为化学能;电解过程是氯化钠和水反应生成氢氧化钠和氢气、氯气;出口①是电解池的阳极,出口②是电解池的阴极;依据装置图可知,阳离子向电解池的阴极移动,故离子交换膜是阳离子交换膜。
【详解】A.装置是电解池,是将电能转化为化学能的装置,选项A正确;
B.依据装置图可知,离子交换膜是阳离子交换膜,只允许阳离子通过,不能让阴离子通过,选项B正确;
C.装置是电解饱和食盐水,电解过程是氯化钠和水反应生成氢氧化钠和氢气、氯气,反应的离子方程式为:2Cl-+2H2OCl2↑+2H2↑+2OH-,选项C不正确;
D.根据钠离子移向阴极确定②是阴极,出口①是电解池的阳极,溶液中的氯离子在阳极失电子生成氯气,出口②是电解池的阴极,溶液中的氢离子得到电子发生还原反应生成氢气,选项D正确;
答案选C。
13.CD
【分析】该装置为电解池,甲池中Cr3+得电子产生Cr,故Cr棒为阴极,a极为负极,b极为正极,石墨电极为阳极,阳极上水失电子产生氧气;阴离子硫酸根离子向阳极移动,故A膜为阴离子交换膜,阳离子氢离子向阴极移动,故B膜为质子交换膜,乙池中硫酸浓度增大;
【详解】A.石墨电极上水失电子产生氧气,酸性条件下电极反应式为,选项A正确;
B.根据分析可知,A膜为阴离子交换膜,B膜为质子交换膜,选项B正确;
C.电解过程中,甲池Cr3+得电子产生Cr,硫酸根离子移向乙池,需要不断补充,丙池水失电子产生氧气且氢离子定向移动到乙池,不需要补充,选项C错误;
D.电解过程中,导线中每通过电子,甲池减少0.5mol,质量减少14.6g,选项D错误;
答案选CD。
14.BD
【详解】A.电极X是水失去电子变为氧气和氢离子,则X为阳极,因此与电源正极相连,故A正确;
B.Y电极又氧气生产过氧化氢,过氧化氢和亚铁离子反应生成铁离子,因此在Y电极重新转化为,故B错误;
C.根据Y负极,亚铁离子和过氧化氢在酸性条件下反应生成铁离子,水和羟基自由基,则产生羟基自由基的反应为,故C正确;
D.根据,每处理含1 mol尿素[]的废水,需要6mol羟基自由基,,则至少有6 mol 在Y电极放电,故D错误;
答案为BD。
15.BC
【详解】A.两膜中间的和可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室,根据电解池“异性相吸”,则通电后中间隔室的向正极迁移,正极区中水电离出的氢氧根失去电子,氢离子和硫酸根结合形成硫酸,因此溶液pH减小,故A错误;
B.结合A选项,该法在处理含废水时,正极区得到硫酸,负极区得到氢氧化钠,故B正确;
C.负极区是水中氢离子得到电子变为氢气,其反应式为,负极区溶液pH增大,故C正确;
D.根据正极区电极反应式,当电路中通过1mol电子的电量时,会有0.25mol的生成,故D错误。
综上所述,答案为BC。
16. 粗铜 精铜 CuSO4(或CuCl2) Cu-2e-=Cu2+ Fe-2e-=Fe2+ Cu2++2e-=Cu
【详解】在粗铜提纯时,阳极材料是粗铜,阴极材料是精铜;电解质溶液是含有Cu2+的盐溶液,可以是CuSO4、CuCl2;在阳极上粗铜的主要成分Cu及活动性比Cu强的金属如Fe会失去电子发生氧化反应变为金属阳离子进入溶液,电极反应式为:Cu-2e-=Cu2+;Fe-2e-=Fe2+;而活动性比铜弱的金属,如Au、Ag则沉淀在阳极底部形成阳极泥;在阴极上只有Cu2+得到电子变为Cu单质,电极反应式为Cu2++2e-=Cu。由于在同一闭合回路中电子转移数目相等,所以当电路中转移2 mol电子时,由于Cu是+2价金属,在阴极上会析出1 mol Cu,其质量是64 g,但阳极上失去电子的物质为Cu及Fe、Zn等金属,同时有Au、Ag等沉淀在阳极底部,故阳极质量减少不等于64 g。
17. 阴 阳 含镀层金属阳离子的盐溶液
【详解】电镀时,待镀件作电解池的阴极,镀层金属作阳极,电解质溶液为含镀层金属阳离子的盐溶液,故答案为:阴;阳;含镀层金属阳离子的盐溶液。
18.(1) PbS、SiO2 过滤
(2)2KOH+SiO2=K2SiO3+H2O
(3)PbS+4H2O2=PbSO4+4H2O
(4) 阴 PbO2+2e-+SO+4H+=PbSO4+2H2O 减小
(5) 10-38 10-3
【分析】铅精矿(主要成分是PbS以及少量Zn、Fe、SiO2、MgO、Al2O3)首先加入稀硫酸酸浸,PbS、SiO2不反应,即为滤渣1,Zn、Fe、MgO、Al2O3转化为相应的金属阳离子进入滤液1,调节滤液1的pH值,分步沉淀各种金属离子;滤渣1先加入强碱溶液溶解SiO2,过滤后滤渣2中主要有PbS,加入溶液4将PbS氧化为硫酸铅,然后在稀硫酸溶液中电解得到铅单质。
(1)
根据信息1可知PbS不溶于稀硫酸,结合所学知识可知SiO2也不溶于稀硫酸,故滤渣1成分为PbS和SiO2;酸浸后分离得到滤渣1和滤液,故操作应为过滤;
(2)
由流程图知,溶液3的作用是分离Pbs和SiO2,滤渣2为PbS,则滤液2是SiO2溶于溶液3所得,溶液3应该是一种碱,再根据其焰色反应为紫色,推测出溶液3为KOH溶液,故方程式为2KOH+SiO2=K2SiO3+H2O;
(3)
溶液4的溶质是化合物且为绿色氧化剂,应为H2O2溶液,作用是将PbS氧化为PbSO4,根据电子守恒、元素守恒可得化学方程式为PbS+4H2O2=PbSO4+4H2O;
(4)
PbSO4转化为Pb单质,硫酸铅发生还原反应,所以这一过程发生在电解池的阴极;铅蓄电池在放电过程中,正极的氧化铅得电子被还原,电极反应为PbO2+2e-+SO+4H+=PbSO4+2H2O;电解过程中硫酸的浓度减小,所以溶液密度减小;
(5)
根据完全沉淀时的pH,Fe(OH)3的Ksp=1×10-5×[10-(14-3.2)]3=10-37.4,所以数量级为10-38;由Zn2+在pH=6.4时完全沉淀可知Zn(OH)2的Ksp=1×10-5×[10-(14-6.4)]2,开始沉淀时pH=5.4,所以滤液1中c(Zn2+)=mol/L=10-3mol/L。
19.(1)正
(2) H2-2e-+2OH-=2H2O -e-=
(3)c%>b%>a%
(4) 156 4
【分析】分析装置的特点,可知左边是燃料电池,右边是电解池;通入氧气的电极甲是电池的正极,电极反应为:O2+4e-+2H2O=4OH-,与甲相连的电极丁是电解池的阳极,则丁电极上被氧化为;丙电极是电解池的阴极,溶液中氢离子在阴极被还原为氢气,电极反应为:2H2O+2e-=2OH-+H2↑,所以气体X是氢气,电极乙的电极反应为:H2-2e-+2OH-=2H2O,据此分析解题。
(1)
由分析可知,通入氧气的电极甲是电池的正极,故答案为:正;
(2)
由分析可知,乙极为电源的负极,X物质为H2,故电极反应式为H2-2e-+2OH-=2H2O,丁极与电源的正极相连,是阳极,该电极的电极反应式为-e-=,故答案为:H2-2e-+2OH-=2H2O;-e-=;
(3)
丙电极为阴极,电极反应为2H2O+2e-=2OH-+H2↑,甲电极的反应式为O2+2H2O+4e-=4OH-,乙电极的反应式为H2+2OH--2e-=2H2O,则甲电极附近始终生成KOH并且不消耗,所以c%>b%,丙电极附近也始终生成KOH,所以b%>a%,故大小关系为c%>b%>a%,故答案为:c%>b%>a%;
(4)
标准状况下,甲电极每消耗22.4L即=1mol氧气时,转移4mol电子,所以理论上有4molK+进入阴极区,则阳极区质量较少了4mol×39g/mol=156g,根据电极反应2H2O+2e-=2OH-+H2↑和电子守恒可知,阴极区产生4molOH-,故答案为:156;4。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.氯碱工业的一种节能新工艺是将电解池与燃料电池相连,相关物料的传输及转化关系如图所示(电极未标出)。下列说法错误的是
A.图中的X是,Y是
B.燃料电池的负极反应式为
C.电解池中产生时,理论上燃料电池中消耗
D.、、的大小关系为
2.下图是一个用石墨作电极,电解稀Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液。下列有关叙述正确的是
A.A极生成的气体无色无味,B极生成的气体有刺激性气味
B.收集B极产生的气体,该气体能使带火星的木条复燃
C.A极附近呈红色,B极附近呈蓝色
D.电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈碱性
3.在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下。下列说法错误的是
A.碳纳米电极为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.精制饱和NaCl溶液从b处进,NaOH溶液从c处出
D.迁移过交换膜的数量等于导线上通过电子的数量
4.厨房垃圾发酵液通过电渗析法处理同时得到乳酸的原理如图所示(图中HA表示乳酸分子,表示乳酸根离子)。下列有关说法中正确的是
A.交换膜I为阴离子交换膜,从浓缩室通过向阳极移动
B.交换膜II为阳离子交换膜,从浓缩室通过向阴极移动
C.阳极的电极反应式为
D.400mL 0.1mol/L乳酸溶液通电一段时间后,浓度上升到0.6mol/L,则阴极上产生的的体积为2.24L
5.是一种极为活泼的卤素气体,在制冷、化学工业中有着广泛应用。可通过电解的无水HF溶液制备,该过程有两种气体生成。下列说法正确的是
A.该反应生成了、
B.电解一段时间后,阴、阳两极生成的气体质量之比为1∶19
C.电解过程中转移1mol电子时,生成的气体体积为22.4L
D.一段时间后,加入一定量的固体,可使电解液恢复到电解前的状态
6.我国科学家以铝和石墨烯载钯作电极,氯铝酸型离子液体作电解质,构建了如图所示的Al-N2电池体系(阳离子略),总反应为2Al+N22AlN。下列说法正确的是
A.电池充电时AlCl向Al电极移动
B.石墨烯载钯电极的电势比Al电极低
C.电池放电时,每转移3mole-消耗11.2LN2
D.电池放电时,正极的电极反应式是8Al2Cl+N2+6e-=2AlN+14AlCl
7.以和为原料的共电解技术既能制备原料气(和),又能实现减排,对环境保护有重要意义。固体氧化物(电解质为掺杂了氧化钇的氧化锆)电解池的工作原理如图,下列说法正确的是
A.N为阴极,与电源的负极相连
B.若,则M极的电极反应式为
C.理论上每生成(标准状况)和电路中转移电子数为
D.该装置在常温下工作,可节约能源
8.在日常生活中,很多物品都离不开电镀,现将一块铜牌镀上一层银,工作示意图如下,下列说法正确的是
A.银片与电源的正极相连
B.电镀一段时间后,溶液的浓度会变小
C.阴极发生的电极反应式为
D.反应一段时间后,将电源反接,铜牌可以恢复到原来的状态
9.一种无需离子交换膜的新型氯流电池可用作储能设备(如图所示),充电时电极a的反应为NaTi2(PO4)3+2Na++2e-=Na3Ti2(PO4)3。下列说法错误的是
A.充电时,电极b与直流电源的正极相连,电极反应式为2Cl--2e-=Cl2↑
B.放电时,化学能转化为电能,氯化钠溶液的浓度增大
C.若用该装置作为电解精炼铜的电源,则电极a与粗铜电极相连
D.放电时,外电路通过的电子的数目为1.204×1024,消耗的氯气的质量为71g
10.无膜氯液流电池是一种先进的低成本高储能电池,可广泛应用于再生能源储能和智能电网的备用电源等,工作原理如图所示,M为多孔碳电极,N为和电极。下列说法正确的是
A.放电时,M极电势低于N极
B.充电时,左侧储液器中的浓度减小
C.充电时,电路中每转移,两电极质量变化的差值为23g
D.放电时,N极的电极反应式为
11.如图所示,工业电解饱和食盐水时使用的阳离子交换膜法只允许通过,其中箭头方向表示的移动方向。则下列说法错误的是
A.电极a为电源负极 B.电极B可使用铁棒
C.2为氢气 D.5为饱和食盐水
12.如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是
A.该装置是将电能转化为化学能的装置
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为2Cl-+2H+Cl2+2H2
D.装置中出口①处的物质是氯气,出口②处的物质是氢气
二、多选题
13.金属铬生产常采用金属热还原法及电解法,下图是一种电解法制备高纯铬和硫酸的简单装置示意图。下列说法错误的是
A.石墨电极反应式为
B.A膜为阴离子交换膜,B膜为质子交换膜
C.电解过程中,甲池需要不断补充,丙池需要不断补充
D.电解过程中,导线中每通过电子,甲池质量减少5.2g
14.电芬顿技术通过产生羟基自由基()处理有机污染物,可获得高效的废水净化效果。其工作原理如图,下列说法错误的是
A.电极X与电源正极相连
B.在X电极重新转化为
C.产生羟基自由基的反应为
D.每处理含1 mol尿素[]的废水,至少有3 mol 在Y电极放电
15.三室式电渗析法处理含废水的原理如图所示,采用惰性电极,ab,cd均为离子交换膜,在直流电场的作用下,两膜中间的和可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
A.通电后中间隔室的向正极迁移,正极区溶液pH增大
B.该法在处理含废水时可以得到NaOH和产品
C.负极反应为,负极区溶液pH增大
D.当电路中通过1mol电子的电量时,会有0.5mol的生成
三、填空题
16.粗铜提纯
(1)原理图
(2)电极材料:阳极为___________;阴极为___________。
(3)电解质溶液:___________。
(4)电极反应:
阳极:___________、___________;
阴极:___________;
(5)特点:当电路中转移2 mol电子时,阳极质量减少不等于64 g,阴极质量增加64 g,电解液的浓度铜离子减小。
17.电镀
(1)原理图
(2)含义:利用电解原理在某些金属表面再镀上一层其他金属或合金,增强金属的抗腐蚀、表面硬度或美观目的。
(3)电镀池构成:
①电极材料:待镀件作___________极,镀层金属作___________极。
②电解质溶液:___________。
(4)电极反应:阳极:X—ne—=Xn+;阴极:Ym++me-=Y。
(5)特点:当电路中转移1mol电子时,阳极质量减少质量与阴极质量增加质量相等,电镀液的浓度基本不变。
四、工业流程题
18.铅用途广泛,是电气工业部门制造蓄电池、汽油添加剂和电缆的原材料。工业上常用铅精矿(主要成分是PbS以及少量Zn、Fe、SiO2、MgO、Al2O3)通过如图所示工业流程制取铅。
已知:①PbS在稀硫酸中不会溶解
②常温下,相关金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Fe2+ Fe3+ Zn2+ Mg2+ Al3+
开始沉淀pH 6.5 2.2 5.4 9.5 3.5
完全沉淀(c=1.0×10-5mol/L)的pH 9.7 3.2 6.4 11.1 4.7
回答下列问题:
(1)滤渣1的成分是___________。酸浸后的分离操作是___________。
(2)已知溶液3的焰色反应透过蓝色钴玻璃是紫色,反应2的化学方程式为___________。
(3)已知溶液4的溶质是化合物且为绿色氧化剂,写出反应3的化学方程式___________。
(4)硫酸铅是铅蓄电池的放电过程中的主要产物,硫酸铅可以通过电解的方式在___________(选填“正”“负”“阴”“阳”)极得到铅。铅蓄电池在放电过程中,正极的电极反应是___________,电解质溶液的密度___________(填“增大”“减小”或者“不变”)。
(5)由“分步沉淀”的条件可知,常温下,Fe(OH)3的Ksp的数量级为___________;滤液1中的c(Zn2+)=___________mol/L(沉淀剂对溶液体积无影响)。
五、原理综合题
19.一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。回答下列问题:
(1)甲为电源的___极。
(2)乙极的电极反应式为___,丁极的电极反应式为___。
(3)KOH溶液的质量分数,将a%、b%、c%由大到小排序___。
(4)标准状况下,甲电极上每消耗22.4L气体时,理论上阳极区减轻质量__g,阴极区产生___molOH-。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【详解】A.在燃料电池中,在正极放电,所以通入空气的一极是燃料电池的正极,通入燃料的一极是燃料电池的负极,即产生Y的一极是电解池的阴极,所产生的是,在电解池中阳极产生的X是,A正确;
B.燃料电池的负极,失电子发生氧化反应,即,B正确;
C.由整个电路中得失电子守恒可知,电解池中产生,理论上转移,又燃料电池的正极反应式为,则燃料电池中消耗,C正确;
D.燃料电池中,负极消耗,则,正极生成,则,所以,a、b、c的大小关系是,D错误;
故选D。
2.B
【分析】该装置为电解池,与电源正极相连的B极作阳极,电极反应式为;与电源负极相连的A极作阴极,电极反应式为;据此分析解答。
【详解】A.A、B电极反应式分别为、, A电极生成的H2与B电极生成的O2都是无色,无味的,A错误;
B.根据分析,B极作阳极,电极反应式为,阳极上生成O2,O2能使带火星的木条复燃,B正确;
C.由电极反应式知,A电极附近溶液呈碱性,B电极附近溶液呈酸性,则A电极溶液呈蓝色,B电极溶液呈红色,C错误;
D.惰性电极电解稀Na2SO4溶液,实际是电解水,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈中性。
故选B。
3.D
【详解】A.电解饱和食盐时氯离子在阳极放电生成氯气,所以碳纳米电极为阳极,发生氧化反应生成氯气,故A正确;
B.为防止阳极生成的氯气与阴极生成的H2、NaOH发生反应,所以离子交换膜为阳离子交换膜,故B正确;
C.Cl2在阳极,依据装置图分析可知精制饱和食盐水从阳极进入,即b处进,NaOH在阴极生成,NaOH溶液的从c处出,故C正确;
D.由B可知,离子交换膜为阳离子交换膜,不迁移,钠离子迁移,故D错误;
故选:D。
4.C
【分析】根据图示可知,该电解池左端电极与电源正极相连,右端电极与电源负极相连,则左端惰性电极为阳极,右端惰性电极为阴极,阳极上是OH-放电,电极反应式为:2H2O-4e-═4H++O2↑,H+从阳极通过交换膜Ⅰ进入浓缩室,阴极上电极反应式为2H2O+2e-=H2↑+2OH-,A-从右侧通过交换膜II进入浓缩室。
【详解】A.左边电极上电极反应式为2H2O 4e ═4H++O2↑,生成的H+通过交换膜I进入浓缩室,所以交换膜I为阳离子交换膜,A 从阴极通过交换膜II移向浓缩室移动,则交换膜II为阴离子交换膜,故A错误;
B.右边电极反应式为2H2O+2e ═2OH +H2↑,溶液中A 从右侧通过交换膜II进入浓缩室,所以交换膜II为阴离子交换膜,H+从阳极通过阳离子交换膜进入浓缩室,故B错误;
C.阳极上水失电子生成氢离子和氧气,电极反应式为2H2O 4e ═4H++O2↑,故C正确;
D.400mL 0.1mol·L-1乳酸溶液通电一段时间后,浓度上升到 0.6mol·L-1,则生成的乳酸物质的量=0.4L×(0.6 0.1)mol/L=0.2mol,转移n(H+)等于生成n(HA)为0.2mol,同时转移电子物质的量为0.2mol,根据2H2O+2e ═2OH +H2↑知,生成氢气的物质的量为0.1mol,在标况下的体积是2.24L,但题中并未告知产生的H2是否处于标况,故D错误;
答案选C。
5.B
【详解】A.电解的无水HF溶液,反应应生成、,溶液中不含氧元素,无生成,A错误;
B.阴极产生氢气,电极反应式为,阳极产生氟气,电极反应式为,则转移的电子,生成的氢气和氟气的物质的量相等,阴、阳两极生成的气体质量之比等于其摩尔质量之比为1∶19,B正确;
C.未指明气体所处状态,无法计算其体积,C错误;
D.阴极产生氢气,阳极产生氟气,则通入气体,可使电解液恢复到电解前的状态,D错误;
故选B。
6.D
【分析】由电池总反应,可知放电时铝电极为负极,负极反应式为,其逆过程就是充电时的阴极反应;正极为石墨烯载钯电极,其电极反应式为,其逆过程就是充电时的阳极反应。
【详解】A.电池充电时向阳极石墨烯载钯电极移动,A项错误;
B.放电时铝电极为负极,石墨烯载钯电极为正极,正极电势高于负极,因此石墨烯载钯电极的电势比铝电极高,B项错误;
C.未指明所处的状态是否为标准状况,无法计算的体积,C项错误;
D.根据上述分析可知,电池放电时,正极的电极反应式是8Al2Cl+N2+6e-=2AlN+14AlCl,D项正确;
答案选D。
7.C
【分析】该电解池中,O2-离子移向N极、失去电子发生氧化反应生成O2,则N极为阳极,N极与电源正极相连,M极是阴极、与电源负极相连,M极上发生还原反应;
【详解】A. 据分析,M为阴极,与电源的负极相连,A错误;
B. 据分析:M极上发生还原反应,若,则M极的电极反应式为,B错误;
C.存在关系式:,每生成(标准状况) 电路中转移电子数为,,每生成(标准状况)电路中转移电子数为,则理论上每生成(标准状况)和电路中转移电子数为,C正确;
D.常温下固体氧化物(电解质为掺杂了氧化钇的氧化锆)中离子不能自由移动,高温下熔融离子可自由移动,则该装置在不能在常温下工作, D错误;
答案选C。
8.A
【分析】本图为在铜牌表面镀银,银作阳极,与电源正极相连,铜作阴极,与电源负极相连,电镀过程中电镀液浓度不变。
【详解】A.银片与电源的正极相连,A正确;
B.电镀过程中溶液的浓度不变,B错误;
C.铜作阴极,阴极发生的电极反应式为,C错误;
D.Cu活泼性比Ag强,将电源反接,铜牌作阳极,发生的电极反应式为,即Cu会溶于溶液中,铜牌不能恢复到原来的状态,D错误;
故选A。
9.C
【详解】A.由题中信息充电时电极a得电子可知,电极a为阴极,则电极b为阳极,电极b与直流电源的正极相连,电极反应式为2Cl--2e-=Cl2↑,A正确;
B.放电时,化学能转化为电能,电极a 反应Na3Ti2(PO4)3-2e-= NaTi2(PO4)3+2Na+,电极b反应Cl2+2e-=2Cl-,氯化钠溶液的浓度增大,B正确;
C.若用该装置作为电解精炼铜的电源,电极a为负极,电极b为正极,则电极b与粗铜电极相连,C错误;
D.放电时,电极b反应Cl2+2e-=2Cl-,外电路通过的电子的数目为1.204×1024即2mol,消耗氯气1mol,质量为71g,D正确;
故答案选C。
10.C
【分析】该装置为二次电池,由信息可知放电时M极氯气得电子,发生还原反应,M为正极,N为负极,充电时M为阳极,N为阴极。
【详解】A.放电时,M极为正极,N极为负极,M极电势高于N极,A错误;
B.充电时,充电时, M为阳极,电极反应2Cl—-2e-=Cl2↑,左侧储液器中的浓度增大,B错误;
C.充电时, M为阳极,电极反应2Cl—-2e-=Cl2↑,N为阴极,电极反应,电路中每转移时,M电极质量不变,N电极质量增加23g,两电极质量变化的差值为23g,C正确;
D.放电时,N极为负极,发生失电子的氧化反应,电极反应式为,D错误;
故答案选C。
11.B
【分析】电解池中阳离子向阴极移动,由钠离子移动方向可知,A为阴极、B为阳极;
【详解】A.A为阴极,连接电源的负极,则电极a为电源负极,A正确;
B.电极B为阳极,需要选择惰性电极,不可使用铁棒,B错误;
C.A为阴极,水放电生成氢气和氢氧根离子,故2为氢气,C正确;
D.B为阳极,氯离子放电生成氯气,故5为饱和食盐水,D正确;
故选B。
12.C
【分析】装置是电解饱和食盐水,将电能转化为化学能;电解过程是氯化钠和水反应生成氢氧化钠和氢气、氯气;出口①是电解池的阳极,出口②是电解池的阴极;依据装置图可知,阳离子向电解池的阴极移动,故离子交换膜是阳离子交换膜。
【详解】A.装置是电解池,是将电能转化为化学能的装置,选项A正确;
B.依据装置图可知,离子交换膜是阳离子交换膜,只允许阳离子通过,不能让阴离子通过,选项B正确;
C.装置是电解饱和食盐水,电解过程是氯化钠和水反应生成氢氧化钠和氢气、氯气,反应的离子方程式为:2Cl-+2H2OCl2↑+2H2↑+2OH-,选项C不正确;
D.根据钠离子移向阴极确定②是阴极,出口①是电解池的阳极,溶液中的氯离子在阳极失电子生成氯气,出口②是电解池的阴极,溶液中的氢离子得到电子发生还原反应生成氢气,选项D正确;
答案选C。
13.CD
【分析】该装置为电解池,甲池中Cr3+得电子产生Cr,故Cr棒为阴极,a极为负极,b极为正极,石墨电极为阳极,阳极上水失电子产生氧气;阴离子硫酸根离子向阳极移动,故A膜为阴离子交换膜,阳离子氢离子向阴极移动,故B膜为质子交换膜,乙池中硫酸浓度增大;
【详解】A.石墨电极上水失电子产生氧气,酸性条件下电极反应式为,选项A正确;
B.根据分析可知,A膜为阴离子交换膜,B膜为质子交换膜,选项B正确;
C.电解过程中,甲池Cr3+得电子产生Cr,硫酸根离子移向乙池,需要不断补充,丙池水失电子产生氧气且氢离子定向移动到乙池,不需要补充,选项C错误;
D.电解过程中,导线中每通过电子,甲池减少0.5mol,质量减少14.6g,选项D错误;
答案选CD。
14.BD
【详解】A.电极X是水失去电子变为氧气和氢离子,则X为阳极,因此与电源正极相连,故A正确;
B.Y电极又氧气生产过氧化氢,过氧化氢和亚铁离子反应生成铁离子,因此在Y电极重新转化为,故B错误;
C.根据Y负极,亚铁离子和过氧化氢在酸性条件下反应生成铁离子,水和羟基自由基,则产生羟基自由基的反应为,故C正确;
D.根据,每处理含1 mol尿素[]的废水,需要6mol羟基自由基,,则至少有6 mol 在Y电极放电,故D错误;
答案为BD。
15.BC
【详解】A.两膜中间的和可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室,根据电解池“异性相吸”,则通电后中间隔室的向正极迁移,正极区中水电离出的氢氧根失去电子,氢离子和硫酸根结合形成硫酸,因此溶液pH减小,故A错误;
B.结合A选项,该法在处理含废水时,正极区得到硫酸,负极区得到氢氧化钠,故B正确;
C.负极区是水中氢离子得到电子变为氢气,其反应式为,负极区溶液pH增大,故C正确;
D.根据正极区电极反应式,当电路中通过1mol电子的电量时,会有0.25mol的生成,故D错误。
综上所述,答案为BC。
16. 粗铜 精铜 CuSO4(或CuCl2) Cu-2e-=Cu2+ Fe-2e-=Fe2+ Cu2++2e-=Cu
【详解】在粗铜提纯时,阳极材料是粗铜,阴极材料是精铜;电解质溶液是含有Cu2+的盐溶液,可以是CuSO4、CuCl2;在阳极上粗铜的主要成分Cu及活动性比Cu强的金属如Fe会失去电子发生氧化反应变为金属阳离子进入溶液,电极反应式为:Cu-2e-=Cu2+;Fe-2e-=Fe2+;而活动性比铜弱的金属,如Au、Ag则沉淀在阳极底部形成阳极泥;在阴极上只有Cu2+得到电子变为Cu单质,电极反应式为Cu2++2e-=Cu。由于在同一闭合回路中电子转移数目相等,所以当电路中转移2 mol电子时,由于Cu是+2价金属,在阴极上会析出1 mol Cu,其质量是64 g,但阳极上失去电子的物质为Cu及Fe、Zn等金属,同时有Au、Ag等沉淀在阳极底部,故阳极质量减少不等于64 g。
17. 阴 阳 含镀层金属阳离子的盐溶液
【详解】电镀时,待镀件作电解池的阴极,镀层金属作阳极,电解质溶液为含镀层金属阳离子的盐溶液,故答案为:阴;阳;含镀层金属阳离子的盐溶液。
18.(1) PbS、SiO2 过滤
(2)2KOH+SiO2=K2SiO3+H2O
(3)PbS+4H2O2=PbSO4+4H2O
(4) 阴 PbO2+2e-+SO+4H+=PbSO4+2H2O 减小
(5) 10-38 10-3
【分析】铅精矿(主要成分是PbS以及少量Zn、Fe、SiO2、MgO、Al2O3)首先加入稀硫酸酸浸,PbS、SiO2不反应,即为滤渣1,Zn、Fe、MgO、Al2O3转化为相应的金属阳离子进入滤液1,调节滤液1的pH值,分步沉淀各种金属离子;滤渣1先加入强碱溶液溶解SiO2,过滤后滤渣2中主要有PbS,加入溶液4将PbS氧化为硫酸铅,然后在稀硫酸溶液中电解得到铅单质。
(1)
根据信息1可知PbS不溶于稀硫酸,结合所学知识可知SiO2也不溶于稀硫酸,故滤渣1成分为PbS和SiO2;酸浸后分离得到滤渣1和滤液,故操作应为过滤;
(2)
由流程图知,溶液3的作用是分离Pbs和SiO2,滤渣2为PbS,则滤液2是SiO2溶于溶液3所得,溶液3应该是一种碱,再根据其焰色反应为紫色,推测出溶液3为KOH溶液,故方程式为2KOH+SiO2=K2SiO3+H2O;
(3)
溶液4的溶质是化合物且为绿色氧化剂,应为H2O2溶液,作用是将PbS氧化为PbSO4,根据电子守恒、元素守恒可得化学方程式为PbS+4H2O2=PbSO4+4H2O;
(4)
PbSO4转化为Pb单质,硫酸铅发生还原反应,所以这一过程发生在电解池的阴极;铅蓄电池在放电过程中,正极的氧化铅得电子被还原,电极反应为PbO2+2e-+SO+4H+=PbSO4+2H2O;电解过程中硫酸的浓度减小,所以溶液密度减小;
(5)
根据完全沉淀时的pH,Fe(OH)3的Ksp=1×10-5×[10-(14-3.2)]3=10-37.4,所以数量级为10-38;由Zn2+在pH=6.4时完全沉淀可知Zn(OH)2的Ksp=1×10-5×[10-(14-6.4)]2,开始沉淀时pH=5.4,所以滤液1中c(Zn2+)=mol/L=10-3mol/L。
19.(1)正
(2) H2-2e-+2OH-=2H2O -e-=
(3)c%>b%>a%
(4) 156 4
【分析】分析装置的特点,可知左边是燃料电池,右边是电解池;通入氧气的电极甲是电池的正极,电极反应为:O2+4e-+2H2O=4OH-,与甲相连的电极丁是电解池的阳极,则丁电极上被氧化为;丙电极是电解池的阴极,溶液中氢离子在阴极被还原为氢气,电极反应为:2H2O+2e-=2OH-+H2↑,所以气体X是氢气,电极乙的电极反应为:H2-2e-+2OH-=2H2O,据此分析解题。
(1)
由分析可知,通入氧气的电极甲是电池的正极,故答案为:正;
(2)
由分析可知,乙极为电源的负极,X物质为H2,故电极反应式为H2-2e-+2OH-=2H2O,丁极与电源的正极相连,是阳极,该电极的电极反应式为-e-=,故答案为:H2-2e-+2OH-=2H2O;-e-=;
(3)
丙电极为阴极,电极反应为2H2O+2e-=2OH-+H2↑,甲电极的反应式为O2+2H2O+4e-=4OH-,乙电极的反应式为H2+2OH--2e-=2H2O,则甲电极附近始终生成KOH并且不消耗,所以c%>b%,丙电极附近也始终生成KOH,所以b%>a%,故大小关系为c%>b%>a%,故答案为:c%>b%>a%;
(4)
标准状况下,甲电极每消耗22.4L即=1mol氧气时,转移4mol电子,所以理论上有4molK+进入阴极区,则阳极区质量较少了4mol×39g/mol=156g,根据电极反应2H2O+2e-=2OH-+H2↑和电子守恒可知,阴极区产生4molOH-,故答案为:156;4。
答案第1页,共2页
答案第1页,共2页
