专题1 化学反应与能量变化 单元检测题(含答案) 2022-2023学年高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 专题1 化学反应与能量变化 单元检测题(含答案) 2022-2023学年高二上学期化学苏教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 569.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-24 11:14:38 | ||
图片预览

文档简介
专题1《化学反应与能量变化》单元检测题
一、单选题(共13题)
1.实验室中利用固体KMnO4进行如图实验,下列说法正确的是
A.本实验中若用稀盐酸代替浓盐酸会减慢反应速率,但不影响单质H的生成量
B.气体H的量小于0.25mol
C.根据盖斯定律,直接用KMnO4和浓盐酸反应的热效应与本实验中的总热效应相等
D.气体H是一种常见的氧化性气体,一般在反应中只表现氧化性
2.氢气是一种清洁能源,“热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。已知:电解在质子交换膜电解池中进行,阳极区为酸性溶液,阴极区为盐酸,电解过程中转化为。下列有关说法错误的是
A.在溶解过程中,发生反应的离子方程式为
B.阳极发生的主要电极反应为
C.在热水解和热分解过程中,发生化合价变化的元素只有O
D.热分解过程中的反应物为
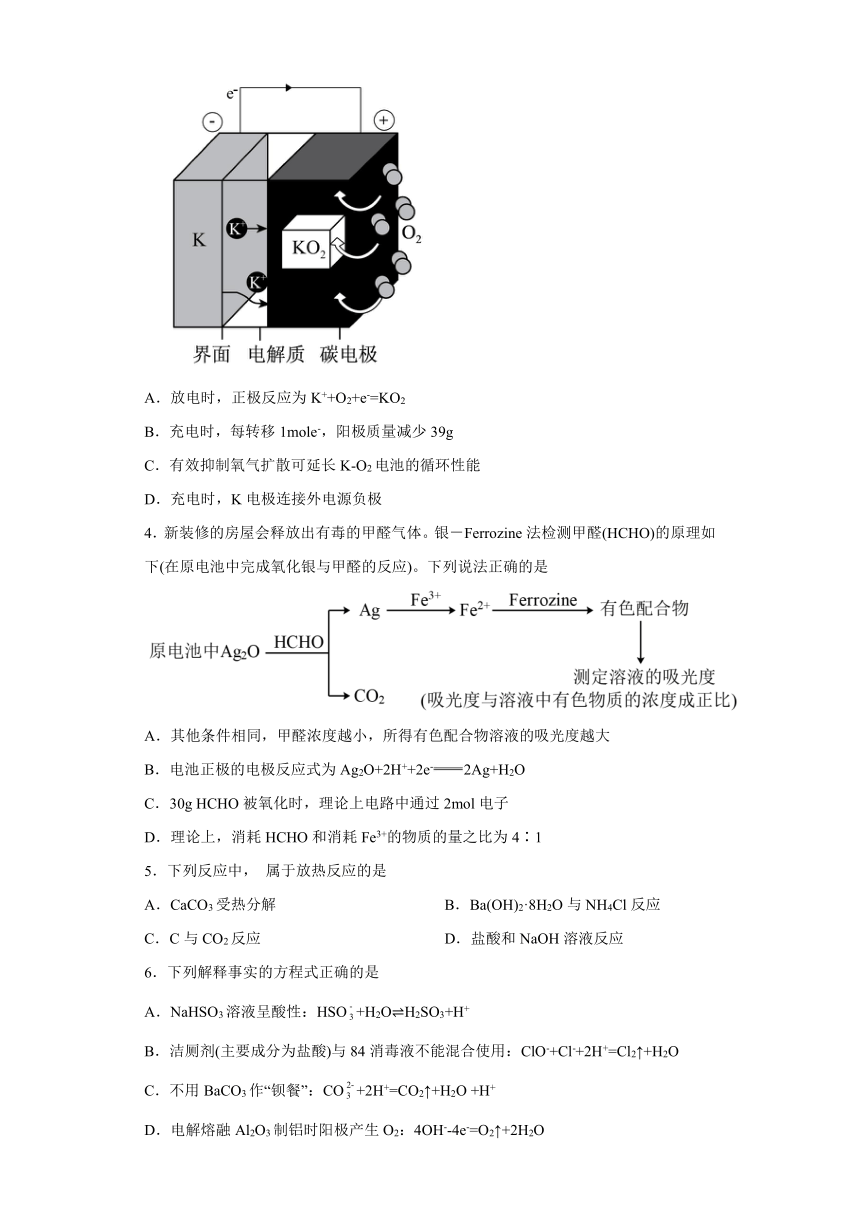
3.K-O2可充电电池可看作金属钾在负极的电镀和剥离与氧气在正极的还原和生成。“界面”用来阻止电解液的持续降解,电解质为二甲醚的二甲基亚砜(DMSO—DME)溶液,能传导K+。电池反应为K+O2=KO2,装置如图所示。下列说法错误的是
A.放电时,正极反应为K++O2+e-=KO2
B.充电时,每转移1mole-,阳极质量减少39g
C.有效抑制氧气扩散可延长K-O2电池的循环性能
D.充电时,K电极连接外电源负极
4.新装修的房屋会释放出有毒的甲醛气体。银-Ferrozine法检测甲醛(HCHO)的原理如下(在原电池中完成氧化银与甲醛的反应)。下列说法正确的是
A.其他条件相同,甲醛浓度越小,所得有色配合物溶液的吸光度越大
B.电池正极的电极反应式为Ag2O+2H++2e-2Ag+H2O
C.30g HCHO被氧化时,理论上电路中通过2mol电子
D.理论上,消耗HCHO和消耗Fe3+的物质的量之比为4∶1
5.下列反应中, 属于放热反应的是
A.CaCO3受热分解 B.Ba(OH)2·8H2O与NH4Cl反应
C.C与CO2反应 D.盐酸和NaOH溶液反应
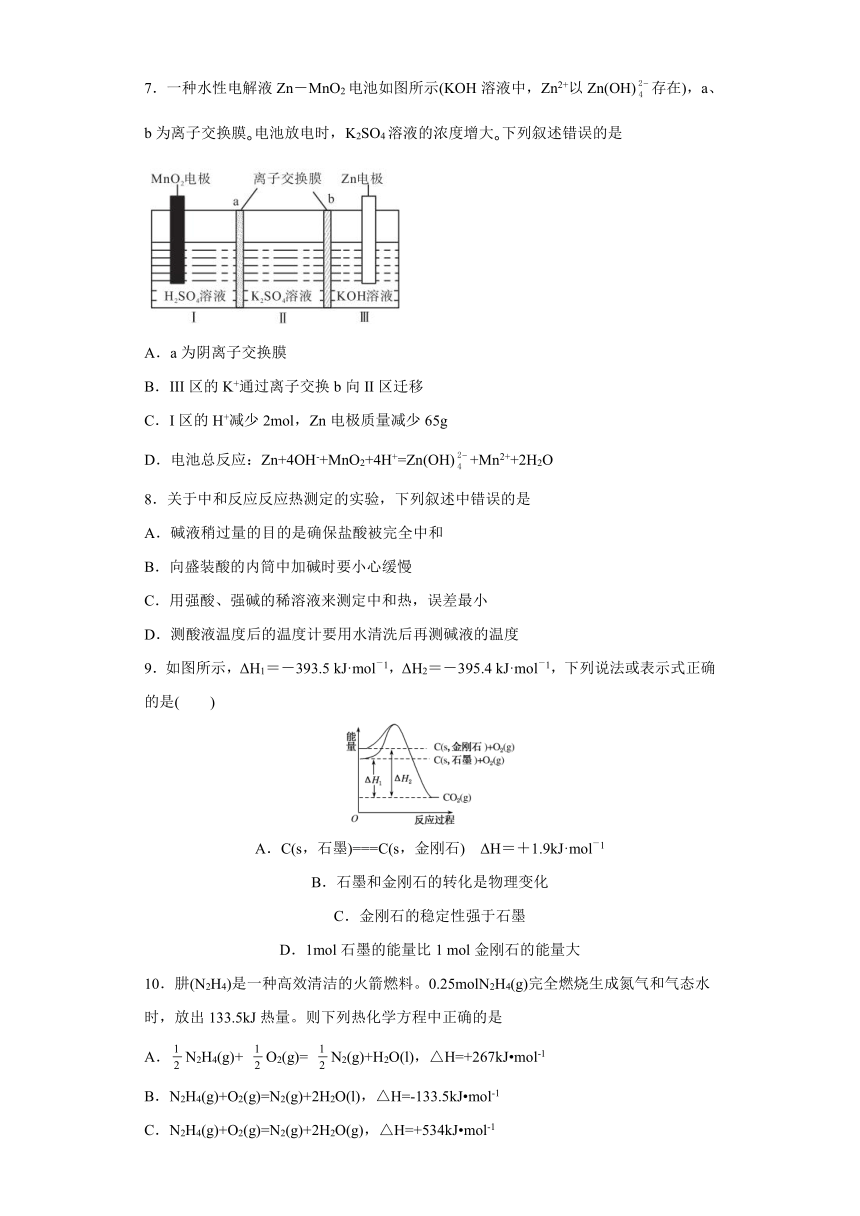
6.下列解释事实的方程式正确的是
A.NaHSO3溶液呈酸性:HSO+H2O H2SO3+H+
B.洁厕剂(主要成分为盐酸)与84消毒液不能混合使用:ClO-+Cl-+2H+=Cl2↑+H2O
C.不用BaCO3作“钡餐”:CO+2H+=CO2↑+H2O +H+
D.电解熔融Al2O3制铝时阳极产生O2:4OH--4e-=O2↑+2H2O
7.一种水性电解液Zn-MnO2电池如图所示(KOH溶液中,Zn2+以Zn(OH)存在),a、b为离子交换膜 电池放电时,K2SO4溶液的浓度增大 下列叙述错误的是
A.a为阴离子交换膜
B.III区的K+通过离子交换b向II区迁移
C.I区的H+减少2mol,Zn电极质量减少65g
D.电池总反应:Zn+4OH-+MnO2+4H+=Zn(OH)+Mn2++2H2O
8.关于中和反应反应热测定的实验,下列叙述中错误的是
A.碱液稍过量的目的是确保盐酸被完全中和
B.向盛装酸的内筒中加碱时要小心缓慢
C.用强酸、强碱的稀溶液来测定中和热,误差最小
D.测酸液温度后的温度计要用水清洗后再测碱液的温度
9.如图所示,ΔH1=-393.5 kJ·mol-1,ΔH2=-395.4 kJ·mol-1,下列说法或表示式正确的是( )
A.C(s,石墨)===C(s,金刚石) ΔH=+1.9kJ·mol-1
B.石墨和金刚石的转化是物理变化
C.金刚石的稳定性强于石墨
D.1mol石墨的能量比1 mol金刚石的能量大
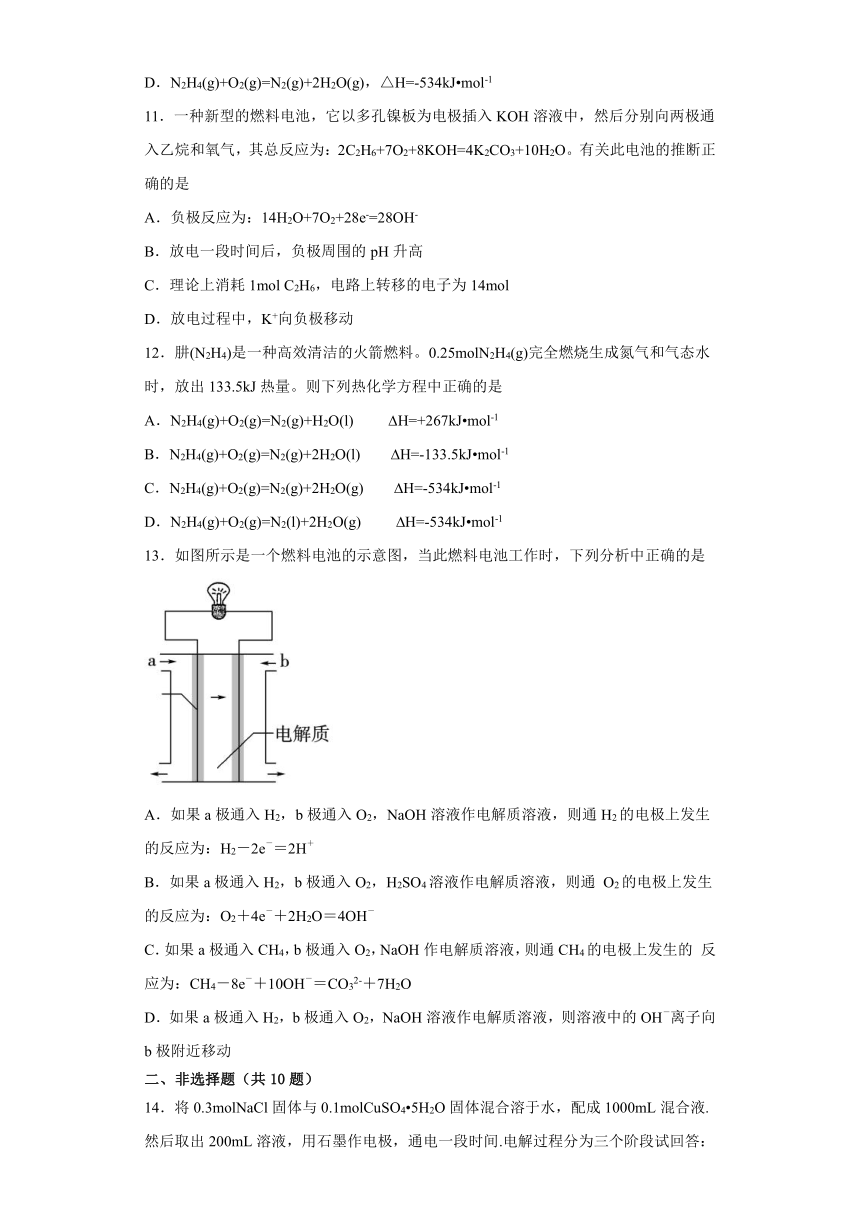
10.肼(N2H4)是一种高效清洁的火箭燃料。0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。则下列热化学方程中正确的是
A.N2H4(g)+ O2(g)= N2(g)+H2O(l),△H=+267kJ mol-1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l),△H=-133.5kJ mol-1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g),△H=+534kJ mol-1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g),△H=-534kJ mol-1
11.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH=4K2CO3+10H2O。有关此电池的推断正确的是
A.负极反应为:14H2O+7O2+28e-=28OH-
B.放电一段时间后,负极周围的pH升高
C.理论上消耗1mol C2H6,电路上转移的电子为14mol
D.放电过程中,K+向负极移动
12.肼(N2H4)是一种高效清洁的火箭燃料。0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。则下列热化学方程中正确的是
A.N2H4(g)+O2(g)=N2(g)+H2O(l) H=+267kJ mol-1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) H=-133.5kJ mol-1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) H=-534kJ mol-1
D.N2H4(g)+O2(g)=N2(l)+2H2O(g) H=-534kJ mol-1
13.如图所示是一个燃料电池的示意图,当此燃料电池工作时,下列分析中正确的是
A.如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则通H2的电极上发生的反应为:H2-2e-=2H+
B.如果a极通入H2,b极通入O2,H2SO4溶液作电解质溶液,则通 O2的电极上发生的反应为:O2+4e-+2H2O=4OH-
C.如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则通CH4的电极上发生的 反应为:CH4-8e-+10OH-=CO32-+7H2O
D.如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则溶液中的OH-离子向b极附近移动
二、非选择题(共10题)
14.将0.3molNaCl固体与0.1molCuSO4 5H2O固体混合溶于水,配成1000mL混合液.然后取出200mL溶液,用石墨作电极,通电一段时间.电解过程分为三个阶段试回答:
(1)其中第一阶段发生的电解反应的离子方程式为____。
(2)电解的最后一个阶段,阴极上发生的电极反应式变为_____。
(3)若Cl-正好全部变为氯气逸出时,阴极上产生气体的体积____L(标准状况下)。
15.(1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片(如图甲所示),可观察到铜片上____(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上_________(填“有”或“没有”)气泡产生。
(2)用导线连接灵敏电流表的两端后,再与溶液中的锌片和铜片相连(如图丙所示),观察到灵敏电流表的指针发生了偏转,说明了导线中有电流通过。从上述现象中可以归纳出构成原电池的一些条件是___________________________和 _________________________________,
有关的电极反应式:锌片_________________________;铜片___________________________。
(3)图乙、图丙是一个将 ___________能转化为 _________能的装置,人们把它叫做原电池。
16.其中B电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:
(1)甲池中,通入甲醇电极反应式为___________。
(2)甲池是___________装置,乙池是___________装置。
(3)乙池中,总反应式为___________。
(4)若甲池中甲醇与氧气互换,则乙池中,A端反应式为___________,B端现象为___________。
三、实验题
17.孔雀石的主要成分为。某同学设计的从孔雀石中提取铜的方案如下:
①将孔雀石粉碎后,加入过量的稀硫酸;
②将反应后的混合物过滤;
③向滤液中加入一种金属粉末。
请根据上述实验方案回答下列问题。
(1)①中可观察到的现象是什么?___________
(2)③中加入的金属粉末可以是什么?请说明理由。___________
(3)设计从滤液中获得铜的另外种方案。___________
18.为了探究化学能与热能的转化,某实验小组设计了如图所示的三套实验装置:
(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是(不能用手触摸和使用温度计)_____。
(2)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钠溶液与稀盐酸,U形管中可观察到的现象是_____,说明该反应属于____(填“吸热反应”或“放热反应”)。
(3)为定量测定(2)中反应的反应热,使50mL0.50mol L-1盐酸与50mL0.55mol L-1NaOH溶液在简易量热计中进行中和反应。回答下列问题:
①该实验中NaOH的浓度大于盐酸的浓度的作用是_____。
②实验中若改用60mL0.50mol L-1盐酸与50mL0.55mol L-1NaOH溶液进行反应,与上述实验相比,所求中和热_____(填“相等”或“不相等”)。
(4)已知一些化学键的键能数据如表所示:
化学键 C-H C-F H-F F-F
键能/kJ mol-1 414 489 565 155
请根据键能数据估算CH4(g)和F2(g)反应生成CF4(g)和HF(g)的热化学方程式:_____。
(5)已知反应:N2(g)+O2(g)=2NO(g) △H1
2H2(g)+O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H4的反应焓变为____(用含△H1、△H2、△H3的式子表示)。
四、计算题
19.碳是常见的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
ΔH=+88.6kJ·mol-1。
则M、N相比,较稳定的是_____。
(2)已知CH3OH(l)的燃烧热ΔH=-726.5kJ·mol-1,CH3OH(l)+O2(g)= CO2(g)+2H2(g) ΔH=-akJ·mol-1,则a________726.5(填“>”“<”或“=”)。
(3)煤气化制合成气(CO和H2)
已知:①C(s)+H2O(g)=CO(g)+H2(g)ΔH1=+131.3kJ·mol-1
②C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH2=+90kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是________。
(4)已知E1=134kJ·mol-1、E2=368kJ·mol-1,请参考题中图表,按要求填空:
①图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。NO2和CO反应的热化学方程式为________。
②下表所示是部分化学键的键能参数:
化学键 P—P P—O O=O P=O
键能/(kJ·mol-1) a b C x
已知P4(g)+5O2(g)=P4O10(g) ΔH=-dkJ·mol-1,P4及P4O10的结构如图Ⅱ所示。表中x=________(用含a、b、c、d的代数式表示)。
20.化学反应过程中释放或吸收的热量在生活、生产、科技及科学研究中具有广泛应用。
(1)“神舟”系列火箭用偏二甲肼()作燃料,作氧化剂,反应后产物无污染。
反应1:
反应2:
写出和反应生成、、的热化学方程式:__________________。
(2)已知,在25℃和101KPa下,部分化学键的键能数据如表所示。
化学键 H-H H-N O=O C-H C=O H-O N-N
键能() 436 391 a 498 414 803 462 193
①25℃和101KPa下,工业合成氨的反应中每生成1 mol 就会放出46 kJ热量,在该条件下,向某容器中加入2 mol 、6 mol 及合适的催化剂,充分反应后测得其放出的热量小于92 kJ,原因可能是________________,表中的a=______。
②科学家发现了一种新的气态分子(图),在25℃和101 KPa下,转化为的热化学方程式为______________________,由此可知与中更稳定的是______(填化学式)。
③已知: 。甲烷是一种常用燃料,则表示甲烷的燃烧热的热化学方程式为_________________________。
21.氮氧化物和硫氧化物污染已成为一个世界性的环境问题,但只要合理利用也是重要的资源,NH3还原法可将NO还原为N2进行脱除。
已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1= 1530kJ·mol 1
②N2(g)+O2(g)=2NO(g) ΔH2=+180kJ·mol 1
写出NH3还原NO的热化学方程式:_______。
22.现有A、B、C、D四种短周期主族元素,其原子序数依次增大。已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。请回答下列问题:
(1)元素D在周期表中的位置是________________________。
(2)C2B2所含的化学键类型有___________;请写出C2B2与A2B反应的离子方程式________________。
(3)元素B、C形成的简单离子中半径较大的是_________(写电子式)。
(4)仅由C、D两种元素组成的一种盐溶于水后pH>7的原因是_____________ (用离子方程式表示)。
(5)如图所示以铂作电极,以C、D两元素的最高价氧化物的水化物X、Y的溶液作为电解质溶液,A、B元素的单质分别在两电极上发生原电池反应,则通入B单质的电极反应式为_________,通入A单质的X溶液的pH将__________ (填“增大”、“不变”或“减小”)。
23.X、Y、Z是同周期的短周期元素,原子序数依次增大。Y为地壳中含量最高的金属元素,Z是所在周期中非金属最强的元素,X、Y的最高价氧化物对应的水化物可以相互反应。
(1)Y元素的原子结构示意图是_________________。
(2)X、Z最高价氧化物对应的水化物之间发生反应的离子方程式为______________。
(3)Z、碳和氟三种元素可组成氟利昂(CZ3F),它在紫外线作用下破坏臭氧层的反应过程部如下:
①CZ3F CZ2F·+Z·
②Z·+O3O2+ZO·
③ ZO·+O·Z·+O2
反应①中破坏的化学键属于________(填“极性”或“非极性”)共价键。
(4)下列说法正确的是___________(填字母)。
a.X与氧元素可形成碱性氧化物
b.常温下与水反应的难易程度可证明金属性:X>Y
c.X、Y、Z形成的简单离子的核外电子排布均相同
(5)Y、石墨与含YCl4-的离子液体可构成原电池,其工作原理如图所示。若电路中转移电子的物质的量为4. 5 mol,则消耗Y单质的质量是________。
参考答案:
1.B 2.C 3.B 4.B 5.D 6.B 7.C 8.B 9.A 10.D 11.C 12.C 13.C
14.(1)
(2)2H++2e-=H2↑
(3)0.224L
15. 没有 有 两活动性不同的电极要插入电解质溶液 两活动性不同的电极用导线连接形成回路 Zn-2e-=Zn2+ 2H++2e-=H2↑ 化学 电
16.(1)
(2) 原电池 电解
(3)4AgNO3+2H2O4Ag+4HNO3+O2↑
(4) Fe-2e-=Fe2+ 碳棒表面析出银白色金属
17.(1)固体溶解,产生气泡,得到蓝色溶液
(2)Fe、Al等,理由是:加入活泼性比Cu强的金属,将Cu从CuSO4溶液中置换出来
(3)以Fe和Cu分别作电极,滤液作电解质溶液,构成原电池
18.(1)III
(2) 左端液柱降低,右端液柱升高 放热反应
(3) 保证盐酸完全被中和,使生成水的量更精确 相等
(4)CH4(g)+4F2(g)=CF4(g)+4HF(g) ΔH=-1940kJ mol-1
(5)2ΔH1+3ΔH2-2ΔH3
19. M < CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.3kJ·mol-1 减小 不变 NO2(g)+CO(g)=CO2(g)+NO(g) ΔH=-234kJ·mol-1
20.(1)
(2) 合成氨的反应为可逆反应 946
21.6NO(g)+4NH3(g)=5N2(g)+6H2O(l) H= 2070kJ/mol
22.(1)第三周期ⅥA族
(2) 离子键、共价键(或非极性共价键) 2Na2O2+2H2O=4Na++4OH-+O2↑
(3)
(4)S2-+H2OHS-+OH-
(5) O2+4H++4e-=2H2O 减小
23. OH-+H+=H2O 极性 ab 40.5
一、单选题(共13题)
1.实验室中利用固体KMnO4进行如图实验,下列说法正确的是
A.本实验中若用稀盐酸代替浓盐酸会减慢反应速率,但不影响单质H的生成量
B.气体H的量小于0.25mol
C.根据盖斯定律,直接用KMnO4和浓盐酸反应的热效应与本实验中的总热效应相等
D.气体H是一种常见的氧化性气体,一般在反应中只表现氧化性
2.氢气是一种清洁能源,“热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。已知:电解在质子交换膜电解池中进行,阳极区为酸性溶液,阴极区为盐酸,电解过程中转化为。下列有关说法错误的是
A.在溶解过程中,发生反应的离子方程式为
B.阳极发生的主要电极反应为
C.在热水解和热分解过程中,发生化合价变化的元素只有O
D.热分解过程中的反应物为
3.K-O2可充电电池可看作金属钾在负极的电镀和剥离与氧气在正极的还原和生成。“界面”用来阻止电解液的持续降解,电解质为二甲醚的二甲基亚砜(DMSO—DME)溶液,能传导K+。电池反应为K+O2=KO2,装置如图所示。下列说法错误的是
A.放电时,正极反应为K++O2+e-=KO2
B.充电时,每转移1mole-,阳极质量减少39g
C.有效抑制氧气扩散可延长K-O2电池的循环性能
D.充电时,K电极连接外电源负极
4.新装修的房屋会释放出有毒的甲醛气体。银-Ferrozine法检测甲醛(HCHO)的原理如下(在原电池中完成氧化银与甲醛的反应)。下列说法正确的是
A.其他条件相同,甲醛浓度越小,所得有色配合物溶液的吸光度越大
B.电池正极的电极反应式为Ag2O+2H++2e-2Ag+H2O
C.30g HCHO被氧化时,理论上电路中通过2mol电子
D.理论上,消耗HCHO和消耗Fe3+的物质的量之比为4∶1
5.下列反应中, 属于放热反应的是
A.CaCO3受热分解 B.Ba(OH)2·8H2O与NH4Cl反应
C.C与CO2反应 D.盐酸和NaOH溶液反应
6.下列解释事实的方程式正确的是
A.NaHSO3溶液呈酸性:HSO+H2O H2SO3+H+
B.洁厕剂(主要成分为盐酸)与84消毒液不能混合使用:ClO-+Cl-+2H+=Cl2↑+H2O
C.不用BaCO3作“钡餐”:CO+2H+=CO2↑+H2O +H+
D.电解熔融Al2O3制铝时阳极产生O2:4OH--4e-=O2↑+2H2O
7.一种水性电解液Zn-MnO2电池如图所示(KOH溶液中,Zn2+以Zn(OH)存在),a、b为离子交换膜 电池放电时,K2SO4溶液的浓度增大 下列叙述错误的是
A.a为阴离子交换膜
B.III区的K+通过离子交换b向II区迁移
C.I区的H+减少2mol,Zn电极质量减少65g
D.电池总反应:Zn+4OH-+MnO2+4H+=Zn(OH)+Mn2++2H2O
8.关于中和反应反应热测定的实验,下列叙述中错误的是
A.碱液稍过量的目的是确保盐酸被完全中和
B.向盛装酸的内筒中加碱时要小心缓慢
C.用强酸、强碱的稀溶液来测定中和热,误差最小
D.测酸液温度后的温度计要用水清洗后再测碱液的温度
9.如图所示,ΔH1=-393.5 kJ·mol-1,ΔH2=-395.4 kJ·mol-1,下列说法或表示式正确的是( )
A.C(s,石墨)===C(s,金刚石) ΔH=+1.9kJ·mol-1
B.石墨和金刚石的转化是物理变化
C.金刚石的稳定性强于石墨
D.1mol石墨的能量比1 mol金刚石的能量大
10.肼(N2H4)是一种高效清洁的火箭燃料。0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。则下列热化学方程中正确的是
A.N2H4(g)+ O2(g)= N2(g)+H2O(l),△H=+267kJ mol-1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l),△H=-133.5kJ mol-1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g),△H=+534kJ mol-1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g),△H=-534kJ mol-1
11.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH=4K2CO3+10H2O。有关此电池的推断正确的是
A.负极反应为:14H2O+7O2+28e-=28OH-
B.放电一段时间后,负极周围的pH升高
C.理论上消耗1mol C2H6,电路上转移的电子为14mol
D.放电过程中,K+向负极移动
12.肼(N2H4)是一种高效清洁的火箭燃料。0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。则下列热化学方程中正确的是
A.N2H4(g)+O2(g)=N2(g)+H2O(l) H=+267kJ mol-1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) H=-133.5kJ mol-1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) H=-534kJ mol-1
D.N2H4(g)+O2(g)=N2(l)+2H2O(g) H=-534kJ mol-1
13.如图所示是一个燃料电池的示意图,当此燃料电池工作时,下列分析中正确的是
A.如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则通H2的电极上发生的反应为:H2-2e-=2H+
B.如果a极通入H2,b极通入O2,H2SO4溶液作电解质溶液,则通 O2的电极上发生的反应为:O2+4e-+2H2O=4OH-
C.如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则通CH4的电极上发生的 反应为:CH4-8e-+10OH-=CO32-+7H2O
D.如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则溶液中的OH-离子向b极附近移动
二、非选择题(共10题)
14.将0.3molNaCl固体与0.1molCuSO4 5H2O固体混合溶于水,配成1000mL混合液.然后取出200mL溶液,用石墨作电极,通电一段时间.电解过程分为三个阶段试回答:
(1)其中第一阶段发生的电解反应的离子方程式为____。
(2)电解的最后一个阶段,阴极上发生的电极反应式变为_____。
(3)若Cl-正好全部变为氯气逸出时,阴极上产生气体的体积____L(标准状况下)。
15.(1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片(如图甲所示),可观察到铜片上____(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上_________(填“有”或“没有”)气泡产生。
(2)用导线连接灵敏电流表的两端后,再与溶液中的锌片和铜片相连(如图丙所示),观察到灵敏电流表的指针发生了偏转,说明了导线中有电流通过。从上述现象中可以归纳出构成原电池的一些条件是___________________________和 _________________________________,
有关的电极反应式:锌片_________________________;铜片___________________________。
(3)图乙、图丙是一个将 ___________能转化为 _________能的装置,人们把它叫做原电池。
16.其中B电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:
(1)甲池中,通入甲醇电极反应式为___________。
(2)甲池是___________装置,乙池是___________装置。
(3)乙池中,总反应式为___________。
(4)若甲池中甲醇与氧气互换,则乙池中,A端反应式为___________,B端现象为___________。
三、实验题
17.孔雀石的主要成分为。某同学设计的从孔雀石中提取铜的方案如下:
①将孔雀石粉碎后,加入过量的稀硫酸;
②将反应后的混合物过滤;
③向滤液中加入一种金属粉末。
请根据上述实验方案回答下列问题。
(1)①中可观察到的现象是什么?___________
(2)③中加入的金属粉末可以是什么?请说明理由。___________
(3)设计从滤液中获得铜的另外种方案。___________
18.为了探究化学能与热能的转化,某实验小组设计了如图所示的三套实验装置:
(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是(不能用手触摸和使用温度计)_____。
(2)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钠溶液与稀盐酸,U形管中可观察到的现象是_____,说明该反应属于____(填“吸热反应”或“放热反应”)。
(3)为定量测定(2)中反应的反应热,使50mL0.50mol L-1盐酸与50mL0.55mol L-1NaOH溶液在简易量热计中进行中和反应。回答下列问题:
①该实验中NaOH的浓度大于盐酸的浓度的作用是_____。
②实验中若改用60mL0.50mol L-1盐酸与50mL0.55mol L-1NaOH溶液进行反应,与上述实验相比,所求中和热_____(填“相等”或“不相等”)。
(4)已知一些化学键的键能数据如表所示:
化学键 C-H C-F H-F F-F
键能/kJ mol-1 414 489 565 155
请根据键能数据估算CH4(g)和F2(g)反应生成CF4(g)和HF(g)的热化学方程式:_____。
(5)已知反应:N2(g)+O2(g)=2NO(g) △H1
2H2(g)+O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H4的反应焓变为____(用含△H1、△H2、△H3的式子表示)。
四、计算题
19.碳是常见的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
ΔH=+88.6kJ·mol-1。
则M、N相比,较稳定的是_____。
(2)已知CH3OH(l)的燃烧热ΔH=-726.5kJ·mol-1,CH3OH(l)+O2(g)= CO2(g)+2H2(g) ΔH=-akJ·mol-1,则a________726.5(填“>”“<”或“=”)。
(3)煤气化制合成气(CO和H2)
已知:①C(s)+H2O(g)=CO(g)+H2(g)ΔH1=+131.3kJ·mol-1
②C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH2=+90kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是________。
(4)已知E1=134kJ·mol-1、E2=368kJ·mol-1,请参考题中图表,按要求填空:
①图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。NO2和CO反应的热化学方程式为________。
②下表所示是部分化学键的键能参数:
化学键 P—P P—O O=O P=O
键能/(kJ·mol-1) a b C x
已知P4(g)+5O2(g)=P4O10(g) ΔH=-dkJ·mol-1,P4及P4O10的结构如图Ⅱ所示。表中x=________(用含a、b、c、d的代数式表示)。
20.化学反应过程中释放或吸收的热量在生活、生产、科技及科学研究中具有广泛应用。
(1)“神舟”系列火箭用偏二甲肼()作燃料,作氧化剂,反应后产物无污染。
反应1:
反应2:
写出和反应生成、、的热化学方程式:__________________。
(2)已知,在25℃和101KPa下,部分化学键的键能数据如表所示。
化学键 H-H H-N O=O C-H C=O H-O N-N
键能() 436 391 a 498 414 803 462 193
①25℃和101KPa下,工业合成氨的反应中每生成1 mol 就会放出46 kJ热量,在该条件下,向某容器中加入2 mol 、6 mol 及合适的催化剂,充分反应后测得其放出的热量小于92 kJ,原因可能是________________,表中的a=______。
②科学家发现了一种新的气态分子(图),在25℃和101 KPa下,转化为的热化学方程式为______________________,由此可知与中更稳定的是______(填化学式)。
③已知: 。甲烷是一种常用燃料,则表示甲烷的燃烧热的热化学方程式为_________________________。
21.氮氧化物和硫氧化物污染已成为一个世界性的环境问题,但只要合理利用也是重要的资源,NH3还原法可将NO还原为N2进行脱除。
已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1= 1530kJ·mol 1
②N2(g)+O2(g)=2NO(g) ΔH2=+180kJ·mol 1
写出NH3还原NO的热化学方程式:_______。
22.现有A、B、C、D四种短周期主族元素,其原子序数依次增大。已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。请回答下列问题:
(1)元素D在周期表中的位置是________________________。
(2)C2B2所含的化学键类型有___________;请写出C2B2与A2B反应的离子方程式________________。
(3)元素B、C形成的简单离子中半径较大的是_________(写电子式)。
(4)仅由C、D两种元素组成的一种盐溶于水后pH>7的原因是_____________ (用离子方程式表示)。
(5)如图所示以铂作电极,以C、D两元素的最高价氧化物的水化物X、Y的溶液作为电解质溶液,A、B元素的单质分别在两电极上发生原电池反应,则通入B单质的电极反应式为_________,通入A单质的X溶液的pH将__________ (填“增大”、“不变”或“减小”)。
23.X、Y、Z是同周期的短周期元素,原子序数依次增大。Y为地壳中含量最高的金属元素,Z是所在周期中非金属最强的元素,X、Y的最高价氧化物对应的水化物可以相互反应。
(1)Y元素的原子结构示意图是_________________。
(2)X、Z最高价氧化物对应的水化物之间发生反应的离子方程式为______________。
(3)Z、碳和氟三种元素可组成氟利昂(CZ3F),它在紫外线作用下破坏臭氧层的反应过程部如下:
①CZ3F CZ2F·+Z·
②Z·+O3O2+ZO·
③ ZO·+O·Z·+O2
反应①中破坏的化学键属于________(填“极性”或“非极性”)共价键。
(4)下列说法正确的是___________(填字母)。
a.X与氧元素可形成碱性氧化物
b.常温下与水反应的难易程度可证明金属性:X>Y
c.X、Y、Z形成的简单离子的核外电子排布均相同
(5)Y、石墨与含YCl4-的离子液体可构成原电池,其工作原理如图所示。若电路中转移电子的物质的量为4. 5 mol,则消耗Y单质的质量是________。
参考答案:
1.B 2.C 3.B 4.B 5.D 6.B 7.C 8.B 9.A 10.D 11.C 12.C 13.C
14.(1)
(2)2H++2e-=H2↑
(3)0.224L
15. 没有 有 两活动性不同的电极要插入电解质溶液 两活动性不同的电极用导线连接形成回路 Zn-2e-=Zn2+ 2H++2e-=H2↑ 化学 电
16.(1)
(2) 原电池 电解
(3)4AgNO3+2H2O4Ag+4HNO3+O2↑
(4) Fe-2e-=Fe2+ 碳棒表面析出银白色金属
17.(1)固体溶解,产生气泡,得到蓝色溶液
(2)Fe、Al等,理由是:加入活泼性比Cu强的金属,将Cu从CuSO4溶液中置换出来
(3)以Fe和Cu分别作电极,滤液作电解质溶液,构成原电池
18.(1)III
(2) 左端液柱降低,右端液柱升高 放热反应
(3) 保证盐酸完全被中和,使生成水的量更精确 相等
(4)CH4(g)+4F2(g)=CF4(g)+4HF(g) ΔH=-1940kJ mol-1
(5)2ΔH1+3ΔH2-2ΔH3
19. M < CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.3kJ·mol-1 减小 不变 NO2(g)+CO(g)=CO2(g)+NO(g) ΔH=-234kJ·mol-1
20.(1)
(2) 合成氨的反应为可逆反应 946
21.6NO(g)+4NH3(g)=5N2(g)+6H2O(l) H= 2070kJ/mol
22.(1)第三周期ⅥA族
(2) 离子键、共价键(或非极性共价键) 2Na2O2+2H2O=4Na++4OH-+O2↑
(3)
(4)S2-+H2OHS-+OH-
(5) O2+4H++4e-=2H2O 减小
23. OH-+H+=H2O 极性 ab 40.5
