第三章 铁 金属材料 单元过关测试 (含解析)2022-2023学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第三章 铁 金属材料 单元过关测试 (含解析)2022-2023学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 545.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-24 15:04:13 | ||
图片预览



文档简介
第三章铁金属材料单元过关测试
2022-2023学年上学期高一化学人教版(2019)必修第一册
一、单选题
1.某人的体检报告中显示,其血液中葡萄糖含量为,则其血液中含葡萄糖分子的数目约为( )
A.5 B. C. D.
2.铝制品在空气中比铁制品更不易被锈蚀,原因是( )
A.铝的金属活动性比铁弱
B.铝的密度比铁的密度小
C.铝在空气中易与氧气反应形成一层致密的氧化膜
D.铝常温不能跟氧气发生化学反应
3.下列材料不属于合金的是( )
A.制造下水井盖用的生铁 B.制作餐具用的不锈钢 C.储存和释放氢气用的储氢合金 D.制作显示屏的有机发光材料
A.A B.B C.C D.D
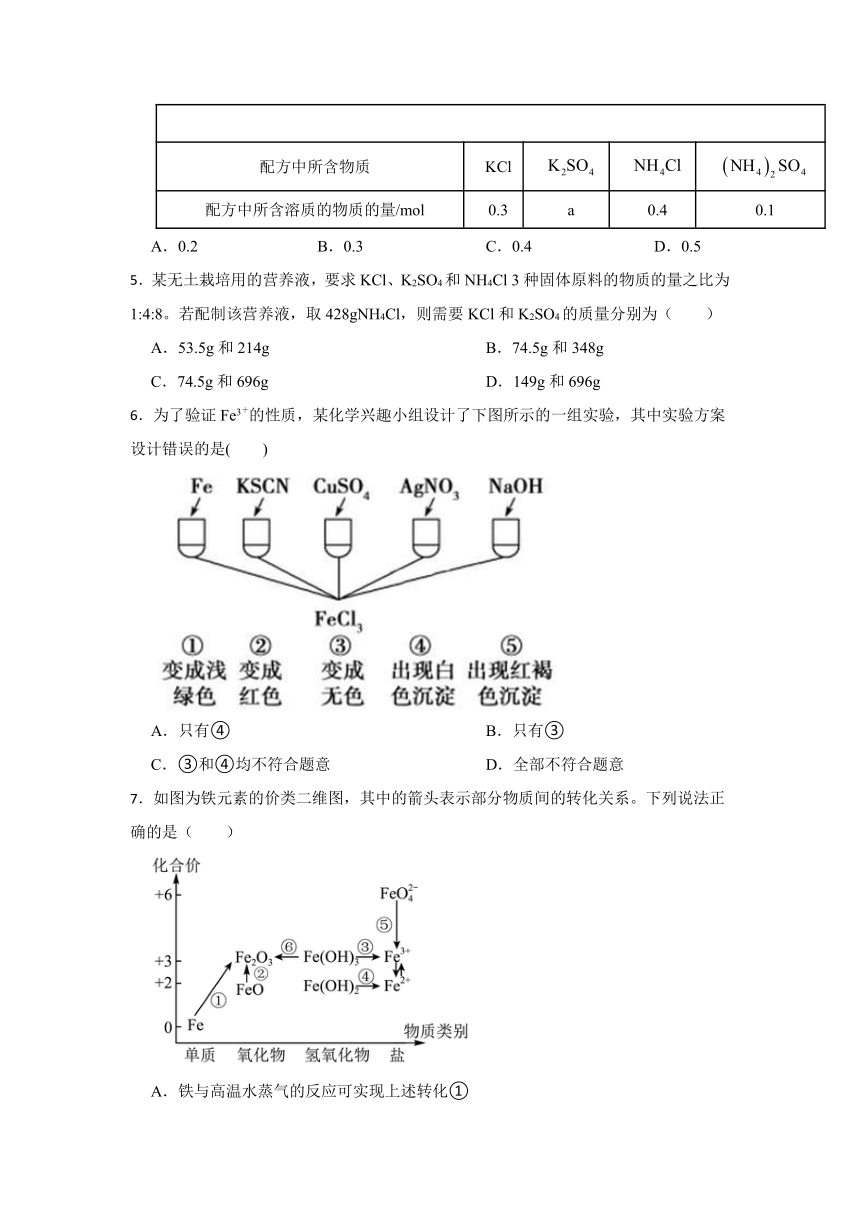
4.营养液是无土栽培技术中不可或缺的成分,现有一种营养液,其配方如表所示。由表中所给数据算得a的值为( )
配方中所含离子 K+ Cl-
配方中所含离子的物质的量/mol 1.1 0.7 0.5 0.6
配方中所含物质 KCl
配方中所含溶质的物质的量/mol 0.3 a 0.4 0.1
A.0.2 B.0.3 C.0.4 D.0.5
5.某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl 3种固体原料的物质的量之比为1:4:8。若配制该营养液,取428gNH4Cl,则需要KCl和K2SO4的质量分别为( )
A.53.5g和214g B.74.5g和348g
C.74.5g和696g D.149g和696g
6.为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是( )
A.只有④ B.只有③
C.③和④均不符合题意 D.全部不符合题意
7.如图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系。下列说法正确的是( )
A.铁与高温水蒸气的反应可实现上述转化①
B.FeO是一种黑色粉末,不稳定,在空气中受热,迅速发生转化②生成红棕色粉末
C.加热发生转化⑥,加水溶解可实现转化③
D.由图可预测:高铁酸盐具有强氧化性,可用于消毒;消毒后可生成胶体,故可作净水剂
8.常温常压下,将等质量的氢气、甲烷、氧气、二氧化碳四种气体分别吹入四个气球,气球中气体为甲烷的是( )
A. B.
C. D.
9.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是( )
A.偏二甲肼的摩尔质量为60 g
B.6.02×1023个偏二甲肼分子的质量约为60 g
C.1 mol偏二甲肼的质量为60 g·mol-1
D.6 g偏二甲肼含有NA个偏二甲肼分子
10.下列各组物质反应后,再滴入KSCN溶液,显红色的是( )
A.过量铁与稀盐酸 B.过量氯水与FeCl2溶液
C.过量铁粉与CuCl2溶液 D.过量铁粉与FeCl3溶液
11.将质量为W1 g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向溶液中逐滴加入浓度为a mol·L 1的HCl溶液,过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L。将溶液蒸干充分灼烧得到固体(NaCl和Al2O3)W2 g.下列关系式中错误的是( )
A.24n(Al)+35.5n(Na)=W2 W1 B.n(Na)+3n(Al)=aV2
C.n(Na)+3n(Al)=V1/11.2 D.aV2=V1/22.4
12.在标准状况下,与9.6g氧气所占体积相同的二氧化碳的质量为( )
A.8.8 g B.13.2 g C.11 g D.15.4 g
13.实验室欲制备少量,可选择的方法是( )
A.与加热反应 B.与稀盐酸反应
C.与溶液反应 D.与溶液反应
14.当O2、SO2、SO3的质量比为2∶4∶5时,它们的物质的量之比为( )
A.2:4:5 B.1:2:3
C.1:1:1 D.2:2:3
15.设表示阿伏加德罗常数的值.下列说法正确的是( )
A.在加热条件下完全水解生成胶粒数为
B.水溶液中与离子数之和为
C.的乙酸和葡萄糖的混合物充分燃烧消耗分子数为
D.在标准状况下,三氯甲烷中含有的共价键数目为
16.在硫酸钠和硫酸铝的混合溶液中,Al3+的物质的量浓度为0.2mol·L-1,SO42-为0.4mol·L-1,溶液中Na+的物质的量浓度为( )
A.0.1 mol·L-1 B.0.2mol·L-1
C.0.3mol·L-1 D.0.4mol·L-1
二、综合题
17.现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙 ,F 。
(2)写出下列反应的离子方程式:
①金属A和水反应 。②红褐色沉淀C与物质E反应 。
③F与黄绿色气体乙反应 。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式 。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在 之间,验证的简单方法是: 。
18.某学生用Na2CO3和KHCO3组成的某混合物进行实验,测得如下几组数据(盐酸的物质的量浓度相等且不考虑HCl的挥发)。
实验序号 ① ② ③ ④
盐酸体积/mL 50 50 50 50
混合物质量/g 3.06 6.12 9.18 12.24
生成气体体积/L(标况) 0.672 1.344 1.568 1.344
请回答:
(1)原混合物样品中n(Na2CO3)︰n(KHCO3) = 。
(2)盐酸的物质的量浓度为
(3)实验④反应后,至少需继续加入 mL的该盐酸才能使12.24g的混合物全部反应。
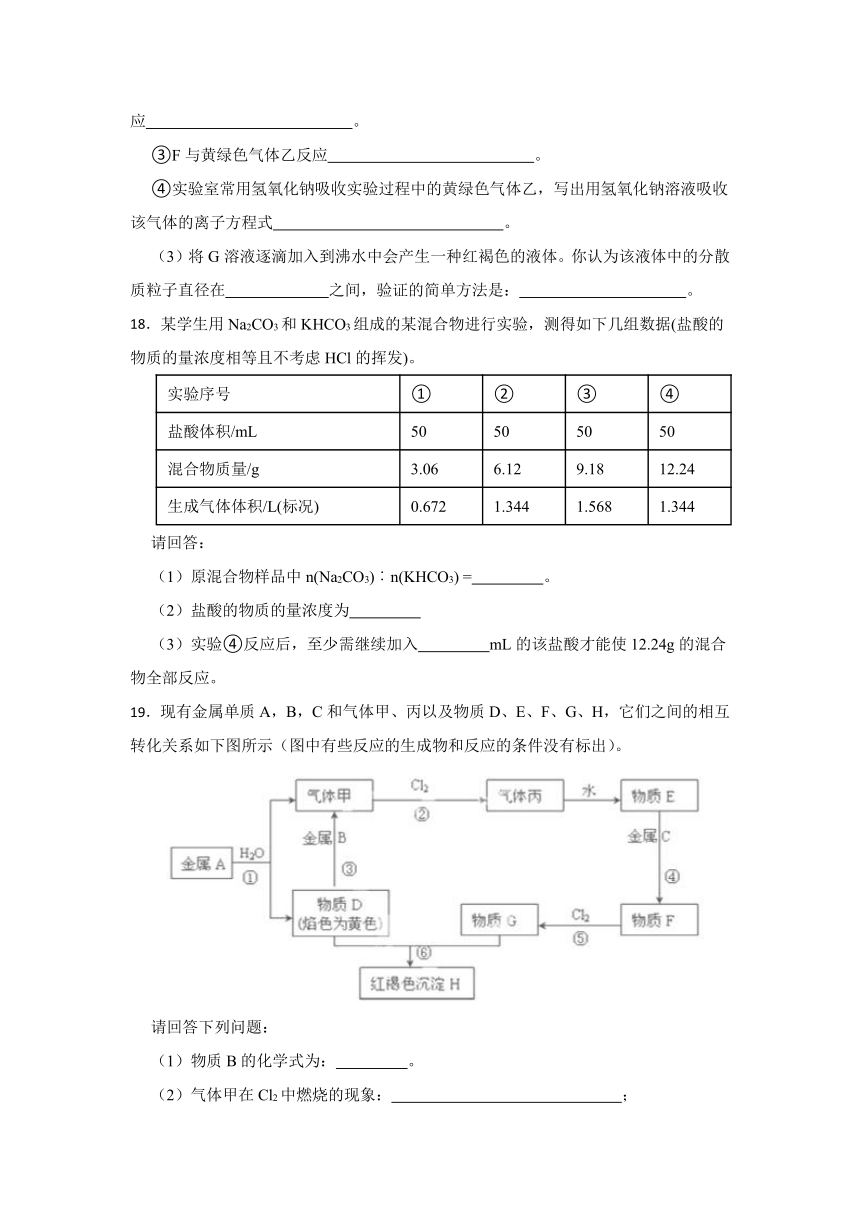
19.现有金属单质A,B,C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)物质B的化学式为: 。
(2)气体甲在Cl2中燃烧的现象: ;
(3)金属A与G的水溶液反应的化学方程式: ;
(4)写出下列反应的离子方程式:
③: .
⑤: .
(5)将Na2O2投入到F溶液中,可以观察到的现象是: 。
20.已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
(1)该“84消毒液”的物质的量浓度约为 mol·L-1。(保留小数点后一位)
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)= mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是__(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2L2.3mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为 mol·L-1。
②需用浓硫酸的体积为 mL。
三、推断题
21.为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。
(1)往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色:A ,B 。
(2)写出上述过程中有关反应的化学方程式:Fe2O3→A ,A→B 。
(3)向B溶液中逐滴加入NaOH得到C,此过程中可观察到的现象是 。
(4)将A的饱和溶液滴入沸水中并不断加热,可制得 胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为 。
22.A,B,C,D 均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):
(1)若 D 是金属,C 溶液在储存时应加入少量 D,其理由是(用必要的文字和离子方程式 表示) 。
(2)若 A、B、C 为含同一种金属元素的无机化合物,请写出 B 转化为 C 的所有可能的离 子力程式: 。
答案解析部分
1.C
由题意可知,某人1L血液中含葡萄糖分子的数目约为5×10-3mol/L×1L×6.02×1023mol-1=3.01×1021,故C符合题意。
根据n=cV和N=nNA计算。
2.C
铁在空气中发生氧化后生成的氧化物是疏松状的,导致内部金属继续被腐蚀,而铝氧化生成的氧化膜结构致密,可阻止内部铝与空气的接触,抗腐蚀能力强,
故答案为:C。
金属铝在狂三其中在表面易被氧化成一薄层氧化物,组织内部金属的继续氧化。
3.D
A.制造下水井盖用的生铁主要是铁和碳的合金,故A不符合题意;
B.不锈钢主要是铁铬镍的合金,故B不符合题意;
C.储氢合金主要是稀土系、Laves 相系、镁系和钛系等合金,故C不符合题意;
D.有机发光材料属于有机物,不是合金,故D符合题意。
故答案为:D。
A.生铁是铁碳合金;
B.不锈钢主要是铁铬镍的合金;
C.储氢合金主要是稀土系、Laves 相系、镁系和钛系等合金。
4.C
有质量守恒可知,n(K+)=1.1mol,所以有1.1=0.3+2a,解得a=0.4mol,
故答案为:C。
根据原子守恒计算。
5.C
428gNH4Cl的物质的量为8mol;KCl、K2SO4、NH4Cl三种固体原料的物质的量之比为1∶4∶8;所以需要KCl 1mol,质量为74.5g、需要K2SO4 4mol,质量为696g,C符合题意。
故答案为:C
先求得NH4Cl的物质的量,再根据KCl、K2SO4、NH4Cl三种固体原料的物质的量之比,求得KCl、K2SO4物质的量,根据公式n=m/M,求得KCl、K2SO4的质量。
6.C
①铁离子与铁反应生成浅绿色的亚铁离子,①正确;
②铁离子与硫氰化钾溶液反应显示红色,据此能够检验铁离子,②正确;
③硫酸铜与氯化铁不发生反应,混合后溶液不会变成无色,③不正确;
④氯化铁与硝酸银反应生成白色氯化银沉淀,该性质不是铁离子的性质,④不正确;
⑤铁离子与氢氧化钠溶液反应生成红褐色氢氧化铁沉淀,据此可以检验是否存在铁离子,⑤正确;
综上,错误的是③④,C符合题意;
故答案为:C
①Fe与FeCl3反应生成FeCl2;
②Fe3+遇KSCN,溶液显红色;
③FeCl2与CuSO4不反应;
④溶液中Cl-与Ag+反应生成AgCl沉淀;
⑤Fe3+与OH-形成Fe(OH)3红褐色沉淀;
7.D
A.高温下,Fe与水蒸气发生反应:3Fe+4H2OFe3O4+4H2,A不符合题意;
B.FeO是一种黑色粉末,不稳定,在空气中加热发生反应:6FeO+O22Fe3O4,B不符合题意;
C.加热Fe(OH)3发生反应:2Fe(OH)3Fe2O3+3H2O,Fe2O3不溶于水,C不符合题意;
D.高铁酸盐中铁元素为+6价,具有强氧化性,因此可用于消毒,同时消毒后转化为Fe3+,可水解产生Fe(OH)3胶体,具有吸附性,可用作净水剂,D符合题意;
故答案为:D
A、高温下,Fe与水蒸气反应生成Fe3O4和H2;
B、FeO加热生成黑色固体Fe3O4;
C、Fe(OH)3加热分解成Fe2O3和H2O,Fe2O3与H2O不反应
D、H2FeO4中铁元素为+6价,具有氧化性,同时其水解可产生Fe(OH)3胶体;
8.C
根据阿伏加德罗定律可知同温同压下,相同质量的气体,体积之比与摩尔质量成反比,即摩尔质量越大,气体占有的体积越小。氢气、甲烷、氧气、二氧化碳四种气体的摩尔质量分别为2g/mol、16g/mol、32g/mol、44g/mol,所以同温同压下,氢气、甲烷、氧气、二氧化碳四种气体占有体积大小为:H2>CH4>CO2>O2,
故答案为:C。
根据阿伏加德罗定律可知,同温同压下,相同质量的气体,体积之比与摩尔质量之比成反比。
9.B
偏二甲肼的摩尔质量为60 g/mol;1 mol这种物质的质量为60 g;6 g偏二甲肼含有0.1NA个偏二甲肼分子。
本题考查的是摩尔质量、质量、伏伽德罗常数等于物质的量之间的关系。
10.B
A.铁与稀盐酸反应只生成FeCl2和H2,反应后所得溶液中存在Fe3+,A不符合题意;
B.Cl2具有氧化性,能将Fe2+氧化成Fe3+,反应后所得溶液中含有Fe3+,B符合题意;
C.过量铁粉与CuCl2溶液反应生成FeCl2和Cu,反应后溶液中不存在Fe3+,C不符合题意;
D.过量铁粉与FeCl3溶液反应生成FeCl2,反应后溶液中不存在Fe3+,D不符合题意;
故答案为:B
滴入KSCN溶液后,显红色,说明溶液中存在Fe3+,据此结合选项进行分析。
11.D
A.根据题意,Na最终以NaCl形式存在,质量增加为35.5n(Na);AlCl3在蒸干过程中水解为Al(OH)3和HCl,HCl挥发,最后蒸干产物为Al2O3,增加的质量为24n(Al),24n(Al)+35.5n(Na)=W2-W1,A不符合题意。
C.W1g的Na和Al经过和一定量的水反应,置换出了V1L H2,由电子得失守恒知:Na和Al完全反应变成Na+和Al3+失去的电子数应该等于生成的H2得到的电子数,则有n(Na)+3n(Al)=2V1/22.4,C不符合题意 ;
;溶液经过一系列的反应最终得到的溶液应该是NaCl和AlCl3的混合,因此;aV2可看成是盐酸中Cl元素的物质的量,由Cl元素守恒知aV2=n(Na)+3n(Al)=2V1/22.4。B不符合题意,D符合题意。
故答案为:D
解决本题的关键是利用守恒思想。此外要知道由于铝离子易水解,因此灼烧氯化铝最终得到的产物是氧化铝。
12.B
同温同压,相同体积的气体,物质的量相同;9.6g氧气的物质的量是 ,与9.6g氧气所占体积相同的二氧化碳的物质的量为0.3mol,质量为0.3mol×44g/mol=13.2 g,
故答案为:B。
依据同温同压,相同体积的气体,物质的量相同计算;
13.A
A.氯气氧化性较强,和铁反应生成氯化铁,A符合题意;
B.铁和稀盐酸反应生成氯化亚铁,B不符合题意;
C.铁和氯化铜发生置换反应生成铜和氯化亚铁,C不符合题意;
D.与溶液不反应,D不符合题意;
故答案为:A。
A.氯气氧化性较强,和铁反应生成氯化铁;
B.铁和稀盐酸反应生成氯化亚铁和氢气;
C.铁和氯化铜反应生成铜和氯化亚铁;
D.与溶液不反应。
14.C
根据题意,可以假设三者的质量分别为2克,4克,5克,所以根据公式可以计算其物质的量分别为2/32,4/64,5/80,三者化简后均为1/16,即物质的量相等。
故答案为:C
根据公式n=计算。
15.C
A.水解为可逆反应,且Fe(OH)3胶粒是由Fe(OH)3颗粒聚集形成的,因此1molFeCl3水解后形成的Fe(OH)3胶粒数小于1NA,A不符合题意;
B.由物料守恒可得,溶液中c(NH4+)+c(NH3·H2O)=1mol·L-1,因此溶液中NH4+与NH3·H2O的微粒数之和为1NA,B不符合题意;
C.乙酸的分子式为C2H4O2,葡萄糖的分子式为C6H12O6,二者的最简式都是CH2O,因此60g混合物的物质的量为2mol,其燃烧的化学方程式为:CH2O+O2CO2+H2O,因此2mol混合物完全燃烧,消耗2molO2,故消耗O2分子数为2NA,C符合题意;
D.标准状态下CHCl3不是气体,因此不能用气体摩尔体积进行计算,D不符合题意;
故答案为:C
A、水解反应为可逆反应;
B、结合物料守恒分析;
C、根据乙酸、葡萄糖燃烧的化学方程式计算;
D、标准状态下,CHCl3不是气态;
16.B
混合溶液呈现电中性,若忽略水解,则溶液呈现中性,阳离子所带正电荷的浓度等于阴离子所带负电荷的浓度,有3c(Al3+)+c(Na+)=2c(SO42-),代入数据,c(Na+)=2×0.4-3×0.2mol·L-1=0.2 mol·L-1;
故答案为:B。
根据溶液中电荷守恒计算钠离子的物质的量浓度,注意离子所带电荷数。
17.(1)Cl2;FeCl2
(2)2Na+2H2O=2Na++2OH﹣+H2↑;Fe(OH)3+3H+=Fe3++3H2O;2Fe2++Cl2=2Fe3++2Cl﹣;Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
(3)1~100nm;是否有丁达尔现象
食盐中的金属元素是Na,所以金属A是Na,Na和水反应生成NaOH和氢气,黄绿色气体乙为Cl2,与Cl2反应的气体甲为H2,丙为HCl,物质E为盐酸,金属A与水反应生成的D为NaOH,盐酸与金属B反应,生成产物F和气体甲为氢气,金属B与氯气反应生成的G与D氢氧化钠反应生成红褐色沉淀为氢氧化铁,则金属B为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,C为Fe(OH)3。(1)由以上分析可知,乙为Cl2,F为FeCl2;(2)①金属A为钠和水反应生成NaOH和H2,离子方程式为:2Na+2H2O=2Na++2OH-+ H2↑;
②红褐色沉淀C与物质E反应是氢氧化铁和盐酸溶液反应生成氯化铁和水,反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O;③F是FeCl2,FeCl2与Cl2反应生成氯化铁,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;④氯气是大气污染物,在实验室中通常是用氢氧化钠溶液来吸收,反应的离子方程式:Cl2+2 OH-=Cl-+ClO-+H2O;(3)将FeCl3溶液逐滴加入到沸水中,继续加热至液体变为红褐色,停止加热,得到的就是氢氧化铁胶体,该液体中的分散质粒子直径在1~100nm之间,验证的简单方法是:用光线照射,看是否产生丁达尔现象,若产生,则该物质就是胶体。
金属A是食盐中的元素为Na元素,Na和水反应生成氢氧化钠和氢气,黄绿色气体乙为Cl2,则与Cl2反应的气体甲为H2,丙为HCl,物质E为盐酸,金属A与水反应生成的D为NaOH,盐酸与金属B反应,生成的产物F和气体甲为氢气,金属B与氯气反应生成的G与D氢氧化钠反应生成红褐色沉淀为氢氧化铁,则金属B为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,C为Fe(OH)3,结合物质的性质分析解答。
18.(1)1:2
(2)2mol/L
(3)30
(1)实验①中混合物全部反应,设Na2CO3和KHCO3的物质的量分别是xmol、ymol,则x+y=0.672÷22.4、106x+100y=3.06,解得x=0.01,y=0.02,则原混合物样品中n(Na2CO3):n(KHCO3)=1:2;
(2)根据①③中数据可知在反应③中盐酸不足,其中二氧化碳是0.07mol,碳酸钠是0.03mol,碳酸氢钾是0.06mol,由于碳酸钠首先与盐酸反应,则反应③中消耗盐酸是0.03mol+0.07mol=0.1mol,所以盐酸的浓度是0.1mol÷0.05L=2mol/L;
(3)根据以上分析可知反应④中碳酸钠是0.04mol,碳酸氢钾是0.08mol,完全反应需要盐酸是0.04mol×2+0.08mol=0.16mol,盐酸的体积是80mL,所以实验④反应后,至少需继续加入30mL的该盐酸溶液才能把12.24g的混合物全部反应。
(1)混合物的计算,可以结合二元一次方程组判断,设其中一种物质的物质的量为x,另一种物质的物质的量为y,根据提供的数据列出相应的式子;
(2)结合二氧化碳和碳酸钠的物质的量计算盐酸的物质的量,推测其浓度;
(3)结合碳酸钠和碳酸氢钾的物质的量,以及盐酸的体积计算。
19.(1)Al
(2)有苍白色火焰,瓶口有白雾
(3)6Na+2FeCl3+6H2O=2Fe(OH)3↓+6NaCl+3H2↑
(4)2OH﹣+2H2O+2Al=2AlO2﹣+3H2↑;Cl2+2Fe2+=2Fe3++2Cl﹣
(5)生成红褐色沉淀,有无色气体产生
根据分析可知A是Na,B是Al,C是Fe,D是NaOH,E是盐酸,F是FeCl2,G是FeCl3,H是Fe(OH)3,甲是H2,丙是HCl。则(1)物质B是铝,化学式为Al。
(2)氢气在Cl2中燃烧生成氯化氢,则现象为有苍白色火焰,瓶口有白雾;(3)金属钠极易与水反应生成氢氧化钠和氢气,生成的氢氧化钠再与氯化铁反应,则与氯化铁溶液反应的化学方程式6Na+2FeCl3+6H2O=2Fe(OH)3↓+6NaCl+3H2↑;
(4)写出下列反应的离子方程式:③是Al与NaOH溶液发生反应生成偏铝酸钠和氢气,反应的离子方程式是2OH-+2H2O+2Al=2AlO2-+3H2↑。⑤是氯气氧化氯化亚铁生成氯化铁,离子方程式为Cl2+2Fe2+=2Fe3++2Cl﹣;
(5)过氧化钠具有强氧化性,溶于水与水反应生成氢氧化钠和氧气,则将Na2O2投入到氯化亚铁溶液中,可以观察到的现象是生成红褐色沉淀,有无色气体产生。
根据红褐色沉淀H为突破口,确定H是氢氧化铁,金属单质A与水反应的产物D的焰色反应为黄色,确定含有钠元素,进而推断A是金属钠,物质G含有铁离子,结合转化关系推出其他物质即可。
20.(1)4.0
(2)0.04
(3)C
(4)4.6;250
(1)由c= 得,c(NaClO)= ≈4.0(mol·L-1)。(2)稀释前后溶液中NaClO的物质的量不变,则有:100 mL×10-3L·mL-1×4.0 mol·L-1=100 mL×100×10-3L·mL-1×c(NaClO),解得稀释后c(NaClO)=0.04 mol·L-1,c(Na+)=c(NaClO)=0.04 mol·L-1。(3)选项A,需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A、B不需要,但还需玻璃棒和胶头滴管。选项B,配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用。选项C,未洗涤烧杯和玻璃棒将导致配制的溶液中溶质的物质的量减小,结果偏低。选项D,应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol·L-1×74.5 g·mol-1=149.0 g(4)①根据H2SO4的组成可知,溶液中c(H+)=2c(H2SO4)=4.6 mol·L-1。②2 000 mL 2.3 mol·L-1的稀硫酸中溶质的物质的量为2 L×2.3 mol·L-1=4.6 mol,设需要98%(密度为1.84 g·cm-3)的浓硫酸的体积为V mL,则有: =4.6 mol,解得V=250。
(1)根据c= 计算消毒液的物质的量浓度;
(2)根据稀释前后溶质的质量不变来分析即可;
(3)根据配制一定物质的量浓度溶液的操作选择适当的仪器;
(4)根据硫酸的浓度可知 H+的物质的量浓度;先计算出稀硫酸中溶质的物质的量,进而求得浓硫酸的体积。
21.(1)红色;浅绿色
(2)Fe2O3 + 6HCl= 2FeCl3+ 3H2O;2FeClЗ+ Fe =3FeCl2
(3)白色沉淀变为灰绿色最后变为红褐色
(4)氢氧化铁;丁达尔效应
(1)氧化铁和酸反应三价铁盐和水,三价铁离子遇到硫氰酸钾显示红色;金属铁可以和三价铁化和生成亚铁离子,亚铁离子遇到硫氰酸钾不变色,故答案为:红色;浅绿色;
(2)氧化铁和盐酸反应生成对应的盐氯化铁和水,即 Fe2O3 + 6HCl= 2FeCl3+ 3H2O,金属铁可以还原三价铁生成亚铁离子,即2FeClЗ+ Fe =3FeCl2,故答案为:
Fe2O3 + 6HCl= 2FeCl3+ 3H2O;
2FeClЗ+ Fe =3FeCl2;
(3)亚铁离子和氢氧根离子反应先产生白色沉淀,迅速变成灰绿色,最后变为红褐色,所以 B 到C 可看到的现象是:白色沉淀变为灰绿色最后变为红褐色。
(4)将氯化铁滴入沸水中,可以获得氢氧化铁胶体,所有的胶体均具有丁达尔效应,故答案为:氢氧化铁;丁达尔效应。
(1)铁离子遇硫氰化钾变为红色,亚铁离子遇硫氰化钾不变色;
(2)氧化铁和焰色反应生成氯化铁和水;氯化铁和铁反应生成氯化亚铁;
(3)亚铁离子遇氢氧根生成白色氢氧化亚铁,然后迅速变为灰绿色,最后变为红褐色的氢氧化铁;
(4)胶体具有丁达尔效应。
22.(1)加入少量铁,防止 Fe2+被氧化为 Fe3+:2Fe3++Fe ═ 3Fe2+
(2)Al(OH)3+3H+ ═ Al3++3H2O、Al(OH)3+OH- ═ AlO2-+2H2O
(1)若 D 是金属,说明金属具有变价,C 溶液在储存时应加入少量 D,说明C中含有Fe2+, A稀溶液具有氧化性, 推断为HNO3Fe(NO3)3Fe(NO3)2,则D为Fe, Fe(NO3)2不稳定被氧化而变质,可加入铁防止被氧化生成硝酸铁,离子方程式为2Fe3++Fe ═ 3Fe2+。故答案为:加入少量铁,防止 Fe2+被氧化为 Fe3+:2Fe3++Fe ═ 3Fe2+。
(2)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B.判断为: Al3+→Al(OH)3→AlO2-; B转化为C的所有可能的离子方程式为生成氢氧化铝沉淀,在酸溶解的离子方程式是: Al(OH)3+3H+ ═ Al3++3H2O、Al(OH)3+OH- ═ AlO2-+2H2O;因此,本题正确答案是: Al(OH)3+3H+ ═ Al3++3H2O、Al(OH)3+OH- ═ AlO2-+2H2O
(1)若 D 是金属,说明金属具有变价,C 溶液在储存时应加入少量 D,说明C中含有Fe2+,A稀溶液具有氧化性, 推断为HNO3Fe(NO3)3Fe(NO3)2,则D为Fe;据此分析;
(2)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B,判断为: Al3+→Al(OH)3→AlO2-;据此结合铝三角的相关转化进行分析
2022-2023学年上学期高一化学人教版(2019)必修第一册
一、单选题
1.某人的体检报告中显示,其血液中葡萄糖含量为,则其血液中含葡萄糖分子的数目约为( )
A.5 B. C. D.
2.铝制品在空气中比铁制品更不易被锈蚀,原因是( )
A.铝的金属活动性比铁弱
B.铝的密度比铁的密度小
C.铝在空气中易与氧气反应形成一层致密的氧化膜
D.铝常温不能跟氧气发生化学反应
3.下列材料不属于合金的是( )
A.制造下水井盖用的生铁 B.制作餐具用的不锈钢 C.储存和释放氢气用的储氢合金 D.制作显示屏的有机发光材料
A.A B.B C.C D.D
4.营养液是无土栽培技术中不可或缺的成分,现有一种营养液,其配方如表所示。由表中所给数据算得a的值为( )
配方中所含离子 K+ Cl-
配方中所含离子的物质的量/mol 1.1 0.7 0.5 0.6
配方中所含物质 KCl
配方中所含溶质的物质的量/mol 0.3 a 0.4 0.1
A.0.2 B.0.3 C.0.4 D.0.5
5.某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl 3种固体原料的物质的量之比为1:4:8。若配制该营养液,取428gNH4Cl,则需要KCl和K2SO4的质量分别为( )
A.53.5g和214g B.74.5g和348g
C.74.5g和696g D.149g和696g
6.为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是( )
A.只有④ B.只有③
C.③和④均不符合题意 D.全部不符合题意
7.如图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系。下列说法正确的是( )
A.铁与高温水蒸气的反应可实现上述转化①
B.FeO是一种黑色粉末,不稳定,在空气中受热,迅速发生转化②生成红棕色粉末
C.加热发生转化⑥,加水溶解可实现转化③
D.由图可预测:高铁酸盐具有强氧化性,可用于消毒;消毒后可生成胶体,故可作净水剂
8.常温常压下,将等质量的氢气、甲烷、氧气、二氧化碳四种气体分别吹入四个气球,气球中气体为甲烷的是( )
A. B.
C. D.
9.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是( )
A.偏二甲肼的摩尔质量为60 g
B.6.02×1023个偏二甲肼分子的质量约为60 g
C.1 mol偏二甲肼的质量为60 g·mol-1
D.6 g偏二甲肼含有NA个偏二甲肼分子
10.下列各组物质反应后,再滴入KSCN溶液,显红色的是( )
A.过量铁与稀盐酸 B.过量氯水与FeCl2溶液
C.过量铁粉与CuCl2溶液 D.过量铁粉与FeCl3溶液
11.将质量为W1 g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向溶液中逐滴加入浓度为a mol·L 1的HCl溶液,过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L。将溶液蒸干充分灼烧得到固体(NaCl和Al2O3)W2 g.下列关系式中错误的是( )
A.24n(Al)+35.5n(Na)=W2 W1 B.n(Na)+3n(Al)=aV2
C.n(Na)+3n(Al)=V1/11.2 D.aV2=V1/22.4
12.在标准状况下,与9.6g氧气所占体积相同的二氧化碳的质量为( )
A.8.8 g B.13.2 g C.11 g D.15.4 g
13.实验室欲制备少量,可选择的方法是( )
A.与加热反应 B.与稀盐酸反应
C.与溶液反应 D.与溶液反应
14.当O2、SO2、SO3的质量比为2∶4∶5时,它们的物质的量之比为( )
A.2:4:5 B.1:2:3
C.1:1:1 D.2:2:3
15.设表示阿伏加德罗常数的值.下列说法正确的是( )
A.在加热条件下完全水解生成胶粒数为
B.水溶液中与离子数之和为
C.的乙酸和葡萄糖的混合物充分燃烧消耗分子数为
D.在标准状况下,三氯甲烷中含有的共价键数目为
16.在硫酸钠和硫酸铝的混合溶液中,Al3+的物质的量浓度为0.2mol·L-1,SO42-为0.4mol·L-1,溶液中Na+的物质的量浓度为( )
A.0.1 mol·L-1 B.0.2mol·L-1
C.0.3mol·L-1 D.0.4mol·L-1
二、综合题
17.现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙 ,F 。
(2)写出下列反应的离子方程式:
①金属A和水反应 。②红褐色沉淀C与物质E反应 。
③F与黄绿色气体乙反应 。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式 。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在 之间,验证的简单方法是: 。
18.某学生用Na2CO3和KHCO3组成的某混合物进行实验,测得如下几组数据(盐酸的物质的量浓度相等且不考虑HCl的挥发)。
实验序号 ① ② ③ ④
盐酸体积/mL 50 50 50 50
混合物质量/g 3.06 6.12 9.18 12.24
生成气体体积/L(标况) 0.672 1.344 1.568 1.344
请回答:
(1)原混合物样品中n(Na2CO3)︰n(KHCO3) = 。
(2)盐酸的物质的量浓度为
(3)实验④反应后,至少需继续加入 mL的该盐酸才能使12.24g的混合物全部反应。
19.现有金属单质A,B,C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)物质B的化学式为: 。
(2)气体甲在Cl2中燃烧的现象: ;
(3)金属A与G的水溶液反应的化学方程式: ;
(4)写出下列反应的离子方程式:
③: .
⑤: .
(5)将Na2O2投入到F溶液中,可以观察到的现象是: 。
20.已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
(1)该“84消毒液”的物质的量浓度约为 mol·L-1。(保留小数点后一位)
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)= mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是__(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2L2.3mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为 mol·L-1。
②需用浓硫酸的体积为 mL。
三、推断题
21.为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。
(1)往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色:A ,B 。
(2)写出上述过程中有关反应的化学方程式:Fe2O3→A ,A→B 。
(3)向B溶液中逐滴加入NaOH得到C,此过程中可观察到的现象是 。
(4)将A的饱和溶液滴入沸水中并不断加热,可制得 胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为 。
22.A,B,C,D 均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):
(1)若 D 是金属,C 溶液在储存时应加入少量 D,其理由是(用必要的文字和离子方程式 表示) 。
(2)若 A、B、C 为含同一种金属元素的无机化合物,请写出 B 转化为 C 的所有可能的离 子力程式: 。
答案解析部分
1.C
由题意可知,某人1L血液中含葡萄糖分子的数目约为5×10-3mol/L×1L×6.02×1023mol-1=3.01×1021,故C符合题意。
根据n=cV和N=nNA计算。
2.C
铁在空气中发生氧化后生成的氧化物是疏松状的,导致内部金属继续被腐蚀,而铝氧化生成的氧化膜结构致密,可阻止内部铝与空气的接触,抗腐蚀能力强,
故答案为:C。
金属铝在狂三其中在表面易被氧化成一薄层氧化物,组织内部金属的继续氧化。
3.D
A.制造下水井盖用的生铁主要是铁和碳的合金,故A不符合题意;
B.不锈钢主要是铁铬镍的合金,故B不符合题意;
C.储氢合金主要是稀土系、Laves 相系、镁系和钛系等合金,故C不符合题意;
D.有机发光材料属于有机物,不是合金,故D符合题意。
故答案为:D。
A.生铁是铁碳合金;
B.不锈钢主要是铁铬镍的合金;
C.储氢合金主要是稀土系、Laves 相系、镁系和钛系等合金。
4.C
有质量守恒可知,n(K+)=1.1mol,所以有1.1=0.3+2a,解得a=0.4mol,
故答案为:C。
根据原子守恒计算。
5.C
428gNH4Cl的物质的量为8mol;KCl、K2SO4、NH4Cl三种固体原料的物质的量之比为1∶4∶8;所以需要KCl 1mol,质量为74.5g、需要K2SO4 4mol,质量为696g,C符合题意。
故答案为:C
先求得NH4Cl的物质的量,再根据KCl、K2SO4、NH4Cl三种固体原料的物质的量之比,求得KCl、K2SO4物质的量,根据公式n=m/M,求得KCl、K2SO4的质量。
6.C
①铁离子与铁反应生成浅绿色的亚铁离子,①正确;
②铁离子与硫氰化钾溶液反应显示红色,据此能够检验铁离子,②正确;
③硫酸铜与氯化铁不发生反应,混合后溶液不会变成无色,③不正确;
④氯化铁与硝酸银反应生成白色氯化银沉淀,该性质不是铁离子的性质,④不正确;
⑤铁离子与氢氧化钠溶液反应生成红褐色氢氧化铁沉淀,据此可以检验是否存在铁离子,⑤正确;
综上,错误的是③④,C符合题意;
故答案为:C
①Fe与FeCl3反应生成FeCl2;
②Fe3+遇KSCN,溶液显红色;
③FeCl2与CuSO4不反应;
④溶液中Cl-与Ag+反应生成AgCl沉淀;
⑤Fe3+与OH-形成Fe(OH)3红褐色沉淀;
7.D
A.高温下,Fe与水蒸气发生反应:3Fe+4H2OFe3O4+4H2,A不符合题意;
B.FeO是一种黑色粉末,不稳定,在空气中加热发生反应:6FeO+O22Fe3O4,B不符合题意;
C.加热Fe(OH)3发生反应:2Fe(OH)3Fe2O3+3H2O,Fe2O3不溶于水,C不符合题意;
D.高铁酸盐中铁元素为+6价,具有强氧化性,因此可用于消毒,同时消毒后转化为Fe3+,可水解产生Fe(OH)3胶体,具有吸附性,可用作净水剂,D符合题意;
故答案为:D
A、高温下,Fe与水蒸气反应生成Fe3O4和H2;
B、FeO加热生成黑色固体Fe3O4;
C、Fe(OH)3加热分解成Fe2O3和H2O,Fe2O3与H2O不反应
D、H2FeO4中铁元素为+6价,具有氧化性,同时其水解可产生Fe(OH)3胶体;
8.C
根据阿伏加德罗定律可知同温同压下,相同质量的气体,体积之比与摩尔质量成反比,即摩尔质量越大,气体占有的体积越小。氢气、甲烷、氧气、二氧化碳四种气体的摩尔质量分别为2g/mol、16g/mol、32g/mol、44g/mol,所以同温同压下,氢气、甲烷、氧气、二氧化碳四种气体占有体积大小为:H2>CH4>CO2>O2,
故答案为:C。
根据阿伏加德罗定律可知,同温同压下,相同质量的气体,体积之比与摩尔质量之比成反比。
9.B
偏二甲肼的摩尔质量为60 g/mol;1 mol这种物质的质量为60 g;6 g偏二甲肼含有0.1NA个偏二甲肼分子。
本题考查的是摩尔质量、质量、伏伽德罗常数等于物质的量之间的关系。
10.B
A.铁与稀盐酸反应只生成FeCl2和H2,反应后所得溶液中存在Fe3+,A不符合题意;
B.Cl2具有氧化性,能将Fe2+氧化成Fe3+,反应后所得溶液中含有Fe3+,B符合题意;
C.过量铁粉与CuCl2溶液反应生成FeCl2和Cu,反应后溶液中不存在Fe3+,C不符合题意;
D.过量铁粉与FeCl3溶液反应生成FeCl2,反应后溶液中不存在Fe3+,D不符合题意;
故答案为:B
滴入KSCN溶液后,显红色,说明溶液中存在Fe3+,据此结合选项进行分析。
11.D
A.根据题意,Na最终以NaCl形式存在,质量增加为35.5n(Na);AlCl3在蒸干过程中水解为Al(OH)3和HCl,HCl挥发,最后蒸干产物为Al2O3,增加的质量为24n(Al),24n(Al)+35.5n(Na)=W2-W1,A不符合题意。
C.W1g的Na和Al经过和一定量的水反应,置换出了V1L H2,由电子得失守恒知:Na和Al完全反应变成Na+和Al3+失去的电子数应该等于生成的H2得到的电子数,则有n(Na)+3n(Al)=2V1/22.4,C不符合题意 ;
;溶液经过一系列的反应最终得到的溶液应该是NaCl和AlCl3的混合,因此;aV2可看成是盐酸中Cl元素的物质的量,由Cl元素守恒知aV2=n(Na)+3n(Al)=2V1/22.4。B不符合题意,D符合题意。
故答案为:D
解决本题的关键是利用守恒思想。此外要知道由于铝离子易水解,因此灼烧氯化铝最终得到的产物是氧化铝。
12.B
同温同压,相同体积的气体,物质的量相同;9.6g氧气的物质的量是 ,与9.6g氧气所占体积相同的二氧化碳的物质的量为0.3mol,质量为0.3mol×44g/mol=13.2 g,
故答案为:B。
依据同温同压,相同体积的气体,物质的量相同计算;
13.A
A.氯气氧化性较强,和铁反应生成氯化铁,A符合题意;
B.铁和稀盐酸反应生成氯化亚铁,B不符合题意;
C.铁和氯化铜发生置换反应生成铜和氯化亚铁,C不符合题意;
D.与溶液不反应,D不符合题意;
故答案为:A。
A.氯气氧化性较强,和铁反应生成氯化铁;
B.铁和稀盐酸反应生成氯化亚铁和氢气;
C.铁和氯化铜反应生成铜和氯化亚铁;
D.与溶液不反应。
14.C
根据题意,可以假设三者的质量分别为2克,4克,5克,所以根据公式可以计算其物质的量分别为2/32,4/64,5/80,三者化简后均为1/16,即物质的量相等。
故答案为:C
根据公式n=计算。
15.C
A.水解为可逆反应,且Fe(OH)3胶粒是由Fe(OH)3颗粒聚集形成的,因此1molFeCl3水解后形成的Fe(OH)3胶粒数小于1NA,A不符合题意;
B.由物料守恒可得,溶液中c(NH4+)+c(NH3·H2O)=1mol·L-1,因此溶液中NH4+与NH3·H2O的微粒数之和为1NA,B不符合题意;
C.乙酸的分子式为C2H4O2,葡萄糖的分子式为C6H12O6,二者的最简式都是CH2O,因此60g混合物的物质的量为2mol,其燃烧的化学方程式为:CH2O+O2CO2+H2O,因此2mol混合物完全燃烧,消耗2molO2,故消耗O2分子数为2NA,C符合题意;
D.标准状态下CHCl3不是气体,因此不能用气体摩尔体积进行计算,D不符合题意;
故答案为:C
A、水解反应为可逆反应;
B、结合物料守恒分析;
C、根据乙酸、葡萄糖燃烧的化学方程式计算;
D、标准状态下,CHCl3不是气态;
16.B
混合溶液呈现电中性,若忽略水解,则溶液呈现中性,阳离子所带正电荷的浓度等于阴离子所带负电荷的浓度,有3c(Al3+)+c(Na+)=2c(SO42-),代入数据,c(Na+)=2×0.4-3×0.2mol·L-1=0.2 mol·L-1;
故答案为:B。
根据溶液中电荷守恒计算钠离子的物质的量浓度,注意离子所带电荷数。
17.(1)Cl2;FeCl2
(2)2Na+2H2O=2Na++2OH﹣+H2↑;Fe(OH)3+3H+=Fe3++3H2O;2Fe2++Cl2=2Fe3++2Cl﹣;Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
(3)1~100nm;是否有丁达尔现象
食盐中的金属元素是Na,所以金属A是Na,Na和水反应生成NaOH和氢气,黄绿色气体乙为Cl2,与Cl2反应的气体甲为H2,丙为HCl,物质E为盐酸,金属A与水反应生成的D为NaOH,盐酸与金属B反应,生成产物F和气体甲为氢气,金属B与氯气反应生成的G与D氢氧化钠反应生成红褐色沉淀为氢氧化铁,则金属B为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,C为Fe(OH)3。(1)由以上分析可知,乙为Cl2,F为FeCl2;(2)①金属A为钠和水反应生成NaOH和H2,离子方程式为:2Na+2H2O=2Na++2OH-+ H2↑;
②红褐色沉淀C与物质E反应是氢氧化铁和盐酸溶液反应生成氯化铁和水,反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O;③F是FeCl2,FeCl2与Cl2反应生成氯化铁,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;④氯气是大气污染物,在实验室中通常是用氢氧化钠溶液来吸收,反应的离子方程式:Cl2+2 OH-=Cl-+ClO-+H2O;(3)将FeCl3溶液逐滴加入到沸水中,继续加热至液体变为红褐色,停止加热,得到的就是氢氧化铁胶体,该液体中的分散质粒子直径在1~100nm之间,验证的简单方法是:用光线照射,看是否产生丁达尔现象,若产生,则该物质就是胶体。
金属A是食盐中的元素为Na元素,Na和水反应生成氢氧化钠和氢气,黄绿色气体乙为Cl2,则与Cl2反应的气体甲为H2,丙为HCl,物质E为盐酸,金属A与水反应生成的D为NaOH,盐酸与金属B反应,生成的产物F和气体甲为氢气,金属B与氯气反应生成的G与D氢氧化钠反应生成红褐色沉淀为氢氧化铁,则金属B为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,C为Fe(OH)3,结合物质的性质分析解答。
18.(1)1:2
(2)2mol/L
(3)30
(1)实验①中混合物全部反应,设Na2CO3和KHCO3的物质的量分别是xmol、ymol,则x+y=0.672÷22.4、106x+100y=3.06,解得x=0.01,y=0.02,则原混合物样品中n(Na2CO3):n(KHCO3)=1:2;
(2)根据①③中数据可知在反应③中盐酸不足,其中二氧化碳是0.07mol,碳酸钠是0.03mol,碳酸氢钾是0.06mol,由于碳酸钠首先与盐酸反应,则反应③中消耗盐酸是0.03mol+0.07mol=0.1mol,所以盐酸的浓度是0.1mol÷0.05L=2mol/L;
(3)根据以上分析可知反应④中碳酸钠是0.04mol,碳酸氢钾是0.08mol,完全反应需要盐酸是0.04mol×2+0.08mol=0.16mol,盐酸的体积是80mL,所以实验④反应后,至少需继续加入30mL的该盐酸溶液才能把12.24g的混合物全部反应。
(1)混合物的计算,可以结合二元一次方程组判断,设其中一种物质的物质的量为x,另一种物质的物质的量为y,根据提供的数据列出相应的式子;
(2)结合二氧化碳和碳酸钠的物质的量计算盐酸的物质的量,推测其浓度;
(3)结合碳酸钠和碳酸氢钾的物质的量,以及盐酸的体积计算。
19.(1)Al
(2)有苍白色火焰,瓶口有白雾
(3)6Na+2FeCl3+6H2O=2Fe(OH)3↓+6NaCl+3H2↑
(4)2OH﹣+2H2O+2Al=2AlO2﹣+3H2↑;Cl2+2Fe2+=2Fe3++2Cl﹣
(5)生成红褐色沉淀,有无色气体产生
根据分析可知A是Na,B是Al,C是Fe,D是NaOH,E是盐酸,F是FeCl2,G是FeCl3,H是Fe(OH)3,甲是H2,丙是HCl。则(1)物质B是铝,化学式为Al。
(2)氢气在Cl2中燃烧生成氯化氢,则现象为有苍白色火焰,瓶口有白雾;(3)金属钠极易与水反应生成氢氧化钠和氢气,生成的氢氧化钠再与氯化铁反应,则与氯化铁溶液反应的化学方程式6Na+2FeCl3+6H2O=2Fe(OH)3↓+6NaCl+3H2↑;
(4)写出下列反应的离子方程式:③是Al与NaOH溶液发生反应生成偏铝酸钠和氢气,反应的离子方程式是2OH-+2H2O+2Al=2AlO2-+3H2↑。⑤是氯气氧化氯化亚铁生成氯化铁,离子方程式为Cl2+2Fe2+=2Fe3++2Cl﹣;
(5)过氧化钠具有强氧化性,溶于水与水反应生成氢氧化钠和氧气,则将Na2O2投入到氯化亚铁溶液中,可以观察到的现象是生成红褐色沉淀,有无色气体产生。
根据红褐色沉淀H为突破口,确定H是氢氧化铁,金属单质A与水反应的产物D的焰色反应为黄色,确定含有钠元素,进而推断A是金属钠,物质G含有铁离子,结合转化关系推出其他物质即可。
20.(1)4.0
(2)0.04
(3)C
(4)4.6;250
(1)由c= 得,c(NaClO)= ≈4.0(mol·L-1)。(2)稀释前后溶液中NaClO的物质的量不变,则有:100 mL×10-3L·mL-1×4.0 mol·L-1=100 mL×100×10-3L·mL-1×c(NaClO),解得稀释后c(NaClO)=0.04 mol·L-1,c(Na+)=c(NaClO)=0.04 mol·L-1。(3)选项A,需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A、B不需要,但还需玻璃棒和胶头滴管。选项B,配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用。选项C,未洗涤烧杯和玻璃棒将导致配制的溶液中溶质的物质的量减小,结果偏低。选项D,应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol·L-1×74.5 g·mol-1=149.0 g(4)①根据H2SO4的组成可知,溶液中c(H+)=2c(H2SO4)=4.6 mol·L-1。②2 000 mL 2.3 mol·L-1的稀硫酸中溶质的物质的量为2 L×2.3 mol·L-1=4.6 mol,设需要98%(密度为1.84 g·cm-3)的浓硫酸的体积为V mL,则有: =4.6 mol,解得V=250。
(1)根据c= 计算消毒液的物质的量浓度;
(2)根据稀释前后溶质的质量不变来分析即可;
(3)根据配制一定物质的量浓度溶液的操作选择适当的仪器;
(4)根据硫酸的浓度可知 H+的物质的量浓度;先计算出稀硫酸中溶质的物质的量,进而求得浓硫酸的体积。
21.(1)红色;浅绿色
(2)Fe2O3 + 6HCl= 2FeCl3+ 3H2O;2FeClЗ+ Fe =3FeCl2
(3)白色沉淀变为灰绿色最后变为红褐色
(4)氢氧化铁;丁达尔效应
(1)氧化铁和酸反应三价铁盐和水,三价铁离子遇到硫氰酸钾显示红色;金属铁可以和三价铁化和生成亚铁离子,亚铁离子遇到硫氰酸钾不变色,故答案为:红色;浅绿色;
(2)氧化铁和盐酸反应生成对应的盐氯化铁和水,即 Fe2O3 + 6HCl= 2FeCl3+ 3H2O,金属铁可以还原三价铁生成亚铁离子,即2FeClЗ+ Fe =3FeCl2,故答案为:
Fe2O3 + 6HCl= 2FeCl3+ 3H2O;
2FeClЗ+ Fe =3FeCl2;
(3)亚铁离子和氢氧根离子反应先产生白色沉淀,迅速变成灰绿色,最后变为红褐色,所以 B 到C 可看到的现象是:白色沉淀变为灰绿色最后变为红褐色。
(4)将氯化铁滴入沸水中,可以获得氢氧化铁胶体,所有的胶体均具有丁达尔效应,故答案为:氢氧化铁;丁达尔效应。
(1)铁离子遇硫氰化钾变为红色,亚铁离子遇硫氰化钾不变色;
(2)氧化铁和焰色反应生成氯化铁和水;氯化铁和铁反应生成氯化亚铁;
(3)亚铁离子遇氢氧根生成白色氢氧化亚铁,然后迅速变为灰绿色,最后变为红褐色的氢氧化铁;
(4)胶体具有丁达尔效应。
22.(1)加入少量铁,防止 Fe2+被氧化为 Fe3+:2Fe3++Fe ═ 3Fe2+
(2)Al(OH)3+3H+ ═ Al3++3H2O、Al(OH)3+OH- ═ AlO2-+2H2O
(1)若 D 是金属,说明金属具有变价,C 溶液在储存时应加入少量 D,说明C中含有Fe2+, A稀溶液具有氧化性, 推断为HNO3Fe(NO3)3Fe(NO3)2,则D为Fe, Fe(NO3)2不稳定被氧化而变质,可加入铁防止被氧化生成硝酸铁,离子方程式为2Fe3++Fe ═ 3Fe2+。故答案为:加入少量铁,防止 Fe2+被氧化为 Fe3+:2Fe3++Fe ═ 3Fe2+。
(2)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B.判断为: Al3+→Al(OH)3→AlO2-; B转化为C的所有可能的离子方程式为生成氢氧化铝沉淀,在酸溶解的离子方程式是: Al(OH)3+3H+ ═ Al3++3H2O、Al(OH)3+OH- ═ AlO2-+2H2O;因此,本题正确答案是: Al(OH)3+3H+ ═ Al3++3H2O、Al(OH)3+OH- ═ AlO2-+2H2O
(1)若 D 是金属,说明金属具有变价,C 溶液在储存时应加入少量 D,说明C中含有Fe2+,A稀溶液具有氧化性, 推断为HNO3Fe(NO3)3Fe(NO3)2,则D为Fe;据此分析;
(2)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B,判断为: Al3+→Al(OH)3→AlO2-;据此结合铝三角的相关转化进行分析
