专题2 原子结构与元素性质 单元测试卷(含解析) 2022-2023学年高二下学期化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题2 原子结构与元素性质 单元测试卷(含解析) 2022-2023学年高二下学期化学苏教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 351.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-25 09:15:31 | ||
图片预览



文档简介
专题2《原子结构与元素性质》单元测试卷
一、单选题
1.常用氨基乙酸钠(NH2CH2COONa)合成工业洗涤剂的中间体。下列说法正确的是
A.半径大小:r(O2-)<r(Na+) B.电负性大小:χ(N)<χ(C)
C.电离能大小:I1(O)<I1(N) D.稳定性大小:H2O<NH3
2.某元素原子的价电子构型是3s23p4,则它在周期表中的位置是
A.第四周期ⅡA族 B.第三周期ⅣA族
C.第三周期ⅥA族 D.第二周期ⅣA族
3.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是
A.CO2的电子式是
B.Cl-的结构示意图
C.乙烯的结构简式是C2H4
D.K原子的价层电子排布是1s22s22p63s23p64s1
4.下列属于氟原子激发态的电子排布式且能量较高的是
A. B. C. D.
5.下列“实验结论”与“实验操作及现象”不相符的一组是
实验操作及现象 实验结论
A 向紫色石蕊溶液中滴加氯水,溶液先变红后褪色 氯水具有酸性和漂白性
B 向某溶液中滴加AgNO3溶液,产生白色沉淀 该溶液中一定含有Cl-
C 向新制的氯水中加入含淀粉的KI溶液,溶液变蓝色 氧化性:Cl2>I2
D 把绿豆大的Na和K分别投入水中,K与水反应更剧烈 金属性:NaA.A B.B C.C D.D
6.下列说法正确的是
A.原子最外层电子的电子云轮廓图为
B.基态的核外电子排布式为
C.的价电子的轨道表示式:
D.砷原子的原子结构示意图:
7.有短周期A、B、C、D四种元素,A、B同周期,C、D同主族,已知A的阳离子与D的阴离子具有相同的电子层结构,B的阴离子和C的阴离子电子层结构相同,且C离子的核电荷数高于B离子,电负性顺序正确的是
A.A>B>C>D B.D>C>B>A
C.C>D>B>A D.A>B>D>C
8.已知锰的核电荷数为25,以下是一些同学绘制的基态锰原子的电子排布图,其中最能准确表示基态锰原子核外电子运动状态的是
A.
B.
C.
D.
9.关于原子结构的下列说法中错误的是
A.电子云图中小点越密,表明概率密度越大
B.基态Cu原子的价电子排布式为,属于ds区
C.有3个价电子的元素不一定是主族元素
D.在一个基态多电子原子中,不可能有两个能量完全相同的电子
10.X、Y、Z、W是原子序数依次增大的短周期主族元素,X为地壳中含量最高的元素,Y、Z相邻,Y原子最外层电子数是X原子内层电子数的2倍,W与X同主族,下列说法正确的是
A.半径大小:r(X)B.电负性大小:χ(Y)<χ(Z)<χ(W)
C.电离能大小:I1(Y)D.氢化物的稳定性:X11.有一种物质的名称叫碘酸碘,其中碘元素的化合价有+3和+5价两种,则碘酸碘的化学式应该是
A.I2O4 B.I3O5 C.I4O7 D.I4O9
12.下列装置或操作一定能达到实验目的的是
A B C D
比较金属M和N的活动性 验证酸性: 验证碱性:NaOH> 验证氧化性:
A.A B.B C.C D.D
13.2022年4月16日,神舟十三号飞船回到地球,第一次在轨飞行半年,创造了我国宇航员在轨时间的记录。下列有关说法错误的是
A.宇航服的材料聚四氟乙烯属于有机高分子材料
B.空间站上太阳能电池板的主要材料为硅
C.空间站推进器的推进剂氙气(Xe)的组成元素位于第四周期0族
D.航天员食品中的优质蛋白质含有C、H、O、N、S等元素
14.X、Y、Z为短周期主族元素,X原子的M层只有一个电子;Y、Z位于同一主族,且Z的单质为黄绿色气体,下列说法不正确的是
A.简单离子半径大小: B.第一电离能大小:
C.元素的电负性大小: D.简单气态氢化物的稳定性:
15.下列各组多电子原子的原子轨道能量比较不正确的是
A.4s>3d B.4px>3pz C.4p>3p D.2s<2p
二、填空题
16.Be和B的第一电离能(I1)如表所示。I1(Be)>I1(B)的原因是___________。
I1/(kJ·mol-1)
Be 900
B 801
17.某核素R具有微弱的放射性,其原子核内中子数比质子数多43,由它组成的固体单质R在一定条件下的密度为。研究表明:在边长为的立方体中含有20个R原子。请回答下列问题:
(1)R的摩尔质量为_______。
(2)R原子的价电子排布式是_______。
(3)R位于元素周期表中第_______周期第_______族,属于_______区元素。
三、实验题
18.某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
实验 序号 锌的质量/g 锌的状态 c(H2SO4) /mol·L-1 V(H2SO4) /mL 反应前溶 液的温度/℃ 添加剂
1 0.65 粒状 0.5 50 20 无
2 0.65 粉末 0.5 50 20 无
3 0.65 粒状 0.5 50 20 2滴CuSO4溶液
4 0.65 粉末 0.8 50 20 无
5 0.65 粉末 0.8 50 35 2滴CuSO4溶液
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定______________________进行判断,其速率最快的实验是________(填实验序号)。
(2)对锌和稀硫酸反应,实验1和2表明,________对反应速率有影响;实验1和3表明,________对反应速率有影响。
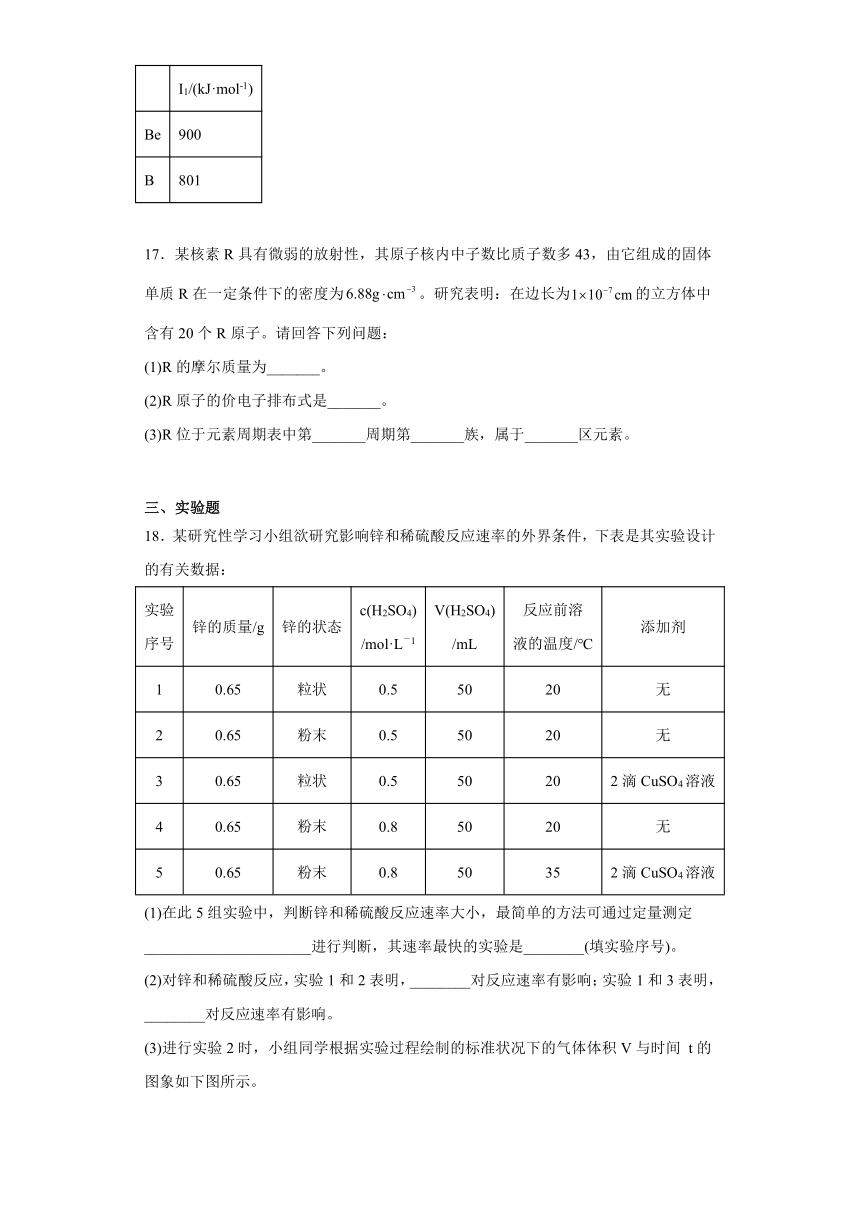
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间 t的图象如下图所示。
①在OA、AB、BC三段中反应速率最快的是________,原因是______________________。
②2~4 min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)为________________________________________________________________________。
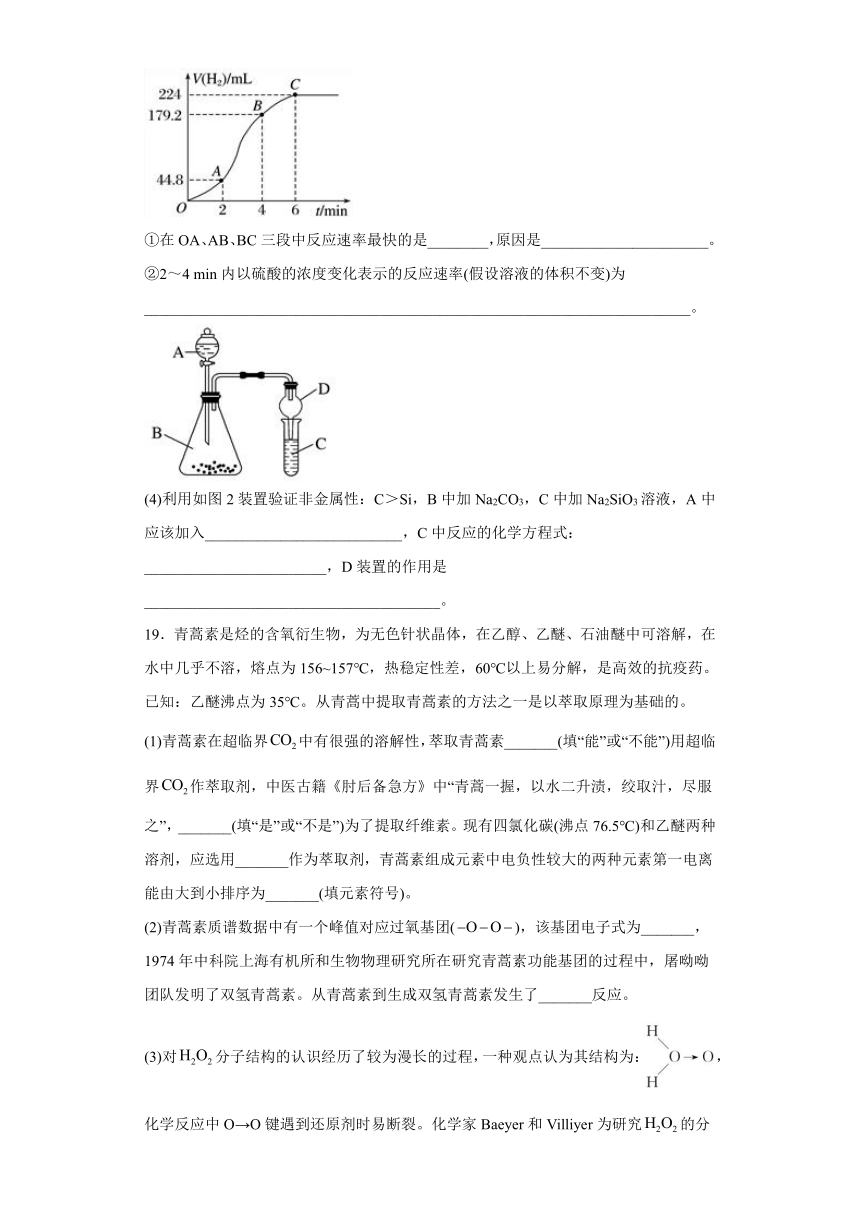
(4)利用如图2装置验证非金属性:C>Si,B中加Na2CO3,C中加Na2SiO3溶液,A中应该加入__________________________,C中反应的化学方程式:________________________,D装置的作用是_______________________________________。
19.青蒿素是烃的含氧衍生物,为无色针状晶体,在乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,60℃以上易分解,是高效的抗疫药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的。
(1)青蒿素在超临界中有很强的溶解性,萃取青蒿素_______(填“能”或“不能”)用超临界作萃取剂,中医古籍《肘后备急方》中“青蒿一握,以水二升渍,绞取汁,尽服之”,_______(填“是”或“不是”)为了提取纤维素。现有四氯化碳(沸点76.5℃)和乙醚两种溶剂,应选用_______作为萃取剂,青蒿素组成元素中电负性较大的两种元素第一电离能由大到小排序为_______(填元素符号)。
(2)青蒿素质谱数据中有一个峰值对应过氧基团(),该基团电子式为_______,1974年中科院上海有机所和生物物理研究所在研究青蒿素功能基团的过程中,屠呦呦团队发明了双氢青蒿素。从青蒿素到生成双氢青蒿素发生了_______反应。
(3)对分子结构的认识经历了较为漫长的过程,一种观点认为其结构为:,化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究的分子结构,设计并完成了下列实验:
a.将与浓反应生成和水
b.将制得的与反应,只生成A和
c.将生成的A与反应(已知该反应中作还原剂)
①如果该观点认为的的分子结构是正确的,实验c中化学反应方程式为(A写结构简式)_______。
②为了进一步确定的结构,还需要在实验c后添加一步实验d,设计d的实验方案:_______。
四、计算题
20.某金属元素X原子的核外电子数等于核内中子数,取该元素的单质0.6 g与足量的氧气充分反应,可得到1.0 g氧化物XO。试通过计算推导出该元素在元素周期表中的位置。
试卷第2页,共6页
参考答案:
1.C
【详解】A.比较粒子半径,当核外电子层相同时,核电荷数越大,粒子半径越小,所以r(Na+)<r(O2-),A错误;
B.同周期元素,从左到右电负性增强,所以χ(N)>χ(C),B错误;
C.同周期元素,从左到右第一电离能增强,但VA大于VIA,I1(O)<I1(N),C正确;
D.同周期元素,从左到右简单气态氢化物稳定性增强,H2O>NH3,D错误;
故答案为:C。
2.C
【详解】从价电子构型看出该元素有三个电子层,最外层有6个电子,所以在元素周期表中的位置是第三周期ⅥA族,选C。
3.B
【解析】略
4.C
【详解】由题干选项可知,A、C为F原子的激发态,而C为2个2p上的电子激发到3p上,A为1个2p上的电子激发到3s上,故C比A的能量更高,B为Ne原子的激发态,D为B原子的激发态,故答案为:C。
5.B
【详解】A.滴加氯水,溶液先变红,随后褪色,氯水含HCl、HClO,HClO具有漂白性可使溶液褪色,故A符合;
B.白色沉淀可能为AgCl也可能是Ag2CO3,则溶液中不一定含有Cl-,故B不符合;
C.氯水中的Cl2与KI发生反应生成碘单质,碘单质遇到淀粉变蓝,可说明氯气的氧化性大于碘单质,故C符合;
D.金属性越强、与水反应越剧烈,由操作和现象可知,金属性:Na<K,故D符合;
故选:B。
6.C
【详解】A.原子最外层电子2s电子云轮廓图为球形,A错误;
B.基态的核外电子排布式为,B错误;
C.的价电子为3d5,其轨道表示式:,C正确;
D.砷元素位于第四周期第VA族,其原子结构示意图为,D错误;
故选C。
7.B
【详解】根据题意可知A、B、C处于同一周期,且原子序数C>B>A,C、D处于同一主族,且C在D的下一周期。据此分析画出A、B、C、D在周期表中相对位置关系为,然后依据同周期、同主族元素电负性变化规律即可确定其电负性顺序:D>C>B>A,答案选B。
8.D
【详解】基态锰原子的电子排布式为1s22s22p63s23p63d54s2,原子轨道的能量由低到高的顺序为1s、2s、2p、3s、3p、4s、3d,其中3d能级上排布了5个电子,为半充满状态,5个电子分别占据不同的轨道,且自旋状态相同。
A.3d能级上的电子排布不对,违反了洪特规则;
B.s能级上两个电子的自旋状态应相反;
C.3d能级上电子排布不对;违反了洪特规则;
只有D项正确。
9.D
【详解】A.电子云图中黑点密度表示电子出现的几率,小点越密,表明概率密度越大,A项正确;
B.Cu的原子序数为29,基态Cu原子的价电子排布式为,属于ds区,B项正确;
C.有3个价电子的元素不一定是主族元素,如钪的价电子排布式为:,有3个价电子,位于IIIB族,C项正确;
D.每个轨道中最多可以填充两个电子,这两个电子自旋相反,能量完全相同,D项错误;
答案选D。
10.B
【分析】X、Y、Z、W是原子序数依次增大的短周期主族元素,X为地壳中含量最高的元素,则X为O元素;Y、Z相邻,Y原子最外层电子数是X原子内层电子数的2倍,则Y为Si元素、Z为P元素;W与X同主族,则W为S元素。
【详解】A.同周期元素,从左到右原子半径依次减小,则硅原子的原子半径大于硫原子,故A错误;
B.同周期元素,从左到右元素的非金属性依次增强,电负性依次增大,则电负性由小到大的顺序为SiC.同周期元素,从左到右第一电离能呈增大趋势,磷原子的3p轨道为稳定的半充满结构,元素的第一电离能大于相邻元素,则第一电离能由大到小的顺序为SiD.同周期元素,从左到右元素的非金属性依次增强,氢化物的稳定性依次增强,同主族元素,从上到下元素的非金属性依次减弱,氢化物的稳定性依次减弱,则氢化物的稳定性由弱到强的顺序为PH3故选B。
11.D
【详解】氯元素与碘元素处于同一主族,元素化合物结构与性质相似,氯酸钾为KClO3,所以碘酸根为,碘酸根中I为+5价,则碘酸碘为I(IO3)3,其化学式为I4O9,故选D;
答案选D。
12.C
【详解】A.利用原电池原理比较金属活动性,应该用稀硫酸作电解质溶液,A项错误;
B.硝酸具有挥发性,挥发的气体溶于溶液,会发生反应,因此不能证明酸性:>,B项错误;
C.锥形瓶中与NaOH反应生成,进入试管中使湿润的红色石蕊试纸变蓝,可以证明碱性:,C项正确;
D.可以将氧化,但没有挥发性,淀粉KI溶液变色无法证明氧化性:,D项错误;
故选C。
13.C
【详解】A.聚氯乙烯是由有机物氯乙烯聚合而成的高分子,属于有机高分子材料,选项A正确;
B.太阳能电池板的主要材料为单质Si,选项B正确;
C.Xe元素位于第五周期0族,氙气属于稀有气体,选项C错误;
D.蛋白质分子中含有C、H、O、N四种元素,常含有S元素,选项D正确;
答案选C。
14.A
【分析】X、Y、Z为短周期主族元素,X原子的M层只有一个电子,X是Na元素,Y、Z位于同一主族,且Z的单质为黄绿色气体,Z是Cl元素,Y是F元素。
【详解】A.电子层结构相同的离子,核电荷数越大,离子半径越小,而离子的电子层越多,离子半径越多,故离子半径:Cl->F->Na+,A错误;
B.同周期主族元素随原子序数增大,第一电离能呈增大趋势,同主族自上而下第一电离能减小,故第一电离F>Cl>Na,B正确;
C.同周期主族元素自左而右电负性增大,同主族自上而下电负性减小,故电负性F>Cl>Na,C正确;
D.元素非金属性F> Cl,故氢化物稳定性: HF> HCl,D正确;
故选A。
15.A
【详解】A.根据构造原理,各能级能量由低到高的顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s……由此可知原子轨道能量4s<3d,A项错误;
B.电子的能层越大,电子的能量越大,同一能级上的原子轨道具有相同的能量。故原子轨道能量:4px=4pz>3pz,B项正确;
C.电子的能层越大,电子的能量越大,故原子轨道能量:4p>3p,C项正确;
D.相同电子层上原子轨道能量s<p,D项正确;
答案选A。
16.Be的核外电子排布为1s22s2,为全满稳定结构,第一电离能更大
【详解】同周期从左往右,第一电离能呈增大趋势,但Be的外电子排布为1s22s2,为全满稳定结构,第一电离能更大。
17. 207g mol-1 六 IVA p
【分析】利用边长为的立方体中含有20个R原子,结合R单质的密度,可求其摩尔质量,根据原子核内中子数比质子数多43,进而求得R的质子数(原子序数),据此作答。
【详解】(1) R的摩尔质量;
(2) R的质量数为207,其中子数比质子数多43,故R的质子数为=82,R为铅元素,位于第六周期第ⅣA族,R原子的价电子排布式是;
(3) R为铅元素位于第六周期第ⅣA族,属于p区元素;
18. 锌完全消失所需的时间 5 固体反应物的表面积 (是否形成)原电池 AB 反应放热,使温度升高,反应速率加快 0.06 mol·L-1·min-1 稀硫酸 CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3 防止倒吸
【详解】(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定锌完全消失所需的时间来判断,其中第5组实验时温度最高,浓度最大,也滴加了硫酸铜溶液,利用了Zn-Cu原电池,因此反应速率最快;
(2)实验1和2除锌的状态不同外,其余均相同,应考查硫酸的固体反应物的表面积对速率的影响,实验3比1多了形成Zn-Cu原电池,因此考查影响速率的因素是否形成原电池;
(3)①从图中看出2-4分钟内产生氢气最多,故这段时间内反应速率最大,因为反应放热,使温度升高,反应速率加快,故三段中反应速率最快的是AB;
②2-4分钟内,产生氢气179.2-44.8=134.4mL,物质的量为=6×10-3mol,根据反应方程式:Zn+H2SO4=ZnSO4+H2↑可知,参加反应硫酸的物质的量为:6×10-3mol,v(H2SO4)===0.06mol L-1 min-1;
(4)利用如图2装置验证非金属性:C>Si,B中加Na2CO3,C中加Na2SiO3溶液,可利用非金属性越强,其最高价氧化物对应水化物的酸性越强来比较,即强酸制取弱酸,为防止影响C中非金属性强弱判断,A中应该加入难挥发的稀硫酸,C中反应的化学方程式:CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3,D装置的作用是防止倒吸。
19.(1) 能 不是 乙醚 O>C
(2) 加成反应(或还原反应)
(3) +H2→C2H5OC2H5+H2O 用无水硫酸铜检验c的反应产物中有没有水
【分析】用乙醚萃取出青蒿素,之后过滤得到提取液,再通过蒸馏的方式分离乙醚和粗品。
(1)
青蒿素在超临界中有很强的溶解性,则能用超临界作萃取剂萃取青蒿素;“青蒿一握,以水二升渍,绞取汁,尽服之”不是为了提取纤维素,而是为了提取青蒿素;青蒿素60℃以上易分解,四氯化碳沸点76.5℃,乙醚沸点为35℃,萃取之后需要蒸馏分离萃取剂和青蒿素,因此应选择乙醚作萃取剂;青蒿素是烃的含氧衍生物,含有C、H、O三种元素,元素的非金属性越强,其电负性越大,则青蒿素中电负性较大的两种元素为C、O,同一周期元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,则第一电离能:O>C,故答案为:能;不是;乙醚;O>C;
(2)
中两个氧之间有一对共用电子对,另外两个氧还各有一个单电子,其电子式为;青蒿素发生加成反应(或还原反应)生成双氢青蒿素,故答案为:;加成反应(或还原反应);
(3)
①与反应,只生成A和,根据质量守恒可知A的分子式为C4H10O2,则A的结构简式为,与H2发生反应+H2→C2H5OC2H5+H2O,故答案为:+H2→C2H5OC2H5+H2O;
②若的结构为,O→O键遇到还原剂时易断裂,实验c的产物中含有水,可用无水硫酸铜检验水,为了进一步确定的结构,实验d为用无水硫酸铜检验c的反应产物中有没有水,故答案为:用无水硫酸铜检验c的反应产物中有没有水。
20.第三周期ⅡA族
【详解】设X的相对原子质量为Ar,则由题意知:
,解得Ar=24
由该元素的原子核外电子数等于核内中子数可知,该元素原子的质子数与中子数相等,所以X的原子序数为12,该元素是Mg,位于周期表的第三周期ⅡA族
一、单选题
1.常用氨基乙酸钠(NH2CH2COONa)合成工业洗涤剂的中间体。下列说法正确的是
A.半径大小:r(O2-)<r(Na+) B.电负性大小:χ(N)<χ(C)
C.电离能大小:I1(O)<I1(N) D.稳定性大小:H2O<NH3
2.某元素原子的价电子构型是3s23p4,则它在周期表中的位置是
A.第四周期ⅡA族 B.第三周期ⅣA族
C.第三周期ⅥA族 D.第二周期ⅣA族
3.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是
A.CO2的电子式是
B.Cl-的结构示意图
C.乙烯的结构简式是C2H4
D.K原子的价层电子排布是1s22s22p63s23p64s1
4.下列属于氟原子激发态的电子排布式且能量较高的是
A. B. C. D.
5.下列“实验结论”与“实验操作及现象”不相符的一组是
实验操作及现象 实验结论
A 向紫色石蕊溶液中滴加氯水,溶液先变红后褪色 氯水具有酸性和漂白性
B 向某溶液中滴加AgNO3溶液,产生白色沉淀 该溶液中一定含有Cl-
C 向新制的氯水中加入含淀粉的KI溶液,溶液变蓝色 氧化性:Cl2>I2
D 把绿豆大的Na和K分别投入水中,K与水反应更剧烈 金属性:Na
6.下列说法正确的是
A.原子最外层电子的电子云轮廓图为
B.基态的核外电子排布式为
C.的价电子的轨道表示式:
D.砷原子的原子结构示意图:
7.有短周期A、B、C、D四种元素,A、B同周期,C、D同主族,已知A的阳离子与D的阴离子具有相同的电子层结构,B的阴离子和C的阴离子电子层结构相同,且C离子的核电荷数高于B离子,电负性顺序正确的是
A.A>B>C>D B.D>C>B>A
C.C>D>B>A D.A>B>D>C
8.已知锰的核电荷数为25,以下是一些同学绘制的基态锰原子的电子排布图,其中最能准确表示基态锰原子核外电子运动状态的是
A.
B.
C.
D.
9.关于原子结构的下列说法中错误的是
A.电子云图中小点越密,表明概率密度越大
B.基态Cu原子的价电子排布式为,属于ds区
C.有3个价电子的元素不一定是主族元素
D.在一个基态多电子原子中,不可能有两个能量完全相同的电子
10.X、Y、Z、W是原子序数依次增大的短周期主族元素,X为地壳中含量最高的元素,Y、Z相邻,Y原子最外层电子数是X原子内层电子数的2倍,W与X同主族,下列说法正确的是
A.半径大小:r(X)
C.电离能大小:I1(Y)
A.I2O4 B.I3O5 C.I4O7 D.I4O9
12.下列装置或操作一定能达到实验目的的是
A B C D
比较金属M和N的活动性 验证酸性: 验证碱性:NaOH> 验证氧化性:
A.A B.B C.C D.D
13.2022年4月16日,神舟十三号飞船回到地球,第一次在轨飞行半年,创造了我国宇航员在轨时间的记录。下列有关说法错误的是
A.宇航服的材料聚四氟乙烯属于有机高分子材料
B.空间站上太阳能电池板的主要材料为硅
C.空间站推进器的推进剂氙气(Xe)的组成元素位于第四周期0族
D.航天员食品中的优质蛋白质含有C、H、O、N、S等元素
14.X、Y、Z为短周期主族元素,X原子的M层只有一个电子;Y、Z位于同一主族,且Z的单质为黄绿色气体,下列说法不正确的是
A.简单离子半径大小: B.第一电离能大小:
C.元素的电负性大小: D.简单气态氢化物的稳定性:
15.下列各组多电子原子的原子轨道能量比较不正确的是
A.4s>3d B.4px>3pz C.4p>3p D.2s<2p
二、填空题
16.Be和B的第一电离能(I1)如表所示。I1(Be)>I1(B)的原因是___________。
I1/(kJ·mol-1)
Be 900
B 801
17.某核素R具有微弱的放射性,其原子核内中子数比质子数多43,由它组成的固体单质R在一定条件下的密度为。研究表明:在边长为的立方体中含有20个R原子。请回答下列问题:
(1)R的摩尔质量为_______。
(2)R原子的价电子排布式是_______。
(3)R位于元素周期表中第_______周期第_______族,属于_______区元素。
三、实验题
18.某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
实验 序号 锌的质量/g 锌的状态 c(H2SO4) /mol·L-1 V(H2SO4) /mL 反应前溶 液的温度/℃ 添加剂
1 0.65 粒状 0.5 50 20 无
2 0.65 粉末 0.5 50 20 无
3 0.65 粒状 0.5 50 20 2滴CuSO4溶液
4 0.65 粉末 0.8 50 20 无
5 0.65 粉末 0.8 50 35 2滴CuSO4溶液
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定______________________进行判断,其速率最快的实验是________(填实验序号)。
(2)对锌和稀硫酸反应,实验1和2表明,________对反应速率有影响;实验1和3表明,________对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间 t的图象如下图所示。
①在OA、AB、BC三段中反应速率最快的是________,原因是______________________。
②2~4 min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)为________________________________________________________________________。
(4)利用如图2装置验证非金属性:C>Si,B中加Na2CO3,C中加Na2SiO3溶液,A中应该加入__________________________,C中反应的化学方程式:________________________,D装置的作用是_______________________________________。
19.青蒿素是烃的含氧衍生物,为无色针状晶体,在乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,60℃以上易分解,是高效的抗疫药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的。
(1)青蒿素在超临界中有很强的溶解性,萃取青蒿素_______(填“能”或“不能”)用超临界作萃取剂,中医古籍《肘后备急方》中“青蒿一握,以水二升渍,绞取汁,尽服之”,_______(填“是”或“不是”)为了提取纤维素。现有四氯化碳(沸点76.5℃)和乙醚两种溶剂,应选用_______作为萃取剂,青蒿素组成元素中电负性较大的两种元素第一电离能由大到小排序为_______(填元素符号)。
(2)青蒿素质谱数据中有一个峰值对应过氧基团(),该基团电子式为_______,1974年中科院上海有机所和生物物理研究所在研究青蒿素功能基团的过程中,屠呦呦团队发明了双氢青蒿素。从青蒿素到生成双氢青蒿素发生了_______反应。
(3)对分子结构的认识经历了较为漫长的过程,一种观点认为其结构为:,化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究的分子结构,设计并完成了下列实验:
a.将与浓反应生成和水
b.将制得的与反应,只生成A和
c.将生成的A与反应(已知该反应中作还原剂)
①如果该观点认为的的分子结构是正确的,实验c中化学反应方程式为(A写结构简式)_______。
②为了进一步确定的结构,还需要在实验c后添加一步实验d,设计d的实验方案:_______。
四、计算题
20.某金属元素X原子的核外电子数等于核内中子数,取该元素的单质0.6 g与足量的氧气充分反应,可得到1.0 g氧化物XO。试通过计算推导出该元素在元素周期表中的位置。
试卷第2页,共6页
参考答案:
1.C
【详解】A.比较粒子半径,当核外电子层相同时,核电荷数越大,粒子半径越小,所以r(Na+)<r(O2-),A错误;
B.同周期元素,从左到右电负性增强,所以χ(N)>χ(C),B错误;
C.同周期元素,从左到右第一电离能增强,但VA大于VIA,I1(O)<I1(N),C正确;
D.同周期元素,从左到右简单气态氢化物稳定性增强,H2O>NH3,D错误;
故答案为:C。
2.C
【详解】从价电子构型看出该元素有三个电子层,最外层有6个电子,所以在元素周期表中的位置是第三周期ⅥA族,选C。
3.B
【解析】略
4.C
【详解】由题干选项可知,A、C为F原子的激发态,而C为2个2p上的电子激发到3p上,A为1个2p上的电子激发到3s上,故C比A的能量更高,B为Ne原子的激发态,D为B原子的激发态,故答案为:C。
5.B
【详解】A.滴加氯水,溶液先变红,随后褪色,氯水含HCl、HClO,HClO具有漂白性可使溶液褪色,故A符合;
B.白色沉淀可能为AgCl也可能是Ag2CO3,则溶液中不一定含有Cl-,故B不符合;
C.氯水中的Cl2与KI发生反应生成碘单质,碘单质遇到淀粉变蓝,可说明氯气的氧化性大于碘单质,故C符合;
D.金属性越强、与水反应越剧烈,由操作和现象可知,金属性:Na<K,故D符合;
故选:B。
6.C
【详解】A.原子最外层电子2s电子云轮廓图为球形,A错误;
B.基态的核外电子排布式为,B错误;
C.的价电子为3d5,其轨道表示式:,C正确;
D.砷元素位于第四周期第VA族,其原子结构示意图为,D错误;
故选C。
7.B
【详解】根据题意可知A、B、C处于同一周期,且原子序数C>B>A,C、D处于同一主族,且C在D的下一周期。据此分析画出A、B、C、D在周期表中相对位置关系为,然后依据同周期、同主族元素电负性变化规律即可确定其电负性顺序:D>C>B>A,答案选B。
8.D
【详解】基态锰原子的电子排布式为1s22s22p63s23p63d54s2,原子轨道的能量由低到高的顺序为1s、2s、2p、3s、3p、4s、3d,其中3d能级上排布了5个电子,为半充满状态,5个电子分别占据不同的轨道,且自旋状态相同。
A.3d能级上的电子排布不对,违反了洪特规则;
B.s能级上两个电子的自旋状态应相反;
C.3d能级上电子排布不对;违反了洪特规则;
只有D项正确。
9.D
【详解】A.电子云图中黑点密度表示电子出现的几率,小点越密,表明概率密度越大,A项正确;
B.Cu的原子序数为29,基态Cu原子的价电子排布式为,属于ds区,B项正确;
C.有3个价电子的元素不一定是主族元素,如钪的价电子排布式为:,有3个价电子,位于IIIB族,C项正确;
D.每个轨道中最多可以填充两个电子,这两个电子自旋相反,能量完全相同,D项错误;
答案选D。
10.B
【分析】X、Y、Z、W是原子序数依次增大的短周期主族元素,X为地壳中含量最高的元素,则X为O元素;Y、Z相邻,Y原子最外层电子数是X原子内层电子数的2倍,则Y为Si元素、Z为P元素;W与X同主族,则W为S元素。
【详解】A.同周期元素,从左到右原子半径依次减小,则硅原子的原子半径大于硫原子,故A错误;
B.同周期元素,从左到右元素的非金属性依次增强,电负性依次增大,则电负性由小到大的顺序为Si
11.D
【详解】氯元素与碘元素处于同一主族,元素化合物结构与性质相似,氯酸钾为KClO3,所以碘酸根为,碘酸根中I为+5价,则碘酸碘为I(IO3)3,其化学式为I4O9,故选D;
答案选D。
12.C
【详解】A.利用原电池原理比较金属活动性,应该用稀硫酸作电解质溶液,A项错误;
B.硝酸具有挥发性,挥发的气体溶于溶液,会发生反应,因此不能证明酸性:>,B项错误;
C.锥形瓶中与NaOH反应生成,进入试管中使湿润的红色石蕊试纸变蓝,可以证明碱性:,C项正确;
D.可以将氧化,但没有挥发性,淀粉KI溶液变色无法证明氧化性:,D项错误;
故选C。
13.C
【详解】A.聚氯乙烯是由有机物氯乙烯聚合而成的高分子,属于有机高分子材料,选项A正确;
B.太阳能电池板的主要材料为单质Si,选项B正确;
C.Xe元素位于第五周期0族,氙气属于稀有气体,选项C错误;
D.蛋白质分子中含有C、H、O、N四种元素,常含有S元素,选项D正确;
答案选C。
14.A
【分析】X、Y、Z为短周期主族元素,X原子的M层只有一个电子,X是Na元素,Y、Z位于同一主族,且Z的单质为黄绿色气体,Z是Cl元素,Y是F元素。
【详解】A.电子层结构相同的离子,核电荷数越大,离子半径越小,而离子的电子层越多,离子半径越多,故离子半径:Cl->F->Na+,A错误;
B.同周期主族元素随原子序数增大,第一电离能呈增大趋势,同主族自上而下第一电离能减小,故第一电离F>Cl>Na,B正确;
C.同周期主族元素自左而右电负性增大,同主族自上而下电负性减小,故电负性F>Cl>Na,C正确;
D.元素非金属性F> Cl,故氢化物稳定性: HF> HCl,D正确;
故选A。
15.A
【详解】A.根据构造原理,各能级能量由低到高的顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s……由此可知原子轨道能量4s<3d,A项错误;
B.电子的能层越大,电子的能量越大,同一能级上的原子轨道具有相同的能量。故原子轨道能量:4px=4pz>3pz,B项正确;
C.电子的能层越大,电子的能量越大,故原子轨道能量:4p>3p,C项正确;
D.相同电子层上原子轨道能量s<p,D项正确;
答案选A。
16.Be的核外电子排布为1s22s2,为全满稳定结构,第一电离能更大
【详解】同周期从左往右,第一电离能呈增大趋势,但Be的外电子排布为1s22s2,为全满稳定结构,第一电离能更大。
17. 207g mol-1 六 IVA p
【分析】利用边长为的立方体中含有20个R原子,结合R单质的密度,可求其摩尔质量,根据原子核内中子数比质子数多43,进而求得R的质子数(原子序数),据此作答。
【详解】(1) R的摩尔质量;
(2) R的质量数为207,其中子数比质子数多43,故R的质子数为=82,R为铅元素,位于第六周期第ⅣA族,R原子的价电子排布式是;
(3) R为铅元素位于第六周期第ⅣA族,属于p区元素;
18. 锌完全消失所需的时间 5 固体反应物的表面积 (是否形成)原电池 AB 反应放热,使温度升高,反应速率加快 0.06 mol·L-1·min-1 稀硫酸 CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3 防止倒吸
【详解】(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定锌完全消失所需的时间来判断,其中第5组实验时温度最高,浓度最大,也滴加了硫酸铜溶液,利用了Zn-Cu原电池,因此反应速率最快;
(2)实验1和2除锌的状态不同外,其余均相同,应考查硫酸的固体反应物的表面积对速率的影响,实验3比1多了形成Zn-Cu原电池,因此考查影响速率的因素是否形成原电池;
(3)①从图中看出2-4分钟内产生氢气最多,故这段时间内反应速率最大,因为反应放热,使温度升高,反应速率加快,故三段中反应速率最快的是AB;
②2-4分钟内,产生氢气179.2-44.8=134.4mL,物质的量为=6×10-3mol,根据反应方程式:Zn+H2SO4=ZnSO4+H2↑可知,参加反应硫酸的物质的量为:6×10-3mol,v(H2SO4)===0.06mol L-1 min-1;
(4)利用如图2装置验证非金属性:C>Si,B中加Na2CO3,C中加Na2SiO3溶液,可利用非金属性越强,其最高价氧化物对应水化物的酸性越强来比较,即强酸制取弱酸,为防止影响C中非金属性强弱判断,A中应该加入难挥发的稀硫酸,C中反应的化学方程式:CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3,D装置的作用是防止倒吸。
19.(1) 能 不是 乙醚 O>C
(2) 加成反应(或还原反应)
(3) +H2→C2H5OC2H5+H2O 用无水硫酸铜检验c的反应产物中有没有水
【分析】用乙醚萃取出青蒿素,之后过滤得到提取液,再通过蒸馏的方式分离乙醚和粗品。
(1)
青蒿素在超临界中有很强的溶解性,则能用超临界作萃取剂萃取青蒿素;“青蒿一握,以水二升渍,绞取汁,尽服之”不是为了提取纤维素,而是为了提取青蒿素;青蒿素60℃以上易分解,四氯化碳沸点76.5℃,乙醚沸点为35℃,萃取之后需要蒸馏分离萃取剂和青蒿素,因此应选择乙醚作萃取剂;青蒿素是烃的含氧衍生物,含有C、H、O三种元素,元素的非金属性越强,其电负性越大,则青蒿素中电负性较大的两种元素为C、O,同一周期元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,则第一电离能:O>C,故答案为:能;不是;乙醚;O>C;
(2)
中两个氧之间有一对共用电子对,另外两个氧还各有一个单电子,其电子式为;青蒿素发生加成反应(或还原反应)生成双氢青蒿素,故答案为:;加成反应(或还原反应);
(3)
①与反应,只生成A和,根据质量守恒可知A的分子式为C4H10O2,则A的结构简式为,与H2发生反应+H2→C2H5OC2H5+H2O,故答案为:+H2→C2H5OC2H5+H2O;
②若的结构为,O→O键遇到还原剂时易断裂,实验c的产物中含有水,可用无水硫酸铜检验水,为了进一步确定的结构,实验d为用无水硫酸铜检验c的反应产物中有没有水,故答案为:用无水硫酸铜检验c的反应产物中有没有水。
20.第三周期ⅡA族
【详解】设X的相对原子质量为Ar,则由题意知:
,解得Ar=24
由该元素的原子核外电子数等于核内中子数可知,该元素原子的质子数与中子数相等,所以X的原子序数为12,该元素是Mg,位于周期表的第三周期ⅡA族
