专题3 微粒间作用力与物质性质 单元测试卷 (含解析)2022-2023学年高二下学期化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题3 微粒间作用力与物质性质 单元测试卷 (含解析)2022-2023学年高二下学期化学苏教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 722.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-25 09:16:29 | ||
图片预览



文档简介
专题3《微粒间作用力与物质性质》单元测试卷
一、单选题
1.下列关于SiO2和金刚石的叙述正确的是
A.SiO2的晶体结构中,每个Si原子与2个O原子直接相连
B.通常状况下,1molSiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数的值)
C.金刚石的网状结构中,由共价键形成的最小环上有6个碳原子
D.1mol金刚石中含有4NA个C-C键(NA表示阿伏加德罗常数的值)
2.下列变化过程中只需破坏共价键的是
A.熔融氧化铝 B.碘升华 C.溶解氯化钠 D.晶体硅熔化
3.下列各对原子序数的原子能以离子键结合成化合物的是
A.1和17 B.6和8 C.13和17 D.11和17
4.下列说法正确的是
A.NaCl、HCl的水溶液都能导电,NaCl、HCl属于离子化合物
B.CaC2、CaCl2都含有离子键和非极性共价键
C.石油分馏、煤的干馏都属于物理变化
D.Na2SiO3和SiC都属于无机非金属材料
5.X元素的1个原子失去2个电子,被Y元素的2个原子各获得1个电子,形成离子化合物Z,下列说法中不正确的是 ( )
A.固态Z是离子晶体
B.Z可以表示为X2Y
C.固态Z熔化后能导电
D.X可形成+2价阳离子
6.将SiCl4与过量的液氨反应可生成化合物Si(NH2)4。将该化合物在无氧条件下高温灼烧,可得到氮化硅(Si3N4)固体,氮化硅是一种新型耐高温、耐磨材料,在工业上有广泛的应用。下列推断可能正确的是
A.SiCl4、Si3N4的晶体类型相同
B.Si3N4晶体是立体网状结构
C.原子晶体C3N4的熔点比Si3N4的低
D.SiCl4晶体在熔化过程中化学键断裂
7.下列物质中既含有离子键又含有共价键的是
A. B. C. D.
8.下列关于晶体的说法正确的是
A.含有共价键的晶体一定是原子晶体
B.分子晶体中分子间作用力越强,分子越稳定
C.金属晶体中一定含有金属键,金属键有方向性和饱和性
D.离子晶体固态时不导电而熔融状态能导电
9.下列有关离子晶体的数据大小比较不正确的是( )
A.熔点:NaF>MgF2>AlF3 B.晶格能:NaF>NaCl>NaBr
C.阴离子的配位数:CsCl>NaCl>CaF2 D.硬度:MgO>CaO>BaO
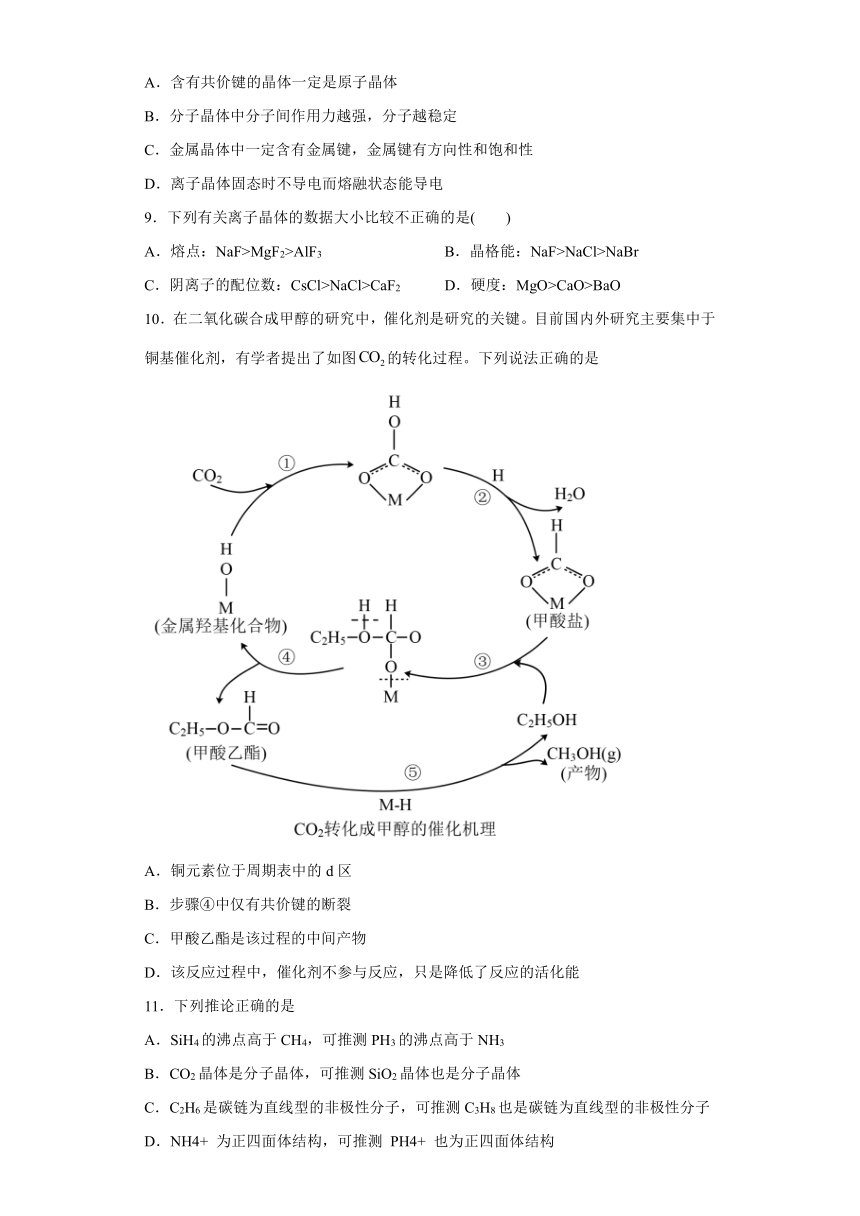
10.在二氧化碳合成甲醇的研究中,催化剂是研究的关键。目前国内外研究主要集中于铜基催化剂,有学者提出了如图的转化过程。下列说法正确的是
A.铜元素位于周期表中的d区
B.步骤④中仅有共价键的断裂
C.甲酸乙酯是该过程的中间产物
D.该反应过程中,催化剂不参与反应,只是降低了反应的活化能
11.下列推论正确的是
A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
B.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
C.C2H6是碳链为直线型的非极性分子,可推测C3H8也是碳链为直线型的非极性分子
D.NH4+ 为正四面体结构,可推测 PH4+ 也为正四面体结构
12.下列各组物质中,晶体类型完全相同的是
A.HCl和NaOH B.和 C.Si和Cu D.和NaCl
13.下列关于物质聚集状态的叙述中,错误的是
A.在电场存在的情况下,液晶分子沿着电场方向有序排列
B.液晶具有液体的流动性,在某些物理性质方面具有类似晶体的各向异性
C.等离子体是指由电子、阳离子组成的带有一定电荷的物质聚集体
D.液态物质的微粒间距离和作用力的强弱介于固气两态之间,表现出明显的流动性
14.下列有关离子晶体的比较不正确的是
A.熔点:
B.离子键强弱:
C.离子晶体中除了含有离子键外,还可能存在共价键、氢键等
D.硬度:
15.如图所示X、Y、Z、M、Q、R为前20号元素,下列说法不正确的是
A.X、Y、Z形成的化合物中可能含有离子键
B.X与Y组成的化合物可能具有漂白性
C.最高价氧化物的水化物酸性
D.第一电离能大小
二、填空题
16.根据物质结构有关性质和特点,回答下列问题:
(1)Ti基态原子核外电子排布式为_______,碳原子的价电子轨道表示式为_______。
(2)钛存在两种同素异形体,α—Ti采纳六方最密堆积,β—Ti采纳体心立方堆积,由α—Ti转变为β—Ti晶体体积_______(填“膨胀”或“收缩”)。
(3)SO2的空间构型为_______。
(4)丙烯腈(CH2=CH—CN)分子中σ键和π键的个数比为_______,分子中碳原子轨道杂化类型是_______。
(5)FeCl3熔点282℃,而FeCl2熔点674℃,二者熔点差异的原因是_______。
17.下面是同学们熟悉的物质:①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3 ⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,只含有共价键的是 _______;只含有离子键的是 _______;既含有共价键又含有离子键的是 _______;不存在化学键的是 _______。
(2)将NaHSO4溶于水,破坏了NaHSO4中的 _______,写出其电离方程式 _______;NaHSO4在熔融状态下电离,破坏了 _______。
三、实验题
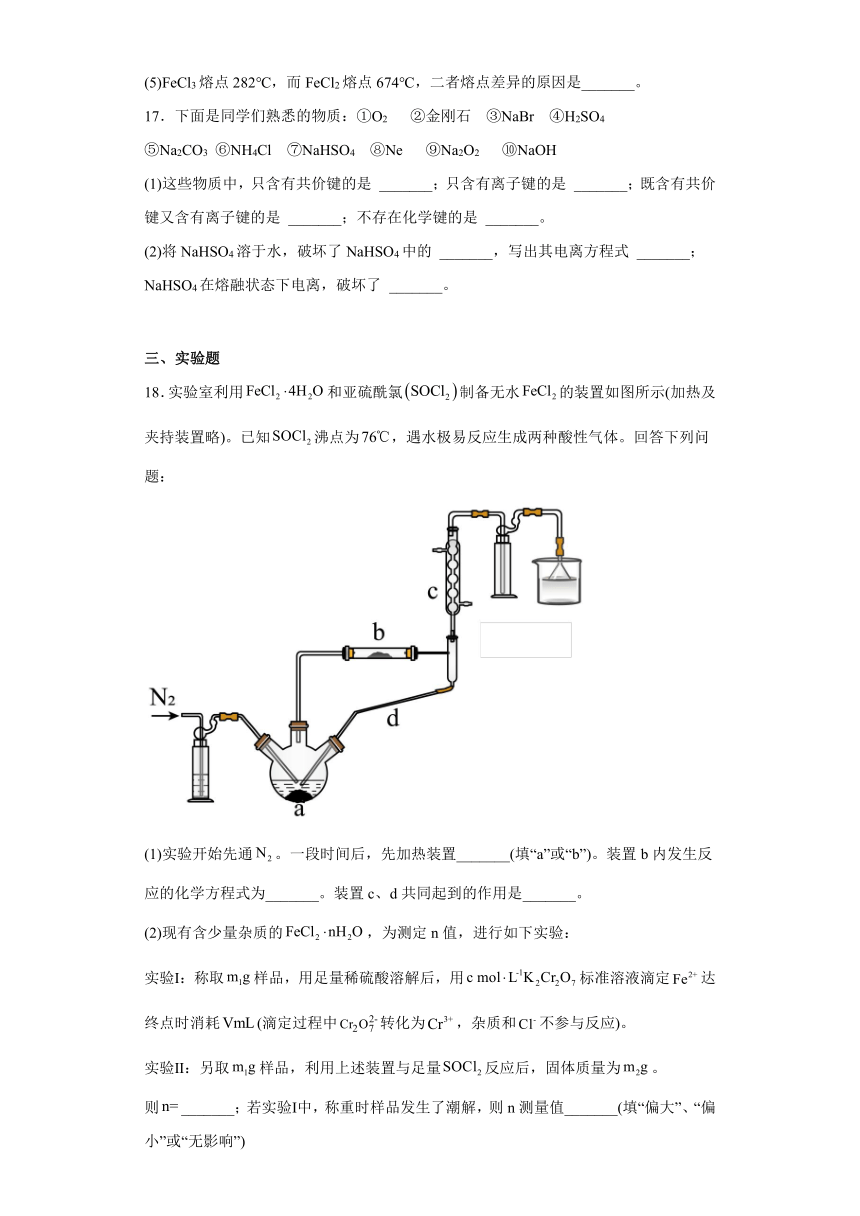
18.实验室利用和亚硫酰氯制备无水的装置如图所示(加热及夹持装置略)。已知沸点为,遇水极易反应生成两种酸性气体。回答下列问题:
(1)实验开始先通。一段时间后,先加热装置_______(填“a”或“b”)。装置b内发生反应的化学方程式为_______。装置c、d共同起到的作用是_______。
(2)现有含少量杂质的,为测定n值,进行如下实验:
实验Ⅰ:称取样品,用足量稀硫酸溶解后,用标准溶液滴定达终点时消耗(滴定过程中转化为,杂质和不参与反应)。
实验Ⅱ:另取样品,利用上述装置与足量反应后,固体质量为。
则_______;若实验Ⅰ中,称重时样品发生了潮解,则n测量值_______(填“偏大”、“偏小”或“无影响”)
(3)用上述装置,根据反应制备。已知与分子结构相似,与互溶,但极易水解。选择合适仪器并组装蒸馏装置对混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为:①⑨⑧_______⑩③⑤(填序号),先馏出的物质_______
19.晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体的晶胞如右图所示。 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m gNaCl固体并转移到定容仪器A中。②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为VmL。回答下列问题:
⑴步骤①中A仪器最好用__________________(填仪器名称)。
⑵能否用胶头滴管代替步骤②中的滴定管______,其原因是____________。
⑶能否用水代替苯_______,其原因是______________________。
⑷经X射线衍射测得NaCl晶胞中最邻近的Na+ 和Cl- 平均距离为acm,则利用上述
方法测得的阿伏加德罗常数的表达式为NA=_______________________。
四、计算题
20.某种Ga2O3的晶体结构如图3所示,O2-以六方最密方式堆积,Ga3+在其八面体空隙中(注:未全部标出,如:Ga3+在1、2、3、4、5、6构成的八面体体心)。
(1)该晶胞中O2-的配位数为_______。
(2)该晶胞有_______%(保留一位小数)八面体空隙填充阳离子。
(3)已知氧离子半径为rcm,晶胞的高为hcm,NA代表阿伏加德罗常数的值,该晶体的密度为_______g·cm-3(用含a、b和NA的代数式表示)。
21.Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有____个。
电池充电时,LiFeO4脱出部分Li+,形成Li1 xFePO4,结构示意图如(b)所示,则x=____,n(Fe2+)∶n(Fe3+)=____。
试卷第2页,共6页
参考答案:
1.C
【详解】A.SiO2的晶体结构中,每个Si原子与4个O原子直接相连,A错误;
B.SiO2属于共价晶体,不存在SiO2分子,B错误;
C.金刚石的网状结构中,每个碳原子与周围的4个成键碳原子共同组成正四面体结构,每个碳原子都是SP3杂化,键角109°28′,由共价键形成的最小环上有6个碳原子,C正确;
D.金刚石中每个C原子与另外四个C原子形成4个C-C键,每个C-C键为两个C原子共享,因此属于每个C原子的成键数目是,1mol金刚石中含有个C原子,故含有个C-C键,D错误;
故选C。
2.D
【详解】A.氧化铝是离子晶体,熔融氧化铝破坏离子键,A错误;
B.碘是分子晶体,碘升华破坏分子间作用力,B错误;
C.氯化钠是离子晶体,溶解氯化钠破坏离子键,C错误;
D.晶体硅是原子晶体,晶体硅熔化破坏共价键,D正确;
答案选D。
3.D
【详解】A.1、17号元素分别是H、Cl元素,二者以共价键结合形成化合物HCl,A错误;
B.6、8号元素分别是C、O元素,二者以共价键结合形成化合物CO、CO2,B错误;
C.13、17号元素分别是Al、Cl元素,二者以共价键结合形成化合物AlCl3,C错误;
D.11、17号元素分别是Na、Cl元素,二者以离子键结合形成化合物NaCl,D正确;
故答案选D。
4.D
【详解】A.化合物的水溶液能导电,和是不是离子化合物没有关系,HCl属于共价化合物,故A错误;
B.CaCl2中只有离子键,没有共价键,故B错误;
C.石油分馏是物理变化,煤的干馏属于化学变化,故C错误;
D.Na2SiO3属于硅酸盐,SiC俗称金刚砂,是无机物,所以它们都属于无机非金属材料,故D正确;
本题答案D。
5.B
【详解】A.根据题意,Z为离子化合物,则固态Z为离子晶体,故A正确;
B.X元素的1个原子失去2个电子,可表示为,其失去的2个电子被Y元素的2个原子各获得1个电子,可表示为,其形成的离子化合物Z可表示为,故B错误;
C.离子化合物在熔融状态下能电离成自由移动的离子,能导电,Z为离子化合物,熔化后能导电,故C正确;
D.X元素的1个原子可失去2个电子,可表示为,可形成+2价阳离子,故D正确;
故选B。
6.B
【详解】SiCl4是分子晶体,在熔化过程中克服的是分子间作用力,化学键不断裂。Si3N4是原子晶体,其晶体为立体网状结构。根据C、Si的原子半径推知C—N键的键能比Si—N键的键能大,故C3N4的熔点比Si3N4的高。答案选B。
7.A
【详解】A.的电子式为,既含离子键又含共价键,选项A正确;
B.H2O2的电子式为,只含共价键,选项B错误;
C.的电子式为,只含共价键,选项C错误;
D.MgCl2的电子式为,只含离子键,选项D错误;
答案选A。
8.D
【详解】A.氢氧化钠中含有共价键,氢氧化钠是离子晶体,A项错误;
B.分子间作用力的大小决定分子的物理性质,而分子的稳定性则取决于化学键的强弱,B项错误;
C.金属晶体中,由于电子的自由运动,金属键没有固定度的方向,因而没有方向性,金属原子是通过密堆积按照各种堆积方式排列在一起的,它们尽可能多的紧密版排列,故没有饱和性,C项错误;
D.离子晶体固体中离子不能自由移动,所以不能导电,而熔融状态下可以电离出自由移动的离子,所以可以导电,D项正确;
答案选D。
9.A
【详解】A. 离子半径越小,离子所带电荷越多,离子晶体熔点越高,所以熔点:NaFB. 离子半径越小,晶格能越大,所以晶格能:NaF>NaCl>NaBr,故B正确;
C. CsCl、NaCl、CaF2的阴离子的配位数分别是8、6、4,所以阴离子的配位数:CsCl>NaCl>CaF2,故C正确;
D. 离子半径:Ba2+>Ca2+>Mg2+,所以硬度:MgO>CaO>BaO,故D正确。故选A。
【点睛】离子半径越小,离子所带电荷越多,离子晶体晶格能越大,熔点越高,硬度越大。
10.C
【详解】A.铜是29号元素,为ⅠB族元素,位于周期表中的ds区,故A错误;
B.步骤④中有O-H、C-O键的断裂,有C=O键的生成,故B错误;
C.甲酸乙酯是反应④的生成物,是反应⑤的反应物,所以甲酸乙酯是该过程的中间产物,故C正确;
D.催化剂通过参与化学反应降低反应的活化能,故D错误;
选C。
11.D
【详解】
12.B
【详解】A.HCl为分子晶体,NaOH为离子晶体,晶体类型不同,A不符合题意;
B.和均为分子晶体,晶体类型相同,B符合题意;
C.Si为共价晶体,Cu为金属晶体,晶体类型不同,C不符合题意;
D.为分子晶体,NaCl为离子晶体,晶体类型不同,D不符合题意;
答案选B。
13.C
【详解】A.施加电场可使液晶的长轴取向发生不同程度的改变,在有电场的情况下分子按照电场方向排列,A项正确;
B.液晶既具有流动性,也具有类似于晶体的各向异性,是介于液体和晶体之间的一种特殊的聚集状态,B项正确;
C.等离子体是由阳离子、中性粒子、自由电子等多种不同性质的粒子所组成的整体上呈电中性的物质,C项错误;
D.液态物质分子相距比较近,分子间作用力也较强,微粒间距离和作用力的强弱介于固气两态之间,液态物质分子的转动明显活跃,平动也有所增加,使之表现出明显的流动性,D项正确;
答案选C。
14.A
【详解】A.,、、所带电荷数依次增大,所以、、的离子键依次增强,故熔点依次升高,A项错误;
B.,故、、的离子键依次减弱,B项正确;
C.晶体为离子晶体,晶体中存在共价键、氢键等,C项正确;
D.,故、、中离子键依次减弱,硬度依次减小,D项正确。
故选A。
15.D
【分析】同周期元素从左到右半径减小,同主族元素从上到下半径增大,根据原子半径与主要化合价关系图,可知X为H元素,Y是-2价,Y是O元素,Z是+5价,Z是N元素,M最高价为+7,M为Cl元素,Q是+1价,Q是Na元素,R是+2价,R是Ca元素;
【详解】A.X、Y、Z可以形成,中含有离子键,A项正确;
B.X与Y组成的化合物可以是,具有漂白性,B项正确;
C.Z是N元素,M为Cl元素,最高价氧化物对应水化物的酸为,酸性强于,C项正确;
D.同主族元素第一电离从上到下依次减弱,同周期元素第一电离能从左到右依次增加,同周期第ⅡA元素第一电离能大于第ⅢA族,第ⅤA族第一电离能大于第ⅥA族, 则第一电离能大小N >H>Cl>Ca,即Z > X >M>R,D项错误;
答案选D。
16.(1) [Ar]3d24s2
(2)膨胀
(3)V形
(4) 2:1 sp2、sp
(5)氯化亚铁为离子晶体,熔化时需要破坏离子键;而氯化铁为分子晶体,熔化时需要破坏分子间作用
【详解】(1)Ti为22号元素,其基态原子核外电子排布式为[Ar]3d24s2;碳原子的价电子轨道表示式为;
(2)六方最密堆积空间利用率大于体心立方堆积,所以由α—Ti转变为β—Ti晶体体积膨胀。
(3)SO2中S原子的价层电子对数为,原子轨道空间构型为平面三角形,分子构型为V形。
(4)丙烯腈可以写成CH2=CH—CN,共价单键为σ键、共价双键中含有1个σ键、1个键,共价三键中含有1个键、2个键,则丙烯腈分子中含有6个σ键、3个π键,所以σ键与π键个数之比为6:3=2:1;价层电子对个数是3的碳原子采用sp2杂化,价层电子对个数是2的C原子采用sp杂化,前两个碳原子价层电子对个数是3、后一个碳原子价层电子对个数是2,故前两个碳原子采用sp2杂化,后一个采用sp杂化。
(5)氯化亚铁为离子晶体,熔化时需要破坏离子键;而氯化铁为分子晶体,熔化时只需要破坏分子间作用,离子键的作用力大于分子间作用力,则氯化亚铁的熔点比氯化铁的熔点高。
17. ①②④ ③ ⑤⑥⑦⑨⑩ ⑧ 离子键和共价键 NaHSO4=Na++H++SO 离子键
【分析】一般来说活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性共价键,同种非金属元素之间易形成非极性共价键,单原子分子中不含化学键;NaHSO4溶于水电离出钠离子、氢离子和硫酸根离子,NaHSO4在熔融状态下电离成钠离子和硫酸氢根离子,破坏了离子键。
【详解】各物质的化学键所属类别①O2中O原子之间只存在非极性共价键,属于单质;②金刚石中碳原子之间只存在非极性共价键,属于单质;③NaBr中钠离子和溴离子之间只存在离子键,属于离子化合物;④H2SO4中S原子和O原子、O原子和H原子之间存在极性共价键,属于共价化合物;⑤Na2CO3中钠离子和碳酸根离子之间存在离子键、C原子和O原子之间存在极性共价键,属于离子化合物;⑥NH4Cl中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在极性共价键,属于离子化合物;⑦NaHSO4中钠离子和硫酸氢根离子之间存在离子键、S原子和O原子之间存在共价键,属于离子化合物;⑧Ne中不存在化学键,属于稀有气体;⑨Na2O2中钠离子和过氧根离子之间存在离子键、O原子之间存在非极性共价键,属于离子化合物;⑩NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,属于离子化合物;
(1)这些物质中,只含有共价键的是 ①②④;只含有离子键的是③;既含有共价键又含有离子键的是⑤⑥⑦⑨⑩;不存在化学键的是⑧。故答案为:①②④;③;⑤⑥⑦⑨⑩;⑧;
(2)将NaHSO4溶于水,电离成钠离子、氢离子、硫酸根离子,破坏了NaHSO4中的离子键和共价键,其电离方程式NaHSO4=Na++H++SO;NaHSO4在熔融状态下电离成钠离子和硫酸氢根离子,破坏了离子键。故答案为:离子键和共价键;NaHSO4=Na++H++SO;离子键。
18.(1) a 冷擬回流
(2) 偏大
(3) ⑥
【分析】SOCl2与H2O反应生成两种酸性气体,FeCl2 4H2O与SOCl2制备无水FeCl2的反应原理为:SOCl2吸收FeCl2 4H2O受热失去的结晶水生成SO2和HCl,HCl可抑制FeCl2的水解,从而制得无水FeCl2。
(1)
实验开始时先通N2,排尽装置中的空气,一段时间后,先加热装置a,产生SOCl2气体充满b装置后再加热b装置,由分析可知,装置b中发生反应的化学方程式为;装置c、d的共同作用是冷凝回流SOCl2;
(2)
滴定过程中将Fe2+氧化成Fe3+,自身被还原成Cr3+,反应的离子方程式为6Fe2+++14H+=6Fe3++2Cr3++7H2O,则m1g样品中n(FeCl2)=6n()=6cV×10-3mol;m1g样品中结晶水的质量为(m1-m2)g,结晶水物质的量为mol,n(FeCl2):n(H2O)=1:n=(6cV×10-3mol):mol,解得n=;若实验Ⅰ中,称重时样品发生了潮解,导致样品中水的量增加,使得n测量值偏大;
(3)
组装蒸馏装置对TiCl4、CCl4混合物进行蒸馏提纯,按由下而上、从左到右的顺序组装,安装顺序为①⑨⑧,然后连接冷凝管,蒸馏装置中应选择直形冷凝管⑥、不选用球形冷凝管⑦,接着连接尾接管⑩,TiCl4极易水解,为防止外界水蒸气进入,最后连接③⑤,安装顺序为①⑨⑧⑥⑩③⑤;由于TiCl4、CCl4分子结构相似,TiCl4的相对分子质量大于CCl4,TiCl4分子间的范德华力较大,TiCl4的沸点高于CCl4,故先蒸出的物质为CCl4;答案为:⑥、CCl4。
19. 容量瓶 否 实验中需要准确量取苯的体积 否 若用水代替苯,NaCl会溶解,造成NaCl的体积不能准确测定出来
【分析】(1)容量瓶为定容仪器,能够较准确的测定体积;
(2)实验中需要准确量取苯的体积,因此不能用胶头滴管代替滴定管;
(3)NaCl会溶解,造成NaCl的体积不能准确测定出来;
(4)由实验中NaCl的质量与体积,可以得到NaCl晶体的密度,均摊法计算晶胞中Na+、Cl-数目,用阿伏加德罗常数表示出晶胞质量,最近的Na+与Cl-间的平均距离为acm,则晶胞棱长=2a cm,而晶胞质量等于晶体密度与晶胞体积乘积,联立计算。
【详解】(1)能够较准确的测定NaCl固体体积,所以步骤①中仪器最好用容量瓶;
(2)实验中需要准确量取苯的体积,因此不能用胶头滴管代替滴定管;
(3)不能用水代替苯,若用水代替苯,NaCl会溶解,造成NaCl的体积不能准确测定出来;
(4)NaCl的密度为g/cm3,最近的Na+与Cl-间的平均距离为acm,则晶胞棱长=2a cm,NaCl晶胞的体积=(2a)3cm3,晶胞中Na+离子数目=1+12×=4、Cl-数目=8×+6×=4,则NaCl晶胞的质量=g=g/cm3×(2a)3cm3,整理得NA=。
20.(1)4
(2)66.7
(3)
【详解】①由晶胞示意图可知,该晶胞中氧离子位于晶胞的顶点、面心和体内,则1个晶胞中氧离子的个数为,镓离子位于晶胞的体内,则1个晶胞中镓离子的个数为4,氧离子和镓离子的个数比为6 : 4=3 : 2,镓离子周围等距的氧离子的数目为6,故镓离子配位数为6,氧离子周围等距的镓离子数目为4,故氧离子配位数为4;故答案为:4;
②该晶胞中共有12个正八面体空隙,其中8个正八面体空隙中填充了Crs+,所占比例为;故答案为:66.7;
③已知氧离子的半径为r cm,则底面边长为2r cm,又知晶胞的高度为h cm,所以晶胞的体积,一个晶胞中含有2个Ga2O3,其质量为,所以该晶体的密度,,故答案为:。
21. 4 或0.1875 13:3
【详解】由题干可知,LiFePO4的晶胞中,Fe存在于由O构成的正八面体内部,P存在由O构成的正四面体内部;再分析题干中给出的(a),(b)和(c)三个不同物质的晶胞结构示意图,对比(a)和(c)的差异可知,(a)图所示的LiFePO4的晶胞中,小球表示为Li+,其位于晶胞的8个顶点,4个侧面面心以及上下底面各自的相对的两条棱心处,经计算一个晶胞中Li+的个数为=4个;进一步分析(a)图所示的LiFePO4的晶胞中,八面体结构和四面体结构的数目均为4,即晶胞中含Fe和P的数目均为4;考虑到化学式为LiFePO4,并且一个晶胞中含有的Li+,Fe和P的数目均为4,所以一个晶胞中含有4个LiFePO4单元。对比(a)和(b)两个晶胞结构示意图可知,Li1-xFePO4相比于LiFePO4缺失一个面心的Li+以及一个棱心的Li+;结合上一个空的分析可知,LiFePO4晶胞的化学式为Li4Fe4P4O16,那么Li1-xFePO4晶胞的化学式为Li3.25Fe4P4O16,所以有,即x=0.1875。结合上一个空计算的结果可知,Li1-xFePO4即Li0.8125FePO4;假设Fe2+和Fe3+数目分别为x和y,则列方程组:x+y=1,0.8125+2x+3y+5=4×2,解得x=0.8125,y=0.1875,则Li1-xFePO4中n(Fe2+)∶n(Fe3+)=0.8125∶0.1875=13∶3,故答案为4;或0.1875;13∶3
一、单选题
1.下列关于SiO2和金刚石的叙述正确的是
A.SiO2的晶体结构中,每个Si原子与2个O原子直接相连
B.通常状况下,1molSiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数的值)
C.金刚石的网状结构中,由共价键形成的最小环上有6个碳原子
D.1mol金刚石中含有4NA个C-C键(NA表示阿伏加德罗常数的值)
2.下列变化过程中只需破坏共价键的是
A.熔融氧化铝 B.碘升华 C.溶解氯化钠 D.晶体硅熔化
3.下列各对原子序数的原子能以离子键结合成化合物的是
A.1和17 B.6和8 C.13和17 D.11和17
4.下列说法正确的是
A.NaCl、HCl的水溶液都能导电,NaCl、HCl属于离子化合物
B.CaC2、CaCl2都含有离子键和非极性共价键
C.石油分馏、煤的干馏都属于物理变化
D.Na2SiO3和SiC都属于无机非金属材料
5.X元素的1个原子失去2个电子,被Y元素的2个原子各获得1个电子,形成离子化合物Z,下列说法中不正确的是 ( )
A.固态Z是离子晶体
B.Z可以表示为X2Y
C.固态Z熔化后能导电
D.X可形成+2价阳离子
6.将SiCl4与过量的液氨反应可生成化合物Si(NH2)4。将该化合物在无氧条件下高温灼烧,可得到氮化硅(Si3N4)固体,氮化硅是一种新型耐高温、耐磨材料,在工业上有广泛的应用。下列推断可能正确的是
A.SiCl4、Si3N4的晶体类型相同
B.Si3N4晶体是立体网状结构
C.原子晶体C3N4的熔点比Si3N4的低
D.SiCl4晶体在熔化过程中化学键断裂
7.下列物质中既含有离子键又含有共价键的是
A. B. C. D.
8.下列关于晶体的说法正确的是
A.含有共价键的晶体一定是原子晶体
B.分子晶体中分子间作用力越强,分子越稳定
C.金属晶体中一定含有金属键,金属键有方向性和饱和性
D.离子晶体固态时不导电而熔融状态能导电
9.下列有关离子晶体的数据大小比较不正确的是( )
A.熔点:NaF>MgF2>AlF3 B.晶格能:NaF>NaCl>NaBr
C.阴离子的配位数:CsCl>NaCl>CaF2 D.硬度:MgO>CaO>BaO
10.在二氧化碳合成甲醇的研究中,催化剂是研究的关键。目前国内外研究主要集中于铜基催化剂,有学者提出了如图的转化过程。下列说法正确的是
A.铜元素位于周期表中的d区
B.步骤④中仅有共价键的断裂
C.甲酸乙酯是该过程的中间产物
D.该反应过程中,催化剂不参与反应,只是降低了反应的活化能
11.下列推论正确的是
A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
B.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
C.C2H6是碳链为直线型的非极性分子,可推测C3H8也是碳链为直线型的非极性分子
D.NH4+ 为正四面体结构,可推测 PH4+ 也为正四面体结构
12.下列各组物质中,晶体类型完全相同的是
A.HCl和NaOH B.和 C.Si和Cu D.和NaCl
13.下列关于物质聚集状态的叙述中,错误的是
A.在电场存在的情况下,液晶分子沿着电场方向有序排列
B.液晶具有液体的流动性,在某些物理性质方面具有类似晶体的各向异性
C.等离子体是指由电子、阳离子组成的带有一定电荷的物质聚集体
D.液态物质的微粒间距离和作用力的强弱介于固气两态之间,表现出明显的流动性
14.下列有关离子晶体的比较不正确的是
A.熔点:
B.离子键强弱:
C.离子晶体中除了含有离子键外,还可能存在共价键、氢键等
D.硬度:
15.如图所示X、Y、Z、M、Q、R为前20号元素,下列说法不正确的是
A.X、Y、Z形成的化合物中可能含有离子键
B.X与Y组成的化合物可能具有漂白性
C.最高价氧化物的水化物酸性
D.第一电离能大小
二、填空题
16.根据物质结构有关性质和特点,回答下列问题:
(1)Ti基态原子核外电子排布式为_______,碳原子的价电子轨道表示式为_______。
(2)钛存在两种同素异形体,α—Ti采纳六方最密堆积,β—Ti采纳体心立方堆积,由α—Ti转变为β—Ti晶体体积_______(填“膨胀”或“收缩”)。
(3)SO2的空间构型为_______。
(4)丙烯腈(CH2=CH—CN)分子中σ键和π键的个数比为_______,分子中碳原子轨道杂化类型是_______。
(5)FeCl3熔点282℃,而FeCl2熔点674℃,二者熔点差异的原因是_______。
17.下面是同学们熟悉的物质:①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3 ⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,只含有共价键的是 _______;只含有离子键的是 _______;既含有共价键又含有离子键的是 _______;不存在化学键的是 _______。
(2)将NaHSO4溶于水,破坏了NaHSO4中的 _______,写出其电离方程式 _______;NaHSO4在熔融状态下电离,破坏了 _______。
三、实验题
18.实验室利用和亚硫酰氯制备无水的装置如图所示(加热及夹持装置略)。已知沸点为,遇水极易反应生成两种酸性气体。回答下列问题:
(1)实验开始先通。一段时间后,先加热装置_______(填“a”或“b”)。装置b内发生反应的化学方程式为_______。装置c、d共同起到的作用是_______。
(2)现有含少量杂质的,为测定n值,进行如下实验:
实验Ⅰ:称取样品,用足量稀硫酸溶解后,用标准溶液滴定达终点时消耗(滴定过程中转化为,杂质和不参与反应)。
实验Ⅱ:另取样品,利用上述装置与足量反应后,固体质量为。
则_______;若实验Ⅰ中,称重时样品发生了潮解,则n测量值_______(填“偏大”、“偏小”或“无影响”)
(3)用上述装置,根据反应制备。已知与分子结构相似,与互溶,但极易水解。选择合适仪器并组装蒸馏装置对混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为:①⑨⑧_______⑩③⑤(填序号),先馏出的物质_______
19.晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体的晶胞如右图所示。 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m gNaCl固体并转移到定容仪器A中。②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为VmL。回答下列问题:
⑴步骤①中A仪器最好用__________________(填仪器名称)。
⑵能否用胶头滴管代替步骤②中的滴定管______,其原因是____________。
⑶能否用水代替苯_______,其原因是______________________。
⑷经X射线衍射测得NaCl晶胞中最邻近的Na+ 和Cl- 平均距离为acm,则利用上述
方法测得的阿伏加德罗常数的表达式为NA=_______________________。
四、计算题
20.某种Ga2O3的晶体结构如图3所示,O2-以六方最密方式堆积,Ga3+在其八面体空隙中(注:未全部标出,如:Ga3+在1、2、3、4、5、6构成的八面体体心)。
(1)该晶胞中O2-的配位数为_______。
(2)该晶胞有_______%(保留一位小数)八面体空隙填充阳离子。
(3)已知氧离子半径为rcm,晶胞的高为hcm,NA代表阿伏加德罗常数的值,该晶体的密度为_______g·cm-3(用含a、b和NA的代数式表示)。
21.Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有____个。
电池充电时,LiFeO4脱出部分Li+,形成Li1 xFePO4,结构示意图如(b)所示,则x=____,n(Fe2+)∶n(Fe3+)=____。
试卷第2页,共6页
参考答案:
1.C
【详解】A.SiO2的晶体结构中,每个Si原子与4个O原子直接相连,A错误;
B.SiO2属于共价晶体,不存在SiO2分子,B错误;
C.金刚石的网状结构中,每个碳原子与周围的4个成键碳原子共同组成正四面体结构,每个碳原子都是SP3杂化,键角109°28′,由共价键形成的最小环上有6个碳原子,C正确;
D.金刚石中每个C原子与另外四个C原子形成4个C-C键,每个C-C键为两个C原子共享,因此属于每个C原子的成键数目是,1mol金刚石中含有个C原子,故含有个C-C键,D错误;
故选C。
2.D
【详解】A.氧化铝是离子晶体,熔融氧化铝破坏离子键,A错误;
B.碘是分子晶体,碘升华破坏分子间作用力,B错误;
C.氯化钠是离子晶体,溶解氯化钠破坏离子键,C错误;
D.晶体硅是原子晶体,晶体硅熔化破坏共价键,D正确;
答案选D。
3.D
【详解】A.1、17号元素分别是H、Cl元素,二者以共价键结合形成化合物HCl,A错误;
B.6、8号元素分别是C、O元素,二者以共价键结合形成化合物CO、CO2,B错误;
C.13、17号元素分别是Al、Cl元素,二者以共价键结合形成化合物AlCl3,C错误;
D.11、17号元素分别是Na、Cl元素,二者以离子键结合形成化合物NaCl,D正确;
故答案选D。
4.D
【详解】A.化合物的水溶液能导电,和是不是离子化合物没有关系,HCl属于共价化合物,故A错误;
B.CaCl2中只有离子键,没有共价键,故B错误;
C.石油分馏是物理变化,煤的干馏属于化学变化,故C错误;
D.Na2SiO3属于硅酸盐,SiC俗称金刚砂,是无机物,所以它们都属于无机非金属材料,故D正确;
本题答案D。
5.B
【详解】A.根据题意,Z为离子化合物,则固态Z为离子晶体,故A正确;
B.X元素的1个原子失去2个电子,可表示为,其失去的2个电子被Y元素的2个原子各获得1个电子,可表示为,其形成的离子化合物Z可表示为,故B错误;
C.离子化合物在熔融状态下能电离成自由移动的离子,能导电,Z为离子化合物,熔化后能导电,故C正确;
D.X元素的1个原子可失去2个电子,可表示为,可形成+2价阳离子,故D正确;
故选B。
6.B
【详解】SiCl4是分子晶体,在熔化过程中克服的是分子间作用力,化学键不断裂。Si3N4是原子晶体,其晶体为立体网状结构。根据C、Si的原子半径推知C—N键的键能比Si—N键的键能大,故C3N4的熔点比Si3N4的高。答案选B。
7.A
【详解】A.的电子式为,既含离子键又含共价键,选项A正确;
B.H2O2的电子式为,只含共价键,选项B错误;
C.的电子式为,只含共价键,选项C错误;
D.MgCl2的电子式为,只含离子键,选项D错误;
答案选A。
8.D
【详解】A.氢氧化钠中含有共价键,氢氧化钠是离子晶体,A项错误;
B.分子间作用力的大小决定分子的物理性质,而分子的稳定性则取决于化学键的强弱,B项错误;
C.金属晶体中,由于电子的自由运动,金属键没有固定度的方向,因而没有方向性,金属原子是通过密堆积按照各种堆积方式排列在一起的,它们尽可能多的紧密版排列,故没有饱和性,C项错误;
D.离子晶体固体中离子不能自由移动,所以不能导电,而熔融状态下可以电离出自由移动的离子,所以可以导电,D项正确;
答案选D。
9.A
【详解】A. 离子半径越小,离子所带电荷越多,离子晶体熔点越高,所以熔点:NaF
C. CsCl、NaCl、CaF2的阴离子的配位数分别是8、6、4,所以阴离子的配位数:CsCl>NaCl>CaF2,故C正确;
D. 离子半径:Ba2+>Ca2+>Mg2+,所以硬度:MgO>CaO>BaO,故D正确。故选A。
【点睛】离子半径越小,离子所带电荷越多,离子晶体晶格能越大,熔点越高,硬度越大。
10.C
【详解】A.铜是29号元素,为ⅠB族元素,位于周期表中的ds区,故A错误;
B.步骤④中有O-H、C-O键的断裂,有C=O键的生成,故B错误;
C.甲酸乙酯是反应④的生成物,是反应⑤的反应物,所以甲酸乙酯是该过程的中间产物,故C正确;
D.催化剂通过参与化学反应降低反应的活化能,故D错误;
选C。
11.D
【详解】
12.B
【详解】A.HCl为分子晶体,NaOH为离子晶体,晶体类型不同,A不符合题意;
B.和均为分子晶体,晶体类型相同,B符合题意;
C.Si为共价晶体,Cu为金属晶体,晶体类型不同,C不符合题意;
D.为分子晶体,NaCl为离子晶体,晶体类型不同,D不符合题意;
答案选B。
13.C
【详解】A.施加电场可使液晶的长轴取向发生不同程度的改变,在有电场的情况下分子按照电场方向排列,A项正确;
B.液晶既具有流动性,也具有类似于晶体的各向异性,是介于液体和晶体之间的一种特殊的聚集状态,B项正确;
C.等离子体是由阳离子、中性粒子、自由电子等多种不同性质的粒子所组成的整体上呈电中性的物质,C项错误;
D.液态物质分子相距比较近,分子间作用力也较强,微粒间距离和作用力的强弱介于固气两态之间,液态物质分子的转动明显活跃,平动也有所增加,使之表现出明显的流动性,D项正确;
答案选C。
14.A
【详解】A.,、、所带电荷数依次增大,所以、、的离子键依次增强,故熔点依次升高,A项错误;
B.,故、、的离子键依次减弱,B项正确;
C.晶体为离子晶体,晶体中存在共价键、氢键等,C项正确;
D.,故、、中离子键依次减弱,硬度依次减小,D项正确。
故选A。
15.D
【分析】同周期元素从左到右半径减小,同主族元素从上到下半径增大,根据原子半径与主要化合价关系图,可知X为H元素,Y是-2价,Y是O元素,Z是+5价,Z是N元素,M最高价为+7,M为Cl元素,Q是+1价,Q是Na元素,R是+2价,R是Ca元素;
【详解】A.X、Y、Z可以形成,中含有离子键,A项正确;
B.X与Y组成的化合物可以是,具有漂白性,B项正确;
C.Z是N元素,M为Cl元素,最高价氧化物对应水化物的酸为,酸性强于,C项正确;
D.同主族元素第一电离从上到下依次减弱,同周期元素第一电离能从左到右依次增加,同周期第ⅡA元素第一电离能大于第ⅢA族,第ⅤA族第一电离能大于第ⅥA族, 则第一电离能大小N >H>Cl>Ca,即Z > X >M>R,D项错误;
答案选D。
16.(1) [Ar]3d24s2
(2)膨胀
(3)V形
(4) 2:1 sp2、sp
(5)氯化亚铁为离子晶体,熔化时需要破坏离子键;而氯化铁为分子晶体,熔化时需要破坏分子间作用
【详解】(1)Ti为22号元素,其基态原子核外电子排布式为[Ar]3d24s2;碳原子的价电子轨道表示式为;
(2)六方最密堆积空间利用率大于体心立方堆积,所以由α—Ti转变为β—Ti晶体体积膨胀。
(3)SO2中S原子的价层电子对数为,原子轨道空间构型为平面三角形,分子构型为V形。
(4)丙烯腈可以写成CH2=CH—CN,共价单键为σ键、共价双键中含有1个σ键、1个键,共价三键中含有1个键、2个键,则丙烯腈分子中含有6个σ键、3个π键,所以σ键与π键个数之比为6:3=2:1;价层电子对个数是3的碳原子采用sp2杂化,价层电子对个数是2的C原子采用sp杂化,前两个碳原子价层电子对个数是3、后一个碳原子价层电子对个数是2,故前两个碳原子采用sp2杂化,后一个采用sp杂化。
(5)氯化亚铁为离子晶体,熔化时需要破坏离子键;而氯化铁为分子晶体,熔化时只需要破坏分子间作用,离子键的作用力大于分子间作用力,则氯化亚铁的熔点比氯化铁的熔点高。
17. ①②④ ③ ⑤⑥⑦⑨⑩ ⑧ 离子键和共价键 NaHSO4=Na++H++SO 离子键
【分析】一般来说活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性共价键,同种非金属元素之间易形成非极性共价键,单原子分子中不含化学键;NaHSO4溶于水电离出钠离子、氢离子和硫酸根离子,NaHSO4在熔融状态下电离成钠离子和硫酸氢根离子,破坏了离子键。
【详解】各物质的化学键所属类别①O2中O原子之间只存在非极性共价键,属于单质;②金刚石中碳原子之间只存在非极性共价键,属于单质;③NaBr中钠离子和溴离子之间只存在离子键,属于离子化合物;④H2SO4中S原子和O原子、O原子和H原子之间存在极性共价键,属于共价化合物;⑤Na2CO3中钠离子和碳酸根离子之间存在离子键、C原子和O原子之间存在极性共价键,属于离子化合物;⑥NH4Cl中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在极性共价键,属于离子化合物;⑦NaHSO4中钠离子和硫酸氢根离子之间存在离子键、S原子和O原子之间存在共价键,属于离子化合物;⑧Ne中不存在化学键,属于稀有气体;⑨Na2O2中钠离子和过氧根离子之间存在离子键、O原子之间存在非极性共价键,属于离子化合物;⑩NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,属于离子化合物;
(1)这些物质中,只含有共价键的是 ①②④;只含有离子键的是③;既含有共价键又含有离子键的是⑤⑥⑦⑨⑩;不存在化学键的是⑧。故答案为:①②④;③;⑤⑥⑦⑨⑩;⑧;
(2)将NaHSO4溶于水,电离成钠离子、氢离子、硫酸根离子,破坏了NaHSO4中的离子键和共价键,其电离方程式NaHSO4=Na++H++SO;NaHSO4在熔融状态下电离成钠离子和硫酸氢根离子,破坏了离子键。故答案为:离子键和共价键;NaHSO4=Na++H++SO;离子键。
18.(1) a 冷擬回流
(2) 偏大
(3) ⑥
【分析】SOCl2与H2O反应生成两种酸性气体,FeCl2 4H2O与SOCl2制备无水FeCl2的反应原理为:SOCl2吸收FeCl2 4H2O受热失去的结晶水生成SO2和HCl,HCl可抑制FeCl2的水解,从而制得无水FeCl2。
(1)
实验开始时先通N2,排尽装置中的空气,一段时间后,先加热装置a,产生SOCl2气体充满b装置后再加热b装置,由分析可知,装置b中发生反应的化学方程式为;装置c、d的共同作用是冷凝回流SOCl2;
(2)
滴定过程中将Fe2+氧化成Fe3+,自身被还原成Cr3+,反应的离子方程式为6Fe2+++14H+=6Fe3++2Cr3++7H2O,则m1g样品中n(FeCl2)=6n()=6cV×10-3mol;m1g样品中结晶水的质量为(m1-m2)g,结晶水物质的量为mol,n(FeCl2):n(H2O)=1:n=(6cV×10-3mol):mol,解得n=;若实验Ⅰ中,称重时样品发生了潮解,导致样品中水的量增加,使得n测量值偏大;
(3)
组装蒸馏装置对TiCl4、CCl4混合物进行蒸馏提纯,按由下而上、从左到右的顺序组装,安装顺序为①⑨⑧,然后连接冷凝管,蒸馏装置中应选择直形冷凝管⑥、不选用球形冷凝管⑦,接着连接尾接管⑩,TiCl4极易水解,为防止外界水蒸气进入,最后连接③⑤,安装顺序为①⑨⑧⑥⑩③⑤;由于TiCl4、CCl4分子结构相似,TiCl4的相对分子质量大于CCl4,TiCl4分子间的范德华力较大,TiCl4的沸点高于CCl4,故先蒸出的物质为CCl4;答案为:⑥、CCl4。
19. 容量瓶 否 实验中需要准确量取苯的体积 否 若用水代替苯,NaCl会溶解,造成NaCl的体积不能准确测定出来
【分析】(1)容量瓶为定容仪器,能够较准确的测定体积;
(2)实验中需要准确量取苯的体积,因此不能用胶头滴管代替滴定管;
(3)NaCl会溶解,造成NaCl的体积不能准确测定出来;
(4)由实验中NaCl的质量与体积,可以得到NaCl晶体的密度,均摊法计算晶胞中Na+、Cl-数目,用阿伏加德罗常数表示出晶胞质量,最近的Na+与Cl-间的平均距离为acm,则晶胞棱长=2a cm,而晶胞质量等于晶体密度与晶胞体积乘积,联立计算。
【详解】(1)能够较准确的测定NaCl固体体积,所以步骤①中仪器最好用容量瓶;
(2)实验中需要准确量取苯的体积,因此不能用胶头滴管代替滴定管;
(3)不能用水代替苯,若用水代替苯,NaCl会溶解,造成NaCl的体积不能准确测定出来;
(4)NaCl的密度为g/cm3,最近的Na+与Cl-间的平均距离为acm,则晶胞棱长=2a cm,NaCl晶胞的体积=(2a)3cm3,晶胞中Na+离子数目=1+12×=4、Cl-数目=8×+6×=4,则NaCl晶胞的质量=g=g/cm3×(2a)3cm3,整理得NA=。
20.(1)4
(2)66.7
(3)
【详解】①由晶胞示意图可知,该晶胞中氧离子位于晶胞的顶点、面心和体内,则1个晶胞中氧离子的个数为,镓离子位于晶胞的体内,则1个晶胞中镓离子的个数为4,氧离子和镓离子的个数比为6 : 4=3 : 2,镓离子周围等距的氧离子的数目为6,故镓离子配位数为6,氧离子周围等距的镓离子数目为4,故氧离子配位数为4;故答案为:4;
②该晶胞中共有12个正八面体空隙,其中8个正八面体空隙中填充了Crs+,所占比例为;故答案为:66.7;
③已知氧离子的半径为r cm,则底面边长为2r cm,又知晶胞的高度为h cm,所以晶胞的体积,一个晶胞中含有2个Ga2O3,其质量为,所以该晶体的密度,,故答案为:。
21. 4 或0.1875 13:3
【详解】由题干可知,LiFePO4的晶胞中,Fe存在于由O构成的正八面体内部,P存在由O构成的正四面体内部;再分析题干中给出的(a),(b)和(c)三个不同物质的晶胞结构示意图,对比(a)和(c)的差异可知,(a)图所示的LiFePO4的晶胞中,小球表示为Li+,其位于晶胞的8个顶点,4个侧面面心以及上下底面各自的相对的两条棱心处,经计算一个晶胞中Li+的个数为=4个;进一步分析(a)图所示的LiFePO4的晶胞中,八面体结构和四面体结构的数目均为4,即晶胞中含Fe和P的数目均为4;考虑到化学式为LiFePO4,并且一个晶胞中含有的Li+,Fe和P的数目均为4,所以一个晶胞中含有4个LiFePO4单元。对比(a)和(b)两个晶胞结构示意图可知,Li1-xFePO4相比于LiFePO4缺失一个面心的Li+以及一个棱心的Li+;结合上一个空的分析可知,LiFePO4晶胞的化学式为Li4Fe4P4O16,那么Li1-xFePO4晶胞的化学式为Li3.25Fe4P4O16,所以有,即x=0.1875。结合上一个空计算的结果可知,Li1-xFePO4即Li0.8125FePO4;假设Fe2+和Fe3+数目分别为x和y,则列方程组:x+y=1,0.8125+2x+3y+5=4×2,解得x=0.8125,y=0.1875,则Li1-xFePO4中n(Fe2+)∶n(Fe3+)=0.8125∶0.1875=13∶3,故答案为4;或0.1875;13∶3
