2.4化学反应的调控 同步练习题(含解析) 高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.4化学反应的调控 同步练习题(含解析) 高二上学期化学人教版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 977.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-25 09:24:15 | ||
图片预览




文档简介
2.4化学反应的调控同步练习题
一、选择题
1.我国科研人员研制了Ti H Fe双温区催化剂(Ti H区域和Fe区域的温度差可超过100℃)。利用该催化剂合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是
A.该历程中能量变化最大的是2.46eV,是氮分子中氮氮三键的断裂过程
B.在高温区加快了反应速率,低温区提高了氨的产率
C.③为N原子由Fe区域向Ti H区域的传递过程
D.①③在高温区发生,②④⑤在低温区发生
2.SO2的催化氧化反应在催化剂表面的反应历程如下:①SO2+V2O5→SO3+VO2(慢反应)、②2VO2+O2→V2O5(快反应)。下列说法正确的是
A.该反应的中间产物是SO3
B.反应①的活化能比反应②的活化能大
C.反应①中V元素的化合价升高,反应②中V元素的化合价降低
D.SO2的催化氧化反应中加入V2O5,可以提高SO2的平衡转化率
3.在硫酸工业中,通过如下反应使SO2转化为SO3:2SO2(g)+O2(g)2SO3(g) H<0。下列说法不正确的是
A.为使SO2尽可能多地转化为SO3,工业生产中的反应温度越低越好
B.使用合适的催化剂可加快该反应的反应速率
C.通入过量的空气可以提高SO2的转化率
D.反应后尾气中的SO2必须回收
4.某温度下,将含有和各0.10mol的气态混合物充入容积为10L的密闭容器中,发生反应,达到平衡后测得,则此温度下该反应的平衡常数为
A.0.25 B.0.5 C.2 D.4
5.密闭容器中加入HBr,一定条件下发生反应:,随反应时间的变化如曲线①所示,分别改变一个条件,得到曲线②和③,下列说法正确的是
A.该反应正反应为放热反应
B.曲线①,0~50min用表示的平均反应速率为
C.曲线②,可能使用了催化剂或压缩容器体积
D.曲线③,达到平衡后,容器内各物质的浓度分别增加,平衡正向移动
6.无水氯化铝是一种重要的催化剂,工业上由制备无水氯化铝的反应为: 。下列分析正确的是
A.增大用量,化学平衡向正反应方向移动
B.增大压强(即压缩气体),化学平衡向正反应方向移动
C.往体系中加入碳粉,化学平衡向正反应方向移动
D.升高体系温度,正反应速率加快,逆反应速率减慢
7.在容积为1L的密闭容器中,投入1molN2和3molH2分别在以下不同实验条件下进行反应。下列分析正确的是
容器编号 实验条件 平衡时反应中的能量变化
Ⅰ 恒温恒容 放热Q1kJ
Ⅱ 恒温恒压 放热Q2kJ
Ⅲ 恒容绝热 放热Q3kJ
A.平衡常数:Ⅱ>Ⅰ B.NH3体积分数:Ⅲ>Ⅰ
C.放出热量:Q1>Q2 D.N2转化率:Ⅱ>Ⅰ
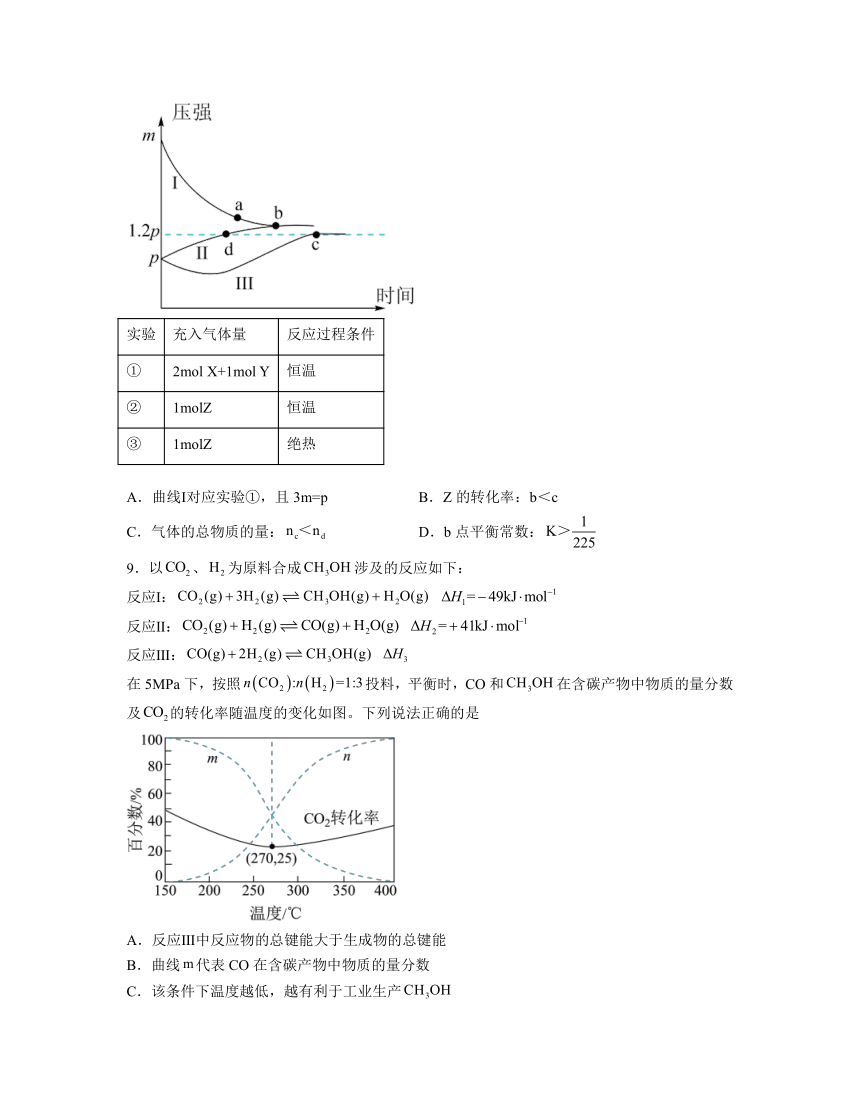
8.一定条件下,分别向体积为1L的密闭容器中充入气体,发生反应Z (g) 2X(g)+Y(g),测得实验①、②、③反应过程中体系压强随时间的变化曲线如图所示。下列说法正确的是
实验 充入气体量 反应过程条件
① 2mol X+1mol Y 恒温
② 1molZ 恒温
③ 1molZ 绝热
A.曲线Ⅰ对应实验①,且3m=p B.Z的转化率:b<c
C.气体的总物质的量: D.b点平衡常数:
9.以、为原料合成涉及的反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
在5MPa下,按照投料,平衡时,CO和在含碳产物中物质的量分数及的转化率随温度的变化如图。下列说法正确的是
A.反应Ⅲ中反应物的总键能大于生成物的总键能
B.曲线代表CO在含碳产物中物质的量分数
C.该条件下温度越低,越有利于工业生产
D.图示270℃时,平衡体系中的体积分数约为66.6%
10.下列有关化学反应速率说法正确的是
A.在一恒温恒容的密闭容器中,发生的催化氧化反应,充入He,压强增大,反应速率不变
B.0.1mol/L的溶液与0.3mol/L的KSCN溶液等体积混合,加入适量的氯化钠溶液,不影响化学反应速率
C.合成的反应是一个分子总数减小反应,增大压强,正反应速率加快,逆反应速率减慢,平衡正向移动
D.用铁片和稀硫酸反应制取氢气时,增大硫酸的浓度一定可以加快产生氢气的速率
11.在一密闭容器中进行以下可逆反应:。在不同的条件下P的体积分数的变化情况如图,则该反应
A.正反应放热,L是固体 B.正反应放热,L是气体
C.正反应吸热,L是气体 D.正反应吸热,L是固体或气体
12.某温度下,反应的平衡常数为,则相同温度下,反应的平衡常数为
A. B. C. D.
13.NO与CO是燃油汽车尾气中的两种有害气体。已知CO(g)+NO(g)CO2(g)+N2(g) △H=-374.3kJ mol-1。在一密闭容器中充入一定量的NO和CO气体,在一定条件下充分反应达到平衡,平衡常数K=2500。下列有关该反应的说法错误的是
A.选用适宜催化剂可达到尾气排放标准
B.K较大,说明该反应速率很大
C.降低温度,反应速率减小,K>2500
D.增大压强,平衡向右移动,K=2500
14.将等物质的量的和的混合气体置于密闭容器中,发生反应 ,一段时间达到平衡后,平衡体系中混合气体的平均摩尔质量M()在不同温度下随压强的变化曲线如图所示。下列说法正确的是
A.温度:
B.平衡常数:
C.反应速率:
D.当时,此时
15.某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
A.由图甲推断,B点SO2的平衡浓度为0.17mol·L-1
B.由图甲推断,A点对应温度下该反应的平衡常数为800
C.达平衡后,若增大容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如图丙,则T2>T1
二、填空题
16.CrO和Cr2O在溶液中可相互转化。室温下,初始浓度为1.0mol/L的K2CrO4溶液中,c(Cr2O)随c(H+)的变化如图所示。
(1)向黄色的K2CrO4溶液中滴加稀硫酸,溶液变为橙色,用离子方程式表示该转化反应:_____。
(2)下列可判断转化反应达到平衡的是_____(填标号)。
a.溶液的pH不再变化 b.v(H+)=2v(Cr2O)
c.不再变化 d.c(CrO)=0.45mol/L
(3)由图可知,溶液酸性增强,CrO的平衡转化率_____(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为_____。
(4)升高温度,溶液中CrO的平衡转化率减小,则该反应的△H____0(填“>”“<”或“=”)。
17.回答下列问题:
(1)已知:2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ/mol;
H2(g)+O2(g)=H2O(1); △H=-285.8 kJ/mol,
由此可知,在等温下蒸发45 g液态水需吸收___________ kJ的热量。
(2)在一定条件下,1 mol某气体若被O2完全氧化放热98.0 kJ。现有2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为:___________(注:某反应物的转化率=该反应物转化(消耗)的物质的量÷该反应物起始的物质的量×100%)
(3)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。 已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1,由N2和H2合成1molNH3时可放出46.2kJ的热量。 N-H键的键能是___________ kJ·mol-1
18.氮、碳氧化物的无害化处理是研究的热点。一定条件下发生如下反应:
Ⅰ.
Ⅱ.
完成下列填空:
(1)反应Ⅰ平衡常数的表达式K=_______。
(2)某温度下,反应Ⅰ的,该温度下,测得容器中、、的浓度分别为、、,此时,反应Ⅰ是否处于平衡状态?若不是,预测反应的方向。_______
(3)甲为10L的恒温容器。盛有和1mol CO,发生反应Ⅰ和反应Ⅱ,5min时,测得CO转化率为60%,,则_______mol;0~5min,的平均反应速率_______。
(4)乙为10L的绝热容器。向其中充入和1mol CO,发生反应Ⅰ和反应Ⅱ,乙中反应达到平衡的时间_______甲;此时乙中比甲中_______(以上两空选填“>”“<”或“=”),理由是:_______。
(5)不同压强的密闭容器中,分别充入和1mol CO,发生反应Ⅰ和反应Ⅱ,测得的平衡转化率与温度的关系如图所示。
P1、P2、P3由小到大的顺序为_______;温度高于T0℃时,容器内发生的主要反应为_______(填“Ⅰ”“Ⅱ”或“Ⅰ和Ⅱ”)。
三、计算题
19.在一定温度下,将3molA和1molB两种气体相混合于1L的密闭容器中,发生以下反应:。2min末反应达到平衡状态,生成了1.2molD。(用三段式解题)
(1)A的转化率为多少_______?
(2)求此温度下的平衡常数_______?
(3)求平衡时D的体积分数_______ (即物质的量分数)?
20.已知反应2NO(g)+2CO(g)N2(g)+CO2(g) △H=-746.8kJ mol-1。测得v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数)。若向1L密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为,则=_______(保留3位有效数字)。
四、实验题
21.I.KI溶液在酸性条件下能与氧气反应。现有以下实验记录:
实验编号 ① ② ③ ④ ⑤
温度/℃ 30 40 50 60 70
显色时间/s 160 80 40 20 10
回答下列问题:
(1)该反应的离子方程式为_______。
(2)该实验的目的是_______。
(3)实验试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要的试剂是_______,实验现象为_______。
II.为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇。某实验人员在一定温度下的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g)CH3OH(g)。测定的部分实验数据如下:
t/s 0 500 s 1 000 s
c(H2)/(mol·L-1) 5.00 3.52 2.48
c(CO)/(mol·L-1) 2.50
(4)在1 000 s内用CO表示的化学反应速率是_______mol/L,
(5)1 000 s时H2的转化率是_______。
【参考答案】
一、选择题
1.B
解析:A.该历程中能量变化最大的是2.46eV,是氮分子中吸附过程,氮氮三键的断裂过程是历程②,吸热 1.87eV ( 2.46eV)=0.59eV,故A错误;
B.一般而言,升高温度可提高反应速率,则在高温区加快了反应速率,由于合成氨反应是放热反应,因此低温区提高了氨的产率,故B正确;
C.③为Ti H Fe吸附N的历程,④为N原子由Fe区域向Ti H区域的传递过程,故C错误;
D.①是催化剂吸附氮气的历程,②是过渡态的历程,③为氮气解离为氮原子的历程,都为吸热反应,因此在高温区发生,④⑤为了增大平衡产率,需要在低温区进行,故D错误。
综上所述,答案为B。
2.B
解析:A.由反应历程可知该反应的中间产物是VO2,SO3是生成物,A错误;
B.反应①比反应②慢,则反应①的活化能比反应②的活化能大,B正确;
C.反应①中V元素的化合价由+5变为+4,降低,反应②中V元素的化合价由+4变为+5,升高,C错误;
D.V2O5是该反应的催化剂,能加快反应速率,不能提高SO2的平衡转化率,D错误;
选B。
3.A
解析:A.为使SO2尽可能多地转化为SO3即平衡正向移动,同时考虑到温度对速率的影响,工业生产中的反应温度并不是越低越好,A错误;
B.使用合适的催化剂可加快该反应的反应速率,B正确;
C.通入过量的空气促使平衡正向移动,可以提高SO2的转化率,C正确;
D.二氧化硫在转化中并未达到100%转化且二氧化硫有毒性的污染性气体需回收并循环利用,D正确;
故选A。
4.A
解析:,此时,A项正确。
故选A。
5.D
【分析】分别改变一个条件,得到曲线②、③,从曲线①得到曲线②,既加快速率平衡又不移动,只能使用催化剂,从曲线①得到曲线③,意味着反应速率加快但平衡右移了,则改变的另一个条件只能是升温。
解析:A.由上述分析可知,升温平衡正向移动,则该反应为吸热反应,故A错误;
B.曲线①,0~ 50 min用HBr表示的平均反应速率为=0.02mol﹒L-1﹒min-1,根据化学反应速率之比等于化学计量数之比可知,用H2表示的平均反应速率为0.01 mol﹒L-1﹒min-1,故B错误;
C.曲线②,可能使用了催化剂,反应速率加快,平衡不移动,各物质浓度不变;如果缩小体积,气体浓度都增大了,而实际上HBr浓度减小了,与图像变化不符合,故C错误;
D.曲线③达到平衡时有:,得,往容器中加入浓度均为0.2 mol﹒L-1的三种物质,得,则Qc<K,平衡将向正反应方向移动,故D正确;
故答案选D。
6.C
解析:A.由于氧化铝是固体,增大用量,化学平衡不移动,故A错误;
B.增大压强(即压缩气体),反应向体积减小的反应即向逆反应方向移动,故B错误;
C.往体系中加入碳粉,碳和氧气反应,氧气浓度减小,化学平衡向正反应方向移动,故C正确;
D.升高体系温度,正反应速率加快,逆反应速率加快,故D错误。
综上所述,答案为C。
7.D
解析:A.Ⅱ与Ⅰ的温度相同,平衡常数相同,则平衡常数:Ⅱ=Ⅰ,A不正确;
B.因为合成氨反应为放热反应,则达平衡时Ⅲ的温度比Ⅰ高,Ⅲ相当于Ⅰ加热,平衡逆向移动,则NH3体积分数:Ⅲ<Ⅰ,B不正确;
C.对于合成氨反应,在恒容容器中,达平衡时,压强减小,则Ⅱ相当于Ⅰ加压,平衡正向移动,所以放出热量:Q1<Q2,C不正确;
D.Ⅱ相当于Ⅰ加压,平衡正向移动,则N2转化率:Ⅱ>Ⅰ,D正确;
故选D。
8.D
解析:A. 恒温恒容条件下,气体的压强之比等于气体物质的量之比,故起始时实验②与实验③的压强相等,实验①的压强是实验②与实验③的3倍,则曲线Ⅰ对应实验①,且,选项A错误;
B.实验①与实验②的温度相等,根据等效平衡可知,实验①与实验②最终会达到相同的平衡状态,故曲线II对应实验②,则曲线III对应实验③,实验②与实验③充入的Z一样多,实验③比实验②达到平衡所用的时间长,则该反应是吸热反应,随反应的进行实验③温度降低,反应速率减慢,温度降低,平衡逆向移动,故Z的转化率:b>c,选项B错误;
C.根据pV=nRT,c、d两点的压强相同,V相同,由于反应吸热,c点的温度比d点低,则c点的气体物质的量更多,故气体的总物质的量:,选项C错误;
D. 假设b点的压强为1.2p,设Z减小的物质的量为x mol,可列出三段式:,可得,解得a=0.1mol,容器体积为1L,则,根据图像可知,b点压强大于1.2p,则a>0.1mol,平衡常数计算式的分子变大,分母减小,故b点平衡常数:,选项D正确;
答案选D。
9.D
解析:A.根据盖斯定律I-Ⅱ可得反应ⅢCO(g)+2H2(g) CH3OH(g) ΔH3=-49kJ·mol-1-41kJ·mol-1=-90kJ·mol-1;ΔH=反应物的总键能-生成物的总键能,故反应Ⅲ中反应物的总键能小于生成物的总键能,A错误;
B.反应Ⅱ的正反应是吸热反应,生成物中有CO,温度升高,反应Ⅱ的平衡正向移动,CO的物质的量分数增大;反应Ⅲ的正反应是放热反应,反应物中有CO,温度升高,反应Ⅲ的平衡逆向移动,CO的物质的量分数也会增大,也就是说,温度升高,CO的产量变大,则CO在含碳产物的物质的量分数增大,故符合这个规律的是曲线n,B错误;
C.由图可知,温度在150℃时有利于反应Ⅰ进行,CH3OH的含量高,有利于提高CH3OH的产率,但并不是温度越低越好,因为温度太低反应速率太慢,C错误;
D.根据题意设起始量n(CO2)=1mol,n(H2)=3mol,平衡时甲醇和CO的物质的量相等,设CH3OH物质的量为 xmol,则CO 的物质的量也为xmol,270℃时CO2的转化率为25%,则平衡时CO2的物质的量为0.75mol,根据碳守恒:0.75+2x=1,解得x=0.125,根据氧守恒,水的物质的量为:2mol-0.75mol×2-0.125mol-0.125mol=0.25mol,根据氢守恒,氢气的物质的量为=2.5mol,则反应后总的物质的量0.75mol+0.125mol+0.125mol+2.5mol+0.25mol=3.75mol,则平衡体系中H2的体积分数为=66.7%,D正确;
答案选D。
10.A
解析:A.SO2的催化氧化反应为2SO2+O22SO3,恒温恒容下,充入He,虽然压强增大,但SO2、O2、SO3浓度不变,因此反应速率不变,故A正确;
B.FeCl3与KSCN溶液反应Fe3++3SCN-Fe(SCN)3,加入适量的氯化钠溶液,相当于对原溶液加水稀释,微粒浓度降低,反应速率减缓,故B错误;
C.合成氨:N2+3H22NH3,增大压强,正逆反应速率都增大,故C错误;
D.如果硫酸为浓硫酸,铁片与浓硫酸反应生成SO2,或铁片与浓硫酸发生钝化反应,故D错误;
答案为A。
11.B
解析:曲线Ⅰ与Ⅱ相比,压强相同时降低温度,φ(P)增大,则表明平衡正向移动,所以正反应为放热反应;
曲线Ⅱ与Ⅲ相比,温度相同时减小压强,φ(P)增大,表明平衡正向移动,则反应物气体分子数小于生成物气体分子数,所以L是气体;
答案选B。
12.C
解析:某温度下,反应的平衡常数为,则相同温度下,反应的平衡常数为,故A符合题意。
综上所述,答案为A。
13.B
解析:A.选用合适的催化剂可以加快反应速率,提高单位时间内反应物的转化率,使汽车尾气达到排放标准,A项正确;
B.K较大说明反应正向进行的程度大,不代表反应速率大,B项错误;
C.降低温度,反应速率减小,,为放热反应,平衡正向移动,K增大,C项正确;
D.正向反应气体物质的量减小,所以增大压强,平衡向右移动,K只与温度有关,所以K不变,D项正确;
综上所述答案为B。
14.D
解析:A.已知不变,该反应为放热反应,升高温度,平衡逆向移动,增大,故M减小,由图可知,A项错误;
B.化学平衡常数与温度有关,该反应为放热反应,温度越高,平衡常数越小,则,B项错误;
C.温度越高,压强越大,化学反应速率越大,则,C项错误;
D.设起始时和的物质的量为,设的转化率为x,则平衡时,,,,气体的总物质的量为,,得,则,D项正确;
故选D。
15.B
解析:A.由图甲推断,B点SO2物质的量为,即浓度为,A错误;
B.根据A点分析,达到平衡c(SO2)=0.04mol/L,c(O2)=0.02 mol/L,c(SO3)=0.16 mol/L,A点对应温度下的平衡常数为,B正确;
C.达平衡后若增大容器容积,即减小压强,平衡向着逆反应方向移动且正逆反应速率都应减小,C错误;
D.压强相同,温度高速率快,即温度高的先达到平衡,由图中信息知T1先达到平衡,即T2故选B。
二、填空题
16.(1)2CrO+2H+Cr2O+H2O
(2)ac
(3) 增大 1.0×1014
(4)<
解析:(1)由图像可知,随着H+浓度增大,Cr2O浓度增大,CrO和H+反应生成Cr2O,根据得失电子守恒和电荷守恒配平方程式为:2CrO+2H+Cr2O+H2O。
(2)a.溶液的pH不再变化,说明H+浓度不变,说明反应得到平衡,故a选;
b.根据离子方程式中系数关系可知v(H+)=2v(Cr2O),不能说明正反应速率等于逆反应速率,不能说明反应达到平衡,故b不选;
c.不再变化,说明正反应速率等于逆反应速率,说明反应达到平衡,故c选;
d.由图可知,当c(Cr2O)=0.45mol/L时,反应达到平衡,此时c(CrO)=0.1mol/L,故d不选;
故选ac。
(3)由图可知,溶液酸性增强,c(H+)增大,平衡正向移动,CrO的平衡转化率增大,根据A点数据,平衡时c(Cr2O)=0.25mol/L、c(CrO)=0.5mol/L、c(H+)=1×10-7mol/L,该转化反应的平衡常数K==1.0×1014。
(4)升高温度,溶液中CrO的平衡转化率减小,平衡逆向移动,说明该反应是放热反应,△H<0。
17.(1)110(2)90%(3)391.6
解析:(1)已知:①2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ/mol;
②H2(g)+O2(g)=H2O(1); △H=-285.8 kJ/mol,
由盖斯定律可知,①-②得H2O(1)=H2O(g);则△H=(-483.6 kJ/mol)-(-285.8 kJ/mol)=+44 kJ/mol,45 g液态水的物质的量为2.5mol,则在等温下蒸发45 g液态水需吸收44 kJ/mol×2.5mol=110 kJ的热量。
(2)2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为:;
(3)由N2和H2合成1molNH3时可放出46.2kJ的热量,则反应为N2(g)+3H2(g)=2NH3(g);△H=-92.4 kJ/mol;焓变等于反应物的总键能和减生成物的总键能,设N-H键的键能是a,则948.9kJ·mol-1+436.0 kJ·mol-1×3-6a=-92.4kJ·mol-1,a=391.6 kJ·mol-1。
18.(1)
(2)反应I没有达到平衡状态,因为此时浓度商Qc=0.25>K,生成物偏多,反应向逆反应方向进行
(3) 0.2 2×10-3
(4) < > 反应I和反应II的正反应均为放热反应,乙容器由于处于绝热环境,随着反应的进行乙容器温度高于甲容器,升高温度,平衡向吸热反应方向移动,所以乙容器平衡较甲容器平衡,乙向逆向吸热方向进行程度大,乙容器中N2O的浓度比甲容器中的大,即乙>甲
(5) P1解析:(1)根据化学平衡常数的定义式可得反应的平衡常数表达式为K=;
(2)此时体系内的浓度商Qc=,0.25>0.16,反应I未达到平衡状态,生成物偏多,反应向逆反应方向进行;
(3)设反应I中N2O减少2xmol,反应I的各物质末态量作为反应II对应物质的起始量,CO在反应II中的转化率为60%为已知量,则可列出:,, 解得x=0.1,则n(N2O)=0.4-2×0.1=0.2mol;5min内v(O2)=;
(4)反应I和反应II的正反应均为放热反应,在乙容器中由于处于绝热环境,随着反应的进行乙容器温度高于甲容器,反应速率乙比甲快,达到平衡时间乙比甲用时少,即乙<甲;升高温度,平衡向吸热反应方向移动,因为乙容器温度高于甲容器,所以乙容器平衡较甲容器平衡,乙向逆向吸热方向进行程度大,乙容器中N2O的浓度比甲容器中的大,即乙>甲;
(5)反应I是正反应气体体积增大的反应,当温度一定时,增大压强,反应I平衡向逆反应气体体积减小方向移动,N2O的转化率降低,因此三者压强由小到大的关系是P1三、计算题
19. 60% 3 30%
解析:(1) ,;
(2)求此温度下的平衡常数;
(3)求平衡时D的体积分数 。
20.247
解析:若在1L的密闭容器中充入1 molCO和1 molNO,在一定温度下达到平衡时,CO的转化率为40%,则
,平衡时v正=v逆,则k正 c2(NO) c2(CO)=k逆 c(N2) c2(CO2),则= =0.247,故答案为:0.247。
四、实验题
21.(1)4I-+O2 + 4H+ = 2I2+ 2H2O
(2)探究温度对化学反应速度的影响
(3) 淀粉 溶液变蓝
(4)1.26×10-3mol/(L·s)
(5)50.4%
解析:(1)KI溶液在酸性条件下能与氧气反应,碘离子被氧气氧化成碘单质,同时会有水的生成,故答案为:4I-+O2 + 4H+ = 2I2+ 2H2O;
(2)由表中数据可知只有温度不同,实验目的为探究温度对反应速率的影响,故答案为:探究温度对化学反应速度的影响;
(3)实验试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要的试剂是淀粉溶液,现象为无色溶液变蓝色,可以检验产物中有碘单质的生成,故答案为:淀粉;溶液变蓝;
(4)1000s内用H2表示的化学反应速率为:,由速率之比等于化学计量数之比可知1 000 s内用CO表示的化学反应速率为: ,答案为:1.26×10-3mol/(L·s);
(5)1000s时氢气转化:,结合反应可知,转化的CO为:,CO的转化率为:,故答案为:50.4%;
一、选择题
1.我国科研人员研制了Ti H Fe双温区催化剂(Ti H区域和Fe区域的温度差可超过100℃)。利用该催化剂合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是
A.该历程中能量变化最大的是2.46eV,是氮分子中氮氮三键的断裂过程
B.在高温区加快了反应速率,低温区提高了氨的产率
C.③为N原子由Fe区域向Ti H区域的传递过程
D.①③在高温区发生,②④⑤在低温区发生
2.SO2的催化氧化反应在催化剂表面的反应历程如下:①SO2+V2O5→SO3+VO2(慢反应)、②2VO2+O2→V2O5(快反应)。下列说法正确的是
A.该反应的中间产物是SO3
B.反应①的活化能比反应②的活化能大
C.反应①中V元素的化合价升高,反应②中V元素的化合价降低
D.SO2的催化氧化反应中加入V2O5,可以提高SO2的平衡转化率
3.在硫酸工业中,通过如下反应使SO2转化为SO3:2SO2(g)+O2(g)2SO3(g) H<0。下列说法不正确的是
A.为使SO2尽可能多地转化为SO3,工业生产中的反应温度越低越好
B.使用合适的催化剂可加快该反应的反应速率
C.通入过量的空气可以提高SO2的转化率
D.反应后尾气中的SO2必须回收
4.某温度下,将含有和各0.10mol的气态混合物充入容积为10L的密闭容器中,发生反应,达到平衡后测得,则此温度下该反应的平衡常数为
A.0.25 B.0.5 C.2 D.4
5.密闭容器中加入HBr,一定条件下发生反应:,随反应时间的变化如曲线①所示,分别改变一个条件,得到曲线②和③,下列说法正确的是
A.该反应正反应为放热反应
B.曲线①,0~50min用表示的平均反应速率为
C.曲线②,可能使用了催化剂或压缩容器体积
D.曲线③,达到平衡后,容器内各物质的浓度分别增加,平衡正向移动
6.无水氯化铝是一种重要的催化剂,工业上由制备无水氯化铝的反应为: 。下列分析正确的是
A.增大用量,化学平衡向正反应方向移动
B.增大压强(即压缩气体),化学平衡向正反应方向移动
C.往体系中加入碳粉,化学平衡向正反应方向移动
D.升高体系温度,正反应速率加快,逆反应速率减慢
7.在容积为1L的密闭容器中,投入1molN2和3molH2分别在以下不同实验条件下进行反应。下列分析正确的是
容器编号 实验条件 平衡时反应中的能量变化
Ⅰ 恒温恒容 放热Q1kJ
Ⅱ 恒温恒压 放热Q2kJ
Ⅲ 恒容绝热 放热Q3kJ
A.平衡常数:Ⅱ>Ⅰ B.NH3体积分数:Ⅲ>Ⅰ
C.放出热量:Q1>Q2 D.N2转化率:Ⅱ>Ⅰ
8.一定条件下,分别向体积为1L的密闭容器中充入气体,发生反应Z (g) 2X(g)+Y(g),测得实验①、②、③反应过程中体系压强随时间的变化曲线如图所示。下列说法正确的是
实验 充入气体量 反应过程条件
① 2mol X+1mol Y 恒温
② 1molZ 恒温
③ 1molZ 绝热
A.曲线Ⅰ对应实验①,且3m=p B.Z的转化率:b<c
C.气体的总物质的量: D.b点平衡常数:
9.以、为原料合成涉及的反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
在5MPa下,按照投料,平衡时,CO和在含碳产物中物质的量分数及的转化率随温度的变化如图。下列说法正确的是
A.反应Ⅲ中反应物的总键能大于生成物的总键能
B.曲线代表CO在含碳产物中物质的量分数
C.该条件下温度越低,越有利于工业生产
D.图示270℃时,平衡体系中的体积分数约为66.6%
10.下列有关化学反应速率说法正确的是
A.在一恒温恒容的密闭容器中,发生的催化氧化反应,充入He,压强增大,反应速率不变
B.0.1mol/L的溶液与0.3mol/L的KSCN溶液等体积混合,加入适量的氯化钠溶液,不影响化学反应速率
C.合成的反应是一个分子总数减小反应,增大压强,正反应速率加快,逆反应速率减慢,平衡正向移动
D.用铁片和稀硫酸反应制取氢气时,增大硫酸的浓度一定可以加快产生氢气的速率
11.在一密闭容器中进行以下可逆反应:。在不同的条件下P的体积分数的变化情况如图,则该反应
A.正反应放热,L是固体 B.正反应放热,L是气体
C.正反应吸热,L是气体 D.正反应吸热,L是固体或气体
12.某温度下,反应的平衡常数为,则相同温度下,反应的平衡常数为
A. B. C. D.
13.NO与CO是燃油汽车尾气中的两种有害气体。已知CO(g)+NO(g)CO2(g)+N2(g) △H=-374.3kJ mol-1。在一密闭容器中充入一定量的NO和CO气体,在一定条件下充分反应达到平衡,平衡常数K=2500。下列有关该反应的说法错误的是
A.选用适宜催化剂可达到尾气排放标准
B.K较大,说明该反应速率很大
C.降低温度,反应速率减小,K>2500
D.增大压强,平衡向右移动,K=2500
14.将等物质的量的和的混合气体置于密闭容器中,发生反应 ,一段时间达到平衡后,平衡体系中混合气体的平均摩尔质量M()在不同温度下随压强的变化曲线如图所示。下列说法正确的是
A.温度:
B.平衡常数:
C.反应速率:
D.当时,此时
15.某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
A.由图甲推断,B点SO2的平衡浓度为0.17mol·L-1
B.由图甲推断,A点对应温度下该反应的平衡常数为800
C.达平衡后,若增大容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如图丙,则T2>T1
二、填空题
16.CrO和Cr2O在溶液中可相互转化。室温下,初始浓度为1.0mol/L的K2CrO4溶液中,c(Cr2O)随c(H+)的变化如图所示。
(1)向黄色的K2CrO4溶液中滴加稀硫酸,溶液变为橙色,用离子方程式表示该转化反应:_____。
(2)下列可判断转化反应达到平衡的是_____(填标号)。
a.溶液的pH不再变化 b.v(H+)=2v(Cr2O)
c.不再变化 d.c(CrO)=0.45mol/L
(3)由图可知,溶液酸性增强,CrO的平衡转化率_____(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为_____。
(4)升高温度,溶液中CrO的平衡转化率减小,则该反应的△H____0(填“>”“<”或“=”)。
17.回答下列问题:
(1)已知:2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ/mol;
H2(g)+O2(g)=H2O(1); △H=-285.8 kJ/mol,
由此可知,在等温下蒸发45 g液态水需吸收___________ kJ的热量。
(2)在一定条件下,1 mol某气体若被O2完全氧化放热98.0 kJ。现有2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为:___________(注:某反应物的转化率=该反应物转化(消耗)的物质的量÷该反应物起始的物质的量×100%)
(3)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。 已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1,由N2和H2合成1molNH3时可放出46.2kJ的热量。 N-H键的键能是___________ kJ·mol-1
18.氮、碳氧化物的无害化处理是研究的热点。一定条件下发生如下反应:
Ⅰ.
Ⅱ.
完成下列填空:
(1)反应Ⅰ平衡常数的表达式K=_______。
(2)某温度下,反应Ⅰ的,该温度下,测得容器中、、的浓度分别为、、,此时,反应Ⅰ是否处于平衡状态?若不是,预测反应的方向。_______
(3)甲为10L的恒温容器。盛有和1mol CO,发生反应Ⅰ和反应Ⅱ,5min时,测得CO转化率为60%,,则_______mol;0~5min,的平均反应速率_______。
(4)乙为10L的绝热容器。向其中充入和1mol CO,发生反应Ⅰ和反应Ⅱ,乙中反应达到平衡的时间_______甲;此时乙中比甲中_______(以上两空选填“>”“<”或“=”),理由是:_______。
(5)不同压强的密闭容器中,分别充入和1mol CO,发生反应Ⅰ和反应Ⅱ,测得的平衡转化率与温度的关系如图所示。
P1、P2、P3由小到大的顺序为_______;温度高于T0℃时,容器内发生的主要反应为_______(填“Ⅰ”“Ⅱ”或“Ⅰ和Ⅱ”)。
三、计算题
19.在一定温度下,将3molA和1molB两种气体相混合于1L的密闭容器中,发生以下反应:。2min末反应达到平衡状态,生成了1.2molD。(用三段式解题)
(1)A的转化率为多少_______?
(2)求此温度下的平衡常数_______?
(3)求平衡时D的体积分数_______ (即物质的量分数)?
20.已知反应2NO(g)+2CO(g)N2(g)+CO2(g) △H=-746.8kJ mol-1。测得v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数)。若向1L密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为,则=_______(保留3位有效数字)。
四、实验题
21.I.KI溶液在酸性条件下能与氧气反应。现有以下实验记录:
实验编号 ① ② ③ ④ ⑤
温度/℃ 30 40 50 60 70
显色时间/s 160 80 40 20 10
回答下列问题:
(1)该反应的离子方程式为_______。
(2)该实验的目的是_______。
(3)实验试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要的试剂是_______,实验现象为_______。
II.为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇。某实验人员在一定温度下的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g)CH3OH(g)。测定的部分实验数据如下:
t/s 0 500 s 1 000 s
c(H2)/(mol·L-1) 5.00 3.52 2.48
c(CO)/(mol·L-1) 2.50
(4)在1 000 s内用CO表示的化学反应速率是_______mol/L,
(5)1 000 s时H2的转化率是_______。
【参考答案】
一、选择题
1.B
解析:A.该历程中能量变化最大的是2.46eV,是氮分子中吸附过程,氮氮三键的断裂过程是历程②,吸热 1.87eV ( 2.46eV)=0.59eV,故A错误;
B.一般而言,升高温度可提高反应速率,则在高温区加快了反应速率,由于合成氨反应是放热反应,因此低温区提高了氨的产率,故B正确;
C.③为Ti H Fe吸附N的历程,④为N原子由Fe区域向Ti H区域的传递过程,故C错误;
D.①是催化剂吸附氮气的历程,②是过渡态的历程,③为氮气解离为氮原子的历程,都为吸热反应,因此在高温区发生,④⑤为了增大平衡产率,需要在低温区进行,故D错误。
综上所述,答案为B。
2.B
解析:A.由反应历程可知该反应的中间产物是VO2,SO3是生成物,A错误;
B.反应①比反应②慢,则反应①的活化能比反应②的活化能大,B正确;
C.反应①中V元素的化合价由+5变为+4,降低,反应②中V元素的化合价由+4变为+5,升高,C错误;
D.V2O5是该反应的催化剂,能加快反应速率,不能提高SO2的平衡转化率,D错误;
选B。
3.A
解析:A.为使SO2尽可能多地转化为SO3即平衡正向移动,同时考虑到温度对速率的影响,工业生产中的反应温度并不是越低越好,A错误;
B.使用合适的催化剂可加快该反应的反应速率,B正确;
C.通入过量的空气促使平衡正向移动,可以提高SO2的转化率,C正确;
D.二氧化硫在转化中并未达到100%转化且二氧化硫有毒性的污染性气体需回收并循环利用,D正确;
故选A。
4.A
解析:,此时,A项正确。
故选A。
5.D
【分析】分别改变一个条件,得到曲线②、③,从曲线①得到曲线②,既加快速率平衡又不移动,只能使用催化剂,从曲线①得到曲线③,意味着反应速率加快但平衡右移了,则改变的另一个条件只能是升温。
解析:A.由上述分析可知,升温平衡正向移动,则该反应为吸热反应,故A错误;
B.曲线①,0~ 50 min用HBr表示的平均反应速率为=0.02mol﹒L-1﹒min-1,根据化学反应速率之比等于化学计量数之比可知,用H2表示的平均反应速率为0.01 mol﹒L-1﹒min-1,故B错误;
C.曲线②,可能使用了催化剂,反应速率加快,平衡不移动,各物质浓度不变;如果缩小体积,气体浓度都增大了,而实际上HBr浓度减小了,与图像变化不符合,故C错误;
D.曲线③达到平衡时有:,得,往容器中加入浓度均为0.2 mol﹒L-1的三种物质,得,则Qc<K,平衡将向正反应方向移动,故D正确;
故答案选D。
6.C
解析:A.由于氧化铝是固体,增大用量,化学平衡不移动,故A错误;
B.增大压强(即压缩气体),反应向体积减小的反应即向逆反应方向移动,故B错误;
C.往体系中加入碳粉,碳和氧气反应,氧气浓度减小,化学平衡向正反应方向移动,故C正确;
D.升高体系温度,正反应速率加快,逆反应速率加快,故D错误。
综上所述,答案为C。
7.D
解析:A.Ⅱ与Ⅰ的温度相同,平衡常数相同,则平衡常数:Ⅱ=Ⅰ,A不正确;
B.因为合成氨反应为放热反应,则达平衡时Ⅲ的温度比Ⅰ高,Ⅲ相当于Ⅰ加热,平衡逆向移动,则NH3体积分数:Ⅲ<Ⅰ,B不正确;
C.对于合成氨反应,在恒容容器中,达平衡时,压强减小,则Ⅱ相当于Ⅰ加压,平衡正向移动,所以放出热量:Q1<Q2,C不正确;
D.Ⅱ相当于Ⅰ加压,平衡正向移动,则N2转化率:Ⅱ>Ⅰ,D正确;
故选D。
8.D
解析:A. 恒温恒容条件下,气体的压强之比等于气体物质的量之比,故起始时实验②与实验③的压强相等,实验①的压强是实验②与实验③的3倍,则曲线Ⅰ对应实验①,且,选项A错误;
B.实验①与实验②的温度相等,根据等效平衡可知,实验①与实验②最终会达到相同的平衡状态,故曲线II对应实验②,则曲线III对应实验③,实验②与实验③充入的Z一样多,实验③比实验②达到平衡所用的时间长,则该反应是吸热反应,随反应的进行实验③温度降低,反应速率减慢,温度降低,平衡逆向移动,故Z的转化率:b>c,选项B错误;
C.根据pV=nRT,c、d两点的压强相同,V相同,由于反应吸热,c点的温度比d点低,则c点的气体物质的量更多,故气体的总物质的量:,选项C错误;
D. 假设b点的压强为1.2p,设Z减小的物质的量为x mol,可列出三段式:,可得,解得a=0.1mol,容器体积为1L,则,根据图像可知,b点压强大于1.2p,则a>0.1mol,平衡常数计算式的分子变大,分母减小,故b点平衡常数:,选项D正确;
答案选D。
9.D
解析:A.根据盖斯定律I-Ⅱ可得反应ⅢCO(g)+2H2(g) CH3OH(g) ΔH3=-49kJ·mol-1-41kJ·mol-1=-90kJ·mol-1;ΔH=反应物的总键能-生成物的总键能,故反应Ⅲ中反应物的总键能小于生成物的总键能,A错误;
B.反应Ⅱ的正反应是吸热反应,生成物中有CO,温度升高,反应Ⅱ的平衡正向移动,CO的物质的量分数增大;反应Ⅲ的正反应是放热反应,反应物中有CO,温度升高,反应Ⅲ的平衡逆向移动,CO的物质的量分数也会增大,也就是说,温度升高,CO的产量变大,则CO在含碳产物的物质的量分数增大,故符合这个规律的是曲线n,B错误;
C.由图可知,温度在150℃时有利于反应Ⅰ进行,CH3OH的含量高,有利于提高CH3OH的产率,但并不是温度越低越好,因为温度太低反应速率太慢,C错误;
D.根据题意设起始量n(CO2)=1mol,n(H2)=3mol,平衡时甲醇和CO的物质的量相等,设CH3OH物质的量为 xmol,则CO 的物质的量也为xmol,270℃时CO2的转化率为25%,则平衡时CO2的物质的量为0.75mol,根据碳守恒:0.75+2x=1,解得x=0.125,根据氧守恒,水的物质的量为:2mol-0.75mol×2-0.125mol-0.125mol=0.25mol,根据氢守恒,氢气的物质的量为=2.5mol,则反应后总的物质的量0.75mol+0.125mol+0.125mol+2.5mol+0.25mol=3.75mol,则平衡体系中H2的体积分数为=66.7%,D正确;
答案选D。
10.A
解析:A.SO2的催化氧化反应为2SO2+O22SO3,恒温恒容下,充入He,虽然压强增大,但SO2、O2、SO3浓度不变,因此反应速率不变,故A正确;
B.FeCl3与KSCN溶液反应Fe3++3SCN-Fe(SCN)3,加入适量的氯化钠溶液,相当于对原溶液加水稀释,微粒浓度降低,反应速率减缓,故B错误;
C.合成氨:N2+3H22NH3,增大压强,正逆反应速率都增大,故C错误;
D.如果硫酸为浓硫酸,铁片与浓硫酸反应生成SO2,或铁片与浓硫酸发生钝化反应,故D错误;
答案为A。
11.B
解析:曲线Ⅰ与Ⅱ相比,压强相同时降低温度,φ(P)增大,则表明平衡正向移动,所以正反应为放热反应;
曲线Ⅱ与Ⅲ相比,温度相同时减小压强,φ(P)增大,表明平衡正向移动,则反应物气体分子数小于生成物气体分子数,所以L是气体;
答案选B。
12.C
解析:某温度下,反应的平衡常数为,则相同温度下,反应的平衡常数为,故A符合题意。
综上所述,答案为A。
13.B
解析:A.选用合适的催化剂可以加快反应速率,提高单位时间内反应物的转化率,使汽车尾气达到排放标准,A项正确;
B.K较大说明反应正向进行的程度大,不代表反应速率大,B项错误;
C.降低温度,反应速率减小,,为放热反应,平衡正向移动,K增大,C项正确;
D.正向反应气体物质的量减小,所以增大压强,平衡向右移动,K只与温度有关,所以K不变,D项正确;
综上所述答案为B。
14.D
解析:A.已知不变,该反应为放热反应,升高温度,平衡逆向移动,增大,故M减小,由图可知,A项错误;
B.化学平衡常数与温度有关,该反应为放热反应,温度越高,平衡常数越小,则,B项错误;
C.温度越高,压强越大,化学反应速率越大,则,C项错误;
D.设起始时和的物质的量为,设的转化率为x,则平衡时,,,,气体的总物质的量为,,得,则,D项正确;
故选D。
15.B
解析:A.由图甲推断,B点SO2物质的量为,即浓度为,A错误;
B.根据A点分析,达到平衡c(SO2)=0.04mol/L,c(O2)=0.02 mol/L,c(SO3)=0.16 mol/L,A点对应温度下的平衡常数为,B正确;
C.达平衡后若增大容器容积,即减小压强,平衡向着逆反应方向移动且正逆反应速率都应减小,C错误;
D.压强相同,温度高速率快,即温度高的先达到平衡,由图中信息知T1先达到平衡,即T2
二、填空题
16.(1)2CrO+2H+Cr2O+H2O
(2)ac
(3) 增大 1.0×1014
(4)<
解析:(1)由图像可知,随着H+浓度增大,Cr2O浓度增大,CrO和H+反应生成Cr2O,根据得失电子守恒和电荷守恒配平方程式为:2CrO+2H+Cr2O+H2O。
(2)a.溶液的pH不再变化,说明H+浓度不变,说明反应得到平衡,故a选;
b.根据离子方程式中系数关系可知v(H+)=2v(Cr2O),不能说明正反应速率等于逆反应速率,不能说明反应达到平衡,故b不选;
c.不再变化,说明正反应速率等于逆反应速率,说明反应达到平衡,故c选;
d.由图可知,当c(Cr2O)=0.45mol/L时,反应达到平衡,此时c(CrO)=0.1mol/L,故d不选;
故选ac。
(3)由图可知,溶液酸性增强,c(H+)增大,平衡正向移动,CrO的平衡转化率增大,根据A点数据,平衡时c(Cr2O)=0.25mol/L、c(CrO)=0.5mol/L、c(H+)=1×10-7mol/L,该转化反应的平衡常数K==1.0×1014。
(4)升高温度,溶液中CrO的平衡转化率减小,平衡逆向移动,说明该反应是放热反应,△H<0。
17.(1)110(2)90%(3)391.6
解析:(1)已知:①2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ/mol;
②H2(g)+O2(g)=H2O(1); △H=-285.8 kJ/mol,
由盖斯定律可知,①-②得H2O(1)=H2O(g);则△H=(-483.6 kJ/mol)-(-285.8 kJ/mol)=+44 kJ/mol,45 g液态水的物质的量为2.5mol,则在等温下蒸发45 g液态水需吸收44 kJ/mol×2.5mol=110 kJ的热量。
(2)2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为:;
(3)由N2和H2合成1molNH3时可放出46.2kJ的热量,则反应为N2(g)+3H2(g)=2NH3(g);△H=-92.4 kJ/mol;焓变等于反应物的总键能和减生成物的总键能,设N-H键的键能是a,则948.9kJ·mol-1+436.0 kJ·mol-1×3-6a=-92.4kJ·mol-1,a=391.6 kJ·mol-1。
18.(1)
(2)反应I没有达到平衡状态,因为此时浓度商Qc=0.25>K,生成物偏多,反应向逆反应方向进行
(3) 0.2 2×10-3
(4) < > 反应I和反应II的正反应均为放热反应,乙容器由于处于绝热环境,随着反应的进行乙容器温度高于甲容器,升高温度,平衡向吸热反应方向移动,所以乙容器平衡较甲容器平衡,乙向逆向吸热方向进行程度大,乙容器中N2O的浓度比甲容器中的大,即乙>甲
(5) P1
(2)此时体系内的浓度商Qc=,0.25>0.16,反应I未达到平衡状态,生成物偏多,反应向逆反应方向进行;
(3)设反应I中N2O减少2xmol,反应I的各物质末态量作为反应II对应物质的起始量,CO在反应II中的转化率为60%为已知量,则可列出:,, 解得x=0.1,则n(N2O)=0.4-2×0.1=0.2mol;5min内v(O2)=;
(4)反应I和反应II的正反应均为放热反应,在乙容器中由于处于绝热环境,随着反应的进行乙容器温度高于甲容器,反应速率乙比甲快,达到平衡时间乙比甲用时少,即乙<甲;升高温度,平衡向吸热反应方向移动,因为乙容器温度高于甲容器,所以乙容器平衡较甲容器平衡,乙向逆向吸热方向进行程度大,乙容器中N2O的浓度比甲容器中的大,即乙>甲;
(5)反应I是正反应气体体积增大的反应,当温度一定时,增大压强,反应I平衡向逆反应气体体积减小方向移动,N2O的转化率降低,因此三者压强由小到大的关系是P1
19. 60% 3 30%
解析:(1) ,;
(2)求此温度下的平衡常数;
(3)求平衡时D的体积分数 。
20.247
解析:若在1L的密闭容器中充入1 molCO和1 molNO,在一定温度下达到平衡时,CO的转化率为40%,则
,平衡时v正=v逆,则k正 c2(NO) c2(CO)=k逆 c(N2) c2(CO2),则= =0.247,故答案为:0.247。
四、实验题
21.(1)4I-+O2 + 4H+ = 2I2+ 2H2O
(2)探究温度对化学反应速度的影响
(3) 淀粉 溶液变蓝
(4)1.26×10-3mol/(L·s)
(5)50.4%
解析:(1)KI溶液在酸性条件下能与氧气反应,碘离子被氧气氧化成碘单质,同时会有水的生成,故答案为:4I-+O2 + 4H+ = 2I2+ 2H2O;
(2)由表中数据可知只有温度不同,实验目的为探究温度对反应速率的影响,故答案为:探究温度对化学反应速度的影响;
(3)实验试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要的试剂是淀粉溶液,现象为无色溶液变蓝色,可以检验产物中有碘单质的生成,故答案为:淀粉;溶液变蓝;
(4)1000s内用H2表示的化学反应速率为:,由速率之比等于化学计量数之比可知1 000 s内用CO表示的化学反应速率为: ,答案为:1.26×10-3mol/(L·s);
(5)1000s时氢气转化:,结合反应可知,转化的CO为:,CO的转化率为:,故答案为:50.4%;
