4.2.1电解原理课时作业(含解析)高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2.1电解原理课时作业(含解析)高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-25 09:52:12 | ||
图片预览


文档简介
4.2.1电解原理 课时作业
一、单选题
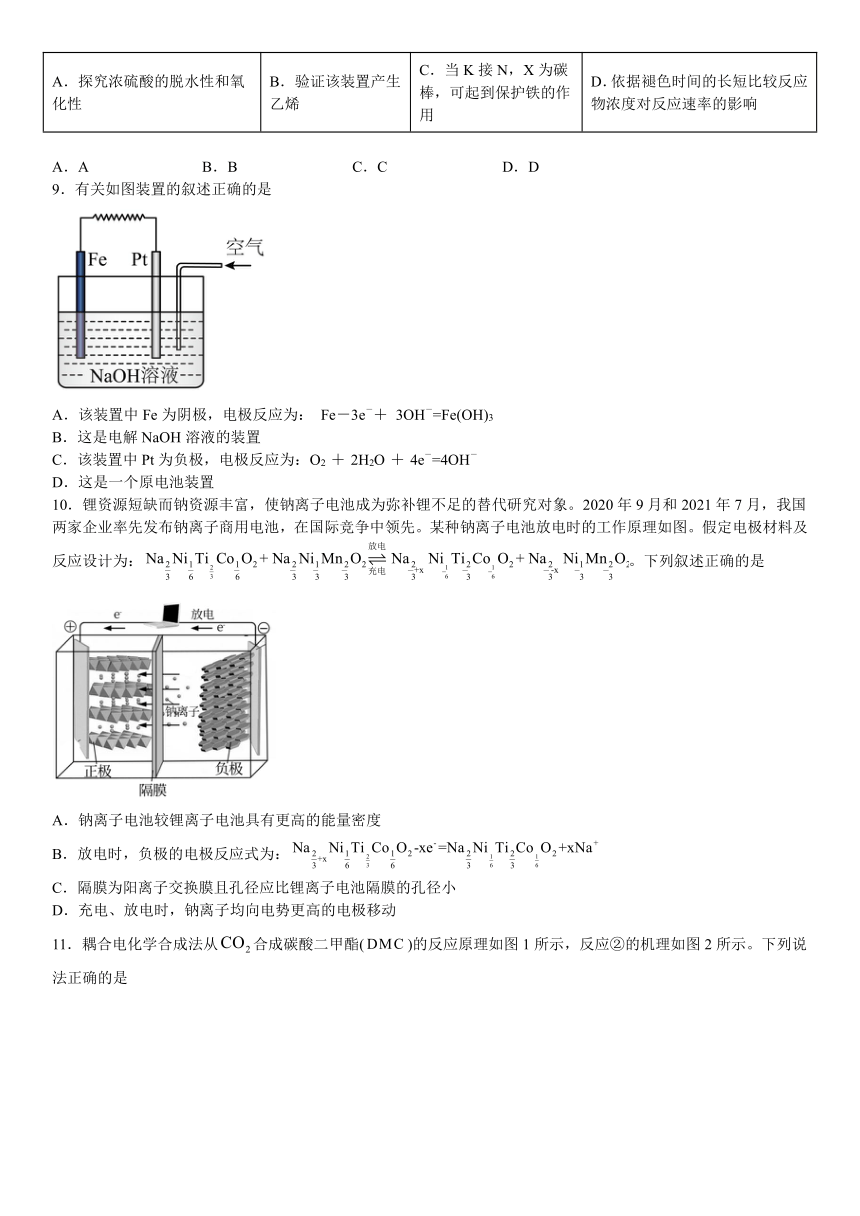
1.从废旧锌锰电池处理后的废料[含MnO2、MnOOH、Zn(OH)2、Fe等]制备Zn和MnO2的一种工艺流程如图:
已知:Mn的金属活动性强于Fe,Mn2+在pH大于5.5时易被氧化。
下列说法不正确的是
A.“还原焙烧”的主要作用是还原Mn元素,有利于“酸浸”时溶出
B.“酸浸”过程中适当加热,主要目的是加快浸取速率
C.“净化”时应该先通氧气氧化亚铁离子,后加入MnCO3调节溶液的pH,使Fe3+沉淀
D.“电解”时阳极反应式为Mn2+-2e-+4OH-=MnO2+2H2O
2.天问一号火星探测器采用可充电电池供电,其反应机理如图所示,下列说法正确的是
A.左电极室可以用硫酸锂溶液做电解质
B.放电时负极每消耗4molLi,正极吸收
C.若用铅蓄电池对该电池充电时,催化电极应与铅电极相连
D.充电时电子移动方向是从电源负极到阴极,经过电解质到阳极,又回到电源正极
3.近日,武汉大学肖巍教授研究了一种电化学分解甲烷源(ESM)的方法,实现了以节能、无排放和无水的方式生产氢气,反应机理如图所示。下列说法正确的是
A.Ni电极连接电源的负极
B.反应过程中,需要不断补充CO
C.理论上每生产11.2 LH2,电路中转移2 mol e-
D.Ni-YSZ电极的电极反应为CH4+2O2-=CO2+2H2
4.某纸电池结构如图所示,其M极为嵌锂石墨烯(),N极为钴酸锂(),电解质为六氟磷酸锂()的碳酸酯溶液(无水)。下列说法正确的是
A.放电时,由N极向M极迁移
B.充电时,M极接直流电源负极
C.放电时,N极的反应式为:
D.充电时,M极的反应式为:
5.用电渗析法由NaH2PO2制备H3PO2的工作原理如图所示,下列说法正确的是
A.电源a极为负极,所连石墨电极上的反应为2H++2e-=H2↑
B.氢氧化钠溶液所在的极室中pH减小
C.H+由左向右穿过阳膜1,H2PO2-由右向左穿过阴膜
D.当导线中转移0.4mole-时,两石墨电极上产生气体体积之和为标准状况下4.48L
6.下列关于电解池的叙述不正确的是
A.若用铁做阴极,则铁不会被氧化 B.与电源负极相连的是电解池的阴极
C.在电解池的阳极发生的是氧化反应 D.与电源正极相连的是电解池的阴极
7.用氟硼酸(HBF4属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF42Pb(BF4)2+2H2O,Pb(BF4)2为可溶于水的强电解质。下列说法正确的是( )
A.放电时,BF4-向PbO2电极移动
B.充电时,阴、阳两极增加的质量相等
C.放电时,电子由Pb电极经氟硼酸溶液流向PbO2电极
D.充电时,阳极的电极反应式为:Pb2++2H2O-2e-=PbO2+4H+
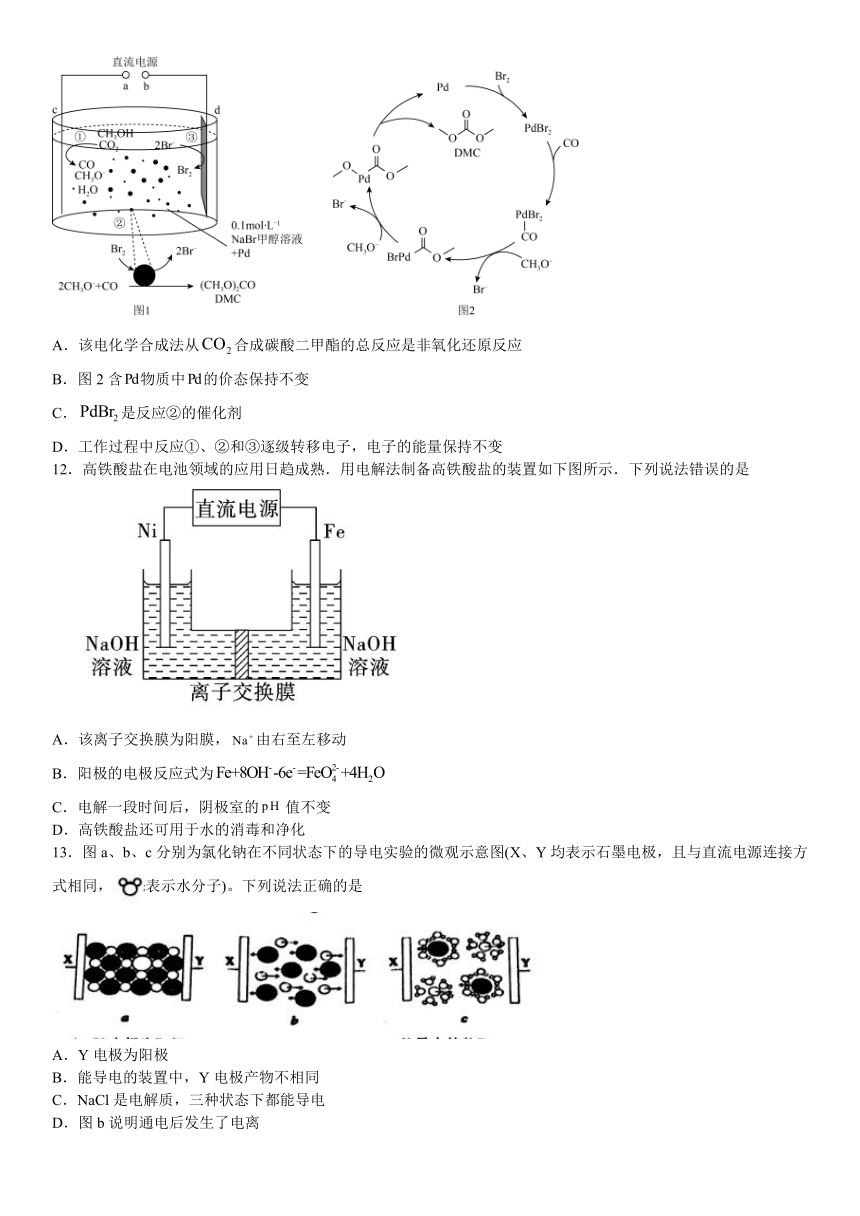
8.下列装置,可以达到相应实验目的的是
A.探究浓硫酸的脱水性和氧化性 B.验证该装置产生乙烯 C.当K接N,X为碳棒,可起到保护铁的作用 D.依据褪色时间的长短比较反应物浓度对反应速率的影响
A.A B.B C.C D.D
9.有关如图装置的叙述正确的是
A.该装置中Fe为阴极,电极反应为: Fe-3e-+ 3OH-=Fe(OH)3
B.这是电解NaOH溶液的装置
C.该装置中Pt为负极,电极反应为:O2 + 2H2O + 4e-=4OH-
D.这是一个原电池装置
10.锂资源短缺而钠资源丰富,使钠离子电池成为弥补锂不足的替代研究对象。2020年9月和2021年7月,我国两家企业率先发布钠离子商用电池,在国际竞争中领先。某种钠离子电池放电时的工作原理如图。假定电极材料及反应设计为:。下列叙述正确的是
A.钠离子电池较锂离子电池具有更高的能量密度
B.放电时,负极的电极反应式为:
C.隔膜为阳离子交换膜且孔径应比锂离子电池隔膜的孔径小
D.充电、放电时,钠离子均向电势更高的电极移动
11.耦合电化学合成法从合成碳酸二甲酯()的反应原理如图1所示,反应②的机理如图2所示。下列说法正确的是
A.该电化学合成法从合成碳酸二甲酯的总反应是非氧化还原反应
B.图2含物质中的价态保持不变
C.是反应②的催化剂
D.工作过程中反应①、②和③逐级转移电子,电子的能量保持不变
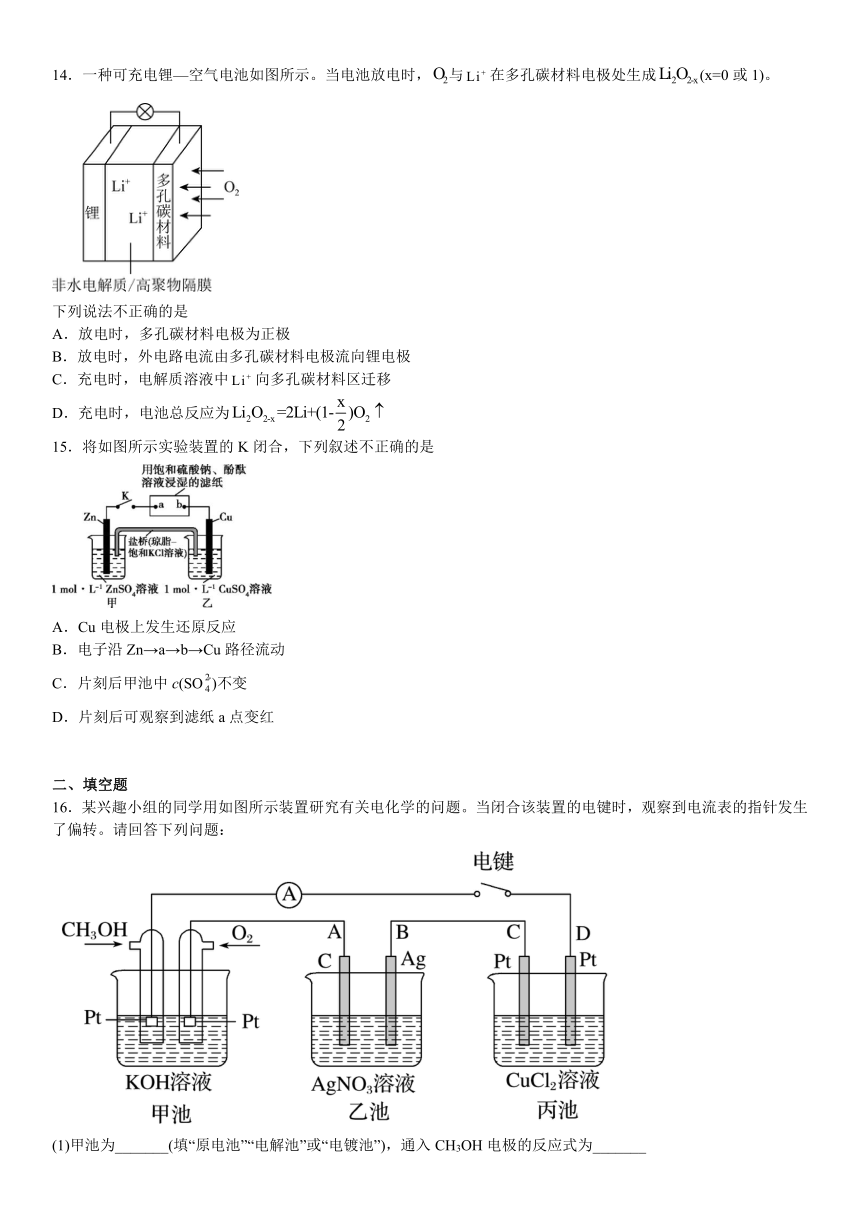
12.高铁酸盐在电池领域的应用日趋成熟.用电解法制备高铁酸盐的装置如下图所示.下列说法错误的是
A.该离子交换膜为阳膜,由右至左移动
B.阳极的电极反应式为
C.电解一段时间后,阴极室的值不变
D.高铁酸盐还可用于水的消毒和净化
13.图a、b、c分别为氯化钠在不同状态下的导电实验的微观示意图(X、Y均表示石墨电极,且与直流电源连接方式相同,表示水分子)。下列说法正确的是
A.Y电极为阳极
B.能导电的装置中,Y电极产物不相同
C.NaCl是电解质,三种状态下都能导电
D.图b说明通电后发生了电离
14.一种可充电锂—空气电池如图所示。当电池放电时,与在多孔碳材料电极处生成(x=0或1)。
下列说法不正确的是
A.放电时,多孔碳材料电极为正极
B.放电时,外电路电流由多孔碳材料电极流向锂电极
C.充电时,电解质溶液中向多孔碳材料区迁移
D.充电时,电池总反应为
15.将如图所示实验装置的K闭合,下列叙述不正确的是
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(SO)不变
D.片刻后可观察到滤纸a点变红
二、填空题
16.某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。请回答下列问题:
(1)甲池为_______(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的反应式为_______
(2)乙池中A(石墨)电极的名称为_______(填“正极”“负极”“阴极”或“阳极”),总反应的化学方程式为_______
(3)当乙池中B极质量增加21.6g时,甲池中理论上消耗O2的体积为_______L(标准状况下)。
17.如图在A、B、C三只烧杯中各盛放稀硫酸、氯化钠溶液和硝酸银溶液
(1)图中A池是_________ (填“原电池” “电解池”或“电镀池”)。
(2)石墨1电极的名称是________,检验该电极反应产物的方法是_________
(3)写出以下电极的电极反应式
B池:石墨1电极_______ 石墨2电极__________
C池:Ag电极__________ Cu电极________
(4)写出B池中反应的离子方程式_______________
三、实验题
18.用酸性溶液脱除后的废液,通过控制电压电解得以再生某同学使用石墨电极,在不同电压下电解的溶液,研究废液再生机理记录如下表。、、代表电压值:
序号 电压 阳极现象 检验阳极产物
Ⅰ 电极附近出现黄色,有气泡产生 有、有
Ⅱ 电极附近出现黄色,无气泡产生 有、无
Ⅲ 无明显变化 无、无
(1)用酸性溶液脱除的离子方程式为___________。
(2)检验废液中是否含有的试剂是___________。
(3)Ⅰ中,产生的原因可能是在阳极放电,生成的将氧化写出有关反应的方程式___________。
(4)由Ⅱ推测,产生的原因可能是___________。
(5)Ⅱ中虽未检测出,但在阳极是否放电仍需进一步验证电解的溶液做对照实验,记录如下表。
序号 电压 阳极现象 检验阳极产物
Ⅳ 无明显变化 有
Ⅴ 无明显变化 无
①溶液的浓度是___________。
②与Ⅱ对比,得出两点结论:
第一:通过控制电压,证实了产生的两种原因都成立。
第二:___________。
四、有机推断题
19.尼龙66机械强度高,刚性大,广泛用于制造机械、汽车、电气装置的零件,其结构简式如下所示。
(尼龙66)
尼龙66的合成与氯碱工业结合。
(1)制备。是_______分子(填“非极性”或“极性”)。
(2)尼龙66的一种合成路线如下所示。
①A属于芳香烃,其结构简式是_______。
②B→的反应类型是_______。
③D存在顺反异构体,生成D的化学方程式是_______。
④生成尼龙66的化学方程式是_______。
(3)C、F反应合成尼龙66时,通过蒸出_______(填物质)来促进反应。
(4)上述合成F的路线生产效率不高。为提高生产效率,科学家研发出了经由电解合成F的方法:
。
其中电解反应如下:
阳极:
阴极:
生成M的总反应方程式是_______。与其他有机合成相比,电有机合成具有反应条件温和、反应试剂纯净和生产效率高等优点。
参考答案:
1.D
【分析】废料中加入过量的炭黑,还原焙烧,锰元素变成二价锰离子,酸浸时得到锰离子、锌离子和亚铁离子,过量的碳黑不溶于酸,过滤变成滤渣,溶液中需要除去亚铁离子,应将亚铁离子氧化为铁离子以氢氧化铁沉淀形成分离除去,但是需要注意二价锰离子在酸性条件下比较稳定,pH高于5.5时易被O2氧化,所以应先通入氧气,后加入碳酸锰调节溶液的pH值并控制二价锰离子不被氧化,最后通过电解,锌离子得到电子在阴极生成锌,二价锰离子在阳极失去电子生成二氧化锰;
【详解】A.“还原焙烧”中MnO2、MnOOH分别与炭黑反应,2MnOOH+C2MnO+CO↑+H2O↑、 MnO2+CMnO+CO↑,反应中锰元素被还原为MnO,MnO能和酸反应有利于“酸浸”时溶出,A正确;
B.“酸浸” 过程中适当加热,能加快浸取速率,B正确;
C.根据以上分析,加入碳酸锰调节溶液的pH值,将杂质Fe3+转化为Fe(OH)3沉淀除去,C正确;
D.由图可知电解阳极锰离子失去电子发生氧化反应产生二氧化锰,则阳极电极反应式为,D错误;
故选D。
2.B
【分析】由图可知,Li电极为负极,电极反应式为,催化电极为正极,电极反应式为。
【详解】A.Li是活泼金属,与水发生反应,不能用硫酸锂溶液做电解质,故A错误;
B.根据电极反应式可知,放电时负极每消耗4molLi,转移4mole-,正极吸收,故B正确;
C.由上述分析可知,催化电极为正极,铅蓄电池中铅作负极,PbO2作正极,催化电极应与PbO2电极相连,故C错误;
D.充电时是电解池,电子从电源的负极沿导线流向电解池阴极,从电解池阳极流向电源正极,电子不经过电解质溶液,故D错误;
答案选B。
3.A
【详解】A.根据图示可知:在Ni电极上CO得到电子产生C、O2-,电极反应式为:CO+4e-=C+3O2-,发生还原反应,所以Ni电极作阴极,与电源的负极连接,A正确;
B.在Ni-YSZ电极上CH4失去电子变为CO,电极反应式为CH4-4e-+2O2-=CO2+2H2,在Ni电极上CO得到电子被还原为C单质,Ni电极反应式为:CO+4e-=C+3O2-,根据同一闭合回路中电子转移数目相等,可知在反应过程中,不需要不断补充CO,B错误﹔
C.反应条件未知,不能计算生成氢气的物质的量,就无法计算转移电子的物质的量,C错误;
D.在Ni-YSZ电极上CH4失去电子变为CO,电极反应式为CH4-4e-+2O2-=CO2+2H2,D错误﹔
故合理选项是A。
4.B
【分析】M极为嵌锂石墨烯(),N极为钴酸锂(),Li是活泼性金属,则M极为负极,N极为正极。
【详解】A.根据原电池“同性相吸”,则放电时,由M极向N极迁移,故A错误;
B.充电时,电源正极连接电池的正极,电源负极连接电池的负极即M极接直流电源负极,故B正确;
C.放电时,N极为正极,其电极反应式为:,故C错误;
D.充电时,M极为阴极,发生还原反应,其电极反应式为:,故D错误。
综上所述,答案为B。
5.C
【详解】由工作原理图可知,四室中左端电极室的H+通过阳膜1进入产品室,H2PO2-由右向左穿过阴膜进入产品室,因此左端电极为阳极,和电源正极相连,a为正极,则b为负极,右端石墨电极为阴极。
A.电源a极为正极,所连石墨电极上的反应为氧化反应2H2O-4e-=4H++O2↑,A错误;
B.氢氧化钠溶液所在的极室中发生的电极反应为还原反应2H2O+2e-=4OH-+H2↑,有OH-生成,故pH增大,B错误;
C.H+由左向右穿过阳膜1,H2PO2-由右向左穿过阴膜,C正确;
D.根据电极反应,当导线中转移0.4 mol e-时,阳极产生0.1 mol O2,阴极产生0.2 mol H2,产生气体体积之和为标准状况下6.72 L,故D错误;
本题正确答案为C。
【点睛】根据离子移动方向判断电解池的阴阳极,进而判断电源的正负极是解题的关键。
6.D
【详解】A.阴极发生还原反应,若用铁做阴极,则铁不会被氧化,A正确;
B.在电解池中,与电源负极相连的是电解池的阴极,B正确;
C.在电解池中,阳极发生的是氧化反应,C正确;
D.在电解池中,与电源正极相连的是电解池的阳极,D错误;
故选D。
7.D
【分析】电池的总反应为:Pb+PbO2+4HBF42Pb(BF4)2+2H2O,又Pb(BF4)2为可溶于水的强电解质,则放电时负极反应为:Pb-2e-=Pb2+;正极反应:PbO2+2e-+4H+=Pb2++2H2O,阴离子向负极移动,电子由负极经过外电路移向正极;充电时,阳极与正极相反,反应为:Pb2++2H2O-2e-═PbO2+4H+,阴极与负极相反,反应为:Pb2++2e-=Pb,据此分析解答。
【详解】A.放电时,阴离子向负极移动,则BF4-向Pb电极移动,故A错误;
B.充电时,阳极反应为:Pb2++2H2O-2e-═PbO2+4H+,阴极反应为:Pb2++2e-=Pb,则阴、阳两极增加的质量不相等,故B错误;
C.放电时,电子由负极经过外电路移向正极,不能经氟硼酸溶液,故C错误;
D.充电时,PbO2电极和电源的正极相连,电极反应式为Pb2++2H2O-2e-═PbO2+4H+,故D正确。
答案选D。
8.A
【详解】A.蔗糖与浓硫酸反应变黑,说明浓硫酸具有脱水性,品红褪色,说明生成SO2,证明浓硫酸具有强氧化性,A符合题意;
B.乙醇与浓硫酸加热会产生乙烯,但由于乙醇会被浓硫酸碳化,C与浓硫酸反应生成SO2,且乙醇易挥发,乙醇、乙烯、SO2均能使KMnO4褪色,故不能说明产生乙烯,B不符合题意;
C.K接N时此时为电解池,Fe为阳极,阳极失电子生成Fe2+,不能护铁,C不符合题意;
D.KMnO4滴入草酸,由于草酸过量,KMnO4会立即褪色,无法判断反应速率,应该保持KMnO4浓度一致,草酸过量且浓度不同,D不符合题意;
故选A。
9.D
【分析】这是一个原电池装置,铁为负极,Pt为正极。
【详解】A.图为原电池装置,铁为负极,电极反应为: Fe-2e-+2OH-═Fe(OH)2,故A错误;
B.这是原电池装置,故B错误;
C.该装置中Pt为正极,氧气在电极上得电子发生还原反应,电极反应为:O2+2H2O+ 4e-=4OH-,故C错误;
D.这是一个原电池装置,铁为负极,Pt为正极,总反应为2Fe+O2+2H2O=2Fe(OH)2,O2+2H2O+4Fe(OH)2=4Fe(OH)3,故D正确;
故选D。
10.B
【详解】A.因为钠的相对原子质量较锂的大,且r(Na+)>r(Li+),单位质量或单位体积的钠离子电池储能、放能较锂离子电池少,钠离子电池的能量密度较锂离子电池低,故A错误;
B.放电时,负极失去电子,发生氧化反应,其电极反应为,故B正确;
C.由图示可知,钠离子电池充放电时依靠Na+迁移导电,则该隔膜为阳离子交换膜;又因为r(Na+)>r(Li+),则孔径应比锂离子电池隔膜的孔径大,故C错误;
D.充电时,作电解池,阳离子向阴极移动,即钠离子向阴极迁移,阴极的电势低于阳极的电势,故D错误;
答案为B。
11.A
【详解】A.①阴极:CO2 +2CH3OH+2e-=CO+2CH3O-+H2O,③阳极:2Br--2e-=Br2,②2CH3O-+CO+Br2=2Br-+(CH3O)2CO,①+②+③得总反应CO2 +2CH3OH H2O+(CH3O)2CO,合成碳酸二甲酯过程中,元素的化合价末发生变化,总反应是非氧化还原反应,A正确;
B.图2由→PdBr2,Pd元素从0升到+2价,的价态发生变化,B错误;
C.反应②发生Br2→2Br-,参与反应,作为中间产物,不是催化剂,C错误;
D.工作过程中反应①发生CO2→CO得到2个电子,③2Br-→Br2都是失去2个电子,反应②Br2→2Br-得电子,CO失电子生成(CH3O)2CO,反应①、②和③不是逐级转移电子,电子的能量保持不变,D错误;
故选A。
12.C
【分析】用电解法制备高铁酸盐,Fe失电子发生氧化反应,Fe是阳极,阳极反应式为,阴极反应式为;
【详解】A.Fe是阳极,阳极生成,为防止向阴极移动,该离子交换膜为阳膜,由右至左移动,故A正确;
B.用电解法制备高铁酸盐,Fe失电子发生氧化反应,阳极的电极反应式为,故B正确;
C.阴极反应式为,电解一段时间后,阴极室的值增大,故C错误;
D.高铁酸盐中铁的化合价为+6,具有强氧化性,的还原产物水解为胶体,吸附水中杂质,所以可用于水的消毒和净化,故D正确;
选C。
13.B
【详解】A.氯离子半径大于钠离子,则图中黑球代表的离子是Cl-,b图中阴离子向X极移动,失电子生成氯气,则X为阳极,接电源正极,Y电极为阴极,与电源负极相连,故A错误;
B.bc中存在自由移动的离子,为能导电的装置,Y是阴极,图b中是Na+得电子生成Na单质,图c中是水电离的H+得电子生成H2,产物不同,故B正确;
C.是电解质,NaCl在晶体状态时离子不能自由移动,不导电,即图a不导电,故C错误;
D.图b说明通电后,电离出的离子发生了定向移动,电解质的电离不需要通电,只需要熔融状态或溶于水,故D错误;
本题答案B。
14.C
【分析】当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x,即O2在多孔碳材料电极表面得到电子生成O2-,再与转移过来的Li+结合生成Li2O2-x,所以锂电极为负极,多孔碳材料电极为正极,原电池总反应为2Li+(1-)O2=Li2O2-x,原电池工作时,外电路中:电子由负极锂电极经过导线流向正极多孔碳材料电极,电解质溶液中:阳离子Li+移向正极多孔碳材料电极,阴离子移向负极锂电极;充电时,装置为电解池,原电池的正极与电源正极相接,负极与电源负极相接,阴阳极电极反应与原电池负正极反应恰好相反,据此分析解答。
【详解】A.由分析可知,放电时,多孔碳材料电极为正极,A正确;
B.由分析可知,放电时,外电路的电流由正极多孔碳材料电极流向负极锂电极,B正确;
C.由分析可知,充电时,多孔碳材料电极为阳极,锂电极为阴极,故电解质溶液中向阴极锂电极区迁移,C错误;
D.由分析可知,充电时,电池总反应刚好是原电池总反应的逆过程,即为,D正确;
故答案为:C。
15.B
【分析】关闭K后,甲、乙装置能自发的进行氧化还原反应,是将化学能转化为电能的原电池,金属性强的锌做负极,锌失去电子发生氧化反应生成锌离子,铜做正极,铜离子在正极上得到电子发生还原反应生成铜,盐桥中的钾离子移向乙池、氯离子移向甲池;与负极锌相连的a为电解池的阴极,水在阴极得到电子生成氢气和氢氧根离子,电极附近溶液呈碱性,能使酚酞溶液变为红色,b为阳极,水在阳极失去电子发生氧化反应生成氧气和氢离子,电极附近溶液呈酸性。
【详解】A.由分析可知,铜做正极,铜离子在正极上得到电子发生还原反应生成铜,故A正确;
B.电解质溶液不能传递电子,所以装置中电子沿Zn→a,b→Cu路径流动,故B错误;
C.由分析可知,锌做负极,锌失去电子发生氧化反应生成锌离子,溶液中硫酸根离子不参加反应,所以硫酸根离子浓度不变,故C正确;
D.由分析可知,与负极锌相连的a为电解池的阴极,水在阴极得到电子生成氢气和氢氧根离子,电极附近溶液呈碱性,能使酚酞溶液变为红色,故D正确;
故选B。
16.(1) 原电池 CH3OH 6e-+8OH-=CO+6H2O
(2) 阳极 4AgNO3+2H2O4Ag+O2↑+4HNO3
(3)1.12
【分析】该串联装置中,甲池为燃料电池,存在自发进行的反应,因此甲池为原电池,乙池和丙池为电解池。
(1)
根据前面分析甲池为原电池,通入CH3OH电极的反应式为
CH3OH 6e-+8OH-=CO+6H2O。
(2)
乙池中A(石墨)与原电池正极相连,因此A电极的名称为阳极,阳极是水中氢氧根失去电子变为氧气和水,阴极是银离子得到电子变为银单质,即总反应式为4AgNO3+2H2O4Ag+O2↑+4HNO3。
(3)
根据关系式4Ag~ O2,当乙池中B极质量增加21.6g时(物质的量为0.2mol),甲池中理论上消耗O2物质的量为0.05mol,则标准状况下体积为11.2L。
17. 原电池 阳极 将湿润的淀粉碘化钾试纸放在电极上方,试纸变蓝 2Cl--2e-=Cl2↑ 2H++2e-=H2↑或2H2O+2e-=H2↑+2OH- Ag-e-=Ag+ Ag+ +e-= Ag 2Cl- + 2H2O2OH- + Cl2 ↑+ H2 ↑
【分析】根据图中装置连接及电化学原理可判断出,图中A池为原电池工作原理,Zn作负极,发生失电子的氧化反应,Cu作正极,氢离子发生得电子的还原反应;则B池与C池均为电解池工作原理,B池石墨1连接电池的正极,作电解池的阳极,氯离子发生失电子的氧化反应生成氯气,石墨2作电解池的阴极,水中氢离子在此极发生得电子的还原反应生成氢气和氢氧根离子;C池Cu极连接负极,作电解池的阴极,Ag+发生得电子的还原反应生成Ag,Ag极作电解池的阳极,发生失电子的氧化反应生成Ag+,据此分析解答。
【详解】(1)根据上述分析可知,图中A池是原电池;
(2)结合上述分析可知,B池为电解池,石墨1电极的名称是阳极;发生的电极反应为:2Cl—-2e-=Cl2↑,可用湿润的淀粉碘化钾试纸放在电极上方,若试纸变蓝,则产生的为氯气,故答案为:阳极;将湿润的淀粉碘化钾试纸放在电极上方,试纸变蓝;
(3) B池:石墨1连接电池的正极,作电解池的阳极,氯离子发生失电子的氧化反应生成氯气,电极反应式为:2Cl--2e-=Cl2↑;石墨2作电解池的阴极,水中氢离子在此极发生得电子的还原反应生成氢气和氢氧根离子,2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-;
C池:Ag极作电解池的阳极,发生失电子的氧化反应生成Ag+,电极反应式为:Ag-e-=Ag+;Cu极连接负极,作电解池的阴极,Ag+发生得电子的还原反应生成Ag,电极反应式为:Ag+ +e-= Ag,故答案为:2Cl--2e-=Cl2↑;2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-;Ag-e-=Ag+;Ag+ +e-= Ag;
(4)根据反应实质可看出B池为电解食盐水的反应,总反应的离子方程式为2Cl- + 2H2O2OH- + Cl2 ↑+ H2 ↑。
18.(1)2Fe3++H2S=2Fe2++2H++S↓
(2)KSCN溶液
(3)2Cl_-2e-=Cl2、2Fe2++Cl2=2Fe3++2Cl-
(4)Fe2+在阳极直接失去电子生成Fe3+
(5) 0.2 通过控制电压,证实了Fe2+的放电能力先于Cl-
【详解】(1)酸性溶液脱除,两则反应氧化还原反应,1mol氯化铁被还原为氯化亚铁得1mol电子,1mol被氧化成S单质失2mol电子,根据得失电子守恒及元素守恒得反应方程式为:2Fe3++H2S=2Fe2++2H++S↓,故答案为:2Fe3++H2S=2Fe2++2H++S↓;
(2)铁离子与KSCN反应生成血红色络合物,故用KSCN溶液检验铁离子,故答案为:KSCN溶液;
(3)Cl-在阳极放电,电解反应式为2Cl--2e-=Cl2↑,生成的氯气氧化Fe2+为Fe3+,方程式为:2Fe2++Cl2=2Fe3++2Cl-;故答案为:2Cl--2e-=Cl2↑;2Fe2++Cl2=2Fe3++2Cl-;
(4)因为阳极产物无Cl2,又Fe2+具有还原性,故也可能是Fe2+在阳极放电,被氧化为Fe3+;故答案为:Fe2+在阳极直接失去电子生成Fe3+;
(5)①因为为对比实验,故Cl-浓度应与电解FeCl2的相同,即为0.1mol/L ×2=0.2mol/L;
②检测氯气可以用淀粉碘化钾试纸,可取少量阳极附近的溶液,滴在淀粉KI试纸上,若试纸变蓝色,则说明有氯气存在;
③与II对比可知,IV中电解氯化亚铁时,电压较大a>x≥c时,氯离子放电产生氯气,即说明Fe3+可能是由氯气氧化亚铁离子得到;电压较小c>x≥b时,氯离子不放电,即还原性Fe2+>Cl-,同时也说明了铁离子也可能是由亚铁离子直接放电得到的。故结论为:①通过控制电压,证实了产生Fe3+的两种原因都成立;②通过控制电压,证实了Fe2+的放电能力先于Cl-。
故答案为:0.2;通过控制电压,证实了Fe2+的放电能力先于Cl-。
19.(1)非极性分子
(2) 加成反应 CH2ClCH=CHCH2Cl +
(3)
(4)
【分析】A为芳香化合物,故A为苯;B与水发生加成反应得到环己醇,B为;环己醇氧化得到C,C与F发生缩聚反应得到尼龙66,故C为HOOC(CH2)4COOH,F为H2N(CH2)6NH2;D存在顺反异构体,故1,3-丁二烯发生了1,4-加成,D为ClCH2CH=CHCH2Cl,D到E发生了取代反应,E为NCCH2CH=CHCH2CN,E与氢气发生加成反应得到F。
(1)
氯气分子正负电荷中心重合,是非极性分子;
(2)
B与水发生加成反应得到环己醇;D存在顺反异构体,故1,3-丁二烯发生了1,4-加成,生成D的化学方程式是:CH2ClCH=CHCH2Cl;C为HOOC(CH2)4COOH,F为H2N(CH2)6NH2,C与F发生缩聚反应得到尼龙66,化学方程式为:+;
(3)
制备尼龙66的缩聚反应为可逆反应,可通过蒸出H2O来促进反应;
(4)
由原子守恒,根据阴极的电极反应式,M为:,M与H2发生加成反应得到F。阴极和阳极的电极式相加即为生成M的总方程式:。
一、单选题
1.从废旧锌锰电池处理后的废料[含MnO2、MnOOH、Zn(OH)2、Fe等]制备Zn和MnO2的一种工艺流程如图:
已知:Mn的金属活动性强于Fe,Mn2+在pH大于5.5时易被氧化。
下列说法不正确的是
A.“还原焙烧”的主要作用是还原Mn元素,有利于“酸浸”时溶出
B.“酸浸”过程中适当加热,主要目的是加快浸取速率
C.“净化”时应该先通氧气氧化亚铁离子,后加入MnCO3调节溶液的pH,使Fe3+沉淀
D.“电解”时阳极反应式为Mn2+-2e-+4OH-=MnO2+2H2O
2.天问一号火星探测器采用可充电电池供电,其反应机理如图所示,下列说法正确的是
A.左电极室可以用硫酸锂溶液做电解质
B.放电时负极每消耗4molLi,正极吸收
C.若用铅蓄电池对该电池充电时,催化电极应与铅电极相连
D.充电时电子移动方向是从电源负极到阴极,经过电解质到阳极,又回到电源正极
3.近日,武汉大学肖巍教授研究了一种电化学分解甲烷源(ESM)的方法,实现了以节能、无排放和无水的方式生产氢气,反应机理如图所示。下列说法正确的是
A.Ni电极连接电源的负极
B.反应过程中,需要不断补充CO
C.理论上每生产11.2 LH2,电路中转移2 mol e-
D.Ni-YSZ电极的电极反应为CH4+2O2-=CO2+2H2
4.某纸电池结构如图所示,其M极为嵌锂石墨烯(),N极为钴酸锂(),电解质为六氟磷酸锂()的碳酸酯溶液(无水)。下列说法正确的是
A.放电时,由N极向M极迁移
B.充电时,M极接直流电源负极
C.放电时,N极的反应式为:
D.充电时,M极的反应式为:
5.用电渗析法由NaH2PO2制备H3PO2的工作原理如图所示,下列说法正确的是
A.电源a极为负极,所连石墨电极上的反应为2H++2e-=H2↑
B.氢氧化钠溶液所在的极室中pH减小
C.H+由左向右穿过阳膜1,H2PO2-由右向左穿过阴膜
D.当导线中转移0.4mole-时,两石墨电极上产生气体体积之和为标准状况下4.48L
6.下列关于电解池的叙述不正确的是
A.若用铁做阴极,则铁不会被氧化 B.与电源负极相连的是电解池的阴极
C.在电解池的阳极发生的是氧化反应 D.与电源正极相连的是电解池的阴极
7.用氟硼酸(HBF4属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF42Pb(BF4)2+2H2O,Pb(BF4)2为可溶于水的强电解质。下列说法正确的是( )
A.放电时,BF4-向PbO2电极移动
B.充电时,阴、阳两极增加的质量相等
C.放电时,电子由Pb电极经氟硼酸溶液流向PbO2电极
D.充电时,阳极的电极反应式为:Pb2++2H2O-2e-=PbO2+4H+
8.下列装置,可以达到相应实验目的的是
A.探究浓硫酸的脱水性和氧化性 B.验证该装置产生乙烯 C.当K接N,X为碳棒,可起到保护铁的作用 D.依据褪色时间的长短比较反应物浓度对反应速率的影响
A.A B.B C.C D.D
9.有关如图装置的叙述正确的是
A.该装置中Fe为阴极,电极反应为: Fe-3e-+ 3OH-=Fe(OH)3
B.这是电解NaOH溶液的装置
C.该装置中Pt为负极,电极反应为:O2 + 2H2O + 4e-=4OH-
D.这是一个原电池装置
10.锂资源短缺而钠资源丰富,使钠离子电池成为弥补锂不足的替代研究对象。2020年9月和2021年7月,我国两家企业率先发布钠离子商用电池,在国际竞争中领先。某种钠离子电池放电时的工作原理如图。假定电极材料及反应设计为:。下列叙述正确的是
A.钠离子电池较锂离子电池具有更高的能量密度
B.放电时,负极的电极反应式为:
C.隔膜为阳离子交换膜且孔径应比锂离子电池隔膜的孔径小
D.充电、放电时,钠离子均向电势更高的电极移动
11.耦合电化学合成法从合成碳酸二甲酯()的反应原理如图1所示,反应②的机理如图2所示。下列说法正确的是
A.该电化学合成法从合成碳酸二甲酯的总反应是非氧化还原反应
B.图2含物质中的价态保持不变
C.是反应②的催化剂
D.工作过程中反应①、②和③逐级转移电子,电子的能量保持不变
12.高铁酸盐在电池领域的应用日趋成熟.用电解法制备高铁酸盐的装置如下图所示.下列说法错误的是
A.该离子交换膜为阳膜,由右至左移动
B.阳极的电极反应式为
C.电解一段时间后,阴极室的值不变
D.高铁酸盐还可用于水的消毒和净化
13.图a、b、c分别为氯化钠在不同状态下的导电实验的微观示意图(X、Y均表示石墨电极,且与直流电源连接方式相同,表示水分子)。下列说法正确的是
A.Y电极为阳极
B.能导电的装置中,Y电极产物不相同
C.NaCl是电解质,三种状态下都能导电
D.图b说明通电后发生了电离
14.一种可充电锂—空气电池如图所示。当电池放电时,与在多孔碳材料电极处生成(x=0或1)。
下列说法不正确的是
A.放电时,多孔碳材料电极为正极
B.放电时,外电路电流由多孔碳材料电极流向锂电极
C.充电时,电解质溶液中向多孔碳材料区迁移
D.充电时,电池总反应为
15.将如图所示实验装置的K闭合,下列叙述不正确的是
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(SO)不变
D.片刻后可观察到滤纸a点变红
二、填空题
16.某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。请回答下列问题:
(1)甲池为_______(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的反应式为_______
(2)乙池中A(石墨)电极的名称为_______(填“正极”“负极”“阴极”或“阳极”),总反应的化学方程式为_______
(3)当乙池中B极质量增加21.6g时,甲池中理论上消耗O2的体积为_______L(标准状况下)。
17.如图在A、B、C三只烧杯中各盛放稀硫酸、氯化钠溶液和硝酸银溶液
(1)图中A池是_________ (填“原电池” “电解池”或“电镀池”)。
(2)石墨1电极的名称是________,检验该电极反应产物的方法是_________
(3)写出以下电极的电极反应式
B池:石墨1电极_______ 石墨2电极__________
C池:Ag电极__________ Cu电极________
(4)写出B池中反应的离子方程式_______________
三、实验题
18.用酸性溶液脱除后的废液,通过控制电压电解得以再生某同学使用石墨电极,在不同电压下电解的溶液,研究废液再生机理记录如下表。、、代表电压值:
序号 电压 阳极现象 检验阳极产物
Ⅰ 电极附近出现黄色,有气泡产生 有、有
Ⅱ 电极附近出现黄色,无气泡产生 有、无
Ⅲ 无明显变化 无、无
(1)用酸性溶液脱除的离子方程式为___________。
(2)检验废液中是否含有的试剂是___________。
(3)Ⅰ中,产生的原因可能是在阳极放电,生成的将氧化写出有关反应的方程式___________。
(4)由Ⅱ推测,产生的原因可能是___________。
(5)Ⅱ中虽未检测出,但在阳极是否放电仍需进一步验证电解的溶液做对照实验,记录如下表。
序号 电压 阳极现象 检验阳极产物
Ⅳ 无明显变化 有
Ⅴ 无明显变化 无
①溶液的浓度是___________。
②与Ⅱ对比,得出两点结论:
第一:通过控制电压,证实了产生的两种原因都成立。
第二:___________。
四、有机推断题
19.尼龙66机械强度高,刚性大,广泛用于制造机械、汽车、电气装置的零件,其结构简式如下所示。
(尼龙66)
尼龙66的合成与氯碱工业结合。
(1)制备。是_______分子(填“非极性”或“极性”)。
(2)尼龙66的一种合成路线如下所示。
①A属于芳香烃,其结构简式是_______。
②B→的反应类型是_______。
③D存在顺反异构体,生成D的化学方程式是_______。
④生成尼龙66的化学方程式是_______。
(3)C、F反应合成尼龙66时,通过蒸出_______(填物质)来促进反应。
(4)上述合成F的路线生产效率不高。为提高生产效率,科学家研发出了经由电解合成F的方法:
。
其中电解反应如下:
阳极:
阴极:
生成M的总反应方程式是_______。与其他有机合成相比,电有机合成具有反应条件温和、反应试剂纯净和生产效率高等优点。
参考答案:
1.D
【分析】废料中加入过量的炭黑,还原焙烧,锰元素变成二价锰离子,酸浸时得到锰离子、锌离子和亚铁离子,过量的碳黑不溶于酸,过滤变成滤渣,溶液中需要除去亚铁离子,应将亚铁离子氧化为铁离子以氢氧化铁沉淀形成分离除去,但是需要注意二价锰离子在酸性条件下比较稳定,pH高于5.5时易被O2氧化,所以应先通入氧气,后加入碳酸锰调节溶液的pH值并控制二价锰离子不被氧化,最后通过电解,锌离子得到电子在阴极生成锌,二价锰离子在阳极失去电子生成二氧化锰;
【详解】A.“还原焙烧”中MnO2、MnOOH分别与炭黑反应,2MnOOH+C2MnO+CO↑+H2O↑、 MnO2+CMnO+CO↑,反应中锰元素被还原为MnO,MnO能和酸反应有利于“酸浸”时溶出,A正确;
B.“酸浸” 过程中适当加热,能加快浸取速率,B正确;
C.根据以上分析,加入碳酸锰调节溶液的pH值,将杂质Fe3+转化为Fe(OH)3沉淀除去,C正确;
D.由图可知电解阳极锰离子失去电子发生氧化反应产生二氧化锰,则阳极电极反应式为,D错误;
故选D。
2.B
【分析】由图可知,Li电极为负极,电极反应式为,催化电极为正极,电极反应式为。
【详解】A.Li是活泼金属,与水发生反应,不能用硫酸锂溶液做电解质,故A错误;
B.根据电极反应式可知,放电时负极每消耗4molLi,转移4mole-,正极吸收,故B正确;
C.由上述分析可知,催化电极为正极,铅蓄电池中铅作负极,PbO2作正极,催化电极应与PbO2电极相连,故C错误;
D.充电时是电解池,电子从电源的负极沿导线流向电解池阴极,从电解池阳极流向电源正极,电子不经过电解质溶液,故D错误;
答案选B。
3.A
【详解】A.根据图示可知:在Ni电极上CO得到电子产生C、O2-,电极反应式为:CO+4e-=C+3O2-,发生还原反应,所以Ni电极作阴极,与电源的负极连接,A正确;
B.在Ni-YSZ电极上CH4失去电子变为CO,电极反应式为CH4-4e-+2O2-=CO2+2H2,在Ni电极上CO得到电子被还原为C单质,Ni电极反应式为:CO+4e-=C+3O2-,根据同一闭合回路中电子转移数目相等,可知在反应过程中,不需要不断补充CO,B错误﹔
C.反应条件未知,不能计算生成氢气的物质的量,就无法计算转移电子的物质的量,C错误;
D.在Ni-YSZ电极上CH4失去电子变为CO,电极反应式为CH4-4e-+2O2-=CO2+2H2,D错误﹔
故合理选项是A。
4.B
【分析】M极为嵌锂石墨烯(),N极为钴酸锂(),Li是活泼性金属,则M极为负极,N极为正极。
【详解】A.根据原电池“同性相吸”,则放电时,由M极向N极迁移,故A错误;
B.充电时,电源正极连接电池的正极,电源负极连接电池的负极即M极接直流电源负极,故B正确;
C.放电时,N极为正极,其电极反应式为:,故C错误;
D.充电时,M极为阴极,发生还原反应,其电极反应式为:,故D错误。
综上所述,答案为B。
5.C
【详解】由工作原理图可知,四室中左端电极室的H+通过阳膜1进入产品室,H2PO2-由右向左穿过阴膜进入产品室,因此左端电极为阳极,和电源正极相连,a为正极,则b为负极,右端石墨电极为阴极。
A.电源a极为正极,所连石墨电极上的反应为氧化反应2H2O-4e-=4H++O2↑,A错误;
B.氢氧化钠溶液所在的极室中发生的电极反应为还原反应2H2O+2e-=4OH-+H2↑,有OH-生成,故pH增大,B错误;
C.H+由左向右穿过阳膜1,H2PO2-由右向左穿过阴膜,C正确;
D.根据电极反应,当导线中转移0.4 mol e-时,阳极产生0.1 mol O2,阴极产生0.2 mol H2,产生气体体积之和为标准状况下6.72 L,故D错误;
本题正确答案为C。
【点睛】根据离子移动方向判断电解池的阴阳极,进而判断电源的正负极是解题的关键。
6.D
【详解】A.阴极发生还原反应,若用铁做阴极,则铁不会被氧化,A正确;
B.在电解池中,与电源负极相连的是电解池的阴极,B正确;
C.在电解池中,阳极发生的是氧化反应,C正确;
D.在电解池中,与电源正极相连的是电解池的阳极,D错误;
故选D。
7.D
【分析】电池的总反应为:Pb+PbO2+4HBF42Pb(BF4)2+2H2O,又Pb(BF4)2为可溶于水的强电解质,则放电时负极反应为:Pb-2e-=Pb2+;正极反应:PbO2+2e-+4H+=Pb2++2H2O,阴离子向负极移动,电子由负极经过外电路移向正极;充电时,阳极与正极相反,反应为:Pb2++2H2O-2e-═PbO2+4H+,阴极与负极相反,反应为:Pb2++2e-=Pb,据此分析解答。
【详解】A.放电时,阴离子向负极移动,则BF4-向Pb电极移动,故A错误;
B.充电时,阳极反应为:Pb2++2H2O-2e-═PbO2+4H+,阴极反应为:Pb2++2e-=Pb,则阴、阳两极增加的质量不相等,故B错误;
C.放电时,电子由负极经过外电路移向正极,不能经氟硼酸溶液,故C错误;
D.充电时,PbO2电极和电源的正极相连,电极反应式为Pb2++2H2O-2e-═PbO2+4H+,故D正确。
答案选D。
8.A
【详解】A.蔗糖与浓硫酸反应变黑,说明浓硫酸具有脱水性,品红褪色,说明生成SO2,证明浓硫酸具有强氧化性,A符合题意;
B.乙醇与浓硫酸加热会产生乙烯,但由于乙醇会被浓硫酸碳化,C与浓硫酸反应生成SO2,且乙醇易挥发,乙醇、乙烯、SO2均能使KMnO4褪色,故不能说明产生乙烯,B不符合题意;
C.K接N时此时为电解池,Fe为阳极,阳极失电子生成Fe2+,不能护铁,C不符合题意;
D.KMnO4滴入草酸,由于草酸过量,KMnO4会立即褪色,无法判断反应速率,应该保持KMnO4浓度一致,草酸过量且浓度不同,D不符合题意;
故选A。
9.D
【分析】这是一个原电池装置,铁为负极,Pt为正极。
【详解】A.图为原电池装置,铁为负极,电极反应为: Fe-2e-+2OH-═Fe(OH)2,故A错误;
B.这是原电池装置,故B错误;
C.该装置中Pt为正极,氧气在电极上得电子发生还原反应,电极反应为:O2+2H2O+ 4e-=4OH-,故C错误;
D.这是一个原电池装置,铁为负极,Pt为正极,总反应为2Fe+O2+2H2O=2Fe(OH)2,O2+2H2O+4Fe(OH)2=4Fe(OH)3,故D正确;
故选D。
10.B
【详解】A.因为钠的相对原子质量较锂的大,且r(Na+)>r(Li+),单位质量或单位体积的钠离子电池储能、放能较锂离子电池少,钠离子电池的能量密度较锂离子电池低,故A错误;
B.放电时,负极失去电子,发生氧化反应,其电极反应为,故B正确;
C.由图示可知,钠离子电池充放电时依靠Na+迁移导电,则该隔膜为阳离子交换膜;又因为r(Na+)>r(Li+),则孔径应比锂离子电池隔膜的孔径大,故C错误;
D.充电时,作电解池,阳离子向阴极移动,即钠离子向阴极迁移,阴极的电势低于阳极的电势,故D错误;
答案为B。
11.A
【详解】A.①阴极:CO2 +2CH3OH+2e-=CO+2CH3O-+H2O,③阳极:2Br--2e-=Br2,②2CH3O-+CO+Br2=2Br-+(CH3O)2CO,①+②+③得总反应CO2 +2CH3OH H2O+(CH3O)2CO,合成碳酸二甲酯过程中,元素的化合价末发生变化,总反应是非氧化还原反应,A正确;
B.图2由→PdBr2,Pd元素从0升到+2价,的价态发生变化,B错误;
C.反应②发生Br2→2Br-,参与反应,作为中间产物,不是催化剂,C错误;
D.工作过程中反应①发生CO2→CO得到2个电子,③2Br-→Br2都是失去2个电子,反应②Br2→2Br-得电子,CO失电子生成(CH3O)2CO,反应①、②和③不是逐级转移电子,电子的能量保持不变,D错误;
故选A。
12.C
【分析】用电解法制备高铁酸盐,Fe失电子发生氧化反应,Fe是阳极,阳极反应式为,阴极反应式为;
【详解】A.Fe是阳极,阳极生成,为防止向阴极移动,该离子交换膜为阳膜,由右至左移动,故A正确;
B.用电解法制备高铁酸盐,Fe失电子发生氧化反应,阳极的电极反应式为,故B正确;
C.阴极反应式为,电解一段时间后,阴极室的值增大,故C错误;
D.高铁酸盐中铁的化合价为+6,具有强氧化性,的还原产物水解为胶体,吸附水中杂质,所以可用于水的消毒和净化,故D正确;
选C。
13.B
【详解】A.氯离子半径大于钠离子,则图中黑球代表的离子是Cl-,b图中阴离子向X极移动,失电子生成氯气,则X为阳极,接电源正极,Y电极为阴极,与电源负极相连,故A错误;
B.bc中存在自由移动的离子,为能导电的装置,Y是阴极,图b中是Na+得电子生成Na单质,图c中是水电离的H+得电子生成H2,产物不同,故B正确;
C.是电解质,NaCl在晶体状态时离子不能自由移动,不导电,即图a不导电,故C错误;
D.图b说明通电后,电离出的离子发生了定向移动,电解质的电离不需要通电,只需要熔融状态或溶于水,故D错误;
本题答案B。
14.C
【分析】当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x,即O2在多孔碳材料电极表面得到电子生成O2-,再与转移过来的Li+结合生成Li2O2-x,所以锂电极为负极,多孔碳材料电极为正极,原电池总反应为2Li+(1-)O2=Li2O2-x,原电池工作时,外电路中:电子由负极锂电极经过导线流向正极多孔碳材料电极,电解质溶液中:阳离子Li+移向正极多孔碳材料电极,阴离子移向负极锂电极;充电时,装置为电解池,原电池的正极与电源正极相接,负极与电源负极相接,阴阳极电极反应与原电池负正极反应恰好相反,据此分析解答。
【详解】A.由分析可知,放电时,多孔碳材料电极为正极,A正确;
B.由分析可知,放电时,外电路的电流由正极多孔碳材料电极流向负极锂电极,B正确;
C.由分析可知,充电时,多孔碳材料电极为阳极,锂电极为阴极,故电解质溶液中向阴极锂电极区迁移,C错误;
D.由分析可知,充电时,电池总反应刚好是原电池总反应的逆过程,即为,D正确;
故答案为:C。
15.B
【分析】关闭K后,甲、乙装置能自发的进行氧化还原反应,是将化学能转化为电能的原电池,金属性强的锌做负极,锌失去电子发生氧化反应生成锌离子,铜做正极,铜离子在正极上得到电子发生还原反应生成铜,盐桥中的钾离子移向乙池、氯离子移向甲池;与负极锌相连的a为电解池的阴极,水在阴极得到电子生成氢气和氢氧根离子,电极附近溶液呈碱性,能使酚酞溶液变为红色,b为阳极,水在阳极失去电子发生氧化反应生成氧气和氢离子,电极附近溶液呈酸性。
【详解】A.由分析可知,铜做正极,铜离子在正极上得到电子发生还原反应生成铜,故A正确;
B.电解质溶液不能传递电子,所以装置中电子沿Zn→a,b→Cu路径流动,故B错误;
C.由分析可知,锌做负极,锌失去电子发生氧化反应生成锌离子,溶液中硫酸根离子不参加反应,所以硫酸根离子浓度不变,故C正确;
D.由分析可知,与负极锌相连的a为电解池的阴极,水在阴极得到电子生成氢气和氢氧根离子,电极附近溶液呈碱性,能使酚酞溶液变为红色,故D正确;
故选B。
16.(1) 原电池 CH3OH 6e-+8OH-=CO+6H2O
(2) 阳极 4AgNO3+2H2O4Ag+O2↑+4HNO3
(3)1.12
【分析】该串联装置中,甲池为燃料电池,存在自发进行的反应,因此甲池为原电池,乙池和丙池为电解池。
(1)
根据前面分析甲池为原电池,通入CH3OH电极的反应式为
CH3OH 6e-+8OH-=CO+6H2O。
(2)
乙池中A(石墨)与原电池正极相连,因此A电极的名称为阳极,阳极是水中氢氧根失去电子变为氧气和水,阴极是银离子得到电子变为银单质,即总反应式为4AgNO3+2H2O4Ag+O2↑+4HNO3。
(3)
根据关系式4Ag~ O2,当乙池中B极质量增加21.6g时(物质的量为0.2mol),甲池中理论上消耗O2物质的量为0.05mol,则标准状况下体积为11.2L。
17. 原电池 阳极 将湿润的淀粉碘化钾试纸放在电极上方,试纸变蓝 2Cl--2e-=Cl2↑ 2H++2e-=H2↑或2H2O+2e-=H2↑+2OH- Ag-e-=Ag+ Ag+ +e-= Ag 2Cl- + 2H2O2OH- + Cl2 ↑+ H2 ↑
【分析】根据图中装置连接及电化学原理可判断出,图中A池为原电池工作原理,Zn作负极,发生失电子的氧化反应,Cu作正极,氢离子发生得电子的还原反应;则B池与C池均为电解池工作原理,B池石墨1连接电池的正极,作电解池的阳极,氯离子发生失电子的氧化反应生成氯气,石墨2作电解池的阴极,水中氢离子在此极发生得电子的还原反应生成氢气和氢氧根离子;C池Cu极连接负极,作电解池的阴极,Ag+发生得电子的还原反应生成Ag,Ag极作电解池的阳极,发生失电子的氧化反应生成Ag+,据此分析解答。
【详解】(1)根据上述分析可知,图中A池是原电池;
(2)结合上述分析可知,B池为电解池,石墨1电极的名称是阳极;发生的电极反应为:2Cl—-2e-=Cl2↑,可用湿润的淀粉碘化钾试纸放在电极上方,若试纸变蓝,则产生的为氯气,故答案为:阳极;将湿润的淀粉碘化钾试纸放在电极上方,试纸变蓝;
(3) B池:石墨1连接电池的正极,作电解池的阳极,氯离子发生失电子的氧化反应生成氯气,电极反应式为:2Cl--2e-=Cl2↑;石墨2作电解池的阴极,水中氢离子在此极发生得电子的还原反应生成氢气和氢氧根离子,2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-;
C池:Ag极作电解池的阳极,发生失电子的氧化反应生成Ag+,电极反应式为:Ag-e-=Ag+;Cu极连接负极,作电解池的阴极,Ag+发生得电子的还原反应生成Ag,电极反应式为:Ag+ +e-= Ag,故答案为:2Cl--2e-=Cl2↑;2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-;Ag-e-=Ag+;Ag+ +e-= Ag;
(4)根据反应实质可看出B池为电解食盐水的反应,总反应的离子方程式为2Cl- + 2H2O2OH- + Cl2 ↑+ H2 ↑。
18.(1)2Fe3++H2S=2Fe2++2H++S↓
(2)KSCN溶液
(3)2Cl_-2e-=Cl2、2Fe2++Cl2=2Fe3++2Cl-
(4)Fe2+在阳极直接失去电子生成Fe3+
(5) 0.2 通过控制电压,证实了Fe2+的放电能力先于Cl-
【详解】(1)酸性溶液脱除,两则反应氧化还原反应,1mol氯化铁被还原为氯化亚铁得1mol电子,1mol被氧化成S单质失2mol电子,根据得失电子守恒及元素守恒得反应方程式为:2Fe3++H2S=2Fe2++2H++S↓,故答案为:2Fe3++H2S=2Fe2++2H++S↓;
(2)铁离子与KSCN反应生成血红色络合物,故用KSCN溶液检验铁离子,故答案为:KSCN溶液;
(3)Cl-在阳极放电,电解反应式为2Cl--2e-=Cl2↑,生成的氯气氧化Fe2+为Fe3+,方程式为:2Fe2++Cl2=2Fe3++2Cl-;故答案为:2Cl--2e-=Cl2↑;2Fe2++Cl2=2Fe3++2Cl-;
(4)因为阳极产物无Cl2,又Fe2+具有还原性,故也可能是Fe2+在阳极放电,被氧化为Fe3+;故答案为:Fe2+在阳极直接失去电子生成Fe3+;
(5)①因为为对比实验,故Cl-浓度应与电解FeCl2的相同,即为0.1mol/L ×2=0.2mol/L;
②检测氯气可以用淀粉碘化钾试纸,可取少量阳极附近的溶液,滴在淀粉KI试纸上,若试纸变蓝色,则说明有氯气存在;
③与II对比可知,IV中电解氯化亚铁时,电压较大a>x≥c时,氯离子放电产生氯气,即说明Fe3+可能是由氯气氧化亚铁离子得到;电压较小c>x≥b时,氯离子不放电,即还原性Fe2+>Cl-,同时也说明了铁离子也可能是由亚铁离子直接放电得到的。故结论为:①通过控制电压,证实了产生Fe3+的两种原因都成立;②通过控制电压,证实了Fe2+的放电能力先于Cl-。
故答案为:0.2;通过控制电压,证实了Fe2+的放电能力先于Cl-。
19.(1)非极性分子
(2) 加成反应 CH2ClCH=CHCH2Cl +
(3)
(4)
【分析】A为芳香化合物,故A为苯;B与水发生加成反应得到环己醇,B为;环己醇氧化得到C,C与F发生缩聚反应得到尼龙66,故C为HOOC(CH2)4COOH,F为H2N(CH2)6NH2;D存在顺反异构体,故1,3-丁二烯发生了1,4-加成,D为ClCH2CH=CHCH2Cl,D到E发生了取代反应,E为NCCH2CH=CHCH2CN,E与氢气发生加成反应得到F。
(1)
氯气分子正负电荷中心重合,是非极性分子;
(2)
B与水发生加成反应得到环己醇;D存在顺反异构体,故1,3-丁二烯发生了1,4-加成,生成D的化学方程式是:CH2ClCH=CHCH2Cl;C为HOOC(CH2)4COOH,F为H2N(CH2)6NH2,C与F发生缩聚反应得到尼龙66,化学方程式为:+;
(3)
制备尼龙66的缩聚反应为可逆反应,可通过蒸出H2O来促进反应;
(4)
由原子守恒,根据阴极的电极反应式,M为:,M与H2发生加成反应得到F。阴极和阳极的电极式相加即为生成M的总方程式:。
