专题3水溶液中的离子反应复习(含解析)高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 专题3水溶液中的离子反应复习(含解析)高二上学期化学苏教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 337.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-25 10:08:39 | ||
图片预览




文档简介
专题3《水溶液中的离子反应》复习
一、单选题
1.不能用于判断HA是弱电解质(弱酸)的依据是( )
A.浓度相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多
B.pH相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多
C.浓度相等的HCl与HA两溶液,c(H+)HCl约是c(H+)HA的100倍
D.pH相等的HCl与HA两溶液,c(HA)约是c(HCl)的100倍
2.常温下,通过下列实验探究CH3COOH溶液的性质,下列说法正确的是(已知常温下,CH3COOH的电离常数Ka=1.8×10-5)
实验1:用pH试纸测定0.1 mol·L-1CH3COOH溶液的pH,测得pH约为3
实验2:向20.00mL 0.1 mol·L-1CH3COOH溶液中逐滴加入10.00mL 0.1 mol·L-1NaOH溶液
实验3:向20.00mL 0.1 mol·L-1CH3COOH溶液中逐滴加入NaOH溶液至恰好完全反应
实验4:将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合
A.实验1:水中加入CH3COOH,水的电离程度变大
B.实验2反应后的溶液中: c(CH3COOH)+c(H+)= c(CH3COO- )+c(OH- )
C.实验3反应后的溶液中:反应后溶液pH=7
D.实验4:混合后溶液c(CH3COO- )> c(H+)> c(OH- )
3.下列关于电解质溶液的判断正确的是
A.常温下,在pH=1的溶液中,Fe2+、NO、ClO-、Na+不能大量共存
B.0.1mol·L-1AlCl3溶液中,Ba2+、K+、AlO、NO可以大量共存
C.0.1mol·L-1K2SO4溶液中,NH、Pb2+、NO、S2-可以大量
D.水电离出的c(H+)=1×10-12mol/L溶液中:Na+、Mg2+、Cl-、SO一定不能大量共存
4.水溶液呈碱性的是
A.NaHSO3 B.NH4Cl C.CH3CH2ONa D.KI
5.NA代表阿伏加德罗常数的值。下列说法正确的是
A.18gD2O中含有的中子数是9NA
B.标准状况下,22.4L SO3含有的分子数为NA
C.在Al3+浓度为0.6 mol/L的硫酸铝溶液中,SO的浓度为0.4 mol/L
D.含有0.4molHCl的浓盐酸与足量MnO2共热,转移的电子数为0.2 NA
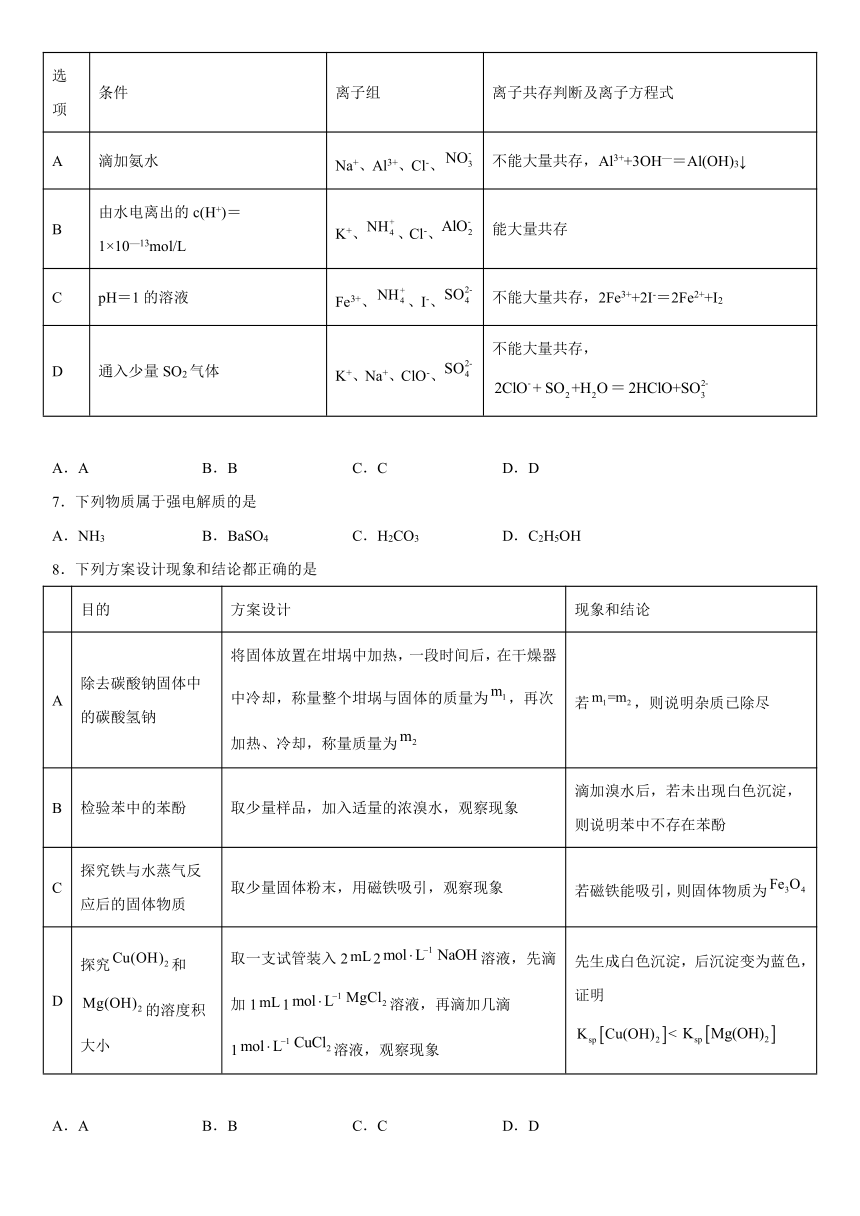
6.下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是
选项 条件 离子组 离子共存判断及离子方程式
A 滴加氨水 Na+、Al3+、Cl-、 不能大量共存,Al3++3OH—=Al(OH)3↓
B 由水电离出的c(H+)=1×10—13mol/L K+、、Cl-、 能大量共存
C pH=1的溶液 Fe3+、、I-、 不能大量共存,2Fe3++2I-=2Fe2++I2
D 通入少量SO2气体 K+、Na+、ClO-、 不能大量共存,
A.A B.B C.C D.D
7.下列物质属于强电解质的是
A.NH3 B.BaSO4 C.H2CO3 D.C2H5OH
8.下列方案设计现象和结论都正确的是
目的 方案设计 现象和结论
A 除去碳酸钠固体中的碳酸氢钠 将固体放置在坩埚中加热,一段时间后,在干燥器中冷却,称量整个坩埚与固体的质量为,再次加热、冷却,称量质量为 若,则说明杂质已除尽
B 检验苯中的苯酚 取少量样品,加入适量的浓溴水,观察现象 滴加溴水后,若未出现白色沉淀,则说明苯中不存在苯酚
C 探究铁与水蒸气反应后的固体物质 取少量固体粉末,用磁铁吸引,观察现象 若磁铁能吸引,则固体物质为
D 探究和的溶度积大小 取一支试管装入22溶液,先滴加11溶液,再滴加几滴1溶液,观察现象 先生成白色沉淀,后沉淀变为蓝色,证明
A.A B.B C.C D.D
9.下列有关化学用语表示正确的是
A.HClO 电离方程式为:HClO H++ClO- B.醛基的电子式:
C.中子数为 18 的氯原子: D.Na+的结构示意图:
10.25℃时,①浓度为0.1mol/L的氨水和②浓度为0.01mol/L的氨水,下列判断不正确的是
A.存在的粒子种类相同
B.的电离程度①②
C.中和等体积等浓度的盐酸,需要②的体积是①的10倍
D.的值:①②
11.室温下,在由水电离产生的的溶液中,一定不能大量共存的离子组是
A.、、、 B.、、、
C.、、、 D.、、、
12.某温度下,0.1 mol·L-1NaHCO3溶液pH=10,下列判断正确的是
A.c(OH-)=10-4 mol·L-1
B.加入少量NaOH固体,c(Na+)和c(HCO)均增大
C.c(Na+)+c(H+)=c(HCO)+c(OH-)
D.c(Na+)=c(HCO)+c(CO)+c(H2CO3)
二、填空题
13.三氯化碘常以二聚体I2Cl6的形式存在,经电导仪测定知,它能发生部分电离,生成的两种离子的相对质量分别为198和269,其电离方程式为_______。
14.泡沫灭火器原理:Al2(SO4)3溶液水解离子方程式:_______;
小苏打溶液水解离子方程式:_______;
二者混合后总反应:_______。
CH3COONH4溶液水解离子方程式:_______;
Al2S3在水中不能稳定存在的原因:_______ 。
15.Ⅰ.请回答下列问题:
(1)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示:
a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是____。
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 Ka=1.8×10-5 Ka1=4.3×10-7 Ka2=5.6×10-11 Ka=3.0×10-8
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是____(用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:____。
(3)已知常温时,amol/L醋酸在水中与0.1mol/LNaOH等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=_____(用含a的代数式表示)。
Ⅱ.结合表格回答下列问题(均为常温下的数据):
酸 电离常数(Ka) 酸 电离常数(Ka) 酸 电离常数(Ka) 酸 电离常数(Ka)
CH3COOH 1.8×10-5 H2CO3 K1=4.4×10-7 H2C2O4 K1=5.4×10-2 H2S K1=1.3×10-7
HClO 3×10-8 K2=4.7×10-11 K2=5.4×10-5 K2=7.1×10-15
(4)0.1mo1/L的KHC2O4溶液呈酸性,该溶液中各离子浓度由大到小的顺序为____。
(5)pH相同的NaClO和CH3COOK溶液中,[c(Na+)-c(C1O-)]____[c(K+)-c(CH3COO-)](填“>”、“<”或“=”)。
(6)向0.1mo1/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=____。(CH3COOH的电离平衡常数Ka=1.8×10-5)
16.已知室温时,的某一元酸HA在水中有0.01%发生电离,回答下列各问题:
(1)HA的电离平衡常数K=___________。
(2)升高温度时,K将___________(填“增大”、“减小”或“不变”)。
(3)由HA电离出的约为水电离出的的___________倍。
(4)HA电离出的对于平衡起到了_______(填“抑制”或“促进”)作用。
17.(1)将碳酸钙、稀盐酸、铁、氧气四种物质填写道下面的适当位置(填化学式)。
①金属单质_______:②非金属单质_______:③化合物:_______
(2)从(1)中的四种物质中选出一种或几种为反应物,按下述反应类型,各写一个化学方程式。
①分解反应:_______;②化合反应:_______;
③置换反应:_______;④复分解反应:_______。
(3)现有①氯气,②NaNO3,③NH3·H2O,④SO2,⑤酒精,⑥H2S其中属于非电解质的是_______,属于强电解质的是_______,属于弱电解质的是_______。(填写序号)
18.回答下列问题
(1)写出醋酸的电离方程式:_______;
(2)向醋酸溶液中加入少量水,电离平衡向 _______移动(填“左”或“右”) _____(填“增大”、“减小”或“不变”)。
(3)醋酸溶液和盐酸溶液与足量粉反应,初始速率____ b;完全中和这两种酸,消耗的量a______b(填“”、“”或“”)。
(4)已知时部分弱电解质的电离平衡常数数据如表所示:
化学式
电离平衡常数
以下说法不正确的是_______。填选项A.向弱酸溶液中加入少量溶液,电离平衡常数变大
B.多元弱酸的酸性主要由第一步电离决定
C.表中三种酸,酸性最强的是
D.向溶液中通入气体,可以生成
19.25℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___________。
参考答案:
1.A
【详解】A.浓度相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA和HCl相同,因为二者最终提供的H+相同,与酸的强弱无关;
B.pH相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多,说明HA提供多的H+是开始没有电离出来的,故HA酸是弱酸;
C.浓度相等的HCl与HA两溶液,c(H+)HCl约是c(H+)HA的100倍,说明HA只有1%的电离,HA酸是弱酸;
D.pH相等的HCl与HA两溶液,c(HA)约是c(HCl)的100倍,HCl全部电离,说明HA只有1%的电离,HA酸是弱酸。
答案选A。
2.D
【详解】A.加酸会抑制水电离,水中加入CH3COOH,水的电离程度变小,A错误;
B.反应后溶液中溶质为等物质的量浓度的CH3COOH和CH3COONa,根据电荷守恒有c(Na+)+c(H+)= c(CH3COO- )+c(OH- ),根据元素质量守恒有c(CH3COOH)+ c(CH3COO- )=2c(Na+),联系电荷守恒和元素质量守恒消去Na+得c(CH3COOH)+2c(H+)= c(CH3COO- )+2c(OH- ),B错误;
C.反应后溶液中溶质为CH3COONa,CH3COONa为强碱弱酸盐,其水溶液呈碱性,pH > 7,C错误;
D.pH = 3的CH3COOH溶液的物质的量浓度远远大于pH =11的NaOH溶液物质的量浓度,二者等体积混合,CH3COOH有大量剩余,溶液呈酸性,c(H+) > c(OH- ),醋酸的电离程度较小,则混合后溶液中存在c(CH3COO- )> c(H+)> c(OH- ),D正确;
故选D。
3.A
【详解】A.pH=1的溶液显酸性,Fe2+与NO、H+发生氧化还原反应,Fe2+与ClO-、H+发生氧化还原反应,均不能大量共存,故A正确;
B.铝离子水解显酸性,偏铝酸根离子水解显碱性,二者混合后,发生双水解且进行到底,产生氢氧化铝沉淀和二氧化碳,不能大量共存,故B错误;
C.Pb2+与S2-生成硫化铅沉淀,硫酸根离子与铅离子形成硫酸铅沉淀,不能大量共存,故C错误;
D.酸碱抑制水电离,所以水电离出的c(H+)=1×10-12mol/L溶液,可显酸性,可显碱性;碱性溶液中,镁离子不能大量共存;在酸性溶液中,四种离子间不反应,可以大量共存,故D错误;
故选A。
4.C
【详解】A.NaHSO3是强碱弱酸盐且为酸式盐,电离大于水解,使溶液显酸性,选项A不符合题意;
B.NH4Cl是强酸弱碱盐,电离产生的发生水解反应使溶液显酸性,选项B不符合题意;
C.CH3COONa是强碱弱酸盐,电离产生的CH3COO-发生水解反应使溶液显碱性,选项C符合题意;
D.KI是强酸强碱盐,不水解,溶液显中性,选项D不符合题意;
答案选C。
5.A
【详解】A.18gD2O的物质的量为n==0.9mol,一个重水分子中含10个中子,故0.9mol重水中含中子为9NA个,故A正确;
B.标准状况下,三氧化硫不是气体,不能根据气体摩尔体积来计算其物质的量,故B错误;
C.Al3+是弱碱阳离子,在溶液中会水解,因此Al3+浓度为0.6mol/L的硫酸铝溶液中,SO的浓度大于0.9mol/L,故C错误;
D.二氧化锰只能与浓盐酸反应,和稀盐酸不反应,含有0.4molHCl的浓盐酸不能反应完全,则转移的电子数小于0.2NA个,故D错误;
故选A。
6.C
【详解】A.氨水是弱碱,在离子方程式中一水合氨不能拆开,A错误;
B.由水电离出的c(H+)=1×10-13mol/L的溶液中水的电离被抑制,溶液可能显酸性,也可能显碱性。如果显酸性,则不能大量共存,如果显碱性,则铵根不能大量共存,B错误;
C.pH=1的溶液显酸性,铁离子氧化碘离子不能大量共存,离子方程式为2Fe3++2I-=2Fe2++I2,C正确;
D.次氯酸根具有强氧化性,能氧化SO2,反应中SO2不足,则离子方程式为,D错误;
答案选C。
7.B
【详解】A.氨气溶于水,与水反应生成一水合氨,一水合氨在溶液中部分电离,氨气属于非电解质,故A不符合题意;
B.硫酸钡难溶于水,但溶于水的硫酸钡在溶液中完全电离,属于强电解质,故B符合题意;
C.碳酸是二元弱酸,在溶液中部分电离,属于弱电解质,故C不符合题意;
D.乙醇是非电解质,在溶液中不能电离,不属于强电解质,故D不符合题意;
故选B。
8.A
【详解】A.碳酸氢钠加热易分解为碳酸钠、二氧化碳和水,用加热法除去碳酸钠固体中的碳酸氢钠。将固体放置在坩埚中加热,一段时间后,在干燥器中冷却,称量整个坩埚与固体的质量为,再次加热、冷却,称量质量为,若,则说明碳酸氢钠完全分解,杂质已除尽,A项正确;
B.三溴苯酚易溶于苯,取少量样品,加入适量的浓溴水,生成的三溴苯酚可能溶解在苯中,未出现白色沉淀,不能说明苯中不存在苯酚,B项错误;
C.磁铁能吸引铁和,固体粉末用磁铁吸引,若固体物质中有剩余的铁,也能被磁铁吸引,所以不能确定固体物质为,C项错误;
D.向22溶液中加入11溶液,完全反应后过量,再滴加几滴1溶液,溶液与过量的溶液反应生成蓝色沉淀,不能说明发生沉淀的转化,无法证明,D项错误;
故选A。
9.A
【详解】A.HClO为弱酸,是弱电解质,在溶液中部分电离,电离方程式为:HClO H++ClO-,故A正确;
B.醛基的电子式:,故B错误;
C.原子中左上角表示质量数,左下角表示质子数,则中子数为18 的氯原子:,故C错误;
D.钠原子的质子数为11,失去一个电子变为Na+,其结构示意图:,故D错误;
答案选A。
10.B
【详解】A.浓度为0.1mol/L的氨水和浓度为0.01mol/L的氨水中的粒子种类相同,A正确;
B.NH3·H2O为弱电解质,越稀电离程度越大,则电离程度②>①,B错误;
C.①中氨水浓度为②中的十倍,则中和等体积等浓度的盐酸,需要②的体积是①的10倍,C正确;
D.,②中氢氧根离子浓度小于①,则的值①<②,D正确;
故答案选B。
11.B
【分析】室温下,在由水电离产生的c(OH-)=1.0×10-12mol·L-1的溶液,水电离受到抑制,溶液呈酸性或碱性;
【详解】A.碱性条件下,不能大量存在,酸性条件下各离子之间相互不反应,能大量共存,选项A不符题意;
B.酸性条件下,、Fe2+发生氧化还原反应,、Fe2+不能共存;碱性条件下,Fe2+、Mg2+生成氢氧化物沉淀,不能大量共存,选项B符合题意;
C.酸性条件下、反应生成硫单质而不能大量共存,碱性条件下各离子之间相互不反应能大量共存,选项C不符合题意;
D.酸性条件下,碳酸根离子、亚硫酸根离子不能大量存在,碱性条件下,、、Na+、K+相互之间不反应,能大量共存,选项D不符题意;
答案选B。
12.D
【详解】A.溶液pH=10,则c(H+)=10-10 mol/L,由于温度不一定是室温,温度未知,因此不能确定Kw的大小,也就不能计算出溶液中c(OH-)大小,A错误;
B.加入少量NaOH固体,c(Na+)增大,c(OH-)增大,对HCO的水解平衡起抑制作用,导致溶液中c(HCO)减小,B错误;
C.在溶液中存在HCO电离产生的,根据电荷守恒可得:c(Na+)+c(H+)=c(HCO)+c(OH-)+2c(CO),C错误;
D.根据物料守恒可得:c(Na+)=c(HCO)+c(CO)+c(H2CO3),D正确;
故合理选项是D。
13.I2Cl6ICl+ICl
【详解】由分子式可知,I2Cl6的相对分子质量为467,由题意可知,I2Cl6发生部分电离时得到的两种离子的相对质量差为71,说明阴阳离子组成上相差2个氯原子,则两种离子分别为ICl和ICl,所以I2Cl6发生电离的电离方程式为I2Cl6ICl+ICl,故答案为:I2Cl6ICl+ICl。
14. Al3++3H2O Al(OH)3↓+3H+ HCO+H2O OH-+H2CO3 Al3++3HCO=Al(OH)3↓+3CO2↑ CH3COO-+ NH+H2O CH3COOH + NH3 H2O Al2S3+6H2O = 2Al(OH)3 ↓+ 3H2S↑
【详解】Al2(SO4)3是强酸弱碱正盐,铝离子水解,水解离子方程式为Al3++3H2O Al(OH)3↓+3H+;小苏打即碳酸氢钠,碳酸氢根离子水解,水解离子方程式为:HCO+H2O OH-+H2CO3;二者混合后发生相互促进水解,水解程度大,完全水解,混合后离子方程式为:Al3++3HCO=Al(OH)3↓+3CO2↑;CH3COONH4是弱酸弱碱盐,醋酸根离子和铵根离子均为水解且相互促进,但总的来说水解不完全,水解离子方程式为CH3COO-+ NH+H2O CH3COOH + NH3 H2O;Al2S3在水中不能稳定存在的原因是铝离子和硫离子发生相互促进水解,水解程度大,完全水解,离子方程式为Al2S3+6H2O = 2Al(OH)3 ↓+ 3H2S↑。
15.(1)c>b>a;
(2) a<d<c<b ClO﹣+H2O+CO2=+HClO
(3)
(4)c(K+)>c()>c(H+)>c()>c(OH-)
(5)=
(6)5
【解析】(1)
根据越稀越电离规律,a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是c>b>a;故答案为:c>b>a;
(2)
①据电离平衡常数可知,酸性由强到弱的顺序为:CH3COOH>H2CO3>HClO>,弱酸的酸性越弱其酸根离子的水解程度越大,溶液碱性越强,则pH由小到大排列顺序是a<d<c<b,故答案为:a<d<c<b;
②酸性:H2CO3>HClO>,向次氯酸钠溶液中通入少量二氧化碳,反应生成碳酸氢根离子,该反应的离子方程式为:ClO﹣+H2O+CO2=+HClO;故答案为:ClO﹣+H2O+CO2=+HClO;
(3)
醋酸钠溶液水解呈碱性,常温时,a mol/L醋酸在水中与0.1 mol/L NaOH等体积混合,溶液为中性,则所得为醋酸和醋酸钠的混合溶液,且c(OH-)=c(H+),溶液中存在电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(Na+)=c(CH3COO-)=0.05 mol/L,由物料守恒可知:,,由醋酸钠的水解离子方程式得平衡常数;故答案为:;
(4)
0.1mo1/L的KHC2O4溶液呈酸性,溶液中大量存在K+和,故两者浓度最大,由于水解、电离损耗,导致其浓度比K+小,KHC2O4溶液呈酸性,说明溶液中电离大于水解,则c(H+)>c()>c(OH-),故溶液中各离子浓度由大到小的顺序为c(K+)>c()>c(H+)>c()>c(OH-),故答案为c(K+)>c()>c(H+)>c()>c(OH-);
(5)
根据电离平衡常数可知:酸性CH3COOH>HClO,则NaClO的水解程度大于CH3COOK,所以pH相同时CH3COOK的浓度大于NaClO,由于两溶液的pH相同,则两溶液中氢离子、氢氧根离子的浓度相同,两溶液中都存在电荷守恒, ,,由于两溶液的pH相同,则两溶液中氢离子、氢氧根离子的浓度相同,根据电荷守恒可得:c(Na+)-c(ClO-)=c(K+)-c(CH3COO-),故答案为:=;
(6)
醋酸的电离平衡常数Ka==1.8×10-5,溶液中c(CH3COOH):c(CH3COO-)=5:9,则c(H+)=1.8×10-5×=1.8×10-5×= 1×10-5 mol/L,则该溶液的pH=5,故答案为5。
16.(1)10-9
(2)增大
(3)104
(4)抑制
【解析】(1)
的某一元酸HA在水中有0.01%发生电离,HA电离出的c(H+)为,由HAH++A-,c(H+)=c(A-)=,则电离平衡常数;
(2)
HA电离是吸热过程,升高温度促进电离,H+和A-的浓度增大,则K增大;
(3)
HA电离出的,水电离出的,则水电离出的,;
(4)
HA电离出,溶液中浓度增加,抑制了水的电离。
17. Fe O2 CaCO3 CaCO3 CaO+CO2↑ 3Fe+2O2Fe3O4 Fe+2HCl=FeCl2+H2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ ④⑤ ② ③⑥
【详解】(1)碳酸钙、稀盐酸、铁、氧气四种物质中,铁是由一种金属元素组成的纯净物,是金属单质;氧气是由一种非金属元素组成的纯净物,是非金属单质;碳酸钙是由多种元素组成的纯净物,是化合物;盐酸是HCl的水溶液,是混合物。
(2)①碳酸钙可以高温分解为氧化钙和二氧化碳:CaCO3 CaO+CO2↑。
②铁可以在纯氧中燃烧,生成Fe3O4,发生化合反应:3Fe+2O2Fe3O4。
③铁能和盐酸发生置换反应,生成FeCl2和H2:Fe+2HCl=FeCl2+H2↑。
④碳酸钙能和盐酸发生复分解反应,生成CaCl2、H2O和CO2:CaCO3+2HCl=CaCl2+H2O+CO2↑。
(3)在水中能全部电离的化合物为强电解质,通常强酸、强碱和绝大部分盐是强电解质;在水中部分电离的化合物为弱电解质,通常弱酸、弱碱和水是弱电解质;在水中和熔融状态下都不能导电的化合物为非电解质,非电解质主要包括除了水之外的非金属氧化物、大部分有机物、NH3。单质和混合物既不是电解质,也不是非电解质。①氯气是单质,既不是电解质,也不是非电解质;②NaNO3属于盐,是强电解质;③NH3·H2O是弱碱,属于弱电解质;④SO2是非金属氧化物,属于非电解质;⑤酒精是有机物,属于非电解质;⑥H2S溶于水是氢硫酸,是弱酸,是弱电解质。故答案为:④⑤,②,③⑥。
18.(1)CH3COOH CH3COO-+H+
(2) 右 增大
(3) < =
(4)A
【详解】(1)醋酸是弱酸,是部分电离。醋酸的电离方程式为;
(2)向醋酸溶液中加入少量水,根据越稀越电离可知电离平衡向右移动;减小,n(CH3COO-)增大,故增大;
(3)醋酸是弱酸,部分电离,盐酸是强酸,全部电离,所以等浓度的两种酸中,盐酸中的H+浓度大于醋酸,故同浓度的两溶液与足量粉反应,初始速率(4)A. 弱酸电离平衡常数只与温度有关,温度不变,常数不变,A错误;
B. 多元弱酸的酸性主要由第一步电离决定,B正确;
C.表中三种酸根据电离常数的比较可得酸性强弱顺序,电离常数越大,酸性越强,故酸性CH3COOH>H2CO3>HClO>HCO,C正确;
D. 因为HClO酸性弱于碳酸,根据较强酸可制较弱酸,向溶液中通入气体,生成次氯酸和碳酸氢钠,D正确;
故选A。
19.90∶11
【详解】pH=11的苛性钠溶液中c(OH-)=mol/L=0.001mol/L,pH=1的稀硫酸中c(H+)=0.1mol/L,pH=2的混合溶液中c(H+)=0.01mol/L,则两溶液混合时满足:0.1mol/L V2-0.001mol/LV1=0.01mol/L(V1+ V2),整理可得:V1∶V2=90:11,故答案为:90:11。
一、单选题
1.不能用于判断HA是弱电解质(弱酸)的依据是( )
A.浓度相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多
B.pH相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多
C.浓度相等的HCl与HA两溶液,c(H+)HCl约是c(H+)HA的100倍
D.pH相等的HCl与HA两溶液,c(HA)约是c(HCl)的100倍
2.常温下,通过下列实验探究CH3COOH溶液的性质,下列说法正确的是(已知常温下,CH3COOH的电离常数Ka=1.8×10-5)
实验1:用pH试纸测定0.1 mol·L-1CH3COOH溶液的pH,测得pH约为3
实验2:向20.00mL 0.1 mol·L-1CH3COOH溶液中逐滴加入10.00mL 0.1 mol·L-1NaOH溶液
实验3:向20.00mL 0.1 mol·L-1CH3COOH溶液中逐滴加入NaOH溶液至恰好完全反应
实验4:将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合
A.实验1:水中加入CH3COOH,水的电离程度变大
B.实验2反应后的溶液中: c(CH3COOH)+c(H+)= c(CH3COO- )+c(OH- )
C.实验3反应后的溶液中:反应后溶液pH=7
D.实验4:混合后溶液c(CH3COO- )> c(H+)> c(OH- )
3.下列关于电解质溶液的判断正确的是
A.常温下,在pH=1的溶液中,Fe2+、NO、ClO-、Na+不能大量共存
B.0.1mol·L-1AlCl3溶液中,Ba2+、K+、AlO、NO可以大量共存
C.0.1mol·L-1K2SO4溶液中,NH、Pb2+、NO、S2-可以大量
D.水电离出的c(H+)=1×10-12mol/L溶液中:Na+、Mg2+、Cl-、SO一定不能大量共存
4.水溶液呈碱性的是
A.NaHSO3 B.NH4Cl C.CH3CH2ONa D.KI
5.NA代表阿伏加德罗常数的值。下列说法正确的是
A.18gD2O中含有的中子数是9NA
B.标准状况下,22.4L SO3含有的分子数为NA
C.在Al3+浓度为0.6 mol/L的硫酸铝溶液中,SO的浓度为0.4 mol/L
D.含有0.4molHCl的浓盐酸与足量MnO2共热,转移的电子数为0.2 NA
6.下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是
选项 条件 离子组 离子共存判断及离子方程式
A 滴加氨水 Na+、Al3+、Cl-、 不能大量共存,Al3++3OH—=Al(OH)3↓
B 由水电离出的c(H+)=1×10—13mol/L K+、、Cl-、 能大量共存
C pH=1的溶液 Fe3+、、I-、 不能大量共存,2Fe3++2I-=2Fe2++I2
D 通入少量SO2气体 K+、Na+、ClO-、 不能大量共存,
A.A B.B C.C D.D
7.下列物质属于强电解质的是
A.NH3 B.BaSO4 C.H2CO3 D.C2H5OH
8.下列方案设计现象和结论都正确的是
目的 方案设计 现象和结论
A 除去碳酸钠固体中的碳酸氢钠 将固体放置在坩埚中加热,一段时间后,在干燥器中冷却,称量整个坩埚与固体的质量为,再次加热、冷却,称量质量为 若,则说明杂质已除尽
B 检验苯中的苯酚 取少量样品,加入适量的浓溴水,观察现象 滴加溴水后,若未出现白色沉淀,则说明苯中不存在苯酚
C 探究铁与水蒸气反应后的固体物质 取少量固体粉末,用磁铁吸引,观察现象 若磁铁能吸引,则固体物质为
D 探究和的溶度积大小 取一支试管装入22溶液,先滴加11溶液,再滴加几滴1溶液,观察现象 先生成白色沉淀,后沉淀变为蓝色,证明
A.A B.B C.C D.D
9.下列有关化学用语表示正确的是
A.HClO 电离方程式为:HClO H++ClO- B.醛基的电子式:
C.中子数为 18 的氯原子: D.Na+的结构示意图:
10.25℃时,①浓度为0.1mol/L的氨水和②浓度为0.01mol/L的氨水,下列判断不正确的是
A.存在的粒子种类相同
B.的电离程度①②
C.中和等体积等浓度的盐酸,需要②的体积是①的10倍
D.的值:①②
11.室温下,在由水电离产生的的溶液中,一定不能大量共存的离子组是
A.、、、 B.、、、
C.、、、 D.、、、
12.某温度下,0.1 mol·L-1NaHCO3溶液pH=10,下列判断正确的是
A.c(OH-)=10-4 mol·L-1
B.加入少量NaOH固体,c(Na+)和c(HCO)均增大
C.c(Na+)+c(H+)=c(HCO)+c(OH-)
D.c(Na+)=c(HCO)+c(CO)+c(H2CO3)
二、填空题
13.三氯化碘常以二聚体I2Cl6的形式存在,经电导仪测定知,它能发生部分电离,生成的两种离子的相对质量分别为198和269,其电离方程式为_______。
14.泡沫灭火器原理:Al2(SO4)3溶液水解离子方程式:_______;
小苏打溶液水解离子方程式:_______;
二者混合后总反应:_______。
CH3COONH4溶液水解离子方程式:_______;
Al2S3在水中不能稳定存在的原因:_______ 。
15.Ⅰ.请回答下列问题:
(1)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示:
a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是____。
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 Ka=1.8×10-5 Ka1=4.3×10-7 Ka2=5.6×10-11 Ka=3.0×10-8
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是____(用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:____。
(3)已知常温时,amol/L醋酸在水中与0.1mol/LNaOH等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=_____(用含a的代数式表示)。
Ⅱ.结合表格回答下列问题(均为常温下的数据):
酸 电离常数(Ka) 酸 电离常数(Ka) 酸 电离常数(Ka) 酸 电离常数(Ka)
CH3COOH 1.8×10-5 H2CO3 K1=4.4×10-7 H2C2O4 K1=5.4×10-2 H2S K1=1.3×10-7
HClO 3×10-8 K2=4.7×10-11 K2=5.4×10-5 K2=7.1×10-15
(4)0.1mo1/L的KHC2O4溶液呈酸性,该溶液中各离子浓度由大到小的顺序为____。
(5)pH相同的NaClO和CH3COOK溶液中,[c(Na+)-c(C1O-)]____[c(K+)-c(CH3COO-)](填“>”、“<”或“=”)。
(6)向0.1mo1/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=____。(CH3COOH的电离平衡常数Ka=1.8×10-5)
16.已知室温时,的某一元酸HA在水中有0.01%发生电离,回答下列各问题:
(1)HA的电离平衡常数K=___________。
(2)升高温度时,K将___________(填“增大”、“减小”或“不变”)。
(3)由HA电离出的约为水电离出的的___________倍。
(4)HA电离出的对于平衡起到了_______(填“抑制”或“促进”)作用。
17.(1)将碳酸钙、稀盐酸、铁、氧气四种物质填写道下面的适当位置(填化学式)。
①金属单质_______:②非金属单质_______:③化合物:_______
(2)从(1)中的四种物质中选出一种或几种为反应物,按下述反应类型,各写一个化学方程式。
①分解反应:_______;②化合反应:_______;
③置换反应:_______;④复分解反应:_______。
(3)现有①氯气,②NaNO3,③NH3·H2O,④SO2,⑤酒精,⑥H2S其中属于非电解质的是_______,属于强电解质的是_______,属于弱电解质的是_______。(填写序号)
18.回答下列问题
(1)写出醋酸的电离方程式:_______;
(2)向醋酸溶液中加入少量水,电离平衡向 _______移动(填“左”或“右”) _____(填“增大”、“减小”或“不变”)。
(3)醋酸溶液和盐酸溶液与足量粉反应,初始速率____ b;完全中和这两种酸,消耗的量a______b(填“”、“”或“”)。
(4)已知时部分弱电解质的电离平衡常数数据如表所示:
化学式
电离平衡常数
以下说法不正确的是_______。填选项A.向弱酸溶液中加入少量溶液,电离平衡常数变大
B.多元弱酸的酸性主要由第一步电离决定
C.表中三种酸,酸性最强的是
D.向溶液中通入气体,可以生成
19.25℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___________。
参考答案:
1.A
【详解】A.浓度相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA和HCl相同,因为二者最终提供的H+相同,与酸的强弱无关;
B.pH相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多,说明HA提供多的H+是开始没有电离出来的,故HA酸是弱酸;
C.浓度相等的HCl与HA两溶液,c(H+)HCl约是c(H+)HA的100倍,说明HA只有1%的电离,HA酸是弱酸;
D.pH相等的HCl与HA两溶液,c(HA)约是c(HCl)的100倍,HCl全部电离,说明HA只有1%的电离,HA酸是弱酸。
答案选A。
2.D
【详解】A.加酸会抑制水电离,水中加入CH3COOH,水的电离程度变小,A错误;
B.反应后溶液中溶质为等物质的量浓度的CH3COOH和CH3COONa,根据电荷守恒有c(Na+)+c(H+)= c(CH3COO- )+c(OH- ),根据元素质量守恒有c(CH3COOH)+ c(CH3COO- )=2c(Na+),联系电荷守恒和元素质量守恒消去Na+得c(CH3COOH)+2c(H+)= c(CH3COO- )+2c(OH- ),B错误;
C.反应后溶液中溶质为CH3COONa,CH3COONa为强碱弱酸盐,其水溶液呈碱性,pH > 7,C错误;
D.pH = 3的CH3COOH溶液的物质的量浓度远远大于pH =11的NaOH溶液物质的量浓度,二者等体积混合,CH3COOH有大量剩余,溶液呈酸性,c(H+) > c(OH- ),醋酸的电离程度较小,则混合后溶液中存在c(CH3COO- )> c(H+)> c(OH- ),D正确;
故选D。
3.A
【详解】A.pH=1的溶液显酸性,Fe2+与NO、H+发生氧化还原反应,Fe2+与ClO-、H+发生氧化还原反应,均不能大量共存,故A正确;
B.铝离子水解显酸性,偏铝酸根离子水解显碱性,二者混合后,发生双水解且进行到底,产生氢氧化铝沉淀和二氧化碳,不能大量共存,故B错误;
C.Pb2+与S2-生成硫化铅沉淀,硫酸根离子与铅离子形成硫酸铅沉淀,不能大量共存,故C错误;
D.酸碱抑制水电离,所以水电离出的c(H+)=1×10-12mol/L溶液,可显酸性,可显碱性;碱性溶液中,镁离子不能大量共存;在酸性溶液中,四种离子间不反应,可以大量共存,故D错误;
故选A。
4.C
【详解】A.NaHSO3是强碱弱酸盐且为酸式盐,电离大于水解,使溶液显酸性,选项A不符合题意;
B.NH4Cl是强酸弱碱盐,电离产生的发生水解反应使溶液显酸性,选项B不符合题意;
C.CH3COONa是强碱弱酸盐,电离产生的CH3COO-发生水解反应使溶液显碱性,选项C符合题意;
D.KI是强酸强碱盐,不水解,溶液显中性,选项D不符合题意;
答案选C。
5.A
【详解】A.18gD2O的物质的量为n==0.9mol,一个重水分子中含10个中子,故0.9mol重水中含中子为9NA个,故A正确;
B.标准状况下,三氧化硫不是气体,不能根据气体摩尔体积来计算其物质的量,故B错误;
C.Al3+是弱碱阳离子,在溶液中会水解,因此Al3+浓度为0.6mol/L的硫酸铝溶液中,SO的浓度大于0.9mol/L,故C错误;
D.二氧化锰只能与浓盐酸反应,和稀盐酸不反应,含有0.4molHCl的浓盐酸不能反应完全,则转移的电子数小于0.2NA个,故D错误;
故选A。
6.C
【详解】A.氨水是弱碱,在离子方程式中一水合氨不能拆开,A错误;
B.由水电离出的c(H+)=1×10-13mol/L的溶液中水的电离被抑制,溶液可能显酸性,也可能显碱性。如果显酸性,则不能大量共存,如果显碱性,则铵根不能大量共存,B错误;
C.pH=1的溶液显酸性,铁离子氧化碘离子不能大量共存,离子方程式为2Fe3++2I-=2Fe2++I2,C正确;
D.次氯酸根具有强氧化性,能氧化SO2,反应中SO2不足,则离子方程式为,D错误;
答案选C。
7.B
【详解】A.氨气溶于水,与水反应生成一水合氨,一水合氨在溶液中部分电离,氨气属于非电解质,故A不符合题意;
B.硫酸钡难溶于水,但溶于水的硫酸钡在溶液中完全电离,属于强电解质,故B符合题意;
C.碳酸是二元弱酸,在溶液中部分电离,属于弱电解质,故C不符合题意;
D.乙醇是非电解质,在溶液中不能电离,不属于强电解质,故D不符合题意;
故选B。
8.A
【详解】A.碳酸氢钠加热易分解为碳酸钠、二氧化碳和水,用加热法除去碳酸钠固体中的碳酸氢钠。将固体放置在坩埚中加热,一段时间后,在干燥器中冷却,称量整个坩埚与固体的质量为,再次加热、冷却,称量质量为,若,则说明碳酸氢钠完全分解,杂质已除尽,A项正确;
B.三溴苯酚易溶于苯,取少量样品,加入适量的浓溴水,生成的三溴苯酚可能溶解在苯中,未出现白色沉淀,不能说明苯中不存在苯酚,B项错误;
C.磁铁能吸引铁和,固体粉末用磁铁吸引,若固体物质中有剩余的铁,也能被磁铁吸引,所以不能确定固体物质为,C项错误;
D.向22溶液中加入11溶液,完全反应后过量,再滴加几滴1溶液,溶液与过量的溶液反应生成蓝色沉淀,不能说明发生沉淀的转化,无法证明,D项错误;
故选A。
9.A
【详解】A.HClO为弱酸,是弱电解质,在溶液中部分电离,电离方程式为:HClO H++ClO-,故A正确;
B.醛基的电子式:,故B错误;
C.原子中左上角表示质量数,左下角表示质子数,则中子数为18 的氯原子:,故C错误;
D.钠原子的质子数为11,失去一个电子变为Na+,其结构示意图:,故D错误;
答案选A。
10.B
【详解】A.浓度为0.1mol/L的氨水和浓度为0.01mol/L的氨水中的粒子种类相同,A正确;
B.NH3·H2O为弱电解质,越稀电离程度越大,则电离程度②>①,B错误;
C.①中氨水浓度为②中的十倍,则中和等体积等浓度的盐酸,需要②的体积是①的10倍,C正确;
D.,②中氢氧根离子浓度小于①,则的值①<②,D正确;
故答案选B。
11.B
【分析】室温下,在由水电离产生的c(OH-)=1.0×10-12mol·L-1的溶液,水电离受到抑制,溶液呈酸性或碱性;
【详解】A.碱性条件下,不能大量存在,酸性条件下各离子之间相互不反应,能大量共存,选项A不符题意;
B.酸性条件下,、Fe2+发生氧化还原反应,、Fe2+不能共存;碱性条件下,Fe2+、Mg2+生成氢氧化物沉淀,不能大量共存,选项B符合题意;
C.酸性条件下、反应生成硫单质而不能大量共存,碱性条件下各离子之间相互不反应能大量共存,选项C不符合题意;
D.酸性条件下,碳酸根离子、亚硫酸根离子不能大量存在,碱性条件下,、、Na+、K+相互之间不反应,能大量共存,选项D不符题意;
答案选B。
12.D
【详解】A.溶液pH=10,则c(H+)=10-10 mol/L,由于温度不一定是室温,温度未知,因此不能确定Kw的大小,也就不能计算出溶液中c(OH-)大小,A错误;
B.加入少量NaOH固体,c(Na+)增大,c(OH-)增大,对HCO的水解平衡起抑制作用,导致溶液中c(HCO)减小,B错误;
C.在溶液中存在HCO电离产生的,根据电荷守恒可得:c(Na+)+c(H+)=c(HCO)+c(OH-)+2c(CO),C错误;
D.根据物料守恒可得:c(Na+)=c(HCO)+c(CO)+c(H2CO3),D正确;
故合理选项是D。
13.I2Cl6ICl+ICl
【详解】由分子式可知,I2Cl6的相对分子质量为467,由题意可知,I2Cl6发生部分电离时得到的两种离子的相对质量差为71,说明阴阳离子组成上相差2个氯原子,则两种离子分别为ICl和ICl,所以I2Cl6发生电离的电离方程式为I2Cl6ICl+ICl,故答案为:I2Cl6ICl+ICl。
14. Al3++3H2O Al(OH)3↓+3H+ HCO+H2O OH-+H2CO3 Al3++3HCO=Al(OH)3↓+3CO2↑ CH3COO-+ NH+H2O CH3COOH + NH3 H2O Al2S3+6H2O = 2Al(OH)3 ↓+ 3H2S↑
【详解】Al2(SO4)3是强酸弱碱正盐,铝离子水解,水解离子方程式为Al3++3H2O Al(OH)3↓+3H+;小苏打即碳酸氢钠,碳酸氢根离子水解,水解离子方程式为:HCO+H2O OH-+H2CO3;二者混合后发生相互促进水解,水解程度大,完全水解,混合后离子方程式为:Al3++3HCO=Al(OH)3↓+3CO2↑;CH3COONH4是弱酸弱碱盐,醋酸根离子和铵根离子均为水解且相互促进,但总的来说水解不完全,水解离子方程式为CH3COO-+ NH+H2O CH3COOH + NH3 H2O;Al2S3在水中不能稳定存在的原因是铝离子和硫离子发生相互促进水解,水解程度大,完全水解,离子方程式为Al2S3+6H2O = 2Al(OH)3 ↓+ 3H2S↑。
15.(1)c>b>a;
(2) a<d<c<b ClO﹣+H2O+CO2=+HClO
(3)
(4)c(K+)>c()>c(H+)>c()>c(OH-)
(5)=
(6)5
【解析】(1)
根据越稀越电离规律,a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是c>b>a;故答案为:c>b>a;
(2)
①据电离平衡常数可知,酸性由强到弱的顺序为:CH3COOH>H2CO3>HClO>,弱酸的酸性越弱其酸根离子的水解程度越大,溶液碱性越强,则pH由小到大排列顺序是a<d<c<b,故答案为:a<d<c<b;
②酸性:H2CO3>HClO>,向次氯酸钠溶液中通入少量二氧化碳,反应生成碳酸氢根离子,该反应的离子方程式为:ClO﹣+H2O+CO2=+HClO;故答案为:ClO﹣+H2O+CO2=+HClO;
(3)
醋酸钠溶液水解呈碱性,常温时,a mol/L醋酸在水中与0.1 mol/L NaOH等体积混合,溶液为中性,则所得为醋酸和醋酸钠的混合溶液,且c(OH-)=c(H+),溶液中存在电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(Na+)=c(CH3COO-)=0.05 mol/L,由物料守恒可知:,,由醋酸钠的水解离子方程式得平衡常数;故答案为:;
(4)
0.1mo1/L的KHC2O4溶液呈酸性,溶液中大量存在K+和,故两者浓度最大,由于水解、电离损耗,导致其浓度比K+小,KHC2O4溶液呈酸性,说明溶液中电离大于水解,则c(H+)>c()>c(OH-),故溶液中各离子浓度由大到小的顺序为c(K+)>c()>c(H+)>c()>c(OH-),故答案为c(K+)>c()>c(H+)>c()>c(OH-);
(5)
根据电离平衡常数可知:酸性CH3COOH>HClO,则NaClO的水解程度大于CH3COOK,所以pH相同时CH3COOK的浓度大于NaClO,由于两溶液的pH相同,则两溶液中氢离子、氢氧根离子的浓度相同,两溶液中都存在电荷守恒, ,,由于两溶液的pH相同,则两溶液中氢离子、氢氧根离子的浓度相同,根据电荷守恒可得:c(Na+)-c(ClO-)=c(K+)-c(CH3COO-),故答案为:=;
(6)
醋酸的电离平衡常数Ka==1.8×10-5,溶液中c(CH3COOH):c(CH3COO-)=5:9,则c(H+)=1.8×10-5×=1.8×10-5×= 1×10-5 mol/L,则该溶液的pH=5,故答案为5。
16.(1)10-9
(2)增大
(3)104
(4)抑制
【解析】(1)
的某一元酸HA在水中有0.01%发生电离,HA电离出的c(H+)为,由HAH++A-,c(H+)=c(A-)=,则电离平衡常数;
(2)
HA电离是吸热过程,升高温度促进电离,H+和A-的浓度增大,则K增大;
(3)
HA电离出的,水电离出的,则水电离出的,;
(4)
HA电离出,溶液中浓度增加,抑制了水的电离。
17. Fe O2 CaCO3 CaCO3 CaO+CO2↑ 3Fe+2O2Fe3O4 Fe+2HCl=FeCl2+H2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ ④⑤ ② ③⑥
【详解】(1)碳酸钙、稀盐酸、铁、氧气四种物质中,铁是由一种金属元素组成的纯净物,是金属单质;氧气是由一种非金属元素组成的纯净物,是非金属单质;碳酸钙是由多种元素组成的纯净物,是化合物;盐酸是HCl的水溶液,是混合物。
(2)①碳酸钙可以高温分解为氧化钙和二氧化碳:CaCO3 CaO+CO2↑。
②铁可以在纯氧中燃烧,生成Fe3O4,发生化合反应:3Fe+2O2Fe3O4。
③铁能和盐酸发生置换反应,生成FeCl2和H2:Fe+2HCl=FeCl2+H2↑。
④碳酸钙能和盐酸发生复分解反应,生成CaCl2、H2O和CO2:CaCO3+2HCl=CaCl2+H2O+CO2↑。
(3)在水中能全部电离的化合物为强电解质,通常强酸、强碱和绝大部分盐是强电解质;在水中部分电离的化合物为弱电解质,通常弱酸、弱碱和水是弱电解质;在水中和熔融状态下都不能导电的化合物为非电解质,非电解质主要包括除了水之外的非金属氧化物、大部分有机物、NH3。单质和混合物既不是电解质,也不是非电解质。①氯气是单质,既不是电解质,也不是非电解质;②NaNO3属于盐,是强电解质;③NH3·H2O是弱碱,属于弱电解质;④SO2是非金属氧化物,属于非电解质;⑤酒精是有机物,属于非电解质;⑥H2S溶于水是氢硫酸,是弱酸,是弱电解质。故答案为:④⑤,②,③⑥。
18.(1)CH3COOH CH3COO-+H+
(2) 右 增大
(3) < =
(4)A
【详解】(1)醋酸是弱酸,是部分电离。醋酸的电离方程式为;
(2)向醋酸溶液中加入少量水,根据越稀越电离可知电离平衡向右移动;减小,n(CH3COO-)增大,故增大;
(3)醋酸是弱酸,部分电离,盐酸是强酸,全部电离,所以等浓度的两种酸中,盐酸中的H+浓度大于醋酸,故同浓度的两溶液与足量粉反应,初始速率
B. 多元弱酸的酸性主要由第一步电离决定,B正确;
C.表中三种酸根据电离常数的比较可得酸性强弱顺序,电离常数越大,酸性越强,故酸性CH3COOH>H2CO3>HClO>HCO,C正确;
D. 因为HClO酸性弱于碳酸,根据较强酸可制较弱酸,向溶液中通入气体,生成次氯酸和碳酸氢钠,D正确;
故选A。
19.90∶11
【详解】pH=11的苛性钠溶液中c(OH-)=mol/L=0.001mol/L,pH=1的稀硫酸中c(H+)=0.1mol/L,pH=2的混合溶液中c(H+)=0.01mol/L,则两溶液混合时满足:0.1mol/L V2-0.001mol/LV1=0.01mol/L(V1+ V2),整理可得:V1∶V2=90:11,故答案为:90:11。
