专题1物质的分类及计量检测题(含解析)高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题1物质的分类及计量检测题(含解析)高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 813.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-25 10:13:19 | ||
图片预览




文档简介
专题1《物质的分类及计量》检测题
一、单选题
1.下列对摩尔(mol)的有关说法中错误的是
A.摩尔是一个单位而非物理量
B.摩尔既能用来计量纯净物,又能用来计量混合物
C.1mol任何气体所含气体的分子数目都相等
D.0.5mol氦约含有1.204×1024个电子
2.下列说法正确的是
A.1mol任何气体的体积都是22.4L
B.1molH2的质量是1g,它所占的体积是22.4L
C.在标准状况下,1mol任何物质所占的体积都约为22.4L
D.在标准状况下,1mol任何气体所占的体积都约为22.4L
3.下列电离方程式书写错误的是( )
A.H2SO4→2H++SO42﹣ B.NaHCO3→Na++HCO3﹣
C.KClO3→K++Cl﹣+3O2﹣ D.HAc H++Ac﹣
4.mg某金属M溶于盐酸中,放出的气体在标准状况下的体积为nL,并生成氯化物MCl2,则金属M的相对原子质量是( )
A.n/m B.2m/n C.m/22.4n D.22.4m/n
5.一定量某营养液中溶质的配方分别如下:
配方一:0.3mol KCl,0.2mol K2SO4,0.1mol ZnSO4
配方二:0.1 mol KCl,0.3 mol K2SO4,0.1mol ZnCl2
对于两种营养液的成分,下列说法中正确的是
A.只有n(K+)相同
B.只有n(Cl-)相同
C.各离子的物质的量完全不同
D.完全相同
6.下列说法中,不正确的是
A.可以利用丁达尔效应区分胶体和溶液
B.胶体中分散质微粒直径通常大于100nm
C.根据分散质微粒直径大小,可将分散系分为溶液、胶体和浊液
D.向沸水中逐滴加入几滴饱和溶液,煮沸至液体呈红褐色,制得胶体
7.当光束通过下列分散系时,能观察到丁达尔效应的是
A.稀硫酸 B.Al(OH)3胶体 C.NaCl溶液 D.CuSO4溶液
8.用NA表示阿伏伽德罗常数,下列说法正确的是
A.22.4LO2的电子数为16NA
B.标准状况下,11.2LH2O的物质的量约为1mol
C.1L1mol/L的NaOH溶液中Na+的物质的量为1mol
D.0.lmol铁与足量的氯气完全反应,铁失去的电子数为0.2NA
9.下列物质属于电解质的是
A.CO2 B.NaOH C.氯水 D.酒精
10.下列说法正确的是( )
A.CO、SO2均属酸性氧化物
B.凡能电离出H+的化合物均属于酸
C.碱性氧化物一定是金属氧化物
D.电解质可以是化合物,也可以是单质
11.下列分散系中,分散质微粒半径最小的是( )
A.雾 B.蛋白质溶液 C.NaCl溶液 D.新制Cu(OH)2悬浊液
12.分类是认识和研究物质及其变化的一种常用的科学方法。下列分类不合理的是
A.H2SO4属于酸 B.Ca(OH)2属于碱
C.NaHCO3属于盐 D.Cu属于电解质
13.下列电离方程式不正确的是( )
A.HCl=H++Cl- B.Ba(OH)2 =Ba2++ 2OH-
C.KNO3 =K++NO3- D.NaHCO3=Na+ +H+ +CO32-
14.下列物质在水溶液中的电离方程式书写错误的是
A.CaCl2=Ca2++2Cl- B.NaOH=Na++OH-
C.HNO3=H++ D.KClO3=K++Cl++3O2-
15.下列说法不正确的是
A.在常温、常压下,11.2LN2含有的分子数为0.5NA
B.标准状况下,22.4LH2和O2的混合气体所含分子数为NA
C.18gH2O的物质的量是1mol
D.标况下,1molSO2的体积是22.4L
二、填空题
16.某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是____(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)怎样检验制得的物质是胶体?____。
(3)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是____。
A.Fe(OH)3胶体粒子的直径在1~100nm之间 B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系 D.Fe(OH)3胶体的分散质能透过滤纸
(4)若取少量Fe(OH)3胶体加入试管中加入稀盐酸溶液,边滴边振荡,现象是____。发生变化的化学方程式为____,此反应属于的反应类型为____。
阅读短文,回答问题。
化学是自然科学的重要组成部分,其特征是从微观层次认识物质,在不同层面创造物质。化学的魅力是在自然界的基础上,创造一个全新的世界。
纵观化学发展史可知,青铜与铁是青铜时代和铁器时代人类创造的新材料,酿酒和发酵工艺是原始的食品化学工艺,药物的发现和提纯是早期药物化学。近现代以来,合成化学在无机、有机、催化、高分子和超分子等领域得到了蓬勃发展,其产物广泛应用在纳米材料、医药、航空、航天及军事等领域。
化学是揭示元素到生命奥秘的核心力量,其核心技术就是通过对分子层面的操纵创造物质。化学在促进人类文明可持续发展中发挥着日益重要的作用!
请依据以上短文,判断下列说法是否正确。
17.从微观层次认识物质是化学的特征之一。____
18.铁的冶炼过程发生了化学变化。____
19.通过对分子层面的操纵可研发新药。___
20.化学合成的物质广泛应用在纳米材料、航空、航天等领域。___
三、计算题
21.合成氨的原料气N2和H2通常是以焦炭、水和空气为原料制取的,其主要反应是:①2C+O22CO②C+H2O(g)CO+H2③CO+H2O(g)CO2+H2,某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1)混合反应,所得气体产物经分析,组成如表:
气体 CO N2 CO2 H2 O2
常温常压下体积(m3) x 20 19 60 1.0
(1)求表中数据x=___。
(2)已知常温常压下,1mol气体的体积为24.5L,求该生产中参加反应的焦炭的质量___kg。
22.“毒鼠强”是一种灭鼠药,具有极强的毒性,国家已禁止使用。它是一种含有C、H、O、N、S的有机物,其摩尔质量为240;其中所含碳元素的质量分数为20%,所含氢元素的质量分数为3.0%,所含氧元素的质量分数为28%,其余为N、S。
(1)误食0.1g “毒鼠强”就可以使人死亡,0.1g “毒鼠强”的物质的量为_______
(2)试求“毒鼠强”中C、H、O三种元素的原子个数比为_______。
四、实验题
23.某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。实验步骤如下:①连接好实验装置,检查装置的气密性。②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。③加热,开始反应,直到不再有气体产生为止。④排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为278.8 mL。⑤准确称量试管和残留物的质量为15. 55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?________。
(2)进行步骤的④实验操作时,若仰视读数,则读取氧气的体积_____(填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是__mol(保留小数点后四位);实验测得氧气的气体摩尔体积是__(保留小数点后两位)。
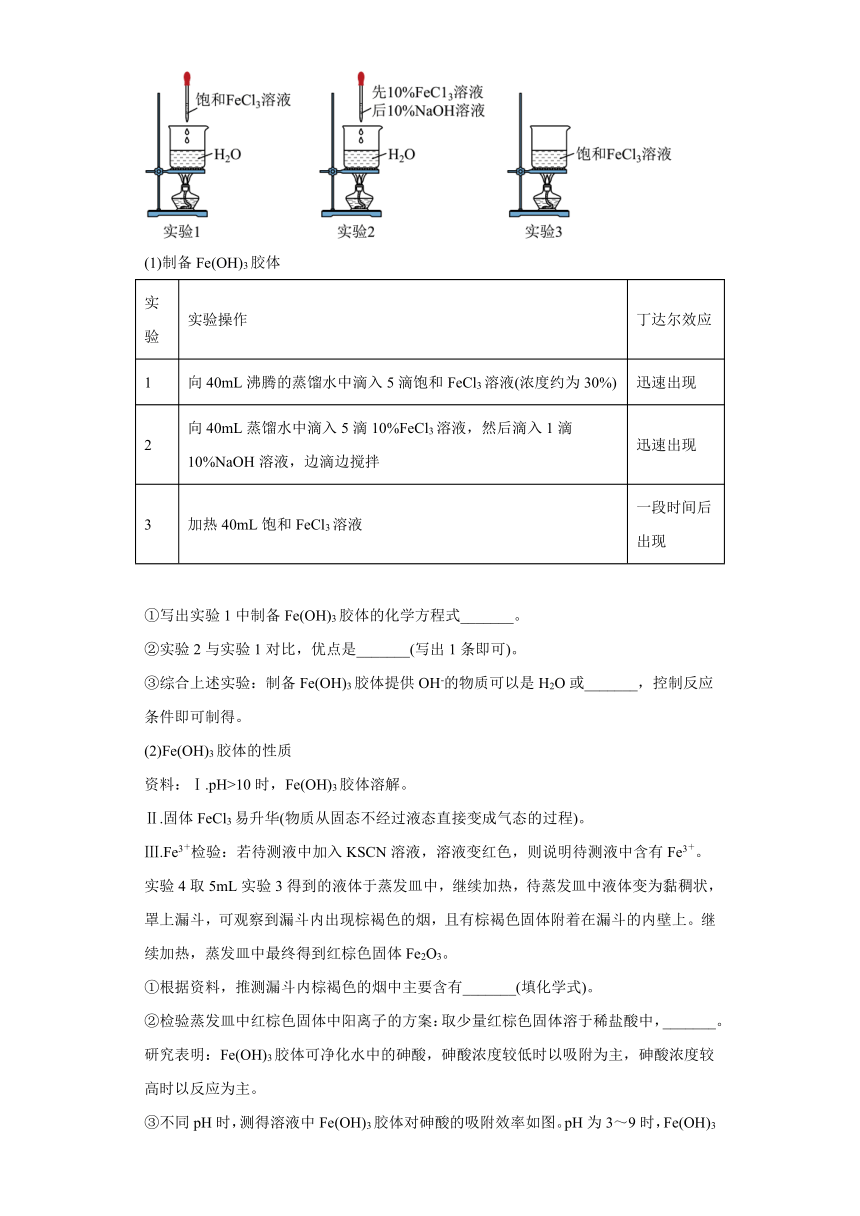
24.实验小组探究Fe(OH)3胶体的制备方法及其性质。
(1)制备Fe(OH)3胶体
实验 实验操作 丁达尔效应
1 向40mL沸腾的蒸馏水中滴入5滴饱和FeCl3溶液(浓度约为30%) 迅速出现
2 向40mL蒸馏水中滴入5滴10%FeCl3溶液,然后滴入1滴10%NaOH溶液,边滴边搅拌 迅速出现
3 加热40mL饱和FeCl3溶液 一段时间后出现
①写出实验1中制备Fe(OH)3胶体的化学方程式_______。
②实验2与实验1对比,优点是_______(写出1条即可)。
③综合上述实验:制备Fe(OH)3胶体提供OH-的物质可以是H2O或_______,控制反应条件即可制得。
(2)Fe(OH)3胶体的性质
资料:Ⅰ.pH>10时,Fe(OH)3胶体溶解。
Ⅱ.固体FeCl3易升华(物质从固态不经过液态直接变成气态的过程)。
Ⅲ.Fe3+检验:若待测液中加入KSCN溶液,溶液变红色,则说明待测液中含有Fe3+。
实验4取5mL实验3得到的液体于蒸发皿中,继续加热,待蒸发皿中液体变为黏稠状,罩上漏斗,可观察到漏斗内出现棕褐色的烟,且有棕褐色固体附着在漏斗的内壁上。继续加热,蒸发皿中最终得到红棕色固体Fe2O3。
①根据资料,推测漏斗内棕褐色的烟中主要含有_______(填化学式)。
②检验蒸发皿中红棕色固体中阳离子的方案:取少量红棕色固体溶于稀盐酸中,_______。
研究表明:Fe(OH)3胶体可净化水中的砷酸,砷酸浓度较低时以吸附为主,砷酸浓度较高时以反应为主。
③不同pH时,测得溶液中Fe(OH)3胶体对砷酸的吸附效率如图。pH为3~9时,Fe(OH)3胶体对砷酸的吸附效率高,pH较高时,吸附效率降低的原因是_______。
④去除水中高浓度砷酸的原理是Fe(OH)3胶体与砷酸反应生成砷酸铁(FeAsO4)沉淀,化学方程式是_______。
参考答案:
1.D
【详解】A.摩尔是物质的量的单位,正确;
B.摩尔用来计量微粒的量,可以是纯净物的微粒,也可以是混合物的微粒,正确;
C.气体物质的量相等,则气体的分子数目相等,正确;
D.氦为单原子分子,0.5mol氦含有0.5molHe原子,1个He原子含有2个电子,所以0.5mol氦约含有6.02×1023个电子,错误;
故选D。
2.D
【详解】A.1 mol任何气体的体积在标准状况下约是22.4 L,A错误;
B.1 molH2的质量是2 g,在标准状况下它所占的体积是22.4 L,B错误;
C.在标准状况下,1 mol任何气体所占的体积都约是22.4 L,C错误;
D.在标准状况下,1 mol任何气体所占的体积都约是22.4 L,D正确;
答案选D。
3.C
【详解】解:A.H2SO4是强电解质,能完全电离,电离方程式为H2SO4=2H++SO42﹣,故A正确;
B.碳酸氢钠是强电解质,能完全电离出钠离子和碳酸氢根离子,碳酸氢根离子不能拆开,电离方程式为NaHCO3=Na++HCO3﹣,故B正确;
C.KClO3是强电解质,能完全电离,电离出钾离子和氯酸根离子,电离方程式为KClO3=K++ClO3﹣,故C错误;
D.HAc是弱电解质,在溶液中部分电离,它的电离方程式为:HAc H++Ac﹣,故D正确;
故选C。
4.D
【详解】M的氯化物的化学式为MCl2,即M元素的化合价为+2价;根据化学反应方程式:
M+2HCl=M Cl2+H2↑,可得金属M的相对原子质量是22.4m/n。
5.D
【详解】溶质均为强电解质,溶于水全部电离出自由移动的离子,两份溶液中含有的离子相同,离子是:K+ 、Cl- 、SO42-和Zn2+,分别计算两溶液中各离子的物质的量;第一份:n(K+)=0.3mol+2×0.2mol=0.7mol,n(Cl-)=0.3mol,n(SO42-)=0.2mol+0.1mol=0.3mol,n( Zn2+)=0.1mol;第二份:n(K+) =0.1mol + 2 × 0.3 mol = 0.7mol,n(Cl-)=0.1mol+2×0.1mol=0.3mol,n(SO42-)=0.3mol,n( Zn2+)=0.1mol,则离子的物质的量完全相同,故选D。
6.B
【详解】A.胶体具有丁达尔效应,而溶液没有此现象,因此可以利用丁达尔效应区分胶体和溶液,故A正确;
B.胶体中分散质微粒直径通常在1nm~100nm之间,故B错误;
C.根据分散质微粒直径大小,可将分散系分为溶液、胶体和浊液,分散质微粒直径小于1nm的为溶液,分散质微粒直径1nm~100nm之间的为胶体,分散质微粒直径大于100nm的为浊液,故C正确;
D.向沸水中逐滴加入几滴饱和溶液,煮沸至液体呈红褐色,停止加热,制得胶体,故D正确。
综上所述,答案为B。
7.B
【详解】胶体具有丁达尔效应,而溶液不具有。
稀硫酸、NaCl溶液和CuSO4溶液均属于溶液,分散质粒径大小小于1 nm,无丁达尔效应,故ACD不符合题意;
Al(OH)3胶体中分散质径大小介于1 nm~100 nm之间,属于胶体,具有丁达尔效应,故C正确。
8.C
【详解】A.缺标准状况,无法计算22.4LO2的物质的量和所含电子数,故A错误;
B.标准状况下,水为液态,无法计算11.2LH2O的物质的量,故B错误;
C.1L1mol/L的NaOH溶液中Na+的物质的量为1L×1mol/L =1mol,故C正确;
D. 0.lmol铁与足量的氯气完全反应生成0.lmol氯化铁,铁失去的电子数为0.3NA,故D错误;
故选C。
9.B
【解析】电解质是在水溶液或熔融状态下导电的化合物,酸、碱、盐、活泼金属氧化物、水等属于电解质;非电解质是在水溶液和熔融状态下都不能导电的化合物,有机物、非金属氧化物、非金属氢化物等属于非电解质,由此分析。
【详解】A.二氧化碳是化合物,二氧化碳分子不导电,二氧化碳溶于水生成碳酸,能电离出自由移动的氢离子和碳酸根离子,能导电,但这些离子是碳酸电离,不是它自身电离,故二氧化碳是非电解质,故A不符合题意;
B.NaOH是碱,在水溶液中电离出钠离子和氢氧根离子,能导电,是电解质,故B符合题意;
C.氯水是氯气溶于水形成的混合物,含有氯分子、水分子、次氯酸分子、氢离子、氯离子、次氯酸根离子、氢氧根离子,电解质必须是化合物,混合物不属于电解质,故氯水不属于电解质,故C不符合题意;
D.酒精属于有机物,在水溶液和熔融状态下都不能导电,属于非电解质,故D不符合题意;
答案为B。
【点睛】电解质在水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子,电解质包括离子型或强极性共价型化合物;而非电解质是指:在熔融状态和水溶液中都不能导电的化合物,非电解质在熔融状态和水溶液中自身都不能离解出自由移动的离子,单质,混合物既不是电解质也不是非电解质。
10.C
【详解】A.CO不能与碱反应,不是酸性氧化物,A错误;
B.只有电离出的阳离子全部是H+的化合物才属于酸,B错误;
C.碱性氧化物一定是金属氧化物,C正确;
D.单质不是电解质,电解质必须是化合物,D错误;
答案为C。
11.C
【分析】根据分散质粒子直径大小分类,把分散系分为:溶液、胶体、浊液,溶液、浊液、胶体的本质区别就是分散质的微粒直径不同,溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),所以溶液的分散质粒子直径最小结合各选项物质的类别即可解答。
【详解】A. 雾属于胶体分散系,故A错误;
B. 蛋白质溶液属于胶体分散系,故B错误;
C. NaCl溶液属于溶液分散系,故C正确;
D. 新制Cu(OH)2悬浊液,属于浊液分散系,故D错误;
故选C。
12.D
【分析】酸:电离时产生的阳离子全部都是氢离子的化合物;
碱:电离时产生的阴离子全部都是氢氧根离子的化合物;
盐:电离时生成金属阳离子(或铵根离子)和酸根离子的化合物
电解质:在水溶液里或熔融状态下能导电的化合物。
非电解质:在水溶液里和熔融状态下都不能导电的化合物。
【详解】A.H2SO4电离产生的阳离子全部为氢离子,符合酸的定义,A正确;
B.Ca(OH)2电离产生的阴离子全部为氢氧根离子,符合碱的定义,B正确;
C.NaHCO3电离了钠离子和碳酸氢根离子,符合盐的定义,C正确;
D.根据定义可知无论电解质还是非电解质都是化合物,而铜属于单质,不是化合物,D错误;
故选D。
13.D
【详解】A.氯化氢的水溶液为盐酸,属于强电解质,完全电离生成氢离子和氯离子:HCl=H++Cl-,故A正确;
B. 氢氧化钡是强碱,属于强电解质,完全电离生成钡离子和氢氧根离子:Ba(OH)2 =Ba2++ 2OH-,故B正确;
C. 硝酸钾属于钾盐,钾盐全可溶,属于强电解质,完全电离生成钾离子和硝酸根离子:KNO3 =K++NO3-,故C正确;
D.碳酸氢钠是钠盐,钠盐全可溶,属于强电解质,完全电离生成钠离子和碳酸氢根离子: NaHCO3=Na+ +HCO3-,故D错误;
答案选D。
【点睛】电离方程式书写时需注意物质是强电解质还是弱电解质。
14.D
【详解】A.CaCl2是盐,属于强电解质,故其电离方程式为CaCl2=Ca2++2Cl-,A正确;
B.NaOH是强碱,属于强电解质,故其电离方程式为NaOH=Na++OH-,B正确;
C.HNO3是强酸,属于强电解质,故其电离方程式为HNO3=H++,C正确;
D.KClO3是盐,属于强电解质,故其电离方程式为KClO3=K++,D错误;
故答案为:D。
15.A
【详解】A.常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,则分子个数小于0.5NA个,故A项错误,符合题意;
B.标况下22.4L氧气和氢气混合气体中的分子个数N=NA=×NA/mol=NA个
故B项正确,不符合题意;
C.18gH2O的物质的量==1mol,故C项正确,不符合题意;
D.标况下,1molSO2的体积=1mol×22.4L/mol=22.4L,故D项正确,不符合题意;
答案选A。
【点睛】本题侧重考查与物质的量相关的化学计量之间的转化关系。学生需要准确理解每个物理量的含义,并正确运用公式,理清它们之间的关系。需要注意的是,注意细节题,气体摩尔体积为22.4L/mol的状态与条件,题设陷阱经常误将“常温常压”当作“标准状况”、误把固体、液体当成气体,学生做题时只要善于辨析,便可识破陷阱,排除选项。
16.(1)B
(2)用激光笔或手电筒照射要检验的物体,从侧面看,如果能看到光束就证明是胶体
(3)A
(4) 先有沉淀生成后沉淀消失 Fe(OH)3+3HCl=FeCl3+3H2O 复分解反应
【解析】(1)
向沸水中滴加饱和FeCl3溶液,继续煮沸至液体呈透明红褐色,得到氢氧化铁胶体,故选B;
(2)
胶体能产生丁达尔效应,用激光笔或手电筒照射要检验的物体,从侧面看,如果能看到光束就证明是胶体。
(3)
根据分散质粒子直径把分散系分为溶液、胶体、浊液,Fe(OH)3胶体区别于FeCl3溶液最本质的特征是Fe(OH)3胶体粒子的直径在1~100nm之间,选A;
(4)
若取少量Fe(OH)3胶体加入试管中加入稀盐酸溶液,边滴边振荡,Fe(OH)3胶体遇盐酸发生聚沉,盐酸过量时,氢氧化铁和盐酸反应生成氯化铁和水,现象是先有沉淀生成后沉淀消失。发生变化的化学方程式为Fe(OH)3+3HCl=FeCl3+3H2O,此反应属于复分解反应。
17.正确 18.正确 19.正确 20.正确
【解析】17.从微观层次认识物质是化学的特征之一,说法正确;
18.铁的冶炼过程发生了化学变化,说法正确;
19.通过对分子层面的操纵可研发新药,说法正确;
20.化学合成的物质广泛应用在纳米材料、航空、航天等领域,说法正确。
21. 30 24
【详解】(1)N2的体积为20 m3,空气中的氮气与氧气的比为4:1,故氧气的体积为5 m3,故参加反应的氧气的体积为5 m3-1 m3=4 m3,由反应可知,产物中二氧化碳你体积为19 m3,故反应③生成的氢气的体积为19 m3,消耗的一氧化碳为19 m3,则反应②生成氢气的体积为60 m3-19 m3=41 m3,故反应②生成一氧化碳的体积为41 m3,参加反应的氧气体积为4 m3,故反应①生成的一氧化碳的体积为8 m3,所得产物中CO的体积为:8 m3+41 m3-19 m3=30 m3;
(2) ①反应的氧气的体积为5 m3-1 m3=4 m3,反应①中的氧气的物质的量为,碳的物质的量为;反应②中碳的物质的量为,碳总的物质的量为:,焦炭的质量=2000mol×12g/mol=2400g=24kg。
22. 4.2×10-4mol 20∶36∶21
【分析】(1)根据n=计算物质的量;
(2)根据该化合物中该元素原子的个数=计算。
【详解】(1)0.1g“毒鼠强”的物质的量n==4.2×10-4mol,答:0.1g“毒鼠强”的物质的量为4.2×10-4mol;
(2)N(C)∶N(H)∶N(O)=∶∶=20∶36∶21,答:“毒鼠强”中C、H、O三种元素的原子个数比为20∶36∶21。
23. 往广口瓶中注满水,塞紧橡胶塞,按装置图连接好装置,用酒精灯微热试管,若观察到广口瓶中长玻璃管内液面上升,停止加热后,玻璃管内的液面下降,则证明该装置不漏气 偏小 0.0125 22. 30 L/mol
【分析】根据化学实验基础分析解答;根据气体摩尔体积、物质的量相关计算分析解答。
【详解】(1)装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性;检验该装置气密性的方法为:往广口瓶中注满水,塞紧橡皮塞,按装置图连接好装置,用酒精灯微热试管,若观察到广口瓶中长玻璃管内液面上升,停止加热后,长玻璃管内的液面下降,则证明该装置不漏气;故答案为往广口瓶中注满水,塞紧橡皮塞,按装置图连接好装置,用酒精灯微热试管,若观察到广口瓶中长玻璃管内液面上升,停止加热后,长玻璃管内的液面下降,则证明该装置不漏气;
(2)进行步骤的④实验操作时,若仰视量筒内的液面会使读数偏小,即读取O2的体积偏小;故答案为偏小;
(3)生成的氧气的质量m=15.95g-15.55g=0.4g,氧气物质的量n==0.0125mol,Vm==22.30L/mol,故答案为0.0125mol,22.30L/mol。
24.(1) FeCl3+3H2O Fe(OH)3胶体+3HCl 不需加热,FeCl3溶液浓度小 NaOH
(2) FeCl3 取少量红棕色固体溶于稀盐酸中,滴加KSCN溶液,溶液变红,则固体中含有Fe3+; pH>10时,Fe(OH)3胶体溶解 Fe(OH)3(胶体)+ H3AsO4=FeAsO4+ 3H2O
【详解】(1)①向40mL沸腾的蒸馏水中滴入5滴饱和FeCl3溶液, FeCl3与H2O反 应生成氢氧化铁胶体和HCl,反应的化学方程式为FeCl3+3H2O Fe(OH)3胶体+3HCl,故答案为: FeCl3+3H2O Fe(OH)3胶体+3HCl;
②由实验操作可知,与实验1对比,实验2的优点是不需加热,可以节约能源,FeCl3溶液浓度小,可以节约药品,故答案为:不需加热,FeCl3溶液浓度小;
③通过实验1和实验2可知,制备Fe(OH)3;胶体提供OH的物质可以是H2O或NaOH,故答案为: NaOH;
(2)①由资料可知,FeCl3固体易升华,则漏斗内棕褐色的烟中主要含有FeCl3,故答案为: FeCl3;
②由题意可知,红棕色固体为氧化铁,验证氧化铁中含有铁离子的操作为取少量红棕色固体溶于稀盐酸中,滴加KSCN溶液,溶液变红,则固体中含有Fe3+,故答案为:取少量红棕色固体溶于稀盐酸中,滴加KSCN溶液,溶液变红,则固体中含有Fe3+;
由题给信息可知,pH>10时,Fe(OH)3胶体溶解导致吸附效率降,根据体重所给资料pH>10时,Fe(OH)3胶体溶解,所以吸附率降低;
④由题意可知,去除水中高浓度砷酸的原理是Fe(OH)3胶体与砷酸反应生成砷酸铁沉淀和水,反应的化学方程式为Fe(OH)3(胶体)+ H3AsO4=FeAsO4+ 3H2O,故答案为: Fe(OH)3(胶体)+ H3AsO4=FeAsO4+ 3H2O。.
一、单选题
1.下列对摩尔(mol)的有关说法中错误的是
A.摩尔是一个单位而非物理量
B.摩尔既能用来计量纯净物,又能用来计量混合物
C.1mol任何气体所含气体的分子数目都相等
D.0.5mol氦约含有1.204×1024个电子
2.下列说法正确的是
A.1mol任何气体的体积都是22.4L
B.1molH2的质量是1g,它所占的体积是22.4L
C.在标准状况下,1mol任何物质所占的体积都约为22.4L
D.在标准状况下,1mol任何气体所占的体积都约为22.4L
3.下列电离方程式书写错误的是( )
A.H2SO4→2H++SO42﹣ B.NaHCO3→Na++HCO3﹣
C.KClO3→K++Cl﹣+3O2﹣ D.HAc H++Ac﹣
4.mg某金属M溶于盐酸中,放出的气体在标准状况下的体积为nL,并生成氯化物MCl2,则金属M的相对原子质量是( )
A.n/m B.2m/n C.m/22.4n D.22.4m/n
5.一定量某营养液中溶质的配方分别如下:
配方一:0.3mol KCl,0.2mol K2SO4,0.1mol ZnSO4
配方二:0.1 mol KCl,0.3 mol K2SO4,0.1mol ZnCl2
对于两种营养液的成分,下列说法中正确的是
A.只有n(K+)相同
B.只有n(Cl-)相同
C.各离子的物质的量完全不同
D.完全相同
6.下列说法中,不正确的是
A.可以利用丁达尔效应区分胶体和溶液
B.胶体中分散质微粒直径通常大于100nm
C.根据分散质微粒直径大小,可将分散系分为溶液、胶体和浊液
D.向沸水中逐滴加入几滴饱和溶液,煮沸至液体呈红褐色,制得胶体
7.当光束通过下列分散系时,能观察到丁达尔效应的是
A.稀硫酸 B.Al(OH)3胶体 C.NaCl溶液 D.CuSO4溶液
8.用NA表示阿伏伽德罗常数,下列说法正确的是
A.22.4LO2的电子数为16NA
B.标准状况下,11.2LH2O的物质的量约为1mol
C.1L1mol/L的NaOH溶液中Na+的物质的量为1mol
D.0.lmol铁与足量的氯气完全反应,铁失去的电子数为0.2NA
9.下列物质属于电解质的是
A.CO2 B.NaOH C.氯水 D.酒精
10.下列说法正确的是( )
A.CO、SO2均属酸性氧化物
B.凡能电离出H+的化合物均属于酸
C.碱性氧化物一定是金属氧化物
D.电解质可以是化合物,也可以是单质
11.下列分散系中,分散质微粒半径最小的是( )
A.雾 B.蛋白质溶液 C.NaCl溶液 D.新制Cu(OH)2悬浊液
12.分类是认识和研究物质及其变化的一种常用的科学方法。下列分类不合理的是
A.H2SO4属于酸 B.Ca(OH)2属于碱
C.NaHCO3属于盐 D.Cu属于电解质
13.下列电离方程式不正确的是( )
A.HCl=H++Cl- B.Ba(OH)2 =Ba2++ 2OH-
C.KNO3 =K++NO3- D.NaHCO3=Na+ +H+ +CO32-
14.下列物质在水溶液中的电离方程式书写错误的是
A.CaCl2=Ca2++2Cl- B.NaOH=Na++OH-
C.HNO3=H++ D.KClO3=K++Cl++3O2-
15.下列说法不正确的是
A.在常温、常压下,11.2LN2含有的分子数为0.5NA
B.标准状况下,22.4LH2和O2的混合气体所含分子数为NA
C.18gH2O的物质的量是1mol
D.标况下,1molSO2的体积是22.4L
二、填空题
16.某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是____(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)怎样检验制得的物质是胶体?____。
(3)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是____。
A.Fe(OH)3胶体粒子的直径在1~100nm之间 B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系 D.Fe(OH)3胶体的分散质能透过滤纸
(4)若取少量Fe(OH)3胶体加入试管中加入稀盐酸溶液,边滴边振荡,现象是____。发生变化的化学方程式为____,此反应属于的反应类型为____。
阅读短文,回答问题。
化学是自然科学的重要组成部分,其特征是从微观层次认识物质,在不同层面创造物质。化学的魅力是在自然界的基础上,创造一个全新的世界。
纵观化学发展史可知,青铜与铁是青铜时代和铁器时代人类创造的新材料,酿酒和发酵工艺是原始的食品化学工艺,药物的发现和提纯是早期药物化学。近现代以来,合成化学在无机、有机、催化、高分子和超分子等领域得到了蓬勃发展,其产物广泛应用在纳米材料、医药、航空、航天及军事等领域。
化学是揭示元素到生命奥秘的核心力量,其核心技术就是通过对分子层面的操纵创造物质。化学在促进人类文明可持续发展中发挥着日益重要的作用!
请依据以上短文,判断下列说法是否正确。
17.从微观层次认识物质是化学的特征之一。____
18.铁的冶炼过程发生了化学变化。____
19.通过对分子层面的操纵可研发新药。___
20.化学合成的物质广泛应用在纳米材料、航空、航天等领域。___
三、计算题
21.合成氨的原料气N2和H2通常是以焦炭、水和空气为原料制取的,其主要反应是:①2C+O22CO②C+H2O(g)CO+H2③CO+H2O(g)CO2+H2,某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1)混合反应,所得气体产物经分析,组成如表:
气体 CO N2 CO2 H2 O2
常温常压下体积(m3) x 20 19 60 1.0
(1)求表中数据x=___。
(2)已知常温常压下,1mol气体的体积为24.5L,求该生产中参加反应的焦炭的质量___kg。
22.“毒鼠强”是一种灭鼠药,具有极强的毒性,国家已禁止使用。它是一种含有C、H、O、N、S的有机物,其摩尔质量为240;其中所含碳元素的质量分数为20%,所含氢元素的质量分数为3.0%,所含氧元素的质量分数为28%,其余为N、S。
(1)误食0.1g “毒鼠强”就可以使人死亡,0.1g “毒鼠强”的物质的量为_______
(2)试求“毒鼠强”中C、H、O三种元素的原子个数比为_______。
四、实验题
23.某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。实验步骤如下:①连接好实验装置,检查装置的气密性。②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。③加热,开始反应,直到不再有气体产生为止。④排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为278.8 mL。⑤准确称量试管和残留物的质量为15. 55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?________。
(2)进行步骤的④实验操作时,若仰视读数,则读取氧气的体积_____(填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是__mol(保留小数点后四位);实验测得氧气的气体摩尔体积是__(保留小数点后两位)。
24.实验小组探究Fe(OH)3胶体的制备方法及其性质。
(1)制备Fe(OH)3胶体
实验 实验操作 丁达尔效应
1 向40mL沸腾的蒸馏水中滴入5滴饱和FeCl3溶液(浓度约为30%) 迅速出现
2 向40mL蒸馏水中滴入5滴10%FeCl3溶液,然后滴入1滴10%NaOH溶液,边滴边搅拌 迅速出现
3 加热40mL饱和FeCl3溶液 一段时间后出现
①写出实验1中制备Fe(OH)3胶体的化学方程式_______。
②实验2与实验1对比,优点是_______(写出1条即可)。
③综合上述实验:制备Fe(OH)3胶体提供OH-的物质可以是H2O或_______,控制反应条件即可制得。
(2)Fe(OH)3胶体的性质
资料:Ⅰ.pH>10时,Fe(OH)3胶体溶解。
Ⅱ.固体FeCl3易升华(物质从固态不经过液态直接变成气态的过程)。
Ⅲ.Fe3+检验:若待测液中加入KSCN溶液,溶液变红色,则说明待测液中含有Fe3+。
实验4取5mL实验3得到的液体于蒸发皿中,继续加热,待蒸发皿中液体变为黏稠状,罩上漏斗,可观察到漏斗内出现棕褐色的烟,且有棕褐色固体附着在漏斗的内壁上。继续加热,蒸发皿中最终得到红棕色固体Fe2O3。
①根据资料,推测漏斗内棕褐色的烟中主要含有_______(填化学式)。
②检验蒸发皿中红棕色固体中阳离子的方案:取少量红棕色固体溶于稀盐酸中,_______。
研究表明:Fe(OH)3胶体可净化水中的砷酸,砷酸浓度较低时以吸附为主,砷酸浓度较高时以反应为主。
③不同pH时,测得溶液中Fe(OH)3胶体对砷酸的吸附效率如图。pH为3~9时,Fe(OH)3胶体对砷酸的吸附效率高,pH较高时,吸附效率降低的原因是_______。
④去除水中高浓度砷酸的原理是Fe(OH)3胶体与砷酸反应生成砷酸铁(FeAsO4)沉淀,化学方程式是_______。
参考答案:
1.D
【详解】A.摩尔是物质的量的单位,正确;
B.摩尔用来计量微粒的量,可以是纯净物的微粒,也可以是混合物的微粒,正确;
C.气体物质的量相等,则气体的分子数目相等,正确;
D.氦为单原子分子,0.5mol氦含有0.5molHe原子,1个He原子含有2个电子,所以0.5mol氦约含有6.02×1023个电子,错误;
故选D。
2.D
【详解】A.1 mol任何气体的体积在标准状况下约是22.4 L,A错误;
B.1 molH2的质量是2 g,在标准状况下它所占的体积是22.4 L,B错误;
C.在标准状况下,1 mol任何气体所占的体积都约是22.4 L,C错误;
D.在标准状况下,1 mol任何气体所占的体积都约是22.4 L,D正确;
答案选D。
3.C
【详解】解:A.H2SO4是强电解质,能完全电离,电离方程式为H2SO4=2H++SO42﹣,故A正确;
B.碳酸氢钠是强电解质,能完全电离出钠离子和碳酸氢根离子,碳酸氢根离子不能拆开,电离方程式为NaHCO3=Na++HCO3﹣,故B正确;
C.KClO3是强电解质,能完全电离,电离出钾离子和氯酸根离子,电离方程式为KClO3=K++ClO3﹣,故C错误;
D.HAc是弱电解质,在溶液中部分电离,它的电离方程式为:HAc H++Ac﹣,故D正确;
故选C。
4.D
【详解】M的氯化物的化学式为MCl2,即M元素的化合价为+2价;根据化学反应方程式:
M+2HCl=M Cl2+H2↑,可得金属M的相对原子质量是22.4m/n。
5.D
【详解】溶质均为强电解质,溶于水全部电离出自由移动的离子,两份溶液中含有的离子相同,离子是:K+ 、Cl- 、SO42-和Zn2+,分别计算两溶液中各离子的物质的量;第一份:n(K+)=0.3mol+2×0.2mol=0.7mol,n(Cl-)=0.3mol,n(SO42-)=0.2mol+0.1mol=0.3mol,n( Zn2+)=0.1mol;第二份:n(K+) =0.1mol + 2 × 0.3 mol = 0.7mol,n(Cl-)=0.1mol+2×0.1mol=0.3mol,n(SO42-)=0.3mol,n( Zn2+)=0.1mol,则离子的物质的量完全相同,故选D。
6.B
【详解】A.胶体具有丁达尔效应,而溶液没有此现象,因此可以利用丁达尔效应区分胶体和溶液,故A正确;
B.胶体中分散质微粒直径通常在1nm~100nm之间,故B错误;
C.根据分散质微粒直径大小,可将分散系分为溶液、胶体和浊液,分散质微粒直径小于1nm的为溶液,分散质微粒直径1nm~100nm之间的为胶体,分散质微粒直径大于100nm的为浊液,故C正确;
D.向沸水中逐滴加入几滴饱和溶液,煮沸至液体呈红褐色,停止加热,制得胶体,故D正确。
综上所述,答案为B。
7.B
【详解】胶体具有丁达尔效应,而溶液不具有。
稀硫酸、NaCl溶液和CuSO4溶液均属于溶液,分散质粒径大小小于1 nm,无丁达尔效应,故ACD不符合题意;
Al(OH)3胶体中分散质径大小介于1 nm~100 nm之间,属于胶体,具有丁达尔效应,故C正确。
8.C
【详解】A.缺标准状况,无法计算22.4LO2的物质的量和所含电子数,故A错误;
B.标准状况下,水为液态,无法计算11.2LH2O的物质的量,故B错误;
C.1L1mol/L的NaOH溶液中Na+的物质的量为1L×1mol/L =1mol,故C正确;
D. 0.lmol铁与足量的氯气完全反应生成0.lmol氯化铁,铁失去的电子数为0.3NA,故D错误;
故选C。
9.B
【解析】电解质是在水溶液或熔融状态下导电的化合物,酸、碱、盐、活泼金属氧化物、水等属于电解质;非电解质是在水溶液和熔融状态下都不能导电的化合物,有机物、非金属氧化物、非金属氢化物等属于非电解质,由此分析。
【详解】A.二氧化碳是化合物,二氧化碳分子不导电,二氧化碳溶于水生成碳酸,能电离出自由移动的氢离子和碳酸根离子,能导电,但这些离子是碳酸电离,不是它自身电离,故二氧化碳是非电解质,故A不符合题意;
B.NaOH是碱,在水溶液中电离出钠离子和氢氧根离子,能导电,是电解质,故B符合题意;
C.氯水是氯气溶于水形成的混合物,含有氯分子、水分子、次氯酸分子、氢离子、氯离子、次氯酸根离子、氢氧根离子,电解质必须是化合物,混合物不属于电解质,故氯水不属于电解质,故C不符合题意;
D.酒精属于有机物,在水溶液和熔融状态下都不能导电,属于非电解质,故D不符合题意;
答案为B。
【点睛】电解质在水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子,电解质包括离子型或强极性共价型化合物;而非电解质是指:在熔融状态和水溶液中都不能导电的化合物,非电解质在熔融状态和水溶液中自身都不能离解出自由移动的离子,单质,混合物既不是电解质也不是非电解质。
10.C
【详解】A.CO不能与碱反应,不是酸性氧化物,A错误;
B.只有电离出的阳离子全部是H+的化合物才属于酸,B错误;
C.碱性氧化物一定是金属氧化物,C正确;
D.单质不是电解质,电解质必须是化合物,D错误;
答案为C。
11.C
【分析】根据分散质粒子直径大小分类,把分散系分为:溶液、胶体、浊液,溶液、浊液、胶体的本质区别就是分散质的微粒直径不同,溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),所以溶液的分散质粒子直径最小结合各选项物质的类别即可解答。
【详解】A. 雾属于胶体分散系,故A错误;
B. 蛋白质溶液属于胶体分散系,故B错误;
C. NaCl溶液属于溶液分散系,故C正确;
D. 新制Cu(OH)2悬浊液,属于浊液分散系,故D错误;
故选C。
12.D
【分析】酸:电离时产生的阳离子全部都是氢离子的化合物;
碱:电离时产生的阴离子全部都是氢氧根离子的化合物;
盐:电离时生成金属阳离子(或铵根离子)和酸根离子的化合物
电解质:在水溶液里或熔融状态下能导电的化合物。
非电解质:在水溶液里和熔融状态下都不能导电的化合物。
【详解】A.H2SO4电离产生的阳离子全部为氢离子,符合酸的定义,A正确;
B.Ca(OH)2电离产生的阴离子全部为氢氧根离子,符合碱的定义,B正确;
C.NaHCO3电离了钠离子和碳酸氢根离子,符合盐的定义,C正确;
D.根据定义可知无论电解质还是非电解质都是化合物,而铜属于单质,不是化合物,D错误;
故选D。
13.D
【详解】A.氯化氢的水溶液为盐酸,属于强电解质,完全电离生成氢离子和氯离子:HCl=H++Cl-,故A正确;
B. 氢氧化钡是强碱,属于强电解质,完全电离生成钡离子和氢氧根离子:Ba(OH)2 =Ba2++ 2OH-,故B正确;
C. 硝酸钾属于钾盐,钾盐全可溶,属于强电解质,完全电离生成钾离子和硝酸根离子:KNO3 =K++NO3-,故C正确;
D.碳酸氢钠是钠盐,钠盐全可溶,属于强电解质,完全电离生成钠离子和碳酸氢根离子: NaHCO3=Na+ +HCO3-,故D错误;
答案选D。
【点睛】电离方程式书写时需注意物质是强电解质还是弱电解质。
14.D
【详解】A.CaCl2是盐,属于强电解质,故其电离方程式为CaCl2=Ca2++2Cl-,A正确;
B.NaOH是强碱,属于强电解质,故其电离方程式为NaOH=Na++OH-,B正确;
C.HNO3是强酸,属于强电解质,故其电离方程式为HNO3=H++,C正确;
D.KClO3是盐,属于强电解质,故其电离方程式为KClO3=K++,D错误;
故答案为:D。
15.A
【详解】A.常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,则分子个数小于0.5NA个,故A项错误,符合题意;
B.标况下22.4L氧气和氢气混合气体中的分子个数N=NA=×NA/mol=NA个
故B项正确,不符合题意;
C.18gH2O的物质的量==1mol,故C项正确,不符合题意;
D.标况下,1molSO2的体积=1mol×22.4L/mol=22.4L,故D项正确,不符合题意;
答案选A。
【点睛】本题侧重考查与物质的量相关的化学计量之间的转化关系。学生需要准确理解每个物理量的含义,并正确运用公式,理清它们之间的关系。需要注意的是,注意细节题,气体摩尔体积为22.4L/mol的状态与条件,题设陷阱经常误将“常温常压”当作“标准状况”、误把固体、液体当成气体,学生做题时只要善于辨析,便可识破陷阱,排除选项。
16.(1)B
(2)用激光笔或手电筒照射要检验的物体,从侧面看,如果能看到光束就证明是胶体
(3)A
(4) 先有沉淀生成后沉淀消失 Fe(OH)3+3HCl=FeCl3+3H2O 复分解反应
【解析】(1)
向沸水中滴加饱和FeCl3溶液,继续煮沸至液体呈透明红褐色,得到氢氧化铁胶体,故选B;
(2)
胶体能产生丁达尔效应,用激光笔或手电筒照射要检验的物体,从侧面看,如果能看到光束就证明是胶体。
(3)
根据分散质粒子直径把分散系分为溶液、胶体、浊液,Fe(OH)3胶体区别于FeCl3溶液最本质的特征是Fe(OH)3胶体粒子的直径在1~100nm之间,选A;
(4)
若取少量Fe(OH)3胶体加入试管中加入稀盐酸溶液,边滴边振荡,Fe(OH)3胶体遇盐酸发生聚沉,盐酸过量时,氢氧化铁和盐酸反应生成氯化铁和水,现象是先有沉淀生成后沉淀消失。发生变化的化学方程式为Fe(OH)3+3HCl=FeCl3+3H2O,此反应属于复分解反应。
17.正确 18.正确 19.正确 20.正确
【解析】17.从微观层次认识物质是化学的特征之一,说法正确;
18.铁的冶炼过程发生了化学变化,说法正确;
19.通过对分子层面的操纵可研发新药,说法正确;
20.化学合成的物质广泛应用在纳米材料、航空、航天等领域,说法正确。
21. 30 24
【详解】(1)N2的体积为20 m3,空气中的氮气与氧气的比为4:1,故氧气的体积为5 m3,故参加反应的氧气的体积为5 m3-1 m3=4 m3,由反应可知,产物中二氧化碳你体积为19 m3,故反应③生成的氢气的体积为19 m3,消耗的一氧化碳为19 m3,则反应②生成氢气的体积为60 m3-19 m3=41 m3,故反应②生成一氧化碳的体积为41 m3,参加反应的氧气体积为4 m3,故反应①生成的一氧化碳的体积为8 m3,所得产物中CO的体积为:8 m3+41 m3-19 m3=30 m3;
(2) ①反应的氧气的体积为5 m3-1 m3=4 m3,反应①中的氧气的物质的量为,碳的物质的量为;反应②中碳的物质的量为,碳总的物质的量为:,焦炭的质量=2000mol×12g/mol=2400g=24kg。
22. 4.2×10-4mol 20∶36∶21
【分析】(1)根据n=计算物质的量;
(2)根据该化合物中该元素原子的个数=计算。
【详解】(1)0.1g“毒鼠强”的物质的量n==4.2×10-4mol,答:0.1g“毒鼠强”的物质的量为4.2×10-4mol;
(2)N(C)∶N(H)∶N(O)=∶∶=20∶36∶21,答:“毒鼠强”中C、H、O三种元素的原子个数比为20∶36∶21。
23. 往广口瓶中注满水,塞紧橡胶塞,按装置图连接好装置,用酒精灯微热试管,若观察到广口瓶中长玻璃管内液面上升,停止加热后,玻璃管内的液面下降,则证明该装置不漏气 偏小 0.0125 22. 30 L/mol
【分析】根据化学实验基础分析解答;根据气体摩尔体积、物质的量相关计算分析解答。
【详解】(1)装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性;检验该装置气密性的方法为:往广口瓶中注满水,塞紧橡皮塞,按装置图连接好装置,用酒精灯微热试管,若观察到广口瓶中长玻璃管内液面上升,停止加热后,长玻璃管内的液面下降,则证明该装置不漏气;故答案为往广口瓶中注满水,塞紧橡皮塞,按装置图连接好装置,用酒精灯微热试管,若观察到广口瓶中长玻璃管内液面上升,停止加热后,长玻璃管内的液面下降,则证明该装置不漏气;
(2)进行步骤的④实验操作时,若仰视量筒内的液面会使读数偏小,即读取O2的体积偏小;故答案为偏小;
(3)生成的氧气的质量m=15.95g-15.55g=0.4g,氧气物质的量n==0.0125mol,Vm==22.30L/mol,故答案为0.0125mol,22.30L/mol。
24.(1) FeCl3+3H2O Fe(OH)3胶体+3HCl 不需加热,FeCl3溶液浓度小 NaOH
(2) FeCl3 取少量红棕色固体溶于稀盐酸中,滴加KSCN溶液,溶液变红,则固体中含有Fe3+; pH>10时,Fe(OH)3胶体溶解 Fe(OH)3(胶体)+ H3AsO4=FeAsO4+ 3H2O
【详解】(1)①向40mL沸腾的蒸馏水中滴入5滴饱和FeCl3溶液, FeCl3与H2O反 应生成氢氧化铁胶体和HCl,反应的化学方程式为FeCl3+3H2O Fe(OH)3胶体+3HCl,故答案为: FeCl3+3H2O Fe(OH)3胶体+3HCl;
②由实验操作可知,与实验1对比,实验2的优点是不需加热,可以节约能源,FeCl3溶液浓度小,可以节约药品,故答案为:不需加热,FeCl3溶液浓度小;
③通过实验1和实验2可知,制备Fe(OH)3;胶体提供OH的物质可以是H2O或NaOH,故答案为: NaOH;
(2)①由资料可知,FeCl3固体易升华,则漏斗内棕褐色的烟中主要含有FeCl3,故答案为: FeCl3;
②由题意可知,红棕色固体为氧化铁,验证氧化铁中含有铁离子的操作为取少量红棕色固体溶于稀盐酸中,滴加KSCN溶液,溶液变红,则固体中含有Fe3+,故答案为:取少量红棕色固体溶于稀盐酸中,滴加KSCN溶液,溶液变红,则固体中含有Fe3+;
由题给信息可知,pH>10时,Fe(OH)3胶体溶解导致吸附效率降,根据体重所给资料pH>10时,Fe(OH)3胶体溶解,所以吸附率降低;
④由题意可知,去除水中高浓度砷酸的原理是Fe(OH)3胶体与砷酸反应生成砷酸铁沉淀和水,反应的化学方程式为Fe(OH)3(胶体)+ H3AsO4=FeAsO4+ 3H2O,故答案为: Fe(OH)3(胶体)+ H3AsO4=FeAsO4+ 3H2O。.
