3.2从化石燃料中获取有机化合物第2课时练习题(含解析)高一下学期化学鲁科版(2019)必修第二册
文档属性
| 名称 | 3.2从化石燃料中获取有机化合物第2课时练习题(含解析)高一下学期化学鲁科版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-25 12:23:20 | ||
图片预览



文档简介
《从化石燃料中获取有机化合物》第2课时练习题
一、单选题
1.迄今为止,煤、石油和天然气等化石能源仍然是人类使用的主要能源。下列有关煤、石油和天然气的说法中,错误的是
A.石油通过裂化,可以获得碳原子数较少的轻质油
B.煤液化后可以转变为石油
C.天然气是一种清洁的化石燃料
D.石油裂解后可得到短链不饱和烃
2.下列变化中,不属于化学变化的是
A.天然气的燃烧 B.煤的干馏 C.石油分馏 D.石油裂解
3.下列说法正确的是
A.厨房中用的食盐、食醋都是电解质
B.石油的分馏、煤的干馏、石油的裂解都是化学变化
C.古代的陶瓷、砖瓦、现代的玻璃、水泥等,都是硅酸盐产品
D.工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属
4.化学与生产、生活密切相关。下列说法正确的是
A.煤经过气化、液化处理后,可减少二氧化碳的排放,有利于实现碳达峰
B.人体摄入的蔬菜、水果所含纤维素水解为葡萄糖为人体提供能量
C.石油裂化的主要目的是获得乙烯、丙烯等基础化工原料
D.二氧化硫可适量添加在红酒中,防止红酒变质而口感变差
5.“碳中和”是指的排放总量和减少总量相当。下列措施能促进碳中和最直接有效的是
A.将重质油裂解为轻质油作为燃料
B.大规模开采可燃冰作为新能源
C.通过清洁煤技术减少煤燃烧污染
D.研发催化剂将还原为甲醇
6.下列说法中不正确的是
A.乙烯是石油化学工业重要的基本原料
B.乙烯的产量可用来衡量一个国家工业化程度
C.乙烯是制备有机高分子材料的重要原料
D.甲烷和乙烯均为易燃气体,点燃前均需验纯
7.下列石油分馏产品中沸点范围最高的是
A.汽油 B.柴油 C.煤油 D.石蜡
8.工业上制取大量乙烯、丙烯采用
A.石油分馏 B.催化裂化 C.石油裂解 D.天然气加工
9.下列反应中,属于加成反应的是
A.甲烷燃烧生成二氧化碳和水
B.乙烯使酸性高锰酸钾褪色
C.乙烯与溴反应生成1,2-二溴乙烷
D.甲烷与氯气在光照条件下反应
10.乙烯是一种重要的化工原科。下利物质中,不能通过乙烯的加成反应一步制得的是
A.CH3CHCl2 B.CH3CH2OH C.CH3CH2Cl D.BrCH2CH2Br
11.下列实验装置及试剂的使用正确且能达到实验目的的是
A.实验I :制备
B.实验II :制备并观察其颜色
C.实验III:实验室模拟侯氏制碱法实验
D.实验IV:用裂化汽油提纯溴水中的
12.除去混在乙烷中的少量乙烯的方法是
A.将混合气体通过盛有溴水的洗气瓶 B.将混合气体与KMnO4溶液中
C.将混合气与H2加成 D.将混合气体与氯气混合光照
13.下列化学用语正确的是
A.乙烯的结构简式: B.的电子式:
C.的结构式: D.甲烷的比例模型
二、多选题
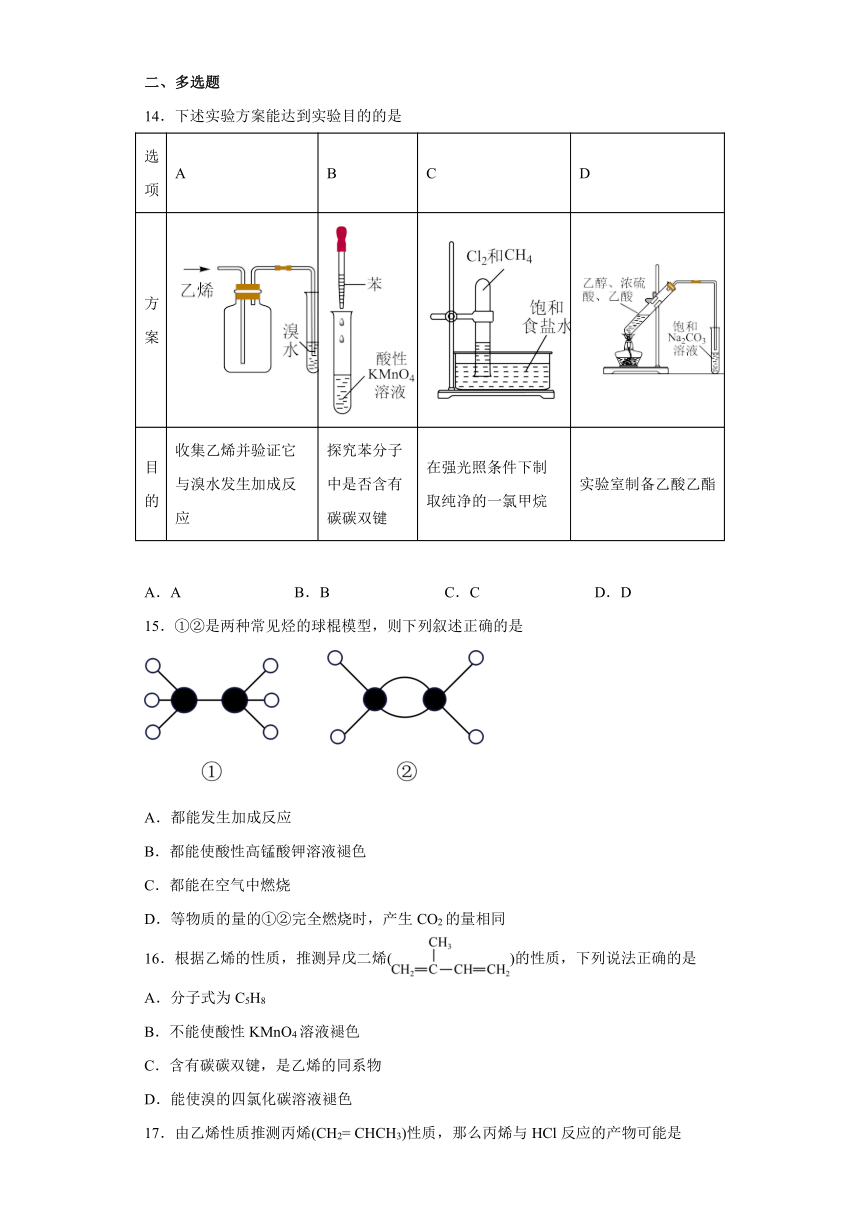
14.下述实验方案能达到实验目的的是
选项 A B C D
方案
目的 收集乙烯并验证它与溴水发生加成反应 探究苯分子中是否含有碳碳双键 在强光照条件下制取纯净的一氯甲烷 实验室制备乙酸乙酯
A.A B.B C.C D.D
15.①②是两种常见烃的球棍模型,则下列叙述正确的是
A.都能发生加成反应
B.都能使酸性高锰酸钾溶液褪色
C.都能在空气中燃烧
D.等物质的量的①②完全燃烧时,产生CO2的量相同
16.根据乙烯的性质,推测异戊二烯()的性质,下列说法正确的是
A.分子式为C5H8
B.不能使酸性KMnO4溶液褪色
C.含有碳碳双键,是乙烯的同系物
D.能使溴的四氯化碳溶液褪色
17.由乙烯性质推测丙烯(CH2= CHCH3)性质,那么丙烯与HCl反应的产物可能是
A.CH3-CH2-CH2Cl B.CH3-CHCl-CH2Cl
C.CH2Cl-CH2— CHCl D.CH3-CHCl-CH3
18.下列说法错误的是
A.汽油的辛烷值越高表示抗爆性越不好
B.裂化的目的是获得轻质液体燃料,裂解的目的是获得乙烯、丙烯等小分子烃
C.石油经过分馏及裂化等工序炼制后即能得到纯净物
D.裂化、裂解是化学变化
三、填空题
19.在炽热条件下,将石蜡油分解产生的乙烯通入下列各试管里,装置如图所示。
根据上述装置,回答下列问题:
(1)已知:1,2-二溴乙烷的密度比水的大,难溶于水,易溶于四氯化碳。
预测:A装置中的现象是_______,B装置中的现象是_______。
(2)D装置中溶液由紫色变无色,D装置中发生反应的类型为_______。
(3)工业上利用乙烯水化制备乙醇,其对应的化学方程式为_______;反应类型为_______。
(4)丙烯()与乙烯具有相似的化学性质。
①丙烯与溴的加成反应产物为_______。
②在一定条件下丙烯与的加成产物可能_______。
20.乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式为_____。
(2)鉴别甲烷和乙烯的试剂是_____(填字母)。
A.稀硫酸
B.溴的四氯化碳溶液
C.水
D.酸性高锰酸钾溶液
(3)下列物质中,一定条件下,可以通过乙烯加成反应得到的是_____(填字母)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
(4)乙烯使溴的四氯化碳溶液褪色的化学方程式为_____,反应类型是_____。
21.乙烯是石油化学工业重要的基本原料。
(1)乙烯分子中含有的官能团是_______(填名称)。
(2)一定条件下,乙烯能与氢气反应生成乙烷,乙烷的结构简式为_______。
(3)乙烯通入到酸性高锰酸钾溶液中,溶液紫色褪去,该过程中乙烯发生了_______(填“取代”“加成”或“氧化”)反应。
(4)乙烯在一定条件下能发生加聚反应生成聚乙烯,聚乙烯的结构简式为_______。
(5)区分甲烷和乙烯两种气体的实验方法、现象和结论是_______(实验可选用的试剂:稀盐酸、溴的四氯化碳溶液、氢氧化钠溶液)
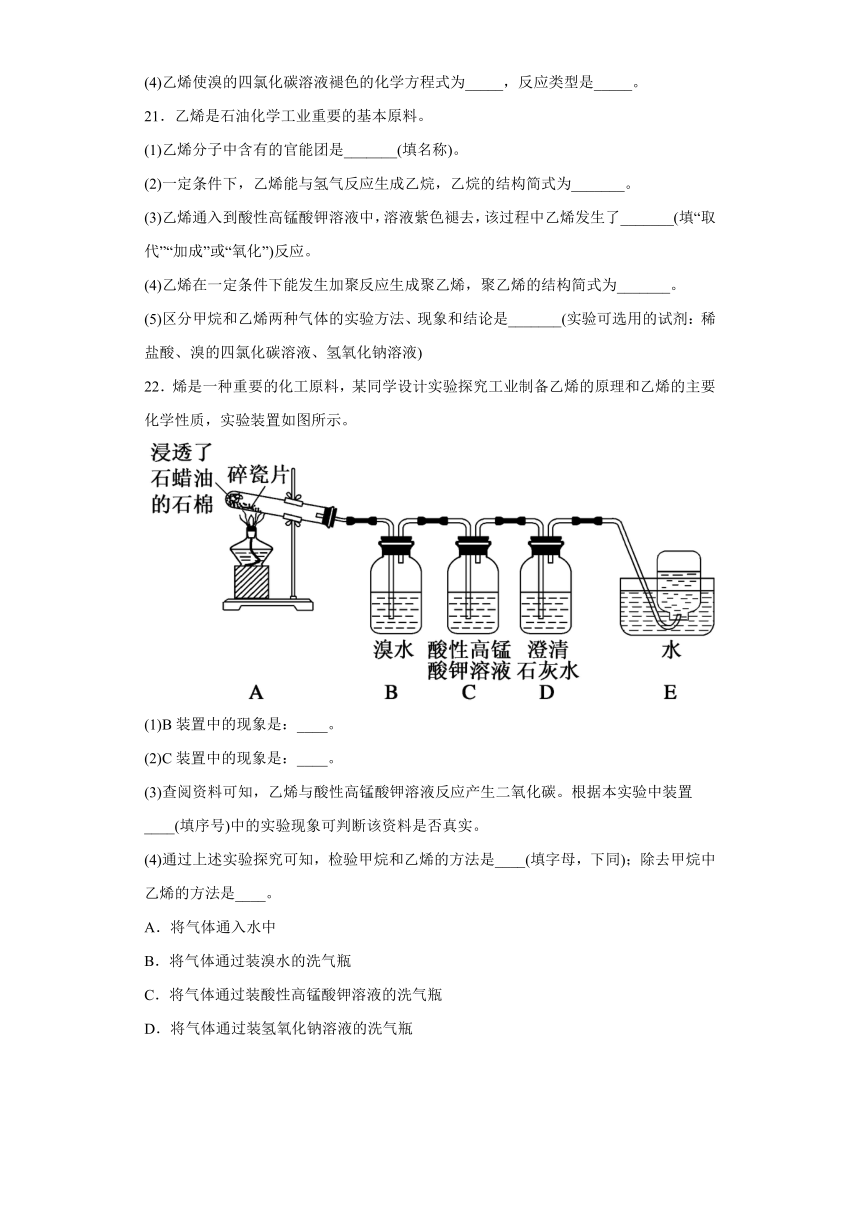
22.烯是一种重要的化工原料,某同学设计实验探究工业制备乙烯的原理和乙烯的主要化学性质,实验装置如图所示。
(1)B装置中的现象是:____。
(2)C装置中的现象是:____。
(3)查阅资料可知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置____(填序号)中的实验现象可判断该资料是否真实。
(4)通过上述实验探究可知,检验甲烷和乙烯的方法是____(填字母,下同);除去甲烷中乙烯的方法是____。
A.将气体通入水中
B.将气体通过装溴水的洗气瓶
C.将气体通过装酸性高锰酸钾溶液的洗气瓶
D.将气体通过装氢氧化钠溶液的洗气瓶
参考答案:
1.B
【详解】A.石油裂化和裂解的目的是为了将重油中的碳链变短,从而得到生活和工业中需求量较大的产物。裂化的主要目的是为了获得轻质油,故A正确;
B.煤液化后可以转变为甲醇等化工原料,不转变为石油,故B错误;
C.天然气的主要成分为甲烷,充分燃烧后生成物为二氧化碳和水,为清洁的化石燃料,故C正确;
D.石油裂解后可得到短链不饱和烃,如乙烯、丙烯等化工原料,故D正确;
故选B。
2.C
【详解】A.天然气的燃烧时有新物质生成,属于化学变化,故A不符合题意;
B.煤的干馏过程中有新物质生成,属于化学变化,故B不符合题意;
C.石油分馏过程中无新物质生成,属于物理变化,不属于化学变化,故C符合题意;
D.石油裂解过程中有新物质生成,属于化学变化,故D不符合题意;
故选C。
3.C
【详解】A.电解质是在水中或熔融状态下能导电的化合物,混合物不是电解质。厨房中用的食盐、食醋都是混合物,不是电解质,故A错误;
B.石油的分馏是利用石油中各组分的沸点不同,用蒸发和冷凝的方法将它们分开的操作,是物理变化;煤的干馏是将煤隔绝空气加强热使之分解的过程,是化学变化;石油的裂解是将石油分馏产品在高温或催化剂作用下分解,获得短链不饱和烃的过程,是化学变化,故B错误;
C.古代的陶瓷、砖瓦、现代的玻璃、水泥等,它们的主要成分都是硅酸盐,都是硅酸盐产品,故C正确;
D.工业上通过电解熔融的氯化物制取Na、Mg,AlCl3是共价化合物,熔融状态不导电,工业上通过电解熔融氧化铝制取Al,故D错误;
故选C。
4.D
【详解】A.煤经过气化、液化可以提高煤的利用率,并不能减少二氧化碳排放,故A错误;
B.人体内不存在纤维素酶,不能使纤维素发生水解,故B错误;
C.石油裂化的主要目的是低沸点液态烃,主要是汽油,故C错误;
D.二氧化硫可适量添加在红酒中,二氧化硫具有还原性能防止红酒氧化变质,故D正确;
故选:D。
5.D
【详解】A.将重质油裂解为轻质油作为燃料,实质是长链烃断裂为短链烃,燃烧后排放的CO2的量并没有改变,A错误;
B.可燃冰是甲烷的结晶水合物,大量开采使用,会产生CO2,不利用碳中和,B错误;
C.通过清洁煤技术减少煤燃烧污染,只会减少SO2的排放,但对CO2的排放总量无影响,C错误;
D.研发催化剂将CO2还原为甲醇,有利于减少CO2的排放,对促进“碳中和”最直接,D正确;
故选D。
6.B
【详解】A.乙烯是石油化学工业重要的基本原料,故A正确;
B.乙烯的产量可用来衡量一个国家的石油化学工业的发展水平,故B错误;
C.乙烯含有碳碳双键,可以发生加聚反应等,是制备有机高分子材料的重要原料,故C正确;
D.甲烷和乙烯均为易燃气体,点燃前均需验纯,故D正确;
故选B。
7.D
【详解】A.汽油的沸点为30-220℃之间,A错误;
B.轻柴油的沸点为180-370℃,重柴油的沸点为350-410℃,B错误;
C.煤油的沸点为110-350℃,C错误;
D.固体石蜡的沸点为300-550℃,D正确;
故答案选D。
8.C
【详解】A. 石油分馏的目的是将石油按沸点的差异进行分离,可得到汽油、煤油、柴油等多种分馏产品,A错误;
B. 催化裂化的目的是为了提高轻质油(汽油,煤油,柴油等)的产量和质量,B错误;
C.裂解是深度裂化,以获得短链不饱和烃(主要为乙烯,丙烯,丁二烯等不饱和烃)为主要成分的石油加工过程,C正确;
D. 天然气加工后可转变为制氨气、甲醇及其它产品,D错误;
答案选C。
9.C
【详解】A.甲烷在氧气中燃烧生成二氧化碳和水,是氧化反应不是加成反应,A错误;
B.乙烯使高锰酸钾褪色是因为乙烯被酸性高锰酸钾氧化,不涉及加成反应,B错误;
C.乙烯与溴单质发生反应生成1,2-二溴乙烷,该反应为加成反应,C正确;
D.甲烷和氯气在光照条件下发生取代反应生成一氯甲烷等卤代烃和HCl,不是加成反应,D错误;
故答案选C。
10.A
【详解】A.乙烯若与HCl加成反应,应生成CH3CH2Cl,若与Cl2加成反应,应生成ClCH2CH2Cl,因此不能通过乙烯的加成反应一步制得CH3CHCl2,A符合题意;
B.一定条件下,乙烯与水发生加成反应生成乙醇,乙醇能通过乙烯的加成反应一步制得,B不符合题意;
C.一定条件下,乙烯与氯化氢发生加成反应生成氯乙烷,氯乙烷能通过乙烯的加成反应一步制得,C不符合题意;
D.乙烯能与溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷能通过乙烯的加成反应一步制得,D不符合题意;
故答案为:A。
11.B
【详解】A.Cu和浓硫酸反应需要加热才可以生成SO2,实验I 没有加热装置不可以制备,故A错误;
B.极易被空气中的氧气氧化,制备用煤油封,可以隔绝空气,使长滴管穿过煤油滴加氢氧化钠溶液,可以观察到生成白色的,故B正确;
C.氨气极易溶于水,通氨气应该防倒吸,故C错误;
D.裂化汽油含有不饱和键,可以和溴加成,不能用于萃取溴水中的Br2,故D错误;
故答案为B。
12.A
【详解】A.乙烯与溴发生加成反应,从而可以除去乙烷中的少量乙烯,故A正确;
B.乙烯会被KMnO4溶液氧化为CO2,会使乙烷中混有新的杂质气体CO2,故B错误;
C.将混合气体与H2加成,无法控制H2的量,H2的过量或不足都会有杂质存在,操作也复杂,故C错误;
D.将混合气体与氯气混合光照,引入多种杂质,故D错误;
故选A。
13.C
【详解】A.乙烯的官能团是碳碳双键,其结构简式为CH2=CH2,A错误;
B.HCl是共价化合物,电子式为,B错误;
C.中氮原子和氢原子之间形成一条共价键,结构式为,C正确;
D.为甲烷的球棍模型,不是比例模型,D错误;
答案选C。
14.BD
【详解】A.乙烯的密度和空气接近,不能用排空气法收集,故A错误;
B.不能使KMnO4溶液褪色,说明苯分子中无双键,故B正确;
C.甲烷与氯气在光照的条件下发生取代反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氯化氢的混合物,不能制取纯净的一氯甲烷,故C错误;
D.实验室制备乙酸乙酯时,为防止倒吸右端导管口应位于饱和碳酸钠溶液的液面上方,故D正确;
故选BD。
15.CD
【详解】A.①是乙烷,乙烷不含碳碳双键,不能发生加成反应,A错误;
B.①是乙烷,乙烷不能使酸性高锰酸钾溶液褪色,②是乙烯,乙烯含有碳碳双键,能使酸性高锰酸钾溶液褪色,B错误;
C.①是乙烷、②是乙烯,都能在空气中燃烧产生二氧化碳和水,C正确;
D.等物质的量的乙烷和乙烯含有的碳原子数量相同,完全燃烧产生的CO2的量相同,D正确;
故答案选CD。
16.AD
【详解】A.异戊二烯的分子式为C5H8,A选项正确;
B.异戊二烯含有碳碳双键,能被高锰酸钾氧化,使高锰酸钾溶液褪色,B选项错误;
C.乙烯含1个碳碳双键,异戊二烯含2个碳碳双键,两者不互为同系物,C选项错误;
D.异戊二烯含有碳碳双键,能与溴发生加成反应使其褪色,D选项正确;
答案选AD。
17.AD
【详解】A.CH2= CHCH3是不对称分子,与HCl加成H和Cl原子加到相邻的碳上,可以生成CH3-CH2-CH2Cl,故A正确;
B.CH2= CHCH3与Cl2加成生成CH3-CHCl-CH2Cl,故B错误;
C.CH2= CHCH3与Cl2加成生成,Cl原子应加到相邻的碳上,故C错误;
D.CH2= CHCH3是不对称分子,加成只与碳碳双键有关,与HCl加成H和Cl原子加到相邻的碳上,可以生成CH3-CHCl-CH3,故D正确;
故答案为AD
18.AC
【详解】A.汽油的辛烷值越高表示抗爆性越好,故A错误;
B.石油裂化的目的是提高轻质油的产量和质量,裂解的目的是获得乙烯、丙烯等小分子烃,故B正确;
C.石油经分馏、裂化等工序炼制后所得到的馏分都是混合物,故C错误;
D.裂化、裂解均属于化学变化,故D正确;
答案选AC。
19.(1) 溶液褪色,液体不分层 溶液褪色,液体分层
(2)氧化反应
(3) CH2=CH2+ H2O CH3CH2OH 加成反应
(4) CH2BrCHBrCH3 CH2(OH)CH2CH3、CH3CH(OH)CH3
【分析】由实验装置可知,A中乙烯与溴发生加成反应,溴的四氯化碳溶液褪色;B中乙烯与溴水发生加成反应,溴水褪色;C中乙烯与硝酸银溶液不反应,但C可检验挥发的溴;D中乙烯被高锰酸钾氧化,溶液褪色;E中石灰水变浑浊,可知乙烯被高锰酸钾氧化生成二氧化碳。
【详解】(1)A、B装置中乙烯与溴发生加成反应均生成有机物CH2BrCH2Br,CH2BrCH2Br能溶于四氯化碳、不溶于水,故现象分别为:溴的四氯化碳溶液褪色液体不分层;溴水褪色液体分层。
(2)D装置中溶液由紫色变无色,是D装置中高锰酸钾被乙烯还原,乙烯被氧化,发生反应的类型为氧化反应。
(3)乙烯水化制备乙醇,乙烯与水发加成反应,反应方程式为CH2=CH2+ H2O CH3CH2OH。
(4)①丙烯中含碳碳双键,与溴发生加成反应:CH2=CHCH3+Br2→CH2BrCHBrCH3,产物为CH2BrCHBrCH3。
②在一定条件下丙烯与H2O的加成反应可能为CH2=CHCH3+H2O→CH3CH(OH)CH3或CH2=CHCH3+H2O→CH2(OH)CH2CH3,产物为:CH3CH(OH)CH3或CH2(OH)CH2CH3。
20.(1)
(2)BD
(3)ACD
(4) CH2=CH2+Br2→CH2BrCH2Br 加成反应
【详解】(1)乙烯的分子式为C2H4,含有碳碳双键,乙烯的电子式为;
(2)乙烯能与溴的四氯化碳发生加成反应,使溴的四氯化碳褪色,乙烯能被高锰酸钾氧化而使高锰酸钾溶液褪色,甲烷不能,故可以用溴的四氯化碳和酸性高锰酸钾鉴别甲烷和乙烯;
(3)乙烯能和发生加成反应生成,乙烯能与发生加成反应生成,能与发生加成反应生成,故选ACD;
(4)乙烯与溴的四氯化碳发生加成反应而使溶液褪色,化学方程式为:,反应类型为:加成反应。
21.(1)碳碳双键
(2)CH3CH3
(3)氧化
(4)
(5)分别把两种气体通入溴的四氯化碳溶液,如果溴的四氯化碳溶液褪色,则通入的气体为乙烯,如果溴的四氯化碳溶液不褪色,则通入的气体为甲烷
【详解】(1)乙烯的结构简式为CH2=CH2,含有的官能团的名称为碳碳双键;故答案为:碳碳双键。
(2)一定条件下,乙烯能与氢气发生加成反应生成乙烷
乙烷的结构简式为CH3CH3,故答案为:CH3CH3。
(3)乙烯通入酸性高锰酸钾溶液中,溶液紫色褪去,该过程中乙烯被酸性高锰酸钾氧化,发生了氧化反应;故答案为:氧化。
(4)乙烯在一定条件下能发生加成聚合反应生成聚乙烯,聚乙烯的结构简式为
故答案为:。
(5)甲烷和乙烯均不与氢氧化钠溶液和稀盐酸发生反应,乙烯能与溴的四氯化碳溶液发生加成反应使溴的四氯化碳溶液褪色,甲烷不与溴的四氯化碳溶液反应,则可以用溴的四氯化碳溶液区分甲烷和乙烯,故答案为:分别把两种气体通入溴的四氯化碳溶液,如果溴的四氯化碳溶液褪色,则通入的气体为乙烯,如果溴的四氯化碳溶液不褪色,则通入的气体为甲烷。
22.(1)褪色
(2)褪色
(3)D
(4) B、C B
【分析】A中产生乙烯、B中乙烯和溴水发生加成反应、C中乙烯被酸性高锰酸钾溶液氧化产生二氧化碳、D中二氧化碳与氢氧化钙溶液反应生成碳酸钙沉淀,E中收集剩余的烷烃等气体。
【详解】(1)乙烯含有碳碳双键,能够与溴发生加成反应而使溴水褪色;
(2)乙烯具有还原性,能够与酸性高锰酸钾溶液发生氧化反应而使酸性高锰酸钾溶液褪色;
(3)乙烯与酸性高锰酸钾溶液反应产生二氧化碳,二氧化碳能够与D中氢氧化钙溶液反应生成碳酸钙沉淀,溶液变浑浊,故答案为:D;
(4)A.甲烷、乙烯均不溶于水,且常温下与水都不反应,不能用于鉴别和除杂。
B.乙烯中含有碳碳双键,能与发生加成反应生成1,2–二溴乙烷液体,甲烷不与溴水反应,所以可用溴水除去甲烷中混有的乙烯,也可以鉴别甲烷与乙烯。
C.甲烷与高锰酸钾溶液不反应,乙烯能够与高锰酸钾溶液反应而使高锰酸钾溶液褪色,可以鉴别甲烷与乙烯;但是乙烯被氧化生成二氧化碳气体,故不能用于除去甲烷中混有的乙烯杂质。
D.甲烷、乙烯都不溶于氢氧化钠溶液,不能用来鉴别和除杂。
综上所述,可用来鉴别的是B、C;可用来除杂的是B项。
一、单选题
1.迄今为止,煤、石油和天然气等化石能源仍然是人类使用的主要能源。下列有关煤、石油和天然气的说法中,错误的是
A.石油通过裂化,可以获得碳原子数较少的轻质油
B.煤液化后可以转变为石油
C.天然气是一种清洁的化石燃料
D.石油裂解后可得到短链不饱和烃
2.下列变化中,不属于化学变化的是
A.天然气的燃烧 B.煤的干馏 C.石油分馏 D.石油裂解
3.下列说法正确的是
A.厨房中用的食盐、食醋都是电解质
B.石油的分馏、煤的干馏、石油的裂解都是化学变化
C.古代的陶瓷、砖瓦、现代的玻璃、水泥等,都是硅酸盐产品
D.工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属
4.化学与生产、生活密切相关。下列说法正确的是
A.煤经过气化、液化处理后,可减少二氧化碳的排放,有利于实现碳达峰
B.人体摄入的蔬菜、水果所含纤维素水解为葡萄糖为人体提供能量
C.石油裂化的主要目的是获得乙烯、丙烯等基础化工原料
D.二氧化硫可适量添加在红酒中,防止红酒变质而口感变差
5.“碳中和”是指的排放总量和减少总量相当。下列措施能促进碳中和最直接有效的是
A.将重质油裂解为轻质油作为燃料
B.大规模开采可燃冰作为新能源
C.通过清洁煤技术减少煤燃烧污染
D.研发催化剂将还原为甲醇
6.下列说法中不正确的是
A.乙烯是石油化学工业重要的基本原料
B.乙烯的产量可用来衡量一个国家工业化程度
C.乙烯是制备有机高分子材料的重要原料
D.甲烷和乙烯均为易燃气体,点燃前均需验纯
7.下列石油分馏产品中沸点范围最高的是
A.汽油 B.柴油 C.煤油 D.石蜡
8.工业上制取大量乙烯、丙烯采用
A.石油分馏 B.催化裂化 C.石油裂解 D.天然气加工
9.下列反应中,属于加成反应的是
A.甲烷燃烧生成二氧化碳和水
B.乙烯使酸性高锰酸钾褪色
C.乙烯与溴反应生成1,2-二溴乙烷
D.甲烷与氯气在光照条件下反应
10.乙烯是一种重要的化工原科。下利物质中,不能通过乙烯的加成反应一步制得的是
A.CH3CHCl2 B.CH3CH2OH C.CH3CH2Cl D.BrCH2CH2Br
11.下列实验装置及试剂的使用正确且能达到实验目的的是
A.实验I :制备
B.实验II :制备并观察其颜色
C.实验III:实验室模拟侯氏制碱法实验
D.实验IV:用裂化汽油提纯溴水中的
12.除去混在乙烷中的少量乙烯的方法是
A.将混合气体通过盛有溴水的洗气瓶 B.将混合气体与KMnO4溶液中
C.将混合气与H2加成 D.将混合气体与氯气混合光照
13.下列化学用语正确的是
A.乙烯的结构简式: B.的电子式:
C.的结构式: D.甲烷的比例模型
二、多选题
14.下述实验方案能达到实验目的的是
选项 A B C D
方案
目的 收集乙烯并验证它与溴水发生加成反应 探究苯分子中是否含有碳碳双键 在强光照条件下制取纯净的一氯甲烷 实验室制备乙酸乙酯
A.A B.B C.C D.D
15.①②是两种常见烃的球棍模型,则下列叙述正确的是
A.都能发生加成反应
B.都能使酸性高锰酸钾溶液褪色
C.都能在空气中燃烧
D.等物质的量的①②完全燃烧时,产生CO2的量相同
16.根据乙烯的性质,推测异戊二烯()的性质,下列说法正确的是
A.分子式为C5H8
B.不能使酸性KMnO4溶液褪色
C.含有碳碳双键,是乙烯的同系物
D.能使溴的四氯化碳溶液褪色
17.由乙烯性质推测丙烯(CH2= CHCH3)性质,那么丙烯与HCl反应的产物可能是
A.CH3-CH2-CH2Cl B.CH3-CHCl-CH2Cl
C.CH2Cl-CH2— CHCl D.CH3-CHCl-CH3
18.下列说法错误的是
A.汽油的辛烷值越高表示抗爆性越不好
B.裂化的目的是获得轻质液体燃料,裂解的目的是获得乙烯、丙烯等小分子烃
C.石油经过分馏及裂化等工序炼制后即能得到纯净物
D.裂化、裂解是化学变化
三、填空题
19.在炽热条件下,将石蜡油分解产生的乙烯通入下列各试管里,装置如图所示。
根据上述装置,回答下列问题:
(1)已知:1,2-二溴乙烷的密度比水的大,难溶于水,易溶于四氯化碳。
预测:A装置中的现象是_______,B装置中的现象是_______。
(2)D装置中溶液由紫色变无色,D装置中发生反应的类型为_______。
(3)工业上利用乙烯水化制备乙醇,其对应的化学方程式为_______;反应类型为_______。
(4)丙烯()与乙烯具有相似的化学性质。
①丙烯与溴的加成反应产物为_______。
②在一定条件下丙烯与的加成产物可能_______。
20.乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式为_____。
(2)鉴别甲烷和乙烯的试剂是_____(填字母)。
A.稀硫酸
B.溴的四氯化碳溶液
C.水
D.酸性高锰酸钾溶液
(3)下列物质中,一定条件下,可以通过乙烯加成反应得到的是_____(填字母)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
(4)乙烯使溴的四氯化碳溶液褪色的化学方程式为_____,反应类型是_____。
21.乙烯是石油化学工业重要的基本原料。
(1)乙烯分子中含有的官能团是_______(填名称)。
(2)一定条件下,乙烯能与氢气反应生成乙烷,乙烷的结构简式为_______。
(3)乙烯通入到酸性高锰酸钾溶液中,溶液紫色褪去,该过程中乙烯发生了_______(填“取代”“加成”或“氧化”)反应。
(4)乙烯在一定条件下能发生加聚反应生成聚乙烯,聚乙烯的结构简式为_______。
(5)区分甲烷和乙烯两种气体的实验方法、现象和结论是_______(实验可选用的试剂:稀盐酸、溴的四氯化碳溶液、氢氧化钠溶液)
22.烯是一种重要的化工原料,某同学设计实验探究工业制备乙烯的原理和乙烯的主要化学性质,实验装置如图所示。
(1)B装置中的现象是:____。
(2)C装置中的现象是:____。
(3)查阅资料可知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置____(填序号)中的实验现象可判断该资料是否真实。
(4)通过上述实验探究可知,检验甲烷和乙烯的方法是____(填字母,下同);除去甲烷中乙烯的方法是____。
A.将气体通入水中
B.将气体通过装溴水的洗气瓶
C.将气体通过装酸性高锰酸钾溶液的洗气瓶
D.将气体通过装氢氧化钠溶液的洗气瓶
参考答案:
1.B
【详解】A.石油裂化和裂解的目的是为了将重油中的碳链变短,从而得到生活和工业中需求量较大的产物。裂化的主要目的是为了获得轻质油,故A正确;
B.煤液化后可以转变为甲醇等化工原料,不转变为石油,故B错误;
C.天然气的主要成分为甲烷,充分燃烧后生成物为二氧化碳和水,为清洁的化石燃料,故C正确;
D.石油裂解后可得到短链不饱和烃,如乙烯、丙烯等化工原料,故D正确;
故选B。
2.C
【详解】A.天然气的燃烧时有新物质生成,属于化学变化,故A不符合题意;
B.煤的干馏过程中有新物质生成,属于化学变化,故B不符合题意;
C.石油分馏过程中无新物质生成,属于物理变化,不属于化学变化,故C符合题意;
D.石油裂解过程中有新物质生成,属于化学变化,故D不符合题意;
故选C。
3.C
【详解】A.电解质是在水中或熔融状态下能导电的化合物,混合物不是电解质。厨房中用的食盐、食醋都是混合物,不是电解质,故A错误;
B.石油的分馏是利用石油中各组分的沸点不同,用蒸发和冷凝的方法将它们分开的操作,是物理变化;煤的干馏是将煤隔绝空气加强热使之分解的过程,是化学变化;石油的裂解是将石油分馏产品在高温或催化剂作用下分解,获得短链不饱和烃的过程,是化学变化,故B错误;
C.古代的陶瓷、砖瓦、现代的玻璃、水泥等,它们的主要成分都是硅酸盐,都是硅酸盐产品,故C正确;
D.工业上通过电解熔融的氯化物制取Na、Mg,AlCl3是共价化合物,熔融状态不导电,工业上通过电解熔融氧化铝制取Al,故D错误;
故选C。
4.D
【详解】A.煤经过气化、液化可以提高煤的利用率,并不能减少二氧化碳排放,故A错误;
B.人体内不存在纤维素酶,不能使纤维素发生水解,故B错误;
C.石油裂化的主要目的是低沸点液态烃,主要是汽油,故C错误;
D.二氧化硫可适量添加在红酒中,二氧化硫具有还原性能防止红酒氧化变质,故D正确;
故选:D。
5.D
【详解】A.将重质油裂解为轻质油作为燃料,实质是长链烃断裂为短链烃,燃烧后排放的CO2的量并没有改变,A错误;
B.可燃冰是甲烷的结晶水合物,大量开采使用,会产生CO2,不利用碳中和,B错误;
C.通过清洁煤技术减少煤燃烧污染,只会减少SO2的排放,但对CO2的排放总量无影响,C错误;
D.研发催化剂将CO2还原为甲醇,有利于减少CO2的排放,对促进“碳中和”最直接,D正确;
故选D。
6.B
【详解】A.乙烯是石油化学工业重要的基本原料,故A正确;
B.乙烯的产量可用来衡量一个国家的石油化学工业的发展水平,故B错误;
C.乙烯含有碳碳双键,可以发生加聚反应等,是制备有机高分子材料的重要原料,故C正确;
D.甲烷和乙烯均为易燃气体,点燃前均需验纯,故D正确;
故选B。
7.D
【详解】A.汽油的沸点为30-220℃之间,A错误;
B.轻柴油的沸点为180-370℃,重柴油的沸点为350-410℃,B错误;
C.煤油的沸点为110-350℃,C错误;
D.固体石蜡的沸点为300-550℃,D正确;
故答案选D。
8.C
【详解】A. 石油分馏的目的是将石油按沸点的差异进行分离,可得到汽油、煤油、柴油等多种分馏产品,A错误;
B. 催化裂化的目的是为了提高轻质油(汽油,煤油,柴油等)的产量和质量,B错误;
C.裂解是深度裂化,以获得短链不饱和烃(主要为乙烯,丙烯,丁二烯等不饱和烃)为主要成分的石油加工过程,C正确;
D. 天然气加工后可转变为制氨气、甲醇及其它产品,D错误;
答案选C。
9.C
【详解】A.甲烷在氧气中燃烧生成二氧化碳和水,是氧化反应不是加成反应,A错误;
B.乙烯使高锰酸钾褪色是因为乙烯被酸性高锰酸钾氧化,不涉及加成反应,B错误;
C.乙烯与溴单质发生反应生成1,2-二溴乙烷,该反应为加成反应,C正确;
D.甲烷和氯气在光照条件下发生取代反应生成一氯甲烷等卤代烃和HCl,不是加成反应,D错误;
故答案选C。
10.A
【详解】A.乙烯若与HCl加成反应,应生成CH3CH2Cl,若与Cl2加成反应,应生成ClCH2CH2Cl,因此不能通过乙烯的加成反应一步制得CH3CHCl2,A符合题意;
B.一定条件下,乙烯与水发生加成反应生成乙醇,乙醇能通过乙烯的加成反应一步制得,B不符合题意;
C.一定条件下,乙烯与氯化氢发生加成反应生成氯乙烷,氯乙烷能通过乙烯的加成反应一步制得,C不符合题意;
D.乙烯能与溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷能通过乙烯的加成反应一步制得,D不符合题意;
故答案为:A。
11.B
【详解】A.Cu和浓硫酸反应需要加热才可以生成SO2,实验I 没有加热装置不可以制备,故A错误;
B.极易被空气中的氧气氧化,制备用煤油封,可以隔绝空气,使长滴管穿过煤油滴加氢氧化钠溶液,可以观察到生成白色的,故B正确;
C.氨气极易溶于水,通氨气应该防倒吸,故C错误;
D.裂化汽油含有不饱和键,可以和溴加成,不能用于萃取溴水中的Br2,故D错误;
故答案为B。
12.A
【详解】A.乙烯与溴发生加成反应,从而可以除去乙烷中的少量乙烯,故A正确;
B.乙烯会被KMnO4溶液氧化为CO2,会使乙烷中混有新的杂质气体CO2,故B错误;
C.将混合气体与H2加成,无法控制H2的量,H2的过量或不足都会有杂质存在,操作也复杂,故C错误;
D.将混合气体与氯气混合光照,引入多种杂质,故D错误;
故选A。
13.C
【详解】A.乙烯的官能团是碳碳双键,其结构简式为CH2=CH2,A错误;
B.HCl是共价化合物,电子式为,B错误;
C.中氮原子和氢原子之间形成一条共价键,结构式为,C正确;
D.为甲烷的球棍模型,不是比例模型,D错误;
答案选C。
14.BD
【详解】A.乙烯的密度和空气接近,不能用排空气法收集,故A错误;
B.不能使KMnO4溶液褪色,说明苯分子中无双键,故B正确;
C.甲烷与氯气在光照的条件下发生取代反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氯化氢的混合物,不能制取纯净的一氯甲烷,故C错误;
D.实验室制备乙酸乙酯时,为防止倒吸右端导管口应位于饱和碳酸钠溶液的液面上方,故D正确;
故选BD。
15.CD
【详解】A.①是乙烷,乙烷不含碳碳双键,不能发生加成反应,A错误;
B.①是乙烷,乙烷不能使酸性高锰酸钾溶液褪色,②是乙烯,乙烯含有碳碳双键,能使酸性高锰酸钾溶液褪色,B错误;
C.①是乙烷、②是乙烯,都能在空气中燃烧产生二氧化碳和水,C正确;
D.等物质的量的乙烷和乙烯含有的碳原子数量相同,完全燃烧产生的CO2的量相同,D正确;
故答案选CD。
16.AD
【详解】A.异戊二烯的分子式为C5H8,A选项正确;
B.异戊二烯含有碳碳双键,能被高锰酸钾氧化,使高锰酸钾溶液褪色,B选项错误;
C.乙烯含1个碳碳双键,异戊二烯含2个碳碳双键,两者不互为同系物,C选项错误;
D.异戊二烯含有碳碳双键,能与溴发生加成反应使其褪色,D选项正确;
答案选AD。
17.AD
【详解】A.CH2= CHCH3是不对称分子,与HCl加成H和Cl原子加到相邻的碳上,可以生成CH3-CH2-CH2Cl,故A正确;
B.CH2= CHCH3与Cl2加成生成CH3-CHCl-CH2Cl,故B错误;
C.CH2= CHCH3与Cl2加成生成,Cl原子应加到相邻的碳上,故C错误;
D.CH2= CHCH3是不对称分子,加成只与碳碳双键有关,与HCl加成H和Cl原子加到相邻的碳上,可以生成CH3-CHCl-CH3,故D正确;
故答案为AD
18.AC
【详解】A.汽油的辛烷值越高表示抗爆性越好,故A错误;
B.石油裂化的目的是提高轻质油的产量和质量,裂解的目的是获得乙烯、丙烯等小分子烃,故B正确;
C.石油经分馏、裂化等工序炼制后所得到的馏分都是混合物,故C错误;
D.裂化、裂解均属于化学变化,故D正确;
答案选AC。
19.(1) 溶液褪色,液体不分层 溶液褪色,液体分层
(2)氧化反应
(3) CH2=CH2+ H2O CH3CH2OH 加成反应
(4) CH2BrCHBrCH3 CH2(OH)CH2CH3、CH3CH(OH)CH3
【分析】由实验装置可知,A中乙烯与溴发生加成反应,溴的四氯化碳溶液褪色;B中乙烯与溴水发生加成反应,溴水褪色;C中乙烯与硝酸银溶液不反应,但C可检验挥发的溴;D中乙烯被高锰酸钾氧化,溶液褪色;E中石灰水变浑浊,可知乙烯被高锰酸钾氧化生成二氧化碳。
【详解】(1)A、B装置中乙烯与溴发生加成反应均生成有机物CH2BrCH2Br,CH2BrCH2Br能溶于四氯化碳、不溶于水,故现象分别为:溴的四氯化碳溶液褪色液体不分层;溴水褪色液体分层。
(2)D装置中溶液由紫色变无色,是D装置中高锰酸钾被乙烯还原,乙烯被氧化,发生反应的类型为氧化反应。
(3)乙烯水化制备乙醇,乙烯与水发加成反应,反应方程式为CH2=CH2+ H2O CH3CH2OH。
(4)①丙烯中含碳碳双键,与溴发生加成反应:CH2=CHCH3+Br2→CH2BrCHBrCH3,产物为CH2BrCHBrCH3。
②在一定条件下丙烯与H2O的加成反应可能为CH2=CHCH3+H2O→CH3CH(OH)CH3或CH2=CHCH3+H2O→CH2(OH)CH2CH3,产物为:CH3CH(OH)CH3或CH2(OH)CH2CH3。
20.(1)
(2)BD
(3)ACD
(4) CH2=CH2+Br2→CH2BrCH2Br 加成反应
【详解】(1)乙烯的分子式为C2H4,含有碳碳双键,乙烯的电子式为;
(2)乙烯能与溴的四氯化碳发生加成反应,使溴的四氯化碳褪色,乙烯能被高锰酸钾氧化而使高锰酸钾溶液褪色,甲烷不能,故可以用溴的四氯化碳和酸性高锰酸钾鉴别甲烷和乙烯;
(3)乙烯能和发生加成反应生成,乙烯能与发生加成反应生成,能与发生加成反应生成,故选ACD;
(4)乙烯与溴的四氯化碳发生加成反应而使溶液褪色,化学方程式为:,反应类型为:加成反应。
21.(1)碳碳双键
(2)CH3CH3
(3)氧化
(4)
(5)分别把两种气体通入溴的四氯化碳溶液,如果溴的四氯化碳溶液褪色,则通入的气体为乙烯,如果溴的四氯化碳溶液不褪色,则通入的气体为甲烷
【详解】(1)乙烯的结构简式为CH2=CH2,含有的官能团的名称为碳碳双键;故答案为:碳碳双键。
(2)一定条件下,乙烯能与氢气发生加成反应生成乙烷
乙烷的结构简式为CH3CH3,故答案为:CH3CH3。
(3)乙烯通入酸性高锰酸钾溶液中,溶液紫色褪去,该过程中乙烯被酸性高锰酸钾氧化,发生了氧化反应;故答案为:氧化。
(4)乙烯在一定条件下能发生加成聚合反应生成聚乙烯,聚乙烯的结构简式为
故答案为:。
(5)甲烷和乙烯均不与氢氧化钠溶液和稀盐酸发生反应,乙烯能与溴的四氯化碳溶液发生加成反应使溴的四氯化碳溶液褪色,甲烷不与溴的四氯化碳溶液反应,则可以用溴的四氯化碳溶液区分甲烷和乙烯,故答案为:分别把两种气体通入溴的四氯化碳溶液,如果溴的四氯化碳溶液褪色,则通入的气体为乙烯,如果溴的四氯化碳溶液不褪色,则通入的气体为甲烷。
22.(1)褪色
(2)褪色
(3)D
(4) B、C B
【分析】A中产生乙烯、B中乙烯和溴水发生加成反应、C中乙烯被酸性高锰酸钾溶液氧化产生二氧化碳、D中二氧化碳与氢氧化钙溶液反应生成碳酸钙沉淀,E中收集剩余的烷烃等气体。
【详解】(1)乙烯含有碳碳双键,能够与溴发生加成反应而使溴水褪色;
(2)乙烯具有还原性,能够与酸性高锰酸钾溶液发生氧化反应而使酸性高锰酸钾溶液褪色;
(3)乙烯与酸性高锰酸钾溶液反应产生二氧化碳,二氧化碳能够与D中氢氧化钙溶液反应生成碳酸钙沉淀,溶液变浑浊,故答案为:D;
(4)A.甲烷、乙烯均不溶于水,且常温下与水都不反应,不能用于鉴别和除杂。
B.乙烯中含有碳碳双键,能与发生加成反应生成1,2–二溴乙烷液体,甲烷不与溴水反应,所以可用溴水除去甲烷中混有的乙烯,也可以鉴别甲烷与乙烯。
C.甲烷与高锰酸钾溶液不反应,乙烯能够与高锰酸钾溶液反应而使高锰酸钾溶液褪色,可以鉴别甲烷与乙烯;但是乙烯被氧化生成二氧化碳气体,故不能用于除去甲烷中混有的乙烯杂质。
D.甲烷、乙烯都不溶于氢氧化钠溶液,不能用来鉴别和除杂。
综上所述,可用来鉴别的是B、C;可用来除杂的是B项。
