第三章 晶体结构与性质 测试题 (含解析)2022-2023学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 第三章 晶体结构与性质 测试题 (含解析)2022-2023学年高二下学期化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 423.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-25 15:29:01 | ||
图片预览



文档简介
第三章 晶体结构与性质 测试题
一、选择题
1.2022年3月“天宫课堂”中,神舟十三号航天员用过饱和CH3COONa溶液做结晶实验,制造了美丽的“冰雪”,有关CH3COONa固体说法正确的是
A.是弱电解质 B.不含非极性键 C.是离子晶体 D.溶于水显酸性
2.金属键、共价键、离子键和分子间作用力是构成物质粒子间的不同作用方式。下列物质中,只含有上述一种作用力的是
A.干冰 B.氯化钠 C.氢氧化钠 D.碘
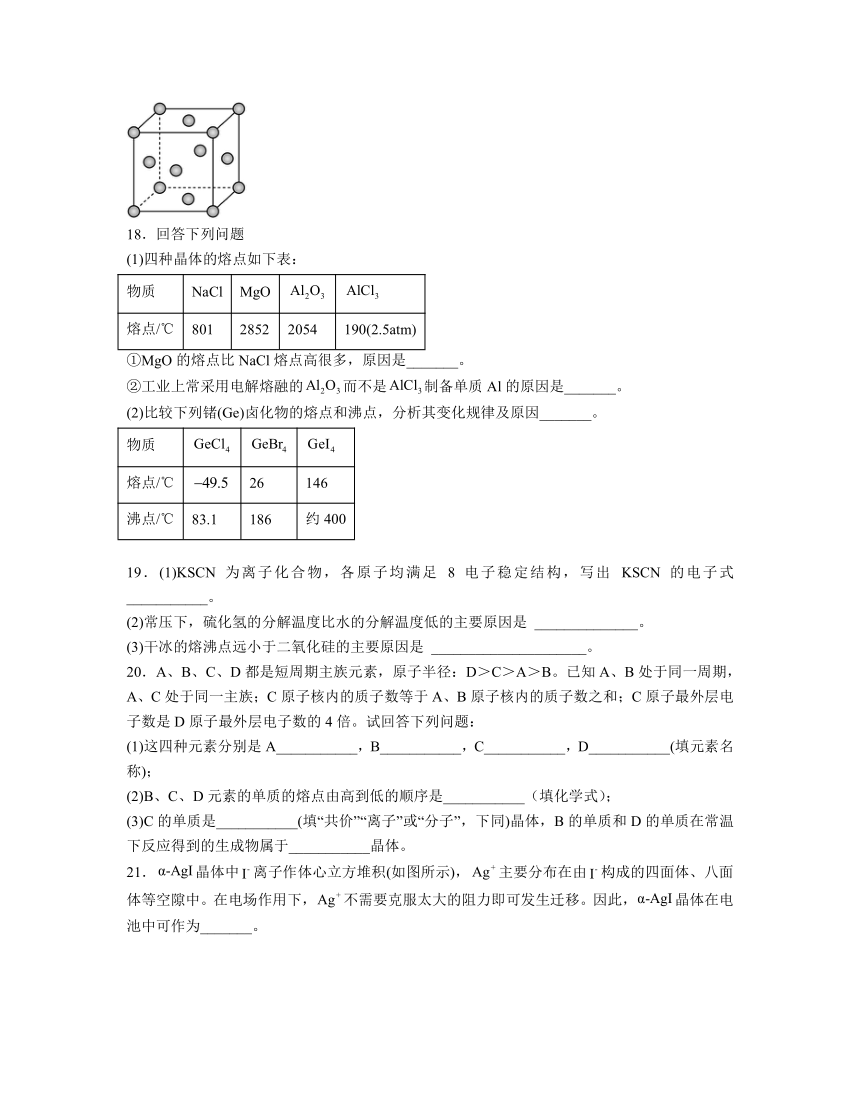
3.设表示阿伏加德罗常数的值,下列说法中不正确的
A.含16g氧原子的二氧化硅晶体中含有的键数目为
B.1mol冰中氢键的个数为
C.向中加入足量溶液,可以得到沉淀
D.12g石墨烯(单层石墨)中含有的六元环数为个
4.室温下,经指定操作后,下列各组溶液中的离子还能大量共存的是
A.通入足量:、、、
B.通入适量:、、、
C.通入足量HCl:、、、
D.通入足量:、、、
5.设NA为阿伏加德罗常数的值,下列说法错误的是
A.1mol14NO和13CO混合气体中所含中子数为15NA
B.1molNa218O2与足量水反应,最终水溶液中18O原子的数目为2NA
C.2mol[Ag(NH3)2OH]中配位键个数为4NA
D.标准状况下,11.2LCH4和22.4LCl2在光照条件下充分反应后的分子数为1.5NA
6.Fe在自然界中分布广泛,Fe3+可与H2O、F-、SCN-等配体形成配位数为6的配离子。下列说法错误的是
A.Fe3+与H2O形成配离子时O提供孤对电子
B.Fe3+的核外有23种运动状态不同的电子
C.Fe3+与SCN-形成的配离子为[Fe(SCN)6]3+
D.Fe3+与SCN-形成的配合离子稳定性强于与H2O形成的配合离子
7.化学上存在许多的递变关系,下列递变关系完全正确的是
A.熔沸点;硬度:
B.稳定性:;沸点:
C.酸性:;非金属性:
D.第一电离能:;电负性:
8.下列叙述错误的是
A.离子键没有方向性和饱和性,而共价键有方向性和饱和性
B.金属键的实质是在整块固态金属中不停运动的“自由电子”与金属阳离子相互作用,使得体系的能量大大降低
C.配位键在形成时,由成键双方各提供一个电子形成共用电子对
D.三种不同的非金属元素可以形成离子化合物
9.下列关于晶体的说法中,正确的是
A.共价键的强弱可决定分子晶体的熔、沸点
B.含有金属阳离子的晶体一定是离子晶体
C.晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
D.CsCl和NaCl晶体中阴、阳离子的配位数都为6
10.NA是阿伏加德罗常数的值。下列说法正确的是
A.溶液中,三种粒子数目之和为0.1NA
B.甲醇分子中含有的共价键数目为4NA
C.金刚石含有的键数目为2NA
D.溶液中含有的CH3COO-数为0.5NA
11.氮化硅(Si3N4)熔点高、硬度大,以硅烷(SiH4,Si为+4价)为原料制备氮化硅(Si3N4)的原理为3SiH4+4NH3=Si3N4+12H2,下列事实能说明N和Si非金属性强弱的是
A.键角:SiH4>NH3 B.SiH4在反应中作还原剂
C.Si3N4为原子晶体 D.SiH4与NH3分子的极性不同
12.双钙钛矿型晶体的一种典型结构单元如图所示,真实的晶体中存在5%的O原子缺陷,能让在其中传导,可用作固体电解质材料。已知La为+3价,Ba为+2价。以下说法错误的是
A.该晶体的一个完整晶胞中含有1个Co原子
B.晶体中与La距离最近的Ba的数目为6
C.+3价Co与+4价Co的原子个数比为4:1
D.忽略氧原子缺陷,每个La或Ba原子都处于氧原子正八面体空隙的中心
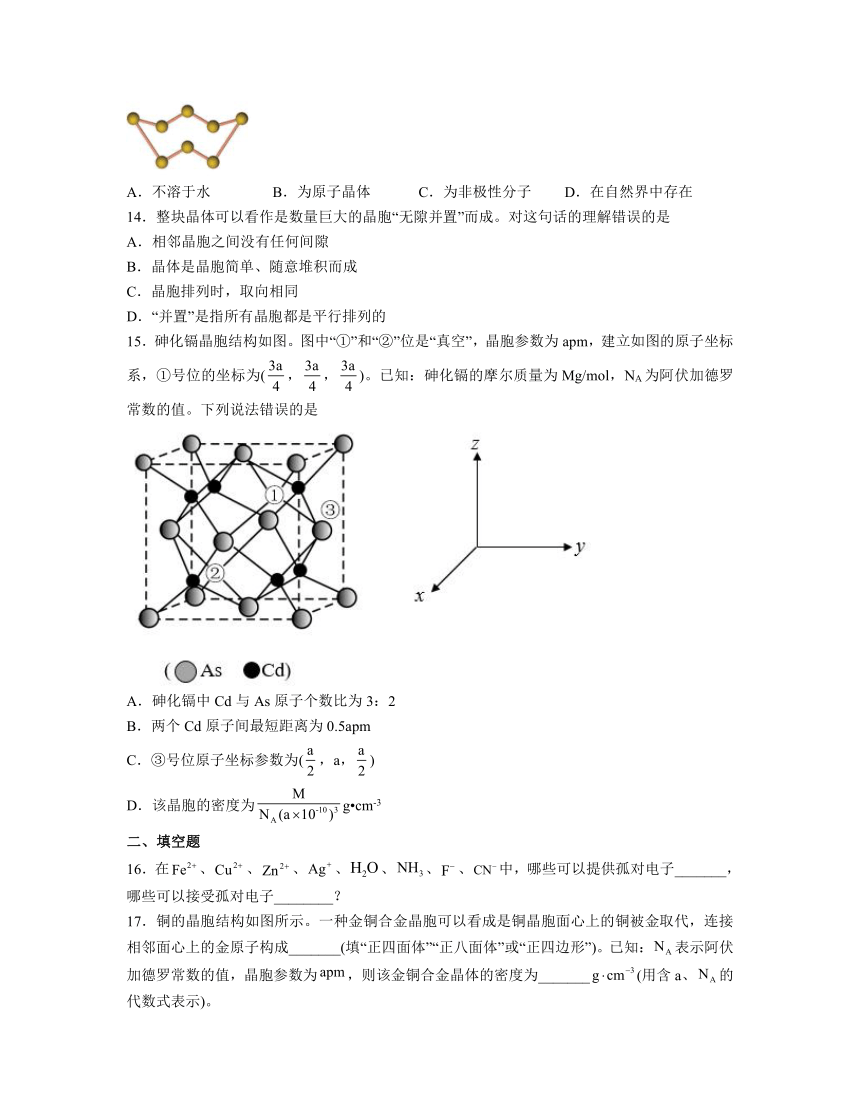
13.硫单质通常以S8形式存在,结构如图,下列关于S8的说法错误的是
A.不溶于水 B.为原子晶体 C.为非极性分子 D.在自然界中存在
14.整块晶体可以看作是数量巨大的晶胞“无隙并置”而成。对这句话的理解错误的是
A.相邻晶胞之间没有任何间隙
B.晶体是晶胞简单、随意堆积而成
C.晶胞排列时,取向相同
D.“并置”是指所有晶胞都是平行排列的
15.砷化镉晶胞结构如图。图中“①”和“②”位是“真空”,晶胞参数为apm,建立如图的原子坐标系,①号位的坐标为(,,)。已知:砷化镉的摩尔质量为Mg/mol,NA为阿伏加德罗常数的值。下列说法错误的是
A.砷化镉中Cd与As原子个数比为3:2
B.两个Cd原子间最短距离为0.5apm
C.③号位原子坐标参数为(,a,)
D.该晶胞的密度为g cm-3
二、填空题
16.在、、、、、、、中,哪些可以提供孤对电子_______,哪些可以接受孤对电子________?
17.铜的晶胞结构如图所示。一种金铜合金晶胞可以看成是铜晶胞面心上的铜被金取代,连接相邻面心上的金原子构成_______(填“正四面体”“正八面体”或“正四边形”)。已知:表示阿伏加德罗常数的值,晶胞参数为,则该金铜合金晶体的密度为_______(用含a、的代数式表示)。
18.回答下列问题
(1)四种晶体的熔点如下表:
物质 NaCl MgO
熔点/℃ 801 2852 2054 190(2.5atm)
①MgO的熔点比NaCl熔点高很多,原因是_______。
②工业上常采用电解熔融的而不是制备单质Al的原因是_______。
(2)比较下列锗(Ge)卤化物的熔点和沸点,分析其变化规律及原因_______。
物质
熔点/℃ 26 146
沸点/℃ 83.1 186 约400
19.(1)KSCN 为离子化合物,各原子均满足 8 电子稳定结构,写出 KSCN 的电子式___________。
(2)常压下,硫化氢的分解温度比水的分解温度低的主要原因是 ______________。
(3)干冰的熔沸点远小于二氧化硅的主要原因是 _____________________。
20.A、B、C、D都是短周期主族元素,原子半径:D>C>A>B。已知A、B处于同一周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的4倍。试回答下列问题:
(1)这四种元素分别是A___________,B___________,C___________,D___________(填元素名称);
(2)B、C、D元素的单质的熔点由高到低的顺序是___________(填化学式);
(3)C的单质是___________(填“共价”“离子”或“分子”,下同)晶体,B的单质和D的单质在常温下反应得到的生成物属于___________晶体。
21.晶体中离子作体心立方堆积(如图所示),主要分布在由构成的四面体、八面体等空隙中。在电场作用下,不需要克服太大的阻力即可发生迁移。因此,晶体在电池中可作为_______。
已知阿伏加德罗常数为,则晶体的摩尔体积_______(列出算式)。
22.Li2O具有反萤石结构,为立方晶系晶体,其晶胞参数为apm。该晶胞中离子的分数坐标为:
氧离子:(0,0,0);(,,0);(,0,);(0,,);……
锂离子:(,,);(,,);(,,);(,,);……
锂离子的配位数为_______。
23.数十亿年来,随着地球上物质的不断变化,大气的成分也发生着很大的变化。
表中是原始大气和目前空气的主要成分:
目前空气的成分 、、、、、等
原始大气的主要成分 、、、等
用表中所涉及物质按要求回答下列问题。
(1)含有10个电子的分子有__________________。
(2)由极性键构成的非极性分子有__________________。
(3)沸点最高的物质是__________________。
(4)不含孤电子对的氢化物分子有__________________,它的空间结构为__________________。
(5)极易溶于水且水溶液呈碱性的物质是_________。
(6)的结构可表示为,与结构最相似的分子是_________。二者分子的极性_________(填“相同”或“不相同”)。
(7)写出与反应的离子方程式:________;能与形成配位键的分子还有______。
【参考答案】
一、选择题
1.C
解析:A.醋酸钠在溶液中完全电离出自由移动的离子,属于强电解质,故A错误;
B.醋酸钠是含有离子键、极性键和非极性键的离子化合物,故B错误;
C.醋酸钠是含有离子键、极性键和非极性键的离子晶体,故C正确;
D.醋酸钠是强碱弱酸盐,醋酸根离子在溶液中水解使溶液呈碱性,故D错误;
故选C。
2.B
解析:A.干冰是二氧化碳分子形成的分子晶体,二氧化碳分子中含有共价键、分子间存在分子间作用力,故A不符合题意;
B.氯化钠是由钠离子和氯离子形成的离子晶体,晶体中只存在离子键,故B符合题意;
C.氢氧化钠是由钠离子和氢氧根离子形成的离子晶体,晶体中存在离子键,氢氧根离子中存在共价键,故C不符合题意;
D.碘是碘分子形成的分子晶体,碘分子中含有共价键、分子间存在分子间作用力,故D不符合题意;
故选B。
3.D
解析:A.16g氧原子的物质的量为1mol,1个氧原子形成2个共价键,含16g氧原子的二氧化硅晶体中含有的键数目为,故A正确;
B.冰晶体中,每个水分子与周围4个水分子形成4个氢键,根据均摊原则,每个水分子形成2个氢键,1mol冰中氢键的个数为,故B正确;
C.向中加入足量溶液,外界的氯离子能电离,所以可以得到沉淀,故C正确;
D.12g石墨烯(单层石墨)中碳原子的物质的量是1mol,根据均摊原则,每个六元环占用2个碳原子,所以含有的六元环数为0.5个,故D错误;
选D。
4.B
解析:A.具有强的还原性,能与和(酸性)发生氧化还原反应,不能大量共存,故A错误;
B.该组离子彼此不发生反应,且均与二氧化碳不能反应,可以大量共存,故B正确;
C.HCl具有还原性,能被离子氧化,不能大量共存,故C错误;
D.足量氨气能与形成络合离子,不能大量共存,故D错误;
故选:B。
5.B
解析:A. 14NO和13CO的中子数均为,故1mol14NO和13CO混合气体中所含中子数为1mol×15×NA/mol=15NA,A正确;
B.1molNa218O2与足量水反应,生成1molNa18OH和0.5mol18O2,最终水溶液中18O原子的数目为NA个,B错误;
C.1分子[Ag(NH3)2]OH中存在2个配位键,则2mol[Ag(NH3)2]OH中配位键个数为4NA,C正确;
D.甲烷与氯气反应前后分子总数不变,标准状况下,11.2L甲烷的物质的量,22.4L氯气的物质的量,反应前分子数为1.5NA,则在光照条件下反应后,所得混合物的分子数仍为1.5NA,D正确;
综上所述答案为B。
6.C
解析:A.Fe3+与H2O形成配离子时,Fe3+提供空轨道,O提供孤对电子,A项正确;
B.由于每个电子的运动状态均不相同且Fe为26号元素,则Fe3+的核外有23种运动状态不同的电子,B项正确;
C.Fe3+与SCN-形成的配离子为[Fe(SCN)6]3-,C项错误;
D.含Fe3+的溶液中加入SCN-,溶液会变为血红色,说明Fe3+与SCN-形成的配合离子稳定性强于与H2O形成的配合离子,D项正确;
答案选C。
7.C
解析:A.金属离子与自由电子间的作用越弱,金属晶体的熔沸点越低,硬度越小,碱金属离子所带电荷量均相同,对应阳离子半径从上至下依次增大,因此熔沸点:Li>Na>K>Rb,硬度:硬度:Li>Na>K>Rb,故A项错误;
B.同一主族从上至下非金属性逐渐减小,因此非金属性:F>Cl>Br>I,则简单氢化物的稳定性:HF>HCl>HBr>HI;HF、HCl、HBr、HI均为分子化合物,由于HF分子间存在氢键,HCl、HBr、HI分子间均无氢键,而分子间氢键使沸点增大,因此沸点:C.同一周期从左至右非金属性逐渐增强,因此非金属性Cl>S,最高价氧化物对应水化物的酸性:;为弱酸,且为C元素最高价氧化物对应水化物,因此酸性:;非金属性:,故C项正确;
D.同一周期从左至右原子的第一电离能有增大的趋势,P原子价电子排布式为3s23p3,其中p能级轨道半充满,因此P原子相对较为稳定,第一电离能:,同一周期从左至右元素的电负性逐渐增大,因此电负性:Cl>S>P,故D项错误;
综上所述,正确的是C项。
8.C
解析:A.离子键通过阴阳离子之间的相互作用形成,离子键没有方向性和饱和性,而共价键有方向性和饱和性,故A正确;
B.金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用,使得体系的能量大大降低,故B正确;
C.配位键在形成时,由成键原子的一方提供孤电子对,另方提供空轨道,故C错误;
D.NH4Cl是不含金属元素的离子化合物且是由三种不同的非金属元素组成的,D正确;
故选C。
9.C
解析:A.分子晶体熔化、沸腾时破坏分子间作用力,不破坏共价键,分子间作用力决定分子晶体的熔、沸点,共价键决定分子晶体的稳定性,故A错误;
B.含有金属阳离子的晶体不一定是离子晶体,如金属中含有金属阳离子,但不属于离子晶体,故B错误;
C.晶体中原子呈周期性有序排列,且有自范性,非晶体中原子排列相对无序,无自范性,故C正确;
D. NaCl晶体中,由体心的钠离子看出周围有6个氯离子,CsCl晶体中,由体心的铯离子看出周围有8个氯离子,故D错误;
故选C。
10.C
解析:A.溶液体积不知,无法计算溶液中微粒数,故A错误;
B.甲醇分子中含5条共价键,故1mol甲醇中含5NA条共价键,故B错误;
C.12g 金刚石中含有C原子的物质的量为=1mol,金刚石晶体中每个C原子与周围的4个碳原子形成碳碳键,每个碳碳键为2个碳原子共用,因此每个碳原子有2个碳碳键,因此1mol金刚石中含2mol键,即2NA个,故C正确;
D.中含有0.5mol CH3COONa,由于醋酸钠水解,溶液中醋酸根的个数少于0.5NA,故D错误;
故选C。
11.B
解析:A.SiH4、NH3中心原子价层电子对数均为4,SiH4中Si无孤电子对,氨分子中N孤电子对数为1,因此键角:SiH4>NH3,但与非金属性强弱无关,故A不符合题意;
B.SiH4中Si为+4价,硅化合价不变,而SiH4中H失去电子,化合价升高,因此SiH4在反应中作还原剂,NH3中N化合价未变,NH3中H得到电子,得出N的电负性大于Si,则说明N的非金属性比Si非金属性强,故B符合题意;
C.氮化硅(Si3N4)熔点高、硬度大,说明Si3N4为共价晶体,与非金属性强弱无关,故C不符合题意;
D.SiH4是非极性分子,NH3是极性分子,两者分子的极性不同,与非金属性无关,故D不符合题意。
综上所述,答案为B。
12.A
解析:A.Co原子位于结构单元的体心,每个结构单元含有1个Co原子,由图可知,若该结构单元重复排列,则其相邻结构单元的La、Ba原子会与该结构单元中的Ba、La 原子重叠,所以该结构单元不是该晶体的晶胞,该晶体的晶胞应是由8个如图所示结构单元组成的,所以一个完整晶胞中含有8个Co原子,故A错误;
B.由晶胞结构可知,晶体中与La距离最近的Ba的数目为6个,故B正确;
C.该结构中Ba原子个数=La原子个数=,Co原子个数是1,O原子个数=,其化学式为Ba0.5La0.5CoO2.85,设+3价的Co为xg,则+4价的Co为(1-x)g个,根据化合价的代数和为0得,=0,x=0.8,所以+3价、+4价的Co原子个数之比=0.8:0.2=4:1,故C正确;
D.由晶胞结构可知,6个氧原子构成正八面体,每个La或Ba原子都处于氧原子正八面体空隙的中心,故D正确;
故选A。
13.B
解析:A.S8不溶于水,故A正确;
B.固态S是由S8构成的,该晶体中存在的微粒是分子,所以属于分子晶体,故B错误;
C.S8以S-S非极性键形成的非极性分子,故C正确;
D.S8是在自然界中存在一种硫单质,故D正确;
故选:B。
14.B
解析:晶体并不是晶胞简单、随意堆积而成,而是晶胞平行排列而成的,且相邻晶胞之间没有任何间隙。故答案选择B。
15.D
解析:A.由图示晶胞可知,一个晶胞中As个数为:,Cd的个数为6,故砷化镉中Cd与As原子个数比为6:4=3:2,A正确;
B.由图示晶胞可知,平行与边的同一直线上Cd原子将边长 4等分,故两个Cd原子间最短距离为0.5apm,B正确;
C.由图所示可知,③号位原子位于右侧面的面心上,故其坐标参数为(,a,),D正确;
D.由A项分析可知,一个晶胞中含有6个Cd和4个As,即含有2个As2Cd3,故该晶胞的密度为g·cm-3,D错误;
故答案为:D。
二、填空题
16. H2O、NH3、F-、CN- Fe2+、Cu2+、 Zn2+、 Ag+
解析:配合物的中心原子,常见的是过渡金属的原子或离子,也可以是主族元素阳离子,如铁离子、铜离子、锌离子和银离子,它们可以接受孤电子对;配位体指配合物中与中心原子结合的离子或分子,指含有孤电子对的分子或离子,常见的有H2O、NH3、F-、CN-、CO等,它们可以提供孤电子对。故答案为:H2O、NH3、F-、CN- ;Fe2+、Cu2+、 Zn2+、 Ag+。
17. 正八面体
解析:铜晶胞面心上的铜被金取代,由图可知,连接相邻面心上的金原子,上下面2个金原子与4个侧面的金原子构成正八面体;晶胞中原子位于顶角,一个晶胞中原子数目为,原子位于晶胞面心,一个晶胞中原子数目为,则晶胞质量为;晶胞边长为,则晶胞体积,所以密度。故答案为:正八面体;。
18.(1) MgO的核间距比NaCl小,离子电荷数比NaCl多,离子键更强 是分子晶体,在熔融状态下不导电
(2)、、均为分子晶体。组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔沸点越高
解析:(1)①MgO中离子都带2个单位电荷,NaCl中离子都带1个单位电荷,离子半径Cl-<O2-,Mg2+<Na+,高价化合物的晶格能远大于低价离子化合物的晶格,晶格能MgO>NaCl,故熔点MgO>NaCl,答案为:MgO的核间距比NaCl小,离子电荷数比NaCl多,离子键更强;
②因AlCl3是共价化合物,在熔融状态下不能电离出离子,不能导电,无法电解,工业一般用熔融的氧化铝制备铝,答案为:是分子晶体,在熔融状态下不导电;
(2)GeCl4、GeBr4、GeI4的熔沸点逐渐升高,三者结构组成结构相似,均为分子晶体,随相对分子质量增大,分子间作用力增大,熔沸点升高,答案为:、、均为分子晶体。组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔沸点越高。
19. 或 原子半径 S>O,H-S 键的键能比H-O 键的键能小 干冰为分子晶体,分子间作用力小,熔沸点低,二氧化硅为原子晶体,原子间共价键强,熔沸点高
解析:(1)KSCN为离子化合物,各原子均满足8电子稳定结构,SCN-结构简式为[S-C≡N]-或[S=C=N]-,电子式为或;
(2)硫化氢、水中分别含有H-S、H-O键,且氧原子半径小于硫原子,则键能:H-S<H-O,故硫化氢的分解温度比水的分解温度低;
(3)干冰为分子晶体而二氧化硅为原子晶体,破坏分子间的作用力的能量远远小于共价键的键能,干冰的熔沸点远小于二氧化硅。
20.(1) 碳 氧 硅 钠
(2)Si>Na>O2
(3) 共价 离子
【分析】A、B、C、D都是短周期主族元素,原子半径:D>C>A>B。已知A、B处于同一周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和,推知A、B、C、D在周期表中的大致相对位置为,因A、C为主族元素,故B为8号元素氧,且C最外层电子数为D的4倍,则D最外层电子数只能为1,D为Na元素,C为Si元素,则A是C元素,据此分析解答。
解析:(1)根据上述分析可知:A是C,B是O,C是Si,D是Na元素。
(2)这四种元素单质中,碳、硅为共价晶体,原子之间以强烈的共价键结合,断裂消耗很高能量,所以其熔沸点最高;钠为金属晶体,在常温下为固体,其熔沸点比共价晶体Si的低,而氧气子固态时为分子晶体,在室温下呈气态,气体物质的熔沸点低于固态,所以它们的熔点由高到低的顺序是:Si>Na>O2;
(3)C的单质是硅,是Si原子之间以共价键结合形成的共价晶体;B的单质是氧气,D的单质是金属钠,二者在常温下反应产生的Na2O是由阳离子Na+与阳离子O2-之间以离子键结合形成的离子晶体。
21. 电解质
解析:由题意可知,在电场作用下,Ag+不需要克服太大阻力即可发生迁移,因此α-AgI晶体是优良的离子导体,在电池中可作为电解质;每个晶胞中含碘离子的个数为8×+1=2个,依据化学式AgI可知,银离子个数也为2个,晶胞的物质的量n=mol=mol,晶胞体积V=a3pm3=(504×10-12)3m3,则α-AgI晶体的摩尔体积Vm===m3/mol。
22.4
解析:萤石中Ca2+在面心和顶点,配位数为8,Li2O具有反萤石结构,Li2O的晶胞中O2-位于8个顶点和6个面心,Li+位于O2- 构成的八个四面体空隙,则锂离子的配位数为4;答案为:4。
23.(1)CH4、NH3、Ne、H2O
(2)CH4、CO2
(3)H2O
(4) CH4 正四面体
(5)NH3
(6) N2 不相同
(7)NH3+H+= H2O、NH3
解析:(1)中性粒子的电子数=各原子的序数之和,10电子的微粒应该在周期表中Ne元素的前后寻找。10电子的微粒有CH4、NH3、Ne、H2O。答案为CH4、NH3、Ne、H2O;
(2)不同种非金属原子之间形成的极性键,有CO2、H2O、CH4、NH3、CO、CO2。非极性分子有非金属单质、正四面体构型(CH4)、对称直线型分子(CO2)、平面正三角形分子。答案为CH4、CO2;
(3)以上均为分子晶体,含氢键的物质沸点较高。同时H2O和NH3中均有氢键,但H2O中氢键更多沸点更高。答案为H2O;
(4)氢化物有NH3、H2O、CH4,分别计算三者的孤电子为、、。CH4的价层电子对为4+0=4对,它的立体构型为正四面体构型。答案为CH4;正四面体;
(5)极性分子、与H2O存在氢键的分子均易溶于水。NH3易溶于水且产生一水合氨呈碱性。答案为NH3;
(6)等电子体结构相似,CO的等电子体有N2。N2为非极性分子,CO正负电中心不重叠为极性分子。答案为N2;不相同;
(7)NH3为碱性气体与酸反应产生盐,反应为NH3+H+=。H+含有空轨道,能提供孤电子对的H2O、NH3均能与其配位。答案为NH3+H+=;H2O、NH3
一、选择题
1.2022年3月“天宫课堂”中,神舟十三号航天员用过饱和CH3COONa溶液做结晶实验,制造了美丽的“冰雪”,有关CH3COONa固体说法正确的是
A.是弱电解质 B.不含非极性键 C.是离子晶体 D.溶于水显酸性
2.金属键、共价键、离子键和分子间作用力是构成物质粒子间的不同作用方式。下列物质中,只含有上述一种作用力的是
A.干冰 B.氯化钠 C.氢氧化钠 D.碘
3.设表示阿伏加德罗常数的值,下列说法中不正确的
A.含16g氧原子的二氧化硅晶体中含有的键数目为
B.1mol冰中氢键的个数为
C.向中加入足量溶液,可以得到沉淀
D.12g石墨烯(单层石墨)中含有的六元环数为个
4.室温下,经指定操作后,下列各组溶液中的离子还能大量共存的是
A.通入足量:、、、
B.通入适量:、、、
C.通入足量HCl:、、、
D.通入足量:、、、
5.设NA为阿伏加德罗常数的值,下列说法错误的是
A.1mol14NO和13CO混合气体中所含中子数为15NA
B.1molNa218O2与足量水反应,最终水溶液中18O原子的数目为2NA
C.2mol[Ag(NH3)2OH]中配位键个数为4NA
D.标准状况下,11.2LCH4和22.4LCl2在光照条件下充分反应后的分子数为1.5NA
6.Fe在自然界中分布广泛,Fe3+可与H2O、F-、SCN-等配体形成配位数为6的配离子。下列说法错误的是
A.Fe3+与H2O形成配离子时O提供孤对电子
B.Fe3+的核外有23种运动状态不同的电子
C.Fe3+与SCN-形成的配离子为[Fe(SCN)6]3+
D.Fe3+与SCN-形成的配合离子稳定性强于与H2O形成的配合离子
7.化学上存在许多的递变关系,下列递变关系完全正确的是
A.熔沸点;硬度:
B.稳定性:;沸点:
C.酸性:;非金属性:
D.第一电离能:;电负性:
8.下列叙述错误的是
A.离子键没有方向性和饱和性,而共价键有方向性和饱和性
B.金属键的实质是在整块固态金属中不停运动的“自由电子”与金属阳离子相互作用,使得体系的能量大大降低
C.配位键在形成时,由成键双方各提供一个电子形成共用电子对
D.三种不同的非金属元素可以形成离子化合物
9.下列关于晶体的说法中,正确的是
A.共价键的强弱可决定分子晶体的熔、沸点
B.含有金属阳离子的晶体一定是离子晶体
C.晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
D.CsCl和NaCl晶体中阴、阳离子的配位数都为6
10.NA是阿伏加德罗常数的值。下列说法正确的是
A.溶液中,三种粒子数目之和为0.1NA
B.甲醇分子中含有的共价键数目为4NA
C.金刚石含有的键数目为2NA
D.溶液中含有的CH3COO-数为0.5NA
11.氮化硅(Si3N4)熔点高、硬度大,以硅烷(SiH4,Si为+4价)为原料制备氮化硅(Si3N4)的原理为3SiH4+4NH3=Si3N4+12H2,下列事实能说明N和Si非金属性强弱的是
A.键角:SiH4>NH3 B.SiH4在反应中作还原剂
C.Si3N4为原子晶体 D.SiH4与NH3分子的极性不同
12.双钙钛矿型晶体的一种典型结构单元如图所示,真实的晶体中存在5%的O原子缺陷,能让在其中传导,可用作固体电解质材料。已知La为+3价,Ba为+2价。以下说法错误的是
A.该晶体的一个完整晶胞中含有1个Co原子
B.晶体中与La距离最近的Ba的数目为6
C.+3价Co与+4价Co的原子个数比为4:1
D.忽略氧原子缺陷,每个La或Ba原子都处于氧原子正八面体空隙的中心
13.硫单质通常以S8形式存在,结构如图,下列关于S8的说法错误的是
A.不溶于水 B.为原子晶体 C.为非极性分子 D.在自然界中存在
14.整块晶体可以看作是数量巨大的晶胞“无隙并置”而成。对这句话的理解错误的是
A.相邻晶胞之间没有任何间隙
B.晶体是晶胞简单、随意堆积而成
C.晶胞排列时,取向相同
D.“并置”是指所有晶胞都是平行排列的
15.砷化镉晶胞结构如图。图中“①”和“②”位是“真空”,晶胞参数为apm,建立如图的原子坐标系,①号位的坐标为(,,)。已知:砷化镉的摩尔质量为Mg/mol,NA为阿伏加德罗常数的值。下列说法错误的是
A.砷化镉中Cd与As原子个数比为3:2
B.两个Cd原子间最短距离为0.5apm
C.③号位原子坐标参数为(,a,)
D.该晶胞的密度为g cm-3
二、填空题
16.在、、、、、、、中,哪些可以提供孤对电子_______,哪些可以接受孤对电子________?
17.铜的晶胞结构如图所示。一种金铜合金晶胞可以看成是铜晶胞面心上的铜被金取代,连接相邻面心上的金原子构成_______(填“正四面体”“正八面体”或“正四边形”)。已知:表示阿伏加德罗常数的值,晶胞参数为,则该金铜合金晶体的密度为_______(用含a、的代数式表示)。
18.回答下列问题
(1)四种晶体的熔点如下表:
物质 NaCl MgO
熔点/℃ 801 2852 2054 190(2.5atm)
①MgO的熔点比NaCl熔点高很多,原因是_______。
②工业上常采用电解熔融的而不是制备单质Al的原因是_______。
(2)比较下列锗(Ge)卤化物的熔点和沸点,分析其变化规律及原因_______。
物质
熔点/℃ 26 146
沸点/℃ 83.1 186 约400
19.(1)KSCN 为离子化合物,各原子均满足 8 电子稳定结构,写出 KSCN 的电子式___________。
(2)常压下,硫化氢的分解温度比水的分解温度低的主要原因是 ______________。
(3)干冰的熔沸点远小于二氧化硅的主要原因是 _____________________。
20.A、B、C、D都是短周期主族元素,原子半径:D>C>A>B。已知A、B处于同一周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的4倍。试回答下列问题:
(1)这四种元素分别是A___________,B___________,C___________,D___________(填元素名称);
(2)B、C、D元素的单质的熔点由高到低的顺序是___________(填化学式);
(3)C的单质是___________(填“共价”“离子”或“分子”,下同)晶体,B的单质和D的单质在常温下反应得到的生成物属于___________晶体。
21.晶体中离子作体心立方堆积(如图所示),主要分布在由构成的四面体、八面体等空隙中。在电场作用下,不需要克服太大的阻力即可发生迁移。因此,晶体在电池中可作为_______。
已知阿伏加德罗常数为,则晶体的摩尔体积_______(列出算式)。
22.Li2O具有反萤石结构,为立方晶系晶体,其晶胞参数为apm。该晶胞中离子的分数坐标为:
氧离子:(0,0,0);(,,0);(,0,);(0,,);……
锂离子:(,,);(,,);(,,);(,,);……
锂离子的配位数为_______。
23.数十亿年来,随着地球上物质的不断变化,大气的成分也发生着很大的变化。
表中是原始大气和目前空气的主要成分:
目前空气的成分 、、、、、等
原始大气的主要成分 、、、等
用表中所涉及物质按要求回答下列问题。
(1)含有10个电子的分子有__________________。
(2)由极性键构成的非极性分子有__________________。
(3)沸点最高的物质是__________________。
(4)不含孤电子对的氢化物分子有__________________,它的空间结构为__________________。
(5)极易溶于水且水溶液呈碱性的物质是_________。
(6)的结构可表示为,与结构最相似的分子是_________。二者分子的极性_________(填“相同”或“不相同”)。
(7)写出与反应的离子方程式:________;能与形成配位键的分子还有______。
【参考答案】
一、选择题
1.C
解析:A.醋酸钠在溶液中完全电离出自由移动的离子,属于强电解质,故A错误;
B.醋酸钠是含有离子键、极性键和非极性键的离子化合物,故B错误;
C.醋酸钠是含有离子键、极性键和非极性键的离子晶体,故C正确;
D.醋酸钠是强碱弱酸盐,醋酸根离子在溶液中水解使溶液呈碱性,故D错误;
故选C。
2.B
解析:A.干冰是二氧化碳分子形成的分子晶体,二氧化碳分子中含有共价键、分子间存在分子间作用力,故A不符合题意;
B.氯化钠是由钠离子和氯离子形成的离子晶体,晶体中只存在离子键,故B符合题意;
C.氢氧化钠是由钠离子和氢氧根离子形成的离子晶体,晶体中存在离子键,氢氧根离子中存在共价键,故C不符合题意;
D.碘是碘分子形成的分子晶体,碘分子中含有共价键、分子间存在分子间作用力,故D不符合题意;
故选B。
3.D
解析:A.16g氧原子的物质的量为1mol,1个氧原子形成2个共价键,含16g氧原子的二氧化硅晶体中含有的键数目为,故A正确;
B.冰晶体中,每个水分子与周围4个水分子形成4个氢键,根据均摊原则,每个水分子形成2个氢键,1mol冰中氢键的个数为,故B正确;
C.向中加入足量溶液,外界的氯离子能电离,所以可以得到沉淀,故C正确;
D.12g石墨烯(单层石墨)中碳原子的物质的量是1mol,根据均摊原则,每个六元环占用2个碳原子,所以含有的六元环数为0.5个,故D错误;
选D。
4.B
解析:A.具有强的还原性,能与和(酸性)发生氧化还原反应,不能大量共存,故A错误;
B.该组离子彼此不发生反应,且均与二氧化碳不能反应,可以大量共存,故B正确;
C.HCl具有还原性,能被离子氧化,不能大量共存,故C错误;
D.足量氨气能与形成络合离子,不能大量共存,故D错误;
故选:B。
5.B
解析:A. 14NO和13CO的中子数均为,故1mol14NO和13CO混合气体中所含中子数为1mol×15×NA/mol=15NA,A正确;
B.1molNa218O2与足量水反应,生成1molNa18OH和0.5mol18O2,最终水溶液中18O原子的数目为NA个,B错误;
C.1分子[Ag(NH3)2]OH中存在2个配位键,则2mol[Ag(NH3)2]OH中配位键个数为4NA,C正确;
D.甲烷与氯气反应前后分子总数不变,标准状况下,11.2L甲烷的物质的量,22.4L氯气的物质的量,反应前分子数为1.5NA,则在光照条件下反应后,所得混合物的分子数仍为1.5NA,D正确;
综上所述答案为B。
6.C
解析:A.Fe3+与H2O形成配离子时,Fe3+提供空轨道,O提供孤对电子,A项正确;
B.由于每个电子的运动状态均不相同且Fe为26号元素,则Fe3+的核外有23种运动状态不同的电子,B项正确;
C.Fe3+与SCN-形成的配离子为[Fe(SCN)6]3-,C项错误;
D.含Fe3+的溶液中加入SCN-,溶液会变为血红色,说明Fe3+与SCN-形成的配合离子稳定性强于与H2O形成的配合离子,D项正确;
答案选C。
7.C
解析:A.金属离子与自由电子间的作用越弱,金属晶体的熔沸点越低,硬度越小,碱金属离子所带电荷量均相同,对应阳离子半径从上至下依次增大,因此熔沸点:Li>Na>K>Rb,硬度:硬度:Li>Na>K>Rb,故A项错误;
B.同一主族从上至下非金属性逐渐减小,因此非金属性:F>Cl>Br>I,则简单氢化物的稳定性:HF>HCl>HBr>HI;HF、HCl、HBr、HI均为分子化合物,由于HF分子间存在氢键,HCl、HBr、HI分子间均无氢键,而分子间氢键使沸点增大,因此沸点:
D.同一周期从左至右原子的第一电离能有增大的趋势,P原子价电子排布式为3s23p3,其中p能级轨道半充满,因此P原子相对较为稳定,第一电离能:,同一周期从左至右元素的电负性逐渐增大,因此电负性:Cl>S>P,故D项错误;
综上所述,正确的是C项。
8.C
解析:A.离子键通过阴阳离子之间的相互作用形成,离子键没有方向性和饱和性,而共价键有方向性和饱和性,故A正确;
B.金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用,使得体系的能量大大降低,故B正确;
C.配位键在形成时,由成键原子的一方提供孤电子对,另方提供空轨道,故C错误;
D.NH4Cl是不含金属元素的离子化合物且是由三种不同的非金属元素组成的,D正确;
故选C。
9.C
解析:A.分子晶体熔化、沸腾时破坏分子间作用力,不破坏共价键,分子间作用力决定分子晶体的熔、沸点,共价键决定分子晶体的稳定性,故A错误;
B.含有金属阳离子的晶体不一定是离子晶体,如金属中含有金属阳离子,但不属于离子晶体,故B错误;
C.晶体中原子呈周期性有序排列,且有自范性,非晶体中原子排列相对无序,无自范性,故C正确;
D. NaCl晶体中,由体心的钠离子看出周围有6个氯离子,CsCl晶体中,由体心的铯离子看出周围有8个氯离子,故D错误;
故选C。
10.C
解析:A.溶液体积不知,无法计算溶液中微粒数,故A错误;
B.甲醇分子中含5条共价键,故1mol甲醇中含5NA条共价键,故B错误;
C.12g 金刚石中含有C原子的物质的量为=1mol,金刚石晶体中每个C原子与周围的4个碳原子形成碳碳键,每个碳碳键为2个碳原子共用,因此每个碳原子有2个碳碳键,因此1mol金刚石中含2mol键,即2NA个,故C正确;
D.中含有0.5mol CH3COONa,由于醋酸钠水解,溶液中醋酸根的个数少于0.5NA,故D错误;
故选C。
11.B
解析:A.SiH4、NH3中心原子价层电子对数均为4,SiH4中Si无孤电子对,氨分子中N孤电子对数为1,因此键角:SiH4>NH3,但与非金属性强弱无关,故A不符合题意;
B.SiH4中Si为+4价,硅化合价不变,而SiH4中H失去电子,化合价升高,因此SiH4在反应中作还原剂,NH3中N化合价未变,NH3中H得到电子,得出N的电负性大于Si,则说明N的非金属性比Si非金属性强,故B符合题意;
C.氮化硅(Si3N4)熔点高、硬度大,说明Si3N4为共价晶体,与非金属性强弱无关,故C不符合题意;
D.SiH4是非极性分子,NH3是极性分子,两者分子的极性不同,与非金属性无关,故D不符合题意。
综上所述,答案为B。
12.A
解析:A.Co原子位于结构单元的体心,每个结构单元含有1个Co原子,由图可知,若该结构单元重复排列,则其相邻结构单元的La、Ba原子会与该结构单元中的Ba、La 原子重叠,所以该结构单元不是该晶体的晶胞,该晶体的晶胞应是由8个如图所示结构单元组成的,所以一个完整晶胞中含有8个Co原子,故A错误;
B.由晶胞结构可知,晶体中与La距离最近的Ba的数目为6个,故B正确;
C.该结构中Ba原子个数=La原子个数=,Co原子个数是1,O原子个数=,其化学式为Ba0.5La0.5CoO2.85,设+3价的Co为xg,则+4价的Co为(1-x)g个,根据化合价的代数和为0得,=0,x=0.8,所以+3价、+4价的Co原子个数之比=0.8:0.2=4:1,故C正确;
D.由晶胞结构可知,6个氧原子构成正八面体,每个La或Ba原子都处于氧原子正八面体空隙的中心,故D正确;
故选A。
13.B
解析:A.S8不溶于水,故A正确;
B.固态S是由S8构成的,该晶体中存在的微粒是分子,所以属于分子晶体,故B错误;
C.S8以S-S非极性键形成的非极性分子,故C正确;
D.S8是在自然界中存在一种硫单质,故D正确;
故选:B。
14.B
解析:晶体并不是晶胞简单、随意堆积而成,而是晶胞平行排列而成的,且相邻晶胞之间没有任何间隙。故答案选择B。
15.D
解析:A.由图示晶胞可知,一个晶胞中As个数为:,Cd的个数为6,故砷化镉中Cd与As原子个数比为6:4=3:2,A正确;
B.由图示晶胞可知,平行与边的同一直线上Cd原子将边长 4等分,故两个Cd原子间最短距离为0.5apm,B正确;
C.由图所示可知,③号位原子位于右侧面的面心上,故其坐标参数为(,a,),D正确;
D.由A项分析可知,一个晶胞中含有6个Cd和4个As,即含有2个As2Cd3,故该晶胞的密度为g·cm-3,D错误;
故答案为:D。
二、填空题
16. H2O、NH3、F-、CN- Fe2+、Cu2+、 Zn2+、 Ag+
解析:配合物的中心原子,常见的是过渡金属的原子或离子,也可以是主族元素阳离子,如铁离子、铜离子、锌离子和银离子,它们可以接受孤电子对;配位体指配合物中与中心原子结合的离子或分子,指含有孤电子对的分子或离子,常见的有H2O、NH3、F-、CN-、CO等,它们可以提供孤电子对。故答案为:H2O、NH3、F-、CN- ;Fe2+、Cu2+、 Zn2+、 Ag+。
17. 正八面体
解析:铜晶胞面心上的铜被金取代,由图可知,连接相邻面心上的金原子,上下面2个金原子与4个侧面的金原子构成正八面体;晶胞中原子位于顶角,一个晶胞中原子数目为,原子位于晶胞面心,一个晶胞中原子数目为,则晶胞质量为;晶胞边长为,则晶胞体积,所以密度。故答案为:正八面体;。
18.(1) MgO的核间距比NaCl小,离子电荷数比NaCl多,离子键更强 是分子晶体,在熔融状态下不导电
(2)、、均为分子晶体。组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔沸点越高
解析:(1)①MgO中离子都带2个单位电荷,NaCl中离子都带1个单位电荷,离子半径Cl-<O2-,Mg2+<Na+,高价化合物的晶格能远大于低价离子化合物的晶格,晶格能MgO>NaCl,故熔点MgO>NaCl,答案为:MgO的核间距比NaCl小,离子电荷数比NaCl多,离子键更强;
②因AlCl3是共价化合物,在熔融状态下不能电离出离子,不能导电,无法电解,工业一般用熔融的氧化铝制备铝,答案为:是分子晶体,在熔融状态下不导电;
(2)GeCl4、GeBr4、GeI4的熔沸点逐渐升高,三者结构组成结构相似,均为分子晶体,随相对分子质量增大,分子间作用力增大,熔沸点升高,答案为:、、均为分子晶体。组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔沸点越高。
19. 或 原子半径 S>O,H-S 键的键能比H-O 键的键能小 干冰为分子晶体,分子间作用力小,熔沸点低,二氧化硅为原子晶体,原子间共价键强,熔沸点高
解析:(1)KSCN为离子化合物,各原子均满足8电子稳定结构,SCN-结构简式为[S-C≡N]-或[S=C=N]-,电子式为或;
(2)硫化氢、水中分别含有H-S、H-O键,且氧原子半径小于硫原子,则键能:H-S<H-O,故硫化氢的分解温度比水的分解温度低;
(3)干冰为分子晶体而二氧化硅为原子晶体,破坏分子间的作用力的能量远远小于共价键的键能,干冰的熔沸点远小于二氧化硅。
20.(1) 碳 氧 硅 钠
(2)Si>Na>O2
(3) 共价 离子
【分析】A、B、C、D都是短周期主族元素,原子半径:D>C>A>B。已知A、B处于同一周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和,推知A、B、C、D在周期表中的大致相对位置为,因A、C为主族元素,故B为8号元素氧,且C最外层电子数为D的4倍,则D最外层电子数只能为1,D为Na元素,C为Si元素,则A是C元素,据此分析解答。
解析:(1)根据上述分析可知:A是C,B是O,C是Si,D是Na元素。
(2)这四种元素单质中,碳、硅为共价晶体,原子之间以强烈的共价键结合,断裂消耗很高能量,所以其熔沸点最高;钠为金属晶体,在常温下为固体,其熔沸点比共价晶体Si的低,而氧气子固态时为分子晶体,在室温下呈气态,气体物质的熔沸点低于固态,所以它们的熔点由高到低的顺序是:Si>Na>O2;
(3)C的单质是硅,是Si原子之间以共价键结合形成的共价晶体;B的单质是氧气,D的单质是金属钠,二者在常温下反应产生的Na2O是由阳离子Na+与阳离子O2-之间以离子键结合形成的离子晶体。
21. 电解质
解析:由题意可知,在电场作用下,Ag+不需要克服太大阻力即可发生迁移,因此α-AgI晶体是优良的离子导体,在电池中可作为电解质;每个晶胞中含碘离子的个数为8×+1=2个,依据化学式AgI可知,银离子个数也为2个,晶胞的物质的量n=mol=mol,晶胞体积V=a3pm3=(504×10-12)3m3,则α-AgI晶体的摩尔体积Vm===m3/mol。
22.4
解析:萤石中Ca2+在面心和顶点,配位数为8,Li2O具有反萤石结构,Li2O的晶胞中O2-位于8个顶点和6个面心,Li+位于O2- 构成的八个四面体空隙,则锂离子的配位数为4;答案为:4。
23.(1)CH4、NH3、Ne、H2O
(2)CH4、CO2
(3)H2O
(4) CH4 正四面体
(5)NH3
(6) N2 不相同
(7)NH3+H+= H2O、NH3
解析:(1)中性粒子的电子数=各原子的序数之和,10电子的微粒应该在周期表中Ne元素的前后寻找。10电子的微粒有CH4、NH3、Ne、H2O。答案为CH4、NH3、Ne、H2O;
(2)不同种非金属原子之间形成的极性键,有CO2、H2O、CH4、NH3、CO、CO2。非极性分子有非金属单质、正四面体构型(CH4)、对称直线型分子(CO2)、平面正三角形分子。答案为CH4、CO2;
(3)以上均为分子晶体,含氢键的物质沸点较高。同时H2O和NH3中均有氢键,但H2O中氢键更多沸点更高。答案为H2O;
(4)氢化物有NH3、H2O、CH4,分别计算三者的孤电子为、、。CH4的价层电子对为4+0=4对,它的立体构型为正四面体构型。答案为CH4;正四面体;
(5)极性分子、与H2O存在氢键的分子均易溶于水。NH3易溶于水且产生一水合氨呈碱性。答案为NH3;
(6)等电子体结构相似,CO的等电子体有N2。N2为非极性分子,CO正负电中心不重叠为极性分子。答案为N2;不相同;
(7)NH3为碱性气体与酸反应产生盐,反应为NH3+H+=。H+含有空轨道,能提供孤电子对的H2O、NH3均能与其配位。答案为NH3+H+=;H2O、NH3
