安徽省安庆市迎江区2022-2023学年高二下学期期中考试化学试题(含答案)
文档属性
| 名称 | 安徽省安庆市迎江区2022-2023学年高二下学期期中考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 217.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-25 09:51:57 | ||
图片预览



文档简介
安庆市迎江区2022-2023学年高二下学期期中考试
化学试题
可能用到的原子量H-1 C-12 N-14 O-16 Mg-24 Zn-65 Cu-64
第I卷(选择题共45分)
一、选择题(本大题共15小题每小题有且只有一个选项符合题意,每小题3分)
1.反应 可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是
A.中子数为1的氢原子: B.N2分子结构式:
C.NH4Cl的电子式: D.Cl-的结构示意图:
2.下列说法或有关化学用语的表述正确的是
A.在基态多电子原子中,p能级电子能量一定高于s能级电子能量
B.基态Fe原子的外围电子轨道表示式为
C.因O的电负性比N大,故O的第一电离能比也大
D.根据原子核外电子排布的特点,Cu在元素周期表中位于s区
3.298K、101kPa下,一组物质的摩尔燃烧焓如下表:
物质 H2(g) CH4(g) CH3OH(1)
摩尔燃烧烙(△H)/(KJ·mol-1) -285.8 -890.3 -726.5
下列说法正确的是
A.1mol H2(g)和0.5molO2(g)的内能之和比1molH2O(g)的内能多285.8kJ
B.16.0gCH4(g)在足量O2(g)中燃烧生成CO(g)和液态水,放出890.3kJ热量
C.1mol CH3OH()完全燃烧的热化学方程式为
D.单位质量的三种物质完全燃烧,CH3OH(1)放出的能量最多
4.X、Y、Z、Q、E、M六种元素中,X的原子的基态价电子排布式为2s2,Y的基态原子核外有5种运动状态不同的电子,Z元素的两种同位素原子通常作为示踪原子研究生物化学反应和测定文物的年代,Q是元素周期表中电负性最大的元素,E的阳离子通常存在于硝石、明矾和草木灰中,M的原子序数比E大1。下列说法正确的是
A.EYQ4中阴离子中心原子的杂化方式为sp3杂化
B.X、Y元素的第一电离能大小关系:XC.ZO32-的空间构型为三角锥形
D.MZ2含离子键和非极性共价键,阴阳离子之比为1:2
5.下列关于NH、NH3、NH三种微粒的说法不正确的是()
A.三种微粒所含有的电子数相等
B.三种微粒中氮原子的杂化方式相同
C.三种微粒的空间构型相同
D.键角大小关系:NH>NH3>NH
6.某课题组用单原子Fe铺定在氮掺杂的碳纳米片上的催化剂(A-Fe-NC)构建二次锌-空气电池,其放电原理如图所示:下列叙述错误的是
A.放电时,空气扩散层有利于O2得电子
B.当锌箔消耗6.5g时,有0.2molOH-通过阴离子交换膜移向锌箔
C.充电时,阴极的电极反应式为
D.放电时,锌箔电极电势低,充电时,锌箔电极电势高
7.用价层电子对互斥模型可以判断许多分子或离子的空间结构,有时也能用来推测键角大小,下列判断正确的是
A.SO32-中心原子的价层电子对数为3,是平面三角形结构
B.BF3键角为120°,SnBr2的键角大于120°
C.CH2O是平面三角形的分子
D.PC13、PCl5都是三角锥形的分子
8.下列有关杂化轨道理论的说法中正确的是
A.NCl3分子呈三角锥形,这是氮原子采取sp2杂化的结果
B.sp3杂化轨道是由能量相近的1个s轨道和3个p轨道混合形成的4个sp3杂化轨道
C.中心原子采取sp3杂化的分子,其空间结构一定是四面体形
D.AB3型的分子空间结构必为平面三角形
9.短周期主族元素A、B可形成AB3分子,下列有关叙述正确的是
A.若A、B为同一周期元素,则AB3分子一定为平面正三角形
B.若AB3分子中的价电子个数为24个,则AB3分子可能为平面正三角形
C.若为A、B为同一主族元素,则AB3分子一定为三角锥形
D.若AB3分子为三角形锥形,则AB3分子一定为NH3
10.298K时,BaSO4与BaCO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是
己知101.4=25
A.298K时,BaSO4的溶解度小于BaCO3的溶解度
B.作为分散质BaSO4,W点v(沉淀)C.U点坐标为(4,4.8)
D.对于沉淀溶解平衡 ,其平衡常数K=0.04
11.As2O3(砒霜)是两性氧化物(分子结构如图所示),溶于盐酸生成AsCl3,AsC13用LiAlH4还原生成AsH3。下列说法正确的是()
A.As2O3分子中As原子的杂化方式为sp2杂化
B.LiAlH4为共价化合物
C.AsCl3的空间结构为平面正三角形
D.AsH3分子的键角小于109°28′
12.前四周期主族元素X、Y、Z、W的原子序数依次增大,它们形成的一种物质的结构如图所示,其中所有原子都形成了8电子稳定结构,四种元素中仅X、Y在同周期。下列推断中错误的是
A.简单离子半径:W>Z>Y B.XZ2分子的空间构型为直线形
C.最简单氢化物的稳定性:Y>X D.Y与氧元素形成的化合物不止3种
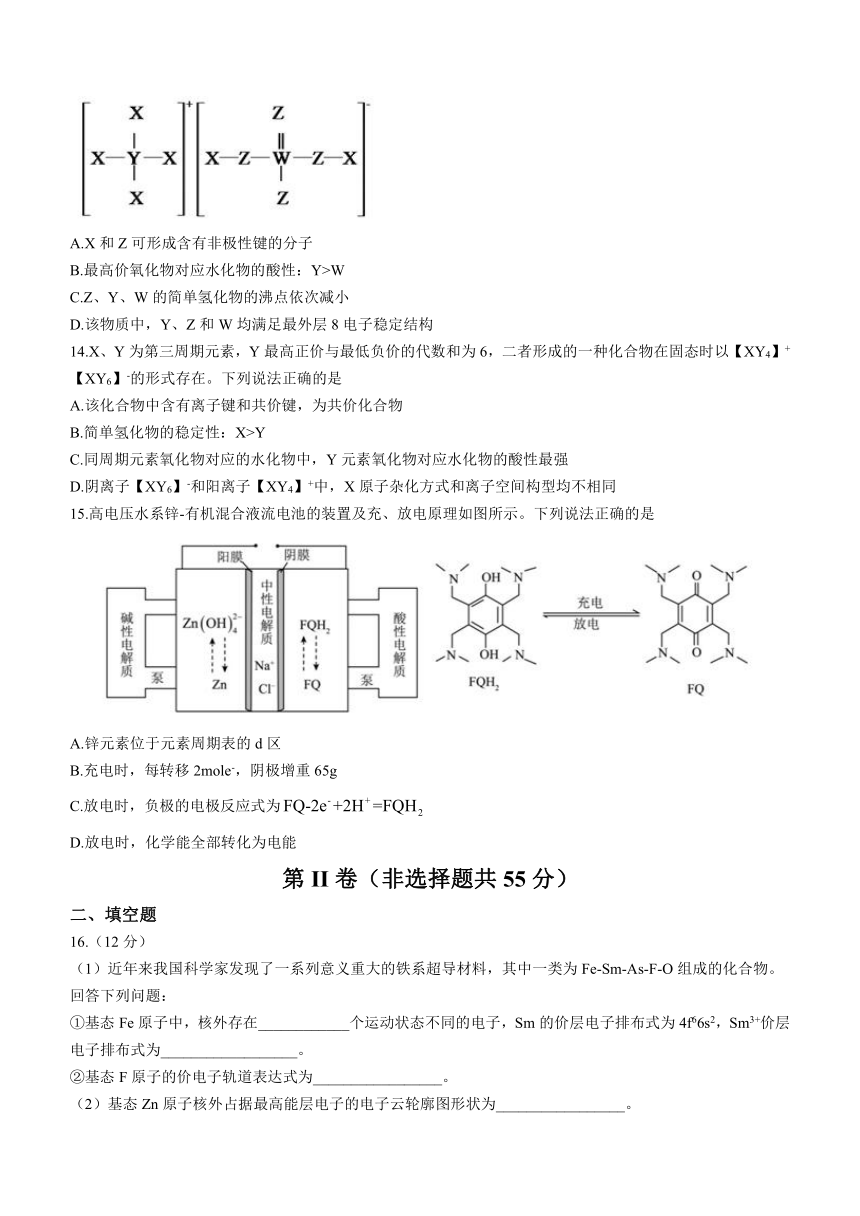
13.一种织物防火剂的结构如下。X、Y、Z、W为原子序数依次增大的四种短周期主族元素,基态Z原子的核外电子总数是其最高能级电子数目的2倍。下列说法错误的是
A.X和Z可形成含有非极性键的分子
B.最高价氧化物对应水化物的酸性:Y>W
C.Z、Y、W的简单氢化物的沸点依次减小
D.该物质中,Y、Z和W均满足最外层8电子稳定结构
14.X、Y为第三周期元素,Y最高正价与最低负价的代数和为6,二者形成的一种化合物在固态时以【XY4】+【XY6】-的形式存在。下列说法正确的是
A.该化合物中含有离子键和共价键,为共价化合物
B.简单氢化物的稳定性:X>Y
C.同周期元素氧化物对应的水化物中,Y元素氧化物对应水化物的酸性最强
D.阴离子【XY6】-和阳离子【XY4】+中,X原子杂化方式和离子空间构型均不相同
15.高电压水系锌-有机混合液流电池的装置及充、放电原理如图所示。下列说法正确的是
A.锌元素位于元素周期表的d区
B.充电时,每转移2mole-,阴极增重65g
C.放电时,负极的电极反应式为
D.放电时,化学能全部转化为电能
第II卷(非选择题共55分)
二、填空题
16.(12分)
(1)近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe-Sm-As-F-O组成的化合物。回答下列问题:
①基态Fe原子中,核外存在____________个运动状态不同的电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为__________________。
②基态F原子的价电子轨道表达式为_________________。
(2)基态Zn原子核外占据最高能层电子的电子云轮廓图形状为_________________。
(3)Cu2+基态原子核外电子排布式为_________________。
(4)下列状态的镁中,电离最外层一个电子所需能量最大的是_________________(填标号)。
A.[Ne] B.[Ne] C.[Ne] D.[Ne]
17.(12分)丁二酮肟()可与Ni2+反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定Ni2+的存在。请回答下列问题:
(1)Ni在元素周期表中的位置为_________________。
(2)基态氧原子的核外电子的空间运动状态有________________种。
(3)丁二酮肟()中涉及元素的电负性由大到小的顺序为_________________;与氮同周期的硼在成键时,能将一个2s电子激发进入2p能级参与形成化学键,请写出该激发态原子的价电子轨道表示式:________________,该过程形成的原子光谱为________________(填“吸收”或“发射”)光谱。
(4)与Ni同周期的铜、锌两种元素位于元素周期表的________________区,两元素的第一电离能(I1)、第二电离能(I2)数据如表所示:
电离能(KJ·mol-1) I1 I2
铜 746 1958
锌 906 1733
铜的I1小于锌,I2却大于锌的主要原因是_________________。
18.(16分)(I)己知常温下部分弱电解质的电离平衡常数如表:
化学式 HF HClO H2CO3 NH3·H2O
电离常数 6.8×10-4 4.7×10-8 K1=4.3×10-7 K2=5.6×10-11 Kb=1.7×10-5
(I)常温下,物质的量浓度相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是_________________。(填序号)
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为_________________,水电离出的氢离子的浓度为_________________。
(3)NaClO溶液中的质子守恒关系为_________________。
(4)向足量的次氯酸钠中通入少量的二氧化碳的离子方程式_________________。
(5)25℃下,将pH=12的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=_________________。
(II)在25℃时对氨水进行如下操作。请填写下列空白。
(6)若向氨水中加入少量硫酸铵固体,则溶液中 将______________(填“增大“减小”或“不变”)。
(7)若向氨水中加入稀硫酸,使氨水恰好被中和,写出反应的离子方程式:_______________;所得溶液的pH______________7(填“>”“<”或“=”)。
19.(15分)实现碳中和成为各国科学家的研究重点,将二氧化碳转化为绿色液体燃料甲醇是一个重要方向。甲醇的制备原理为:
(1)工业上利用低浓度氨水作为捕获剂,吸收烟气中CO2生成NH4HCO3以获得原料气体,其离子方程式为_______________。
(2)甲醇的制备反应一般认为通过如下两步来实现:
①
②
根据盖斯定律,该反应的△H_______________kJ·mol-1,反应能在______________(填“高温”或“低温”)自发进行。
(3)为探究该反应原理,进行如下实验:在一恒温,体积为1L恒容密闭容器中,充入1molCO2和3molH2,进行该反应(不考虑其它副反应)。10min时测得CO2和CH3OH(g)的体积分数之比变为1:3且比值不再随时间变化。回答下列问题:
①反应开始到平衡,v(H2)=_______________。
②该温度下的平衡常数K=_______________(mol/L)-2(保留两位有效数值)。
③若上述反应过程中不断升高反应温度,下列图像正确的是_______________。
A. B.
C. D.
(4)研究发现,CO2加氢还可制备甲酸(HCOOH),反应为CO2(g)+H2(g)f HCOOH(g)△H<0。在
一容积固定的密闭容器中进行反应,实验测得:v正=k正c(CO2)c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。温度为T1℃时,该反应K=2,温度为T2℃时,k正=1.9k逆,则T2℃时平衡压强(填“><”或“=”)T1℃时平衡压强,理由__________________。
安庆市迎江区2022-2023学年高二下学期期中考试
化学试题参考答案
1.B 2.B 3.C 4.A 5.C 6.D 7.C 8.B 9.B 10.C 11.D 12.A 13.D 14.D 15.B
16.(每空2分共12分)(1)26 4f5 (2)球形
(3)1s22s22p63s23p63d9或者【Ar】3d9 (4)A
17.(12分)(1)第四周期第VIII族(2分)(2)5(2分)
(3)O>N>C>H(2分)(2分)吸收(1分
(4)ds(1分)铜的价层电子排布式为3d104s1,锌的价层电子排布式为3d104s2,铜失去一个电子可以达到稳定的3d全满结构,因此铜的I1小于锌的I1,也由于3d全满结构稳定,Cu+再失去一个电子较困难,因此铜的I2大于锌的I2(2分)
18.(16分)(1)③>②>①(2分)
(2) (2分)10-4mol/L(2分)
(3) (2分)(4) (2分)(5)9:2(2分)
(6)减小(1分)(7) (2分) <(1分)
19.(15分)(1) (2分)
(2)-49(2分) 低温(1分)
(3)0.225 mol(L·min)(2分)5.3(2分)AC(2分)
(4)>(2分)
该反应为放热反应,温度升高,平衡常数减小,T1小于T2说明平衡左移,气体的分子数增大,压强增大(2分)
化学试题
可能用到的原子量H-1 C-12 N-14 O-16 Mg-24 Zn-65 Cu-64
第I卷(选择题共45分)
一、选择题(本大题共15小题每小题有且只有一个选项符合题意,每小题3分)
1.反应 可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是
A.中子数为1的氢原子: B.N2分子结构式:
C.NH4Cl的电子式: D.Cl-的结构示意图:
2.下列说法或有关化学用语的表述正确的是
A.在基态多电子原子中,p能级电子能量一定高于s能级电子能量
B.基态Fe原子的外围电子轨道表示式为
C.因O的电负性比N大,故O的第一电离能比也大
D.根据原子核外电子排布的特点,Cu在元素周期表中位于s区
3.298K、101kPa下,一组物质的摩尔燃烧焓如下表:
物质 H2(g) CH4(g) CH3OH(1)
摩尔燃烧烙(△H)/(KJ·mol-1) -285.8 -890.3 -726.5
下列说法正确的是
A.1mol H2(g)和0.5molO2(g)的内能之和比1molH2O(g)的内能多285.8kJ
B.16.0gCH4(g)在足量O2(g)中燃烧生成CO(g)和液态水,放出890.3kJ热量
C.1mol CH3OH()完全燃烧的热化学方程式为
D.单位质量的三种物质完全燃烧,CH3OH(1)放出的能量最多
4.X、Y、Z、Q、E、M六种元素中,X的原子的基态价电子排布式为2s2,Y的基态原子核外有5种运动状态不同的电子,Z元素的两种同位素原子通常作为示踪原子研究生物化学反应和测定文物的年代,Q是元素周期表中电负性最大的元素,E的阳离子通常存在于硝石、明矾和草木灰中,M的原子序数比E大1。下列说法正确的是
A.EYQ4中阴离子中心原子的杂化方式为sp3杂化
B.X、Y元素的第一电离能大小关系:X
D.MZ2含离子键和非极性共价键,阴阳离子之比为1:2
5.下列关于NH、NH3、NH三种微粒的说法不正确的是()
A.三种微粒所含有的电子数相等
B.三种微粒中氮原子的杂化方式相同
C.三种微粒的空间构型相同
D.键角大小关系:NH>NH3>NH
6.某课题组用单原子Fe铺定在氮掺杂的碳纳米片上的催化剂(A-Fe-NC)构建二次锌-空气电池,其放电原理如图所示:下列叙述错误的是
A.放电时,空气扩散层有利于O2得电子
B.当锌箔消耗6.5g时,有0.2molOH-通过阴离子交换膜移向锌箔
C.充电时,阴极的电极反应式为
D.放电时,锌箔电极电势低,充电时,锌箔电极电势高
7.用价层电子对互斥模型可以判断许多分子或离子的空间结构,有时也能用来推测键角大小,下列判断正确的是
A.SO32-中心原子的价层电子对数为3,是平面三角形结构
B.BF3键角为120°,SnBr2的键角大于120°
C.CH2O是平面三角形的分子
D.PC13、PCl5都是三角锥形的分子
8.下列有关杂化轨道理论的说法中正确的是
A.NCl3分子呈三角锥形,这是氮原子采取sp2杂化的结果
B.sp3杂化轨道是由能量相近的1个s轨道和3个p轨道混合形成的4个sp3杂化轨道
C.中心原子采取sp3杂化的分子,其空间结构一定是四面体形
D.AB3型的分子空间结构必为平面三角形
9.短周期主族元素A、B可形成AB3分子,下列有关叙述正确的是
A.若A、B为同一周期元素,则AB3分子一定为平面正三角形
B.若AB3分子中的价电子个数为24个,则AB3分子可能为平面正三角形
C.若为A、B为同一主族元素,则AB3分子一定为三角锥形
D.若AB3分子为三角形锥形,则AB3分子一定为NH3
10.298K时,BaSO4与BaCO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是
己知101.4=25
A.298K时,BaSO4的溶解度小于BaCO3的溶解度
B.作为分散质BaSO4,W点v(沉淀)
D.对于沉淀溶解平衡 ,其平衡常数K=0.04
11.As2O3(砒霜)是两性氧化物(分子结构如图所示),溶于盐酸生成AsCl3,AsC13用LiAlH4还原生成AsH3。下列说法正确的是()
A.As2O3分子中As原子的杂化方式为sp2杂化
B.LiAlH4为共价化合物
C.AsCl3的空间结构为平面正三角形
D.AsH3分子的键角小于109°28′
12.前四周期主族元素X、Y、Z、W的原子序数依次增大,它们形成的一种物质的结构如图所示,其中所有原子都形成了8电子稳定结构,四种元素中仅X、Y在同周期。下列推断中错误的是
A.简单离子半径:W>Z>Y B.XZ2分子的空间构型为直线形
C.最简单氢化物的稳定性:Y>X D.Y与氧元素形成的化合物不止3种
13.一种织物防火剂的结构如下。X、Y、Z、W为原子序数依次增大的四种短周期主族元素,基态Z原子的核外电子总数是其最高能级电子数目的2倍。下列说法错误的是
A.X和Z可形成含有非极性键的分子
B.最高价氧化物对应水化物的酸性:Y>W
C.Z、Y、W的简单氢化物的沸点依次减小
D.该物质中,Y、Z和W均满足最外层8电子稳定结构
14.X、Y为第三周期元素,Y最高正价与最低负价的代数和为6,二者形成的一种化合物在固态时以【XY4】+【XY6】-的形式存在。下列说法正确的是
A.该化合物中含有离子键和共价键,为共价化合物
B.简单氢化物的稳定性:X>Y
C.同周期元素氧化物对应的水化物中,Y元素氧化物对应水化物的酸性最强
D.阴离子【XY6】-和阳离子【XY4】+中,X原子杂化方式和离子空间构型均不相同
15.高电压水系锌-有机混合液流电池的装置及充、放电原理如图所示。下列说法正确的是
A.锌元素位于元素周期表的d区
B.充电时,每转移2mole-,阴极增重65g
C.放电时,负极的电极反应式为
D.放电时,化学能全部转化为电能
第II卷(非选择题共55分)
二、填空题
16.(12分)
(1)近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe-Sm-As-F-O组成的化合物。回答下列问题:
①基态Fe原子中,核外存在____________个运动状态不同的电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为__________________。
②基态F原子的价电子轨道表达式为_________________。
(2)基态Zn原子核外占据最高能层电子的电子云轮廓图形状为_________________。
(3)Cu2+基态原子核外电子排布式为_________________。
(4)下列状态的镁中,电离最外层一个电子所需能量最大的是_________________(填标号)。
A.[Ne] B.[Ne] C.[Ne] D.[Ne]
17.(12分)丁二酮肟()可与Ni2+反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定Ni2+的存在。请回答下列问题:
(1)Ni在元素周期表中的位置为_________________。
(2)基态氧原子的核外电子的空间运动状态有________________种。
(3)丁二酮肟()中涉及元素的电负性由大到小的顺序为_________________;与氮同周期的硼在成键时,能将一个2s电子激发进入2p能级参与形成化学键,请写出该激发态原子的价电子轨道表示式:________________,该过程形成的原子光谱为________________(填“吸收”或“发射”)光谱。
(4)与Ni同周期的铜、锌两种元素位于元素周期表的________________区,两元素的第一电离能(I1)、第二电离能(I2)数据如表所示:
电离能(KJ·mol-1) I1 I2
铜 746 1958
锌 906 1733
铜的I1小于锌,I2却大于锌的主要原因是_________________。
18.(16分)(I)己知常温下部分弱电解质的电离平衡常数如表:
化学式 HF HClO H2CO3 NH3·H2O
电离常数 6.8×10-4 4.7×10-8 K1=4.3×10-7 K2=5.6×10-11 Kb=1.7×10-5
(I)常温下,物质的量浓度相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是_________________。(填序号)
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为_________________,水电离出的氢离子的浓度为_________________。
(3)NaClO溶液中的质子守恒关系为_________________。
(4)向足量的次氯酸钠中通入少量的二氧化碳的离子方程式_________________。
(5)25℃下,将pH=12的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=_________________。
(II)在25℃时对氨水进行如下操作。请填写下列空白。
(6)若向氨水中加入少量硫酸铵固体,则溶液中 将______________(填“增大“减小”或“不变”)。
(7)若向氨水中加入稀硫酸,使氨水恰好被中和,写出反应的离子方程式:_______________;所得溶液的pH______________7(填“>”“<”或“=”)。
19.(15分)实现碳中和成为各国科学家的研究重点,将二氧化碳转化为绿色液体燃料甲醇是一个重要方向。甲醇的制备原理为:
(1)工业上利用低浓度氨水作为捕获剂,吸收烟气中CO2生成NH4HCO3以获得原料气体,其离子方程式为_______________。
(2)甲醇的制备反应一般认为通过如下两步来实现:
①
②
根据盖斯定律,该反应的△H_______________kJ·mol-1,反应能在______________(填“高温”或“低温”)自发进行。
(3)为探究该反应原理,进行如下实验:在一恒温,体积为1L恒容密闭容器中,充入1molCO2和3molH2,进行该反应(不考虑其它副反应)。10min时测得CO2和CH3OH(g)的体积分数之比变为1:3且比值不再随时间变化。回答下列问题:
①反应开始到平衡,v(H2)=_______________。
②该温度下的平衡常数K=_______________(mol/L)-2(保留两位有效数值)。
③若上述反应过程中不断升高反应温度,下列图像正确的是_______________。
A. B.
C. D.
(4)研究发现,CO2加氢还可制备甲酸(HCOOH),反应为CO2(g)+H2(g)f HCOOH(g)△H<0。在
一容积固定的密闭容器中进行反应,实验测得:v正=k正c(CO2)c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。温度为T1℃时,该反应K=2,温度为T2℃时,k正=1.9k逆,则T2℃时平衡压强(填“><”或“=”)T1℃时平衡压强,理由__________________。
安庆市迎江区2022-2023学年高二下学期期中考试
化学试题参考答案
1.B 2.B 3.C 4.A 5.C 6.D 7.C 8.B 9.B 10.C 11.D 12.A 13.D 14.D 15.B
16.(每空2分共12分)(1)26 4f5 (2)球形
(3)1s22s22p63s23p63d9或者【Ar】3d9 (4)A
17.(12分)(1)第四周期第VIII族(2分)(2)5(2分)
(3)O>N>C>H(2分)(2分)吸收(1分
(4)ds(1分)铜的价层电子排布式为3d104s1,锌的价层电子排布式为3d104s2,铜失去一个电子可以达到稳定的3d全满结构,因此铜的I1小于锌的I1,也由于3d全满结构稳定,Cu+再失去一个电子较困难,因此铜的I2大于锌的I2(2分)
18.(16分)(1)③>②>①(2分)
(2) (2分)10-4mol/L(2分)
(3) (2分)(4) (2分)(5)9:2(2分)
(6)减小(1分)(7) (2分) <(1分)
19.(15分)(1) (2分)
(2)-49(2分) 低温(1分)
(3)0.225 mol(L·min)(2分)5.3(2分)AC(2分)
(4)>(2分)
该反应为放热反应,温度升高,平衡常数减小,T1小于T2说明平衡左移,气体的分子数增大,压强增大(2分)
同课章节目录
