第二章 海水中的重要元素——钠和氯 测试题(含解析) 2022-2023学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第二章 海水中的重要元素——钠和氯 测试题(含解析) 2022-2023学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 620.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-25 15:53:20 | ||
图片预览



文档简介
第二章《海水中的重要元素——钠和氯》测试题
一、单选题(共12题)
1.已知ag气体XY3含有b个原子,设阿伏加德罗常数的值为NA,气体摩尔体积为c L·mol-1,则该条件下11.2L该气体的质量为
A. B. C. D.
2.下列说法中正确的是
A.金属钛密度小、硬度大、熔点高且抗腐蚀性能强,可用于飞机、火箭等航天领域
B.因为Na2CO3能与盐酸反应,所以可用于治疗胃酸过多
C.FeCl3溶液能与Cu反应,说明Fe的还原性强于Cu
D.玻璃、光导纤维和陶瓷都是传统硅酸盐材料
3.下列反应的离子方程式正确的是
A.铜投入足量稀硝酸:
B.用醋酸洗涤水垢:
C.工业制漂白粉:
D.溶液中加入足量溶液:
4.有一位学生将一小块钠投入到盛有煤油和水的试管中(煤油和水均足够多),可能观察到的现象是
A.钠浮在试管中的液面上
B.钠沉入试管底部
C.钠燃烧起来
D.钠处于煤油和水的交界处,上下浮动
5.NA为阿伏加德罗常数,下列叙述正确的是
A.常温常压下,11.2LCO和CO2混合气体中含有的碳原子数目为0.5NA
B.92gNO2和N2O4的混合气体中含有的原子总数为6NA
C.将FeCl3的饱和溶液(含FeCl30.1mol)加入沸水中充分作用制成胶体,其中含有胶体粒子的数目为0.1NA
D.100g17%的氨水中含有的NH3分子数为NA
6.工业上制备下列物质的生产流程合理的是
A.由铝土矿冶炼铝:铝土矿 Al2O3 AlCl3 Al
B.由NaCl 制漂白粉:饱和食盐水Cl2漂白粉
C.侯德榜制碱:饱和 NaCl 溶液 NaHCO3Na2CO3
D.从海水中提取镁:海水 Mg(OH)2 MgO Mg
7.下列叙述正确的是
A.1mol水中含有2mol氢和1mol氧 B.0.012kg12C中含有约6.02×1023个碳原子
C.CH4的摩尔质量为16g D.1molNe含有约6.02×1023个电子
8.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.18 g D2O和18 g H2O中含有的质子数均为10NA
B.1 L 0.1 mol/L NH4Cl溶液中,NH的数目小于0.1NA
C.标准状况下,2.24 L CCl4含有的共价键数为0.4NA
D.1 mol N2与3 mol H2反应生成的NH3分子数为2NA
9.市场上销售的“84”消毒液,其商品标识上注明;①本品为无色液体呈碱性;②使用时应加水稀释;③可对餐具、衣物进行消毒,可漂白浅色衣物。其有效成分可能是
A.Cl2 B.H2SO4 C.NaClO D.KMnO4
10.物质a、b、c、d均为中学化学中的常见单质或化合物,它们之间的转化关系如右图所示(部分产物已略去),下列各组物质中,通过一步反应就能实现图示转化的是
选项 a b c d
A SO2 SO3 S H2SO4
B Na2O Na2O2 Na NaOH
C CO CO2 C H2CO3
D Al2O3 NaAlO2 Al Al(OH)3
A.A B.B C.C D.D
11.设NA表示阿伏加德罗常数的值。下列叙述正确的是
A.92gN2O4含有的氮原子数目为NA
B.1molAl变为Al3+时,失去的电子数目为3NA
C.标准状况下,22.4L苯含有的分子数目为NA
D.pH=1的盐酸溶液中含有H+的数目为0.1NA
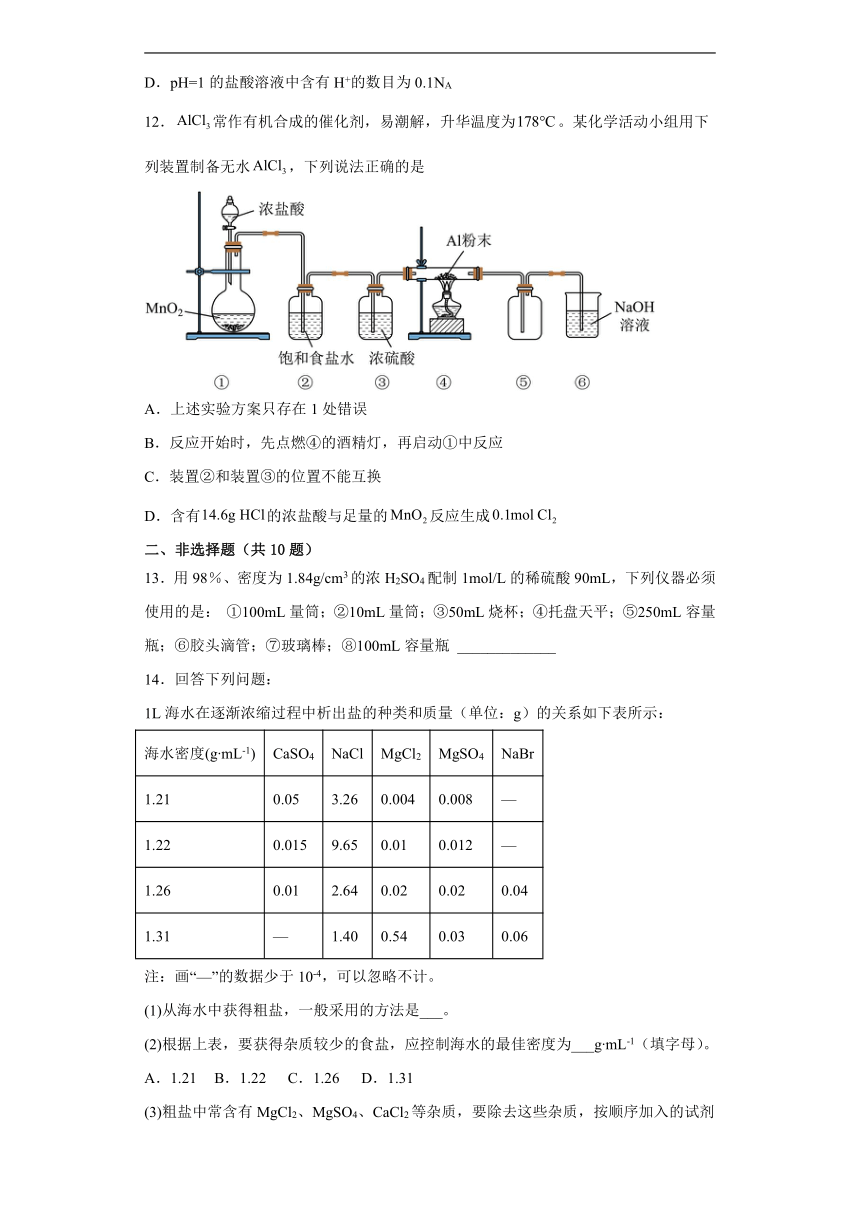
12.常作有机合成的催化剂,易潮解,升华温度为。某化学活动小组用下列装置制备无水,下列说法正确的是
A.上述实验方案只存在1处错误
B.反应开始时,先点燃④的酒精灯,再启动①中反应
C.装置②和装置③的位置不能互换
D.含有的浓盐酸与足量的反应生成
二、非选择题(共10题)
13.用98%、密度为1.84g/cm3的浓H2SO4配制1mol/L的稀硫酸90mL,下列仪器必须使用的是: ①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤250mL容量瓶;⑥胶头滴管;⑦玻璃棒;⑧100mL容量瓶 _____________
14.回答下列问题:
1L海水在逐渐浓缩过程中析出盐的种类和质量(单位:g)的关系如下表所示:
海水密度(g mL-1) CaSO4 NaCl MgCl2 MgSO4 NaBr
1.21 0.05 3.26 0.004 0.008 —
1.22 0.015 9.65 0.01 0.012 —
1.26 0.01 2.64 0.02 0.02 0.04
1.31 — 1.40 0.54 0.03 0.06
注:画“—”的数据少于10-4,可以忽略不计。
(1)从海水中获得粗盐,一般采用的方法是___。
(2)根据上表,要获得杂质较少的食盐,应控制海水的最佳密度为___g mL-1(填字母)。
A.1.21 B.1.22 C.1.26 D.1.31
(3)粗盐中常含有MgCl2、MgSO4、CaCl2等杂质,要除去这些杂质,按顺序加入的试剂依次为NaOH、BaCl2、___、___等(填化学式)。
(4)工业上电解熔融氯化钠制取金属钠的化学方程式为___。
(5)钠元素的一种常见氧化物可作为呼吸面具的供氧剂,写出该氧化物和CO2反应的化学方程式___。
15.某学习小组探究潮湿的与反应的产物,进行如下实验:
请回答:
(1)仪器X的名称是___________。试剂Y是___________。
(2)装置E的作用是___________。
(3)请写出装置A中的离子方程式___________。
(4)若将上述装置中的C、D、E部分换成下图所述装置,其中Ⅰ与Ⅲ是干燥的有色布条,E中盛装NaOH溶液,请回答下列问题:
①装置C的作用是验证氯气是否具有漂白性,则装置C中应装入的物质是___________。
a、浓硫酸 b、生石灰 c、固体 d、NaOH固体
②描述Ⅰ、Ⅲ处的现象___________,从物质性质角度说明Ⅰ、Ⅲ处现象不同的原因___________。
16.I.某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液。实验操作过程为:废铁屑A溶液氯化铁溶液;根据要求回答问题:
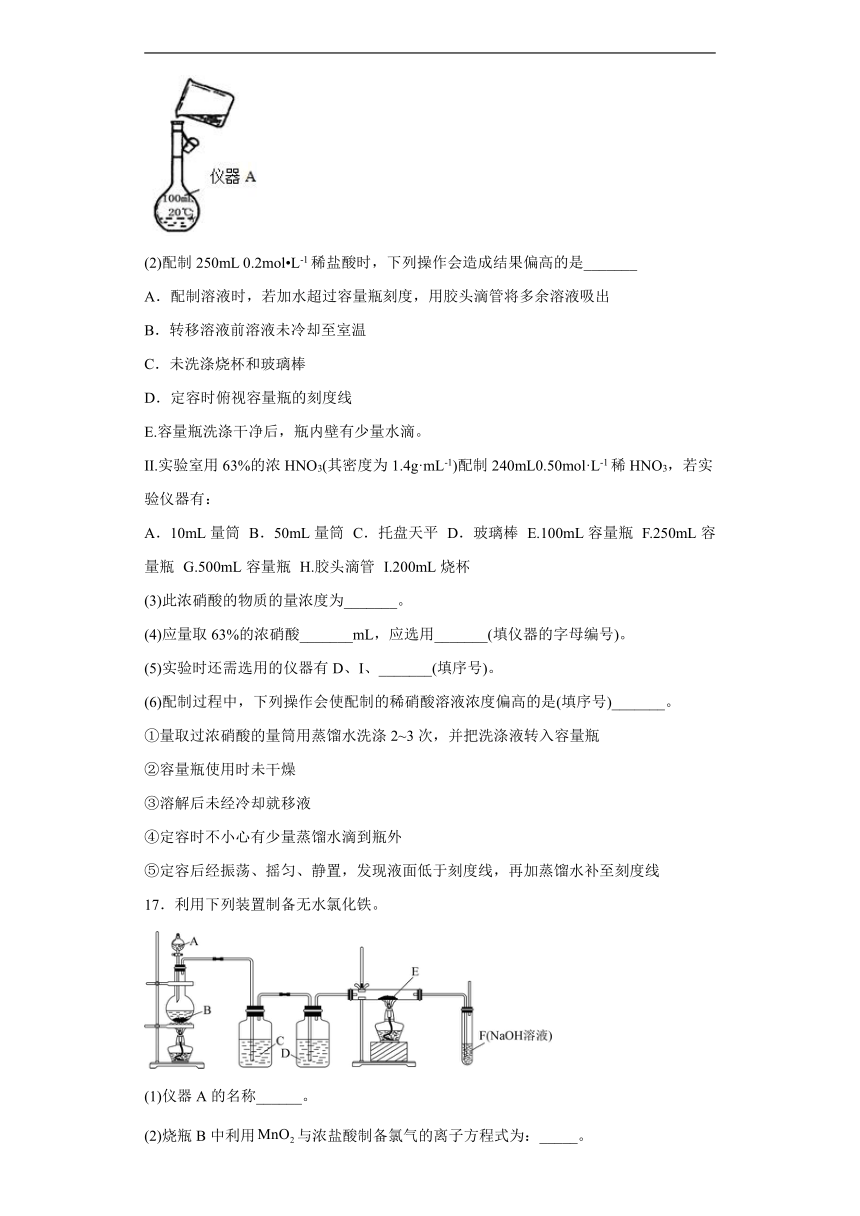
(1)用浓盐酸配制250mL 0.2mol L-1稀盐酸,图中有两处错误分别是_______,_______。
(2)配制250mL 0.2mol L-1稀盐酸时,下列操作会造成结果偏高的是_______
A.配制溶液时,若加水超过容量瓶刻度,用胶头滴管将多余溶液吸出
B.转移溶液前溶液未冷却至室温
C.未洗涤烧杯和玻璃棒
D.定容时俯视容量瓶的刻度线
E.容量瓶洗涤干净后,瓶内壁有少量水滴。
II.实验室用63%的浓HNO3(其密度为1.4g·mL-1)配制240mL0.50mol·L-1稀HNO3,若实验仪器有:
A.10mL量筒 B.50mL量筒 C.托盘天平 D.玻璃棒 E.100mL容量瓶 F.250mL容量瓶 G.500mL容量瓶 H.胶头滴管 I.200mL烧杯
(3)此浓硝酸的物质的量浓度为_______。
(4)应量取63%的浓硝酸_______mL,应选用_______(填仪器的字母编号)。
(5)实验时还需选用的仪器有D、I、_______(填序号)。
(6)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)_______。
①量取过浓硝酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
17.利用下列装置制备无水氯化铁。
(1)仪器A的名称______。
(2)烧瓶B中利用与浓盐酸制备氯气的离子方程式为:_____。
(3)将8.7g与含HCl14.6g的浓盐酸共热制,甲同学认为可制得7.1g,乙同学认为制得的质量小于7.1g,你认为_____(填“甲”或“乙”)同学正确,原因是_______。
(4)装置C盛有饱和食盐水的作用为_______。
(5)取E中制取的配成溶液,往里加入少量铁屑,反应的离子方程式为:_____。
(6)装置F的作用是_____。
(7)制备无水氯化铁,该实验装置是否存在缺陷_____(填“是”或“否”),若存在缺陷应怎样改进:____。
18.某氮肥中混有少量,现采用下列方案测定该氮肥中的质量分数:称取5.7g上述样品与2.0溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用溶液体积的关系如图所示:
请回答下列问题:
(1)A点前样品与反应的离子方程式为_______。
(2)样品中的质量分数是_______%(保留一位小数)。
19.将10.9g和的固体混合物溶于水得到500mL溶液,所得溶液用100mL稀硫酸恰好完全中和。
回答下列问题:
(1)固体混合物中的质量分数为_________。
(2)固体混合物与水反应生成气体的体积为__________L(标准状况)。
(3)固体混合物与水反应后,所得NaOH溶液的物质的量浓度_________。
(4)若用质量分数为98%,密度为的浓硫酸配制题中所用的稀硫酸,则需量取浓硫酸的体积为__________。
20.室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可按下面框图进行反应。又知D溶液为棕黄色,E溶液为无色,请回答:
(1)A是________,B是________,C是________(填写化学式)。
(2)反应①的化学方程式为___________。
(3)反应③的化学方程式为___________。
(4)反应④的化学方程式为___________。
21.现有金属单质A和及物质 B、C、D,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
(1)加热条件下,实验室制取黄绿色气体 B 的化学方程式为:___________
为制得纯净气体B,还需将气体依次通入___________和___________中以除去B中的___________和___________。
(2)实验室处理尾气B 的离子方程式为:___________。
(3)工业上用B 与石灰乳制备漂白粉,其有效成分为___________(填化学式)。
(4)将黄绿色气体溶于水后,长时间放置,溶液中主要溶质为 ___________(填化学式),请用化学方程式解释___________。
22.A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
(1)若A是一种金属,C是淡黄色固体,则A的化学式为_______,B的化学式为_______,C的化学式为_______,A→C反应的化学方程式为_______。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为_______,B→C反应的化学方程式为_______。A和C是否能反应?_______(填“能”或“不能”),若能,写出反应的化学方程式:_______。(若不能,此空不填)
参考答案:
1.A
a g该气体的物质的量n=,该气体摩尔质量M=,11.2 L该气体的物质的量n`=,对应质量m`=n`M=,故答案选A。
2.A
A.金属钛具有密度小、硬度大、熔点高且抗腐蚀性能强的特性,常用于飞机、火箭等航天领域,故A正确;
B.碳酸钠的碱性较强,不能治疗因胃酸过多,应选氢氧化铝或碳酸氢钠用于治疗胃酸过多,故B错误;
C.FeCl3溶液与Cu反应生成氯化铜和氯化亚铁,但只能说明,三价铁的氧化性大于铜离子,不能说明Fe的还原性强于Cu,故C错误;
D.光导纤维主要成分是二氧化硅,是氧化物,不是硅酸盐,故D错误;
故选:A。
3.A
A.Cu与稀硝酸反应生成硝酸铜、水和NO,反应的离子方程式为:,故A正确;
B.醋酸是弱酸,应保留化学式,反应的离子方程式为:,故B错误;
C.工业上将氯气通入石灰乳中制备漂白粉,石灰乳中氢氧化钙主要以固体形式存在,应保留化学式,反应的离子方程式为,故错误;
D.溶液中加入足量溶液,完全反应,即铁离子与硫酸根离子按2:3反应,反应的离子方程式为,故D错误;
答案选A。
4.D
煤油的密度比水小,二者互不相溶,所以煤油在上层,水在下层,又因钠的密度比水小,比煤油大,因此投入的金属钠介于两者之间,而钠能与水反应产生氢气,2Na+2H2O=2NaOH+H2↑,Na与水反应生成气体后被气体带离水层,进入煤油层后停止反应又下沉,如此往复,直至钠反应完,反应没有氧气,钠不能燃烧,所以钠处于煤油和水的交界处,上下浮动,故合理选项是D。
5.B
A.不是在标准状况下,混合气体中含有的碳原子数目不是0.5NA,故A错误;
B.N2O4分子可以看成由两个NO2构成,故92g混合物中含有的NO2的物质的量,则含有的原子为6NA个,故B正确;
C.将FeCl3的饱和溶液(含FeCl30.1mol)加入沸水中充分作用制成胶体,胶体分散质是氢氧化铁的集合体,其中含有胶体粒子的数目小于0.1NA,故C错误;
D.氨气溶于水后部分和水反应生成一水合氨,故溶液中含有的NH3的物质的量小于1mol,故D错误;
故选:B。
6.C
A.铝土矿主要成分是三氧化二铝,应提纯后再电解,电解氧化铝制备Al,反应为2Al2O3(熔融)4Al+3O2↑,不能电解氯化铝,故A不合理;
B.由NaCl可以制漂白液,而漂白粉主要成分为氯化钙、次氯酸钙,是氯气和石灰乳反应生成氯化钙、次氯酸钙和水,2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,故B不合理;
C.侯德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱,此过程可以表示为:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,2NaHCO3Na2CO3+CO2↑+H2O,故C正确;
D.从海水中提取镁,是先由贝壳煅烧生成的生石灰与水反应获得石灰乳,将石灰乳加入海水中沉淀镁离子生成氢氧化镁沉淀,过滤得到沉淀氢氧化镁,加入盐酸溶解氢氧化镁变为氯化镁,将氯化镁溶液蒸发浓缩、冷却结晶得到氯化镁晶体,在氯化氢气流中加热氯化镁晶体失水得到无水氯化镁,熔融氯化镁通电分解获得Mg;氧化镁熔点高,电解氧化镁会消耗更多能量,故D不合理;
故答案选C。
7.B
A.1 mol H2O中含有2 molH(氢原子)和1 molO (氧原子),要指明是什么粒子,选项A错误;
B.0.012kg12C中所含的碳原子数为阿伏加德罗常数,约6.02×1023个碳原子,选项B正确;
C.CH4的摩尔质量为16g/mol,选项C错误;
D.Ne是10电子粒子,1molNe含有约6.02×1024个电子,选项D错误;
答案选B。
8.B
A.18 g D2O含有的质子数为9NA,18 g H2O中含有的质子数为10NA,故A错误;
B.NH4Cl溶液中NH水解,1 L 0.1 mol/L NH4Cl溶液中,NH的数目小于0.1NA,故B正确;
C.标准状况下,CCl4是液体,2.24 L CCl4的物质的量不是0.1mol,故C错误;
D.是可逆反应,1 mol N2与3 mol H2反应生成的NH3分子数小于2NA,故D错误;
选B。
9.C
A.Cl2水溶液为氯水,显酸性,与本品为无色液体呈碱性相矛盾,故A错误;
B.H2SO4为酸性溶液,与本品为无色液体呈碱性相矛盾,故B错误;
C.市场上销售的“84”消毒液,主要成分为NaClO,溶液显碱性,且具有漂白性和强氧化性,故C正确;
D. KMnO4溶液具有强氧化性,溶液显紫色,与本品为无色液体呈碱性相矛盾,故D错误;
故答案选C。
10.D
A.S在氧气中燃烧只生成SO2,SO2和O2在催化剂的条件下反应生成SO3,S不能通过一步反应生成SO3,A项错误;
B.NaOH受热不分解,无法生成Na2O,B项错误;
C.H2CO3分解生成CO2和水,无法生成CO,C项错误;
D.Al2O3与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2生成Al(OH)3,Al(OH)3受热分解生成氧化铝和水,Al与强碱反应生成NaAlO2和氢气,Al在空气中燃烧生成Al2O3,都能通过一步反应实现转化,D项正确;
答案选D。
【点睛】本题考查常见物质的转化。对于铝的化合物,总结如下:
(1)Al2O3、Al(OH)3是中学阶段接触的唯一与碱反应的金属氧化物和氢氧化物,经常应用到除杂、计算题中,所以一定要熟记这两个反应的离子方程式。
(2)Al(OH)3具有两性,能溶于强酸(如盐酸)、强碱(如NaOH溶液),但不溶于弱酸(如H2CO3)、弱碱溶液(如氨水)。
(3)由Al(OH)3的两式电离以及与酸和碱反应的离子方程式可知:与酸反应时相当于三元碱,与碱反应时相当于一元酸。
(4)明矾净水只能除去水中的悬浮杂质,不能杀菌消毒,与氯水净水原理不同。
11.B
A.92gN2O4为1mol,含有的氮原子数目为2NA,A错误;
B.Al由0价升到+3价失去3个电子,故1molAl变为Al3+时,失去的电子数目为3NA,B正确;
C.标准状况下苯不是气体,不能计算,C错误;
D.未给出溶液体积,不能计算氢离子数目,D错误;
故选B。
12.C
A.二氧化锰和浓盐酸的反应需要加热;氯化铝易升华,导出氯化铝的导管太细,容易堵塞导管;装置⑥中氢氧化钠溶液中水易挥发,进入装置⑤使产品变质,共3处错误,A错误;
B.先启动①中反应,通入氯气排净装置内的空气,再点燃④的酒精灯,使氯气在与铝发生反应,B错误;
C.实验中产生的氯气中含有氯化氢气体和水蒸气杂质,应该先除去氯化氢后除去水蒸气,故装置②和装置③的位置不能互换,C正确;
D.二氧化锰和浓盐酸随着反应的进行,浓盐酸变成稀盐酸,不再生产氯气,故含有14.6gHCl的浓盐酸与足量的MnO2反应生成的Cl2小于0.1mol,D错误;
故选C。
13.②③⑥⑦⑧
根据C=1000ρω/M和稀释定律C浓V浓=C稀V稀来计算所需浓硫酸的体积,然后根据配制一定物质的量浓度的溶液的步骤是计算、量取、稀释、移液、洗涤、定容、摇匀来选择使用的仪器。
浓硫酸的物质的量浓度C=1000ρω/M=(1000×1.84×98%)/98g.mol-1=18.4mol/L,由于无90mL容量瓶,故应选用100mL容量瓶,配制出100mL的溶液。设需要浓硫酸的体积为VmL,根据稀释定律C浓V浓=C稀V稀: 可知:18.4mol/L×VmL=1mol/L×100mL,解得V=5.4mL,
用10mL量筒量取5.4mL浓硫酸,后放入烧杯中稀释,同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃棒引流移液至100ml容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1至2cm时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶。用到的仪器有:10mL量筒、烧杯、玻璃棒、100ml容量瓶、胶头滴管;所以答案:②③⑥⑦⑧。
14. 蒸发或日晒 B Na2CO3 HCl 2NaCl(熔融)2Na+Cl2↑ 2Na2O2+2CO2=2Na2CO3+O2
(1)在海水逐渐浓缩过程中,海水中的某些盐的浓度会发生一定的改变,表中数值为析出盐的质量,所以要获取某种盐,应选择其析出量多的点。
(2)除去粗盐中的杂质,某些试剂的加入存在一定的顺序,也就是先加入的试剂,过量部分需要后加入试剂去除。对粗盐提纯来说,与此相关的试剂为Na2CO3和HCl,所以Na2CO3必须在加入BaCl2之后加入,HCl必须在过滤之后加入。
(1)从海水中获得粗盐,常需增大浓度,让盐水变得饱和,所以一般采用的方法是蒸发或日晒。答案为:蒸发或日晒;
(2)根据表中信息,要获得杂质较少的食盐,应控制海水的最佳密度为1.22g mL-1,这时析出食盐最多,杂质最少,因此选B。答案为:B;
(3)粗盐中常含有MgCl2、MgSO4、CaCl2等杂质,加NaOH用来除去Mg2+,加入BaCl2除去SO42-,应加入Na2CO3除去过量的Ba2+和原有的Ca2+,最后加入盐酸除去过量的CO32-,要除去这些杂质,按顺序加入的试剂依次为NaOH、BaCl2、Na2CO3、HCl。答案为:Na2CO3;HCl;
(4)工业上电解熔融氯化钠制取金属钠,化学方程式为2NaCl(熔融)2Na+Cl2↑。答案为:2NaCl(熔融)2Na+Cl2↑;
(5)过氧化钠可作为呼吸面具的供氧剂,它和CO2反应的化学方程式2Na2O2 + 2CO2 == 2Na2CO3 + O2。答案为:2Na2O2 + 2CO2 == 2Na2CO3 + O2。
【点睛】Na2O2 与CO2或H2O反应,都是Na2O2 自身发生的氧化还原反应,配平时具有一定的难度,也就成为书写方程式时的易错点。
15.(1) 圆底烧瓶 饱和食盐水
(2)吸收多余的氯气,防止污染环境
(3)
(4) c Ⅰ处有色布条褪色,Ⅲ处有色布条不褪色 干燥的氯气没有漂白性,潮湿的氯气中发生反应,HClO具有强氧化性,具有漂白性
A装置中用二氧化锰与浓盐酸制取氯气,由于浓盐酸具有挥发性,氯气中混有HCl和水蒸气,为探究潮湿的与反应的产物,装置B中为饱和食盐水,除去HCl,装置D为集气瓶,收集反应可能生成的二氧化碳,装置E用于吸收氯气,防止污染环境。
(1)仪器X的名称是圆底烧瓶。由分析知,试剂Y是饱和食盐水。
(2)装置E的作用是吸收多余的氯气,防止污染环境。
(3)A装置中用二氧化锰与浓盐酸制取氯气,离子方程式为。
(4)①装置A制取氯气,装置B除去HCl,进入装置C的氯气为潮湿的氯气,装置C的作用是验证氯气是否具有漂白性,装置C中装入的物质应该能干燥氯气,并且应该是固体干燥剂,潮湿的氯气与生石灰、NaOH固体均反应,则装置C中应装入的物质是固体,故选c。
②干燥的氯气没有漂白性,潮湿的氯气中发生反应,HClO具有强氧化性,具有漂白性,故Ⅰ、Ⅲ处的现象Ⅰ处有色布条褪色,Ⅲ处有色布条不褪色。
16.(1) 转移溶液时未用玻璃棒引流 应选用250 mL容量瓶
(2)BD
(3)14.0mol/L
(4) 8.9 A
(5)FH
(6)①③
(1)
用浓盐酸配制250mL 0.2mol L-1稀盐酸,配制250mL溶液应该选用250mL的容量瓶,转移溶液应该用玻璃棒引流;
(2)
A.配制溶液时,若加水超过容量瓶刻度,用胶头滴管将多余溶液吸出,溶质物质的量偏少,所配溶液浓度偏低,故不选A;
B.转移溶液前溶液未冷却至室温,溶液体积偏小,所配溶液浓度偏高,故选B;
C.未洗涤烧杯和玻璃棒,溶质物质的量偏少,所配溶液浓度偏低,故不选C;
D.定容时俯视容量瓶的刻度线,溶液体积偏小,所配溶液浓度偏高,故选D;
E.容量瓶洗涤干净后,瓶内壁有少量水滴,所配溶液的浓度不变,故不选E;
选BD;
(3)
此浓硝酸的物质的量浓度mol/L;
(4)
配制240mL 0.50mol·L-1的稀硝酸需选取250mL的容量瓶,设需量取浓硝酸的体积为V,根据硝酸的物质的量相等,14 mol·L-1×V=250mL×0.50mol·L-1,V=8.9mL,应选用10mL的量筒量取,选A;
(5)
根据配制溶液的步骤:计算、量取、稀释并冷却、移液、洗涤、定容、摇匀,实验时需选用的仪器有量筒、玻璃棒 、250mL容量瓶、胶头滴管、200mL烧杯,还需选F、H;
(6)
①量取过浓硝酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶,溶质偏多,配制的稀硝酸浓度偏高,故选①;
②容量瓶使用时未干燥,无影响,故不选②;
③溶解后未经冷却就移液,溶液体积偏小,配制的稀硝酸浓度偏高,故选③;
④定容时不小心有少量蒸馏水滴到瓶外,无影响,故不选④;
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,溶液体积偏大,配制的稀硝酸浓度偏低,故不选⑤;
选①③。
17.(1)分液漏斗
(2)
(3) 乙 随着反应进行,浓盐酸浓度会降低,稀盐酸将不再反应
(4)除去挥发的HCl
(5)
(6)吸收尾气中的
(7) 是 在E和F之间增加一个干燥装置
本题是制备无水氯化铁的实验,首先在烧瓶B中利用与浓盐酸制备氯气,生成的氯气中含有氯化氢气体和水蒸气,应该首先除去氯化氢气体,然后干燥氯气,则装置C盛有饱和食盐水,除去挥发的HCl,装置D盛有浓硫酸,干燥氯气,装置E中Fe和Cl2在加热条件下反应得到氯化铁,最后装置F吸收多余Cl2,防止污染空气。
(1)由装置图知,仪器A的名称为分液漏斗,故答案为:分液漏斗。
(2)与浓盐酸在加热条件下反应生成氯化锰、氯气和水,反应的离子方程式为:,故答案为:。
(3)8.7g的物质的量=, 14.6g HCl的物质的量=,根据可知,只有0.1molMnO2和0.4molHCl恰好完全反应才能产生0.1molCl2(即7.1gCl2)。但是,反应过程中随着HCl逐渐消耗以及反应生成水,使得浓盐酸逐渐变稀,而稀盐酸不能跟MnO2反应,因此0.1molMnO2和0.4molHCl不能完全反应,所以产生的Cl2小于0.1mol(即产生的的质量小于7.1g),乙同学正确,故答案为:乙;随着反应进行,浓盐酸浓度会降低,稀盐酸将不再反应。
(4)生成的氯气中含有氯化氢气体和水蒸气,应该首先除去氯化氢气体,然后干燥氯气,则装置C盛有饱和食盐水的作用为除去挥发的HCl,故答案为:除去挥发的HCl。
(5)Fe3+具有强氧化性,与Fe发生氧化还原反应生成Fe2+,反应的离子方程式为:,故答案为:。
(6)氯气有毒,需要进行尾气处理,则装置F的作用是吸收尾气中的,防止污染空气,故答案为:吸收尾气中的。
(7)由于F装置中的水蒸气可进入E装置中,影响无水氯化铁的制备,因此该实验装置存在缺陷,改进的方法是:在装置E和装置F之间增加一个干燥装置,故答案为:是;在E和F之间增加一个干燥装置。
18.(1)
(2)16.8
溶液中碳酸氢根先与氢氧根离子反应生成碳酸根与水,然后铵根离子再与氢氧根离子在加热条件下反应生成氨气与水;
(1)
溶液中碳酸氢根先与氢氧根离子反应生成碳酸根与水,然后铵根离子再与氢氧根离子在加热条件下反应生成氨气与水,故A点前样品与NaOH反应的离子方程式为,故答案为:;
(2)
加入70mL NaOH溶液时,溶液中溶质为Na2CO3,根据钠离子守恒n(Na2CO3)=n(NaOH)=×0.07L×2mol/L=0.07mol,设NH4HCO3、(NH4)2CO3的物质的量分别为xmol、ymol,根据二者质量之和与碳元素守恒,则:79x+96y=5.7、x+y=0.07,解得x=0.06 y=0.01,样品中(NH4)2CO3的质量分数是=16.8%,故答案为:16.8%。
19. 71.56% 1.12 0.6 8.2mL
设固体混合物中的物质的量为xmol,的物质的量为ymol,
由固体混合物的质量为10.9g,可得①;
由,
则固体混合物与水反应生成的,
由钠原子守恒,可得②;
联立①②两式可解得,,据此分析解答。
(1),则固体混合物中的质量分数为;
(2)由反应,可得,
标准状况下,;
(3)由,溶液体积为500mL,可得; (4)由公式,可得浓硫酸的物质的量浓度,结合稀释定律,可得,需要量取8.2mL。
20. Fe Cl2 H2 2Fe+3Cl22FeCl3 Fe+2HCl===FeCl2+H2↑ 2FeCl2+Cl2===2FeCl3
从反应的框图看出,反应①A+B―→D(固体),反应④F+B―→D(溶液),可知:F是化合物,A是变价金属,且A在F中呈低价。又从物理性质可以判断B为Cl2。推出A是Fe,D为FeCl3,F为FeCl2。从反应③A+E―→F+C可知,E为HCl,C为H2,结合物质的相关性质解答该题。
(1)由以上分析可知,A为Fe,B为Cl2,C为H2,故答案为:Fe,Cl2,H2;
(2)反应①为Fe和Cl2的反应,反应的化学方程式为:;故答案为:;
(3)反应③为Fe和HCl的反应,反应的离子方程式为Fe+2HCl=FeCl2+H2↑,故答案为:Fe+2HCl=FeCl2+H2↑;
(4)反应④为FeCl2和Cl2的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-。
21. MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 饱和食盐水 浓硫酸 HCl H2O Cl2+2OH- =Cl-+ClO-+H2O Ca(ClO)2 HCl 2HClO2HCl+O2↑
电解熔融氯化钠得到钠和氯气,故金属A为Na,黄绿色气体B为Cl2,金属钠在空气中加热得到过氧化钠,则C为过氧化钠,氯气和石灰乳反应得到漂白粉,氯气和氢氧化钠溶液反应得到漂白液,则D为氢氧化钠,过氧化钠可和水反应生成氢氧化钠和氧气,据此回答;
(1)加热条件下,实验室用二氧化锰和浓盐酸共热制取氯气,化学方程式为:
浓盐酸易挥发,氯气中含氯化氢,为制得纯净气体B即氯气,还需将气体依次通入饱和食盐水和浓硫酸,以除去氯气中的氯化氢气体和水蒸气。
(2)氯气有毒,实验室用氢氧化钠溶液处理多余氯气,离子方程式为:Cl2+2OH- =Cl-+ClO-+H2O。
(3)工业上用氯气和石灰乳制备漂白粉,生成氯化钙、次氯酸钙和水,其有效成分为Ca(ClO)2。
(4)将黄绿色气体溶于水后,得到氯水,新制氯水中含HCl、HClO,HClO不稳定,见光分解生成盐酸和氧气,故久置的氯水只含盐酸,请用化学方程式解释2HClO2HCl+O2↑。
22.(1) Na Na2O Na2O2 2Na+O2Na2O2
(2) CO2 2CO+O22CO2 能 C+CO22CO
(1)A是一种金属,C是淡黄色固体,则A为Na,B为Na2O,C为Na2O2,A→C反应的化学方程式为2Na+O2Na2O2;
(2)A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则A为碳,B为CO,C为CO2,B→C反应的化学方程式为2CO+O22CO2,碳和二氧化碳在高温条件下发生反应生成一氧化碳,反应的化学方程式为C+CO22CO
一、单选题(共12题)
1.已知ag气体XY3含有b个原子,设阿伏加德罗常数的值为NA,气体摩尔体积为c L·mol-1,则该条件下11.2L该气体的质量为
A. B. C. D.
2.下列说法中正确的是
A.金属钛密度小、硬度大、熔点高且抗腐蚀性能强,可用于飞机、火箭等航天领域
B.因为Na2CO3能与盐酸反应,所以可用于治疗胃酸过多
C.FeCl3溶液能与Cu反应,说明Fe的还原性强于Cu
D.玻璃、光导纤维和陶瓷都是传统硅酸盐材料
3.下列反应的离子方程式正确的是
A.铜投入足量稀硝酸:
B.用醋酸洗涤水垢:
C.工业制漂白粉:
D.溶液中加入足量溶液:
4.有一位学生将一小块钠投入到盛有煤油和水的试管中(煤油和水均足够多),可能观察到的现象是
A.钠浮在试管中的液面上
B.钠沉入试管底部
C.钠燃烧起来
D.钠处于煤油和水的交界处,上下浮动
5.NA为阿伏加德罗常数,下列叙述正确的是
A.常温常压下,11.2LCO和CO2混合气体中含有的碳原子数目为0.5NA
B.92gNO2和N2O4的混合气体中含有的原子总数为6NA
C.将FeCl3的饱和溶液(含FeCl30.1mol)加入沸水中充分作用制成胶体,其中含有胶体粒子的数目为0.1NA
D.100g17%的氨水中含有的NH3分子数为NA
6.工业上制备下列物质的生产流程合理的是
A.由铝土矿冶炼铝:铝土矿 Al2O3 AlCl3 Al
B.由NaCl 制漂白粉:饱和食盐水Cl2漂白粉
C.侯德榜制碱:饱和 NaCl 溶液 NaHCO3Na2CO3
D.从海水中提取镁:海水 Mg(OH)2 MgO Mg
7.下列叙述正确的是
A.1mol水中含有2mol氢和1mol氧 B.0.012kg12C中含有约6.02×1023个碳原子
C.CH4的摩尔质量为16g D.1molNe含有约6.02×1023个电子
8.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.18 g D2O和18 g H2O中含有的质子数均为10NA
B.1 L 0.1 mol/L NH4Cl溶液中,NH的数目小于0.1NA
C.标准状况下,2.24 L CCl4含有的共价键数为0.4NA
D.1 mol N2与3 mol H2反应生成的NH3分子数为2NA
9.市场上销售的“84”消毒液,其商品标识上注明;①本品为无色液体呈碱性;②使用时应加水稀释;③可对餐具、衣物进行消毒,可漂白浅色衣物。其有效成分可能是
A.Cl2 B.H2SO4 C.NaClO D.KMnO4
10.物质a、b、c、d均为中学化学中的常见单质或化合物,它们之间的转化关系如右图所示(部分产物已略去),下列各组物质中,通过一步反应就能实现图示转化的是
选项 a b c d
A SO2 SO3 S H2SO4
B Na2O Na2O2 Na NaOH
C CO CO2 C H2CO3
D Al2O3 NaAlO2 Al Al(OH)3
A.A B.B C.C D.D
11.设NA表示阿伏加德罗常数的值。下列叙述正确的是
A.92gN2O4含有的氮原子数目为NA
B.1molAl变为Al3+时,失去的电子数目为3NA
C.标准状况下,22.4L苯含有的分子数目为NA
D.pH=1的盐酸溶液中含有H+的数目为0.1NA
12.常作有机合成的催化剂,易潮解,升华温度为。某化学活动小组用下列装置制备无水,下列说法正确的是
A.上述实验方案只存在1处错误
B.反应开始时,先点燃④的酒精灯,再启动①中反应
C.装置②和装置③的位置不能互换
D.含有的浓盐酸与足量的反应生成
二、非选择题(共10题)
13.用98%、密度为1.84g/cm3的浓H2SO4配制1mol/L的稀硫酸90mL,下列仪器必须使用的是: ①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤250mL容量瓶;⑥胶头滴管;⑦玻璃棒;⑧100mL容量瓶 _____________
14.回答下列问题:
1L海水在逐渐浓缩过程中析出盐的种类和质量(单位:g)的关系如下表所示:
海水密度(g mL-1) CaSO4 NaCl MgCl2 MgSO4 NaBr
1.21 0.05 3.26 0.004 0.008 —
1.22 0.015 9.65 0.01 0.012 —
1.26 0.01 2.64 0.02 0.02 0.04
1.31 — 1.40 0.54 0.03 0.06
注:画“—”的数据少于10-4,可以忽略不计。
(1)从海水中获得粗盐,一般采用的方法是___。
(2)根据上表,要获得杂质较少的食盐,应控制海水的最佳密度为___g mL-1(填字母)。
A.1.21 B.1.22 C.1.26 D.1.31
(3)粗盐中常含有MgCl2、MgSO4、CaCl2等杂质,要除去这些杂质,按顺序加入的试剂依次为NaOH、BaCl2、___、___等(填化学式)。
(4)工业上电解熔融氯化钠制取金属钠的化学方程式为___。
(5)钠元素的一种常见氧化物可作为呼吸面具的供氧剂,写出该氧化物和CO2反应的化学方程式___。
15.某学习小组探究潮湿的与反应的产物,进行如下实验:
请回答:
(1)仪器X的名称是___________。试剂Y是___________。
(2)装置E的作用是___________。
(3)请写出装置A中的离子方程式___________。
(4)若将上述装置中的C、D、E部分换成下图所述装置,其中Ⅰ与Ⅲ是干燥的有色布条,E中盛装NaOH溶液,请回答下列问题:
①装置C的作用是验证氯气是否具有漂白性,则装置C中应装入的物质是___________。
a、浓硫酸 b、生石灰 c、固体 d、NaOH固体
②描述Ⅰ、Ⅲ处的现象___________,从物质性质角度说明Ⅰ、Ⅲ处现象不同的原因___________。
16.I.某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液。实验操作过程为:废铁屑A溶液氯化铁溶液;根据要求回答问题:
(1)用浓盐酸配制250mL 0.2mol L-1稀盐酸,图中有两处错误分别是_______,_______。
(2)配制250mL 0.2mol L-1稀盐酸时,下列操作会造成结果偏高的是_______
A.配制溶液时,若加水超过容量瓶刻度,用胶头滴管将多余溶液吸出
B.转移溶液前溶液未冷却至室温
C.未洗涤烧杯和玻璃棒
D.定容时俯视容量瓶的刻度线
E.容量瓶洗涤干净后,瓶内壁有少量水滴。
II.实验室用63%的浓HNO3(其密度为1.4g·mL-1)配制240mL0.50mol·L-1稀HNO3,若实验仪器有:
A.10mL量筒 B.50mL量筒 C.托盘天平 D.玻璃棒 E.100mL容量瓶 F.250mL容量瓶 G.500mL容量瓶 H.胶头滴管 I.200mL烧杯
(3)此浓硝酸的物质的量浓度为_______。
(4)应量取63%的浓硝酸_______mL,应选用_______(填仪器的字母编号)。
(5)实验时还需选用的仪器有D、I、_______(填序号)。
(6)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)_______。
①量取过浓硝酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
17.利用下列装置制备无水氯化铁。
(1)仪器A的名称______。
(2)烧瓶B中利用与浓盐酸制备氯气的离子方程式为:_____。
(3)将8.7g与含HCl14.6g的浓盐酸共热制,甲同学认为可制得7.1g,乙同学认为制得的质量小于7.1g,你认为_____(填“甲”或“乙”)同学正确,原因是_______。
(4)装置C盛有饱和食盐水的作用为_______。
(5)取E中制取的配成溶液,往里加入少量铁屑,反应的离子方程式为:_____。
(6)装置F的作用是_____。
(7)制备无水氯化铁,该实验装置是否存在缺陷_____(填“是”或“否”),若存在缺陷应怎样改进:____。
18.某氮肥中混有少量,现采用下列方案测定该氮肥中的质量分数:称取5.7g上述样品与2.0溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用溶液体积的关系如图所示:
请回答下列问题:
(1)A点前样品与反应的离子方程式为_______。
(2)样品中的质量分数是_______%(保留一位小数)。
19.将10.9g和的固体混合物溶于水得到500mL溶液,所得溶液用100mL稀硫酸恰好完全中和。
回答下列问题:
(1)固体混合物中的质量分数为_________。
(2)固体混合物与水反应生成气体的体积为__________L(标准状况)。
(3)固体混合物与水反应后,所得NaOH溶液的物质的量浓度_________。
(4)若用质量分数为98%,密度为的浓硫酸配制题中所用的稀硫酸,则需量取浓硫酸的体积为__________。
20.室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可按下面框图进行反应。又知D溶液为棕黄色,E溶液为无色,请回答:
(1)A是________,B是________,C是________(填写化学式)。
(2)反应①的化学方程式为___________。
(3)反应③的化学方程式为___________。
(4)反应④的化学方程式为___________。
21.现有金属单质A和及物质 B、C、D,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
(1)加热条件下,实验室制取黄绿色气体 B 的化学方程式为:___________
为制得纯净气体B,还需将气体依次通入___________和___________中以除去B中的___________和___________。
(2)实验室处理尾气B 的离子方程式为:___________。
(3)工业上用B 与石灰乳制备漂白粉,其有效成分为___________(填化学式)。
(4)将黄绿色气体溶于水后,长时间放置,溶液中主要溶质为 ___________(填化学式),请用化学方程式解释___________。
22.A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
(1)若A是一种金属,C是淡黄色固体,则A的化学式为_______,B的化学式为_______,C的化学式为_______,A→C反应的化学方程式为_______。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为_______,B→C反应的化学方程式为_______。A和C是否能反应?_______(填“能”或“不能”),若能,写出反应的化学方程式:_______。(若不能,此空不填)
参考答案:
1.A
a g该气体的物质的量n=,该气体摩尔质量M=,11.2 L该气体的物质的量n`=,对应质量m`=n`M=,故答案选A。
2.A
A.金属钛具有密度小、硬度大、熔点高且抗腐蚀性能强的特性,常用于飞机、火箭等航天领域,故A正确;
B.碳酸钠的碱性较强,不能治疗因胃酸过多,应选氢氧化铝或碳酸氢钠用于治疗胃酸过多,故B错误;
C.FeCl3溶液与Cu反应生成氯化铜和氯化亚铁,但只能说明,三价铁的氧化性大于铜离子,不能说明Fe的还原性强于Cu,故C错误;
D.光导纤维主要成分是二氧化硅,是氧化物,不是硅酸盐,故D错误;
故选:A。
3.A
A.Cu与稀硝酸反应生成硝酸铜、水和NO,反应的离子方程式为:,故A正确;
B.醋酸是弱酸,应保留化学式,反应的离子方程式为:,故B错误;
C.工业上将氯气通入石灰乳中制备漂白粉,石灰乳中氢氧化钙主要以固体形式存在,应保留化学式,反应的离子方程式为,故错误;
D.溶液中加入足量溶液,完全反应,即铁离子与硫酸根离子按2:3反应,反应的离子方程式为,故D错误;
答案选A。
4.D
煤油的密度比水小,二者互不相溶,所以煤油在上层,水在下层,又因钠的密度比水小,比煤油大,因此投入的金属钠介于两者之间,而钠能与水反应产生氢气,2Na+2H2O=2NaOH+H2↑,Na与水反应生成气体后被气体带离水层,进入煤油层后停止反应又下沉,如此往复,直至钠反应完,反应没有氧气,钠不能燃烧,所以钠处于煤油和水的交界处,上下浮动,故合理选项是D。
5.B
A.不是在标准状况下,混合气体中含有的碳原子数目不是0.5NA,故A错误;
B.N2O4分子可以看成由两个NO2构成,故92g混合物中含有的NO2的物质的量,则含有的原子为6NA个,故B正确;
C.将FeCl3的饱和溶液(含FeCl30.1mol)加入沸水中充分作用制成胶体,胶体分散质是氢氧化铁的集合体,其中含有胶体粒子的数目小于0.1NA,故C错误;
D.氨气溶于水后部分和水反应生成一水合氨,故溶液中含有的NH3的物质的量小于1mol,故D错误;
故选:B。
6.C
A.铝土矿主要成分是三氧化二铝,应提纯后再电解,电解氧化铝制备Al,反应为2Al2O3(熔融)4Al+3O2↑,不能电解氯化铝,故A不合理;
B.由NaCl可以制漂白液,而漂白粉主要成分为氯化钙、次氯酸钙,是氯气和石灰乳反应生成氯化钙、次氯酸钙和水,2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,故B不合理;
C.侯德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱,此过程可以表示为:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,2NaHCO3Na2CO3+CO2↑+H2O,故C正确;
D.从海水中提取镁,是先由贝壳煅烧生成的生石灰与水反应获得石灰乳,将石灰乳加入海水中沉淀镁离子生成氢氧化镁沉淀,过滤得到沉淀氢氧化镁,加入盐酸溶解氢氧化镁变为氯化镁,将氯化镁溶液蒸发浓缩、冷却结晶得到氯化镁晶体,在氯化氢气流中加热氯化镁晶体失水得到无水氯化镁,熔融氯化镁通电分解获得Mg;氧化镁熔点高,电解氧化镁会消耗更多能量,故D不合理;
故答案选C。
7.B
A.1 mol H2O中含有2 molH(氢原子)和1 molO (氧原子),要指明是什么粒子,选项A错误;
B.0.012kg12C中所含的碳原子数为阿伏加德罗常数,约6.02×1023个碳原子,选项B正确;
C.CH4的摩尔质量为16g/mol,选项C错误;
D.Ne是10电子粒子,1molNe含有约6.02×1024个电子,选项D错误;
答案选B。
8.B
A.18 g D2O含有的质子数为9NA,18 g H2O中含有的质子数为10NA,故A错误;
B.NH4Cl溶液中NH水解,1 L 0.1 mol/L NH4Cl溶液中,NH的数目小于0.1NA,故B正确;
C.标准状况下,CCl4是液体,2.24 L CCl4的物质的量不是0.1mol,故C错误;
D.是可逆反应,1 mol N2与3 mol H2反应生成的NH3分子数小于2NA,故D错误;
选B。
9.C
A.Cl2水溶液为氯水,显酸性,与本品为无色液体呈碱性相矛盾,故A错误;
B.H2SO4为酸性溶液,与本品为无色液体呈碱性相矛盾,故B错误;
C.市场上销售的“84”消毒液,主要成分为NaClO,溶液显碱性,且具有漂白性和强氧化性,故C正确;
D. KMnO4溶液具有强氧化性,溶液显紫色,与本品为无色液体呈碱性相矛盾,故D错误;
故答案选C。
10.D
A.S在氧气中燃烧只生成SO2,SO2和O2在催化剂的条件下反应生成SO3,S不能通过一步反应生成SO3,A项错误;
B.NaOH受热不分解,无法生成Na2O,B项错误;
C.H2CO3分解生成CO2和水,无法生成CO,C项错误;
D.Al2O3与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2生成Al(OH)3,Al(OH)3受热分解生成氧化铝和水,Al与强碱反应生成NaAlO2和氢气,Al在空气中燃烧生成Al2O3,都能通过一步反应实现转化,D项正确;
答案选D。
【点睛】本题考查常见物质的转化。对于铝的化合物,总结如下:
(1)Al2O3、Al(OH)3是中学阶段接触的唯一与碱反应的金属氧化物和氢氧化物,经常应用到除杂、计算题中,所以一定要熟记这两个反应的离子方程式。
(2)Al(OH)3具有两性,能溶于强酸(如盐酸)、强碱(如NaOH溶液),但不溶于弱酸(如H2CO3)、弱碱溶液(如氨水)。
(3)由Al(OH)3的两式电离以及与酸和碱反应的离子方程式可知:与酸反应时相当于三元碱,与碱反应时相当于一元酸。
(4)明矾净水只能除去水中的悬浮杂质,不能杀菌消毒,与氯水净水原理不同。
11.B
A.92gN2O4为1mol,含有的氮原子数目为2NA,A错误;
B.Al由0价升到+3价失去3个电子,故1molAl变为Al3+时,失去的电子数目为3NA,B正确;
C.标准状况下苯不是气体,不能计算,C错误;
D.未给出溶液体积,不能计算氢离子数目,D错误;
故选B。
12.C
A.二氧化锰和浓盐酸的反应需要加热;氯化铝易升华,导出氯化铝的导管太细,容易堵塞导管;装置⑥中氢氧化钠溶液中水易挥发,进入装置⑤使产品变质,共3处错误,A错误;
B.先启动①中反应,通入氯气排净装置内的空气,再点燃④的酒精灯,使氯气在与铝发生反应,B错误;
C.实验中产生的氯气中含有氯化氢气体和水蒸气杂质,应该先除去氯化氢后除去水蒸气,故装置②和装置③的位置不能互换,C正确;
D.二氧化锰和浓盐酸随着反应的进行,浓盐酸变成稀盐酸,不再生产氯气,故含有14.6gHCl的浓盐酸与足量的MnO2反应生成的Cl2小于0.1mol,D错误;
故选C。
13.②③⑥⑦⑧
根据C=1000ρω/M和稀释定律C浓V浓=C稀V稀来计算所需浓硫酸的体积,然后根据配制一定物质的量浓度的溶液的步骤是计算、量取、稀释、移液、洗涤、定容、摇匀来选择使用的仪器。
浓硫酸的物质的量浓度C=1000ρω/M=(1000×1.84×98%)/98g.mol-1=18.4mol/L,由于无90mL容量瓶,故应选用100mL容量瓶,配制出100mL的溶液。设需要浓硫酸的体积为VmL,根据稀释定律C浓V浓=C稀V稀: 可知:18.4mol/L×VmL=1mol/L×100mL,解得V=5.4mL,
用10mL量筒量取5.4mL浓硫酸,后放入烧杯中稀释,同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃棒引流移液至100ml容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1至2cm时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶。用到的仪器有:10mL量筒、烧杯、玻璃棒、100ml容量瓶、胶头滴管;所以答案:②③⑥⑦⑧。
14. 蒸发或日晒 B Na2CO3 HCl 2NaCl(熔融)2Na+Cl2↑ 2Na2O2+2CO2=2Na2CO3+O2
(1)在海水逐渐浓缩过程中,海水中的某些盐的浓度会发生一定的改变,表中数值为析出盐的质量,所以要获取某种盐,应选择其析出量多的点。
(2)除去粗盐中的杂质,某些试剂的加入存在一定的顺序,也就是先加入的试剂,过量部分需要后加入试剂去除。对粗盐提纯来说,与此相关的试剂为Na2CO3和HCl,所以Na2CO3必须在加入BaCl2之后加入,HCl必须在过滤之后加入。
(1)从海水中获得粗盐,常需增大浓度,让盐水变得饱和,所以一般采用的方法是蒸发或日晒。答案为:蒸发或日晒;
(2)根据表中信息,要获得杂质较少的食盐,应控制海水的最佳密度为1.22g mL-1,这时析出食盐最多,杂质最少,因此选B。答案为:B;
(3)粗盐中常含有MgCl2、MgSO4、CaCl2等杂质,加NaOH用来除去Mg2+,加入BaCl2除去SO42-,应加入Na2CO3除去过量的Ba2+和原有的Ca2+,最后加入盐酸除去过量的CO32-,要除去这些杂质,按顺序加入的试剂依次为NaOH、BaCl2、Na2CO3、HCl。答案为:Na2CO3;HCl;
(4)工业上电解熔融氯化钠制取金属钠,化学方程式为2NaCl(熔融)2Na+Cl2↑。答案为:2NaCl(熔融)2Na+Cl2↑;
(5)过氧化钠可作为呼吸面具的供氧剂,它和CO2反应的化学方程式2Na2O2 + 2CO2 == 2Na2CO3 + O2。答案为:2Na2O2 + 2CO2 == 2Na2CO3 + O2。
【点睛】Na2O2 与CO2或H2O反应,都是Na2O2 自身发生的氧化还原反应,配平时具有一定的难度,也就成为书写方程式时的易错点。
15.(1) 圆底烧瓶 饱和食盐水
(2)吸收多余的氯气,防止污染环境
(3)
(4) c Ⅰ处有色布条褪色,Ⅲ处有色布条不褪色 干燥的氯气没有漂白性,潮湿的氯气中发生反应,HClO具有强氧化性,具有漂白性
A装置中用二氧化锰与浓盐酸制取氯气,由于浓盐酸具有挥发性,氯气中混有HCl和水蒸气,为探究潮湿的与反应的产物,装置B中为饱和食盐水,除去HCl,装置D为集气瓶,收集反应可能生成的二氧化碳,装置E用于吸收氯气,防止污染环境。
(1)仪器X的名称是圆底烧瓶。由分析知,试剂Y是饱和食盐水。
(2)装置E的作用是吸收多余的氯气,防止污染环境。
(3)A装置中用二氧化锰与浓盐酸制取氯气,离子方程式为。
(4)①装置A制取氯气,装置B除去HCl,进入装置C的氯气为潮湿的氯气,装置C的作用是验证氯气是否具有漂白性,装置C中装入的物质应该能干燥氯气,并且应该是固体干燥剂,潮湿的氯气与生石灰、NaOH固体均反应,则装置C中应装入的物质是固体,故选c。
②干燥的氯气没有漂白性,潮湿的氯气中发生反应,HClO具有强氧化性,具有漂白性,故Ⅰ、Ⅲ处的现象Ⅰ处有色布条褪色,Ⅲ处有色布条不褪色。
16.(1) 转移溶液时未用玻璃棒引流 应选用250 mL容量瓶
(2)BD
(3)14.0mol/L
(4) 8.9 A
(5)FH
(6)①③
(1)
用浓盐酸配制250mL 0.2mol L-1稀盐酸,配制250mL溶液应该选用250mL的容量瓶,转移溶液应该用玻璃棒引流;
(2)
A.配制溶液时,若加水超过容量瓶刻度,用胶头滴管将多余溶液吸出,溶质物质的量偏少,所配溶液浓度偏低,故不选A;
B.转移溶液前溶液未冷却至室温,溶液体积偏小,所配溶液浓度偏高,故选B;
C.未洗涤烧杯和玻璃棒,溶质物质的量偏少,所配溶液浓度偏低,故不选C;
D.定容时俯视容量瓶的刻度线,溶液体积偏小,所配溶液浓度偏高,故选D;
E.容量瓶洗涤干净后,瓶内壁有少量水滴,所配溶液的浓度不变,故不选E;
选BD;
(3)
此浓硝酸的物质的量浓度mol/L;
(4)
配制240mL 0.50mol·L-1的稀硝酸需选取250mL的容量瓶,设需量取浓硝酸的体积为V,根据硝酸的物质的量相等,14 mol·L-1×V=250mL×0.50mol·L-1,V=8.9mL,应选用10mL的量筒量取,选A;
(5)
根据配制溶液的步骤:计算、量取、稀释并冷却、移液、洗涤、定容、摇匀,实验时需选用的仪器有量筒、玻璃棒 、250mL容量瓶、胶头滴管、200mL烧杯,还需选F、H;
(6)
①量取过浓硝酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶,溶质偏多,配制的稀硝酸浓度偏高,故选①;
②容量瓶使用时未干燥,无影响,故不选②;
③溶解后未经冷却就移液,溶液体积偏小,配制的稀硝酸浓度偏高,故选③;
④定容时不小心有少量蒸馏水滴到瓶外,无影响,故不选④;
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,溶液体积偏大,配制的稀硝酸浓度偏低,故不选⑤;
选①③。
17.(1)分液漏斗
(2)
(3) 乙 随着反应进行,浓盐酸浓度会降低,稀盐酸将不再反应
(4)除去挥发的HCl
(5)
(6)吸收尾气中的
(7) 是 在E和F之间增加一个干燥装置
本题是制备无水氯化铁的实验,首先在烧瓶B中利用与浓盐酸制备氯气,生成的氯气中含有氯化氢气体和水蒸气,应该首先除去氯化氢气体,然后干燥氯气,则装置C盛有饱和食盐水,除去挥发的HCl,装置D盛有浓硫酸,干燥氯气,装置E中Fe和Cl2在加热条件下反应得到氯化铁,最后装置F吸收多余Cl2,防止污染空气。
(1)由装置图知,仪器A的名称为分液漏斗,故答案为:分液漏斗。
(2)与浓盐酸在加热条件下反应生成氯化锰、氯气和水,反应的离子方程式为:,故答案为:。
(3)8.7g的物质的量=, 14.6g HCl的物质的量=,根据可知,只有0.1molMnO2和0.4molHCl恰好完全反应才能产生0.1molCl2(即7.1gCl2)。但是,反应过程中随着HCl逐渐消耗以及反应生成水,使得浓盐酸逐渐变稀,而稀盐酸不能跟MnO2反应,因此0.1molMnO2和0.4molHCl不能完全反应,所以产生的Cl2小于0.1mol(即产生的的质量小于7.1g),乙同学正确,故答案为:乙;随着反应进行,浓盐酸浓度会降低,稀盐酸将不再反应。
(4)生成的氯气中含有氯化氢气体和水蒸气,应该首先除去氯化氢气体,然后干燥氯气,则装置C盛有饱和食盐水的作用为除去挥发的HCl,故答案为:除去挥发的HCl。
(5)Fe3+具有强氧化性,与Fe发生氧化还原反应生成Fe2+,反应的离子方程式为:,故答案为:。
(6)氯气有毒,需要进行尾气处理,则装置F的作用是吸收尾气中的,防止污染空气,故答案为:吸收尾气中的。
(7)由于F装置中的水蒸气可进入E装置中,影响无水氯化铁的制备,因此该实验装置存在缺陷,改进的方法是:在装置E和装置F之间增加一个干燥装置,故答案为:是;在E和F之间增加一个干燥装置。
18.(1)
(2)16.8
溶液中碳酸氢根先与氢氧根离子反应生成碳酸根与水,然后铵根离子再与氢氧根离子在加热条件下反应生成氨气与水;
(1)
溶液中碳酸氢根先与氢氧根离子反应生成碳酸根与水,然后铵根离子再与氢氧根离子在加热条件下反应生成氨气与水,故A点前样品与NaOH反应的离子方程式为,故答案为:;
(2)
加入70mL NaOH溶液时,溶液中溶质为Na2CO3,根据钠离子守恒n(Na2CO3)=n(NaOH)=×0.07L×2mol/L=0.07mol,设NH4HCO3、(NH4)2CO3的物质的量分别为xmol、ymol,根据二者质量之和与碳元素守恒,则:79x+96y=5.7、x+y=0.07,解得x=0.06 y=0.01,样品中(NH4)2CO3的质量分数是=16.8%,故答案为:16.8%。
19. 71.56% 1.12 0.6 8.2mL
设固体混合物中的物质的量为xmol,的物质的量为ymol,
由固体混合物的质量为10.9g,可得①;
由,
则固体混合物与水反应生成的,
由钠原子守恒,可得②;
联立①②两式可解得,,据此分析解答。
(1),则固体混合物中的质量分数为;
(2)由反应,可得,
标准状况下,;
(3)由,溶液体积为500mL,可得; (4)由公式,可得浓硫酸的物质的量浓度,结合稀释定律,可得,需要量取8.2mL。
20. Fe Cl2 H2 2Fe+3Cl22FeCl3 Fe+2HCl===FeCl2+H2↑ 2FeCl2+Cl2===2FeCl3
从反应的框图看出,反应①A+B―→D(固体),反应④F+B―→D(溶液),可知:F是化合物,A是变价金属,且A在F中呈低价。又从物理性质可以判断B为Cl2。推出A是Fe,D为FeCl3,F为FeCl2。从反应③A+E―→F+C可知,E为HCl,C为H2,结合物质的相关性质解答该题。
(1)由以上分析可知,A为Fe,B为Cl2,C为H2,故答案为:Fe,Cl2,H2;
(2)反应①为Fe和Cl2的反应,反应的化学方程式为:;故答案为:;
(3)反应③为Fe和HCl的反应,反应的离子方程式为Fe+2HCl=FeCl2+H2↑,故答案为:Fe+2HCl=FeCl2+H2↑;
(4)反应④为FeCl2和Cl2的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-。
21. MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 饱和食盐水 浓硫酸 HCl H2O Cl2+2OH- =Cl-+ClO-+H2O Ca(ClO)2 HCl 2HClO2HCl+O2↑
电解熔融氯化钠得到钠和氯气,故金属A为Na,黄绿色气体B为Cl2,金属钠在空气中加热得到过氧化钠,则C为过氧化钠,氯气和石灰乳反应得到漂白粉,氯气和氢氧化钠溶液反应得到漂白液,则D为氢氧化钠,过氧化钠可和水反应生成氢氧化钠和氧气,据此回答;
(1)加热条件下,实验室用二氧化锰和浓盐酸共热制取氯气,化学方程式为:
浓盐酸易挥发,氯气中含氯化氢,为制得纯净气体B即氯气,还需将气体依次通入饱和食盐水和浓硫酸,以除去氯气中的氯化氢气体和水蒸气。
(2)氯气有毒,实验室用氢氧化钠溶液处理多余氯气,离子方程式为:Cl2+2OH- =Cl-+ClO-+H2O。
(3)工业上用氯气和石灰乳制备漂白粉,生成氯化钙、次氯酸钙和水,其有效成分为Ca(ClO)2。
(4)将黄绿色气体溶于水后,得到氯水,新制氯水中含HCl、HClO,HClO不稳定,见光分解生成盐酸和氧气,故久置的氯水只含盐酸,请用化学方程式解释2HClO2HCl+O2↑。
22.(1) Na Na2O Na2O2 2Na+O2Na2O2
(2) CO2 2CO+O22CO2 能 C+CO22CO
(1)A是一种金属,C是淡黄色固体,则A为Na,B为Na2O,C为Na2O2,A→C反应的化学方程式为2Na+O2Na2O2;
(2)A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则A为碳,B为CO,C为CO2,B→C反应的化学方程式为2CO+O22CO2,碳和二氧化碳在高温条件下发生反应生成一氧化碳,反应的化学方程式为C+CO22CO
