第八章 化学与可持续发展 测试题(含解析) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第八章 化学与可持续发展 测试题(含解析) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 794.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-25 15:56:13 | ||
图片预览




文档简介
第八章《化学与可持续发展》测试题
一、单选题(共12题)
1.化学在人类生活中扮演着重要角色,以下应用不正确的是( )
A.使用无磷洗衣粉,可彻底解决水体富营养化问题
B.应用高效洁净的能源转换技术有利于节能减排、保护环境
C.用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的
D.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺
2.近期我国冀东渤海湾发现储量达10亿吨的大型油田。下列有关说法正确的是( )
①石油裂解得到的汽油可与溴水反应
②石油的分馏是化学变化
③石油的分馏实验中,温度计水银球插入液面以下,因为它测的是混合液的温度
④石油分馏得到的汽油仍是混合物
A.①③
B.②④
C.①④
D.②③
3.2022年北京冬奥会中使用了大量高科技材料,下列说法中错误的是
A.钛合金速滑冰刀属于无机非金属材料
B.颁奖礼服保暖用到的石墨烯与金刚石互为同素异形体
C.火炬中的聚硅氮烷树脂属于高分子化合物
D.跨临界直冷制冰技术用到的节能、安全无毒
4.下列叙述正确的是
A.将煤在空气中加强热使其分解叫做煤的干馏
B.石油的分馏、裂化、裂解均为化学变化
C.向鸡蛋清溶液中滴加CuSO4溶液析出固体,加入足量蒸馏水后固体不能重新溶解
D.油脂、糖类、蛋白质都是天然有机高分子化合物,都可以发生水解反应
5.下列做法符合“绿色化学”思想的是
A.回收利用废旧电池
B.在通风橱中制取SO2不用NaOH溶液吸收尾气
C.将实验室的有机废液直接倒入下水道
D.用燃气热水器代替太阳能热水器
6.下列物质不能用作食品添加剂的是
A.食盐 B.碳酸氢钠 C.维生素 D.三聚氰胺
7.化学与生活密切相关,下列说法不正确的是
A.灼烧的方法能区分蚕丝和棉纤维
B.酿酒过程中葡萄糖在酒化酶的作用下发生水解反应生成乙醇
C.CO、甲醛、放射性元素氡(Rn)都是室内空气污染物
D.用聚乳酸塑料代替聚乙烯塑料可减少白色污染
8.化学与生活、生产及科技密切相关,下列有关说法错误的是
A.2022年北京冬奥火种灯采用了很多高科技手段致力于结构创新和节能减碳,火种灯材质采用的铝合金是混合物
B.中国“奋斗者”号载人潜水器的钛合金比纯金属钛具有更高的硬度
C.为防控新冠病毒,将“84”消毒液与酒精等体积混合后,消毒效果会更好
D.2021年5月,四川广汉三星堆遗址最新发现的3号祭祀坑的国宝级商代文物“铜顶尊跪坐人像”再惊天下,青铜器的出土表明我国商代已经掌握冶炼铜技术
9.对于金属的下列叙述错误的是
A.金属具有导电性、导热性和延展性
B.金属的焰色试验发生的是物理变化
C.向碳素钢中加入不同的合金元素,可制得不同性能的合金钢
D.铁生锈能形成一层保护层,所以铁锈不必除去
10.海洋是一个十分巨大的资源宝库。海水中含量最多的是H、O两种元素,还含有Na、Cl、Mg、Br、Ca、K、S等元素。以海水为原料可制备氯气、氯化钠和溴等。以海水为原料制备氯化钠和溴的流程如图。
下列说法正确的是
A.粗盐通过溶解、过滤、蒸发结晶可获得纯净氯化钠
B.过程②可以在碱性条件下进行
C.Na2CO3溶液与Br2反应的离子方程式:Br2+CO=Br-+BrO+CO2↑
D.溶液I中Br2的浓度小于溶液II
11.对化工生产认识正确的是
A.海水提溴:一般需要经过浓缩、氧化、提取三个步骤
B.合成氯化氢:通入 H2 的量略大于 Cl2,可以使平衡正移
C.合成氨:采用 500℃的高温,有利于增大反应正向进行的程度
D.氯碱法:使用的粗盐事先不需要经过除杂处理
12.纵观古今,化学与生活皆有着密切联系。下列说法错误的是
A.《本草图经》在绿矾项载:“盖此矾色绿,味酸,烧之则赤…”。因为绿矾能电离出H+,所以有“味酸”.
B.《天工开物》记载:“凡白土曰垩土,为陶家精美器用”。陶是一种传统硅酸盐材料
C.“水声冰下咽,沙路雪中平”描述的是水的三态变化:“冰,水为之,而寒于水”,说明冰转化为水吸热
D.唐未《真元妙道要略)中有云:“以硫黄、雄黄合硝石并蜜烧之;焰起,烧手面及烬屋舍者”,文中描述的是黑火药的制作过程
二、非选择题(共10题)
13.新能源、绿色能源特点:资源丰富、___________、对环境___________等。
14.实验室铝热反应的实验装置如下:
(1)下面放置盛细沙的____________(填名称)。
(2)镁条的作用是______________________________________。
(3)实验现象有:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(4)写出该反应的化学反应方程式:________________,在冶金工业上也常用这一反应原理来冶炼________。
A.不活泼金属 B.较活泼金属
C.稀有金属 D.高熔点金属
(5)已知下表数据:
物质 Al Al2O3 Fe Fe2O3
熔点/℃ 660 2054 1535 1462
沸点/℃ 2467 2980 2750
①某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量能使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是______________,当观察到___________________现象时,反应的离子方程式是________________________________________________________________________。
③实验室欲溶解此熔融物,最好选用下列试剂中的________(填字母)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.NaOH溶液
15.海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
(1)实验室灼烧海带,需要下列仪器中的___(填字母)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f. 酒精灯
(2)指出提取碘的过程中有关的实验操作名称:
①____,③____。
(3)提取碘的过程中,可选择的有机试剂是___。
A.苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、酒精
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有___、__。
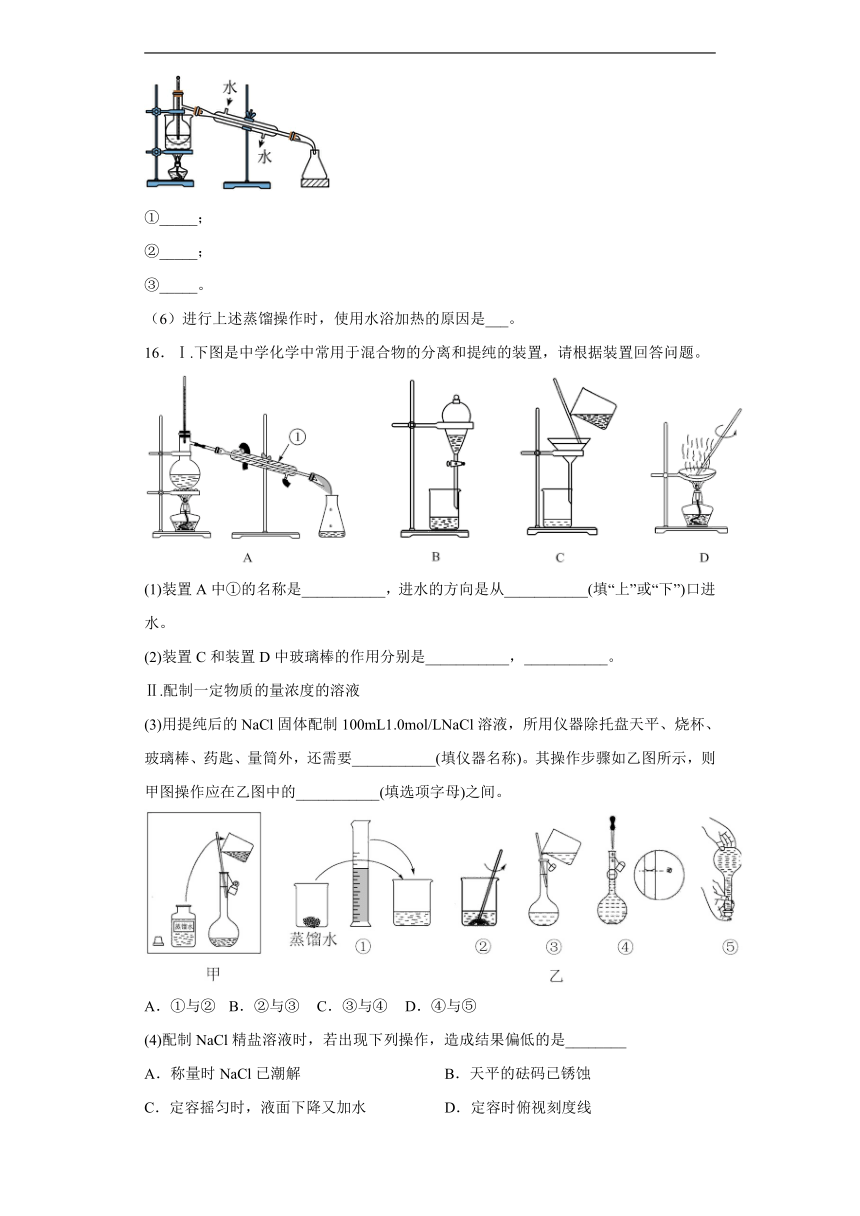
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
①_____;
②_____;
③_____。
(6)进行上述蒸馏操作时,使用水浴加热的原因是___。
16.Ⅰ.下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题。
(1)装置A中①的名称是___________,进水的方向是从___________(填“上”或“下”)口进水。
(2)装置C和装置D中玻璃棒的作用分别是___________,___________。
Ⅱ.配制一定物质的量浓度的溶液
(3)用提纯后的NaCl固体配制100mL1.0mol/LNaCl溶液,所用仪器除托盘天平、烧杯、玻璃棒、药匙、量筒外,还需要___________(填仪器名称)。其操作步骤如乙图所示,则甲图操作应在乙图中的___________(填选项字母)之间。
A.①与② B.②与③ C.③与④ D.④与⑤
(4)配制NaCl精盐溶液时,若出现下列操作,造成结果偏低的是________
A.称量时NaCl已潮解 B.天平的砝码已锈蚀
C.定容摇匀时,液面下降又加水 D.定容时俯视刻度线
17.在和的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。
(1)原溶液中、的物质的量浓度之比为_______。
(2)图中线段_______。
18.已知丁烷在催化剂、加热、加压的条件下会以如下两种方式发生裂解:
现有1mol丁烷,其中有36%以方式①裂解,有24%以方式②裂解,还有40%没有裂解,则最终所得混合气体的平均摩尔质量是______________________。
19.粉末状试样A是由和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取全部溶于盐酸中,固体全部溶解,得溶液C;
③将①中得到的单质B和溶液C反应,放出(标况)气体。同时生成溶液D,还残留有固体物质B;
④用溶液检查时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是____________,产物中的单质B是___________________。
(2)②中所发生反应的化学方程式是____________、____________。
(3)③中所发生反应的离子方程式是____________、____________。
(4)若溶液D的体积仍视为,则该溶液中为____________,为____________。
20.提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
(1)C是_______,D是_______,F是__________。(写化学式)
(2)写出由I生成J的离子反应方程式_____________________________________。
(3)溶液E中所含金属离子是____。
(4)写出A与B反应的化学方程式_____________________________________。
21.已知:A、C均为常见的单质,B、D为常见的化合物,它们在一定条件下有
如下转化关系:A + B→C + D。
⑴ 若A、C均为生活中常见金属,B 为红棕色固体,D既能与盐酸,又能与氢氧化钠溶液反应,则组成A单质的元素在周期表中的位置为_______________;请写出该反应的化学方程式:_____________________________;A和B所具有的总能量_____(填“大于”、“小于”或“等于”)C和D所具有的总能量。
⑵ 若A、C分别是由原子序数相差8的非金属元素组成的固体单质,B是一种不溶于水的酸性氧化物。请写出该反应的化学方程式:______________________,则该反应中氧化剂和还原剂的物质的量之比为__________。
⑶ 若组成A单质的元素可形成带两个单位正电荷的阳离子,且具有与氖原子相同的电子层结构, C为黑色固态单质,该反应的化学方程式是____________________,B为__________分子(填“极性”或“非极性”),D存在化学键的类型为____________。
22.已知A是一种红棕色金属氧化物,B、D是常见的金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
(1)写出下列物质的化学式:A:_________I:_________J:_________G:_________;
(2)按要求写出下列反应的方程式
C→I的离子方程式:_____________________________________
F→G的化学方程式:_____________________________________
(3)将一定量A和C混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
①混合物中含A的质量为______________;
②所用硫酸溶液物质的量浓度为___________;
参考答案:
1.A
A.含磷洗衣粉的使用只是造成水体富营养化的原因之一,因此使用无磷洗衣粉,不可能彻底解决水体富营养化问题,故A错误;
B.应用高效洁净的能源转换技术,可以节约能源、减少二氧化碳的排放,有利于节能减排、保护环境,故B正确;
C.乙烯具有催熟作用,高锰酸钾能氧化乙烯,则用浸泡过的高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的,故C正确;
D.可燃冰(固态甲烷水合物)可作燃料,合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺,故D正确;
故选:A。
2.C
根据题中大型油田可知,本题考查石油分离提纯知识,运用石油分离提纯操作分析。
石油裂解为了获得乙烯、丙烯、甲烷等化工原料,其中乙烯、丙烯可以与溴水反应,①正确;石油的分馏是依据各物质的沸点不同经加热气化和冷凝而分离的操作,故为物理变化,②错;石油分馏实验中,温度计水银球应放在蒸馏烧瓶支管口处,以测量馏出蒸气的温度,③错;石油分馏得到的汽油是C5~C11的烷烃,属于混合物,④正确,C项符合题意。
答案选C。
【点睛】石油的分馏是依据各物质的沸点不同经加热气化和冷凝而分离的操作,为物理变化。
3.A
A. 钛合金属于金属材料,故A错误;
B. 石墨烯与金刚石为碳元素组成的不同的单质,互为同素异形体,故B正确;
C. 聚硅氮烷树脂属于高分子化合物,故C正确;
D. 跨临界直冷制冰技术用到的节能、安全无毒,故D正确;
故选A。
4.C
A.将煤隔绝空气加强热使其分解叫做煤的干馏,故A错误;
B.石油的分馏是物理变化,而石油的裂化、裂解为化学变化,故B错误;
C.向鸡蛋清溶液中滴加CuSO4溶液,使蛋白质变性,析出固体不能再生,则加入足量蒸馏水后固体不能重新溶解,故C正确;
D.油脂不是天然有机高分子化合物,油脂和蛋白质都可以发生水解反应,而糖类中的单糖不能水解,故D错误;
故答案为C。
5.A
根据“绿色化学”要求从根本上减少或杜绝污染,尽可能使原料的利用率提高进行解答。
A.回收利用废旧电池可减少电池对环境的污染,符合“绿色化学”要求,所以A选项是正确的;
B. 在通风橱中制取SO2不用NaOH溶液吸收尾气会污染空气,不符合“绿色化学”要求,故B错误;
C.将实验室的有机废液直接倒入下水道会污染下水道中的水,污染环境,不符合“绿色化学”要求,故C错误;
D. 用燃气热水器代替太阳能热水器会增大大气污染物的排放,增加化石能源的消耗,不符合“绿色化学”要求,故D错误。
所以A选项是正确的。
6.D
A.食盐是生活必备的调味品,A不合题意;
B.碳酸氢钠作为膨松剂和中和胃酸过多的调味品,B不合题意;
C.维生素是六大营养素之一,是生活必需的调味品,C不合题意;
D.三聚氰胺不是食品添加剂,不法商法添加三聚氰胺以提高牛奶中N的含量,D符合题意;
故答案为:D。
7.B
A.蚕丝的主要成分是蛋白质,棉纤维的主要成分是纤维素,二者可用灼烧的方法区别,有烧焦的羽毛气味的是蚕丝,故A正确;
B.酿酒过程中葡萄糖转化为乙醇是分解反应,淀粉转变为葡萄糖是水解反应,故B错误;
C.石材会释放放射性元素氡,装饰材料会释放CO、甲醛,均是室内空气污染物,故C正确;
D.聚乙烯塑料难降解,可造成白色污染,聚乳酸塑料易降解不会造成白色污染,故D正确;
故答案为B。
8.C
A.铝合金是铝和多种物质组成的混合物, A正确;
B.合金硬度大于成分金属、熔点低于成分金属,B正确;
C.“84”消毒液中次氯酸根具有强氧化性,会与酒精反应,降低消毒效果,C错误;
D.商代文物“铜顶尊跪坐人像”的出土表明我国商代已经掌握冶炼铜技术,D正确;
故选C。
9.D
A.金属具有良好的导电性,可以作导体,有良好的导热性,可以作炊具,有良好的延展性,可以压成薄皮和制成细丝,A正确;
B.焰色试验没有新物质生成,属于物理变化,B正确;
C.向碳素钢中加入不同的合金元素,可制得不同性能的合金钢,如加入铬、镍、锰等元素可制成不锈钢,C正确;
D.铁锈的主要成分为疏松多孔的Fe2O3·xH2O,不能形成保护层,反而易吸水和空气使内部铁锈蚀,因此铁锈需要除去,D错误;
答案选D。
10.D
海水得到的粗盐中含有氯化钠,通过精制得到氯化钠;母液中含有溴离子,通入氯气将溴离子氧化为单质溴,利用热空气吹出溴,用碳酸钠溶液吸收转化为溴化钠、溴酸钠,然后加入稀硫酸酸化得到含溴的溶液,据此解答。
A.粗盐中含有杂质离子,通过溶解、过滤、蒸发结晶不可能获得纯净氯化钠,A错误;
B.过程②是氯气氧化溴离子,氯气和溴均能与碱液反应,所以不能在碱性条件下进行,B错误;
C.Na2CO3溶液与Br2反应生成溴化钠、溴酸钠,反应的离子方程式:3Br2+3CO=5Br-+BrO+3CO2↑,C错误;
D.海水中溴的含量低,通过富集提高溴的含量,因此溶液I中Br2的浓度小于溶液II,D正确;
答案选D。
11.A
A. 海水提溴:一般需要经过浓缩、氧化、提取三个步骤,故A正确。
B. 合成氯化氢的反应不是可逆反应不存在平衡移动,故B错误。
C. 合成氨的正反应是放热反应,所以采用 500℃的高温,不利于增大反应正向进行的程度,有利于加快反应速率,故C错误。
D. 氯碱法:使用的粗盐事先要经过除杂处理,故D错误。
故答案选A,
12.A
A项,绿矾不能电离出H+,之所以有“味酸”,是由于FeSO4是强酸弱碱盐,易水解而使其水溶液呈酸性,故A项错误;陶瓷是传统硅酸盐材料,属于无机非金属材料,故B 正确;C. “水声冰下咽,沙路雪中平”描述的是水变成冰就没有声音,有三态变化,“冰,水为之,而寒于水”,说明冰转化为水吸热是正确;D.黑火药是由木炭粉(C)、硫磺(S)和硝石(KNO3)按一定比例配制而成的,根据题意可以知道,题中描述的是制备黑火药的过程,所以D选项是正确的;答案:A。
13. 可再生 无污染
新能源、绿色能源具有可再生,资源丰富,不产生对环境有污染的物质特点,故答案为:可再生;无污染。
14. 蒸发皿 镁条燃烧放出热量,使氯酸钾分解,且在高温下促使三氧化二铁粉末和铝粉发生剧烈反应 镁条剧烈燃烧 三氧化二铁粉末和铝粉发生剧烈反应,放出大量热,并发出耀眼的光芒 “纸”漏斗的下部被烧穿,有熔融物落入沙中 2Al+Fe2O32Fe+Al2O3 D 合理 NaOH溶液 有气泡放出 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ B
(1)用蒸发皿盛细沙,作用是防止蒸发皿炸裂;
(2)镁条燃烧放出热量,使氯酸钾分解,且在高温下促使三氧化二铁粉末和铝粉发生剧烈反应;
(3)该反应的现象有①镁条剧烈燃烧,②三氧化二铁粉末和铝粉发生剧烈反应,放出大量热,并发出耀眼的光芒,③“纸”漏斗的下部被烧穿,有熔融物落入沙中;
(4)该反应为2Al+Fe2O32Fe+Al2O3,铝热反应放出大量的热量,使被还原的金属处于熔融状态,利用铝热反应可以冶炼比铝不活泼的高熔点金属;
(5)①因该反应放出大量的热,能够使置换出的铁以液态析出,而铝的熔点比铁的低,易混杂在铁水中,冷却后得到合金;
②铝能够与氢氧化钠溶液反应产生氢气,而铁不能与氢氧化钠溶液反应,可用氢氧化钠溶液检验块状熔融物中是否含有金属铝;
③A、C中物质与熔融物反应产生污染空气的气体,而D中氢氧化钠溶液只能溶解铝,只有稀硫酸最合适。
(1)用蒸发皿盛细沙,作用是防止蒸发皿炸裂;
(2)镁条燃烧放出热量,使氯酸钾分解,且在高温下促使三氧化二铁粉末和铝粉发生剧烈反应;
(3)该反应的现象有①镁条剧烈燃烧,②三氧化二铁粉末和铝粉发生剧烈反应,放出大量热,并发出耀眼的光芒,③“纸”漏斗的下部被烧穿,有熔融物落入沙中;
(4)该反应为2Al+Fe2O32Fe+Al2O3,铝热反应放出大量的热量,使被还原的金属处于熔融状态,利用铝热反应可以冶炼比铝不活泼的高熔点金属;
(5)①解释合理;因该反应放出大量的热,能够使置换出的铁以液态析出,而铝的熔点比铁的低,易混杂在铁水中,冷却后得到合金;
②铝能够与氢氧化钠溶液反应产生氢气,而铁不能与氢氧化钠溶液反应,可用氢氧化钠溶液检验块状熔融物中是否含有金属铝;反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;
③A、C中物质与熔融物反应产生污染空气的气体,而D中氢氧化钠溶液只能溶解铝,只有稀硫酸最合适。
答案选B。
15. cdef 过滤 萃取分液 B 普通漏斗 分液漏斗 蒸馏烧瓶加热需要垫石棉网,根据装置图,未垫石棉网 蒸馏时温度计的水银球应在略低于支管口,图中温度计在液面以下 冷凝水进水是下进上出,图中冷凝水的进水方向反了 受热均匀,温度便于控制
(1)灼烧海带需要的仪器是坩埚、坩埚钳、泥三角、三脚架、酒精灯,因此cdef;
(2) 反应①得到滤渣和溶液,说明操作是过滤,反应③得到含碘的有机溶液,说明操作是萃取分液;
(3)选择的萃取剂:①不能与原溶剂互溶;②被萃取物质在萃取剂中的溶解度大于在原溶剂中的溶解度;③被萃取的物质与萃取剂不反应,因此选项B正确;
(4)整个操作中需要过滤和萃取分液,因此缺少的仪器是普通漏斗和分液漏斗;
(5)①蒸馏烧瓶加热需要垫石棉网,根据装置图,未垫石棉网;
②蒸馏时温度计的水银球应在略低于支管口,图中温度计在液面以下;
③冷凝水进水是下进上出,图中冷凝水的进水方向反了;
(6)水浴加热的优点:受热均匀,温度便于控制,固体碘聚集在蒸馏烧瓶。
16.(1) 冷凝管 下
(2) 引流 搅拌
(3) 100mL容量瓶、胶头滴管 C
(4)AC
【解析】(1)
仪器①的名称为冷凝管;冷凝水方向为下进上出,故此处填:下;
(2)
过滤时玻璃棒起引流作用,蒸发时玻璃棒起搅拌作用,使受热均匀,防止局部过热引起液体飞溅,故此处依次填:引流、搅拌;
(3)
配制溶液需要一定规格的容量瓶,另外定容时需要用到胶头滴管,故此处填:100 mL容量瓶、胶头滴管;甲图为洗涤过程,其位于转移(③)操作之后,定容(④)操作之前,故答案选C;
(4)
A.NaCl潮解,导致所取溶质NaCl偏少,造成所配溶液浓度偏低,A符合题意;
B.砝码锈蚀,导致称取的NaCl偏多,造成所配溶液浓度偏高,B不符合题意;
C.摇匀后加水,导致溶液体积偏大,造成所配溶液浓度偏低,C符合题意;
D.定容时俯视刻度线,导致所配溶液体积偏小,造成所配溶液浓度偏高,D不符合题意;
故答案选AC。
17.(1)2∶1
(2)7∶1
发生的离子反应有Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO+2H2O,结合图象与反应的对应关系、沉淀的物质的量及原子守恒来计算;
(1)
由图象可知,0~A发生Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,A~B发生Al(OH)3+OH-=AlO+2H2O,C点对应的沉淀为Mg(OH)2,D点对应的沉淀为Mg(OH)2和Al(OH)3,则Mg(OH)2的物质的量为0.2mol,Al(OH)3的物质的量为0.3mol-0.2mol=0.1mol,由Mg(OH)2~Mg2+、Al(OH)3~Al3+,溶液的体积相同,浓度之比等于物质的量之比,所以原溶液中Mg2+、Al3+物质的量浓度之比为0.2mol:0.1mol=2:1;
(2)
0~A发生Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,A~B发生Al(OH)3+OH-=AlO+2H2O,则线段OA对应的NaOH的物质的量为0.4mol+0.3mol=0.7mol,线段AB对应的NaOH的物质的量为0.1mol,所以线段OA:AB=0.7mol:0.1mol=7:1。
18.36.25g·mol-1
先根据反应①、②计算出丁烷分解产物的总物质的量,分解过程中遵循质量守恒,则分解后气体总质量仍然为1mol丁烷的质量,然后结合M=计算最终所得混合气体的平均摩尔质量。
现有1mol丁烷,其中有36%以方式①裂解,有24%以方式②裂解,还有40%没有裂解;
发生反应①C4H10CH4+C3H6的丁烷为:1mol×36%=0.36mol,分解后气体总物质的量增大一倍,变为0.72mol;
发生反应②C4H10C2H6+C2H4的丁烷为:1mol×24%=0.24mol,分解后气体总物质的量增大一倍,变为0.48mol;
分解后气体总物质的量为:0.72mol+0.48mol+1mol×40%=1.6mol,丁烷分解过程中总质量不变,则最终所得混合气体的平均摩尔质量为:=36.25g/mol。
19. 加入氯酸钾插上镁条点燃镁条引起 Fe MgO+2HCl=MgCl2+H2O Fe2O3+6HCl=2FeCl3+3H2O Fe+2H+=Fe2++H2↑ Fe+2Fe3+=3Fe2+ 0.67mol/L 2.33mol/L
①铝热反应的本质是置换反应,金属性Al>Fe,所以发生Al与Fe2O3反应,置换出铁,即B为Fe;
②MgO与盐酸反应生成氯化镁与水,Fe2O3与盐酸反应生成氯化铁与水,溶液C中含有MgCl2、FeCl3;
③单质B和溶液C反应,放出1.12L(标准状况)气体,该气体为氢气,说明②中盐酸过量,溶液C为MgCl2、FeCl3、HCl混合溶液,反应同时生成溶液D,还残留有固体物质B,说明Fe有剩余,结合④用KSCN溶液检验时,溶液D不变色,说明D溶液不含铁离子,则D中溶质为MgCl2、FeCl2,据此分析解答。
(1)①中引发铝热反应的操作为:加少量KClO3,插上镁条并将其点燃;产物中的单质B是Fe,故答案为:加少量KClO3,插上镁条并将其点燃;Fe;
(2)氧化镁与盐酸反应生成氯化镁与水,氧化铁与盐酸反应生成氯化铁与水,②中所发生反应的化学方程式为:MgO+2HCl=MgCl2+H2O、Fe2O3+6HCl=2FeCl3+3H2O,故答案为:MgO+2HCl=MgCl2+H2O、Fe2O3+6HCl=2FeCl3+3H2O;
(3)Fe与盐酸反应生成氯化亚铁与氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑,铁与氯化铁反应生成氯化亚铁,反应的离子方程式为Fe+2Fe3+=3Fe2+,故答案为:Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;
(4)令MgO和Fe2O3的物质的量分别为xmol、ymol,则40x+160y=20,溶液C为MgCl2、FeCl3、HCl混合溶液,加入铁粉后生成的氢气为=0.05mol,根据氯元素守恒,2x+3×2y+0.05×2=0.15×6,解得:x=0.1,y=0.1;n(Mg2+)=n(MgO)=0.1mol,所以c(Mg2+)==0.67mol/L;溶液D为MgCl2、FeCl2的混合溶液,根据电荷守恒溶液中2c(Mg2+)+2c(Fe2+)=c(Cl-),所以2×0.67mol/L+2c(Fe2+)=6mol/L,解得c(Fe2+)=2.33mol/L,故答案为:0.67mol/L;2.33mol/L。
20.(1) Fe Al2O3 H2
(2)
(3)Fe2+
(4)Fe2O3+2AlAl2O3+2Fe
溶液E和氨水、空气反应生成红褐色沉淀,红褐色沉淀是氢氧化铁,则E是亚铁盐;单质C和稀酸L反应生成溶液E和单质F,E是亚铁盐,金属和酸反应生成盐,所以C是铁;沉淀J和强碱反应,则J是氢氧化铝,I和氨水反应生成氢氧化铝,所以I是铝盐;氢氧化铝和强碱反应生成溶液K,氢氧化铝和强碱反应生成偏铝酸盐,所以K是偏铝酸盐,单质B和强碱反应生成偏铝酸盐和氢气,则B是金属铝,F是氢气;化合物A和铝反应生成铁和化合物D,根据铝热反应知,A是铁的氧化物,D是氧化铝;高温条件下,氧化铝和熔融的氢氧化钠反应生成盐,K是偏铝酸钠。据此分析解题。
(1)通过以上分析知,C是Fe,D是Al2O3,F是H2,故答案为Fe;Al2O3;H2。
(2)I是铝盐,与氨水反应生成J(氢氧化铝),反应的离子方程式为,故答案为:。
(3)单质C为Fe,铁与稀酸反应生成硫酸亚铁和氢气,所以E中所含金属离子Fe2+,故答案为Fe2+。
(4)铝与氧化铁发生铝热反应,化学方程式为:Fe2O3+2AlAl2O3+2Fe,
故答案为Fe2O3+2AlAl2O3+2Fe。
21. 第三周期 ⅢA族 2Al+Fe2O3Al2O3+2Fe 大于 2C+SiO2Si+2CO↑ 1:2 2Mg+CO22MgO+C 非极性 离子键
试题分析:⑴ 若A、C均为生活中常见金属,B 为红棕色固体,B是氧化铁;D既能与盐酸,又能与氢氧化钠,D具有两性,D是氧化铝;A、C均为常见的单质,A + B→C + D,A的活泼性大于C,所以A是铝、C是铁。
⑵B是一种不溶于水的酸性氧化物,B是 ,A、C分别是由原子序数相差8的非金属元素组成的固体单质,A + B→C + D,则A是碳单质、C是Si,D是CO;
⑶ 若组成A单质的元素可形成带两个单位正电荷的阳离子,且具有与氖原子相同的电
子层结构,则A是Mg; C为黑色固态单质,C是碳单质,D是氧化镁、B是CO2;
解析:根据以上分析,⑴ A是铝、C是铁,若A、C均为生活中常见金属,B 为红棕色固体,B是氧化铁;D既能与盐酸,又能与氢氧化钠,D具有两性,D是氧化铝;A、C均为常见的单质,A + B→C + D,A的活泼性大于C,所以A是铝、C是铁、B是氧化铁、D是氧化铝;铝单质的元素在周期表中的位置为第三周期 ⅢA族;该反应
的化学方程式:2Al+Fe2O3Al2O3+2Fe;该反应放热,所以A和B所具有的总能量大于C和D所具有的总能量。
⑵B是 ,A、C分别是由原子序数相差8的非金属元素组成的固体单质,A + B→C + D,则A是碳单质、B是、C是Si,D是CO;该反应的化学方程式:2C+SiO2Si+2CO↑,
则该反应中氧化剂是、还原剂是C,物质的量之比为1:2;
⑶
A是Mg; C为黑色固态单质,C是碳单质,D是氧化镁、B是CO2;反应的化学方程式是2Mg+CO22MgO+C,CO2分子是直线型,结构对称为非极性分子,氧化镁是离子化合物,存在离子键。
点睛:金属镁在CO2能燃烧生成氧化镁和碳,所以金属镁着火后要用沙土盖灭,不能用干冰灭火器灭火。
22. Fe2O3 NaAlO2 Al(OH)3 Fe(OH)3 Al2O3+2OH-=2AlO2-+H2O 4Fe(OH)2+O2+2H2O = 4Fe(OH)3 16g 6.5mol/L
(1)A是一种红棕色金属氧化物,所以是三氧化二铁,和金属B在高温下发生铝热反应,生成的C为铝的氧化物,既能和酸反应又能和碱反应,白色沉淀在空气中变成红褐色沉淀,一定是氢氧化亚铁和氢氧化铁之间的转换,所以G是氢氧化铁,F是氢氧化亚铁,根据物质的性质可推断得,E是氯化亚铁,D是金属铁,J是一种难溶于水的白色化合物为氢氧化铝,则金属B是铝,H是氯化铝,I是偏铝酸钠,根据铁及化合物以及铝及化合物的有关性质来回答。
(2)根据氧化铝、氢氧化铁的性质写出相应的方程式;
(3)A和C为Fe2O3 和Al2O3的混合物,溶于100mL稀硫酸中,生成铁离子和铝离子;根据图象可知,加入氢氧化钠溶液后,没有沉淀生成,说明硫酸溶解氧化铝、氧化铁后硫酸有剩余;随着碱量的增加,沉淀逐渐增多,达到最大值,碱过量,氢氧化铝溶解,氢氧化铁不溶解,先根据溶解的氢氧化铝计算出氢氧化钠的浓度,然后再根据生成沉淀量最大时,溶液中存在的2n(Na2SO4)=n(NaOH)关系,找到n(H2SO4)= n(Na2SO4)关系,从而计算出硫酸的浓度。
A是一种红棕色金属氧化物,所以是三氧化二铁,和金属B在高温下发生铝热反应,生成的C为铝的氧化物,既能和酸反应又能和碱反应,白色沉淀在空气中变成红褐色沉淀,一定是氢氧化亚铁和氢氧化铁之间的转换,所以G是氢氧化铁,F是氢氧化亚铁,根据物质的性质可推断得,E是氯化亚铁,D是金属铁,J是一种难溶于水的白色化合物为氢氧化铝,则金属B是铝,H是氯化铝,I是偏铝酸钠;
(1)根据上面的分析可以知道,则A为Fe2O3, I是NaAlO2,J是Al(OH)3,G是Fe(OH)3;
因此,本题正确答案是: Fe2O3; NaAlO2;Al(OH)3 ;Fe(OH)3。
(2) 氧化铝是两性氧化物,氧化铝在氢氧化钠溶液中反应生成偏铝酸钠和水,C→I的离子方程式:Al2O3+2OH-=2AlO2-+H2O;综上所述,本题答案是:Al2O3+2OH-=2AlO2-+H2O。
氢氧化亚铁与氧气、水共同作用生成氢氧化铁,F→G的化学方程式:4Fe(OH)2+O2+2H2O = 4Fe(OH)3 ;综上所述,本题答案是:4Fe(OH)2+O2+2H2O = 4Fe(OH)3。
(3) A和C为Fe2O3 和Al2O3的混合物,溶于100mL稀硫酸中,生成铁离子和铝离子;根据图象可知,加入氢氧化钠溶液后,没有沉淀生成,说明硫酸溶解氧化铝、氧化铁后硫酸有剩余;随着碱量的增加,沉淀逐渐增多,达到最大值,碱过量,氢氧化铝溶解,氢氧化铁不溶解,
①根据21.4g沉淀的质量是氢氧化铁的质量,氢氧化铁物质的量是21.4/107=0.2mol,根据铁元素守恒,所以氧化铁的物质的量是0.1mol, Fe2O3的质量是0.1×160=16g;
因此,本题正确答案是16。
②从260-300mL,NaOH溶解Al(OH)3,发生反应:NaOH+Al(OH)3=NaAlO2+2H2O,氢氧化铝的质量是:37-21.4=15.6g,即0.2mol,消耗NaOH为0.2mol,所以氢氧化钠的浓度0.2/0.04=5mol/L;当V(NaOH)=260mL时,沉淀量最大,此时沉淀为Fe(OH)3和Al(OH)3,溶液中溶质为Na2SO4;根据钠元素守恒:2n(Na2SO4)=n(NaOH),n(Na2SO4)=0.5n(NaOH)=0.5×0.26×5=0.65mol;根据硫酸根离子守恒:n(H2SO4)= n(Na2SO4)=0.65mol,则c(H2SO4)=0.65/0.1=6.5mol/L;
综上所述,本题答案是:6.5mol/L
一、单选题(共12题)
1.化学在人类生活中扮演着重要角色,以下应用不正确的是( )
A.使用无磷洗衣粉,可彻底解决水体富营养化问题
B.应用高效洁净的能源转换技术有利于节能减排、保护环境
C.用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的
D.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺
2.近期我国冀东渤海湾发现储量达10亿吨的大型油田。下列有关说法正确的是( )
①石油裂解得到的汽油可与溴水反应
②石油的分馏是化学变化
③石油的分馏实验中,温度计水银球插入液面以下,因为它测的是混合液的温度
④石油分馏得到的汽油仍是混合物
A.①③
B.②④
C.①④
D.②③
3.2022年北京冬奥会中使用了大量高科技材料,下列说法中错误的是
A.钛合金速滑冰刀属于无机非金属材料
B.颁奖礼服保暖用到的石墨烯与金刚石互为同素异形体
C.火炬中的聚硅氮烷树脂属于高分子化合物
D.跨临界直冷制冰技术用到的节能、安全无毒
4.下列叙述正确的是
A.将煤在空气中加强热使其分解叫做煤的干馏
B.石油的分馏、裂化、裂解均为化学变化
C.向鸡蛋清溶液中滴加CuSO4溶液析出固体,加入足量蒸馏水后固体不能重新溶解
D.油脂、糖类、蛋白质都是天然有机高分子化合物,都可以发生水解反应
5.下列做法符合“绿色化学”思想的是
A.回收利用废旧电池
B.在通风橱中制取SO2不用NaOH溶液吸收尾气
C.将实验室的有机废液直接倒入下水道
D.用燃气热水器代替太阳能热水器
6.下列物质不能用作食品添加剂的是
A.食盐 B.碳酸氢钠 C.维生素 D.三聚氰胺
7.化学与生活密切相关,下列说法不正确的是
A.灼烧的方法能区分蚕丝和棉纤维
B.酿酒过程中葡萄糖在酒化酶的作用下发生水解反应生成乙醇
C.CO、甲醛、放射性元素氡(Rn)都是室内空气污染物
D.用聚乳酸塑料代替聚乙烯塑料可减少白色污染
8.化学与生活、生产及科技密切相关,下列有关说法错误的是
A.2022年北京冬奥火种灯采用了很多高科技手段致力于结构创新和节能减碳,火种灯材质采用的铝合金是混合物
B.中国“奋斗者”号载人潜水器的钛合金比纯金属钛具有更高的硬度
C.为防控新冠病毒,将“84”消毒液与酒精等体积混合后,消毒效果会更好
D.2021年5月,四川广汉三星堆遗址最新发现的3号祭祀坑的国宝级商代文物“铜顶尊跪坐人像”再惊天下,青铜器的出土表明我国商代已经掌握冶炼铜技术
9.对于金属的下列叙述错误的是
A.金属具有导电性、导热性和延展性
B.金属的焰色试验发生的是物理变化
C.向碳素钢中加入不同的合金元素,可制得不同性能的合金钢
D.铁生锈能形成一层保护层,所以铁锈不必除去
10.海洋是一个十分巨大的资源宝库。海水中含量最多的是H、O两种元素,还含有Na、Cl、Mg、Br、Ca、K、S等元素。以海水为原料可制备氯气、氯化钠和溴等。以海水为原料制备氯化钠和溴的流程如图。
下列说法正确的是
A.粗盐通过溶解、过滤、蒸发结晶可获得纯净氯化钠
B.过程②可以在碱性条件下进行
C.Na2CO3溶液与Br2反应的离子方程式:Br2+CO=Br-+BrO+CO2↑
D.溶液I中Br2的浓度小于溶液II
11.对化工生产认识正确的是
A.海水提溴:一般需要经过浓缩、氧化、提取三个步骤
B.合成氯化氢:通入 H2 的量略大于 Cl2,可以使平衡正移
C.合成氨:采用 500℃的高温,有利于增大反应正向进行的程度
D.氯碱法:使用的粗盐事先不需要经过除杂处理
12.纵观古今,化学与生活皆有着密切联系。下列说法错误的是
A.《本草图经》在绿矾项载:“盖此矾色绿,味酸,烧之则赤…”。因为绿矾能电离出H+,所以有“味酸”.
B.《天工开物》记载:“凡白土曰垩土,为陶家精美器用”。陶是一种传统硅酸盐材料
C.“水声冰下咽,沙路雪中平”描述的是水的三态变化:“冰,水为之,而寒于水”,说明冰转化为水吸热
D.唐未《真元妙道要略)中有云:“以硫黄、雄黄合硝石并蜜烧之;焰起,烧手面及烬屋舍者”,文中描述的是黑火药的制作过程
二、非选择题(共10题)
13.新能源、绿色能源特点:资源丰富、___________、对环境___________等。
14.实验室铝热反应的实验装置如下:
(1)下面放置盛细沙的____________(填名称)。
(2)镁条的作用是______________________________________。
(3)实验现象有:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(4)写出该反应的化学反应方程式:________________,在冶金工业上也常用这一反应原理来冶炼________。
A.不活泼金属 B.较活泼金属
C.稀有金属 D.高熔点金属
(5)已知下表数据:
物质 Al Al2O3 Fe Fe2O3
熔点/℃ 660 2054 1535 1462
沸点/℃ 2467 2980 2750
①某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量能使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是______________,当观察到___________________现象时,反应的离子方程式是________________________________________________________________________。
③实验室欲溶解此熔融物,最好选用下列试剂中的________(填字母)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.NaOH溶液
15.海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
(1)实验室灼烧海带,需要下列仪器中的___(填字母)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f. 酒精灯
(2)指出提取碘的过程中有关的实验操作名称:
①____,③____。
(3)提取碘的过程中,可选择的有机试剂是___。
A.苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、酒精
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有___、__。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
①_____;
②_____;
③_____。
(6)进行上述蒸馏操作时,使用水浴加热的原因是___。
16.Ⅰ.下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题。
(1)装置A中①的名称是___________,进水的方向是从___________(填“上”或“下”)口进水。
(2)装置C和装置D中玻璃棒的作用分别是___________,___________。
Ⅱ.配制一定物质的量浓度的溶液
(3)用提纯后的NaCl固体配制100mL1.0mol/LNaCl溶液,所用仪器除托盘天平、烧杯、玻璃棒、药匙、量筒外,还需要___________(填仪器名称)。其操作步骤如乙图所示,则甲图操作应在乙图中的___________(填选项字母)之间。
A.①与② B.②与③ C.③与④ D.④与⑤
(4)配制NaCl精盐溶液时,若出现下列操作,造成结果偏低的是________
A.称量时NaCl已潮解 B.天平的砝码已锈蚀
C.定容摇匀时,液面下降又加水 D.定容时俯视刻度线
17.在和的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。
(1)原溶液中、的物质的量浓度之比为_______。
(2)图中线段_______。
18.已知丁烷在催化剂、加热、加压的条件下会以如下两种方式发生裂解:
现有1mol丁烷,其中有36%以方式①裂解,有24%以方式②裂解,还有40%没有裂解,则最终所得混合气体的平均摩尔质量是______________________。
19.粉末状试样A是由和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取全部溶于盐酸中,固体全部溶解,得溶液C;
③将①中得到的单质B和溶液C反应,放出(标况)气体。同时生成溶液D,还残留有固体物质B;
④用溶液检查时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是____________,产物中的单质B是___________________。
(2)②中所发生反应的化学方程式是____________、____________。
(3)③中所发生反应的离子方程式是____________、____________。
(4)若溶液D的体积仍视为,则该溶液中为____________,为____________。
20.提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
(1)C是_______,D是_______,F是__________。(写化学式)
(2)写出由I生成J的离子反应方程式_____________________________________。
(3)溶液E中所含金属离子是____。
(4)写出A与B反应的化学方程式_____________________________________。
21.已知:A、C均为常见的单质,B、D为常见的化合物,它们在一定条件下有
如下转化关系:A + B→C + D。
⑴ 若A、C均为生活中常见金属,B 为红棕色固体,D既能与盐酸,又能与氢氧化钠溶液反应,则组成A单质的元素在周期表中的位置为_______________;请写出该反应的化学方程式:_____________________________;A和B所具有的总能量_____(填“大于”、“小于”或“等于”)C和D所具有的总能量。
⑵ 若A、C分别是由原子序数相差8的非金属元素组成的固体单质,B是一种不溶于水的酸性氧化物。请写出该反应的化学方程式:______________________,则该反应中氧化剂和还原剂的物质的量之比为__________。
⑶ 若组成A单质的元素可形成带两个单位正电荷的阳离子,且具有与氖原子相同的电子层结构, C为黑色固态单质,该反应的化学方程式是____________________,B为__________分子(填“极性”或“非极性”),D存在化学键的类型为____________。
22.已知A是一种红棕色金属氧化物,B、D是常见的金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
(1)写出下列物质的化学式:A:_________I:_________J:_________G:_________;
(2)按要求写出下列反应的方程式
C→I的离子方程式:_____________________________________
F→G的化学方程式:_____________________________________
(3)将一定量A和C混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
①混合物中含A的质量为______________;
②所用硫酸溶液物质的量浓度为___________;
参考答案:
1.A
A.含磷洗衣粉的使用只是造成水体富营养化的原因之一,因此使用无磷洗衣粉,不可能彻底解决水体富营养化问题,故A错误;
B.应用高效洁净的能源转换技术,可以节约能源、减少二氧化碳的排放,有利于节能减排、保护环境,故B正确;
C.乙烯具有催熟作用,高锰酸钾能氧化乙烯,则用浸泡过的高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的,故C正确;
D.可燃冰(固态甲烷水合物)可作燃料,合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺,故D正确;
故选:A。
2.C
根据题中大型油田可知,本题考查石油分离提纯知识,运用石油分离提纯操作分析。
石油裂解为了获得乙烯、丙烯、甲烷等化工原料,其中乙烯、丙烯可以与溴水反应,①正确;石油的分馏是依据各物质的沸点不同经加热气化和冷凝而分离的操作,故为物理变化,②错;石油分馏实验中,温度计水银球应放在蒸馏烧瓶支管口处,以测量馏出蒸气的温度,③错;石油分馏得到的汽油是C5~C11的烷烃,属于混合物,④正确,C项符合题意。
答案选C。
【点睛】石油的分馏是依据各物质的沸点不同经加热气化和冷凝而分离的操作,为物理变化。
3.A
A. 钛合金属于金属材料,故A错误;
B. 石墨烯与金刚石为碳元素组成的不同的单质,互为同素异形体,故B正确;
C. 聚硅氮烷树脂属于高分子化合物,故C正确;
D. 跨临界直冷制冰技术用到的节能、安全无毒,故D正确;
故选A。
4.C
A.将煤隔绝空气加强热使其分解叫做煤的干馏,故A错误;
B.石油的分馏是物理变化,而石油的裂化、裂解为化学变化,故B错误;
C.向鸡蛋清溶液中滴加CuSO4溶液,使蛋白质变性,析出固体不能再生,则加入足量蒸馏水后固体不能重新溶解,故C正确;
D.油脂不是天然有机高分子化合物,油脂和蛋白质都可以发生水解反应,而糖类中的单糖不能水解,故D错误;
故答案为C。
5.A
根据“绿色化学”要求从根本上减少或杜绝污染,尽可能使原料的利用率提高进行解答。
A.回收利用废旧电池可减少电池对环境的污染,符合“绿色化学”要求,所以A选项是正确的;
B. 在通风橱中制取SO2不用NaOH溶液吸收尾气会污染空气,不符合“绿色化学”要求,故B错误;
C.将实验室的有机废液直接倒入下水道会污染下水道中的水,污染环境,不符合“绿色化学”要求,故C错误;
D. 用燃气热水器代替太阳能热水器会增大大气污染物的排放,增加化石能源的消耗,不符合“绿色化学”要求,故D错误。
所以A选项是正确的。
6.D
A.食盐是生活必备的调味品,A不合题意;
B.碳酸氢钠作为膨松剂和中和胃酸过多的调味品,B不合题意;
C.维生素是六大营养素之一,是生活必需的调味品,C不合题意;
D.三聚氰胺不是食品添加剂,不法商法添加三聚氰胺以提高牛奶中N的含量,D符合题意;
故答案为:D。
7.B
A.蚕丝的主要成分是蛋白质,棉纤维的主要成分是纤维素,二者可用灼烧的方法区别,有烧焦的羽毛气味的是蚕丝,故A正确;
B.酿酒过程中葡萄糖转化为乙醇是分解反应,淀粉转变为葡萄糖是水解反应,故B错误;
C.石材会释放放射性元素氡,装饰材料会释放CO、甲醛,均是室内空气污染物,故C正确;
D.聚乙烯塑料难降解,可造成白色污染,聚乳酸塑料易降解不会造成白色污染,故D正确;
故答案为B。
8.C
A.铝合金是铝和多种物质组成的混合物, A正确;
B.合金硬度大于成分金属、熔点低于成分金属,B正确;
C.“84”消毒液中次氯酸根具有强氧化性,会与酒精反应,降低消毒效果,C错误;
D.商代文物“铜顶尊跪坐人像”的出土表明我国商代已经掌握冶炼铜技术,D正确;
故选C。
9.D
A.金属具有良好的导电性,可以作导体,有良好的导热性,可以作炊具,有良好的延展性,可以压成薄皮和制成细丝,A正确;
B.焰色试验没有新物质生成,属于物理变化,B正确;
C.向碳素钢中加入不同的合金元素,可制得不同性能的合金钢,如加入铬、镍、锰等元素可制成不锈钢,C正确;
D.铁锈的主要成分为疏松多孔的Fe2O3·xH2O,不能形成保护层,反而易吸水和空气使内部铁锈蚀,因此铁锈需要除去,D错误;
答案选D。
10.D
海水得到的粗盐中含有氯化钠,通过精制得到氯化钠;母液中含有溴离子,通入氯气将溴离子氧化为单质溴,利用热空气吹出溴,用碳酸钠溶液吸收转化为溴化钠、溴酸钠,然后加入稀硫酸酸化得到含溴的溶液,据此解答。
A.粗盐中含有杂质离子,通过溶解、过滤、蒸发结晶不可能获得纯净氯化钠,A错误;
B.过程②是氯气氧化溴离子,氯气和溴均能与碱液反应,所以不能在碱性条件下进行,B错误;
C.Na2CO3溶液与Br2反应生成溴化钠、溴酸钠,反应的离子方程式:3Br2+3CO=5Br-+BrO+3CO2↑,C错误;
D.海水中溴的含量低,通过富集提高溴的含量,因此溶液I中Br2的浓度小于溶液II,D正确;
答案选D。
11.A
A. 海水提溴:一般需要经过浓缩、氧化、提取三个步骤,故A正确。
B. 合成氯化氢的反应不是可逆反应不存在平衡移动,故B错误。
C. 合成氨的正反应是放热反应,所以采用 500℃的高温,不利于增大反应正向进行的程度,有利于加快反应速率,故C错误。
D. 氯碱法:使用的粗盐事先要经过除杂处理,故D错误。
故答案选A,
12.A
A项,绿矾不能电离出H+,之所以有“味酸”,是由于FeSO4是强酸弱碱盐,易水解而使其水溶液呈酸性,故A项错误;陶瓷是传统硅酸盐材料,属于无机非金属材料,故B 正确;C. “水声冰下咽,沙路雪中平”描述的是水变成冰就没有声音,有三态变化,“冰,水为之,而寒于水”,说明冰转化为水吸热是正确;D.黑火药是由木炭粉(C)、硫磺(S)和硝石(KNO3)按一定比例配制而成的,根据题意可以知道,题中描述的是制备黑火药的过程,所以D选项是正确的;答案:A。
13. 可再生 无污染
新能源、绿色能源具有可再生,资源丰富,不产生对环境有污染的物质特点,故答案为:可再生;无污染。
14. 蒸发皿 镁条燃烧放出热量,使氯酸钾分解,且在高温下促使三氧化二铁粉末和铝粉发生剧烈反应 镁条剧烈燃烧 三氧化二铁粉末和铝粉发生剧烈反应,放出大量热,并发出耀眼的光芒 “纸”漏斗的下部被烧穿,有熔融物落入沙中 2Al+Fe2O32Fe+Al2O3 D 合理 NaOH溶液 有气泡放出 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ B
(1)用蒸发皿盛细沙,作用是防止蒸发皿炸裂;
(2)镁条燃烧放出热量,使氯酸钾分解,且在高温下促使三氧化二铁粉末和铝粉发生剧烈反应;
(3)该反应的现象有①镁条剧烈燃烧,②三氧化二铁粉末和铝粉发生剧烈反应,放出大量热,并发出耀眼的光芒,③“纸”漏斗的下部被烧穿,有熔融物落入沙中;
(4)该反应为2Al+Fe2O32Fe+Al2O3,铝热反应放出大量的热量,使被还原的金属处于熔融状态,利用铝热反应可以冶炼比铝不活泼的高熔点金属;
(5)①因该反应放出大量的热,能够使置换出的铁以液态析出,而铝的熔点比铁的低,易混杂在铁水中,冷却后得到合金;
②铝能够与氢氧化钠溶液反应产生氢气,而铁不能与氢氧化钠溶液反应,可用氢氧化钠溶液检验块状熔融物中是否含有金属铝;
③A、C中物质与熔融物反应产生污染空气的气体,而D中氢氧化钠溶液只能溶解铝,只有稀硫酸最合适。
(1)用蒸发皿盛细沙,作用是防止蒸发皿炸裂;
(2)镁条燃烧放出热量,使氯酸钾分解,且在高温下促使三氧化二铁粉末和铝粉发生剧烈反应;
(3)该反应的现象有①镁条剧烈燃烧,②三氧化二铁粉末和铝粉发生剧烈反应,放出大量热,并发出耀眼的光芒,③“纸”漏斗的下部被烧穿,有熔融物落入沙中;
(4)该反应为2Al+Fe2O32Fe+Al2O3,铝热反应放出大量的热量,使被还原的金属处于熔融状态,利用铝热反应可以冶炼比铝不活泼的高熔点金属;
(5)①解释合理;因该反应放出大量的热,能够使置换出的铁以液态析出,而铝的熔点比铁的低,易混杂在铁水中,冷却后得到合金;
②铝能够与氢氧化钠溶液反应产生氢气,而铁不能与氢氧化钠溶液反应,可用氢氧化钠溶液检验块状熔融物中是否含有金属铝;反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;
③A、C中物质与熔融物反应产生污染空气的气体,而D中氢氧化钠溶液只能溶解铝,只有稀硫酸最合适。
答案选B。
15. cdef 过滤 萃取分液 B 普通漏斗 分液漏斗 蒸馏烧瓶加热需要垫石棉网,根据装置图,未垫石棉网 蒸馏时温度计的水银球应在略低于支管口,图中温度计在液面以下 冷凝水进水是下进上出,图中冷凝水的进水方向反了 受热均匀,温度便于控制
(1)灼烧海带需要的仪器是坩埚、坩埚钳、泥三角、三脚架、酒精灯,因此cdef;
(2) 反应①得到滤渣和溶液,说明操作是过滤,反应③得到含碘的有机溶液,说明操作是萃取分液;
(3)选择的萃取剂:①不能与原溶剂互溶;②被萃取物质在萃取剂中的溶解度大于在原溶剂中的溶解度;③被萃取的物质与萃取剂不反应,因此选项B正确;
(4)整个操作中需要过滤和萃取分液,因此缺少的仪器是普通漏斗和分液漏斗;
(5)①蒸馏烧瓶加热需要垫石棉网,根据装置图,未垫石棉网;
②蒸馏时温度计的水银球应在略低于支管口,图中温度计在液面以下;
③冷凝水进水是下进上出,图中冷凝水的进水方向反了;
(6)水浴加热的优点:受热均匀,温度便于控制,固体碘聚集在蒸馏烧瓶。
16.(1) 冷凝管 下
(2) 引流 搅拌
(3) 100mL容量瓶、胶头滴管 C
(4)AC
【解析】(1)
仪器①的名称为冷凝管;冷凝水方向为下进上出,故此处填:下;
(2)
过滤时玻璃棒起引流作用,蒸发时玻璃棒起搅拌作用,使受热均匀,防止局部过热引起液体飞溅,故此处依次填:引流、搅拌;
(3)
配制溶液需要一定规格的容量瓶,另外定容时需要用到胶头滴管,故此处填:100 mL容量瓶、胶头滴管;甲图为洗涤过程,其位于转移(③)操作之后,定容(④)操作之前,故答案选C;
(4)
A.NaCl潮解,导致所取溶质NaCl偏少,造成所配溶液浓度偏低,A符合题意;
B.砝码锈蚀,导致称取的NaCl偏多,造成所配溶液浓度偏高,B不符合题意;
C.摇匀后加水,导致溶液体积偏大,造成所配溶液浓度偏低,C符合题意;
D.定容时俯视刻度线,导致所配溶液体积偏小,造成所配溶液浓度偏高,D不符合题意;
故答案选AC。
17.(1)2∶1
(2)7∶1
发生的离子反应有Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO+2H2O,结合图象与反应的对应关系、沉淀的物质的量及原子守恒来计算;
(1)
由图象可知,0~A发生Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,A~B发生Al(OH)3+OH-=AlO+2H2O,C点对应的沉淀为Mg(OH)2,D点对应的沉淀为Mg(OH)2和Al(OH)3,则Mg(OH)2的物质的量为0.2mol,Al(OH)3的物质的量为0.3mol-0.2mol=0.1mol,由Mg(OH)2~Mg2+、Al(OH)3~Al3+,溶液的体积相同,浓度之比等于物质的量之比,所以原溶液中Mg2+、Al3+物质的量浓度之比为0.2mol:0.1mol=2:1;
(2)
0~A发生Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,A~B发生Al(OH)3+OH-=AlO+2H2O,则线段OA对应的NaOH的物质的量为0.4mol+0.3mol=0.7mol,线段AB对应的NaOH的物质的量为0.1mol,所以线段OA:AB=0.7mol:0.1mol=7:1。
18.36.25g·mol-1
先根据反应①、②计算出丁烷分解产物的总物质的量,分解过程中遵循质量守恒,则分解后气体总质量仍然为1mol丁烷的质量,然后结合M=计算最终所得混合气体的平均摩尔质量。
现有1mol丁烷,其中有36%以方式①裂解,有24%以方式②裂解,还有40%没有裂解;
发生反应①C4H10CH4+C3H6的丁烷为:1mol×36%=0.36mol,分解后气体总物质的量增大一倍,变为0.72mol;
发生反应②C4H10C2H6+C2H4的丁烷为:1mol×24%=0.24mol,分解后气体总物质的量增大一倍,变为0.48mol;
分解后气体总物质的量为:0.72mol+0.48mol+1mol×40%=1.6mol,丁烷分解过程中总质量不变,则最终所得混合气体的平均摩尔质量为:=36.25g/mol。
19. 加入氯酸钾插上镁条点燃镁条引起 Fe MgO+2HCl=MgCl2+H2O Fe2O3+6HCl=2FeCl3+3H2O Fe+2H+=Fe2++H2↑ Fe+2Fe3+=3Fe2+ 0.67mol/L 2.33mol/L
①铝热反应的本质是置换反应,金属性Al>Fe,所以发生Al与Fe2O3反应,置换出铁,即B为Fe;
②MgO与盐酸反应生成氯化镁与水,Fe2O3与盐酸反应生成氯化铁与水,溶液C中含有MgCl2、FeCl3;
③单质B和溶液C反应,放出1.12L(标准状况)气体,该气体为氢气,说明②中盐酸过量,溶液C为MgCl2、FeCl3、HCl混合溶液,反应同时生成溶液D,还残留有固体物质B,说明Fe有剩余,结合④用KSCN溶液检验时,溶液D不变色,说明D溶液不含铁离子,则D中溶质为MgCl2、FeCl2,据此分析解答。
(1)①中引发铝热反应的操作为:加少量KClO3,插上镁条并将其点燃;产物中的单质B是Fe,故答案为:加少量KClO3,插上镁条并将其点燃;Fe;
(2)氧化镁与盐酸反应生成氯化镁与水,氧化铁与盐酸反应生成氯化铁与水,②中所发生反应的化学方程式为:MgO+2HCl=MgCl2+H2O、Fe2O3+6HCl=2FeCl3+3H2O,故答案为:MgO+2HCl=MgCl2+H2O、Fe2O3+6HCl=2FeCl3+3H2O;
(3)Fe与盐酸反应生成氯化亚铁与氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑,铁与氯化铁反应生成氯化亚铁,反应的离子方程式为Fe+2Fe3+=3Fe2+,故答案为:Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;
(4)令MgO和Fe2O3的物质的量分别为xmol、ymol,则40x+160y=20,溶液C为MgCl2、FeCl3、HCl混合溶液,加入铁粉后生成的氢气为=0.05mol,根据氯元素守恒,2x+3×2y+0.05×2=0.15×6,解得:x=0.1,y=0.1;n(Mg2+)=n(MgO)=0.1mol,所以c(Mg2+)==0.67mol/L;溶液D为MgCl2、FeCl2的混合溶液,根据电荷守恒溶液中2c(Mg2+)+2c(Fe2+)=c(Cl-),所以2×0.67mol/L+2c(Fe2+)=6mol/L,解得c(Fe2+)=2.33mol/L,故答案为:0.67mol/L;2.33mol/L。
20.(1) Fe Al2O3 H2
(2)
(3)Fe2+
(4)Fe2O3+2AlAl2O3+2Fe
溶液E和氨水、空气反应生成红褐色沉淀,红褐色沉淀是氢氧化铁,则E是亚铁盐;单质C和稀酸L反应生成溶液E和单质F,E是亚铁盐,金属和酸反应生成盐,所以C是铁;沉淀J和强碱反应,则J是氢氧化铝,I和氨水反应生成氢氧化铝,所以I是铝盐;氢氧化铝和强碱反应生成溶液K,氢氧化铝和强碱反应生成偏铝酸盐,所以K是偏铝酸盐,单质B和强碱反应生成偏铝酸盐和氢气,则B是金属铝,F是氢气;化合物A和铝反应生成铁和化合物D,根据铝热反应知,A是铁的氧化物,D是氧化铝;高温条件下,氧化铝和熔融的氢氧化钠反应生成盐,K是偏铝酸钠。据此分析解题。
(1)通过以上分析知,C是Fe,D是Al2O3,F是H2,故答案为Fe;Al2O3;H2。
(2)I是铝盐,与氨水反应生成J(氢氧化铝),反应的离子方程式为,故答案为:。
(3)单质C为Fe,铁与稀酸反应生成硫酸亚铁和氢气,所以E中所含金属离子Fe2+,故答案为Fe2+。
(4)铝与氧化铁发生铝热反应,化学方程式为:Fe2O3+2AlAl2O3+2Fe,
故答案为Fe2O3+2AlAl2O3+2Fe。
21. 第三周期 ⅢA族 2Al+Fe2O3Al2O3+2Fe 大于 2C+SiO2Si+2CO↑ 1:2 2Mg+CO22MgO+C 非极性 离子键
试题分析:⑴ 若A、C均为生活中常见金属,B 为红棕色固体,B是氧化铁;D既能与盐酸,又能与氢氧化钠,D具有两性,D是氧化铝;A、C均为常见的单质,A + B→C + D,A的活泼性大于C,所以A是铝、C是铁。
⑵B是一种不溶于水的酸性氧化物,B是 ,A、C分别是由原子序数相差8的非金属元素组成的固体单质,A + B→C + D,则A是碳单质、C是Si,D是CO;
⑶ 若组成A单质的元素可形成带两个单位正电荷的阳离子,且具有与氖原子相同的电
子层结构,则A是Mg; C为黑色固态单质,C是碳单质,D是氧化镁、B是CO2;
解析:根据以上分析,⑴ A是铝、C是铁,若A、C均为生活中常见金属,B 为红棕色固体,B是氧化铁;D既能与盐酸,又能与氢氧化钠,D具有两性,D是氧化铝;A、C均为常见的单质,A + B→C + D,A的活泼性大于C,所以A是铝、C是铁、B是氧化铁、D是氧化铝;铝单质的元素在周期表中的位置为第三周期 ⅢA族;该反应
的化学方程式:2Al+Fe2O3Al2O3+2Fe;该反应放热,所以A和B所具有的总能量大于C和D所具有的总能量。
⑵B是 ,A、C分别是由原子序数相差8的非金属元素组成的固体单质,A + B→C + D,则A是碳单质、B是、C是Si,D是CO;该反应的化学方程式:2C+SiO2Si+2CO↑,
则该反应中氧化剂是、还原剂是C,物质的量之比为1:2;
⑶
A是Mg; C为黑色固态单质,C是碳单质,D是氧化镁、B是CO2;反应的化学方程式是2Mg+CO22MgO+C,CO2分子是直线型,结构对称为非极性分子,氧化镁是离子化合物,存在离子键。
点睛:金属镁在CO2能燃烧生成氧化镁和碳,所以金属镁着火后要用沙土盖灭,不能用干冰灭火器灭火。
22. Fe2O3 NaAlO2 Al(OH)3 Fe(OH)3 Al2O3+2OH-=2AlO2-+H2O 4Fe(OH)2+O2+2H2O = 4Fe(OH)3 16g 6.5mol/L
(1)A是一种红棕色金属氧化物,所以是三氧化二铁,和金属B在高温下发生铝热反应,生成的C为铝的氧化物,既能和酸反应又能和碱反应,白色沉淀在空气中变成红褐色沉淀,一定是氢氧化亚铁和氢氧化铁之间的转换,所以G是氢氧化铁,F是氢氧化亚铁,根据物质的性质可推断得,E是氯化亚铁,D是金属铁,J是一种难溶于水的白色化合物为氢氧化铝,则金属B是铝,H是氯化铝,I是偏铝酸钠,根据铁及化合物以及铝及化合物的有关性质来回答。
(2)根据氧化铝、氢氧化铁的性质写出相应的方程式;
(3)A和C为Fe2O3 和Al2O3的混合物,溶于100mL稀硫酸中,生成铁离子和铝离子;根据图象可知,加入氢氧化钠溶液后,没有沉淀生成,说明硫酸溶解氧化铝、氧化铁后硫酸有剩余;随着碱量的增加,沉淀逐渐增多,达到最大值,碱过量,氢氧化铝溶解,氢氧化铁不溶解,先根据溶解的氢氧化铝计算出氢氧化钠的浓度,然后再根据生成沉淀量最大时,溶液中存在的2n(Na2SO4)=n(NaOH)关系,找到n(H2SO4)= n(Na2SO4)关系,从而计算出硫酸的浓度。
A是一种红棕色金属氧化物,所以是三氧化二铁,和金属B在高温下发生铝热反应,生成的C为铝的氧化物,既能和酸反应又能和碱反应,白色沉淀在空气中变成红褐色沉淀,一定是氢氧化亚铁和氢氧化铁之间的转换,所以G是氢氧化铁,F是氢氧化亚铁,根据物质的性质可推断得,E是氯化亚铁,D是金属铁,J是一种难溶于水的白色化合物为氢氧化铝,则金属B是铝,H是氯化铝,I是偏铝酸钠;
(1)根据上面的分析可以知道,则A为Fe2O3, I是NaAlO2,J是Al(OH)3,G是Fe(OH)3;
因此,本题正确答案是: Fe2O3; NaAlO2;Al(OH)3 ;Fe(OH)3。
(2) 氧化铝是两性氧化物,氧化铝在氢氧化钠溶液中反应生成偏铝酸钠和水,C→I的离子方程式:Al2O3+2OH-=2AlO2-+H2O;综上所述,本题答案是:Al2O3+2OH-=2AlO2-+H2O。
氢氧化亚铁与氧气、水共同作用生成氢氧化铁,F→G的化学方程式:4Fe(OH)2+O2+2H2O = 4Fe(OH)3 ;综上所述,本题答案是:4Fe(OH)2+O2+2H2O = 4Fe(OH)3。
(3) A和C为Fe2O3 和Al2O3的混合物,溶于100mL稀硫酸中,生成铁离子和铝离子;根据图象可知,加入氢氧化钠溶液后,没有沉淀生成,说明硫酸溶解氧化铝、氧化铁后硫酸有剩余;随着碱量的增加,沉淀逐渐增多,达到最大值,碱过量,氢氧化铝溶解,氢氧化铁不溶解,
①根据21.4g沉淀的质量是氢氧化铁的质量,氢氧化铁物质的量是21.4/107=0.2mol,根据铁元素守恒,所以氧化铁的物质的量是0.1mol, Fe2O3的质量是0.1×160=16g;
因此,本题正确答案是16。
②从260-300mL,NaOH溶解Al(OH)3,发生反应:NaOH+Al(OH)3=NaAlO2+2H2O,氢氧化铝的质量是:37-21.4=15.6g,即0.2mol,消耗NaOH为0.2mol,所以氢氧化钠的浓度0.2/0.04=5mol/L;当V(NaOH)=260mL时,沉淀量最大,此时沉淀为Fe(OH)3和Al(OH)3,溶液中溶质为Na2SO4;根据钠元素守恒:2n(Na2SO4)=n(NaOH),n(Na2SO4)=0.5n(NaOH)=0.5×0.26×5=0.65mol;根据硫酸根离子守恒:n(H2SO4)= n(Na2SO4)=0.65mol,则c(H2SO4)=0.65/0.1=6.5mol/L;
综上所述,本题答案是:6.5mol/L
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
