1.1物质的分类及转化同步练习题(含解析)高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1物质的分类及转化同步练习题(含解析)高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 431.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-25 16:13:11 | ||
图片预览




文档简介
1.1 物质的分类及转化 同步练习题
一、选择题
1.化学与生产、生活、环境等密切相关。下列说法错误的是
A.盐酸、食醋、碘酒都是混合物
B.食品包装袋中常有一个内盛硅胶或生石灰或铁粉的小纸袋,它们的作用相同
C.复方氢氧化铝片可做抗酸药
D.大量排放二氧化碳气体可导致温室效应
2.下列物质中,属于碱性氧化物的是
A.SO2 B.CO C.Na2O D.Ca(OH)2
3.海洋中有丰富的水生生物和化学资源。海水晒盐后,以其母液(卤水)和贝壳为原料,还可以生产一种具有特殊用途的材料——纳米氧化镁,其简要流程如下:
下列说法正确的是;
A.步骤I的煅烧可在表面皿中直接进行
B.纳米MgO溶于水后形成的分散系可产生丁达尔效应
C.步骤II中发生反应的离子方程式为
D.滤液中含有的微粒仅为和
4.下列关于胶体的叙述中,不正确的是
A.胶体可用于净水,能吸附水中的悬浮物质而沉降
B.浊液、胶体、溶液的本质区别是分散质粒子的直径大小
C.利用丁达尔效应可以区别溶液和胶体
D.胶体制备:将饱和氯化铁滴入沸水中,同时不断搅拌,液体呈红褐色立即停止加热
5.下列有关物质分类的说法,不正确的是
A.H2SO3是含氧酸、二元酸,也是强酸
B.N2O5、SO2是非金属氧化物,也是酸性氧化物
C.KNO3是钾盐、硝酸盐,也是正盐
D.NaOH是可溶性碱,也是强碱
6.下列物质的分类合理的是
A.酸性氧化物:CO2、SiO2、SO2、Cl2O7
B.碱:烧碱、纯碱、苛性钾、氢氧化钡
C.混合物:盐酸、漂白粉、水银、氢氧化铁胶体
D.碱性氧化物:Na2O、CaO、MgO、Al2O3
7.虎年春晚一段舞蹈诗剧《只此青绿》惊艳了许多观众,生动还原了北宋名画《千里江山图》,此画用到了一种矿物颜料——石青[2CuCO3 Cu(OH)2],以下说法不正确的是
A.该颜料难溶于水
B.石青与盐酸反应的化学方程式为2CuCO3 Cu(OH)2+8HCl=4CuCl2+4H2O+CO2↑
C.石青加热分解能得到一种黑色固体
D.石青颜料除了色彩鲜艳,在常温下较稳定,也是历史上名家大作喜爱的原因
8.氧气的分子式是
A. B. C. D.
9.下列物质的化学式与其俗称相符的是
A.铜绿: B.石膏:
C.胆矾: D.火碱:
10.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将FeSO4和Fe2(SO4)3溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子的直径为5.5~36nm的磁流体。下列说法中正确的是
A.该磁流体是一种纯净物
B.用一束光照射该“磁流体”分散在蒸馏水中形成的分散系,会出现丁达尔效应
C.该分散质粒子不能透过滤纸
D.该分散系的分散质为Fe(OH)3
11.下列关于胶体的认识错误的是
A.清晨在密林中看到的一缕缕光束,是丁达尔效应的表现
B.胶体与溶液的本质区别是能够产生丁达尔效应
C.向沸水中加入饱和FeCl3溶液并加热至液体呈透明的红褐色,可得氢氧化铁胶体
D.形成胶体的分散系可以是固体
12.下列物质的分类正确的是
选项 碱 酸 盐 酸性氧化物
A K2CO3 H3PO4 Cu2(OH)2CO3 CO2
B KOH HCl NaCl CO
C Fe(OH)3 NaHSO4 MgCl2 SO2
D NaOH H2CO3 Na2SO4 Mn2O7
A.A B.B C.C D.D
13.推理和归纳是化学学习和研究中常用的思维方法,下列推理正确的是
A.稀有气体可做保护气,可做保护气的一定是稀有气体
B.单质是由一种元素组成的纯净物,由一种元素组成的纯净物一定是单质
C.性质活泼的金属能与稀盐酸反应生成气体,能跟稀盐酸反应产生气体的物质一定是金属
D.有机化合物是含碳元素的化合物,含碳元素的化合物一定是有机化合物
14.下列关于物质分类的正确组合是
碱 酸 盐 碱性氧化物 酸性氧化物
A 纯碱 硫酸 小苏打 氧化钙 干冰
B 烧碱 盐酸 食盐 氧化钠 一氧化碳
C 石灰水 碳酸钙 过氧化钠 二氧化硫
D HNO3 Na2SiO3 氧化铁 三氧化硫
A.A B.B C.C D.D
15.分类是认识和研究物质的一种常用的科学方法,下列有关物质的分类,正确的是
选项 类别 物质
A 纯净物 液氯、胆矾、漂白粉
B 合金 不锈钢、石墨、硬铝
C 碱性氧化物 Al2O3、Na2O2、Fe2O3
D 胶体 豆浆、雾、有色玻璃
A.A B.B C.C D.D
二、填空题
16.取一定量粉末加入适量某浓度的盐酸中,得到呈棕黄色的饱和溶液,利用此溶液进行系列实验。完成下列填空:
(1)在小烧杯甲中加入25mL蒸馏水,加热至沸腾后,向沸水中加入2mL该溶液,继续煮沸至溶液呈_______色,即可制得胶体,反应的化学方程式为_______。
(2)另取一小烧杯乙加入25mL蒸馏水,然后再加入2mL该溶液,振荡均匀,将乙烧杯与另一盛有胶体的丙烧杯一起放置在暗处,分别用红色激光笔照射烧杯中的液体,可以看到_______填“乙”或“丙”)烧杯中产生丁达尔效应。
(3)取丙烧杯中的少量胶体置于试管乙中,向试管乙中滴加一定量的稀盐酸,边滴加边振荡直至过量,在此过程中可看到试管乙中现象是_______。
(4)胶体区别于溶液最本质的特征是_______。
A.胶体粒子的直径在1~100nm之间
B.胶体具有丁达尔效应
C.胶体的分散质能透过滤纸
D.胶体是均一的分散系
17.阅读下面的一段文字,用相关物质前的序号数字回答有关问题。
燃料电池是一种化学电池,具有能量转化率高、对环境友好等优点。例如,氢氧燃料电池在工作时,从负极连续通入①,从正极连续通入②,二者在电池内部(含③或④KOH等物质的溶液)发生反应生成⑤,同时产生电能。除了,⑥、⑦等也可以作为燃料电池的燃料。目前已研制成功⑧Al-⑨空气燃料电池,它可以替代⑩汽油为汽车提供动力,也可以用作照明电源等。
在上述标有序号的物质中属于混合物的有___________,属于氧化物的有___________,属于酸的是___________,属于碱的是___________,属于有机物的有___________,属于单质的有___________。
18.现有下列物质:①CaO ②CO2③Na2O ④CO ⑤SO2。其中,属于酸性氧化物的有___________,属于碱性氧化物的有___________。
三、元素或物质推断题
19.A—J都是初中化学常用的物质。其中B、E、H、J是单质,其余均为化合物,气体C可用于灭火。它们相互间的转化关系如下图所示(部分反应物、生成物及反应条件已略去)。
请回答下列问题:
⑴写出物质D、J的化学式:D___________,J___________。
⑵“气体C→B”的转化过程,在自然界中称为____________作用。
⑶反应①的反应条件___________,其基本反应类型___________。
⑷写出反应②的化学方程式:______________________。
⑸若要实现“H+I→红色固体J”的转化,物质I必须满足的条件是___________。
四、实验题
20.Ⅰ 某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质.
(1)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备。
①甲同学的操作是:取一小烧杯,加入25mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。
②乙向饱和FeCl3溶液直接加入过量的NaOH溶液。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟。
你认为哪位同学的制备方法正确:_______,发生的化学方程式是______________。
(2)Fe(OH)3胶体稳定存在的主要原因是_____。
A.胶粒小,不受重力作用 B.胶粒带同种电荷
C.胶体具有丁达尔效应 D.胶粒能透过滤纸
(3)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________________________。
A.Fe(OH)3胶体粒子的直径在1~100nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
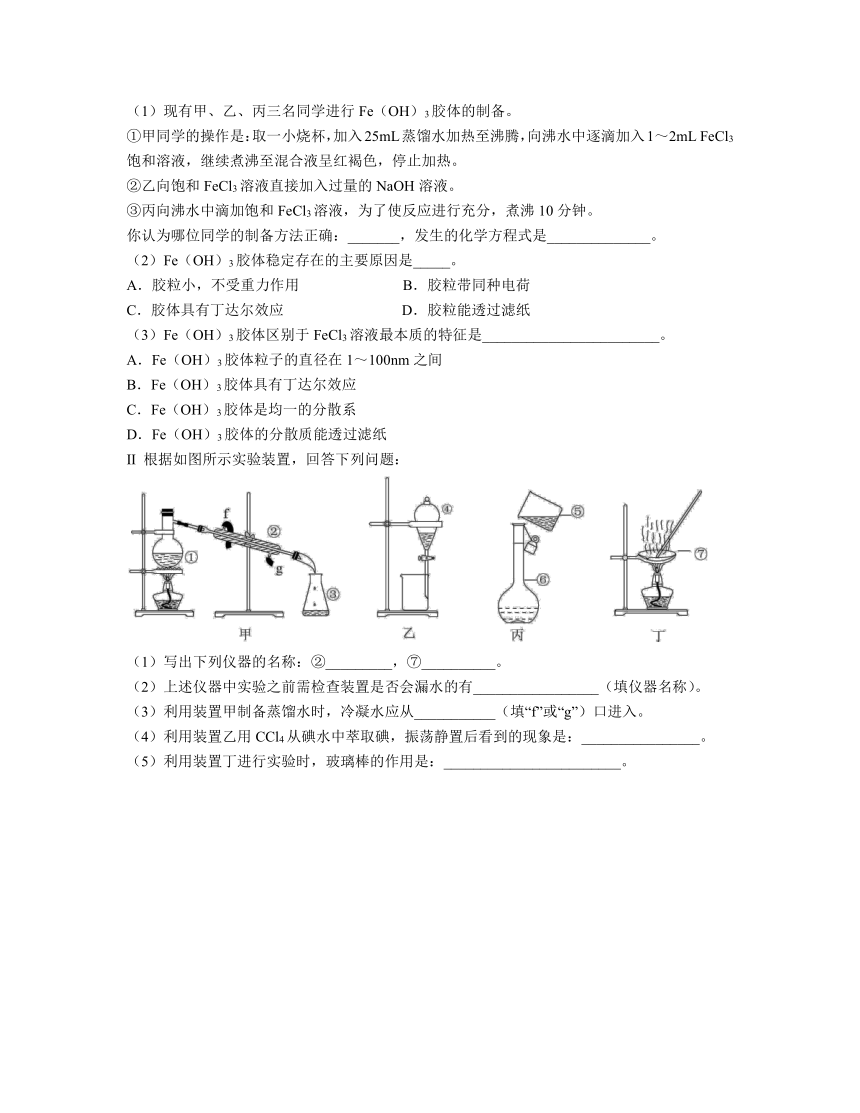
Ⅱ 根据如图所示实验装置,回答下列问题:
(1)写出下列仪器的名称:②_________,⑦__________。
(2)上述仪器中实验之前需检查装置是否会漏水的有_________________(填仪器名称)。
(3)利用装置甲制备蒸馏水时,冷凝水应从___________(填“f”或“g”)口进入。
(4)利用装置乙用CCl4从碘水中萃取碘,振荡静置后看到的现象是:________________。
(5)利用装置丁进行实验时,玻璃棒的作用是:________________________。
【参考答案】
一、选择题
1.B
解析:A.盐酸主要成分是HCl和H2O,食醋中主要成分是醋酸和水,碘酒主要成分为碘单质和酒精,均属混合物,A正确;
B.硅胶或生石灰为干燥剂,铁粉为抗氧化剂,作用不同,B错误;
C.氢氧化铝可与胃酸反应,可用作抗酸药,C正确;
D.大量的二氧化碳排放到空气中可导致温室效应,D正确;
故选B。
2.C
解析:A.SO2溶于水反应产生H2SO3,因此SO2属于酸性氧化物,A不符合题意;
B.CO不能与酸、碱反应产生盐和水,CO属于不成盐氧化物,B不符合题意;
C.Na2O溶于水,与水反应产生碱NaOH,因此Na2O属于碱性氧化物,C符合题意;
D.Ca(OH)2溶于水或受热熔化时电离产生Ca2+、OH-,因此Ca(OH)2属于碱,D不符合题意;
故合理选项是C。
3.C
【分析】煅烧石灰石生成氧化钙和二氧化碳,氧化钙溶于水生成氢氧化钙,石灰乳加入卤水中沉淀镁离子生成氢氧化镁沉淀,氢氧化镁经一系列处理得到纳米氧化镁,据此解答。
解析:A.固体灼烧应该在坩埚中进行,因此步骤I的煅烧不能在表面皿中直接进行,A错误;
B.纳米MgO的微粒直径超过100nm,溶于水后形成的分散系不是胶体,不能产生丁达尔效应,B错误;
C.步骤II沉淀镁离子,其中发生反应的离子方程式为,C正确;
D.滤液中含有的微粒主要为和,还含有少量镁离子等,D错误;
答案选C。
4.D
解析:A.胶体能吸附水中的悬浮物质而沉降,因此胶体可用于净水,故A正确;
B.浊液、胶体、溶液的本质区别是分散质粒子的直径大小,小于1nm的为溶液,1nm~100nm之间的为胶体,大于100nm的为浊液,故B正确;
C.胶体具有丁达尔效应,而溶液没有丁达尔效应,因此利用丁达尔效应可以区别溶液和胶体,故C正确;
D.胶体制备:将饱和氯化铁滴入沸水中,待液体呈红褐色立即停止加热,制备过程中不能搅拌,故D错误。
综上所述,答案为D。
5.A
解析:A.H2SO3中含有氧元素,属于含氧酸,水溶液中可以电离出2个H离子,属于二元酸,但不能完全电离,属于弱酸,A错误;
B.N2O5、SO2是非金属氧化物,与碱反应只生成盐,属于酸性氧化物,B正确;
C.KNO3只含金属阳离子和酸根阴离子,属于正盐,含有钾离子属于钾盐,含有硝酸根属于硝酸盐,故C正确;
D.NaOH电离出的阴离子全部为氢氧根,属于碱,可溶于水,属于可溶性碱,且在水溶液中完全电离,属于强碱,故D正确;
故答案为:A。
6.A
解析:A.能与碱反应生成盐和水的氧化物是酸性氧化物,CO2、SiO2、SO2、Cl2O7均是是酸性氧化物,A符合;
B.碱是指溶于水电离出的阴离子全部是氢氧根离子的化合物,烧碱、苛性钾、氢氧化钡均是碱,纯碱是碳酸钠,属于盐,B不符合;
C.由两种或两种以上物质组成的是混合物,盐酸、漂白粉、氢氧化铁胶体均是混合物,水银是金属单质,属于纯净物,C不符合;
D.能与酸反应生成盐和水的氧化物是碱性氧化物,Na2O、CaO、MgO均是碱性氧化物,Al2O3是两性氧化物,D不符合;
答案选A。
7.B
解析:A.该颜料中CuCO3和Cu(OH)2均难溶于水,故A正确;
B.石青与盐酸反应的化学方程式为2CuCO3·Cu(OH)2+6HCl===3CuCl2+4H2O+2CO2↑,故B错误;
C.CuCO3和Cu(OH)2受热分解均可得到黑色固体CuO,故石青加热分解能得到黑色固体,故C正确;
D.石青[2CuCO3·Cu(OH)2]在常温下较稳定,是历史上名家大作喜爱的原因,故D正确;
答案选B。
8.B
解析:A.NO2是二氧化氮的分子式,故不选A;
B.O2是氧气的分子式,故选B;
C.ClO2是二氧化氯的分子式,故不选C;
D.H2O是水的分子式,故不选D;
故选B。
9.C
解析:A. 铜绿是碱式碳酸铜,化学式为Cu2(OH)2CO3,选项A错误;
B.天然二水石膏(CaSO4·2H2O)又称为生石膏,经过煅烧、磨细可得β型半水石膏(2CaSO4·H2O),即建筑石膏,又称熟石膏,选项B错误;
C. 胆矾也叫蓝矾,是五水硫酸铜,化学式为CuSO4 5H2O,选项C正确;
D. 烧碱是氢氧化钠,化学式为NaOH,选项D错误;
答案选C。
10.B
【分析】磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将含等量FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子的直径在5.5~36nm之间的磁流体,磁流体形成的分散系为胶体。
解析:A. 磁流体形成的分散系为胶体,该磁流体是一种混合物,故A错误;
B. 磁流体形成的分散系为胶体,用一束光照射该“磁流体”分散在蒸馏水中形成的分散系,会出现丁达尔效应,故B正确;
C. 滤纸的孔隙大于100nm,该分散质粒子能透过滤纸,故C错误;
D. 所得的分散系中分散质为Fe3O4,不仅有磁性而且是黑色,故D错误;
故选B。
11.B
解析:A.大气是胶体,当阳光透过大气时,会形成一缕缕光束,是胶体的丁达尔效应,和胶体的性质有关,故A正确;
B.胶体和其它分散系的本质区别是分散质粒子直径的大小,其中胶体粒子的直径大小在1-100nm之间,丁达尔效应可以区分胶体和溶液,故B错误;
C.向沸水中逐滴加入饱和溶液,继续煮沸至溶液呈红褐色,停止加热,得到氢氧化铁胶体,其反应为,故C正确;
D.胶体分为气溶胶、液溶胶、固溶胶,所以形成胶体的分散系可以是固体,如琼脂,故D正确;
故选B。
12.D
解析:A.K2CO3由金属阳离子K+与酸根阴离子构成,属于盐,A错误;
B.CO是不成盐氧化物,B错误;
C.NaHSO4由金属阳离子Na+与酸根阴离子为构成,属于盐类,不属于酸,C错误;
D.选项各种物质符合物质的分类标准,D正确;
故合理选项是D。
13.B
解析:A.稀有气体可做保护气,可做保护气的不一定是稀有气体,如N2,A错误;
B.单质是由一种元素组成的纯净物,由一种元素组成的纯净物一定是单质,B正确;
C.性质活泼的金属能与稀盐酸反应生成气体,能跟稀盐酸反应产生气体的物质不一定是金属,如碳酸钙和稀盐酸反应生成CO2,C错误;
D.有机化合物是含碳元素的化合物,含碳元素的化合物不一定是有机化合物,如CO、CO2、碳酸盐等属于无机物,D错误;
故选B。
14.D
解析:A.纯碱是碳酸钠,属于盐,故A错误;
B.一氧化碳既不是酸性氧化物又不是碱性氧化物,故B错误;
C.是盐、过氧化钠是过氧化物,故C错误;
D.电离出的阴离子全是氢氧根离子,是碱;HNO3是含氧酸;Na2SiO3是硅酸盐;氧化铁与盐酸反应生成氯化铁和水,氧化铁是碱性氧化物;三氧化硫和氢氧化钠反应生成硫酸钠和水,三氧化硫是酸性氧化物,故D正确;
选D。
15.D
解析:A.漂白粉主要成分是次氯酸钙和氯化钙,属于混合物,不是纯净物,故A错误;
B.石墨是由碳元素形成的单质,不属于合金,故B错误;
C.Al2O3是两性氧化物,Na2O2是过氧化物,不是碱性氧化物,故C错误;
D.豆浆是液溶胶、雾是气溶胶、有色玻璃是固溶胶,都属于胶体,故D正确;
答案选D。
二、填空题
16.(1) 红褐色 胶体
(2)丙
(3)开始产生红褐色沉淀,后来沉淀逐渐溶解,形成棕黄色溶液
(4)A
【分析】Fe2O3与盐酸反应生成氯化铁和水;FeCl3溶液中滴入NaOH溶液生成氢氧化铁沉淀和氯化钠;在加热条件下,氯化铁水解生成氢氧化铁胶体;氢氧化铁胶体中加入稀硫酸,会发生聚沉,继续加入稀硫酸氢氧化铁沉淀溶解得到硫酸铁溶液;分散系本质特征是分散质微粒直径大小,分散系根据分散质粒子直径大小分为溶液、胶体和浊液。
解析:(1)在小烧杯中加入25 mL蒸馏水,加热至沸腾后,向沸水中加入2 mL FeCl3溶液,在加热条件下,氯化铁水解生成氢氧化铁胶体,溶液显红褐色(或红棕色),反应的化学方程式为;
(2)分别用红色激光笔照射烧杯中的液体,可以看到丙烧杯中产生丁达尔效应,丁达尔效应能区分胶体和溶液;
(3)取丙烧杯中的少量Fe(OH)3胶体置于试管乙中,向试管乙中滴加一定量的稀硫酸,边滴加边振荡,在此过程中可看到试管乙中生成的红褐色沉淀逐渐溶解,最终又得到棕黄色的溶液;
(4)胶体区别于其他分散系的本质特征是分散质微粒直径的大小不同,胶体的分散质微粒直径介于1~ 100nm之间,故答案为A。
17. ⑨⑩ ⑤ ③ ④ ⑥⑦ ①②⑧
解析:属于混合物是空气和汽油,即⑨⑩;氧化物是两种元素组成的化合物,其中一种元素是氧元素,因此符合氧化物定义的是H2O,即⑤;酸:电离的出的阳离子全部是H+的化合物,属于酸的是H2SO4,即③;碱:电离出的阴离子全部是OH-的化合物,属于碱的是KOH,即④;有机物是含碳的化合物,属于有机物的是CH4、C2H5OH,即⑥⑦;属于单质的是H2、O2、Al,即①②⑧;故答案为⑨⑩;⑤;③;④;⑥⑦;①②⑧。
18.②⑤ ①③
解析:②CO2、⑤SO2均可以与等碱溶液反应发生盐和水,故属于酸性氧化物;①CaO 、③Na2O均可以与酸溶液反应发生盐和水,故属于碱性氧化物;CO既不能与酸反应,又不能与碱反应,所以既不是酸性氧化物又不是碱性氧化物。则属于酸性氧化物的有②⑤,属于碱性氧化物的有①③。
三、元素或物质推断题
19. CaCO3 Cu 光合 点燃 化合反应 C + CO2 2CO 可溶性铜盐
【分析】根据A-J都是初中化学常见的物质,B、E、H、J是单质,其余均为化合物,气体C可用于灭火,所以C是二氧化碳,二氧化碳和氢氧化钙会生成碳酸钙沉淀和水,所以D是碳酸钙,二氧化碳和碳高温会生成一氧化碳,所以E是木炭,F是一氧化碳,一氧化碳和G生成的会转化成红色固体J,所以G是氧化铁,H是铁,I可以是硫酸铜,J是铜,铁和B会生成黑色固体A,所以B是氧气,A是四氧化三铁,然后将推出的物质进行验证即可。
解析:根据上述分析可知,
(1)D是CaCO3,J是Cu,故答案为CaCO3;Cu;
(2)“气体C→B”的转化过程是二氧化碳转化成氧气,在自然界中称为光合作用,故答案为光合;
(3)反应①是铁和氧气在点燃的条件下生成四氧化三铁,反应条件是点燃,该反应满足化合反应多变一的条件,属于化合反应,故答案为点燃;化合反应;
(4)反应②是二氧化碳和木炭在高温的条件下生成一氧化碳,化学方程式为:C+CO22CO;
(5)若要实现“H+I→红色固体J”的转化,物质I必领满足的条件是可溶性铜盐,故答案为可溶性铜盐。
四、实验题
20. 甲 FeCl3+ 3H2OFe(OH)3(胶体)+ 3HCl B A 冷凝管 蒸发皿 分液漏斗、容量瓶 g 上层液体无色,下层液体紫红色 受热均匀,防止液体飞溅
【分析】Ⅰ.根据胶体制备及其性质解答;
Ⅱ.根据分离提纯的操作注意事项解答。
解析:Ⅰ(1)①实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,当溶液变为红褐色时应立即停止加热,如继续加热会导致胶体聚沉,故甲正确;
②乙直接加热饱和FeCl3溶液会促进氯化铁水解,且加热促进HCl挥发,导致溶液产生沉淀现象,故乙错误;
③继续煮沸10分钟会产生沉淀,故丙错误;故答案为:甲同学;FeCl3 + 3H2O Fe(OH)3 (胶体)+ 3HCl;
(2)胶体具有很强的吸附能力,能吸附溶液中的离子而带电荷,胶粒之间相互排斥,而不易产生较大微粒而聚沉,故答案为:B;
(3)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是Fe(OH)3胶体的分散质微粒直径大小在1 ~ 100nm之间,故答案为:A;
Ⅱ(1)依据仪器的形状可知:②冷凝管;⑦蒸发皿,故答案为:冷凝管;蒸发皿;
(2)容量瓶带有瓶塞、分液漏斗带有活塞使用前应检查是否漏水,故答案为:分液漏斗、容量瓶;
(3)蒸馏时,冷凝水从冷凝管下口进入,故答案为:g;
(4)CCl4的密度比水大,且不与水互溶,所以在溶液下方,碘单质易溶于CCl4,碘的有机溶剂的颜色为紫色,故答案为:上层液体无色,下层液体紫红色;
(5)顶装置的操作是蒸发,玻璃棒的作用是:受热均匀,防止液体飞溅,故答案为:受热均匀,防止液体飞溅。
一、选择题
1.化学与生产、生活、环境等密切相关。下列说法错误的是
A.盐酸、食醋、碘酒都是混合物
B.食品包装袋中常有一个内盛硅胶或生石灰或铁粉的小纸袋,它们的作用相同
C.复方氢氧化铝片可做抗酸药
D.大量排放二氧化碳气体可导致温室效应
2.下列物质中,属于碱性氧化物的是
A.SO2 B.CO C.Na2O D.Ca(OH)2
3.海洋中有丰富的水生生物和化学资源。海水晒盐后,以其母液(卤水)和贝壳为原料,还可以生产一种具有特殊用途的材料——纳米氧化镁,其简要流程如下:
下列说法正确的是;
A.步骤I的煅烧可在表面皿中直接进行
B.纳米MgO溶于水后形成的分散系可产生丁达尔效应
C.步骤II中发生反应的离子方程式为
D.滤液中含有的微粒仅为和
4.下列关于胶体的叙述中,不正确的是
A.胶体可用于净水,能吸附水中的悬浮物质而沉降
B.浊液、胶体、溶液的本质区别是分散质粒子的直径大小
C.利用丁达尔效应可以区别溶液和胶体
D.胶体制备:将饱和氯化铁滴入沸水中,同时不断搅拌,液体呈红褐色立即停止加热
5.下列有关物质分类的说法,不正确的是
A.H2SO3是含氧酸、二元酸,也是强酸
B.N2O5、SO2是非金属氧化物,也是酸性氧化物
C.KNO3是钾盐、硝酸盐,也是正盐
D.NaOH是可溶性碱,也是强碱
6.下列物质的分类合理的是
A.酸性氧化物:CO2、SiO2、SO2、Cl2O7
B.碱:烧碱、纯碱、苛性钾、氢氧化钡
C.混合物:盐酸、漂白粉、水银、氢氧化铁胶体
D.碱性氧化物:Na2O、CaO、MgO、Al2O3
7.虎年春晚一段舞蹈诗剧《只此青绿》惊艳了许多观众,生动还原了北宋名画《千里江山图》,此画用到了一种矿物颜料——石青[2CuCO3 Cu(OH)2],以下说法不正确的是
A.该颜料难溶于水
B.石青与盐酸反应的化学方程式为2CuCO3 Cu(OH)2+8HCl=4CuCl2+4H2O+CO2↑
C.石青加热分解能得到一种黑色固体
D.石青颜料除了色彩鲜艳,在常温下较稳定,也是历史上名家大作喜爱的原因
8.氧气的分子式是
A. B. C. D.
9.下列物质的化学式与其俗称相符的是
A.铜绿: B.石膏:
C.胆矾: D.火碱:
10.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将FeSO4和Fe2(SO4)3溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子的直径为5.5~36nm的磁流体。下列说法中正确的是
A.该磁流体是一种纯净物
B.用一束光照射该“磁流体”分散在蒸馏水中形成的分散系,会出现丁达尔效应
C.该分散质粒子不能透过滤纸
D.该分散系的分散质为Fe(OH)3
11.下列关于胶体的认识错误的是
A.清晨在密林中看到的一缕缕光束,是丁达尔效应的表现
B.胶体与溶液的本质区别是能够产生丁达尔效应
C.向沸水中加入饱和FeCl3溶液并加热至液体呈透明的红褐色,可得氢氧化铁胶体
D.形成胶体的分散系可以是固体
12.下列物质的分类正确的是
选项 碱 酸 盐 酸性氧化物
A K2CO3 H3PO4 Cu2(OH)2CO3 CO2
B KOH HCl NaCl CO
C Fe(OH)3 NaHSO4 MgCl2 SO2
D NaOH H2CO3 Na2SO4 Mn2O7
A.A B.B C.C D.D
13.推理和归纳是化学学习和研究中常用的思维方法,下列推理正确的是
A.稀有气体可做保护气,可做保护气的一定是稀有气体
B.单质是由一种元素组成的纯净物,由一种元素组成的纯净物一定是单质
C.性质活泼的金属能与稀盐酸反应生成气体,能跟稀盐酸反应产生气体的物质一定是金属
D.有机化合物是含碳元素的化合物,含碳元素的化合物一定是有机化合物
14.下列关于物质分类的正确组合是
碱 酸 盐 碱性氧化物 酸性氧化物
A 纯碱 硫酸 小苏打 氧化钙 干冰
B 烧碱 盐酸 食盐 氧化钠 一氧化碳
C 石灰水 碳酸钙 过氧化钠 二氧化硫
D HNO3 Na2SiO3 氧化铁 三氧化硫
A.A B.B C.C D.D
15.分类是认识和研究物质的一种常用的科学方法,下列有关物质的分类,正确的是
选项 类别 物质
A 纯净物 液氯、胆矾、漂白粉
B 合金 不锈钢、石墨、硬铝
C 碱性氧化物 Al2O3、Na2O2、Fe2O3
D 胶体 豆浆、雾、有色玻璃
A.A B.B C.C D.D
二、填空题
16.取一定量粉末加入适量某浓度的盐酸中,得到呈棕黄色的饱和溶液,利用此溶液进行系列实验。完成下列填空:
(1)在小烧杯甲中加入25mL蒸馏水,加热至沸腾后,向沸水中加入2mL该溶液,继续煮沸至溶液呈_______色,即可制得胶体,反应的化学方程式为_______。
(2)另取一小烧杯乙加入25mL蒸馏水,然后再加入2mL该溶液,振荡均匀,将乙烧杯与另一盛有胶体的丙烧杯一起放置在暗处,分别用红色激光笔照射烧杯中的液体,可以看到_______填“乙”或“丙”)烧杯中产生丁达尔效应。
(3)取丙烧杯中的少量胶体置于试管乙中,向试管乙中滴加一定量的稀盐酸,边滴加边振荡直至过量,在此过程中可看到试管乙中现象是_______。
(4)胶体区别于溶液最本质的特征是_______。
A.胶体粒子的直径在1~100nm之间
B.胶体具有丁达尔效应
C.胶体的分散质能透过滤纸
D.胶体是均一的分散系
17.阅读下面的一段文字,用相关物质前的序号数字回答有关问题。
燃料电池是一种化学电池,具有能量转化率高、对环境友好等优点。例如,氢氧燃料电池在工作时,从负极连续通入①,从正极连续通入②,二者在电池内部(含③或④KOH等物质的溶液)发生反应生成⑤,同时产生电能。除了,⑥、⑦等也可以作为燃料电池的燃料。目前已研制成功⑧Al-⑨空气燃料电池,它可以替代⑩汽油为汽车提供动力,也可以用作照明电源等。
在上述标有序号的物质中属于混合物的有___________,属于氧化物的有___________,属于酸的是___________,属于碱的是___________,属于有机物的有___________,属于单质的有___________。
18.现有下列物质:①CaO ②CO2③Na2O ④CO ⑤SO2。其中,属于酸性氧化物的有___________,属于碱性氧化物的有___________。
三、元素或物质推断题
19.A—J都是初中化学常用的物质。其中B、E、H、J是单质,其余均为化合物,气体C可用于灭火。它们相互间的转化关系如下图所示(部分反应物、生成物及反应条件已略去)。
请回答下列问题:
⑴写出物质D、J的化学式:D___________,J___________。
⑵“气体C→B”的转化过程,在自然界中称为____________作用。
⑶反应①的反应条件___________,其基本反应类型___________。
⑷写出反应②的化学方程式:______________________。
⑸若要实现“H+I→红色固体J”的转化,物质I必须满足的条件是___________。
四、实验题
20.Ⅰ 某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质.
(1)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备。
①甲同学的操作是:取一小烧杯,加入25mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。
②乙向饱和FeCl3溶液直接加入过量的NaOH溶液。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟。
你认为哪位同学的制备方法正确:_______,发生的化学方程式是______________。
(2)Fe(OH)3胶体稳定存在的主要原因是_____。
A.胶粒小,不受重力作用 B.胶粒带同种电荷
C.胶体具有丁达尔效应 D.胶粒能透过滤纸
(3)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________________________。
A.Fe(OH)3胶体粒子的直径在1~100nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
Ⅱ 根据如图所示实验装置,回答下列问题:
(1)写出下列仪器的名称:②_________,⑦__________。
(2)上述仪器中实验之前需检查装置是否会漏水的有_________________(填仪器名称)。
(3)利用装置甲制备蒸馏水时,冷凝水应从___________(填“f”或“g”)口进入。
(4)利用装置乙用CCl4从碘水中萃取碘,振荡静置后看到的现象是:________________。
(5)利用装置丁进行实验时,玻璃棒的作用是:________________________。
【参考答案】
一、选择题
1.B
解析:A.盐酸主要成分是HCl和H2O,食醋中主要成分是醋酸和水,碘酒主要成分为碘单质和酒精,均属混合物,A正确;
B.硅胶或生石灰为干燥剂,铁粉为抗氧化剂,作用不同,B错误;
C.氢氧化铝可与胃酸反应,可用作抗酸药,C正确;
D.大量的二氧化碳排放到空气中可导致温室效应,D正确;
故选B。
2.C
解析:A.SO2溶于水反应产生H2SO3,因此SO2属于酸性氧化物,A不符合题意;
B.CO不能与酸、碱反应产生盐和水,CO属于不成盐氧化物,B不符合题意;
C.Na2O溶于水,与水反应产生碱NaOH,因此Na2O属于碱性氧化物,C符合题意;
D.Ca(OH)2溶于水或受热熔化时电离产生Ca2+、OH-,因此Ca(OH)2属于碱,D不符合题意;
故合理选项是C。
3.C
【分析】煅烧石灰石生成氧化钙和二氧化碳,氧化钙溶于水生成氢氧化钙,石灰乳加入卤水中沉淀镁离子生成氢氧化镁沉淀,氢氧化镁经一系列处理得到纳米氧化镁,据此解答。
解析:A.固体灼烧应该在坩埚中进行,因此步骤I的煅烧不能在表面皿中直接进行,A错误;
B.纳米MgO的微粒直径超过100nm,溶于水后形成的分散系不是胶体,不能产生丁达尔效应,B错误;
C.步骤II沉淀镁离子,其中发生反应的离子方程式为,C正确;
D.滤液中含有的微粒主要为和,还含有少量镁离子等,D错误;
答案选C。
4.D
解析:A.胶体能吸附水中的悬浮物质而沉降,因此胶体可用于净水,故A正确;
B.浊液、胶体、溶液的本质区别是分散质粒子的直径大小,小于1nm的为溶液,1nm~100nm之间的为胶体,大于100nm的为浊液,故B正确;
C.胶体具有丁达尔效应,而溶液没有丁达尔效应,因此利用丁达尔效应可以区别溶液和胶体,故C正确;
D.胶体制备:将饱和氯化铁滴入沸水中,待液体呈红褐色立即停止加热,制备过程中不能搅拌,故D错误。
综上所述,答案为D。
5.A
解析:A.H2SO3中含有氧元素,属于含氧酸,水溶液中可以电离出2个H离子,属于二元酸,但不能完全电离,属于弱酸,A错误;
B.N2O5、SO2是非金属氧化物,与碱反应只生成盐,属于酸性氧化物,B正确;
C.KNO3只含金属阳离子和酸根阴离子,属于正盐,含有钾离子属于钾盐,含有硝酸根属于硝酸盐,故C正确;
D.NaOH电离出的阴离子全部为氢氧根,属于碱,可溶于水,属于可溶性碱,且在水溶液中完全电离,属于强碱,故D正确;
故答案为:A。
6.A
解析:A.能与碱反应生成盐和水的氧化物是酸性氧化物,CO2、SiO2、SO2、Cl2O7均是是酸性氧化物,A符合;
B.碱是指溶于水电离出的阴离子全部是氢氧根离子的化合物,烧碱、苛性钾、氢氧化钡均是碱,纯碱是碳酸钠,属于盐,B不符合;
C.由两种或两种以上物质组成的是混合物,盐酸、漂白粉、氢氧化铁胶体均是混合物,水银是金属单质,属于纯净物,C不符合;
D.能与酸反应生成盐和水的氧化物是碱性氧化物,Na2O、CaO、MgO均是碱性氧化物,Al2O3是两性氧化物,D不符合;
答案选A。
7.B
解析:A.该颜料中CuCO3和Cu(OH)2均难溶于水,故A正确;
B.石青与盐酸反应的化学方程式为2CuCO3·Cu(OH)2+6HCl===3CuCl2+4H2O+2CO2↑,故B错误;
C.CuCO3和Cu(OH)2受热分解均可得到黑色固体CuO,故石青加热分解能得到黑色固体,故C正确;
D.石青[2CuCO3·Cu(OH)2]在常温下较稳定,是历史上名家大作喜爱的原因,故D正确;
答案选B。
8.B
解析:A.NO2是二氧化氮的分子式,故不选A;
B.O2是氧气的分子式,故选B;
C.ClO2是二氧化氯的分子式,故不选C;
D.H2O是水的分子式,故不选D;
故选B。
9.C
解析:A. 铜绿是碱式碳酸铜,化学式为Cu2(OH)2CO3,选项A错误;
B.天然二水石膏(CaSO4·2H2O)又称为生石膏,经过煅烧、磨细可得β型半水石膏(2CaSO4·H2O),即建筑石膏,又称熟石膏,选项B错误;
C. 胆矾也叫蓝矾,是五水硫酸铜,化学式为CuSO4 5H2O,选项C正确;
D. 烧碱是氢氧化钠,化学式为NaOH,选项D错误;
答案选C。
10.B
【分析】磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将含等量FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子的直径在5.5~36nm之间的磁流体,磁流体形成的分散系为胶体。
解析:A. 磁流体形成的分散系为胶体,该磁流体是一种混合物,故A错误;
B. 磁流体形成的分散系为胶体,用一束光照射该“磁流体”分散在蒸馏水中形成的分散系,会出现丁达尔效应,故B正确;
C. 滤纸的孔隙大于100nm,该分散质粒子能透过滤纸,故C错误;
D. 所得的分散系中分散质为Fe3O4,不仅有磁性而且是黑色,故D错误;
故选B。
11.B
解析:A.大气是胶体,当阳光透过大气时,会形成一缕缕光束,是胶体的丁达尔效应,和胶体的性质有关,故A正确;
B.胶体和其它分散系的本质区别是分散质粒子直径的大小,其中胶体粒子的直径大小在1-100nm之间,丁达尔效应可以区分胶体和溶液,故B错误;
C.向沸水中逐滴加入饱和溶液,继续煮沸至溶液呈红褐色,停止加热,得到氢氧化铁胶体,其反应为,故C正确;
D.胶体分为气溶胶、液溶胶、固溶胶,所以形成胶体的分散系可以是固体,如琼脂,故D正确;
故选B。
12.D
解析:A.K2CO3由金属阳离子K+与酸根阴离子构成,属于盐,A错误;
B.CO是不成盐氧化物,B错误;
C.NaHSO4由金属阳离子Na+与酸根阴离子为构成,属于盐类,不属于酸,C错误;
D.选项各种物质符合物质的分类标准,D正确;
故合理选项是D。
13.B
解析:A.稀有气体可做保护气,可做保护气的不一定是稀有气体,如N2,A错误;
B.单质是由一种元素组成的纯净物,由一种元素组成的纯净物一定是单质,B正确;
C.性质活泼的金属能与稀盐酸反应生成气体,能跟稀盐酸反应产生气体的物质不一定是金属,如碳酸钙和稀盐酸反应生成CO2,C错误;
D.有机化合物是含碳元素的化合物,含碳元素的化合物不一定是有机化合物,如CO、CO2、碳酸盐等属于无机物,D错误;
故选B。
14.D
解析:A.纯碱是碳酸钠,属于盐,故A错误;
B.一氧化碳既不是酸性氧化物又不是碱性氧化物,故B错误;
C.是盐、过氧化钠是过氧化物,故C错误;
D.电离出的阴离子全是氢氧根离子,是碱;HNO3是含氧酸;Na2SiO3是硅酸盐;氧化铁与盐酸反应生成氯化铁和水,氧化铁是碱性氧化物;三氧化硫和氢氧化钠反应生成硫酸钠和水,三氧化硫是酸性氧化物,故D正确;
选D。
15.D
解析:A.漂白粉主要成分是次氯酸钙和氯化钙,属于混合物,不是纯净物,故A错误;
B.石墨是由碳元素形成的单质,不属于合金,故B错误;
C.Al2O3是两性氧化物,Na2O2是过氧化物,不是碱性氧化物,故C错误;
D.豆浆是液溶胶、雾是气溶胶、有色玻璃是固溶胶,都属于胶体,故D正确;
答案选D。
二、填空题
16.(1) 红褐色 胶体
(2)丙
(3)开始产生红褐色沉淀,后来沉淀逐渐溶解,形成棕黄色溶液
(4)A
【分析】Fe2O3与盐酸反应生成氯化铁和水;FeCl3溶液中滴入NaOH溶液生成氢氧化铁沉淀和氯化钠;在加热条件下,氯化铁水解生成氢氧化铁胶体;氢氧化铁胶体中加入稀硫酸,会发生聚沉,继续加入稀硫酸氢氧化铁沉淀溶解得到硫酸铁溶液;分散系本质特征是分散质微粒直径大小,分散系根据分散质粒子直径大小分为溶液、胶体和浊液。
解析:(1)在小烧杯中加入25 mL蒸馏水,加热至沸腾后,向沸水中加入2 mL FeCl3溶液,在加热条件下,氯化铁水解生成氢氧化铁胶体,溶液显红褐色(或红棕色),反应的化学方程式为;
(2)分别用红色激光笔照射烧杯中的液体,可以看到丙烧杯中产生丁达尔效应,丁达尔效应能区分胶体和溶液;
(3)取丙烧杯中的少量Fe(OH)3胶体置于试管乙中,向试管乙中滴加一定量的稀硫酸,边滴加边振荡,在此过程中可看到试管乙中生成的红褐色沉淀逐渐溶解,最终又得到棕黄色的溶液;
(4)胶体区别于其他分散系的本质特征是分散质微粒直径的大小不同,胶体的分散质微粒直径介于1~ 100nm之间,故答案为A。
17. ⑨⑩ ⑤ ③ ④ ⑥⑦ ①②⑧
解析:属于混合物是空气和汽油,即⑨⑩;氧化物是两种元素组成的化合物,其中一种元素是氧元素,因此符合氧化物定义的是H2O,即⑤;酸:电离的出的阳离子全部是H+的化合物,属于酸的是H2SO4,即③;碱:电离出的阴离子全部是OH-的化合物,属于碱的是KOH,即④;有机物是含碳的化合物,属于有机物的是CH4、C2H5OH,即⑥⑦;属于单质的是H2、O2、Al,即①②⑧;故答案为⑨⑩;⑤;③;④;⑥⑦;①②⑧。
18.②⑤ ①③
解析:②CO2、⑤SO2均可以与等碱溶液反应发生盐和水,故属于酸性氧化物;①CaO 、③Na2O均可以与酸溶液反应发生盐和水,故属于碱性氧化物;CO既不能与酸反应,又不能与碱反应,所以既不是酸性氧化物又不是碱性氧化物。则属于酸性氧化物的有②⑤,属于碱性氧化物的有①③。
三、元素或物质推断题
19. CaCO3 Cu 光合 点燃 化合反应 C + CO2 2CO 可溶性铜盐
【分析】根据A-J都是初中化学常见的物质,B、E、H、J是单质,其余均为化合物,气体C可用于灭火,所以C是二氧化碳,二氧化碳和氢氧化钙会生成碳酸钙沉淀和水,所以D是碳酸钙,二氧化碳和碳高温会生成一氧化碳,所以E是木炭,F是一氧化碳,一氧化碳和G生成的会转化成红色固体J,所以G是氧化铁,H是铁,I可以是硫酸铜,J是铜,铁和B会生成黑色固体A,所以B是氧气,A是四氧化三铁,然后将推出的物质进行验证即可。
解析:根据上述分析可知,
(1)D是CaCO3,J是Cu,故答案为CaCO3;Cu;
(2)“气体C→B”的转化过程是二氧化碳转化成氧气,在自然界中称为光合作用,故答案为光合;
(3)反应①是铁和氧气在点燃的条件下生成四氧化三铁,反应条件是点燃,该反应满足化合反应多变一的条件,属于化合反应,故答案为点燃;化合反应;
(4)反应②是二氧化碳和木炭在高温的条件下生成一氧化碳,化学方程式为:C+CO22CO;
(5)若要实现“H+I→红色固体J”的转化,物质I必领满足的条件是可溶性铜盐,故答案为可溶性铜盐。
四、实验题
20. 甲 FeCl3+ 3H2OFe(OH)3(胶体)+ 3HCl B A 冷凝管 蒸发皿 分液漏斗、容量瓶 g 上层液体无色,下层液体紫红色 受热均匀,防止液体飞溅
【分析】Ⅰ.根据胶体制备及其性质解答;
Ⅱ.根据分离提纯的操作注意事项解答。
解析:Ⅰ(1)①实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,当溶液变为红褐色时应立即停止加热,如继续加热会导致胶体聚沉,故甲正确;
②乙直接加热饱和FeCl3溶液会促进氯化铁水解,且加热促进HCl挥发,导致溶液产生沉淀现象,故乙错误;
③继续煮沸10分钟会产生沉淀,故丙错误;故答案为:甲同学;FeCl3 + 3H2O Fe(OH)3 (胶体)+ 3HCl;
(2)胶体具有很强的吸附能力,能吸附溶液中的离子而带电荷,胶粒之间相互排斥,而不易产生较大微粒而聚沉,故答案为:B;
(3)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是Fe(OH)3胶体的分散质微粒直径大小在1 ~ 100nm之间,故答案为:A;
Ⅱ(1)依据仪器的形状可知:②冷凝管;⑦蒸发皿,故答案为:冷凝管;蒸发皿;
(2)容量瓶带有瓶塞、分液漏斗带有活塞使用前应检查是否漏水,故答案为:分液漏斗、容量瓶;
(3)蒸馏时,冷凝水从冷凝管下口进入,故答案为:g;
(4)CCl4的密度比水大,且不与水互溶,所以在溶液下方,碘单质易溶于CCl4,碘的有机溶剂的颜色为紫色,故答案为:上层液体无色,下层液体紫红色;
(5)顶装置的操作是蒸发,玻璃棒的作用是:受热均匀,防止液体飞溅,故答案为:受热均匀,防止液体飞溅。
