5.3无机非金属材料同步练习题(含解析) 高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.3无机非金属材料同步练习题(含解析) 高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 113.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-25 16:14:43 | ||
图片预览




文档简介
5.3无机非金属材料同步练习题
一、单选题
1.随着科学技术的发展,无机非金属材料突破了传统硅酸盐体系的界限,一系列新型无机非金属材料相继问世。下列有关硅及其化合物的说法中不正确的是
A.高温结构陶瓷具有耐高温、耐腐蚀、抗氧化等优良性能
B.二氧化硅常用于制作光导纤维
C.水泥、玻璃、水晶饰物都是硅酸盐制品
D.硅晶片是生产芯片的基础材料
2.下列关于重要非金属元素的用途的叙述不正确的是
A.晶体硅是一种半导体材料,常用于制造光导纤维
B.自然界中存在游离态的硫和化合态的硫(如黄铁矿FeS2),二者均可作为工业上制备硫酸的原料
C.工业合成氨不仅为农作物的生长提供了必需的氮元素,而且为其他化工产品(如炸药、农药等)的生产提供了原料
D.高压输电线路使用的陶瓷绝缘材料、用作砂轮磨料的碳化硅都属于无机非金属材料
3.氮化硅陶瓷的机械强度高,硬度接近于刚玉(Al2O3),热稳定性好,化学性质稳定。以下关于氮化硅陶瓷的用途不正确的
A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备
B.在电子工业上制成耐高温的电的良导体
C.研发氮化硅的全陶发动机替代同类型金属发动机
D.氮化硅陶瓷的原料来源丰富,很有发展前途
4.化学与环境、生活密切相关,下列与化学有关的说法正确的是( )
A.用石材制作砚台的过程是化学变化
B.氯化铵溶液可清除铜制品表面的锈渍,是因为氨根离子水解使溶液显酸性
C.月饼因为富含油脂而易发生氧化,保存时常放入装有硅胶的透气袋
D.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
5.下列说法正确的是
A.SiO2是酸性氧化物,不跟任何酸反应
B.水玻璃敞口存放,不可能有白色胶状沉淀析出
C.高温时SiO2能跟Na2CO3反应放出CO2,所以硅酸的酸性比碳酸强
D.SiO2不溶于水,也不能与水反应
6.下列物质与俗名不对应的是
A.小苏打:NaHCO3 B.皓矾:FeSO4·7H2O C.冰晶石:Na3AlF6 D.脉石:SiO2
7.我国嫦娥五号探测器带回的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z的原子序数依次增大,四种元素最外层电子数之和为15,X、Y、Z为同周期相邻元素,且均不与W同族。下列结论正确的是
A.简单离子的半径大小顺序为W>Y>Z>X
B.Y元素最高价氧化物对应的水化物具有两性
C.工业上均采用电解法制备Y和Z的单质
D.四种元素的最高正价等于主族序数
8.下列物质的工业制法合理的是
A.玻璃是纯碱和石灰石高温反应制得
B.高炉炼铁中通过焦炭直接还原赤铁矿
C.工业上通过电解NaCl溶液获取Na单质
D.高纯硅的制备是通过氢气还原四氯化硅实现的
9.制备硅单质时,主要化学反应如下:
(1)SiO2+2CSi+2CO↑
(2)Si+2Cl2SiCl4
(3)SiCl4+2H2Si+4HCl
下列对上述三个反应的叙述中,不正确的是
A.(1)(3)为置换反应 B.(1)(2)(3)均为氧化还原反应
C.(2)为化合反应 D.三个反应的反应物中硅元素均被还原
10.化学与生活、科技密切相关。下列说法正确的是
A.食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质
B.稳定且有非凡的比表面积的铝硅酸盐沸石(ZEO-1)属于金属材料
C.螺旋碳纳米管TEM与石墨烯互为同素异形体
D.清华大学打造的世界首款异构融合类脑芯片——天机芯的主要材料与光导纤维的相同
11.化学在生产、生活中应用广泛,下列说法正确的是
A.晶体硅是良好的半导体材料
B.铁、铝合金的熔点高于铁的熔点,硬度小
C.氨常用作制冷剂利用了氨的化学性质
D.漂白粉、明矾都可用于污水的净化,其原理是相同的
12.下列叙述错误的是
A.硅在自然界中主要以单质形式存在 B.硅是应用最为广泛的半导体材料
C.高纯度的硅可用于制造计算机芯片 D.二氧化硅可用于生产玻璃
13.下列离子方程式正确的是
A.钠与水反应:
B.硅酸钠溶液与醋酸溶液混合:
C.等体积等物质的量浓度的溶液与溶液混合:
D.浓硝酸中加入过量铁粉并加热:
14.“一带一路”是跨越时空的宏伟构思,赋予古丝绸之路崭新的时代内涵。下列古丝绸之路的商品的主要成分不属于有机物的是
A.丝绸 B.茶叶 C.陶瓷 D.香料
15.能用磨口玻璃塞玻璃瓶存放的试剂有( )
A.烧碱溶液 B.浓硝酸 C.氢氟酸 D.硅酸钠溶液
二、填空题
16.氮化硅陶瓷因其熔点高,对于金属及氧化物熔体具有相当的高温稳定性,越来越多被应用于热工各个领域,如陶瓷烧成棚板、辊棒,以及高温轴承、涡轮叶片等。
(1)下列关于氮化硅陶瓷的说法正确的是________。
A.硅粉合成氮化硅的反应属于氧化还原反应
B.氮化硅陶瓷属于硅酸盐
C.氮化硅陶瓷可用于制造磨刀材料
D.太阳能光伏产业的主体材料为氮化硅
(2)在烧结氮化硅陶瓷的过程中,二氧化硅、碳、氮气以物质的量之比3:6:2反应生成两种化合物。
①该反应的化学方程式为___________________________。
②该反应中氧化剂与还原剂的质量比为________。
17.在一定条件下,利用置换反应X+Y=W+Z,可实现物质之间的转化
(1)若X为Mg,W为C,则Z为_________。
(2)若X为SiO2,W为CO,该反应在工业的用途是________。
三、实验题
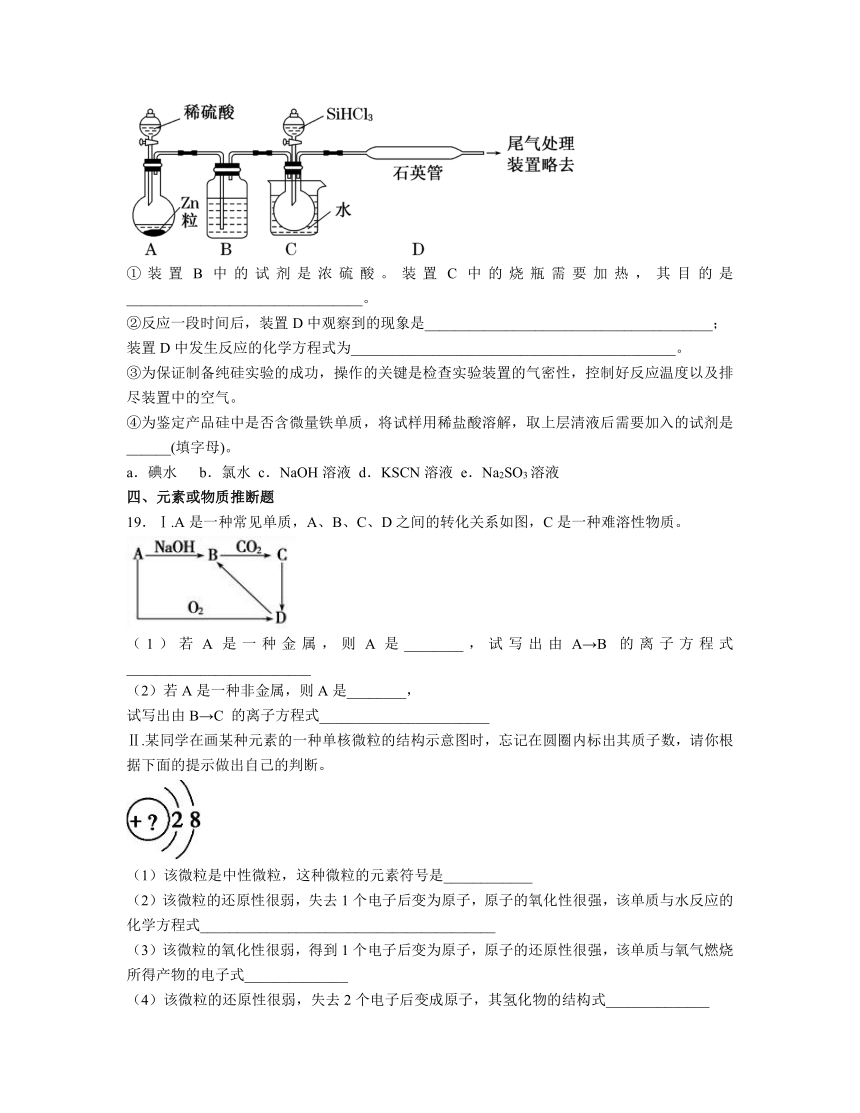
18.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:
Si+3HClSiHCl3+H2;
③SiHCl3与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_______________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为_______________________。
(3)用SiHCl3与过量H2反应制备硅的装置如图(热源及夹持装置略去):
①装置B中的试剂是浓硫酸。装置C中的烧瓶需要加热,其目的是________________________________。
②反应一段时间后,装置D中观察到的现象是_______________________________________;
装置D中发生反应的化学方程式为____________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及排尽装置中的空气。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂是______(填字母)。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
四、元素或物质推断题
19.Ⅰ.A是一种常见单质,A、B、C、D之间的转化关系如图,C是一种难溶性物质。
(1)若A是一种金属,则A是________,试写出由A→B 的离子方程式_________________________
(2)若A是一种非金属,则A是________,
试写出由B→C 的离子方程式_______________________
Ⅱ.某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断。
(1)该微粒是中性微粒,这种微粒的元素符号是____________
(2)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,该单质与水反应的化学方程式________________________________________
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,该单质与氧气燃烧所得产物的电子式______________
(4)该微粒的还原性很弱,失去2个电子后变成原子,其氢化物的结构式______________
(5)该微粒的符号为X3+,其氢氧化物与强碱反应的离子方程式____________________________
【参考答案】
一、单选题
1.C
解析:A. 高温结构陶瓷具有共价晶体的特性,具有耐高温、耐腐蚀、抗氧化等优良性能,故A正确;
B. 二氧化硅具有良好的导光性和对光全反射的性质,常用于制作光导纤维,故B正确;
C. 水泥、玻璃都是硅酸盐制品,水晶饰物主要成是二氧化硅,故C错误;
D. 硅晶片是良好的半导体材料,是生产芯片的基础材料,故D正确;
故选C。
2.A
解析:A.晶体硅的导电性介于导体与绝缘体之间,因此是一种半导体材料,而常用于制造光导纤维的主要成分是二氧化硅,A错误;
B.自然界中存在游离态的硫和化合态的硫(如黄铁矿FeS2),它们可以通过与O2反应产生SO2,然后SO2与O2在一定条件下反应产生SO3,SO3被吸收得到硫酸,因此二者均可作为工业上制备硫酸的原料,B正确;
C.NH3与酸发生反应产生的铵盐可以作化肥,为农作物的生长提供了必需的氮元素,而且也可以作为其他化工产品(如炸药、农药等)提供生产原料,C正确;
D.陶瓷绝缘材料、碳化硅都是无机非金属材料,D正确;
故合理选项是A。
3.B
解析:A.根据题干信息,氮化硅的热稳定性好,可以用于可以在冶金工业上制成坩埚、铝电解槽衬里等设备,故A正确;
B.氮化硅属于原子晶体,不是电的良导体,故B错误;
C.氮化硅陶瓷的机械强度高,硬度大,可以研发氮化硅的全陶发动机替代同类型金属发动机,故C正确;
D.制备氮化硅的原料来源丰富,自然界中有大量氮气和二氧化硅,具有广阔的发展前景,故D正确;
答案选B。
4.B
解析:A.用石材制作砚台的过程没有新物质生成,属于物理变化,故A错误;
B.氨根离子水解使溶液显酸性,酸性溶液可以用来除锈,故B正确;
C.硅胶具有吸水性,可作食品包装中的硅胶为干燥剂,但硅胶没有还原性、不能除去月饼包装袋中的氧气,可放入装有铁粉的透气袋,故C错误;
D.石英坩埚中含有二氧化硅,二氧化硅能和氢氧化钠发生反应,故D错误;
故答案选B。
5.D
解析:A. SiO2是酸性氧化物,能与氢氟酸反应生成四氟化硅和水,A错误;
B. 水玻璃敞口存放,硅酸钠与空气中的二氧化碳反应生成白色硅酸胶状沉淀,B错误;
C.二氧化硅和碳酸钠反应生成硅酸钠和二氧化碳,是由难挥发性的酸酐制取易挥发性的酸酐,不能比较酸性强弱 ,C错误;
D. SiO2虽然是酸性氧化物,但是它不溶于水,也不能与水反应,D正确;
答案选D。
6.B
解析:A.NaHCO3俗名小苏打,故A不符合题意;
B.FeSO4 7H2O俗名为绿矾,故B符合题意;
C.Na3AlF6NH4俗名冰晶石,可以用来降低氧化铝的熔点,故C不符合题意;
D.SiO2俗称脉石,是石英的主要成分,故D不符合题意。
故选B。
7.B
解析:短周期元素W、X、Y、Z的原子序数依次增大,最外层电子数之和为15,X,Y,Z为同周期相邻元素,且均不与W同族,设X的最外层电子数为x,W的最外层电子数为y,则x+x+1+x+2+y=15,整理可得:3x+y=12,且x<4、y≤8,x=1时y=9>8(不符合),x=2时y=6,结合原子序数可知X为Mg,Y为Al,Z为Si,W为O元素;x=3时y=3,X、W同主族,不符合要求;综上所述,X为Mg,Y为Al,Z为Si,W为O元素。
A.一般来讲,电子层越多离子半径越大,核外电子排布相同时,核电荷数越大离子半径越小,则离子半径大小顺序为Z>W>X>Y,故A错误;
B.Y为Al,最高价氧化物对应的水化物Al(OH)3能与强酸反应,也能与强碱反应,具有两性,故B正确;
C.Y为Al,工业上电解熔融的氧化铝得到单质Al,Z为Si,工业上用C高温下还原SiO2得到Si,故C错误;
D.W为O,没有最高正价,故D错误;
故选B。
8.D
解析:A. 玻璃是石英、纯碱和石灰石高温反应制得,A错误;
B. 高炉炼铁中通过焦炭与氧气反应生成的CO还原赤铁矿,B错误;
C. 工业上通过电解熔融NaCl获取Na单质,电解氯化钠溶液生成氢氧化钠、氢气和氯气,C错误;
D. 高纯硅的制备是通过氢气还原四氯化硅实现的,D正确。
答案选D。
9.D
解析:A.一种单质和一种化合物生成另一种单质和另一种化合物的反应是置换反应,(1)(3)为置换反应,A正确;
B.反应(1)(2)(3)中均有化合价的升高和降低,都是氧化还原反应,B正确;
C.化合反应是两种或者两种以上的物质生成一种物质的反应,(2)为化合反应,C正确;
D.反应(1) (3)中硅元素的化合价降低,被还原;(2)中硅元素的化合价升高,被氧化,D错误;答案选D。
10.C
解析:A.硅胶、生石灰只能吸收水分,无法除去氧气,不能防止食品氧化变质,故A错误;
B.铝硅酸盐沸石为无机非金属材料,故B错误;
C.碳纳米管与石墨烯为碳元素的不同单质,互为同素异形体,故C正确;
D.制作电脑芯片的材料为硅单质,光导纤维的材料为二氧化硅,故D错误;
故选:C。
11.A
解析:试题分析:A.晶体硅是良好的半导体材料,故A正确;B.合金的熔点低于成分金属的熔点,故B错误;C.氨常用作制冷剂是利用了液氨挥发时吸收热量,属于物理性质,故C错误;D.漂白粉用于污水的杀菌消毒,利用的是漂白粉的氧化性、明矾用于污水的净化,是利用明矾水解生成的胶体具有吸附性,故D错误;故选A。
12.A
解析:A.硅在自然界中主要以二氧化硅、硅酸盐形式存在,自然界没有游离态的硅,A错误;
B. 硅的导电性介于导体和绝缘体之间,良好的半导体材料,是应用最为广泛的半导体材料,B正确;
C.硅是良好的半导体材料,高纯度的硅可用于制造计算机芯片,C正确;
D. 二氧化硅、纯碱和石灰石可用于生产玻璃,D正确;
答案选A。
13.C
解析:A.钠与水反应生成氢氧化钠和氢气,正确的离子方程式:,A错误;
B.醋酸是弱酸,要用化学式表示,不能写成,B错误;
C.等体积等物质的量浓度的溶液与溶液混合,离子方程式为,C正确;
D.浓硝酸中加入过量铁粉并加热,生成亚铁离子而不是铁离子,D错误;
故答案选C。
14.C
解析:A.丝绸的主要成分为蛋白质,属于有机物,故A不选;
B.茶叶成分较复杂,含有有机酸,茶多酚、氨基酸等,含有有机物,故B不选;
C.陶瓷属于硅酸盐产品,属于传统无机非金属材料,不含有机物,故C可选;
D.香料中含有香精等有机物,故D不选;
故选C。
15.B
解析:A.氢氧化钠和二氧化硅反应生成粘性的物质硅酸钠,反应方程式为2NaOH+SiO2=Na2SiO3+H2O,硅酸钠能将玻璃瓶塞和试剂瓶粘结在一起而打不开,所以氢氧化钠溶液不能用磨口玻璃塞玻璃瓶存放,A错误;
B.浓硝酸虽然具有强氧化性,但浓硝酸和二氧化硅不反应,所以可以用磨口玻璃塞玻璃瓶存放,B正确;
C.氢氟酸能和二氧化硅反应生成四氟化硅和水,反应方程式为SiO2+4HF=SiF4+2H2O,所以HF不能用玻璃瓶存放,C错误;
D.硅酸钠具有粘性,能将玻璃瓶塞和试剂瓶粘结在一起而打不开,因此硅酸钠溶液不能用磨口玻璃塞玻璃瓶存放,D错误;
答案选B。
二、填空题
16. AC 3SiO2+2N2+6CSi3N4+6CO 7:9
解析:(1)Si与N2反应前后,N、Si元素的化合价发生变化,故属于氧化还原反应,A正确;氮化硅属于新型高温结构陶瓷,不属于硅酸盐,B错误;根据氮化硅的性能,可用于制造磨刀材料,C正确;太阳能光伏产业的主体材料为硅,D错误。
(2)①硅原子最外层有4个电子,氮原子最外层有5个电子,在氮化硅中硅显+4价,氮显-3价,根据化合物中化合价代数和等于零的原则,可得氮化硅的化学式为Si3N4。烧结Si3N4的反应物为SiO2、N2、C,生成物为Si3N4和另一种化合物,则有3SiO2+2N2+6C―→Si3N4+另一种化合物,根据原子守恒可得另一种化合物为CO,故反应方程式为3SiO2+2N2+6CSi3N4+6CO。②根据反应:3SiO2+2N2+6CSi3N4+6CO,分析各元素化合价变化可知,Si、O元素反应前后化合价没有变化,氮元素价态降低,为氧化剂,碳元素价态升高为还原剂,其质量比为2 mol×28 g/mol:(6 mol×12 g/mol)=7:9。
17. MgO 制备粗硅
解析:(1)由于Mg的还原性很强,可以在CO2中燃烧生成“一黑一白”两种产物即碳单质和MgO,此题考查的正是Mg的这个性质;所以Z为MgO;
(2)工业制粗硅涉及的反应是SiO2与C高温下生成CO和Si单质的反应,此题考查的正是SiO2的这条性质;所以该反应在工业上的用途即制备粗硅。
三、实验题
18. SiO2+2CSi+2CO↑ 分馏(或蒸馏) 使滴入烧瓶中的SiHCl3汽化 有固体物质生成 SiHCl3+H2Si+3HCl b、d
解析:(1)根据题给信息,粗硅可以用碳还原二氧化硅的办法来制得,故反应方程式为SiO2+2CSi+2CO↑;
(2)因HCl易溶于水,而SiHCl3与H2O强烈反应,故提纯SiHCl3的方法只能在无水的条件下利用它们的沸点不同,采用分馏的方法进行;
(3)①C中烧瓶需加热,其目的是使SiHCl3汽化,加快与H2的反应;
②根据题给信息石英管中产生的物质应为硅,故D中现象为有固体产生;SiHCl3和H2反应生成Si和HCl,Si元素化合价由+2价下降到0价,H元素由0价上升到+1价,根据得失电子守恒和原子守恒配平方程式为:SiHCl3+H2Si+3HCl;
④铁与盐酸反应产生Fe2+,常常采用先将Fe2+氧化为Fe3+,然后再加入KSCN溶液看是否变红来检验,故答案为:b、d。
四、元素或物质推断题
19. Al 2 Al +2 OH-+ 2H2O=2+ 3H2↑ Si + H2O +CO2=H2SiO3↓+ Ne 2F2 + 2H2O=4HF + O2 H-O-H或H-O-O-H Al(OH)3 + OH-=+ 2H2O
解析:I. 从框图可以看出,D是一种氧化物,B是一种钠盐,C是一种难溶性物质,通入CO2能产生沉淀的钠盐主要有偏铝酸盐和硅酸盐,故可初步推断A可能是Si或Al;
(1). 若A是一种金属,则A是Al,B为NaAlO2,A→B的离子方程式为2Al+2H2O+2OH-=2+3H2↑,故答案为Al;2Al+2H2O+2OH-=2+3H2↑;
(2). 若A是一种非金属,则A是Si,B为Na2SiO3,C为H2SiO3,B→C的离子方程式为+ H2O +CO2=H2SiO3↓+,故答案为Si;+ H2O +CO2=H2SiO3↓+;
II. (1). 由该单核微粒的结构示意图可知,其原子核外有10个电子,若该微粒是中性微粒,由质子数=核外电子数可知,这种微粒是Ne元素,故答案为Ne;
(2). 该微粒的还原性很弱,失去1个电子后变为原子,说明该元素的原子含有9个电子,为F元素,F2和水反应生成HF和O2,化学方程式为:2F2 + 2H2O=4HF + O2,故答案为2F2 + 2H2O=4HF + O2;
(3). 该微粒的氧化性很弱,得到1个电子后变为原子,说明该元素的原子含有11个电子,为Na元素,Na在氧气中燃烧生成Na2O2,Na2O2的电子式为:,故答案为;
(4). 该微粒的还原性很弱,失去2个电子后变成原子,说明该元素的原子含有8个电子,为O元素,O元素的氢化物是H2O或H2O2,结构式为:H-O-H或H-O-O-H,故答案为H-O-H或H-O-O-H;
(5). 该微粒的符号为X3+,说明是Al3+,Al(OH)3与强碱反应生成偏铝酸盐和水,离子方程式为:Al(OH)3 + OH-= + 2H2O,故答案为Al(OH)3 + OH-= + 2H2O。
一、单选题
1.随着科学技术的发展,无机非金属材料突破了传统硅酸盐体系的界限,一系列新型无机非金属材料相继问世。下列有关硅及其化合物的说法中不正确的是
A.高温结构陶瓷具有耐高温、耐腐蚀、抗氧化等优良性能
B.二氧化硅常用于制作光导纤维
C.水泥、玻璃、水晶饰物都是硅酸盐制品
D.硅晶片是生产芯片的基础材料
2.下列关于重要非金属元素的用途的叙述不正确的是
A.晶体硅是一种半导体材料,常用于制造光导纤维
B.自然界中存在游离态的硫和化合态的硫(如黄铁矿FeS2),二者均可作为工业上制备硫酸的原料
C.工业合成氨不仅为农作物的生长提供了必需的氮元素,而且为其他化工产品(如炸药、农药等)的生产提供了原料
D.高压输电线路使用的陶瓷绝缘材料、用作砂轮磨料的碳化硅都属于无机非金属材料
3.氮化硅陶瓷的机械强度高,硬度接近于刚玉(Al2O3),热稳定性好,化学性质稳定。以下关于氮化硅陶瓷的用途不正确的
A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备
B.在电子工业上制成耐高温的电的良导体
C.研发氮化硅的全陶发动机替代同类型金属发动机
D.氮化硅陶瓷的原料来源丰富,很有发展前途
4.化学与环境、生活密切相关,下列与化学有关的说法正确的是( )
A.用石材制作砚台的过程是化学变化
B.氯化铵溶液可清除铜制品表面的锈渍,是因为氨根离子水解使溶液显酸性
C.月饼因为富含油脂而易发生氧化,保存时常放入装有硅胶的透气袋
D.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
5.下列说法正确的是
A.SiO2是酸性氧化物,不跟任何酸反应
B.水玻璃敞口存放,不可能有白色胶状沉淀析出
C.高温时SiO2能跟Na2CO3反应放出CO2,所以硅酸的酸性比碳酸强
D.SiO2不溶于水,也不能与水反应
6.下列物质与俗名不对应的是
A.小苏打:NaHCO3 B.皓矾:FeSO4·7H2O C.冰晶石:Na3AlF6 D.脉石:SiO2
7.我国嫦娥五号探测器带回的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z的原子序数依次增大,四种元素最外层电子数之和为15,X、Y、Z为同周期相邻元素,且均不与W同族。下列结论正确的是
A.简单离子的半径大小顺序为W>Y>Z>X
B.Y元素最高价氧化物对应的水化物具有两性
C.工业上均采用电解法制备Y和Z的单质
D.四种元素的最高正价等于主族序数
8.下列物质的工业制法合理的是
A.玻璃是纯碱和石灰石高温反应制得
B.高炉炼铁中通过焦炭直接还原赤铁矿
C.工业上通过电解NaCl溶液获取Na单质
D.高纯硅的制备是通过氢气还原四氯化硅实现的
9.制备硅单质时,主要化学反应如下:
(1)SiO2+2CSi+2CO↑
(2)Si+2Cl2SiCl4
(3)SiCl4+2H2Si+4HCl
下列对上述三个反应的叙述中,不正确的是
A.(1)(3)为置换反应 B.(1)(2)(3)均为氧化还原反应
C.(2)为化合反应 D.三个反应的反应物中硅元素均被还原
10.化学与生活、科技密切相关。下列说法正确的是
A.食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质
B.稳定且有非凡的比表面积的铝硅酸盐沸石(ZEO-1)属于金属材料
C.螺旋碳纳米管TEM与石墨烯互为同素异形体
D.清华大学打造的世界首款异构融合类脑芯片——天机芯的主要材料与光导纤维的相同
11.化学在生产、生活中应用广泛,下列说法正确的是
A.晶体硅是良好的半导体材料
B.铁、铝合金的熔点高于铁的熔点,硬度小
C.氨常用作制冷剂利用了氨的化学性质
D.漂白粉、明矾都可用于污水的净化,其原理是相同的
12.下列叙述错误的是
A.硅在自然界中主要以单质形式存在 B.硅是应用最为广泛的半导体材料
C.高纯度的硅可用于制造计算机芯片 D.二氧化硅可用于生产玻璃
13.下列离子方程式正确的是
A.钠与水反应:
B.硅酸钠溶液与醋酸溶液混合:
C.等体积等物质的量浓度的溶液与溶液混合:
D.浓硝酸中加入过量铁粉并加热:
14.“一带一路”是跨越时空的宏伟构思,赋予古丝绸之路崭新的时代内涵。下列古丝绸之路的商品的主要成分不属于有机物的是
A.丝绸 B.茶叶 C.陶瓷 D.香料
15.能用磨口玻璃塞玻璃瓶存放的试剂有( )
A.烧碱溶液 B.浓硝酸 C.氢氟酸 D.硅酸钠溶液
二、填空题
16.氮化硅陶瓷因其熔点高,对于金属及氧化物熔体具有相当的高温稳定性,越来越多被应用于热工各个领域,如陶瓷烧成棚板、辊棒,以及高温轴承、涡轮叶片等。
(1)下列关于氮化硅陶瓷的说法正确的是________。
A.硅粉合成氮化硅的反应属于氧化还原反应
B.氮化硅陶瓷属于硅酸盐
C.氮化硅陶瓷可用于制造磨刀材料
D.太阳能光伏产业的主体材料为氮化硅
(2)在烧结氮化硅陶瓷的过程中,二氧化硅、碳、氮气以物质的量之比3:6:2反应生成两种化合物。
①该反应的化学方程式为___________________________。
②该反应中氧化剂与还原剂的质量比为________。
17.在一定条件下,利用置换反应X+Y=W+Z,可实现物质之间的转化
(1)若X为Mg,W为C,则Z为_________。
(2)若X为SiO2,W为CO,该反应在工业的用途是________。
三、实验题
18.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:
Si+3HClSiHCl3+H2;
③SiHCl3与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_______________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为_______________________。
(3)用SiHCl3与过量H2反应制备硅的装置如图(热源及夹持装置略去):
①装置B中的试剂是浓硫酸。装置C中的烧瓶需要加热,其目的是________________________________。
②反应一段时间后,装置D中观察到的现象是_______________________________________;
装置D中发生反应的化学方程式为____________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及排尽装置中的空气。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂是______(填字母)。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
四、元素或物质推断题
19.Ⅰ.A是一种常见单质,A、B、C、D之间的转化关系如图,C是一种难溶性物质。
(1)若A是一种金属,则A是________,试写出由A→B 的离子方程式_________________________
(2)若A是一种非金属,则A是________,
试写出由B→C 的离子方程式_______________________
Ⅱ.某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断。
(1)该微粒是中性微粒,这种微粒的元素符号是____________
(2)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,该单质与水反应的化学方程式________________________________________
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,该单质与氧气燃烧所得产物的电子式______________
(4)该微粒的还原性很弱,失去2个电子后变成原子,其氢化物的结构式______________
(5)该微粒的符号为X3+,其氢氧化物与强碱反应的离子方程式____________________________
【参考答案】
一、单选题
1.C
解析:A. 高温结构陶瓷具有共价晶体的特性,具有耐高温、耐腐蚀、抗氧化等优良性能,故A正确;
B. 二氧化硅具有良好的导光性和对光全反射的性质,常用于制作光导纤维,故B正确;
C. 水泥、玻璃都是硅酸盐制品,水晶饰物主要成是二氧化硅,故C错误;
D. 硅晶片是良好的半导体材料,是生产芯片的基础材料,故D正确;
故选C。
2.A
解析:A.晶体硅的导电性介于导体与绝缘体之间,因此是一种半导体材料,而常用于制造光导纤维的主要成分是二氧化硅,A错误;
B.自然界中存在游离态的硫和化合态的硫(如黄铁矿FeS2),它们可以通过与O2反应产生SO2,然后SO2与O2在一定条件下反应产生SO3,SO3被吸收得到硫酸,因此二者均可作为工业上制备硫酸的原料,B正确;
C.NH3与酸发生反应产生的铵盐可以作化肥,为农作物的生长提供了必需的氮元素,而且也可以作为其他化工产品(如炸药、农药等)提供生产原料,C正确;
D.陶瓷绝缘材料、碳化硅都是无机非金属材料,D正确;
故合理选项是A。
3.B
解析:A.根据题干信息,氮化硅的热稳定性好,可以用于可以在冶金工业上制成坩埚、铝电解槽衬里等设备,故A正确;
B.氮化硅属于原子晶体,不是电的良导体,故B错误;
C.氮化硅陶瓷的机械强度高,硬度大,可以研发氮化硅的全陶发动机替代同类型金属发动机,故C正确;
D.制备氮化硅的原料来源丰富,自然界中有大量氮气和二氧化硅,具有广阔的发展前景,故D正确;
答案选B。
4.B
解析:A.用石材制作砚台的过程没有新物质生成,属于物理变化,故A错误;
B.氨根离子水解使溶液显酸性,酸性溶液可以用来除锈,故B正确;
C.硅胶具有吸水性,可作食品包装中的硅胶为干燥剂,但硅胶没有还原性、不能除去月饼包装袋中的氧气,可放入装有铁粉的透气袋,故C错误;
D.石英坩埚中含有二氧化硅,二氧化硅能和氢氧化钠发生反应,故D错误;
故答案选B。
5.D
解析:A. SiO2是酸性氧化物,能与氢氟酸反应生成四氟化硅和水,A错误;
B. 水玻璃敞口存放,硅酸钠与空气中的二氧化碳反应生成白色硅酸胶状沉淀,B错误;
C.二氧化硅和碳酸钠反应生成硅酸钠和二氧化碳,是由难挥发性的酸酐制取易挥发性的酸酐,不能比较酸性强弱 ,C错误;
D. SiO2虽然是酸性氧化物,但是它不溶于水,也不能与水反应,D正确;
答案选D。
6.B
解析:A.NaHCO3俗名小苏打,故A不符合题意;
B.FeSO4 7H2O俗名为绿矾,故B符合题意;
C.Na3AlF6NH4俗名冰晶石,可以用来降低氧化铝的熔点,故C不符合题意;
D.SiO2俗称脉石,是石英的主要成分,故D不符合题意。
故选B。
7.B
解析:短周期元素W、X、Y、Z的原子序数依次增大,最外层电子数之和为15,X,Y,Z为同周期相邻元素,且均不与W同族,设X的最外层电子数为x,W的最外层电子数为y,则x+x+1+x+2+y=15,整理可得:3x+y=12,且x<4、y≤8,x=1时y=9>8(不符合),x=2时y=6,结合原子序数可知X为Mg,Y为Al,Z为Si,W为O元素;x=3时y=3,X、W同主族,不符合要求;综上所述,X为Mg,Y为Al,Z为Si,W为O元素。
A.一般来讲,电子层越多离子半径越大,核外电子排布相同时,核电荷数越大离子半径越小,则离子半径大小顺序为Z>W>X>Y,故A错误;
B.Y为Al,最高价氧化物对应的水化物Al(OH)3能与强酸反应,也能与强碱反应,具有两性,故B正确;
C.Y为Al,工业上电解熔融的氧化铝得到单质Al,Z为Si,工业上用C高温下还原SiO2得到Si,故C错误;
D.W为O,没有最高正价,故D错误;
故选B。
8.D
解析:A. 玻璃是石英、纯碱和石灰石高温反应制得,A错误;
B. 高炉炼铁中通过焦炭与氧气反应生成的CO还原赤铁矿,B错误;
C. 工业上通过电解熔融NaCl获取Na单质,电解氯化钠溶液生成氢氧化钠、氢气和氯气,C错误;
D. 高纯硅的制备是通过氢气还原四氯化硅实现的,D正确。
答案选D。
9.D
解析:A.一种单质和一种化合物生成另一种单质和另一种化合物的反应是置换反应,(1)(3)为置换反应,A正确;
B.反应(1)(2)(3)中均有化合价的升高和降低,都是氧化还原反应,B正确;
C.化合反应是两种或者两种以上的物质生成一种物质的反应,(2)为化合反应,C正确;
D.反应(1) (3)中硅元素的化合价降低,被还原;(2)中硅元素的化合价升高,被氧化,D错误;答案选D。
10.C
解析:A.硅胶、生石灰只能吸收水分,无法除去氧气,不能防止食品氧化变质,故A错误;
B.铝硅酸盐沸石为无机非金属材料,故B错误;
C.碳纳米管与石墨烯为碳元素的不同单质,互为同素异形体,故C正确;
D.制作电脑芯片的材料为硅单质,光导纤维的材料为二氧化硅,故D错误;
故选:C。
11.A
解析:试题分析:A.晶体硅是良好的半导体材料,故A正确;B.合金的熔点低于成分金属的熔点,故B错误;C.氨常用作制冷剂是利用了液氨挥发时吸收热量,属于物理性质,故C错误;D.漂白粉用于污水的杀菌消毒,利用的是漂白粉的氧化性、明矾用于污水的净化,是利用明矾水解生成的胶体具有吸附性,故D错误;故选A。
12.A
解析:A.硅在自然界中主要以二氧化硅、硅酸盐形式存在,自然界没有游离态的硅,A错误;
B. 硅的导电性介于导体和绝缘体之间,良好的半导体材料,是应用最为广泛的半导体材料,B正确;
C.硅是良好的半导体材料,高纯度的硅可用于制造计算机芯片,C正确;
D. 二氧化硅、纯碱和石灰石可用于生产玻璃,D正确;
答案选A。
13.C
解析:A.钠与水反应生成氢氧化钠和氢气,正确的离子方程式:,A错误;
B.醋酸是弱酸,要用化学式表示,不能写成,B错误;
C.等体积等物质的量浓度的溶液与溶液混合,离子方程式为,C正确;
D.浓硝酸中加入过量铁粉并加热,生成亚铁离子而不是铁离子,D错误;
故答案选C。
14.C
解析:A.丝绸的主要成分为蛋白质,属于有机物,故A不选;
B.茶叶成分较复杂,含有有机酸,茶多酚、氨基酸等,含有有机物,故B不选;
C.陶瓷属于硅酸盐产品,属于传统无机非金属材料,不含有机物,故C可选;
D.香料中含有香精等有机物,故D不选;
故选C。
15.B
解析:A.氢氧化钠和二氧化硅反应生成粘性的物质硅酸钠,反应方程式为2NaOH+SiO2=Na2SiO3+H2O,硅酸钠能将玻璃瓶塞和试剂瓶粘结在一起而打不开,所以氢氧化钠溶液不能用磨口玻璃塞玻璃瓶存放,A错误;
B.浓硝酸虽然具有强氧化性,但浓硝酸和二氧化硅不反应,所以可以用磨口玻璃塞玻璃瓶存放,B正确;
C.氢氟酸能和二氧化硅反应生成四氟化硅和水,反应方程式为SiO2+4HF=SiF4+2H2O,所以HF不能用玻璃瓶存放,C错误;
D.硅酸钠具有粘性,能将玻璃瓶塞和试剂瓶粘结在一起而打不开,因此硅酸钠溶液不能用磨口玻璃塞玻璃瓶存放,D错误;
答案选B。
二、填空题
16. AC 3SiO2+2N2+6CSi3N4+6CO 7:9
解析:(1)Si与N2反应前后,N、Si元素的化合价发生变化,故属于氧化还原反应,A正确;氮化硅属于新型高温结构陶瓷,不属于硅酸盐,B错误;根据氮化硅的性能,可用于制造磨刀材料,C正确;太阳能光伏产业的主体材料为硅,D错误。
(2)①硅原子最外层有4个电子,氮原子最外层有5个电子,在氮化硅中硅显+4价,氮显-3价,根据化合物中化合价代数和等于零的原则,可得氮化硅的化学式为Si3N4。烧结Si3N4的反应物为SiO2、N2、C,生成物为Si3N4和另一种化合物,则有3SiO2+2N2+6C―→Si3N4+另一种化合物,根据原子守恒可得另一种化合物为CO,故反应方程式为3SiO2+2N2+6CSi3N4+6CO。②根据反应:3SiO2+2N2+6CSi3N4+6CO,分析各元素化合价变化可知,Si、O元素反应前后化合价没有变化,氮元素价态降低,为氧化剂,碳元素价态升高为还原剂,其质量比为2 mol×28 g/mol:(6 mol×12 g/mol)=7:9。
17. MgO 制备粗硅
解析:(1)由于Mg的还原性很强,可以在CO2中燃烧生成“一黑一白”两种产物即碳单质和MgO,此题考查的正是Mg的这个性质;所以Z为MgO;
(2)工业制粗硅涉及的反应是SiO2与C高温下生成CO和Si单质的反应,此题考查的正是SiO2的这条性质;所以该反应在工业上的用途即制备粗硅。
三、实验题
18. SiO2+2CSi+2CO↑ 分馏(或蒸馏) 使滴入烧瓶中的SiHCl3汽化 有固体物质生成 SiHCl3+H2Si+3HCl b、d
解析:(1)根据题给信息,粗硅可以用碳还原二氧化硅的办法来制得,故反应方程式为SiO2+2CSi+2CO↑;
(2)因HCl易溶于水,而SiHCl3与H2O强烈反应,故提纯SiHCl3的方法只能在无水的条件下利用它们的沸点不同,采用分馏的方法进行;
(3)①C中烧瓶需加热,其目的是使SiHCl3汽化,加快与H2的反应;
②根据题给信息石英管中产生的物质应为硅,故D中现象为有固体产生;SiHCl3和H2反应生成Si和HCl,Si元素化合价由+2价下降到0价,H元素由0价上升到+1价,根据得失电子守恒和原子守恒配平方程式为:SiHCl3+H2Si+3HCl;
④铁与盐酸反应产生Fe2+,常常采用先将Fe2+氧化为Fe3+,然后再加入KSCN溶液看是否变红来检验,故答案为:b、d。
四、元素或物质推断题
19. Al 2 Al +2 OH-+ 2H2O=2+ 3H2↑ Si + H2O +CO2=H2SiO3↓+ Ne 2F2 + 2H2O=4HF + O2 H-O-H或H-O-O-H Al(OH)3 + OH-=+ 2H2O
解析:I. 从框图可以看出,D是一种氧化物,B是一种钠盐,C是一种难溶性物质,通入CO2能产生沉淀的钠盐主要有偏铝酸盐和硅酸盐,故可初步推断A可能是Si或Al;
(1). 若A是一种金属,则A是Al,B为NaAlO2,A→B的离子方程式为2Al+2H2O+2OH-=2+3H2↑,故答案为Al;2Al+2H2O+2OH-=2+3H2↑;
(2). 若A是一种非金属,则A是Si,B为Na2SiO3,C为H2SiO3,B→C的离子方程式为+ H2O +CO2=H2SiO3↓+,故答案为Si;+ H2O +CO2=H2SiO3↓+;
II. (1). 由该单核微粒的结构示意图可知,其原子核外有10个电子,若该微粒是中性微粒,由质子数=核外电子数可知,这种微粒是Ne元素,故答案为Ne;
(2). 该微粒的还原性很弱,失去1个电子后变为原子,说明该元素的原子含有9个电子,为F元素,F2和水反应生成HF和O2,化学方程式为:2F2 + 2H2O=4HF + O2,故答案为2F2 + 2H2O=4HF + O2;
(3). 该微粒的氧化性很弱,得到1个电子后变为原子,说明该元素的原子含有11个电子,为Na元素,Na在氧气中燃烧生成Na2O2,Na2O2的电子式为:,故答案为;
(4). 该微粒的还原性很弱,失去2个电子后变成原子,说明该元素的原子含有8个电子,为O元素,O元素的氢化物是H2O或H2O2,结构式为:H-O-H或H-O-O-H,故答案为H-O-H或H-O-O-H;
(5). 该微粒的符号为X3+,说明是Al3+,Al(OH)3与强碱反应生成偏铝酸盐和水,离子方程式为:Al(OH)3 + OH-= + 2H2O,故答案为Al(OH)3 + OH-= + 2H2O。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
