第1章《原子结构元素周期律》测试题(含解析)高一下学期鲁科版(2019)化学必修第二册
文档属性
| 名称 | 第1章《原子结构元素周期律》测试题(含解析)高一下学期鲁科版(2019)化学必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-26 11:27:06 | ||
图片预览



文档简介
第1章《原子结构 元素周期律》测试题
一、单选题(共12题)
1.下列说法正确的是
A.SO2能使酸性KMnO4溶液褪色,故SO2有漂白性
B.NO2与水反应生成HNO3,故NO2是酸性氧化物
C.H2SiO3的酸性弱于H2CO3,故非金属性C强于Si
D.CaCO3难溶于水,故CO2能与CaCl2溶液反应
2.化学与生产生活及环境密切相关。下列说法正确的是
A.“玉兔号”月球车帆板太阳能电池片的材料主要是二氧化硅
B.厨房燃气泄漏时,要及时打开抽油烟机进行通风换气
C.“奋斗者”号潜水器下沉时要携带两组压载铁,生铁是合金
D.绿色化学研究的是如何用化学技术与原理治理已经被污染的环境
3.下列关于元素周期律的叙述中不正确的是
A.Na、Mg、Al最外层电子数依次增多,其单核离子的氧化性依次增强
B.P、S、Cl最高正化合价依次升高,对应简单气态氢化物的稳定性依次增强
C.原子半径大小关系为NaD.Na、Mg、Al的氢氧化物的碱性依次减弱
4.原子序数依次增大的短周期元素X、Y、Z、W、M可形成a、b两种化合物(如图),a为磁共振氢谱中常用的参照物,b为有机合成中的一种还原剂。下列说法错误的是
A.原子半径:W>M>Z
B.元素非金属性:Z>M
C.W的最高价氧化物的水化物具有两性
D.常温常压下X与Z形成的化合物为气态
5.某酸根离子的电子数比硝酸根离子的电子数多10,则下列说法中正确的是
A.R与N原子电子层数相同
B.R与N原子最外层电子数相同
C.R与N的简单负离子所带的电荷数相同
D.中R元素与中N元素的化合价相同
6.铝原子结构示意图为,它在元素周期表中所处位置是
A.第二周期第ⅢA族 B.第二周期第ⅥA族
C.第三周期第ⅢA族 D.第三周期第ⅥA族
7.根据元素周期律,下列推断错误的是
A.原子半径:C > N B.热稳定性:HF < HCl
C.还原性:Mg > Al D.碱性:NaOH<KOH
8.下列关于物质性质变化的比较,不正确的是( )
A.酸性强弱:HI>HBr>HCl>HF
B.原子半径大小:Na>S>O
C.碱性强弱:KOH>NaOH>LiOH
D.还原性强弱:F->Cl->I-
9.化学科学与技术在宇宙探索、改进生活、改善环境与促进发展方面均发挥着关键性的作用。下列说法正确的是
A.指南针是我国古代的四大发明之一,制造指南针的磁性物质是FeO
B.湖南苗族银饰和江西景德镇彩瓷是我国特有的文化产品,其主要成分均为金属材料
C.人工合成淀粉不仅有利于解决人类的温饱问题,也有利于实现“碳中和”
D.北斗导航专用ASIC硬件结合国产处理器打造出的一颗真正意义的“中国芯”,其主要成分为SiO2
10.实验室下列做法正确的是
A.金属钠着火立即用水扑灭 B.用二硫化碳清洗试管壁附着的硫
C.氢氟酸保存在玻璃瓶中 D.隔绝空气密封保存日常所用铝条
11.有机化合物M的结构简式如右图所示,其组成元素X、Y、Z、W、Q为原子序数依次增大的短周期元素。只有Y、Z、W为同周期相邻元素,Z的原子序数与Q的最外层电子数相同。下列说法正确的是
A.简单氢化物的沸点由高到低顺序为
B.含氧酸的酸性强弱顺序为
C.元素第一电离能由小到大的顺序为
D.元素X、Z、W形成的离子化合物中含有正四面体结构
12.有A、B、C、D四种元素,质子数均小于18。A元素原子的最外层电子数是其电子层数的3倍;B元素的原子失去1个电子,所得到的微粒具有与氖原子相同的电子层结构;C元素是地壳中含量最多的金属元素;D元素的原子M层电子数是K层的3倍,下列说法不正确的是
A.A元素可以形成多种同素异形体
B.C的氧化物能与盐酸反应生成盐和水,所以C的氧化物为碱性氧化物
C.可以通过焰色反应检验B元素
D.A和D两种元素形成的化合物能与NaOH溶液反应
二、非选择题(共10题)
13.完成下表
核素 核电荷数 中子数 电子排布 元素所在周期 元素所在族
3 _______ _______ _______ _______
_______ _______ _______ 2 VI A族
_______ _______ 2,8,8 _______ _______
14.下列分离提纯中最适宜的方法是(填字母编号,每空只选一项):
A.洗气 B.升华 C.过滤 D.蒸发结晶 E.蒸馏 F.萃取 G.分液
①除去CO中混有的CO2___________;
②用75%的医用酒精制无水乙醇__________;
③提取碘水中的碘______________;
④从氯化钠和硝酸钾混合液中提取氯化钠_________;
⑤除去氯化钠溶液中的泥沙_________;
⑥分离植物油和水____________;
15.碘元素的一种核素可用于治疗肿瘤。该核素的质子数为_______,中子数为_______,质量数为_______,核外电子数为_______。
16.已知普通玻璃的成分为Na2O∶13%,CaO∶11.7%,SiO2∶75.3%。某玻璃厂现有石灰石500 t,纯碱2 400 t。计算上述原料能生产普通玻璃_________吨?
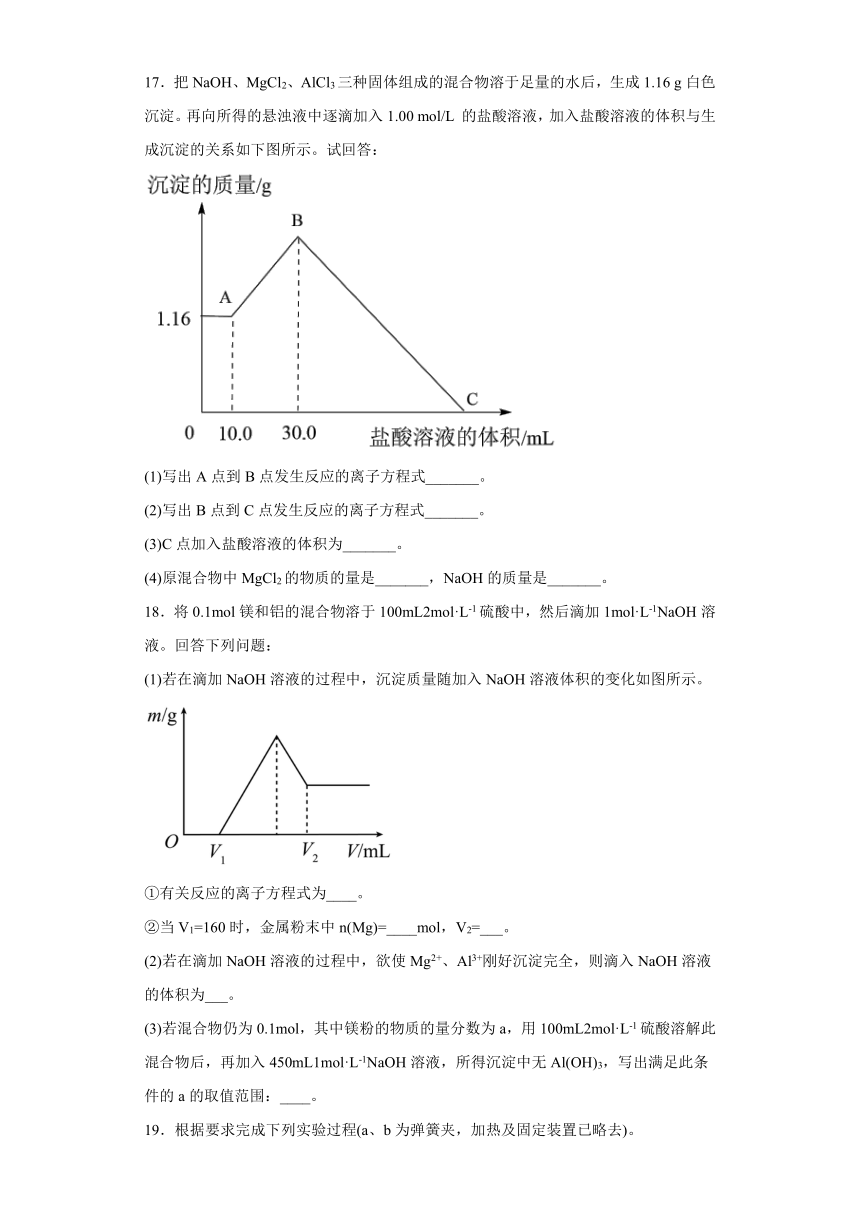
17.把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量的水后,生成1.16 g白色沉淀。再向所得的悬浊液中逐滴加入1.00 mol/L 的盐酸溶液,加入盐酸溶液的体积与生成沉淀的关系如下图所示。试回答:
(1)写出A点到B点发生反应的离子方程式_______。
(2)写出B点到C点发生反应的离子方程式_______。
(3)C点加入盐酸溶液的体积为_______。
(4)原混合物中MgCl2的物质的量是_______,NaOH的质量是_______。
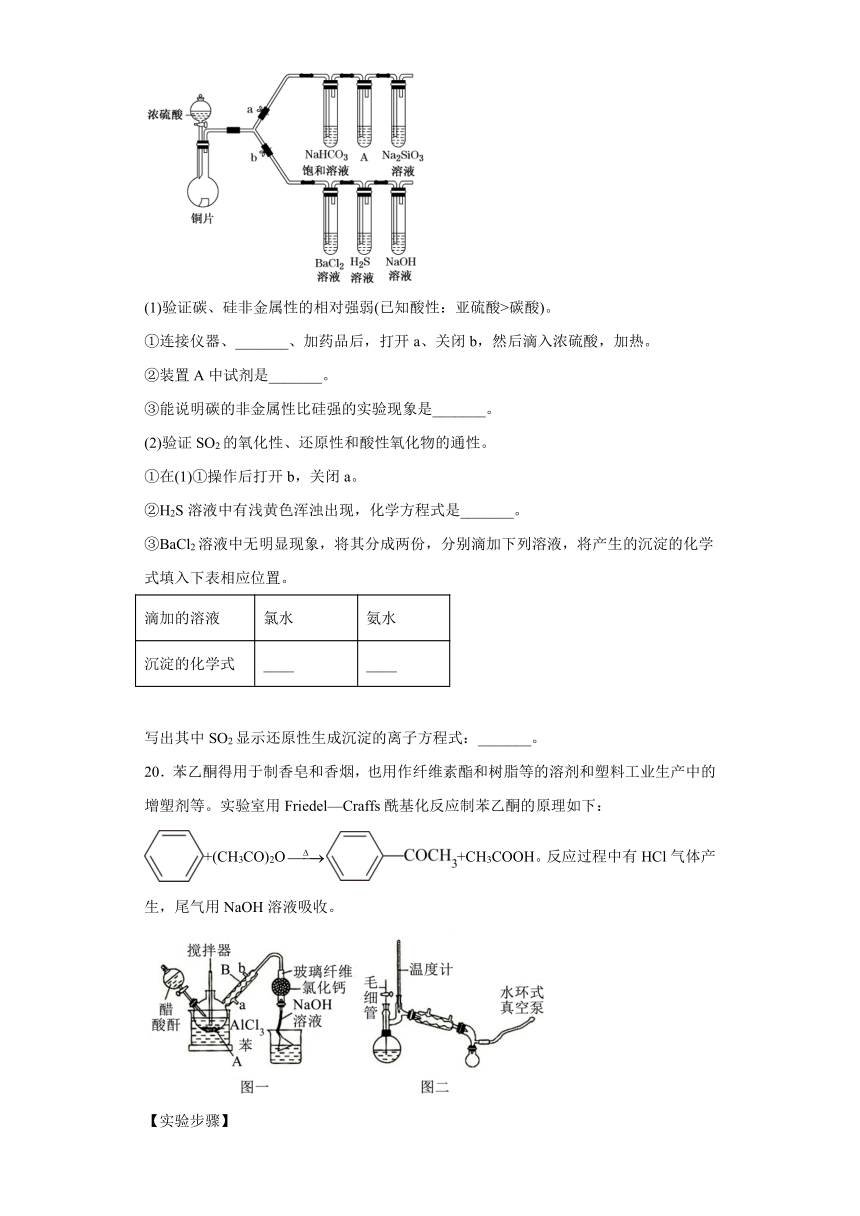
18.将0.1mol镁和铝的混合物溶于100mL2mol·L-1硫酸中,然后滴加1mol·L-1NaOH溶液。回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液体积的变化如图所示。
①有关反应的离子方程式为____。
②当V1=160时,金属粉末中n(Mg)=____mol,V2=___。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积为___。
(3)若混合物仍为0.1mol,其中镁粉的物质的量分数为a,用100mL2mol·L-1硫酸溶解此混合物后,再加入450mL1mol·L-1NaOH溶液,所得沉淀中无Al(OH)3,写出满足此条件的a的取值范围:____。
19.根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去)。
(1)验证碳、硅非金属性的相对强弱(已知酸性:亚硫酸>碳酸)。
①连接仪器、_______、加药品后,打开a、关闭b,然后滴入浓硫酸,加热。
②装置A中试剂是_______。
③能说明碳的非金属性比硅强的实验现象是_______。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①在(1)①操作后打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式是_______。
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
滴加的溶液 氯水 氨水
沉淀的化学式 ____ ____
写出其中SO2显示还原性生成沉淀的离子方程式:_______。
20.苯乙酮得用于制香皂和香烟,也用作纤维素酯和树脂等的溶剂和塑料工业生产中的增塑剂等。实验室用Friedel—Craffs酰基化反应制苯乙酮的原理如下:+(CH3CO)2O+CH3COOH。反应过程中有HCl气体产生,尾气用NaOH溶液吸收。
【实验步骤】
步骤一:向装有10mL分液漏斗、机械搅拌装置和回流装置(上端通过氯化钙干燥管与氯化氢气体吸收装置相连)的100mL仪器A中迅速加入13g(0.097mol)粉状无水三氯化铝和16mL(约14g,0.18mol)无水苯。在搅拌下将4mL(约4.3g,0.04mol)醋酸肝自分液漏斗慢慢滴加到A(先加几滴,待反应发生后再继续滴加),控制醋酸的滴加速度以使A稍热为宜。加完后(约10min),待反应稍和缓后在沸水浴中搅拌回流,直到不再有氯化氢气体逸出为止。
步骤二:反应结束,将A中的液体倒入冷水中,经处理得到较纯净的苯乙酮。
步骤三:经称重苯乙酮产量约为4.1g,计算产率。
已知在常压下:
名称 分子质量 颜色晶型 熔点 沸点 密度 溶解度
醋酸酐 102 无色液体 -73 140 1.082 与水反应
苯 78 无色液体 5.5 80.5 0.879 不溶
苯乙酮 120 无色液体 20.5 202 1.0281 微溶
(1)图一装置中仪器A名称是___。
(2)图一装置中漏斗一半扣在水面下、一半露在水面上的原因是___。
(3)制备过程中为什么要逐渐地滴加醋酸酐?___。
(4)图一装置中CaCl2的作用是___。
(5)步骤二为得到较纯净的苯乙酮,需要经过下列的操作:①蒸馏收集某温度下的馏分;②依次用10%的NaOH溶液、水洗分液;③用无水MgSO4干燥并过滤;④水层用苯萃取合并有机层;⑤分液。正确的顺序是___(填字母代号)。A.⑤④②③① B.⑤②③④① C.②④⑤①③ D.②④⑤③①
(6)本实验为收集产品用了减压蒸馏装置,如图二所示。装置中温度计水银球的位置是否正确?___(“是”或“否”)。收集产品,需要控制一定温度,可能是___(填字母代号)。
A.202℃B.220℃C.175℃
(7)经计算,该反应的产率为____(保留两位有效数)。
21.回答下列问题
(1)常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为:
_________________________________→___________
完善并配平该反应___________。
(2)铝与在酸性或碱性条件下均可反应,为了降低饮用水中的浓度,可以在碱性条件下用铝粉将还原为,完善并配平该反应:(产物中铝元素以偏铝酸根形式存在)___________
___________Al+_________________________________+______________________
(3)已知:与水不相溶且密度比水大,的溶液呈黄绿色,的溶液呈橙红色,且易从水溶液中溶入中。既能氧化,也能氧化。
①取溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为红色。另取少量反应后的溶液加入,振荡后,下层为无色液体。以上实验结论表明还原性:___________(填“>”或“<”)。
②若在溶液中通入标准状况下672mL的,取少量反应后的溶液加入,振荡后下层液体呈___________色,写出该反应的离子方程式___________。
22.如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)地壳中含量居于第二位的元素在周期表中的位置是_______。
(2)用电子式表示②的最高价氧化物的形成过程为_______。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:_______。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是_______(填字母)。
A.最高正化合价为+6
B.气态氢化物比H2S稳定
C.最高价氧化物对应水化物的酸性比硫酸弱
D.单质在常温下可与氢气化合
(5)已知Cs元素位于元素周期表中第六周期第IA族,请回答下列问题:
①铯的原子序数为_______。
②铯单质与H2O反应的化学反应方程式为_______。
③预测铯单质的还原性比钠单质的还原性_______(填“弱”或“强”)。
④下列推断正确的是_______(填字母)。
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为_______。
参考答案:
1.C
A.SO2的还原性将KMnO4还原而使其褪色,A错误;
B.NO2与水反应生成HNO3和NO,故NO2不是酸性氧化物,B错误;
C.Si的最高价氧化物对应水化物H2SiO3的酸性弱于C的最高价氧化物对应水化物H2CO3,故非金属性C强于Si,C正确;
D.CaCO3难溶于水,但由于碳酸酸性弱于盐酸,CO2与CaCl2溶液不反应,D错误;
故选C。
2.C
A.太阳能电池片的材料主要是硅,A项错误;
B.厨房燃气泄漏时,不能打开抽油烟机进行通风换气,避免电火花引起火灾,应直接开窗通风,B项错误;
C.生铁是铁和碳的合金,C项正确;
D.绿色化学是利用化学技术从源头上消除或减少污染的产生,D项错误。
故选C。
3.C
A.Na、Mg、Al在同周期,最外层电子数分别为1、2、3,从左向右金属性减弱,则单核离子的氧化性依次增强,A正确;
B.P、S、Cl在同周期,最高正价分别为5、6、7,从左向右非金属性增强,则气态氢化物的稳定性增强,B正确;
C.因同周期从左向右原子半径在逐渐减小,则同周期元素的原子半径以VIIA族的为最小,C错误;
D.Na、Mg、Al在同周期,从左向右金属性减弱,则对应的氢氧化物的碱性减弱,D正确;
故选C。
4.D
a为磁共振氢谱中常用的参照物,根据a的结构推测a为四甲基硅,M为Si元素、Z为C元素、X为H元素,b为有机合成中的一种还原剂,b应为四氢铝锂,W为Al元素,Y为Li元素,符合原子序数依次增大的短周期元素这一要求。
A. 核外电子层数越多,原子半径越大,电子层数相同时,核电荷数越大,原子半径越小,所以原子半径W>M>Z,A正确;
B. 同主族元素,从上到下,非金属性逐渐减弱,所以C元素的非金属性强于Si,B正确;
C. W的最高价氧化物的水化物为,为两性氢氧化物,C正确;
D. X与Z形成的化合物为烃,当烃的相对分子量较大时,常温常压下可以为液态和固态,D错误;
故答案选D。
5.D
A.和所带电荷数一样,且的电子数比硝酸根离子的电子数多10,所以R的质子数为7+10=17,R为Cl,R电子层数为3,N的电子层数为2,电子层数不同,故A错误;
B.R是Cl,最外层电子数是7个,N的最外层电子数是5个,R与N原子最外层电子数不相同,故B错误;
C.R与N的简单负离子分别是Cl-、N3-,二者所带的电荷数不相同,故C错误;
D.和均带1个负电荷,且氧元素化合价均是-2价,所以R、N元素的化合价均为+5,故D正确;
故选D。
6.C
根据原子结构示意,有3个电子层,位于第三周期,最外层电子数为3,位于第ⅢA族,所以该元素在周期表中位置为第3周期第ⅢA族,故选C。
7.B
A.同周期元素,从左到右原子半径依次减小,则碳原子的原子半径大于氮原子,故A正确;
B.元素的非金属性越强,氢化物的热稳定性越强,氟元素的非金属性强于氯元素,则氟化氢的热稳定性强于氯化氢,故B错误;
C.元素的金属性越强,金属单质的还原性越强,镁元素的金属性强于铝元素,则镁的还原性强于铝,故C正确;
D.元素的金属性越强,最高价氧化物对应水化物的碱性越强,钠元素的金属性弱于钾元素,则氢氧化钠的碱性弱于氢氧化钾,故D正确;
故选B。
8.D
A、第ⅤⅡA主族元素从上到下氢化物稳定性减弱,溶于水形成酸的酸性从上到下增强,即酸性强弱为,故A正确;
B、同周期从左到右原子半径依次减小,同主族从上到下原子半径逐渐增大,Na、S、O三种原子的半径大小为,故B正确;
C、第ⅠA主族金属形成的最高价氢氧化物碱性依次增强,,故C正确;
D、第ⅤⅡA主族元素单质的氧化性从上到下依次减弱,对应阴离子的还原性依次增强,故D错误;
故选D。
9.C
A.制造指南针的磁性物质是Fe3O4,故A错误;
B.苗族银饰和景德镇彩瓷是我国特有的文化产品,苗族银饰的主要成分为金属材料,而景德镇彩瓷的主要成分为无机非金属材料,故B错误;
C.二氧化碳与氢气合成淀粉,可以将二氧化碳回收利用并转化为有机物,因此人工合成淀粉不仅有利于解决人类的温饱问题,也有利于实现“碳中和”,故C正确;
D.硅属于半导体材料,芯片的主要成分为晶体Si,故D错误;
故选C。
10.B
A.金属钠着火立即用沙子盖灭,故A错误;
B.硫易溶于二硫化碳,用二硫化碳清洗试管壁附着的硫,故B正确;
C.氢氟酸能腐蚀玻璃,氢氟酸不能保存在玻璃瓶中,故C错误;
D.铝在空气形成致密氧化膜保护内部金属不再氧化,铝条不用密封保存,故D错误;
选B。
11.D
Z的原子序数与Q的最外层电子数相同,说明Z为第二周期,Q为第三周期元素,依据有机物结构简式可知,元素Y形成四个键,应为C元素,则Z、W依次为N、O元素,Q则为Cl元素,X为H元素。
A.W、Q的简单氢化物依次为、HCl,其沸点由高到低顺序为,A错误;
B.Q、Y、Z对应最高价含氧酸分别为、、,满足酸性强弱顺序为,但含氧酸则不正确,如HClO酸性弱于,B错误;
C.N元素2p轨道半充满,较为稳定,元素第一电离能最大,即顺序应为,C错误;
D.元素X、Z、W形成的离子化合物中含有的为正四面体结构离子,D正确。
故选D。
12.B
A、B、C、D四种元素的质子数都小于18,A元素原子的最外层电子数是其电子层数的3倍,A有2个电子层符合电子排布规律,最外层电子数为6,A为O;B元素的原子失去1个电子,所得到的微粒具有与氖原子相同的电子层结构,B为Na;C元素是地壳中含量最多的金属元素,C为Al;D元素的原子M层电子数是K层的3倍,M层电子数为K层的3倍=6,D为S,由上述分析可知,A为O、B为Na、C为Al、D为S;
A.A为O元素,同素异形体有O2、O3,A正确;
B.C为Al其氧化物为Al2O3,既可以与强酸反应,也可以与强碱反应,Al2O3为两性氧化物,B错误;
C.Na元素的焰色反应为黄色,C正确;
D.二氧化硫或三氧化硫均能与NaOH反应,生成盐和水,D正确;
故答案为:B。
13. 4 2,1 2 I A族 8 10 2,8 18 22 3 0
的核电荷数为3、中子数为7—3=4,电子排布为2,1,位于元素周期表第二周期I A族;的核电荷数为8、中子数为18—8=10,电子排布为2,8,位于元素周期表第二周期VI A族;的核电荷数为18、中子数为40—18=22,电子排布为2,8,8,位于元素周期表第二三周期0族,故答案为:4;2,1;2;I A族;8;10;2,8;18;22;3;0。
14. A E F D C G
①CO2是酸性氧化物可与碱溶液反应,除去CO中混有的CO2可将混合气通过盛有NaOH溶液的洗气瓶进行洗气,故选A;
②水和乙醇的沸点不同,水和乙醇互溶,用75%的医用酒精制无水乙醇,可用蒸馏的方法,故选E;
③碘易溶于有机溶剂,可用萃取的方法提取碘水中的碘,故选F;
④氯化钠和硝酸钾的溶解度随温度变化不同,氯化钠的溶解度随温度升高增大不明显,硝酸钾的溶解度随温度升高明显增大,从氯化钠和硝酸钾混合液中提取氯化钠可用蒸发结晶的方法,故选D;
⑤泥沙不溶于水,可用过滤的方法除去氯化钠溶液中的泥沙,故选C;
⑥植物油和水二者互不相溶,可用分液的方法分离,故选G;
15. 53 72 125 53
核素符合左下角为质子数、左上角为质量数,则该核素的质子数为53,中子数=质量数-质子数=125-53=72,质量数为125,核外电子数等于质子数=53。
16.2 393.16 t
普通玻璃中n(Na2O)∶n(CaO)∶n(SiO2)=∶∶≈1∶1∶6,
因为Na2O~Na2CO3,CaO~CaCO3,
所以三种原料的物质的量之比为Na2CO3∶CaCO3∶SiO2=1∶1∶6。
题中所给原料的物质的量之比为∶≈5∶22.6 = 1∶4.52,显然Na2CO3有剩余。
设500吨石灰石折合氧化钙xt
56:x=100∶500,解得x=280 t,280 t÷11.7%≈2 393.16 t。故答案为:2393.16 t。
17.(1)+H++H2O= Al(OH)3↓
(2)Al(OH)3+3H+=Al3++3H2O、Mg(OH)2+2H+=Mg2++2H2O
(3)130 mL
(4) 0.02 mol 0.13 mol
向所得悬浊液中逐滴加入1.00 mol/L盐酸溶液时,A点之前没有沉淀生成,说明溶液中NaOH过量,故混合物溶于水之后所含物质为:NaAlO2、NaOH、Mg(OH)2,A点之前发生反应:NaOH+HCl=NaCl+H2O,AB段沉淀增加,发生反应:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,BC段发生沉淀溶解,对应反应为:Al(OH)3+3HCl=AlCl3+3H2O、Mg(OH)2+2HCl=MgCl2+2H2O。
(1)
由分析知,AB段发生反应:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,对应离子方程式为:+H++H2O= Al(OH)3↓;
(2)
由分析知,BC段发生沉淀溶解,对应离子方程式为:Al(OH)3+3H+=Al3++3H2O、Mg(OH)2+2H+=Mg2++2H2O;
(3)
A点沉淀是Mg(OH)2,物质的量是1.16 g÷58 g/mol=0.02 mol,根据Mg原子守恒得n(MgCl2)=0.02 mol;AB段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,根据反应比例知,n( )=n(HCl)= n[Al(OH)3]=1 mol/L×(0.03-0.01)L=0.02 mol,根据铝元素守恒得n(AlCl3)=n()=0.02 mol, BC段消耗盐酸物质的量n(HCl,BC)=2n[Mg(OH)2]+ 3n[Al(OH)3]=0.02 mol×2+0.02 mol×3=0.1 mol,对应消耗体积V(HCl,BC)=,即100 mL,故C点加入盐酸总体积=30+100=130 mL,故此处填130 mL;
(4)
由(3)分析知,n(MgCl2)=0.02 mol;根据反应知,B点溶液中溶质为NaCl,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.02 mol×2+0.02 mol×3+0.03 L×1 mol/L=0.13 mol。
18.(1) OH-+H+=H2O、Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=+2H2O 0.06 440
(2)400
(3)0.5≤a<1
【解析】(1)
①O点到V1点说明为H2SO4和NaOH反应。离子方程式为:OH-+H+=H2O,V1是开始生成沉淀,离子方程式为:Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,然后沉淀减少,是由于Al(OH)3+OH-=+2H2O,故在滴加NaOH溶液过程中有关反应的离子方程式为OH-+H+=H2O、Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=+2H2O,故答案为:OH-+H+=H2O、Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=+2H2O;
②当V1=160mL时,此时溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=n(Na+)=n(NaOH)=×0.16L×1mol/L=0.08mol,设MgSO4为xmol,Al2(SO4)3为ymol,则:根据Mg原子、Al原子守恒有:x+2y=0.1,根据离子守恒有:x+3y=0.2-0.08,联立方程解得:x=0.06、y=0.02,所以金属粉末中n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol,滴加NaOH溶液到体积V2时时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.1L×2mol/L×+0.04mol=0.44mol,所以,V2==0.44L=440mL,故答案为:0.06;440;
(2)
当溶液中Mg2+、Al3+恰好沉淀完全时,此时,溶液是Na2SO4溶液,根据离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2(H2SO4)=2×0.1L×2mol/L=0.4mol,所以,V(NaOH)==0.4L=400mL,故答案为:400;
(3)
若混合物仍为0.1mol,其中镁的物质的量分数为a,用100mL 2mol L-1硫酸溶解后,再加入450mL 1mol L-1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:v1=400ml,再加入50mL 1mol L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,Al(OH)3+NaOH=NaAlO2+2H2O,Al(OH)3最大取值0.05mol,即0<n(Al)≤0.05mol,n(Mg)+n(Al)=0.1mol,则0.5≤n(Mg)<1,故答案为:0.5≤a<1;
19.(1) 检验装置气密性 酸性KMnO4溶液 A中酸性KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀
(2) 2H2S+SO2=3S↓+2H2O BaSO4 BaSO3 Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-
本实验Cu与浓硫酸加热反应生成SO2,气体分两个方向进行,通a是检验碳硅元素的非金属性强弱;通b则是检验SO2的性质。
(1)确保装置气密性良好后加药品反应,打开a、关闭b ,使SO2与NaHCO3饱和溶液反应,生成的气体除了CO2还有SO2,需将气体通过酸性KMnO4溶液,不褪为无色的情况下,说明已将CO2中的SO2完全除去,此时通入Na2SiO3溶液的是CO2,若产生白色沉淀H2SiO3,则说明H2CO3的酸性强于H2SiO3,而H2CO3和H2SiO3分别是C和 Si元素的最高价氧化物对应水化物,故说明碳的非金属性比硅强。
(2)打开b、关闭a ,SO2与H2S 溶液反应:2H2S+SO2=3S↓+2H2O,出现浅黄色浑浊;因H2SO 3酸性弱于HCl,SO2通入BaCl2溶液不反应,但再往溶液滴入氯水后,SO2被氧化:Cl2+SO2+2H2O=H2SO4+2HCl,H2SO4与BaCl2产生BaSO4沉淀;若是往溶液滴加氨水,则SO2与氨水反应生成(NH4)2SO3,与Ba2+结合生成BaSO3沉淀。
20.(1)三颈烧瓶
(2)因为远离水面,氯化氢气体不被吸收而逸出,造成空气污染;若深入到水中,氯化氢极易溶于水造成倒吸
(3)醋酸酐与苯反应是放热反应,滴的太快,放热量太大,温度不易控制,温度急剧上升,轻则发生副反应,重则毁坏仪器引起危险
(4)防止水蒸气进入A装置,与醋酸酐反应,且AlCl3遇水后,失去催化能力
(5)A
(6) 是 C
(7)85%
有机反应受温度影响很大,,温度过高,容易发生副反应或使有机物分解。由苯和乙酸酐制取苯乙酮的反应放热,因此需要逐滴滴加醋酸酐,以控制反应体系温度,防止其升温过快。本实验需要严格控制无水环境,因为醋酸酐与AlCl3都是极易水解的物质。
(1)
仪器A为三颈烧瓶。
(2)
因为远离水面,氯化氢气体不被吸收而逸出,造成空气污染;若深入到水中,氯化氢极易溶于水造成倒吸,故要漏斗一半扣在水面下、一半露在水面上。
(3)
因为醋酸酐与苯反应是放热反应,滴的太快,放热量太大,温度不易控制,温度急剧上升,轻则发生副反应,重则毁坏仪器引起危险,故需要逐渐地滴加醋酸酐。
(4)
CaCl2具有吸水干燥的作用,故作用为防止水蒸气进入A装置,与醋酸酐反应,且AlCl3遇水后,失去催化能力。
(5)
步骤一得到的苯乙酮中含有苯、醋酸酐等杂质,故1.分液除去分层的物质,2.为提高产率,水层用苯萃取合并有机层,3.依次用10%的NaOH溶液洗涤除去醋酸酐,再用水洗除去氢氧化钠溶液,最后分液,4.无水硫酸镁干燥除水,5.蒸馏除去苯。故顺序为⑤④②③①,选A。
(6)
蒸馏装置中温度计测量的是馏分的温度,故温度计位置正确,温度应该控制比苯乙酮的沸点低,比其他杂质的沸点高,故为C。
(7)
根据反应式+(CH3CO)2O+CH3COOH,又0.04mol醋酸酐参加反应,故生成苯乙酮为0.04mol,所以产率==85%。
21.(1)
(2)
(3) > 橙红
【解析】(1)
由方程式可知,氯酸钾氧化碘单质,生成碘酸氢钾[KH(IO3)2],KClO3一般被还原为KCl,根据原子守恒和得失电子守恒,可得化学方程式为:6I2+11KClO3+3H2O═6KH(IO3)2+5KCl+3Cl2↑。
(2)
反应物为Al、、OH-,生成物为:N2、H2O、碱性条件下铝参加反应生成物还有,反应中Al元素化合价由0价升高为+3价,共升高3价,→N2↑,氮元素化合价由+5价降低为0价,共降低10价,最小公倍数为30,故Al的系数为10,N2系数为3,由氮元素守恒可知系数为6,由电荷守恒可知OH-系数为4,由H元素守恒可知H2O前面的系数为2,故配平后离子方程式为:。
(3)
①FeBr2溶液中滴加几滴新制的氯水,振荡后溶液呈黄色,取少量反应后的溶液加入KSCN溶液,溶液变为血红色,说明有Fe3+生成,另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体,说明没有Br2生成,由此可知Fe2+被氧化为Fe3+,而Br-未被氧化,还原性强的先被氧化,则可证明还原性Fe2+>Br-;
②n(FeBr2)=0.04L×0.1mol/L=0.004mol,n(Cl2)==0.003mol,二者的物质的量比为4:3,结合还原性Fe2+>Br-,根据“2Fe2++Cl2=2Fe3++2Cl-”知,Fe2+完全被氧化需要消耗n(Cl2)=n(Fe2+)=×0.004mol=0.002mol,则剩余的Cl2氧化溴离子生成Br2,根据“2Br-+Cl2=Br2+2Cl-”知,0.001molCl2氧化的n(Br-)=2n(Cl2)=2×0.001mol=0.002mol,所以总反应中氯气完全被还原,亚铁离子完全被氧化、有0.002mol的溴离子被氧化,部分溴离子未被氧化,则取少量反应后的溶液加入CCl4,振荡后,下层为无色液体为橙红色,参加反应的n(Cl2):n(Fe2+):n(Br-)=0.003mol:0.004mol:0.002mol=3:4:2,则发生的离子方程式为4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-。
22. 第三周期第ⅣA族 、 BD 55 强 B b=a+1或b=a+11
根据元素周期表的结构可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl。
(1)地壳中含量居于第二位的元素是Si,Si位于周期表中第三周期第ⅣA族,故答案为:第三周期第ⅣA族;
(2)O原子和C原子通过共用电子对形成二氧化碳,所以其形成过程为;
(3)H、Na、O元素形成的化合物可能是H2O、H2O2、NaOH、Na2O、Na2O2、NaH,其中既含离子键又含共价键的离子化合物是NaOH和Na2O2,电子式为:、,故答案为:、;
(4)W为Se,Se的非金属性比S弱,故H2Se的稳定性不及H2S,常温下Se与H2难以化合,故选项B、D所述性质不可能,故答案为:BD;
(5)①根据碱金属元素核外电子排布规律,结合铯在周期表中的位置可知,铯原子核外共有6个电子层,每个电子层的电子数目分别是2、8、18、18、8、1,原子序数等于核外电子总数,故为55,故答案为:55;
②铯与钠、钾同主族,具有极强的金属性,与H2O反应的化学方程式为;
③同主族元素,从上到下,金属性依次增强,故铯单质的还原性比钠单质强;
④A项,与铯同主族的氢元素为非金属元素,错误;
B项,铯单质还原性较强,反应时铯原子易失去电子,正确;
C项,碳酸钠为可溶性盐,以此类推,碳酸铯是一种可溶性盐,错误;
D项,金属性较强的元素,其简单阳离子的氧化性较弱,故铯离子的氧化性弱于钾离子,错误;
故答案为:;强;B;
(6) 若X位于第二、三周期,则b=a+1;若X位于第四周期,则b=a+11,故答案为:b=a+1或b=a+11。
一、单选题(共12题)
1.下列说法正确的是
A.SO2能使酸性KMnO4溶液褪色,故SO2有漂白性
B.NO2与水反应生成HNO3,故NO2是酸性氧化物
C.H2SiO3的酸性弱于H2CO3,故非金属性C强于Si
D.CaCO3难溶于水,故CO2能与CaCl2溶液反应
2.化学与生产生活及环境密切相关。下列说法正确的是
A.“玉兔号”月球车帆板太阳能电池片的材料主要是二氧化硅
B.厨房燃气泄漏时,要及时打开抽油烟机进行通风换气
C.“奋斗者”号潜水器下沉时要携带两组压载铁,生铁是合金
D.绿色化学研究的是如何用化学技术与原理治理已经被污染的环境
3.下列关于元素周期律的叙述中不正确的是
A.Na、Mg、Al最外层电子数依次增多,其单核离子的氧化性依次增强
B.P、S、Cl最高正化合价依次升高,对应简单气态氢化物的稳定性依次增强
C.原子半径大小关系为Na
4.原子序数依次增大的短周期元素X、Y、Z、W、M可形成a、b两种化合物(如图),a为磁共振氢谱中常用的参照物,b为有机合成中的一种还原剂。下列说法错误的是
A.原子半径:W>M>Z
B.元素非金属性:Z>M
C.W的最高价氧化物的水化物具有两性
D.常温常压下X与Z形成的化合物为气态
5.某酸根离子的电子数比硝酸根离子的电子数多10,则下列说法中正确的是
A.R与N原子电子层数相同
B.R与N原子最外层电子数相同
C.R与N的简单负离子所带的电荷数相同
D.中R元素与中N元素的化合价相同
6.铝原子结构示意图为,它在元素周期表中所处位置是
A.第二周期第ⅢA族 B.第二周期第ⅥA族
C.第三周期第ⅢA族 D.第三周期第ⅥA族
7.根据元素周期律,下列推断错误的是
A.原子半径:C > N B.热稳定性:HF < HCl
C.还原性:Mg > Al D.碱性:NaOH<KOH
8.下列关于物质性质变化的比较,不正确的是( )
A.酸性强弱:HI>HBr>HCl>HF
B.原子半径大小:Na>S>O
C.碱性强弱:KOH>NaOH>LiOH
D.还原性强弱:F->Cl->I-
9.化学科学与技术在宇宙探索、改进生活、改善环境与促进发展方面均发挥着关键性的作用。下列说法正确的是
A.指南针是我国古代的四大发明之一,制造指南针的磁性物质是FeO
B.湖南苗族银饰和江西景德镇彩瓷是我国特有的文化产品,其主要成分均为金属材料
C.人工合成淀粉不仅有利于解决人类的温饱问题,也有利于实现“碳中和”
D.北斗导航专用ASIC硬件结合国产处理器打造出的一颗真正意义的“中国芯”,其主要成分为SiO2
10.实验室下列做法正确的是
A.金属钠着火立即用水扑灭 B.用二硫化碳清洗试管壁附着的硫
C.氢氟酸保存在玻璃瓶中 D.隔绝空气密封保存日常所用铝条
11.有机化合物M的结构简式如右图所示,其组成元素X、Y、Z、W、Q为原子序数依次增大的短周期元素。只有Y、Z、W为同周期相邻元素,Z的原子序数与Q的最外层电子数相同。下列说法正确的是
A.简单氢化物的沸点由高到低顺序为
B.含氧酸的酸性强弱顺序为
C.元素第一电离能由小到大的顺序为
D.元素X、Z、W形成的离子化合物中含有正四面体结构
12.有A、B、C、D四种元素,质子数均小于18。A元素原子的最外层电子数是其电子层数的3倍;B元素的原子失去1个电子,所得到的微粒具有与氖原子相同的电子层结构;C元素是地壳中含量最多的金属元素;D元素的原子M层电子数是K层的3倍,下列说法不正确的是
A.A元素可以形成多种同素异形体
B.C的氧化物能与盐酸反应生成盐和水,所以C的氧化物为碱性氧化物
C.可以通过焰色反应检验B元素
D.A和D两种元素形成的化合物能与NaOH溶液反应
二、非选择题(共10题)
13.完成下表
核素 核电荷数 中子数 电子排布 元素所在周期 元素所在族
3 _______ _______ _______ _______
_______ _______ _______ 2 VI A族
_______ _______ 2,8,8 _______ _______
14.下列分离提纯中最适宜的方法是(填字母编号,每空只选一项):
A.洗气 B.升华 C.过滤 D.蒸发结晶 E.蒸馏 F.萃取 G.分液
①除去CO中混有的CO2___________;
②用75%的医用酒精制无水乙醇__________;
③提取碘水中的碘______________;
④从氯化钠和硝酸钾混合液中提取氯化钠_________;
⑤除去氯化钠溶液中的泥沙_________;
⑥分离植物油和水____________;
15.碘元素的一种核素可用于治疗肿瘤。该核素的质子数为_______,中子数为_______,质量数为_______,核外电子数为_______。
16.已知普通玻璃的成分为Na2O∶13%,CaO∶11.7%,SiO2∶75.3%。某玻璃厂现有石灰石500 t,纯碱2 400 t。计算上述原料能生产普通玻璃_________吨?
17.把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量的水后,生成1.16 g白色沉淀。再向所得的悬浊液中逐滴加入1.00 mol/L 的盐酸溶液,加入盐酸溶液的体积与生成沉淀的关系如下图所示。试回答:
(1)写出A点到B点发生反应的离子方程式_______。
(2)写出B点到C点发生反应的离子方程式_______。
(3)C点加入盐酸溶液的体积为_______。
(4)原混合物中MgCl2的物质的量是_______,NaOH的质量是_______。
18.将0.1mol镁和铝的混合物溶于100mL2mol·L-1硫酸中,然后滴加1mol·L-1NaOH溶液。回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液体积的变化如图所示。
①有关反应的离子方程式为____。
②当V1=160时,金属粉末中n(Mg)=____mol,V2=___。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积为___。
(3)若混合物仍为0.1mol,其中镁粉的物质的量分数为a,用100mL2mol·L-1硫酸溶解此混合物后,再加入450mL1mol·L-1NaOH溶液,所得沉淀中无Al(OH)3,写出满足此条件的a的取值范围:____。
19.根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去)。
(1)验证碳、硅非金属性的相对强弱(已知酸性:亚硫酸>碳酸)。
①连接仪器、_______、加药品后,打开a、关闭b,然后滴入浓硫酸,加热。
②装置A中试剂是_______。
③能说明碳的非金属性比硅强的实验现象是_______。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①在(1)①操作后打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式是_______。
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
滴加的溶液 氯水 氨水
沉淀的化学式 ____ ____
写出其中SO2显示还原性生成沉淀的离子方程式:_______。
20.苯乙酮得用于制香皂和香烟,也用作纤维素酯和树脂等的溶剂和塑料工业生产中的增塑剂等。实验室用Friedel—Craffs酰基化反应制苯乙酮的原理如下:+(CH3CO)2O+CH3COOH。反应过程中有HCl气体产生,尾气用NaOH溶液吸收。
【实验步骤】
步骤一:向装有10mL分液漏斗、机械搅拌装置和回流装置(上端通过氯化钙干燥管与氯化氢气体吸收装置相连)的100mL仪器A中迅速加入13g(0.097mol)粉状无水三氯化铝和16mL(约14g,0.18mol)无水苯。在搅拌下将4mL(约4.3g,0.04mol)醋酸肝自分液漏斗慢慢滴加到A(先加几滴,待反应发生后再继续滴加),控制醋酸的滴加速度以使A稍热为宜。加完后(约10min),待反应稍和缓后在沸水浴中搅拌回流,直到不再有氯化氢气体逸出为止。
步骤二:反应结束,将A中的液体倒入冷水中,经处理得到较纯净的苯乙酮。
步骤三:经称重苯乙酮产量约为4.1g,计算产率。
已知在常压下:
名称 分子质量 颜色晶型 熔点 沸点 密度 溶解度
醋酸酐 102 无色液体 -73 140 1.082 与水反应
苯 78 无色液体 5.5 80.5 0.879 不溶
苯乙酮 120 无色液体 20.5 202 1.0281 微溶
(1)图一装置中仪器A名称是___。
(2)图一装置中漏斗一半扣在水面下、一半露在水面上的原因是___。
(3)制备过程中为什么要逐渐地滴加醋酸酐?___。
(4)图一装置中CaCl2的作用是___。
(5)步骤二为得到较纯净的苯乙酮,需要经过下列的操作:①蒸馏收集某温度下的馏分;②依次用10%的NaOH溶液、水洗分液;③用无水MgSO4干燥并过滤;④水层用苯萃取合并有机层;⑤分液。正确的顺序是___(填字母代号)。A.⑤④②③① B.⑤②③④① C.②④⑤①③ D.②④⑤③①
(6)本实验为收集产品用了减压蒸馏装置,如图二所示。装置中温度计水银球的位置是否正确?___(“是”或“否”)。收集产品,需要控制一定温度,可能是___(填字母代号)。
A.202℃B.220℃C.175℃
(7)经计算,该反应的产率为____(保留两位有效数)。
21.回答下列问题
(1)常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为:
_________________________________→___________
完善并配平该反应___________。
(2)铝与在酸性或碱性条件下均可反应,为了降低饮用水中的浓度,可以在碱性条件下用铝粉将还原为,完善并配平该反应:(产物中铝元素以偏铝酸根形式存在)___________
___________Al+_________________________________+______________________
(3)已知:与水不相溶且密度比水大,的溶液呈黄绿色,的溶液呈橙红色,且易从水溶液中溶入中。既能氧化,也能氧化。
①取溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为红色。另取少量反应后的溶液加入,振荡后,下层为无色液体。以上实验结论表明还原性:___________(填“>”或“<”)。
②若在溶液中通入标准状况下672mL的,取少量反应后的溶液加入,振荡后下层液体呈___________色,写出该反应的离子方程式___________。
22.如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)地壳中含量居于第二位的元素在周期表中的位置是_______。
(2)用电子式表示②的最高价氧化物的形成过程为_______。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:_______。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是_______(填字母)。
A.最高正化合价为+6
B.气态氢化物比H2S稳定
C.最高价氧化物对应水化物的酸性比硫酸弱
D.单质在常温下可与氢气化合
(5)已知Cs元素位于元素周期表中第六周期第IA族,请回答下列问题:
①铯的原子序数为_______。
②铯单质与H2O反应的化学反应方程式为_______。
③预测铯单质的还原性比钠单质的还原性_______(填“弱”或“强”)。
④下列推断正确的是_______(填字母)。
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为_______。
参考答案:
1.C
A.SO2的还原性将KMnO4还原而使其褪色,A错误;
B.NO2与水反应生成HNO3和NO,故NO2不是酸性氧化物,B错误;
C.Si的最高价氧化物对应水化物H2SiO3的酸性弱于C的最高价氧化物对应水化物H2CO3,故非金属性C强于Si,C正确;
D.CaCO3难溶于水,但由于碳酸酸性弱于盐酸,CO2与CaCl2溶液不反应,D错误;
故选C。
2.C
A.太阳能电池片的材料主要是硅,A项错误;
B.厨房燃气泄漏时,不能打开抽油烟机进行通风换气,避免电火花引起火灾,应直接开窗通风,B项错误;
C.生铁是铁和碳的合金,C项正确;
D.绿色化学是利用化学技术从源头上消除或减少污染的产生,D项错误。
故选C。
3.C
A.Na、Mg、Al在同周期,最外层电子数分别为1、2、3,从左向右金属性减弱,则单核离子的氧化性依次增强,A正确;
B.P、S、Cl在同周期,最高正价分别为5、6、7,从左向右非金属性增强,则气态氢化物的稳定性增强,B正确;
C.因同周期从左向右原子半径在逐渐减小,则同周期元素的原子半径以VIIA族的为最小,C错误;
D.Na、Mg、Al在同周期,从左向右金属性减弱,则对应的氢氧化物的碱性减弱,D正确;
故选C。
4.D
a为磁共振氢谱中常用的参照物,根据a的结构推测a为四甲基硅,M为Si元素、Z为C元素、X为H元素,b为有机合成中的一种还原剂,b应为四氢铝锂,W为Al元素,Y为Li元素,符合原子序数依次增大的短周期元素这一要求。
A. 核外电子层数越多,原子半径越大,电子层数相同时,核电荷数越大,原子半径越小,所以原子半径W>M>Z,A正确;
B. 同主族元素,从上到下,非金属性逐渐减弱,所以C元素的非金属性强于Si,B正确;
C. W的最高价氧化物的水化物为,为两性氢氧化物,C正确;
D. X与Z形成的化合物为烃,当烃的相对分子量较大时,常温常压下可以为液态和固态,D错误;
故答案选D。
5.D
A.和所带电荷数一样,且的电子数比硝酸根离子的电子数多10,所以R的质子数为7+10=17,R为Cl,R电子层数为3,N的电子层数为2,电子层数不同,故A错误;
B.R是Cl,最外层电子数是7个,N的最外层电子数是5个,R与N原子最外层电子数不相同,故B错误;
C.R与N的简单负离子分别是Cl-、N3-,二者所带的电荷数不相同,故C错误;
D.和均带1个负电荷,且氧元素化合价均是-2价,所以R、N元素的化合价均为+5,故D正确;
故选D。
6.C
根据原子结构示意,有3个电子层,位于第三周期,最外层电子数为3,位于第ⅢA族,所以该元素在周期表中位置为第3周期第ⅢA族,故选C。
7.B
A.同周期元素,从左到右原子半径依次减小,则碳原子的原子半径大于氮原子,故A正确;
B.元素的非金属性越强,氢化物的热稳定性越强,氟元素的非金属性强于氯元素,则氟化氢的热稳定性强于氯化氢,故B错误;
C.元素的金属性越强,金属单质的还原性越强,镁元素的金属性强于铝元素,则镁的还原性强于铝,故C正确;
D.元素的金属性越强,最高价氧化物对应水化物的碱性越强,钠元素的金属性弱于钾元素,则氢氧化钠的碱性弱于氢氧化钾,故D正确;
故选B。
8.D
A、第ⅤⅡA主族元素从上到下氢化物稳定性减弱,溶于水形成酸的酸性从上到下增强,即酸性强弱为,故A正确;
B、同周期从左到右原子半径依次减小,同主族从上到下原子半径逐渐增大,Na、S、O三种原子的半径大小为,故B正确;
C、第ⅠA主族金属形成的最高价氢氧化物碱性依次增强,,故C正确;
D、第ⅤⅡA主族元素单质的氧化性从上到下依次减弱,对应阴离子的还原性依次增强,故D错误;
故选D。
9.C
A.制造指南针的磁性物质是Fe3O4,故A错误;
B.苗族银饰和景德镇彩瓷是我国特有的文化产品,苗族银饰的主要成分为金属材料,而景德镇彩瓷的主要成分为无机非金属材料,故B错误;
C.二氧化碳与氢气合成淀粉,可以将二氧化碳回收利用并转化为有机物,因此人工合成淀粉不仅有利于解决人类的温饱问题,也有利于实现“碳中和”,故C正确;
D.硅属于半导体材料,芯片的主要成分为晶体Si,故D错误;
故选C。
10.B
A.金属钠着火立即用沙子盖灭,故A错误;
B.硫易溶于二硫化碳,用二硫化碳清洗试管壁附着的硫,故B正确;
C.氢氟酸能腐蚀玻璃,氢氟酸不能保存在玻璃瓶中,故C错误;
D.铝在空气形成致密氧化膜保护内部金属不再氧化,铝条不用密封保存,故D错误;
选B。
11.D
Z的原子序数与Q的最外层电子数相同,说明Z为第二周期,Q为第三周期元素,依据有机物结构简式可知,元素Y形成四个键,应为C元素,则Z、W依次为N、O元素,Q则为Cl元素,X为H元素。
A.W、Q的简单氢化物依次为、HCl,其沸点由高到低顺序为,A错误;
B.Q、Y、Z对应最高价含氧酸分别为、、,满足酸性强弱顺序为,但含氧酸则不正确,如HClO酸性弱于,B错误;
C.N元素2p轨道半充满,较为稳定,元素第一电离能最大,即顺序应为,C错误;
D.元素X、Z、W形成的离子化合物中含有的为正四面体结构离子,D正确。
故选D。
12.B
A、B、C、D四种元素的质子数都小于18,A元素原子的最外层电子数是其电子层数的3倍,A有2个电子层符合电子排布规律,最外层电子数为6,A为O;B元素的原子失去1个电子,所得到的微粒具有与氖原子相同的电子层结构,B为Na;C元素是地壳中含量最多的金属元素,C为Al;D元素的原子M层电子数是K层的3倍,M层电子数为K层的3倍=6,D为S,由上述分析可知,A为O、B为Na、C为Al、D为S;
A.A为O元素,同素异形体有O2、O3,A正确;
B.C为Al其氧化物为Al2O3,既可以与强酸反应,也可以与强碱反应,Al2O3为两性氧化物,B错误;
C.Na元素的焰色反应为黄色,C正确;
D.二氧化硫或三氧化硫均能与NaOH反应,生成盐和水,D正确;
故答案为:B。
13. 4 2,1 2 I A族 8 10 2,8 18 22 3 0
的核电荷数为3、中子数为7—3=4,电子排布为2,1,位于元素周期表第二周期I A族;的核电荷数为8、中子数为18—8=10,电子排布为2,8,位于元素周期表第二周期VI A族;的核电荷数为18、中子数为40—18=22,电子排布为2,8,8,位于元素周期表第二三周期0族,故答案为:4;2,1;2;I A族;8;10;2,8;18;22;3;0。
14. A E F D C G
①CO2是酸性氧化物可与碱溶液反应,除去CO中混有的CO2可将混合气通过盛有NaOH溶液的洗气瓶进行洗气,故选A;
②水和乙醇的沸点不同,水和乙醇互溶,用75%的医用酒精制无水乙醇,可用蒸馏的方法,故选E;
③碘易溶于有机溶剂,可用萃取的方法提取碘水中的碘,故选F;
④氯化钠和硝酸钾的溶解度随温度变化不同,氯化钠的溶解度随温度升高增大不明显,硝酸钾的溶解度随温度升高明显增大,从氯化钠和硝酸钾混合液中提取氯化钠可用蒸发结晶的方法,故选D;
⑤泥沙不溶于水,可用过滤的方法除去氯化钠溶液中的泥沙,故选C;
⑥植物油和水二者互不相溶,可用分液的方法分离,故选G;
15. 53 72 125 53
核素符合左下角为质子数、左上角为质量数,则该核素的质子数为53,中子数=质量数-质子数=125-53=72,质量数为125,核外电子数等于质子数=53。
16.2 393.16 t
普通玻璃中n(Na2O)∶n(CaO)∶n(SiO2)=∶∶≈1∶1∶6,
因为Na2O~Na2CO3,CaO~CaCO3,
所以三种原料的物质的量之比为Na2CO3∶CaCO3∶SiO2=1∶1∶6。
题中所给原料的物质的量之比为∶≈5∶22.6 = 1∶4.52,显然Na2CO3有剩余。
设500吨石灰石折合氧化钙xt
56:x=100∶500,解得x=280 t,280 t÷11.7%≈2 393.16 t。故答案为:2393.16 t。
17.(1)+H++H2O= Al(OH)3↓
(2)Al(OH)3+3H+=Al3++3H2O、Mg(OH)2+2H+=Mg2++2H2O
(3)130 mL
(4) 0.02 mol 0.13 mol
向所得悬浊液中逐滴加入1.00 mol/L盐酸溶液时,A点之前没有沉淀生成,说明溶液中NaOH过量,故混合物溶于水之后所含物质为:NaAlO2、NaOH、Mg(OH)2,A点之前发生反应:NaOH+HCl=NaCl+H2O,AB段沉淀增加,发生反应:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,BC段发生沉淀溶解,对应反应为:Al(OH)3+3HCl=AlCl3+3H2O、Mg(OH)2+2HCl=MgCl2+2H2O。
(1)
由分析知,AB段发生反应:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,对应离子方程式为:+H++H2O= Al(OH)3↓;
(2)
由分析知,BC段发生沉淀溶解,对应离子方程式为:Al(OH)3+3H+=Al3++3H2O、Mg(OH)2+2H+=Mg2++2H2O;
(3)
A点沉淀是Mg(OH)2,物质的量是1.16 g÷58 g/mol=0.02 mol,根据Mg原子守恒得n(MgCl2)=0.02 mol;AB段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,根据反应比例知,n( )=n(HCl)= n[Al(OH)3]=1 mol/L×(0.03-0.01)L=0.02 mol,根据铝元素守恒得n(AlCl3)=n()=0.02 mol, BC段消耗盐酸物质的量n(HCl,BC)=2n[Mg(OH)2]+ 3n[Al(OH)3]=0.02 mol×2+0.02 mol×3=0.1 mol,对应消耗体积V(HCl,BC)=,即100 mL,故C点加入盐酸总体积=30+100=130 mL,故此处填130 mL;
(4)
由(3)分析知,n(MgCl2)=0.02 mol;根据反应知,B点溶液中溶质为NaCl,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.02 mol×2+0.02 mol×3+0.03 L×1 mol/L=0.13 mol。
18.(1) OH-+H+=H2O、Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=+2H2O 0.06 440
(2)400
(3)0.5≤a<1
【解析】(1)
①O点到V1点说明为H2SO4和NaOH反应。离子方程式为:OH-+H+=H2O,V1是开始生成沉淀,离子方程式为:Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,然后沉淀减少,是由于Al(OH)3+OH-=+2H2O,故在滴加NaOH溶液过程中有关反应的离子方程式为OH-+H+=H2O、Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=+2H2O,故答案为:OH-+H+=H2O、Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=+2H2O;
②当V1=160mL时,此时溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=n(Na+)=n(NaOH)=×0.16L×1mol/L=0.08mol,设MgSO4为xmol,Al2(SO4)3为ymol,则:根据Mg原子、Al原子守恒有:x+2y=0.1,根据离子守恒有:x+3y=0.2-0.08,联立方程解得:x=0.06、y=0.02,所以金属粉末中n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol,滴加NaOH溶液到体积V2时时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.1L×2mol/L×+0.04mol=0.44mol,所以,V2==0.44L=440mL,故答案为:0.06;440;
(2)
当溶液中Mg2+、Al3+恰好沉淀完全时,此时,溶液是Na2SO4溶液,根据离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2(H2SO4)=2×0.1L×2mol/L=0.4mol,所以,V(NaOH)==0.4L=400mL,故答案为:400;
(3)
若混合物仍为0.1mol,其中镁的物质的量分数为a,用100mL 2mol L-1硫酸溶解后,再加入450mL 1mol L-1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:v1=400ml,再加入50mL 1mol L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,Al(OH)3+NaOH=NaAlO2+2H2O,Al(OH)3最大取值0.05mol,即0<n(Al)≤0.05mol,n(Mg)+n(Al)=0.1mol,则0.5≤n(Mg)<1,故答案为:0.5≤a<1;
19.(1) 检验装置气密性 酸性KMnO4溶液 A中酸性KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀
(2) 2H2S+SO2=3S↓+2H2O BaSO4 BaSO3 Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-
本实验Cu与浓硫酸加热反应生成SO2,气体分两个方向进行,通a是检验碳硅元素的非金属性强弱;通b则是检验SO2的性质。
(1)确保装置气密性良好后加药品反应,打开a、关闭b ,使SO2与NaHCO3饱和溶液反应,生成的气体除了CO2还有SO2,需将气体通过酸性KMnO4溶液,不褪为无色的情况下,说明已将CO2中的SO2完全除去,此时通入Na2SiO3溶液的是CO2,若产生白色沉淀H2SiO3,则说明H2CO3的酸性强于H2SiO3,而H2CO3和H2SiO3分别是C和 Si元素的最高价氧化物对应水化物,故说明碳的非金属性比硅强。
(2)打开b、关闭a ,SO2与H2S 溶液反应:2H2S+SO2=3S↓+2H2O,出现浅黄色浑浊;因H2SO 3酸性弱于HCl,SO2通入BaCl2溶液不反应,但再往溶液滴入氯水后,SO2被氧化:Cl2+SO2+2H2O=H2SO4+2HCl,H2SO4与BaCl2产生BaSO4沉淀;若是往溶液滴加氨水,则SO2与氨水反应生成(NH4)2SO3,与Ba2+结合生成BaSO3沉淀。
20.(1)三颈烧瓶
(2)因为远离水面,氯化氢气体不被吸收而逸出,造成空气污染;若深入到水中,氯化氢极易溶于水造成倒吸
(3)醋酸酐与苯反应是放热反应,滴的太快,放热量太大,温度不易控制,温度急剧上升,轻则发生副反应,重则毁坏仪器引起危险
(4)防止水蒸气进入A装置,与醋酸酐反应,且AlCl3遇水后,失去催化能力
(5)A
(6) 是 C
(7)85%
有机反应受温度影响很大,,温度过高,容易发生副反应或使有机物分解。由苯和乙酸酐制取苯乙酮的反应放热,因此需要逐滴滴加醋酸酐,以控制反应体系温度,防止其升温过快。本实验需要严格控制无水环境,因为醋酸酐与AlCl3都是极易水解的物质。
(1)
仪器A为三颈烧瓶。
(2)
因为远离水面,氯化氢气体不被吸收而逸出,造成空气污染;若深入到水中,氯化氢极易溶于水造成倒吸,故要漏斗一半扣在水面下、一半露在水面上。
(3)
因为醋酸酐与苯反应是放热反应,滴的太快,放热量太大,温度不易控制,温度急剧上升,轻则发生副反应,重则毁坏仪器引起危险,故需要逐渐地滴加醋酸酐。
(4)
CaCl2具有吸水干燥的作用,故作用为防止水蒸气进入A装置,与醋酸酐反应,且AlCl3遇水后,失去催化能力。
(5)
步骤一得到的苯乙酮中含有苯、醋酸酐等杂质,故1.分液除去分层的物质,2.为提高产率,水层用苯萃取合并有机层,3.依次用10%的NaOH溶液洗涤除去醋酸酐,再用水洗除去氢氧化钠溶液,最后分液,4.无水硫酸镁干燥除水,5.蒸馏除去苯。故顺序为⑤④②③①,选A。
(6)
蒸馏装置中温度计测量的是馏分的温度,故温度计位置正确,温度应该控制比苯乙酮的沸点低,比其他杂质的沸点高,故为C。
(7)
根据反应式+(CH3CO)2O+CH3COOH,又0.04mol醋酸酐参加反应,故生成苯乙酮为0.04mol,所以产率==85%。
21.(1)
(2)
(3) > 橙红
【解析】(1)
由方程式可知,氯酸钾氧化碘单质,生成碘酸氢钾[KH(IO3)2],KClO3一般被还原为KCl,根据原子守恒和得失电子守恒,可得化学方程式为:6I2+11KClO3+3H2O═6KH(IO3)2+5KCl+3Cl2↑。
(2)
反应物为Al、、OH-,生成物为:N2、H2O、碱性条件下铝参加反应生成物还有,反应中Al元素化合价由0价升高为+3价,共升高3价,→N2↑,氮元素化合价由+5价降低为0价,共降低10价,最小公倍数为30,故Al的系数为10,N2系数为3,由氮元素守恒可知系数为6,由电荷守恒可知OH-系数为4,由H元素守恒可知H2O前面的系数为2,故配平后离子方程式为:。
(3)
①FeBr2溶液中滴加几滴新制的氯水,振荡后溶液呈黄色,取少量反应后的溶液加入KSCN溶液,溶液变为血红色,说明有Fe3+生成,另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体,说明没有Br2生成,由此可知Fe2+被氧化为Fe3+,而Br-未被氧化,还原性强的先被氧化,则可证明还原性Fe2+>Br-;
②n(FeBr2)=0.04L×0.1mol/L=0.004mol,n(Cl2)==0.003mol,二者的物质的量比为4:3,结合还原性Fe2+>Br-,根据“2Fe2++Cl2=2Fe3++2Cl-”知,Fe2+完全被氧化需要消耗n(Cl2)=n(Fe2+)=×0.004mol=0.002mol,则剩余的Cl2氧化溴离子生成Br2,根据“2Br-+Cl2=Br2+2Cl-”知,0.001molCl2氧化的n(Br-)=2n(Cl2)=2×0.001mol=0.002mol,所以总反应中氯气完全被还原,亚铁离子完全被氧化、有0.002mol的溴离子被氧化,部分溴离子未被氧化,则取少量反应后的溶液加入CCl4,振荡后,下层为无色液体为橙红色,参加反应的n(Cl2):n(Fe2+):n(Br-)=0.003mol:0.004mol:0.002mol=3:4:2,则发生的离子方程式为4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-。
22. 第三周期第ⅣA族 、 BD 55 强 B b=a+1或b=a+11
根据元素周期表的结构可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl。
(1)地壳中含量居于第二位的元素是Si,Si位于周期表中第三周期第ⅣA族,故答案为:第三周期第ⅣA族;
(2)O原子和C原子通过共用电子对形成二氧化碳,所以其形成过程为;
(3)H、Na、O元素形成的化合物可能是H2O、H2O2、NaOH、Na2O、Na2O2、NaH,其中既含离子键又含共价键的离子化合物是NaOH和Na2O2,电子式为:、,故答案为:、;
(4)W为Se,Se的非金属性比S弱,故H2Se的稳定性不及H2S,常温下Se与H2难以化合,故选项B、D所述性质不可能,故答案为:BD;
(5)①根据碱金属元素核外电子排布规律,结合铯在周期表中的位置可知,铯原子核外共有6个电子层,每个电子层的电子数目分别是2、8、18、18、8、1,原子序数等于核外电子总数,故为55,故答案为:55;
②铯与钠、钾同主族,具有极强的金属性,与H2O反应的化学方程式为;
③同主族元素,从上到下,金属性依次增强,故铯单质的还原性比钠单质强;
④A项,与铯同主族的氢元素为非金属元素,错误;
B项,铯单质还原性较强,反应时铯原子易失去电子,正确;
C项,碳酸钠为可溶性盐,以此类推,碳酸铯是一种可溶性盐,错误;
D项,金属性较强的元素,其简单阳离子的氧化性较弱,故铯离子的氧化性弱于钾离子,错误;
故答案为:;强;B;
(6) 若X位于第二、三周期,则b=a+1;若X位于第四周期,则b=a+11,故答案为:b=a+1或b=a+11。
