第1章化学反应与能量转化单元测试(含解析)高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第1章化学反应与能量转化单元测试(含解析)高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-26 11:27:47 | ||
图片预览


文档简介
第1章 化学反应与能量转化 单元训练卷
一、单选题
1.某些共价键的键能信息如表所示:则反应H2(g)+Cl2(g)=2HCl(g)的△H为
共价键 H-H H-Cl Cl-Cl
键能(kJ·mol-1) 436 431 243
A.183kJ·mol-1 B.381kJ·mol-1 C.-183kJ·mol-1 D.小于-183kJ·mol-1
2.某次发射火箭,用肼)在中燃烧,生成、液态。
已知:①
②
假如都在相同状态下,请计算发射火箭反应的热化学方程式:的ΔH
A. B.
C. D.
3.碱性锌锰电池的总反应为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2。下列说法正确的是
A.Zn为正极,MnO2为负极
B.该电池为二次电池
C.负极的电极反应式为:Zn+2OH--2e-=Zn(OH)2
D.工作时电子由MnO2经外电路流向
4.下列叙述不正确的是
A.生铁比纯铁更容易生锈
B.铁管上镶嵌锌块,铁管不易被腐蚀
C.电解精炼铜时,以待精炼的铜作为阳极
D.外加电流法是把被保护的钢铁设备作为阳极,使钢铁表面腐蚀电流降至零或接近零
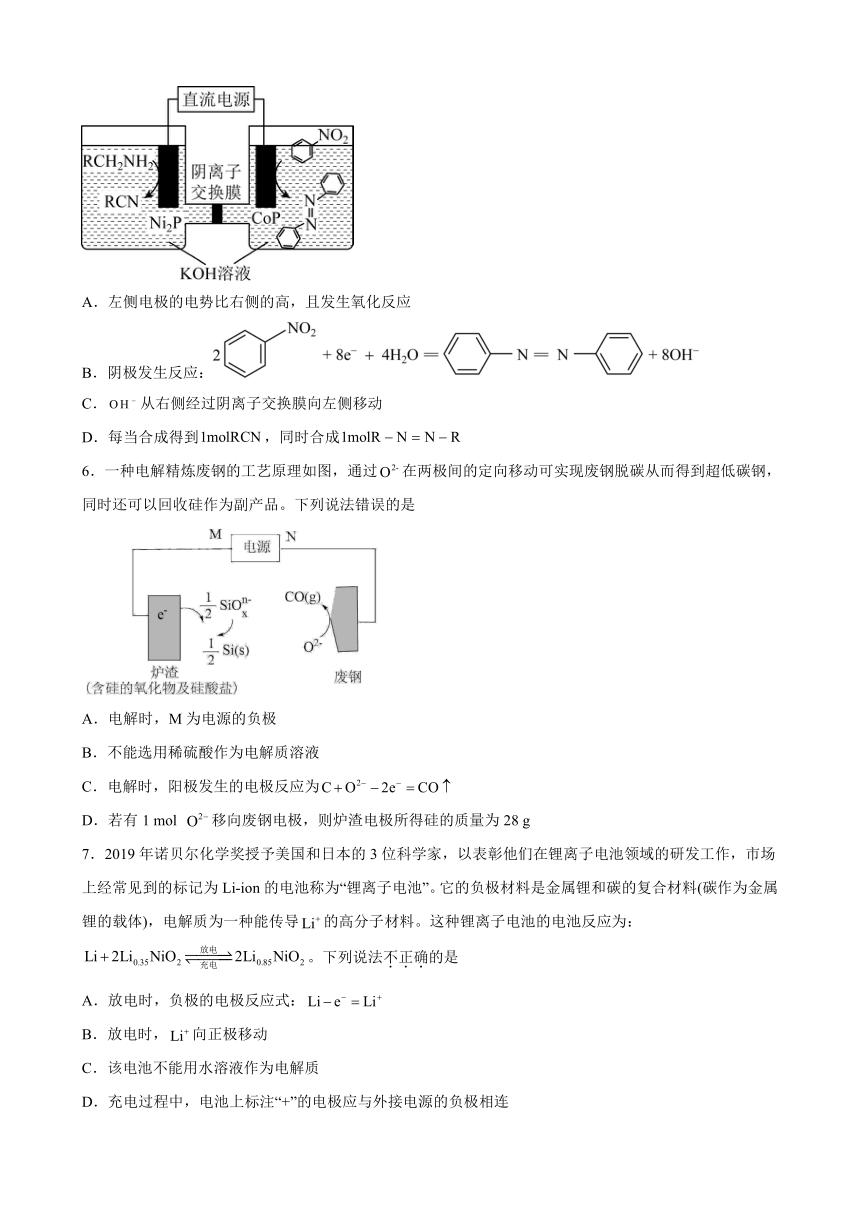
5.某种电催化法以为催化电极合成腈类化合物和偶氮化合物,装置示意图如图。下列说法错误的是
A.左侧电极的电势比右侧的高,且发生氧化反应
B.阴极发生反应:
C.从右侧经过阴离子交换膜向左侧移动
D.每当合成得到,同时合成
6.一种电解精炼废钢的工艺原理如图,通过在两极间的定向移动可实现废钢脱碳从而得到超低碳钢,同时还可以回收硅作为副产品。下列说法错误的是
A.电解时,M为电源的负极
B.不能选用稀硫酸作为电解质溶液
C.电解时,阳极发生的电极反应为
D.若有1 mol 移向废钢电极,则炉渣电极所得硅的质量为28 g
7.2019年诺贝尔化学奖授予美国和日本的3位科学家,以表彰他们在锂离子电池领域的研发工作,市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导的高分子材料。这种锂离子电池的电池反应为:。下列说法不正确的是
A.放电时,负极的电极反应式:
B.放电时,向正极移动
C.该电池不能用水溶液作为电解质
D.充电过程中,电池上标注“+”的电极应与外接电源的负极相连
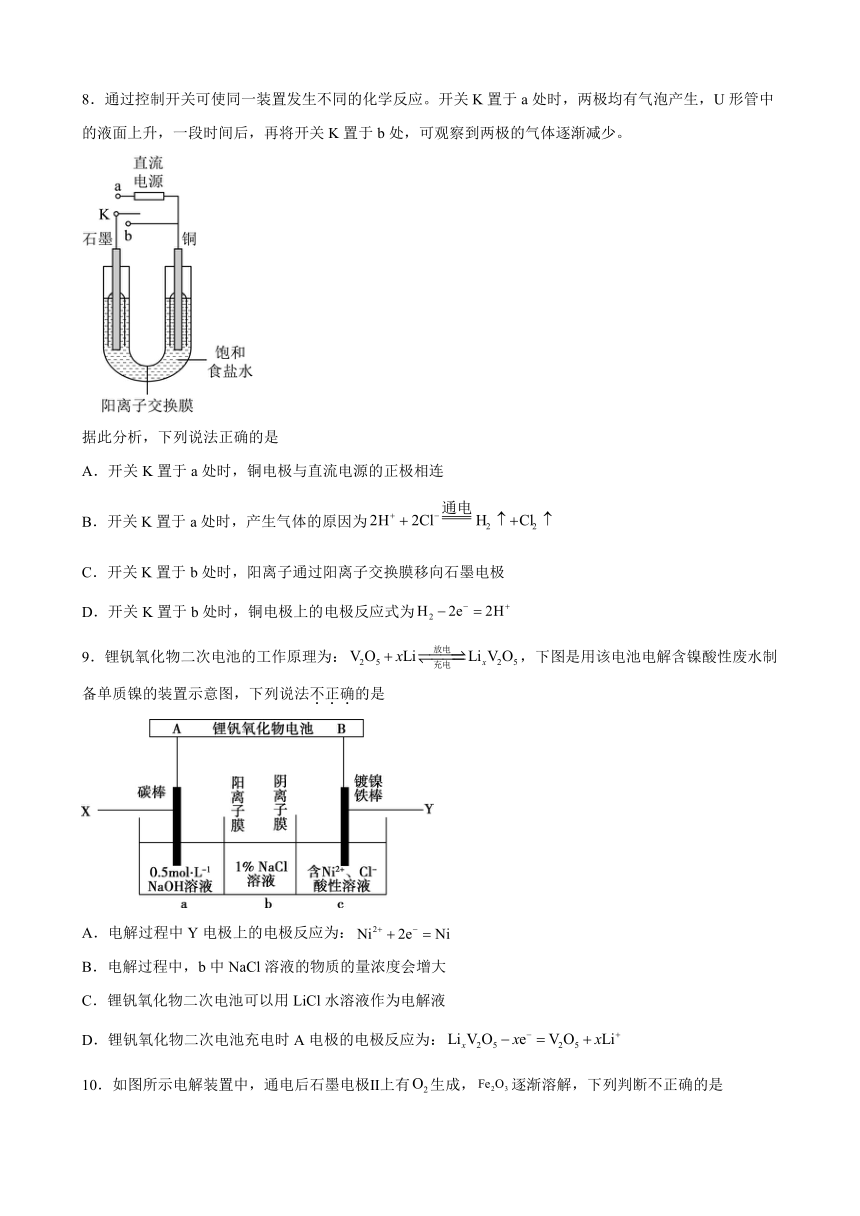
8.通过控制开关可使同一装置发生不同的化学反应。开关K置于a处时,两极均有气泡产生,U形管中的液面上升,一段时间后,再将开关K置于b处,可观察到两极的气体逐渐减少。
据此分析,下列说法正确的是
A.开关K置于a处时,铜电极与直流电源的正极相连
B.开关K置于a处时,产生气体的原因为
C.开关K置于b处时,阳离子通过阳离子交换膜移向石墨电极
D.开关K置于b处时,铜电极上的电极反应式为
9.锂钒氧化物二次电池的工作原理为:,下图是用该电池电解含镍酸性废水制备单质镍的装置示意图,下列说法不正确的是
A.电解过程中Y电极上的电极反应为:
B.电解过程中,b中NaCl溶液的物质的量浓度会增大
C.锂钒氧化物二次电池可以用LiCl水溶液作为电解液
D.锂钒氧化物二次电池充电时A电极的电极反应为:
10.如图所示电解装置中,通电后石墨电极Ⅱ上有生成,逐渐溶解,下列判断不正确的是
A.是电源的负极
B.随着电解的进行,溶液浓度变大
C.当完全溶解时,至少产生气体折合成标准状况下
D.通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色
11.石墨烯基电催化转化为等小分子燃料的装置示意图如图所示。下列叙述正确的是
A.a电极应该连接电源的负极
B.电催化过程溶液中的由Ⅱ室向Ⅰ室迁移
C.Ⅱ室中每消耗气体,Ⅰ室生成
D.转化为的反应为
12.已知中的化学键断裂时需要吸收的能量,中的化学键断裂时需要吸收的能量,中的化学键形成时释放的能量,与反应生成的热化学方程式为
A.
B.
C.
D.
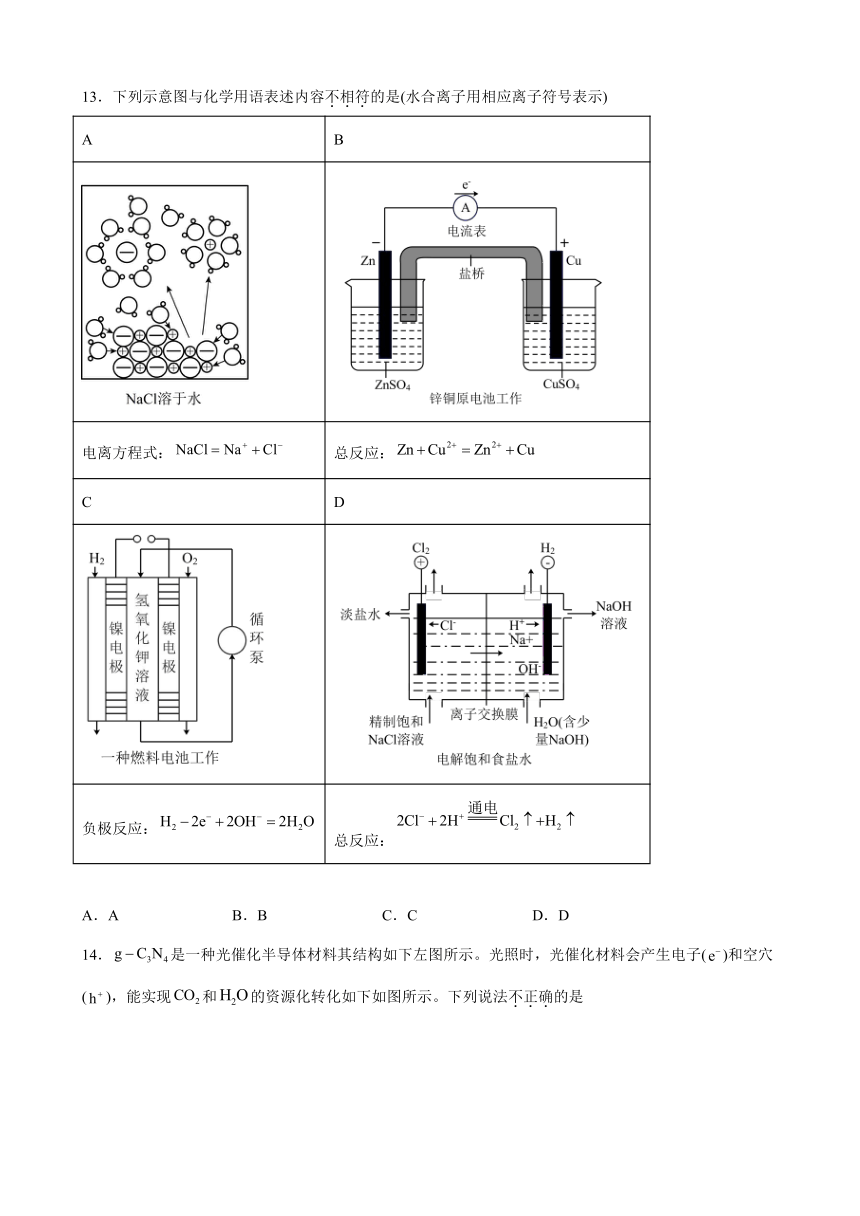
13.下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A B
电离方程式: 总反应:
C D
负极反应: 总反应:
A.A B.B C.C D.D
14.是一种光催化半导体材料其结构如下左图所示。光照时,光催化材料会产生电子()和空穴 (),能实现和的资源化转化如下如图所示。下列说法不正确的是
A.该光催化材料实现了太阳能→电能→化学能
B.上述两图中碳原子的杂化方式共有3种
C.转化的反应为
D.理论上每消耗,能产生标况下
二、填空题
15.氨是重要的化工原料,已知在纯氧中燃烧的能量变化如图。
(1)已知: ,则的燃烧热的热化学方程式为_______。
(2)的燃烧反应可设计成燃料电池,工作原理如图甲所示。电极b为_______(填“正极”或“负极”);电极a上的电极反应为_______。当共消耗1.568 L(标准状况)气体时,通过负载的电子的物质的量为_______mol。
(3)一种肼()燃料电池的工作原理如图乙所示。
①a极的电极反应式为_______;电池中的离子方程式为_______。
②若利用该电池给铅酸蓄电池充电,当消耗3.2 g 时,电极质量_______(填“增加”或“减少”)_______g。
16.I.某化学活动小组利用如甲装置对原电池进行研究,请回答下列问题:(其中盐桥为含有KCl饱和溶液的琼脂)
(1)在甲图装置中,当检流计中指针发生偏转时,盐桥中的离子移动方向为K+移向________(填“A”或“B”)烧杯。
(2)在甲图装置中铜电极为电池的________极,发生_________反应(填“氧化”或“还原”),铜电极上发生的电极反应式为__________ 。
II.该小组同学提出设想,如果该实验中的盐桥换为导线(铜线),检流计指针是否也发生偏转呢?带着疑问:
该小组利用图乙装置进行了实验,发现检流计指针同样发生偏转,回答下列问题:
(3)对于实验中产生电流的原因,该小组进行了深入探讨,后经老师提醒注意到使用的是铜导线,烧杯C实际为原电池,D成了用电器。对于图乙烧杯C实际是原电池的问题上,该小组成员发生了很大分歧:
①一部分同学认为是由于ZnSO4溶液水解显酸性,此时原电池实际是由Zn、Cu作电极。H2SO4溶液作为电解质溶液而构成的原电池。如果这个观点正确,那么原电池的正极反应式为______________。
②另一部分同学认为是溶液酸性较弱。由于溶解在溶液中的氧气的作用,使得Zn、Cu之间形成原电池。如果这个观点正确,那么原电池的正极反应式为__________________。
17.如图是一个化学过程的示意图。已知甲池的总反应式为2CH3OH+3O2+4KOH2K2CO3+6H2O。
请回答下列问题:
(1)图中甲是_____装置。(“原电池”或“电解池”)
(2)下列电极的名称:A(石墨)电极的名称是_____。
(3)写出通入O2的电极的电极反应式_____。
(4)当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2_____mol;此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是_____(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
(5)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阴极反应式是:_____。
②除去杂质后的氢氧化钾溶液从液体出口_____(填写“A”或“B”)导出。
18.某同学设计了如图所示装置,可探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
(1)甲装置中通入氧气的电极为_______(填“正极”或“负极”),负极的电极反应式_______。
(2)乙装置中Fe电极为_______(填“阳极”或“阴极”);C电极上发生_______(填“氧化”或“还原”)反应,电极反应式为_______。
(3)反应一段时间后,乙装置中氢氧化钠主要在_______(填“Fe电极”或“C电极”)区生成。
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间后,CuSO4溶液的浓度_______(填“增大”“减小”或“不变”)。
(5)已知NA为阿伏加德罗常数的值。若在标准状况下,有2.24L氧气参加反应,则丙装置中阴极析出铜的质量为_______。
19.回答下列问题:
(1)指出下列变化能量是怎样转化的:学校燃烧煤煮饭_________,给手机的电池充电_________。
(2)磷元素有多种性质不同的单质,红磷(结构复杂用“P”表示)和白磷(P4)是磷的两种同素异形体,充分燃烧之后的产物都是五氧化二磷。在25 ℃、101 kPa下,31 g白磷完全转化为红磷,放出11 kJ的热量,根据以上事实回答下列问题:
①红磷转化为白磷属于_________反应(填“放热”或“吸热”)。
②二者更稳定的是_________。(填“白磷”或“红磷”)。
(3)拆开1 mol H—H键、1 mol I—I、1 mol H—I键需要吸收的能量为436kJ、151k J、299k J。则氢气和碘生成1 mol HI需要_________(填“放出”或“吸收”)_________k J的热量。
三、实验题
20.将裹有锌片的铁钉放入溶有琼脂的饱和NaCl溶液中,滴入少量酚酞,回答下列问题。
(1)一段时间后a处可能出现的现象是_____,请结合化学用语解释原因______。
(2)某同学为验证选择的铁钉未被腐蚀,取少量溶液于试管,分别进行如表实验,能证明铁钉未被腐蚀的实验是_____(填序号)。
序号 ① ② ③ ④
滴入试剂 AgNO3溶液 淀粉KI溶液 KSCN溶液 K3[Fe(CN)6]溶液
实验现象 产生沉淀 无蓝色出现 无红色出现 无蓝色沉淀
(3)某同学欲将铁棒镀铜设计电镀铜实验,请依据提供实验用品完成如图所示电镀装置_____,并写出电池工作一段时间后的现象。
供选择的实验用品:FeCl2溶液,CuSO4溶液,铜棒,锌棒,铁棒
实验现象:_____。
21.某小组研究和的氧化性,进行如下实验。
已知:是黄色液体,氧化性:。
(1)实验Ⅰ过程Ⅰ中与反应的化学方程式是_________。
(2)实验Ⅰ过程Ⅱ中溶液变红,说明产生了,分析可能原因。
假设①被氧化。过程Ⅱ发生反应的电极反应式:
a.氧化反应:
b.还原反应:_________。
假设②和生成,进而使清液中的氧化为。设计实验Ⅱ证实假设。
i._________。
ⅱ.实验Ⅱ中过程Ⅱ的离子方程式为_________。
(3)设计实验进一步研究能否氧化。
编号 实验Ⅲ 实验Ⅳ
实验及现象
①实验Ⅲ中溶液的作用是_________。
②实验Ⅳ证实能氧化的实验现象除电流表指针偏转外,还有_________(答出2点)。
(4)分析实验Ⅱ中能氧化,实验Ⅲ中未能氧化的原因:_________。
四、工业流程题
22.工业上用电解溶液生成的氯气为原料,生产溴酸钾的工艺流程如下:
回答下列问题:
(1)惰性电极电解溶液产生氯气总反应的离子方程式为______________。
(2)“合成I”中得到,该反应的还原剂是______________;“合成II”中加入的目的是____________。
(3)结合溶解度曲线分析,“合成Ⅲ”为复分解反应,该反应能发生的原因是____________;若向溶液中加入______________粉末,可使溶液中的降为[假设溶液体积不变,已知该温度下]。“合成III”实际中用饱和溶液而不用粉末的优点是______________(写一条)。
(4)为了从过滤II后的滤液中获得氯化镁结晶,依次要经过________、___________操作。
(5)另一种产生溴酸盐的方法是用溶液吸收,同时生成气体。写出相应的化学方程式______________;原子经济性更高的是______________(填“吸收法”或“氯气氧化法”)。
五、原理综合题
23.氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
(1)已知:
反应I的热化学方程式:_______。
(2)反应I所得产物的溶液在碘过量时会自发分成两层。分离两层溶液的实验操作是_______。
(3)研究发现,通过电解方法实现反应I,既可减少碘的加入量,也可减少溶液后续纯化过程的能耗。写出通过电解法实现反应I时,阳极的电极反应式:_______。
(4)碘硫循环过程中反应I所制备出的HI浓度较低,必须对HI溶液进行浓缩。电解电渗析浓缩HI溶液的原理如下图所示,初始时阳极液和阴极液相同,溶液组成均为n(HI):n(H2O):n(I2)=1:6.8:2。
①电渗析过程中,阳极液中I2的浓度会_______(填“增大”或“减小”)。
②结合化学用语,解释阴极区进行HI浓缩的原理_______。
(5)某科研小组采用双极膜电渗析法制备高浓度氢碘酸,工作原理如下图所示。
已知:双极膜在直流电场作用下可将水解离,在双极膜的两侧分别得到H+和OH-。
①X极是_______(填“阳极”或“阴极”)。
②电解后,_______室获得较浓的氢碘酸(填“a”、“b”或“c”)。
参考答案:
1.C
【详解】焓变=反应物总键能-生成物总键能,H2(g)+Cl2(g)=2HCl(g) △H=(436+243-431×2) kJ·mol-1= -183kJ·mol-1,故选C。
2.D
【详解】已知:① ;② ,由盖斯定律可知,②×2-①可得 ΔH=ΔH2×2-ΔH1=×2-=,故选D。
3.C
【详解】A.碱性锌锰电池的总反应为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,Zn的化合价升高,失去电子,被氧化,则Zn为负极,Mn元素的化合价降低,得到电子,被还原,MnO2为正极,故A错误;
B.碱性锌锰电池为一次电池,故B错误;
C.Zn为负极,Zn失去电子转化为Zn(OH)2,负极的电极反应式为:Zn+2OH--2e-=Zn(OH)2,故C正确;
D.Zn为负极,MnO2为正极,原电池中电子从负极经导线流向正极,则工作时电子由经外电路流向MnO2,故D错误;
故选C。
4.D
【详解】A.生铁中杂质比较多,易构成原电池加快腐蚀速率,所以比纯铁更容易生锈,A正确;
B.铁管上镶嵌锌块,锌比铁活泼,构成原电池时锌做负极,铁管不易被腐蚀 ,B正确;
C.电解精炼铜时,以待精炼的铜作为阳极,精铜做阴极,C正确;
D.外加电流法是把被保护的钢铁设备作为阴极,使钢铁表面腐蚀电流降至零或接近零,D错误;
故选D。
5.D
【详解】A.右侧电极硝基苯发生还原反应,右侧为阴极、左侧为阳极,所以左侧电极的电势比右侧的高,且发生氧化反应,故A正确;
B.右侧电极硝基苯发生还原反应,右侧为阴极,阴极发生反应为 ,故B正确;
C.右侧为阴极、左侧为阳极,从右侧经过阴离子交换膜向左侧移动,故C正确;
D.阳极反应式为,R-CH2NH2-4e-+4OH-=R-CN+4H2O,根据得失电子守恒,每当合成得到,同时合成,故D错误;
选D。
6.D
【分析】根据题意可知,该装置可回收硅,因而产生硅单质的炉渣一极为得电子的阴极,连接的M极为负极,而连接废钢为阳极,N为正极。
【详解】A.根据分析可知,M为电源负极,选项A正确;
B.该实验是废钢脱碳故其中含有大量Fe,用稀H2SO4会与之反应,不能选用稀硫酸作为电解质溶液,选项B正确;
C.电解时,阳极上C失电子产生CO,发生的电极反应为,选项C正确;
D.若有1 mol 移向废钢电极,由反应可知转移电子为2mole-,阴极的电极反应式为,则炉渣电极所得硅的质量为,选项D;
答案选D。
7.D
【分析】据锂离子电池的电池反应式为:,可知放电时,Li的化合价升高,被氧化,为原电池的负极,负极的电极反应式:Li-e-=Li+;充电时,反应物只有一种,故化合价既有升,又有降,所以既发生氧化反应又发生还原反应;由于Li可以与水反应,故电解质材料应为非水材料;原电池工作时,阳离子向正极移动,阴离子向负极移动。
【详解】A.放电时,负极反应:Li-e-=Li+,故A正确;
B.放电过程中,阳离子向正极移动,Li+向正极移动,故B正确;
C.Li很活泼,会与水反应,不能用水溶液作为电解质,故C正确;
D.充电过程中,电池上标注“+”的电极应与外接电源的正极相连,故D错误;
故选D。
8.C
【分析】开关K置于a处时,构成电解池,两极均有气泡产生,说明石墨电极与直流电源正极相连,铜电极与直流电源负极相连,因为如果铜电极与直流电源正极相连,则铜电极作阳极,铜失电子生成铜离子,没有气体产生;阳极的电极反应式为,阴极的电极反应式为,U形管中的液面上升,则左侧收集的气体为Cl2,右侧为H2;一段时间后,再将开关K置于b处,构成原电池,可观察到两极的气体逐渐减少,则左侧石墨电极为正极,电极反应式为,右侧铜电极为负极,电极反应式为,据此分析解答。
【详解】A.根据分析,开关K置于a处时,铜电极与直流电源负极相连,A错误;
B.开关K置于a处时,产生气体的原因为,B错误;
C.开关K置于b处时,构成原电池,左侧石墨电极为正极,右侧铜电极为负极,阳离子通过阳离子交换膜移向石墨电极,C正确;
D.根据分析,开关K置于b处时,铜电极上的电极反应式为,D错误;
故选C。
9.C
【分析】电解含镍酸性废水制备单质镍,镀镍铁棒为阴极,发生反应Ni2++2e-=Ni,B是锂钒氧化物二次电池的负极,A是正极,碳棒是电解池的阳极。
【详解】A.电解含镍酸性废水制备单质镍,镀镍铁棒为阴极,电解过程中Y电极上的电极反应为:,故A正确;
B.电解过程中,c中氯离子通过阴离子交换膜进入b、a中钠离子通过阳离子交换膜进入b,b中NaCl溶液的物质的量浓度会增大,故B正确;
C.锂能与水反应,锂钒氧化物二次电池不能用LiCl水溶液作为电解液,故C错误;
D.A是锂钒氧化物二次电池的正极,充电时,正极发生氧化反应,锂钒氧化物二次电池充电时A电极的电极反应为, 故D正确;
选C。
10.B
【分析】通电后石墨电极Ⅱ上有生成,氢氧根离子放电生成氧气,电极反应式为,石墨电极Ⅱ为阳极,电极为电源正极,为负极,石墨电极I为阴极,得电子发生还原,据此分析解答。
【详解】A.通电后石墨电极Ⅱ上有生成,石墨电极Ⅱ为阳极,电极为电源正极,为负极,故A正确;
B.石墨电极Ⅰ为阴极,得电子发生还原,氯离子向阳极移动,随着电解的进行,溶液浓度减小,故B错误;
C.当0.01molFe2O3完全溶解时,消耗氢离子,根据,生成O20.015mol,标准状况下至少产生气体336mL,故C正确;
D.通电后石墨电极Ⅱ电极反应式为,该极酸性增强,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色,故D正确;
故答案为B。
11.D
【详解】A.a电极上转化为,O元素失电子化合价升高,则a为阳极,正极连接阳极,则a电极应该连接电源的正极,故A错误;
B.电解池中阳离子由阳极移向阴极,则溶液中的由Ⅰ室向Ⅱ室迁移,故B错误;
C.Ⅱ室中转化为、、等,不是只生成,则每消耗气体,转移电子不等于,则无法确定生成的物质的量,故C错误;
D.b极转化为,C元素化合价降低,电极反应式为,故D正确;
故答案为:D。
12.D
【详解】断裂1 molN2(g)和1 molO2(g)中化学键吸收能量分别为946kJ、498kJ,形成1 mol NO(g)中化学键释放出632kJ能量。反应N2(g)+O2(g)=2NO(g)中,断裂反应物中化学键吸收总能量为946kJ+498kJ=1444kJ,形成反应物中化学键释放的总能量为632kJ×2=1264kJ,则该反应是吸热反应,二者的能量差为1444kJ-1264kJ=180kJ,故△H=+180 kJ/mol,与反应生成的热化学方程式为,故选D。
13.D
【详解】A.NaCl溶于水,在水分子作用下电离出Na+、Cl-,其电离方程式为,A项正确;
B.该原电池装置,锌为负极,其电极反应为Zn-2e-=Zn2+,铜为正极,其电极反应为Cu2++2e-=Cu,故总反应为Zn+ Cu2+= Zn2++ Cu,B项正确;
C.此装置为氢氧燃料电池,在碱性条件下负极反应为,C项正确;
D.电解饱和食盐水总反应为,D项错误;
答案选D。
14.D
【详解】A.光照时,光催化材料会产生电子(e )和空穴(h+),能实现CO2和H2O的资源化转化,实现了太阳能→电能→化学能的转化,A正确;
B.图1和图2物质中碳原子的杂化方式共有3种,甲烷中的碳采用sp3杂化,二氧化碳中是sp杂化,g C3N4中碳采用sp2杂化,B正确;
C.空穴(h+)可得电子,可视为氧化剂,H2O转化的反应为,C正确;
D.得到×8e-=4e-变成CH4,得失电子守恒可知H2O中的-2价氧元素失去4mol电子生成1molO2,标况下体积,D错误;
故选:D。
15.(1)
(2) 正极 0.12
(3) 减少 12.8
【详解】(1)根据图像可知
①
②
根据盖斯定律可知①-②×6即得到 ,则燃烧热的热化学方程式为 。
(2)电极b通入氧气,发生得到电子的还原反应,为正极;电极a是负极,氨气失去电子被氧化为氮气,电极反应为;当共消耗1.568 L(标准状况)气体时,气体的物质的量是1.568L÷22.4L/mol=0.07mol,根据反应可知氨气是0.04mol,氧气是0.03mol,所以通过负载的电子的物质的量为0.04mol×3=0.12mol。
(3)①a极通入的是肼,发生失去电子的氧化反应,电极反应式为;电池中氧气把亚铁离子氧化为铁离子,则的离子方程式为。
②若利用该电池给铅酸蓄电池充电,当消耗3.2 g 时,转移电子的物质的量是,电极理解原电池的正极,作阳极,电极反应式为PbSO4-2e-+2H2O=PbO2+SO+4H+,所以该电极质量减少,减少的质量为0.2mol×64g/mol=12.8g。
16.(1)B
(2) 正 还原 Cu2++2e- =Cu
(3) 2H++2e-=H2; O2+4e-+2H2O=4OH-
【详解】(1)在甲图装置中,锌的活泼性大于铜,锌是负极、铜是正极,当检流计中指针发生偏转时,盐桥中的离子移动方向为K+移向B烧杯。
(2)在甲图装置中,锌的活泼性大于铜,锌是负极、铜是正极,正极铜离子得电子发生还原反应,铜电极上发生的电极反应式为Cu2++2e- =Cu。
(3)①Zn、Cu作电极,H2SO4溶液作为电解质溶液,正极氢离子得电子生成氢气,正极反应式为2H++2e-=H2;
②由于溶解在溶液中的氧气的作用,使得Zn、Cu之间形成原电池,正极氧气得电子生成氢氧根离子,正极反应式为O2+4e-+2H2O=4OH-。
17.(1)原电池
(2)阳极
(3)O2+4e-+2H2O=4OH-
(4) 0.0125 BD
(5) 2H++2e-=H2↑##2H2O+2e-=H2↑+2OH- B
【分析】甲装置为燃料电池,通燃料的一极是负极,该极甲醇失电子和氢氧根离子反应生成碳酸根离子和水,通氧气的一极为正极;乙池、丙池均是电解池,A电极与原电池正极相连,为阳极,则B电极为阴极,D电极与原电池负极相连,为阴极,则C电极为阳极,据此分析。
【详解】(1)据分析,甲装置为燃料电池,是原电池,故答案为:原电池。
(2)据分析,A(石墨)电极的名称是阳极,故答案为:阳极。
(3)通入O2的电极是正极,电极反应式:,故答案为:。
(4)乙池中B(Ag)极的电极反应为,当B(Ag)极的质量增加5.40g时即n(Ag)=0.05mol,则转移电子为0.05mol,甲中正极反应为:,则转移0.05mol电子时消耗的氧气为0.0125mol;丙池是电解池,阴极上金属离子放电析出金属单质,则金属元素在氢元素之后,D电极连接甲醇电极,所以D是阴极,根据转移电子相等知,当析出一价金属时,其摩尔质量为1.6÷0.05 = 32g/mol,无符合题意的选项,当析出的是二价金属,则其摩尔质量为(1.6÷0.05)2=64g/mol,所以该金属是铜,则溶液是硫酸铜溶液,也可能是硝酸银放电结束后水放电,所以也可能是硝酸银,故选BD。故答案为:0.0125;BD。
(5)①该电解槽的右侧电极和电源负极相连,为阴极,用阳离子交换膜电解法除去工业品氢氧化钾溶液中的杂质含氧酸根,相当于电解水,所以该极的反应式是:;
②结合以上分析可知在阴极区聚集大量的K+和OH-,从而产生纯的氢氧化钾溶液,除杂后的氢氧化钾溶液从出口B导出;
故答案为:;B。
18.(1) 正极
(2) 阴极 氧化
(3)Fe电极
(4)减小
(5)12.8g
【分析】分析三个装置,甲装置是氢氧燃料电池,通氧气的一极是正极,通氢气的一极是负极;乙是电解氯化钠溶液,探究氯碱工业,铁电极接负极,是阴极,碳棒极是正极;丙池是精炼铜。
【详解】(1)甲装置是氢氧燃料电池,通入氧气的电极为正极,负极是通入氢气的一极,介质是KOH溶液,所以电极反应式是;故答案是正极;;
(2)乙是电解氯化钠溶液,探究氯碱工业,铁电极接甲池通氢气的一极,故铁电极为阴极;碳棒极是正极,电极上发生氧化反应;电极方程式为;
(3)阴极中氢离子放电生成氢气,氢氧根逐渐增多,故乙电极中氢氧化钠主要在阴极生成,即Fe电极;
(4)丙装置中,阳极中的粗铜中活泼金属成分如锌、铜先反应,阴极是溶液中的Cu2+放电,根据两极电子转移相等,故阴极中铜得到的数目比阳极中的铜失去的电子数目大,即溶液中由阳极产生的Cu→Cu2+的含量比阴极Cu2+→Cu的含量少,溶液中铜离子浓度减少,故如果粗铜中含有锌、银等杂质,丙装置中反应一段时间后,CuSO4溶液的浓度减小;
(5)标准状况下,有2.24L氧气即0.1mol氧气参与反应,就转移电子数目是0.4mol电子,根据串联装置中,电子转移数目相等,丙装置阴极发生Cu2++2e-=Cu↓,反应析出铜的质量是12.8g。
19.(1) 化学能转化为热能 电能转化为化学能
(2) 吸热 红磷
(3) 放出 5.5kJ
【详解】(1)学校燃烧煤煮饭,燃烧放热,将化学能转化为热能;给手机的电池充电利用的是电解池原理,能量变化为电能转化为化学能;
(2)在25℃、101 kPa下,31 g白磷完全转化为红磷,放出11 kJ的热量,说明同一条件下白磷比红磷能量高,则
①红磷转化为白磷属于吸热反应;
②能量越低越稳定,则上述二者更稳定的是红磷;
(3)根据=断键吸收的能量-成键放出的能量,因为拆开1 mol H—H键、1 mol I—I、1 mol H—I键需要吸收的能量为436kJ、151k J、299kJ,所以氢气和碘生成1 mol HI对应的反应焓变==-5.5 kJ/mol,故答案为:放出;5.5kJ。
20.(1) 溶液变红色 铁做正极,空气氧气得到电子发生还原反应生成氢氧根离子,使得a处溶液显碱性
(2)④
(3) 铁表面生成红色固体,铜棒溶解
【分析】裹有锌片的铁钉放入溶有琼脂的饱和NaCl溶液中,锌比铁活泼,锌做负极发生氧化反应生成锌离子,铁做正极被保护;
电镀实验中镀层金属做阳极、镀件做阴极,含有镀层金属阳离子的溶液做电解液;
【详解】(1)锌比铁活泼,锌做负极发生氧化反应,铁做正极,空气氧气得到电子发生还原反应生成氢氧根离子,使得a处溶液显碱性,酚酞溶液变红色;
(2)若铁被腐蚀,则会生成亚铁离子;
①溶液中含有氯化钠,氯离子和银离子生成氯化银白色沉淀,不能说明铁未被腐蚀,不符合题意;
②亚铁离子和碘离子不反应,无蓝色沉淀不能说明铁未被腐蚀,不符合题意;
③亚铁离子和KSCN溶液不反应,无红色出现不能说明铁未被腐蚀,不符合题意;
④K3[Fe(CN)6]溶液和亚铁离子生成蓝色沉淀,物蓝色沉淀,说明铁未被腐蚀,符合题意;
故选④;
(3)将铁棒镀铜设计电镀铜实验,则镀件铁棒做阴极,铜离子发生还原在铁表面生成铜,硫酸铜溶液做电解液,铜棒做阳极发生氧化反应生成铜离子,图示为 ;
现象为:铁表面生成红色固体,铜棒溶解。
21.(1)Cu+2FeCl3=2FeCl2+CuCl2
(2) Cu2++e-+SCN-=CuSCN↓ 0.1 2Fe2++(SCN)2=2Fe(SCN)2+
(3) 检验实验中是否有Fe2+生成 正极区FeCl3溶液颜色变浅,负极区KSCN溶液由无色变为黄色
(4)实验Ⅱ中能氧化由于生成CuSCN白色沉淀,促进反应正向进行,而实验Ⅲ中能与形成Fe(SCN)2+络离子,从而减弱了Fe3+的氧化性
【详解】(1)实验Ⅰ过程Ⅰ中Cu与FeCl3反应生成FeCl2和CuCl2,故该反应的化学方程式是Cu+2FeCl3=2FeCl2+CuCl2,故答案为:Cu+2FeCl3=2FeCl2+CuCl2;
(2)b.由题干实验信息可知,生成白色沉淀CuSCN,则还原反应为:Cu2++e-+SCN-=CuSCN↓,故答案为:Cu2++e-+SCN-=CuSCN↓;
i.根据对照实验I中,FeCl3的浓度为0.1mol/L,根据反应Cu+2FeCl3=2FeCl2+CuCl2可知,足量的Cu与FeCl3反应后生成的CuCl2的物质的量浓度为0.1mol/L,为了实验中控制变量,故0.1,故答案为:0.1;
ⅱ.实验Ⅱ中过程I的方程式为:2Cu2++4SCN-=2CuSCN↓+(SCN)2,则过程Ⅱ的离子方程式为2Fe2++(SCN)2=2Fe(SCN)2+,故答案为:2Fe2++(SCN)2=2Fe(SCN)2+;
(3)①Fe2+与K3[Fe(CN)6]溶液反应生成普鲁士蓝色沉淀,则实验Ⅲ中K3[Fe(CN)6]溶液的作用是检验实验中是否有Fe2+生成,故答案为:检验实验中是否有Fe2+生成;
②实验Ⅳ证实能氧化,即该原电池的电极反应分别为:负极反应:2SCN--2e-=(SCN)2,正极反应为:Fe3++e-=Fe2+,故实验现象除电流表指针偏转外,还有正极区FeCl3溶液颜色变浅,负极区KSCN溶液由无色变为黄色,故答案为:正极区FeCl3溶液颜色变浅,负极区KSCN溶液由无色变为黄色;
(4)实验Ⅱ中能氧化由于生成CuSCN白色沉淀,促进反应正向进行,而实验Ⅲ中能与形成Fe(SCN)2+络离子,从而减弱了Fe3+的氧化性,故答案为:实验Ⅱ中能氧化由于生成CuSCN白色沉淀,促进反应正向进行,而实验Ⅲ中能与形成Fe(SCN)2+络离子,从而减弱了Fe3+的氧化性。
22.(1)
(2) 与反应得到溴酸根离子,在合成Ⅲ中更多地生成溴酸钾与氯化镁分离,提高的纯度
(3) 反应体系中溶解度较小,析出沉淀 1.08 用饱和溶液沉淀速率更快或转化率(利用率)更高
(4) 蒸发结晶 趁热过滤
(5) 氯气氧化法
【分析】工业上用电解饱和食盐水生成氯气生产溴酸钾的工艺流程,分析流程可知,饱和食盐水电解生成氯气具有氧化性,在水中和溴单质反应生成溴酸和氯化氢,加入过量氧化镁和盐酸溴酸反应生成氯化镁和溴酸镁,过滤得到滤液中加入饱和氯化钾溶液,溴酸镁在饱和溶液中析出晶体,以此解答。
【详解】(1)用惰性电极电解 MgCl2溶液过程中,阳极2Cl--2e-=Cl2↑ 阴极2H2O+2e-+Mg2+=H2↑+ Mg(OH)2↓, 总反应的离子方程式为。
(2)“合成I”发生反应是氯气在水溶液中氧化溴单质为溴酸,反应的化学方程式5Cl2+Br2+6H2O=2HBrO3+10HCl,Br元素化合价上升,该反应的还原剂是;依据流程分析可知,加入和溶液中反应得到溴酸根离子,在合成Ⅲ中更多地生成溴酸钾与氯化镁分离,提高的纯度。
(3)过量氧化镁和盐酸溴酸反应生成氯化镁和溴酸镁,加入饱和氯化钾溶液,反应体系中溶解度较小,析出沉淀,发生了复分解反应;降为时,即需要沉淀2×0.15mol/L×2-2×0.1mol/L=0.4mol,需要消耗0.4molKCl,此时溶液中剩余c(K+)=,需要加入KCl的物质的量n(K+)=0.34mol/L×2L+0.4mol=1.08mol;“合成III”实际中用饱和溶液而不用粉末的优点是:用饱和溶液沉淀速率更快或转化率(利用率)更高。
(4)氯化镁的溶解度随温度变化较大,可以通过重结晶的方法从溶液中获得氯化镁结晶,依次要经过蒸发结晶、冷却结晶操作。
(5)和反应生成、和KBr,Br元素化合价由0价上升到+5价,又由0价下降到-1价,根据得失电子守恒和原子守恒配平方程式为: ;该方法中部分转化为KBr,氯气氧化法中全部转化为,所以原子经济性更高的是氯气氧化法。
23.(1)
(2)分液
(3)
(4) 增大 阴极: ,H+通过质子交换膜由阳极区进入阴极区,阴极区HI的浓度增大
(5) 阴 c
【详解】(1)反应①
反应②
反应③
按盖斯定律,反应Ⅰ=-×①-②-×③,反应Ⅰ的=---,则反应I的热化学方程式为: 。
(2)反应I所得产物溶液在碘过量时会自发分成两层,则为互不相溶的两层液体,分离两层溶液的实验操作是分液。
(3)反应I为,电解法实现反应I时,阳极二氧化硫失去电子被氧化转变为硫酸根,阳极的电极反应式:。
(4)①通过电解电渗析浓缩HI溶液,电渗析过程中,阳极碘离子失去电子被氧化转变为碘单质,则阳极液中I2的浓度会增大。
②结合化学用语,解释阴极区进行HI浓缩的原理为:阴极电极反应为 ,H+通过质子交换膜由阳极区进入阴极区,阴极区HI的浓度增大。
(5)①采用双极膜电渗析法制备高浓度氢碘酸,X电极上水提供的氢离子转变为氢气,是还原反应,则X极是阴极。
②Y为阳极,进入b中碘离子通过阴离子交换膜进入c室,右侧双极膜在直流电场作用下可将水解离产生的H+在c室、OH-在阳极Y放电产生氧气,则电解后,c室获得较浓的氢碘酸。
一、单选题
1.某些共价键的键能信息如表所示:则反应H2(g)+Cl2(g)=2HCl(g)的△H为
共价键 H-H H-Cl Cl-Cl
键能(kJ·mol-1) 436 431 243
A.183kJ·mol-1 B.381kJ·mol-1 C.-183kJ·mol-1 D.小于-183kJ·mol-1
2.某次发射火箭,用肼)在中燃烧,生成、液态。
已知:①
②
假如都在相同状态下,请计算发射火箭反应的热化学方程式:的ΔH
A. B.
C. D.
3.碱性锌锰电池的总反应为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2。下列说法正确的是
A.Zn为正极,MnO2为负极
B.该电池为二次电池
C.负极的电极反应式为:Zn+2OH--2e-=Zn(OH)2
D.工作时电子由MnO2经外电路流向
4.下列叙述不正确的是
A.生铁比纯铁更容易生锈
B.铁管上镶嵌锌块,铁管不易被腐蚀
C.电解精炼铜时,以待精炼的铜作为阳极
D.外加电流法是把被保护的钢铁设备作为阳极,使钢铁表面腐蚀电流降至零或接近零
5.某种电催化法以为催化电极合成腈类化合物和偶氮化合物,装置示意图如图。下列说法错误的是
A.左侧电极的电势比右侧的高,且发生氧化反应
B.阴极发生反应:
C.从右侧经过阴离子交换膜向左侧移动
D.每当合成得到,同时合成
6.一种电解精炼废钢的工艺原理如图,通过在两极间的定向移动可实现废钢脱碳从而得到超低碳钢,同时还可以回收硅作为副产品。下列说法错误的是
A.电解时,M为电源的负极
B.不能选用稀硫酸作为电解质溶液
C.电解时,阳极发生的电极反应为
D.若有1 mol 移向废钢电极,则炉渣电极所得硅的质量为28 g
7.2019年诺贝尔化学奖授予美国和日本的3位科学家,以表彰他们在锂离子电池领域的研发工作,市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导的高分子材料。这种锂离子电池的电池反应为:。下列说法不正确的是
A.放电时,负极的电极反应式:
B.放电时,向正极移动
C.该电池不能用水溶液作为电解质
D.充电过程中,电池上标注“+”的电极应与外接电源的负极相连
8.通过控制开关可使同一装置发生不同的化学反应。开关K置于a处时,两极均有气泡产生,U形管中的液面上升,一段时间后,再将开关K置于b处,可观察到两极的气体逐渐减少。
据此分析,下列说法正确的是
A.开关K置于a处时,铜电极与直流电源的正极相连
B.开关K置于a处时,产生气体的原因为
C.开关K置于b处时,阳离子通过阳离子交换膜移向石墨电极
D.开关K置于b处时,铜电极上的电极反应式为
9.锂钒氧化物二次电池的工作原理为:,下图是用该电池电解含镍酸性废水制备单质镍的装置示意图,下列说法不正确的是
A.电解过程中Y电极上的电极反应为:
B.电解过程中,b中NaCl溶液的物质的量浓度会增大
C.锂钒氧化物二次电池可以用LiCl水溶液作为电解液
D.锂钒氧化物二次电池充电时A电极的电极反应为:
10.如图所示电解装置中,通电后石墨电极Ⅱ上有生成,逐渐溶解,下列判断不正确的是
A.是电源的负极
B.随着电解的进行,溶液浓度变大
C.当完全溶解时,至少产生气体折合成标准状况下
D.通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色
11.石墨烯基电催化转化为等小分子燃料的装置示意图如图所示。下列叙述正确的是
A.a电极应该连接电源的负极
B.电催化过程溶液中的由Ⅱ室向Ⅰ室迁移
C.Ⅱ室中每消耗气体,Ⅰ室生成
D.转化为的反应为
12.已知中的化学键断裂时需要吸收的能量,中的化学键断裂时需要吸收的能量,中的化学键形成时释放的能量,与反应生成的热化学方程式为
A.
B.
C.
D.
13.下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A B
电离方程式: 总反应:
C D
负极反应: 总反应:
A.A B.B C.C D.D
14.是一种光催化半导体材料其结构如下左图所示。光照时,光催化材料会产生电子()和空穴 (),能实现和的资源化转化如下如图所示。下列说法不正确的是
A.该光催化材料实现了太阳能→电能→化学能
B.上述两图中碳原子的杂化方式共有3种
C.转化的反应为
D.理论上每消耗,能产生标况下
二、填空题
15.氨是重要的化工原料,已知在纯氧中燃烧的能量变化如图。
(1)已知: ,则的燃烧热的热化学方程式为_______。
(2)的燃烧反应可设计成燃料电池,工作原理如图甲所示。电极b为_______(填“正极”或“负极”);电极a上的电极反应为_______。当共消耗1.568 L(标准状况)气体时,通过负载的电子的物质的量为_______mol。
(3)一种肼()燃料电池的工作原理如图乙所示。
①a极的电极反应式为_______;电池中的离子方程式为_______。
②若利用该电池给铅酸蓄电池充电,当消耗3.2 g 时,电极质量_______(填“增加”或“减少”)_______g。
16.I.某化学活动小组利用如甲装置对原电池进行研究,请回答下列问题:(其中盐桥为含有KCl饱和溶液的琼脂)
(1)在甲图装置中,当检流计中指针发生偏转时,盐桥中的离子移动方向为K+移向________(填“A”或“B”)烧杯。
(2)在甲图装置中铜电极为电池的________极,发生_________反应(填“氧化”或“还原”),铜电极上发生的电极反应式为__________ 。
II.该小组同学提出设想,如果该实验中的盐桥换为导线(铜线),检流计指针是否也发生偏转呢?带着疑问:
该小组利用图乙装置进行了实验,发现检流计指针同样发生偏转,回答下列问题:
(3)对于实验中产生电流的原因,该小组进行了深入探讨,后经老师提醒注意到使用的是铜导线,烧杯C实际为原电池,D成了用电器。对于图乙烧杯C实际是原电池的问题上,该小组成员发生了很大分歧:
①一部分同学认为是由于ZnSO4溶液水解显酸性,此时原电池实际是由Zn、Cu作电极。H2SO4溶液作为电解质溶液而构成的原电池。如果这个观点正确,那么原电池的正极反应式为______________。
②另一部分同学认为是溶液酸性较弱。由于溶解在溶液中的氧气的作用,使得Zn、Cu之间形成原电池。如果这个观点正确,那么原电池的正极反应式为__________________。
17.如图是一个化学过程的示意图。已知甲池的总反应式为2CH3OH+3O2+4KOH2K2CO3+6H2O。
请回答下列问题:
(1)图中甲是_____装置。(“原电池”或“电解池”)
(2)下列电极的名称:A(石墨)电极的名称是_____。
(3)写出通入O2的电极的电极反应式_____。
(4)当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2_____mol;此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是_____(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
(5)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阴极反应式是:_____。
②除去杂质后的氢氧化钾溶液从液体出口_____(填写“A”或“B”)导出。
18.某同学设计了如图所示装置,可探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
(1)甲装置中通入氧气的电极为_______(填“正极”或“负极”),负极的电极反应式_______。
(2)乙装置中Fe电极为_______(填“阳极”或“阴极”);C电极上发生_______(填“氧化”或“还原”)反应,电极反应式为_______。
(3)反应一段时间后,乙装置中氢氧化钠主要在_______(填“Fe电极”或“C电极”)区生成。
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间后,CuSO4溶液的浓度_______(填“增大”“减小”或“不变”)。
(5)已知NA为阿伏加德罗常数的值。若在标准状况下,有2.24L氧气参加反应,则丙装置中阴极析出铜的质量为_______。
19.回答下列问题:
(1)指出下列变化能量是怎样转化的:学校燃烧煤煮饭_________,给手机的电池充电_________。
(2)磷元素有多种性质不同的单质,红磷(结构复杂用“P”表示)和白磷(P4)是磷的两种同素异形体,充分燃烧之后的产物都是五氧化二磷。在25 ℃、101 kPa下,31 g白磷完全转化为红磷,放出11 kJ的热量,根据以上事实回答下列问题:
①红磷转化为白磷属于_________反应(填“放热”或“吸热”)。
②二者更稳定的是_________。(填“白磷”或“红磷”)。
(3)拆开1 mol H—H键、1 mol I—I、1 mol H—I键需要吸收的能量为436kJ、151k J、299k J。则氢气和碘生成1 mol HI需要_________(填“放出”或“吸收”)_________k J的热量。
三、实验题
20.将裹有锌片的铁钉放入溶有琼脂的饱和NaCl溶液中,滴入少量酚酞,回答下列问题。
(1)一段时间后a处可能出现的现象是_____,请结合化学用语解释原因______。
(2)某同学为验证选择的铁钉未被腐蚀,取少量溶液于试管,分别进行如表实验,能证明铁钉未被腐蚀的实验是_____(填序号)。
序号 ① ② ③ ④
滴入试剂 AgNO3溶液 淀粉KI溶液 KSCN溶液 K3[Fe(CN)6]溶液
实验现象 产生沉淀 无蓝色出现 无红色出现 无蓝色沉淀
(3)某同学欲将铁棒镀铜设计电镀铜实验,请依据提供实验用品完成如图所示电镀装置_____,并写出电池工作一段时间后的现象。
供选择的实验用品:FeCl2溶液,CuSO4溶液,铜棒,锌棒,铁棒
实验现象:_____。
21.某小组研究和的氧化性,进行如下实验。
已知:是黄色液体,氧化性:。
(1)实验Ⅰ过程Ⅰ中与反应的化学方程式是_________。
(2)实验Ⅰ过程Ⅱ中溶液变红,说明产生了,分析可能原因。
假设①被氧化。过程Ⅱ发生反应的电极反应式:
a.氧化反应:
b.还原反应:_________。
假设②和生成,进而使清液中的氧化为。设计实验Ⅱ证实假设。
i._________。
ⅱ.实验Ⅱ中过程Ⅱ的离子方程式为_________。
(3)设计实验进一步研究能否氧化。
编号 实验Ⅲ 实验Ⅳ
实验及现象
①实验Ⅲ中溶液的作用是_________。
②实验Ⅳ证实能氧化的实验现象除电流表指针偏转外,还有_________(答出2点)。
(4)分析实验Ⅱ中能氧化,实验Ⅲ中未能氧化的原因:_________。
四、工业流程题
22.工业上用电解溶液生成的氯气为原料,生产溴酸钾的工艺流程如下:
回答下列问题:
(1)惰性电极电解溶液产生氯气总反应的离子方程式为______________。
(2)“合成I”中得到,该反应的还原剂是______________;“合成II”中加入的目的是____________。
(3)结合溶解度曲线分析,“合成Ⅲ”为复分解反应,该反应能发生的原因是____________;若向溶液中加入______________粉末,可使溶液中的降为[假设溶液体积不变,已知该温度下]。“合成III”实际中用饱和溶液而不用粉末的优点是______________(写一条)。
(4)为了从过滤II后的滤液中获得氯化镁结晶,依次要经过________、___________操作。
(5)另一种产生溴酸盐的方法是用溶液吸收,同时生成气体。写出相应的化学方程式______________;原子经济性更高的是______________(填“吸收法”或“氯气氧化法”)。
五、原理综合题
23.氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
(1)已知:
反应I的热化学方程式:_______。
(2)反应I所得产物的溶液在碘过量时会自发分成两层。分离两层溶液的实验操作是_______。
(3)研究发现,通过电解方法实现反应I,既可减少碘的加入量,也可减少溶液后续纯化过程的能耗。写出通过电解法实现反应I时,阳极的电极反应式:_______。
(4)碘硫循环过程中反应I所制备出的HI浓度较低,必须对HI溶液进行浓缩。电解电渗析浓缩HI溶液的原理如下图所示,初始时阳极液和阴极液相同,溶液组成均为n(HI):n(H2O):n(I2)=1:6.8:2。
①电渗析过程中,阳极液中I2的浓度会_______(填“增大”或“减小”)。
②结合化学用语,解释阴极区进行HI浓缩的原理_______。
(5)某科研小组采用双极膜电渗析法制备高浓度氢碘酸,工作原理如下图所示。
已知:双极膜在直流电场作用下可将水解离,在双极膜的两侧分别得到H+和OH-。
①X极是_______(填“阳极”或“阴极”)。
②电解后,_______室获得较浓的氢碘酸(填“a”、“b”或“c”)。
参考答案:
1.C
【详解】焓变=反应物总键能-生成物总键能,H2(g)+Cl2(g)=2HCl(g) △H=(436+243-431×2) kJ·mol-1= -183kJ·mol-1,故选C。
2.D
【详解】已知:① ;② ,由盖斯定律可知,②×2-①可得 ΔH=ΔH2×2-ΔH1=×2-=,故选D。
3.C
【详解】A.碱性锌锰电池的总反应为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,Zn的化合价升高,失去电子,被氧化,则Zn为负极,Mn元素的化合价降低,得到电子,被还原,MnO2为正极,故A错误;
B.碱性锌锰电池为一次电池,故B错误;
C.Zn为负极,Zn失去电子转化为Zn(OH)2,负极的电极反应式为:Zn+2OH--2e-=Zn(OH)2,故C正确;
D.Zn为负极,MnO2为正极,原电池中电子从负极经导线流向正极,则工作时电子由经外电路流向MnO2,故D错误;
故选C。
4.D
【详解】A.生铁中杂质比较多,易构成原电池加快腐蚀速率,所以比纯铁更容易生锈,A正确;
B.铁管上镶嵌锌块,锌比铁活泼,构成原电池时锌做负极,铁管不易被腐蚀 ,B正确;
C.电解精炼铜时,以待精炼的铜作为阳极,精铜做阴极,C正确;
D.外加电流法是把被保护的钢铁设备作为阴极,使钢铁表面腐蚀电流降至零或接近零,D错误;
故选D。
5.D
【详解】A.右侧电极硝基苯发生还原反应,右侧为阴极、左侧为阳极,所以左侧电极的电势比右侧的高,且发生氧化反应,故A正确;
B.右侧电极硝基苯发生还原反应,右侧为阴极,阴极发生反应为 ,故B正确;
C.右侧为阴极、左侧为阳极,从右侧经过阴离子交换膜向左侧移动,故C正确;
D.阳极反应式为,R-CH2NH2-4e-+4OH-=R-CN+4H2O,根据得失电子守恒,每当合成得到,同时合成,故D错误;
选D。
6.D
【分析】根据题意可知,该装置可回收硅,因而产生硅单质的炉渣一极为得电子的阴极,连接的M极为负极,而连接废钢为阳极,N为正极。
【详解】A.根据分析可知,M为电源负极,选项A正确;
B.该实验是废钢脱碳故其中含有大量Fe,用稀H2SO4会与之反应,不能选用稀硫酸作为电解质溶液,选项B正确;
C.电解时,阳极上C失电子产生CO,发生的电极反应为,选项C正确;
D.若有1 mol 移向废钢电极,由反应可知转移电子为2mole-,阴极的电极反应式为,则炉渣电极所得硅的质量为,选项D;
答案选D。
7.D
【分析】据锂离子电池的电池反应式为:,可知放电时,Li的化合价升高,被氧化,为原电池的负极,负极的电极反应式:Li-e-=Li+;充电时,反应物只有一种,故化合价既有升,又有降,所以既发生氧化反应又发生还原反应;由于Li可以与水反应,故电解质材料应为非水材料;原电池工作时,阳离子向正极移动,阴离子向负极移动。
【详解】A.放电时,负极反应:Li-e-=Li+,故A正确;
B.放电过程中,阳离子向正极移动,Li+向正极移动,故B正确;
C.Li很活泼,会与水反应,不能用水溶液作为电解质,故C正确;
D.充电过程中,电池上标注“+”的电极应与外接电源的正极相连,故D错误;
故选D。
8.C
【分析】开关K置于a处时,构成电解池,两极均有气泡产生,说明石墨电极与直流电源正极相连,铜电极与直流电源负极相连,因为如果铜电极与直流电源正极相连,则铜电极作阳极,铜失电子生成铜离子,没有气体产生;阳极的电极反应式为,阴极的电极反应式为,U形管中的液面上升,则左侧收集的气体为Cl2,右侧为H2;一段时间后,再将开关K置于b处,构成原电池,可观察到两极的气体逐渐减少,则左侧石墨电极为正极,电极反应式为,右侧铜电极为负极,电极反应式为,据此分析解答。
【详解】A.根据分析,开关K置于a处时,铜电极与直流电源负极相连,A错误;
B.开关K置于a处时,产生气体的原因为,B错误;
C.开关K置于b处时,构成原电池,左侧石墨电极为正极,右侧铜电极为负极,阳离子通过阳离子交换膜移向石墨电极,C正确;
D.根据分析,开关K置于b处时,铜电极上的电极反应式为,D错误;
故选C。
9.C
【分析】电解含镍酸性废水制备单质镍,镀镍铁棒为阴极,发生反应Ni2++2e-=Ni,B是锂钒氧化物二次电池的负极,A是正极,碳棒是电解池的阳极。
【详解】A.电解含镍酸性废水制备单质镍,镀镍铁棒为阴极,电解过程中Y电极上的电极反应为:,故A正确;
B.电解过程中,c中氯离子通过阴离子交换膜进入b、a中钠离子通过阳离子交换膜进入b,b中NaCl溶液的物质的量浓度会增大,故B正确;
C.锂能与水反应,锂钒氧化物二次电池不能用LiCl水溶液作为电解液,故C错误;
D.A是锂钒氧化物二次电池的正极,充电时,正极发生氧化反应,锂钒氧化物二次电池充电时A电极的电极反应为, 故D正确;
选C。
10.B
【分析】通电后石墨电极Ⅱ上有生成,氢氧根离子放电生成氧气,电极反应式为,石墨电极Ⅱ为阳极,电极为电源正极,为负极,石墨电极I为阴极,得电子发生还原,据此分析解答。
【详解】A.通电后石墨电极Ⅱ上有生成,石墨电极Ⅱ为阳极,电极为电源正极,为负极,故A正确;
B.石墨电极Ⅰ为阴极,得电子发生还原,氯离子向阳极移动,随着电解的进行,溶液浓度减小,故B错误;
C.当0.01molFe2O3完全溶解时,消耗氢离子,根据,生成O20.015mol,标准状况下至少产生气体336mL,故C正确;
D.通电后石墨电极Ⅱ电极反应式为,该极酸性增强,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色,故D正确;
故答案为B。
11.D
【详解】A.a电极上转化为,O元素失电子化合价升高,则a为阳极,正极连接阳极,则a电极应该连接电源的正极,故A错误;
B.电解池中阳离子由阳极移向阴极,则溶液中的由Ⅰ室向Ⅱ室迁移,故B错误;
C.Ⅱ室中转化为、、等,不是只生成,则每消耗气体,转移电子不等于,则无法确定生成的物质的量,故C错误;
D.b极转化为,C元素化合价降低,电极反应式为,故D正确;
故答案为:D。
12.D
【详解】断裂1 molN2(g)和1 molO2(g)中化学键吸收能量分别为946kJ、498kJ,形成1 mol NO(g)中化学键释放出632kJ能量。反应N2(g)+O2(g)=2NO(g)中,断裂反应物中化学键吸收总能量为946kJ+498kJ=1444kJ,形成反应物中化学键释放的总能量为632kJ×2=1264kJ,则该反应是吸热反应,二者的能量差为1444kJ-1264kJ=180kJ,故△H=+180 kJ/mol,与反应生成的热化学方程式为,故选D。
13.D
【详解】A.NaCl溶于水,在水分子作用下电离出Na+、Cl-,其电离方程式为,A项正确;
B.该原电池装置,锌为负极,其电极反应为Zn-2e-=Zn2+,铜为正极,其电极反应为Cu2++2e-=Cu,故总反应为Zn+ Cu2+= Zn2++ Cu,B项正确;
C.此装置为氢氧燃料电池,在碱性条件下负极反应为,C项正确;
D.电解饱和食盐水总反应为,D项错误;
答案选D。
14.D
【详解】A.光照时,光催化材料会产生电子(e )和空穴(h+),能实现CO2和H2O的资源化转化,实现了太阳能→电能→化学能的转化,A正确;
B.图1和图2物质中碳原子的杂化方式共有3种,甲烷中的碳采用sp3杂化,二氧化碳中是sp杂化,g C3N4中碳采用sp2杂化,B正确;
C.空穴(h+)可得电子,可视为氧化剂,H2O转化的反应为,C正确;
D.得到×8e-=4e-变成CH4,得失电子守恒可知H2O中的-2价氧元素失去4mol电子生成1molO2,标况下体积,D错误;
故选:D。
15.(1)
(2) 正极 0.12
(3) 减少 12.8
【详解】(1)根据图像可知
①
②
根据盖斯定律可知①-②×6即得到 ,则燃烧热的热化学方程式为 。
(2)电极b通入氧气,发生得到电子的还原反应,为正极;电极a是负极,氨气失去电子被氧化为氮气,电极反应为;当共消耗1.568 L(标准状况)气体时,气体的物质的量是1.568L÷22.4L/mol=0.07mol,根据反应可知氨气是0.04mol,氧气是0.03mol,所以通过负载的电子的物质的量为0.04mol×3=0.12mol。
(3)①a极通入的是肼,发生失去电子的氧化反应,电极反应式为;电池中氧气把亚铁离子氧化为铁离子,则的离子方程式为。
②若利用该电池给铅酸蓄电池充电,当消耗3.2 g 时,转移电子的物质的量是,电极理解原电池的正极,作阳极,电极反应式为PbSO4-2e-+2H2O=PbO2+SO+4H+,所以该电极质量减少,减少的质量为0.2mol×64g/mol=12.8g。
16.(1)B
(2) 正 还原 Cu2++2e- =Cu
(3) 2H++2e-=H2; O2+4e-+2H2O=4OH-
【详解】(1)在甲图装置中,锌的活泼性大于铜,锌是负极、铜是正极,当检流计中指针发生偏转时,盐桥中的离子移动方向为K+移向B烧杯。
(2)在甲图装置中,锌的活泼性大于铜,锌是负极、铜是正极,正极铜离子得电子发生还原反应,铜电极上发生的电极反应式为Cu2++2e- =Cu。
(3)①Zn、Cu作电极,H2SO4溶液作为电解质溶液,正极氢离子得电子生成氢气,正极反应式为2H++2e-=H2;
②由于溶解在溶液中的氧气的作用,使得Zn、Cu之间形成原电池,正极氧气得电子生成氢氧根离子,正极反应式为O2+4e-+2H2O=4OH-。
17.(1)原电池
(2)阳极
(3)O2+4e-+2H2O=4OH-
(4) 0.0125 BD
(5) 2H++2e-=H2↑##2H2O+2e-=H2↑+2OH- B
【分析】甲装置为燃料电池,通燃料的一极是负极,该极甲醇失电子和氢氧根离子反应生成碳酸根离子和水,通氧气的一极为正极;乙池、丙池均是电解池,A电极与原电池正极相连,为阳极,则B电极为阴极,D电极与原电池负极相连,为阴极,则C电极为阳极,据此分析。
【详解】(1)据分析,甲装置为燃料电池,是原电池,故答案为:原电池。
(2)据分析,A(石墨)电极的名称是阳极,故答案为:阳极。
(3)通入O2的电极是正极,电极反应式:,故答案为:。
(4)乙池中B(Ag)极的电极反应为,当B(Ag)极的质量增加5.40g时即n(Ag)=0.05mol,则转移电子为0.05mol,甲中正极反应为:,则转移0.05mol电子时消耗的氧气为0.0125mol;丙池是电解池,阴极上金属离子放电析出金属单质,则金属元素在氢元素之后,D电极连接甲醇电极,所以D是阴极,根据转移电子相等知,当析出一价金属时,其摩尔质量为1.6÷0.05 = 32g/mol,无符合题意的选项,当析出的是二价金属,则其摩尔质量为(1.6÷0.05)2=64g/mol,所以该金属是铜,则溶液是硫酸铜溶液,也可能是硝酸银放电结束后水放电,所以也可能是硝酸银,故选BD。故答案为:0.0125;BD。
(5)①该电解槽的右侧电极和电源负极相连,为阴极,用阳离子交换膜电解法除去工业品氢氧化钾溶液中的杂质含氧酸根,相当于电解水,所以该极的反应式是:;
②结合以上分析可知在阴极区聚集大量的K+和OH-,从而产生纯的氢氧化钾溶液,除杂后的氢氧化钾溶液从出口B导出;
故答案为:;B。
18.(1) 正极
(2) 阴极 氧化
(3)Fe电极
(4)减小
(5)12.8g
【分析】分析三个装置,甲装置是氢氧燃料电池,通氧气的一极是正极,通氢气的一极是负极;乙是电解氯化钠溶液,探究氯碱工业,铁电极接负极,是阴极,碳棒极是正极;丙池是精炼铜。
【详解】(1)甲装置是氢氧燃料电池,通入氧气的电极为正极,负极是通入氢气的一极,介质是KOH溶液,所以电极反应式是;故答案是正极;;
(2)乙是电解氯化钠溶液,探究氯碱工业,铁电极接甲池通氢气的一极,故铁电极为阴极;碳棒极是正极,电极上发生氧化反应;电极方程式为;
(3)阴极中氢离子放电生成氢气,氢氧根逐渐增多,故乙电极中氢氧化钠主要在阴极生成,即Fe电极;
(4)丙装置中,阳极中的粗铜中活泼金属成分如锌、铜先反应,阴极是溶液中的Cu2+放电,根据两极电子转移相等,故阴极中铜得到的数目比阳极中的铜失去的电子数目大,即溶液中由阳极产生的Cu→Cu2+的含量比阴极Cu2+→Cu的含量少,溶液中铜离子浓度减少,故如果粗铜中含有锌、银等杂质,丙装置中反应一段时间后,CuSO4溶液的浓度减小;
(5)标准状况下,有2.24L氧气即0.1mol氧气参与反应,就转移电子数目是0.4mol电子,根据串联装置中,电子转移数目相等,丙装置阴极发生Cu2++2e-=Cu↓,反应析出铜的质量是12.8g。
19.(1) 化学能转化为热能 电能转化为化学能
(2) 吸热 红磷
(3) 放出 5.5kJ
【详解】(1)学校燃烧煤煮饭,燃烧放热,将化学能转化为热能;给手机的电池充电利用的是电解池原理,能量变化为电能转化为化学能;
(2)在25℃、101 kPa下,31 g白磷完全转化为红磷,放出11 kJ的热量,说明同一条件下白磷比红磷能量高,则
①红磷转化为白磷属于吸热反应;
②能量越低越稳定,则上述二者更稳定的是红磷;
(3)根据=断键吸收的能量-成键放出的能量,因为拆开1 mol H—H键、1 mol I—I、1 mol H—I键需要吸收的能量为436kJ、151k J、299kJ,所以氢气和碘生成1 mol HI对应的反应焓变==-5.5 kJ/mol,故答案为:放出;5.5kJ。
20.(1) 溶液变红色 铁做正极,空气氧气得到电子发生还原反应生成氢氧根离子,使得a处溶液显碱性
(2)④
(3) 铁表面生成红色固体,铜棒溶解
【分析】裹有锌片的铁钉放入溶有琼脂的饱和NaCl溶液中,锌比铁活泼,锌做负极发生氧化反应生成锌离子,铁做正极被保护;
电镀实验中镀层金属做阳极、镀件做阴极,含有镀层金属阳离子的溶液做电解液;
【详解】(1)锌比铁活泼,锌做负极发生氧化反应,铁做正极,空气氧气得到电子发生还原反应生成氢氧根离子,使得a处溶液显碱性,酚酞溶液变红色;
(2)若铁被腐蚀,则会生成亚铁离子;
①溶液中含有氯化钠,氯离子和银离子生成氯化银白色沉淀,不能说明铁未被腐蚀,不符合题意;
②亚铁离子和碘离子不反应,无蓝色沉淀不能说明铁未被腐蚀,不符合题意;
③亚铁离子和KSCN溶液不反应,无红色出现不能说明铁未被腐蚀,不符合题意;
④K3[Fe(CN)6]溶液和亚铁离子生成蓝色沉淀,物蓝色沉淀,说明铁未被腐蚀,符合题意;
故选④;
(3)将铁棒镀铜设计电镀铜实验,则镀件铁棒做阴极,铜离子发生还原在铁表面生成铜,硫酸铜溶液做电解液,铜棒做阳极发生氧化反应生成铜离子,图示为 ;
现象为:铁表面生成红色固体,铜棒溶解。
21.(1)Cu+2FeCl3=2FeCl2+CuCl2
(2) Cu2++e-+SCN-=CuSCN↓ 0.1 2Fe2++(SCN)2=2Fe(SCN)2+
(3) 检验实验中是否有Fe2+生成 正极区FeCl3溶液颜色变浅,负极区KSCN溶液由无色变为黄色
(4)实验Ⅱ中能氧化由于生成CuSCN白色沉淀,促进反应正向进行,而实验Ⅲ中能与形成Fe(SCN)2+络离子,从而减弱了Fe3+的氧化性
【详解】(1)实验Ⅰ过程Ⅰ中Cu与FeCl3反应生成FeCl2和CuCl2,故该反应的化学方程式是Cu+2FeCl3=2FeCl2+CuCl2,故答案为:Cu+2FeCl3=2FeCl2+CuCl2;
(2)b.由题干实验信息可知,生成白色沉淀CuSCN,则还原反应为:Cu2++e-+SCN-=CuSCN↓,故答案为:Cu2++e-+SCN-=CuSCN↓;
i.根据对照实验I中,FeCl3的浓度为0.1mol/L,根据反应Cu+2FeCl3=2FeCl2+CuCl2可知,足量的Cu与FeCl3反应后生成的CuCl2的物质的量浓度为0.1mol/L,为了实验中控制变量,故0.1,故答案为:0.1;
ⅱ.实验Ⅱ中过程I的方程式为:2Cu2++4SCN-=2CuSCN↓+(SCN)2,则过程Ⅱ的离子方程式为2Fe2++(SCN)2=2Fe(SCN)2+,故答案为:2Fe2++(SCN)2=2Fe(SCN)2+;
(3)①Fe2+与K3[Fe(CN)6]溶液反应生成普鲁士蓝色沉淀,则实验Ⅲ中K3[Fe(CN)6]溶液的作用是检验实验中是否有Fe2+生成,故答案为:检验实验中是否有Fe2+生成;
②实验Ⅳ证实能氧化,即该原电池的电极反应分别为:负极反应:2SCN--2e-=(SCN)2,正极反应为:Fe3++e-=Fe2+,故实验现象除电流表指针偏转外,还有正极区FeCl3溶液颜色变浅,负极区KSCN溶液由无色变为黄色,故答案为:正极区FeCl3溶液颜色变浅,负极区KSCN溶液由无色变为黄色;
(4)实验Ⅱ中能氧化由于生成CuSCN白色沉淀,促进反应正向进行,而实验Ⅲ中能与形成Fe(SCN)2+络离子,从而减弱了Fe3+的氧化性,故答案为:实验Ⅱ中能氧化由于生成CuSCN白色沉淀,促进反应正向进行,而实验Ⅲ中能与形成Fe(SCN)2+络离子,从而减弱了Fe3+的氧化性。
22.(1)
(2) 与反应得到溴酸根离子,在合成Ⅲ中更多地生成溴酸钾与氯化镁分离,提高的纯度
(3) 反应体系中溶解度较小,析出沉淀 1.08 用饱和溶液沉淀速率更快或转化率(利用率)更高
(4) 蒸发结晶 趁热过滤
(5) 氯气氧化法
【分析】工业上用电解饱和食盐水生成氯气生产溴酸钾的工艺流程,分析流程可知,饱和食盐水电解生成氯气具有氧化性,在水中和溴单质反应生成溴酸和氯化氢,加入过量氧化镁和盐酸溴酸反应生成氯化镁和溴酸镁,过滤得到滤液中加入饱和氯化钾溶液,溴酸镁在饱和溶液中析出晶体,以此解答。
【详解】(1)用惰性电极电解 MgCl2溶液过程中,阳极2Cl--2e-=Cl2↑ 阴极2H2O+2e-+Mg2+=H2↑+ Mg(OH)2↓, 总反应的离子方程式为。
(2)“合成I”发生反应是氯气在水溶液中氧化溴单质为溴酸,反应的化学方程式5Cl2+Br2+6H2O=2HBrO3+10HCl,Br元素化合价上升,该反应的还原剂是;依据流程分析可知,加入和溶液中反应得到溴酸根离子,在合成Ⅲ中更多地生成溴酸钾与氯化镁分离,提高的纯度。
(3)过量氧化镁和盐酸溴酸反应生成氯化镁和溴酸镁,加入饱和氯化钾溶液,反应体系中溶解度较小,析出沉淀,发生了复分解反应;降为时,即需要沉淀2×0.15mol/L×2-2×0.1mol/L=0.4mol,需要消耗0.4molKCl,此时溶液中剩余c(K+)=,需要加入KCl的物质的量n(K+)=0.34mol/L×2L+0.4mol=1.08mol;“合成III”实际中用饱和溶液而不用粉末的优点是:用饱和溶液沉淀速率更快或转化率(利用率)更高。
(4)氯化镁的溶解度随温度变化较大,可以通过重结晶的方法从溶液中获得氯化镁结晶,依次要经过蒸发结晶、冷却结晶操作。
(5)和反应生成、和KBr,Br元素化合价由0价上升到+5价,又由0价下降到-1价,根据得失电子守恒和原子守恒配平方程式为: ;该方法中部分转化为KBr,氯气氧化法中全部转化为,所以原子经济性更高的是氯气氧化法。
23.(1)
(2)分液
(3)
(4) 增大 阴极: ,H+通过质子交换膜由阳极区进入阴极区,阴极区HI的浓度增大
(5) 阴 c
【详解】(1)反应①
反应②
反应③
按盖斯定律,反应Ⅰ=-×①-②-×③,反应Ⅰ的=---,则反应I的热化学方程式为: 。
(2)反应I所得产物溶液在碘过量时会自发分成两层,则为互不相溶的两层液体,分离两层溶液的实验操作是分液。
(3)反应I为,电解法实现反应I时,阳极二氧化硫失去电子被氧化转变为硫酸根,阳极的电极反应式:。
(4)①通过电解电渗析浓缩HI溶液,电渗析过程中,阳极碘离子失去电子被氧化转变为碘单质,则阳极液中I2的浓度会增大。
②结合化学用语,解释阴极区进行HI浓缩的原理为:阴极电极反应为 ,H+通过质子交换膜由阳极区进入阴极区,阴极区HI的浓度增大。
(5)①采用双极膜电渗析法制备高浓度氢碘酸,X电极上水提供的氢离子转变为氢气,是还原反应,则X极是阴极。
②Y为阳极,进入b中碘离子通过阴离子交换膜进入c室,右侧双极膜在直流电场作用下可将水解离产生的H+在c室、OH-在阳极Y放电产生氧气,则电解后,c室获得较浓的氢碘酸。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
