第二章 分子结构与性质 测试题(含解析) 高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 第二章 分子结构与性质 测试题(含解析) 高二下学期化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-26 11:57:14 | ||
图片预览




文档简介
第二章 分子结构与性质 测试题
一、选择题
1.下列对一些实验事实的理论解释正确的是
选项 实验事实 理论解释
A 、空间构型均为角形 和是等电子体
B 白磷为正四面体分子 白磷分子中P—Р键间的夹角是109.5°
C 硼酸固体难溶于水,加热溶解度增大 加热后,硼酸分子之间的氢键部分断裂,与水分子产生氢键作用
D HF的沸点高于HCl H—F的键能比H—Cl的键能大
A.A B.B C.C D.D
2.从烟道气(含粉渣、CO2、SO2等)中分离回收硫的基本反应之一是SO2(g) + 2CO(g)2CO2(g) + S(s) ΔH<0。SO2在大气中能生成SO3、H2SO3、H2SO4。下列有关SO2、SO3、SO和SO的说法正确的是
A.SO中S原子的杂化方式为sp3 B.SO的空间构型为平面正方形
C.SO2晶体熔点高、硬度大 D.SO3分子是极性分子
3.火药制备是我国古代闻名世界的化学工艺,原理为 2KNO3+S+3C=K2S+N2↑+ 3CO2 ↑。下列说法正确的是
A.K2S 的电子式:K
B.CO2和N2都是非极性分子
C.K+的结构示意图:
D.基态O原子核外电子轨道表达式:
4.由键能数据大小,不能解释下列事实的是
化学键 N≡N O=O F-F H-F H-Cl H-Br H-I
键能/kJ mol-1 946 497.3 157 568 431.8 366 298.7
A.熔沸点:HF>HCl>HBr B.稳定性:HCl>HBr>HI
C.与H2的反应能力:F2>O2>N2 D.热分解温度:HCl>HBr>HI
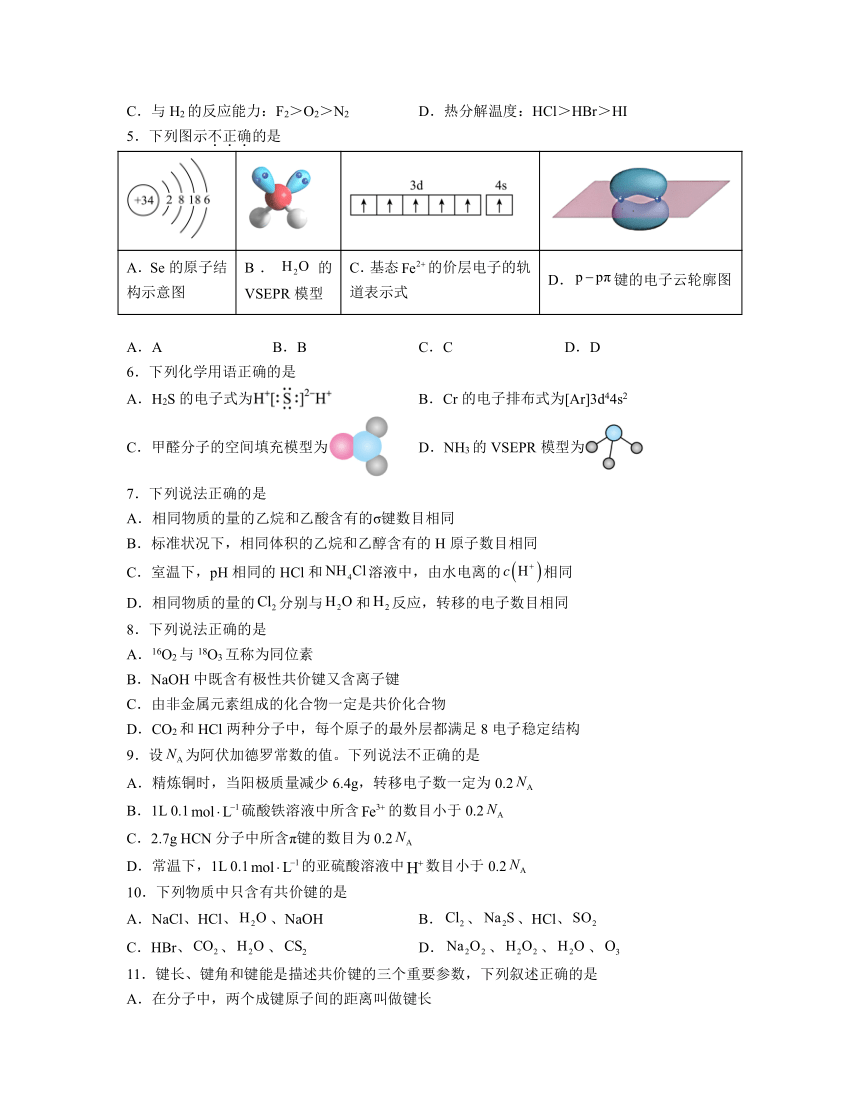
5.下列图示不正确的是
A.Se的原子结构示意图 B.的VSEPR模型 C.基态的价层电子的轨道表示式 D.键的电子云轮廓图
A.A B.B C.C D.D
6.下列化学用语正确的是
A.H2S的电子式为 B.Cr的电子排布式为[Ar]3d44s2
C.甲醛分子的空间填充模型为 D.NH3的VSEPR模型为
7.下列说法正确的是
A.相同物质的量的乙烷和乙酸含有的σ键数目相同
B.标准状况下,相同体积的乙烷和乙醇含有的H原子数目相同
C.室温下,pH相同的HCl和溶液中,由水电离的相同
D.相同物质的量的分别与和反应,转移的电子数目相同
8.下列说法正确的是
A.16O2与18O3互称为同位素
B.NaOH中既含有极性共价键又含离子键
C.由非金属元素组成的化合物一定是共价化合物
D.CO2和HCl两种分子中,每个原子的最外层都满足8电子稳定结构
9.设为阿伏加德罗常数的值。下列说法不正确的是
A.精炼铜时,当阳极质量减少6.4g,转移电子数一定为0.2
B.1L 0.1硫酸铁溶液中所含的数目小于0.2
C.2.7g HCN分子中所含π键的数目为0.2
D.常温下,1L 0.1的亚硫酸溶液中数目小于0.2
10.下列物质中只含有共价键的是
A.NaCl、HCl、、NaOH B.、、HCl、
C.HBr、、、 D.、、、
11.键长、键角和键能是描述共价键的三个重要参数,下列叙述正确的是
A.在分子中,两个成键原子间的距离叫做键长
B.型分子的键角均为180°
C.C—C键的键能为347.7,但C=C键的键能小于
D.H—Cl键的键能为431.8,故HCl分解成1mol和1mol时,消耗的能量为863.6kJ
12.下列物质由离子构成的是( ).
A.水 B.氢气 C.氯化钠 D.铁
13.下列物质中,即含有离子键,又含有共价键的是
A.H2SO4 B.NaOH C.Na2O D.H2O2
14.下列说法错误的是
A.基态B原子核外电子的运动状态有5种
B.水溶性:
C.的价电子对分布的几何构型与分子的空间结构一致
D.可以通过红外光谱仪来测定分子结构
15.某种净水剂由原子序数依次增大的R、W、X、Y、Z五种主族元素组成。五种元素分处三个短周期,且包含地壳中含量前三的三种元素。五种元素原子的最外层电子数之和为20。下列说法正确的是
A.简单离子半径:
B.最简单氢化物的稳定性:
C.R分别与W、Z形成的三原子分子均为V形分子
D.常见单质的熔点:
二、填空题
16.根据已学知识,请回答下列问题:
(1)最外层电子排布为的基态原子的核电荷数为_______。
(2)某元素被科学家称之为人体微量元素中的“防癌之王”,其基态原子的外围电子排布式为,该元素的名称是_______。
(3)的空间构型为:_______。
(4)周期表中电负性最大的元素基态原子的轨道表示式为_______。
(5)某元素基态原子核外有三个电子层,最外层电子数是核外电子总数的,写出该元素原子的电子排布是_______。
17.已知某些元素在周期表中的位置如下图所示,请按要求填空。
(1)元素2的电子排布式为_______。
(2)元素5的价电子排布图为_______。
(3)元素4位于_______区。
(4)元素6的低价氧化物分子构型为_______。与该氧化物互为等电子体的分子为_______,离子为_______(只写一种)。
(5)元素3在周期表中的位置为_______。其原子结构示意图为_______。
18.(1)石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图所示),可由石墨剥离而成,具有很好的应用前景。
①石墨烯中的化学键是______(填“极性”或“非极性”)键。
②石墨烯中的键角为______。
(2)已知几种常见化学键的键能如表所示:
化学键
键能/() 368 467 226 x
比较键与键的键能大小:x______(填“>”“<”或“=")226。
19.磷酸和亚磷酸(H3PO3)是磷元素的两种含氧酸。亚磷酸与NaOH反应只生成NaHPO3和NaH2PO3两种盐,则H3PO3的结构式为___________,其为___________元酸,原因是___________。
20.请填写下表:
空间构型 杂化方式 分子类型(极性或非极性)
二氧化硫 __ ___ ___
氨气 ___ ___ ____
三氧化硫 ____ ___ ___
21.(1) CH3COO[Cu(NH3)2]中C原子轨道的杂化类型是____。与NH3分子互为等电子体的阴离子为____。
(2) 乳酸分子()中C原子的杂化类型为____。与互为等电子体的一种分子化学式为_____。
(3) 的空间构型为________(用文字描述);NaNT可由(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________。
(4)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是____;与SiF4互为等电子体的阴离子的化学式为_______。
(5) 中N原子轨道的杂化类型是___。与互为等电子体的一种分子为__(填化学式)。
(6)苯甲醇()中碳原子的杂化轨道类型为______。与 互为等电子体的阳离子为______(填化学式),离子的空间构型为(用文字描述)________。
22.杂化轨道理论是一种价键理论,是鲍林为了解释分子的空间结构提出的。
(1)轨道的杂化
在外界条件影响下,原子内部___________的原子轨道发生混杂,重新组合成一组新的轨道的过程。
(2)杂化轨道
原子轨道___________后形成的一组新的原子轨道,叫做杂化原子轨道,简称杂化轨道。
(3)轨道杂化的过程:___________。
三、元素或物质推断题
23.A、B、C、D、E、F 六种短周期主族元素,它们的原子序数依次增大。A 与 E 同主族,D 与 F 同主族,且 A 与 D 能形成两种液态化合物;B 的某种单质是自然界中硬度最大的物质,C 与D 形成的化合物是大气常见污染物之一。请回答下列问题:
(1)F 在元素周期表中的位置是_____,D、E、F 三种元素简单离子半径由大到小的顺序是________(用离子符号表示)。
(2)元素 E、F 可形成多原子化合物E2Fx(x ≥ 2)。该化合物中所含的化学键类型是_____。
(3)实验室可利用_____(填试剂名称)清洗附着于试管内壁的 F 单质。
(4)处理含 BC 废水的方法之一是在微生物的作用下,BC 被 D 的单质氧化成 ABD ,同时生成C 的简单氢化物,该反应的离子方程式为_____。
【参考答案】
一、选择题
1.C
解析:A.的价层电子数为4,含有2对孤电子对,空间构型为V形,价层电子数为3,孤电子对数为1,空间构型为V形,空间构型和等电子体无关,A项错误;
B.白磷分子为,4个P原子位于正四面体的4个顶点,每个面都是正三角形,P-P键,键角60°,B项错误;
C.硼酸分子由于分子间氢键的存在,形成了块状,使得硼酸固体难溶于水,加热时破坏了硼酸分子间的氢键,使得硼酸更易与水产生分子间氢键,故溶解度增大,C项正确;
D.HF和HCl的熔沸点与分子内的共价键无关,只与分子间作用力有关,HF分子间可以形成氢键,所以HF比HCl沸点高,D项错误;
答案选C。
2.A
解析:A.SO中S原子的价层电子对数=3+1=4,S杂化方式为sp3,A正确;
B.SO中S原子的价层电子对数=4+0=4,S杂化方式为sp3,没有孤电子对,空间构型为正四面体形,B错误;
C.SO2晶体是分子晶体,熔点低、硬度小,C错误;
D.SO3分子中S原子的价层电子对数=3+0=3,S杂化方式为sp2,没有孤电子对,空间构型为正三角形,正负电荷中心重合,是非极性分子,D错误;
答案选A。
3.B
解析:A.K2S结构中K+与S2-形成离子键,其电子式为:,A错误;
B.由非极性键形成的分子称为非极性分子,N2由非极性键构成的非极性分子,由极性键形成的分子,如果电荷分布是对称均匀的,也是非极性分子,二氧化碳结构为:O=C=O,直链对称的,所以为非极性分子,B正确;
C.K元素的核电荷数为19,质子数为19,核外电子数为19,K+表示失去最外层一个电子,K+核外还有18个电子,各层电子数分别为2、8、8,K+的结构示意图为,C错误;
D.O为8号元素,根据泡利原理和洪特规,则原子核外电子轨道表达式:,D错误;
故选B。
4.A
解析:A.键能影响化学性质,熔沸点是物理性质,不能用键能数据大小来解释,故A错误;
B.Cl、Br、I原子与H原子间形成的共价键的键能越来越弱,氢化物的稳定性减弱,稳定性:HCl>HBr>HI,可以用键能数据大小解释,故B正确;
C.键能:H-F>H-O>H-N,稳定性:H-F>H-O>H-N,与H2的反应能力:F2>O2>N2,可以用键能数据大小解释,故C正确;
D.键能:H-Cl>H-Br>H-I,键能越大氢化物越难分解,热分解温度:HCl>HBr>HI,可以用键能数据大小解释,故D正确;
故选A。
5.C
解析:A.Se为34号元素,原子结构示意图,A正确;
B.H2O分子中中心O原子价层电子对数为2+=4,O原子采用sp3杂化,O原子上含有2对孤电子对,VSEPR模型正确,B正确;
C.铁为26号元素,失去2个电子形成亚铁离子,基态的价层电子的轨道表示式,C错误;
D.键成镜面对称,D正确;
故选C。
6.C
解析:A.H2S是共价化合物,电子式为,A错误;
B.Cr的原子序数是24,电子排布式为[Ar]3d54s1,B错误;
C.甲醛分子的结构简式为HCHO,其空间填充模型为,C正确;
D.NH3的VSEPR模型为四面体,空间构型是三角锥形,D错误;
答案选C。
7.A
解析:A.乙烷含有σ键数目为7,和乙酸含有的σ键为7,相同物质的量,含有的σ键数目相同,A正确;
B.标准状况下,乙烷为气体,乙醇为液体,相同体积的乙烷和乙醇物质的量不同,含有的H原子数目不相同,B错误;
C.抑制水的电离,促进水的电离,室温下,pH相同的和溶液中,水的电离程度:,水电离的:,C错误;
D.与反应为可逆反应,不能计算转移的电子数目,1mol和完全反应,转移的电子数目为2mol,D错误;
故选A。
8.B
解析:A.16O2与18O3均是单质,不是核素,不能互称为同位素,二者互为同素异形体,A错误;
B.NaOH的电子式为,其中既含有极性共价键又含离子键,B正确;
C.由非金属元素组成的化合物不一定是共价化合物,例如氯化铵是离子化合物,C错误;
D.CO2和HCl两种分子中,除氢原子以外其他原子的最外层都满足8电子稳定结构,D错误;
答案选B。
9.A
解析:A.阳极为粗铜,比铜活泼的杂质也参与反应,无法判断转移电子数,A错误;
B.溶液中存在的水解,所以1L 0.1硫酸铁溶液中所含铁离子物质的量小于0.2mol,数目小于0.2,B正确;
C.HCN分子中存在碳氮三键,1mol HCN中所含π键的数目为2,2.7g HCN物质的量为0.1mol,所含π键的数目为0.2,C正确;
D.亚硫酸为弱酸,不能完全电离,故1L0.1mol/L的亚硫酸溶液中数目小于0.2,D正确;
故选A。
10.C
解析:A. NaCl属于盐类,NaOH是强碱,二者均含有离子键,A项错误;
B. 属于盐类,含有离子键,B项错误;
C. HBr、、、均是由非金属元素组成的化合物,都只含有共价键,C项正确;
D. 是活泼金属与活泼非金属元素形成的过氧化物,含有离子键,D项错误;
故选C。
11.C
解析:A.键长是指两个原子核间的平均间距,故A错误;
B.型分子可能是直线型如二氧化碳,键角为,也可能使V型,如OF2,键角约为104°,故B错误;
C.C—C键为键,C=C中有一个是键、一个π键,π键键能小于键能,故C=C键的键能小于,故C正确;
D.H—Cl键的键能为431.8,2molHCl分解成2mol和2mol时,消耗的能量为863.6kJ,故D错误;
故选:C。
12.C
解析:A.水是由水分子构成的,故A错误;
B.氢气是由氢气分子构成的,故B错误;
C.氯化钠是由钠离子和氯离子构成的,故C正确;
D.铁是金属单质,由铁原子直接构成,故D错误;
答案选C。
13.B
解析:A.H2SO4只有共价键,A错误;
B.NaOH既含有离子键,又含有共价键,B正确;
C.Na2O只有离子键,C错误;
D.H2O2只有共价键,D错误。
答案选B。
14.C
解析:A.基态B原子核外有5个电子,运动状态各不相同,共5种,A正确;
B.乙醇与水能形成分子间氢键,溶解度大,而乙醚不能与水形成氢键,故水溶性乙醇大于乙醚,B正确;
C.SCl2的价层电子对数为,VSEPR模型为正四面体,而分子构型为V形,价电子对分布的几何构型与分子的空间结构不一致,C错误;
D.红外光谱可以研究分子的结构和化学键,D正确;
故选C。
15.C
【分析】R、W、X、Y、Z为原子序数依次增大的五种主族元素,且分处三个短周期,则R一定位于第一周期,Z一定位于第三周期。五种元素包含地壳中含量前三的元素O、Si、Al,五种元素原子的最外层电子数之和为20,则剩余的最后一种元素最外层电子数为,为S,结合原子序数关系,可知R为H,W为O,X为Al,Y为Si,Z为S。
解析:A.电子层结构相同的离子,原子序数越大,半径越小,故离子半径,A错误;
B.非金属性,故最简单氢化物的稳定性,B错误;
C.和的空间构型均为V形,C正确;
D.硅单质为共价晶体(原子晶体),其熔点比铝单质的高,D错误;
故选C。
二、填空题
16.(1)31
(2)硒
(3)三角锥形
(4)
(5)1s22s22p63s2或[Ne]3s2
解析:(1)最外层电子排布为的原子中其内层电子层上完全排满电子,所以该原子中电子数= 2+8+18+3=31,原子中核外电子数=核电荷数,所以它的核电荷数为31,故答案为:31;
(2)原子的外围电子排布是,说明该原子中各个轨道都充满电子,该原子核外电子数是34,所以是硒元素,故答案为:硒;
(3)根据VSEPR模型得,的价层电子对=,有1个孤电子对,所以是三角锥形,故答案为:三角锥形;
(4)周期表中最活泼的非金属元素F,核外电子排布式为1s22s22p5,其原子的轨道表示式为,故答案为:;
(5)设最外层电子数为x,则x= (x+2+8)×,求得x= 2,其核外电子数=质子数= 12,该元素的为Mg,该元素原子的电子排布式是1s22s22p63s2或[Ne]3s2,故答案为:1s22s22p63s2或[Ne]3s2。
17.(1)[Ar]3d54s1
(2)
(3)ds
(4) V型 O3 NO
(5) 第四周期第VIII族
【分析】根据元素在周期表中的位置可知,1为H,2为Cr,3为Fe,4为Zn,5为Sb,6为S,7为Br。
解析:(1)2为Cr,为24号元素,根据构造原理和洪特规则的特例可知,其电子排布式为[Ar]3d54s1。
(2)元素5为Sb,位于第VA族,价电子排布图为 。
(3)元素4为Zn,位于ds区。
(4)元素6为S,低价氧化物分子为SO2,孤电子对数为,价层电子对数为3,故分子构型为V型;原子总数相同,价电子总数相同的离子或分子互为等电子体,故与SO2互为等电子体的分子为O3,离子为NO。
(5)元素3为Fe,在周期表中的位置为第四周期第VIII族,为26号元素,原子结构示意图为 。
18. 非极性 120° >
解析:(1)①由题意可知石墨烯就是石墨中的一层,石墨是碳元素的一种单质,分子中只存在键,属于非极性键,故答案为:非极性;
②根据石墨烯的结构可知石墨烯中的键角为120°(正六边形的内角),故答案为:120°;
(2)键的键长比键的键长长,键能小,故答案为:>。
19. 或 二 一个H3PO3分子中只有两个羟基,含氧酸羟基上的氢易电离
解析:亚磷酸与NaOH反应只生成NaHPO3和NaH2PO3两种盐,说明亚磷酸为二元弱酸,结构式为或;原因是:一个H3PO3分子中只有两个羟基,含氧酸羟基上的氢易电离。
20. V sp2 极性 三角锥形 sp3 极性 平面三角形 sp2 非极性
【分析】根据价层电子对互斥理论,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=(a-xb),确定微粒空间构型和中心原子杂化方式;根据正负电荷重心是否重合确定分子的极性。
解析:SO2中S原子含有2个σ键,孤电子对个数=×(6-2×2)=1,其价层电子对个数是3,采用sp2杂化,为V形结构,分子中正负电荷重心不重合,是极性分子;
NH3中N原子含有3个σ键,孤电子对个数=×(5-1×3)=1,其价层电子对个数是4,采用sp3杂化,为三角锥形结构,分子中正负电荷重心不重合,是极性分子;
SO3中S原子含有3个σ键,孤电子对个数=×(6-2×3)=0,采用sp2杂化,为平面三角形结构,分子中正负电荷重心重合,是非极性分子;
故答案为:V;sp2;极性;三角锥形;sp3;极性;平面三角形;sp2;非极性。
21. sp3和sp2 CH3- sp3和sp2 SO3 正四面体 sp和sp2 sp2 SO sp2 SO3 sp3和sp2 NH 正四面体
【分析】等电子体是原子总数相同,价电子总数也相同的粒子。等电子体可以从周期表中临近元素中寻找和替换。空间构型和杂化方式可以利用价层电子对互斥理论判断。
解析:(1) CH3COO[Cu(NH3)2]中甲基上的C原子有4个价层电子对,其轨道的杂化类型是sp3,-COO-上的C原子的价层电子对数是3,其轨道的杂化类型是sp2。与NH3分子互为等电子体的阴离子为CH3-。
(2) 乳酸分子()中甲基上的C原子有4个价层电子对,其轨道的杂化类型是sp3,羧基上的C原子的价层电子对数是3,其轨道的杂化类型是sp2。与互为等电子体的一种分子化学式为SO3。
(3) 的中心原子Cl的价层电子对是4+(7+1-2×4)=4,空间构型为正四面体; (双聚氰胺)中以双键和氮原子连接的碳原子的价层电子对数为3,碳原子杂化轨道类型为sp2,-CN上的碳原子的价层电子对数为2,碳原子的轨道杂化类型为sp。
(4)草酸(HOOCCOOH)分子中碳原子的价层电子对数均为3,所以轨道的杂化类型是sp2;与SiF4互为等电子体的阴离子是SO。
(5) 中N原子的价层电子对数=3+(5+1-3×2)=3,所以N原子的轨道杂化类型是sp2。与互为等电子体的一种分子为SO3。
(6)苯甲醇()中和羟基相连的碳原子有4个价层电子对,其轨道的杂化类型是sp3,苯环上的C原子的价层电子对数是3,其轨道的杂化类型是sp2。与 互为等电子体的阳离子为NH,离子的中心原子B的价层电子对数=4+(3+1-4×1)=4,所以其空间构型为正四面体。
22.(1)能量相近
(2)杂化
(3)激发→杂化→轨道重叠
解析:(1)在外界条件影响下,原子内部能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程;
(2)原子轨道杂化后形成的一组新的原子轨道,叫做杂化原子轨道,简称杂化轨道;
(3)轨道杂化的过程:激发→杂化→轨道重叠。
三、元素或物质推断题
23. 第三周期第ⅥA族 S2 >O2 >Na+ 离子键和共价键 二硫化碳(或热碱液、热氢氧化钠溶液) 2CN +O2+4H2O=2HCO3 +2NH3
【分析】A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,A与E同主族,D与F同主族,且A与D能形成两种液态化合物,则A为H,D为O;两种液态化合物,为H2O、H2O2,B的某种单质是自然界中硬度最大的物质,B为C,D与F同主族,F为S,A与E同主族,E介于D、F之间,E为Na,C与D形成的化合物是大气常见污染物之一,C介于B、D之间,C为N。
解析:(1)F为S,在元素周期表中的位置是第三周期第ⅥA族,D为O,E为Na,F为S,简单离子分别为O2-,Na+,S2-,电子层数多的半径大,核外电子排布相同的离子,核电荷数越大,离子半径越小,所以其半径由大到小的顺序S2 >O2 >Na+,故答案为:第三周期第ⅥA族;S2 >O2 >Na+;
(2)E为Na,F为S,形成多原子化合物Na2Sx(x 2),含有离子键、共价键,属于离子化合物,故答案为:离子键和共价键;
(3)F为S,CS2为良好的有机溶剂,可溶解S,硫在加热条件下能与热NaOH溶液反应生成硫化钠、亚硫酸钠和水,所以用热NaOH溶液洗去附着在试管内壁的硫,故答案为:二硫化碳(或热碱液、热氢氧化钠溶液);
(4)B为C,C为N,BC 为CN ,D为O,BC 被D的单质氧化成HCO3 ,同时生成C的简单氢化物NH3,该反应的离子方程式为:2CN +O2+4H2O=2HCO3 +2NH3,故答案为:2CN +O2+4H2O=2HCO3 +2NH3。
一、选择题
1.下列对一些实验事实的理论解释正确的是
选项 实验事实 理论解释
A 、空间构型均为角形 和是等电子体
B 白磷为正四面体分子 白磷分子中P—Р键间的夹角是109.5°
C 硼酸固体难溶于水,加热溶解度增大 加热后,硼酸分子之间的氢键部分断裂,与水分子产生氢键作用
D HF的沸点高于HCl H—F的键能比H—Cl的键能大
A.A B.B C.C D.D
2.从烟道气(含粉渣、CO2、SO2等)中分离回收硫的基本反应之一是SO2(g) + 2CO(g)2CO2(g) + S(s) ΔH<0。SO2在大气中能生成SO3、H2SO3、H2SO4。下列有关SO2、SO3、SO和SO的说法正确的是
A.SO中S原子的杂化方式为sp3 B.SO的空间构型为平面正方形
C.SO2晶体熔点高、硬度大 D.SO3分子是极性分子
3.火药制备是我国古代闻名世界的化学工艺,原理为 2KNO3+S+3C=K2S+N2↑+ 3CO2 ↑。下列说法正确的是
A.K2S 的电子式:K
B.CO2和N2都是非极性分子
C.K+的结构示意图:
D.基态O原子核外电子轨道表达式:
4.由键能数据大小,不能解释下列事实的是
化学键 N≡N O=O F-F H-F H-Cl H-Br H-I
键能/kJ mol-1 946 497.3 157 568 431.8 366 298.7
A.熔沸点:HF>HCl>HBr B.稳定性:HCl>HBr>HI
C.与H2的反应能力:F2>O2>N2 D.热分解温度:HCl>HBr>HI
5.下列图示不正确的是
A.Se的原子结构示意图 B.的VSEPR模型 C.基态的价层电子的轨道表示式 D.键的电子云轮廓图
A.A B.B C.C D.D
6.下列化学用语正确的是
A.H2S的电子式为 B.Cr的电子排布式为[Ar]3d44s2
C.甲醛分子的空间填充模型为 D.NH3的VSEPR模型为
7.下列说法正确的是
A.相同物质的量的乙烷和乙酸含有的σ键数目相同
B.标准状况下,相同体积的乙烷和乙醇含有的H原子数目相同
C.室温下,pH相同的HCl和溶液中,由水电离的相同
D.相同物质的量的分别与和反应,转移的电子数目相同
8.下列说法正确的是
A.16O2与18O3互称为同位素
B.NaOH中既含有极性共价键又含离子键
C.由非金属元素组成的化合物一定是共价化合物
D.CO2和HCl两种分子中,每个原子的最外层都满足8电子稳定结构
9.设为阿伏加德罗常数的值。下列说法不正确的是
A.精炼铜时,当阳极质量减少6.4g,转移电子数一定为0.2
B.1L 0.1硫酸铁溶液中所含的数目小于0.2
C.2.7g HCN分子中所含π键的数目为0.2
D.常温下,1L 0.1的亚硫酸溶液中数目小于0.2
10.下列物质中只含有共价键的是
A.NaCl、HCl、、NaOH B.、、HCl、
C.HBr、、、 D.、、、
11.键长、键角和键能是描述共价键的三个重要参数,下列叙述正确的是
A.在分子中,两个成键原子间的距离叫做键长
B.型分子的键角均为180°
C.C—C键的键能为347.7,但C=C键的键能小于
D.H—Cl键的键能为431.8,故HCl分解成1mol和1mol时,消耗的能量为863.6kJ
12.下列物质由离子构成的是( ).
A.水 B.氢气 C.氯化钠 D.铁
13.下列物质中,即含有离子键,又含有共价键的是
A.H2SO4 B.NaOH C.Na2O D.H2O2
14.下列说法错误的是
A.基态B原子核外电子的运动状态有5种
B.水溶性:
C.的价电子对分布的几何构型与分子的空间结构一致
D.可以通过红外光谱仪来测定分子结构
15.某种净水剂由原子序数依次增大的R、W、X、Y、Z五种主族元素组成。五种元素分处三个短周期,且包含地壳中含量前三的三种元素。五种元素原子的最外层电子数之和为20。下列说法正确的是
A.简单离子半径:
B.最简单氢化物的稳定性:
C.R分别与W、Z形成的三原子分子均为V形分子
D.常见单质的熔点:
二、填空题
16.根据已学知识,请回答下列问题:
(1)最外层电子排布为的基态原子的核电荷数为_______。
(2)某元素被科学家称之为人体微量元素中的“防癌之王”,其基态原子的外围电子排布式为,该元素的名称是_______。
(3)的空间构型为:_______。
(4)周期表中电负性最大的元素基态原子的轨道表示式为_______。
(5)某元素基态原子核外有三个电子层,最外层电子数是核外电子总数的,写出该元素原子的电子排布是_______。
17.已知某些元素在周期表中的位置如下图所示,请按要求填空。
(1)元素2的电子排布式为_______。
(2)元素5的价电子排布图为_______。
(3)元素4位于_______区。
(4)元素6的低价氧化物分子构型为_______。与该氧化物互为等电子体的分子为_______,离子为_______(只写一种)。
(5)元素3在周期表中的位置为_______。其原子结构示意图为_______。
18.(1)石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图所示),可由石墨剥离而成,具有很好的应用前景。
①石墨烯中的化学键是______(填“极性”或“非极性”)键。
②石墨烯中的键角为______。
(2)已知几种常见化学键的键能如表所示:
化学键
键能/() 368 467 226 x
比较键与键的键能大小:x______(填“>”“<”或“=")226。
19.磷酸和亚磷酸(H3PO3)是磷元素的两种含氧酸。亚磷酸与NaOH反应只生成NaHPO3和NaH2PO3两种盐,则H3PO3的结构式为___________,其为___________元酸,原因是___________。
20.请填写下表:
空间构型 杂化方式 分子类型(极性或非极性)
二氧化硫 __ ___ ___
氨气 ___ ___ ____
三氧化硫 ____ ___ ___
21.(1) CH3COO[Cu(NH3)2]中C原子轨道的杂化类型是____。与NH3分子互为等电子体的阴离子为____。
(2) 乳酸分子()中C原子的杂化类型为____。与互为等电子体的一种分子化学式为_____。
(3) 的空间构型为________(用文字描述);NaNT可由(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________。
(4)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是____;与SiF4互为等电子体的阴离子的化学式为_______。
(5) 中N原子轨道的杂化类型是___。与互为等电子体的一种分子为__(填化学式)。
(6)苯甲醇()中碳原子的杂化轨道类型为______。与 互为等电子体的阳离子为______(填化学式),离子的空间构型为(用文字描述)________。
22.杂化轨道理论是一种价键理论,是鲍林为了解释分子的空间结构提出的。
(1)轨道的杂化
在外界条件影响下,原子内部___________的原子轨道发生混杂,重新组合成一组新的轨道的过程。
(2)杂化轨道
原子轨道___________后形成的一组新的原子轨道,叫做杂化原子轨道,简称杂化轨道。
(3)轨道杂化的过程:___________。
三、元素或物质推断题
23.A、B、C、D、E、F 六种短周期主族元素,它们的原子序数依次增大。A 与 E 同主族,D 与 F 同主族,且 A 与 D 能形成两种液态化合物;B 的某种单质是自然界中硬度最大的物质,C 与D 形成的化合物是大气常见污染物之一。请回答下列问题:
(1)F 在元素周期表中的位置是_____,D、E、F 三种元素简单离子半径由大到小的顺序是________(用离子符号表示)。
(2)元素 E、F 可形成多原子化合物E2Fx(x ≥ 2)。该化合物中所含的化学键类型是_____。
(3)实验室可利用_____(填试剂名称)清洗附着于试管内壁的 F 单质。
(4)处理含 BC 废水的方法之一是在微生物的作用下,BC 被 D 的单质氧化成 ABD ,同时生成C 的简单氢化物,该反应的离子方程式为_____。
【参考答案】
一、选择题
1.C
解析:A.的价层电子数为4,含有2对孤电子对,空间构型为V形,价层电子数为3,孤电子对数为1,空间构型为V形,空间构型和等电子体无关,A项错误;
B.白磷分子为,4个P原子位于正四面体的4个顶点,每个面都是正三角形,P-P键,键角60°,B项错误;
C.硼酸分子由于分子间氢键的存在,形成了块状,使得硼酸固体难溶于水,加热时破坏了硼酸分子间的氢键,使得硼酸更易与水产生分子间氢键,故溶解度增大,C项正确;
D.HF和HCl的熔沸点与分子内的共价键无关,只与分子间作用力有关,HF分子间可以形成氢键,所以HF比HCl沸点高,D项错误;
答案选C。
2.A
解析:A.SO中S原子的价层电子对数=3+1=4,S杂化方式为sp3,A正确;
B.SO中S原子的价层电子对数=4+0=4,S杂化方式为sp3,没有孤电子对,空间构型为正四面体形,B错误;
C.SO2晶体是分子晶体,熔点低、硬度小,C错误;
D.SO3分子中S原子的价层电子对数=3+0=3,S杂化方式为sp2,没有孤电子对,空间构型为正三角形,正负电荷中心重合,是非极性分子,D错误;
答案选A。
3.B
解析:A.K2S结构中K+与S2-形成离子键,其电子式为:,A错误;
B.由非极性键形成的分子称为非极性分子,N2由非极性键构成的非极性分子,由极性键形成的分子,如果电荷分布是对称均匀的,也是非极性分子,二氧化碳结构为:O=C=O,直链对称的,所以为非极性分子,B正确;
C.K元素的核电荷数为19,质子数为19,核外电子数为19,K+表示失去最外层一个电子,K+核外还有18个电子,各层电子数分别为2、8、8,K+的结构示意图为,C错误;
D.O为8号元素,根据泡利原理和洪特规,则原子核外电子轨道表达式:,D错误;
故选B。
4.A
解析:A.键能影响化学性质,熔沸点是物理性质,不能用键能数据大小来解释,故A错误;
B.Cl、Br、I原子与H原子间形成的共价键的键能越来越弱,氢化物的稳定性减弱,稳定性:HCl>HBr>HI,可以用键能数据大小解释,故B正确;
C.键能:H-F>H-O>H-N,稳定性:H-F>H-O>H-N,与H2的反应能力:F2>O2>N2,可以用键能数据大小解释,故C正确;
D.键能:H-Cl>H-Br>H-I,键能越大氢化物越难分解,热分解温度:HCl>HBr>HI,可以用键能数据大小解释,故D正确;
故选A。
5.C
解析:A.Se为34号元素,原子结构示意图,A正确;
B.H2O分子中中心O原子价层电子对数为2+=4,O原子采用sp3杂化,O原子上含有2对孤电子对,VSEPR模型正确,B正确;
C.铁为26号元素,失去2个电子形成亚铁离子,基态的价层电子的轨道表示式,C错误;
D.键成镜面对称,D正确;
故选C。
6.C
解析:A.H2S是共价化合物,电子式为,A错误;
B.Cr的原子序数是24,电子排布式为[Ar]3d54s1,B错误;
C.甲醛分子的结构简式为HCHO,其空间填充模型为,C正确;
D.NH3的VSEPR模型为四面体,空间构型是三角锥形,D错误;
答案选C。
7.A
解析:A.乙烷含有σ键数目为7,和乙酸含有的σ键为7,相同物质的量,含有的σ键数目相同,A正确;
B.标准状况下,乙烷为气体,乙醇为液体,相同体积的乙烷和乙醇物质的量不同,含有的H原子数目不相同,B错误;
C.抑制水的电离,促进水的电离,室温下,pH相同的和溶液中,水的电离程度:,水电离的:,C错误;
D.与反应为可逆反应,不能计算转移的电子数目,1mol和完全反应,转移的电子数目为2mol,D错误;
故选A。
8.B
解析:A.16O2与18O3均是单质,不是核素,不能互称为同位素,二者互为同素异形体,A错误;
B.NaOH的电子式为,其中既含有极性共价键又含离子键,B正确;
C.由非金属元素组成的化合物不一定是共价化合物,例如氯化铵是离子化合物,C错误;
D.CO2和HCl两种分子中,除氢原子以外其他原子的最外层都满足8电子稳定结构,D错误;
答案选B。
9.A
解析:A.阳极为粗铜,比铜活泼的杂质也参与反应,无法判断转移电子数,A错误;
B.溶液中存在的水解,所以1L 0.1硫酸铁溶液中所含铁离子物质的量小于0.2mol,数目小于0.2,B正确;
C.HCN分子中存在碳氮三键,1mol HCN中所含π键的数目为2,2.7g HCN物质的量为0.1mol,所含π键的数目为0.2,C正确;
D.亚硫酸为弱酸,不能完全电离,故1L0.1mol/L的亚硫酸溶液中数目小于0.2,D正确;
故选A。
10.C
解析:A. NaCl属于盐类,NaOH是强碱,二者均含有离子键,A项错误;
B. 属于盐类,含有离子键,B项错误;
C. HBr、、、均是由非金属元素组成的化合物,都只含有共价键,C项正确;
D. 是活泼金属与活泼非金属元素形成的过氧化物,含有离子键,D项错误;
故选C。
11.C
解析:A.键长是指两个原子核间的平均间距,故A错误;
B.型分子可能是直线型如二氧化碳,键角为,也可能使V型,如OF2,键角约为104°,故B错误;
C.C—C键为键,C=C中有一个是键、一个π键,π键键能小于键能,故C=C键的键能小于,故C正确;
D.H—Cl键的键能为431.8,2molHCl分解成2mol和2mol时,消耗的能量为863.6kJ,故D错误;
故选:C。
12.C
解析:A.水是由水分子构成的,故A错误;
B.氢气是由氢气分子构成的,故B错误;
C.氯化钠是由钠离子和氯离子构成的,故C正确;
D.铁是金属单质,由铁原子直接构成,故D错误;
答案选C。
13.B
解析:A.H2SO4只有共价键,A错误;
B.NaOH既含有离子键,又含有共价键,B正确;
C.Na2O只有离子键,C错误;
D.H2O2只有共价键,D错误。
答案选B。
14.C
解析:A.基态B原子核外有5个电子,运动状态各不相同,共5种,A正确;
B.乙醇与水能形成分子间氢键,溶解度大,而乙醚不能与水形成氢键,故水溶性乙醇大于乙醚,B正确;
C.SCl2的价层电子对数为,VSEPR模型为正四面体,而分子构型为V形,价电子对分布的几何构型与分子的空间结构不一致,C错误;
D.红外光谱可以研究分子的结构和化学键,D正确;
故选C。
15.C
【分析】R、W、X、Y、Z为原子序数依次增大的五种主族元素,且分处三个短周期,则R一定位于第一周期,Z一定位于第三周期。五种元素包含地壳中含量前三的元素O、Si、Al,五种元素原子的最外层电子数之和为20,则剩余的最后一种元素最外层电子数为,为S,结合原子序数关系,可知R为H,W为O,X为Al,Y为Si,Z为S。
解析:A.电子层结构相同的离子,原子序数越大,半径越小,故离子半径,A错误;
B.非金属性,故最简单氢化物的稳定性,B错误;
C.和的空间构型均为V形,C正确;
D.硅单质为共价晶体(原子晶体),其熔点比铝单质的高,D错误;
故选C。
二、填空题
16.(1)31
(2)硒
(3)三角锥形
(4)
(5)1s22s22p63s2或[Ne]3s2
解析:(1)最外层电子排布为的原子中其内层电子层上完全排满电子,所以该原子中电子数= 2+8+18+3=31,原子中核外电子数=核电荷数,所以它的核电荷数为31,故答案为:31;
(2)原子的外围电子排布是,说明该原子中各个轨道都充满电子,该原子核外电子数是34,所以是硒元素,故答案为:硒;
(3)根据VSEPR模型得,的价层电子对=,有1个孤电子对,所以是三角锥形,故答案为:三角锥形;
(4)周期表中最活泼的非金属元素F,核外电子排布式为1s22s22p5,其原子的轨道表示式为,故答案为:;
(5)设最外层电子数为x,则x= (x+2+8)×,求得x= 2,其核外电子数=质子数= 12,该元素的为Mg,该元素原子的电子排布式是1s22s22p63s2或[Ne]3s2,故答案为:1s22s22p63s2或[Ne]3s2。
17.(1)[Ar]3d54s1
(2)
(3)ds
(4) V型 O3 NO
(5) 第四周期第VIII族
【分析】根据元素在周期表中的位置可知,1为H,2为Cr,3为Fe,4为Zn,5为Sb,6为S,7为Br。
解析:(1)2为Cr,为24号元素,根据构造原理和洪特规则的特例可知,其电子排布式为[Ar]3d54s1。
(2)元素5为Sb,位于第VA族,价电子排布图为 。
(3)元素4为Zn,位于ds区。
(4)元素6为S,低价氧化物分子为SO2,孤电子对数为,价层电子对数为3,故分子构型为V型;原子总数相同,价电子总数相同的离子或分子互为等电子体,故与SO2互为等电子体的分子为O3,离子为NO。
(5)元素3为Fe,在周期表中的位置为第四周期第VIII族,为26号元素,原子结构示意图为 。
18. 非极性 120° >
解析:(1)①由题意可知石墨烯就是石墨中的一层,石墨是碳元素的一种单质,分子中只存在键,属于非极性键,故答案为:非极性;
②根据石墨烯的结构可知石墨烯中的键角为120°(正六边形的内角),故答案为:120°;
(2)键的键长比键的键长长,键能小,故答案为:>。
19. 或 二 一个H3PO3分子中只有两个羟基,含氧酸羟基上的氢易电离
解析:亚磷酸与NaOH反应只生成NaHPO3和NaH2PO3两种盐,说明亚磷酸为二元弱酸,结构式为或;原因是:一个H3PO3分子中只有两个羟基,含氧酸羟基上的氢易电离。
20. V sp2 极性 三角锥形 sp3 极性 平面三角形 sp2 非极性
【分析】根据价层电子对互斥理论,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=(a-xb),确定微粒空间构型和中心原子杂化方式;根据正负电荷重心是否重合确定分子的极性。
解析:SO2中S原子含有2个σ键,孤电子对个数=×(6-2×2)=1,其价层电子对个数是3,采用sp2杂化,为V形结构,分子中正负电荷重心不重合,是极性分子;
NH3中N原子含有3个σ键,孤电子对个数=×(5-1×3)=1,其价层电子对个数是4,采用sp3杂化,为三角锥形结构,分子中正负电荷重心不重合,是极性分子;
SO3中S原子含有3个σ键,孤电子对个数=×(6-2×3)=0,采用sp2杂化,为平面三角形结构,分子中正负电荷重心重合,是非极性分子;
故答案为:V;sp2;极性;三角锥形;sp3;极性;平面三角形;sp2;非极性。
21. sp3和sp2 CH3- sp3和sp2 SO3 正四面体 sp和sp2 sp2 SO sp2 SO3 sp3和sp2 NH 正四面体
【分析】等电子体是原子总数相同,价电子总数也相同的粒子。等电子体可以从周期表中临近元素中寻找和替换。空间构型和杂化方式可以利用价层电子对互斥理论判断。
解析:(1) CH3COO[Cu(NH3)2]中甲基上的C原子有4个价层电子对,其轨道的杂化类型是sp3,-COO-上的C原子的价层电子对数是3,其轨道的杂化类型是sp2。与NH3分子互为等电子体的阴离子为CH3-。
(2) 乳酸分子()中甲基上的C原子有4个价层电子对,其轨道的杂化类型是sp3,羧基上的C原子的价层电子对数是3,其轨道的杂化类型是sp2。与互为等电子体的一种分子化学式为SO3。
(3) 的中心原子Cl的价层电子对是4+(7+1-2×4)=4,空间构型为正四面体; (双聚氰胺)中以双键和氮原子连接的碳原子的价层电子对数为3,碳原子杂化轨道类型为sp2,-CN上的碳原子的价层电子对数为2,碳原子的轨道杂化类型为sp。
(4)草酸(HOOCCOOH)分子中碳原子的价层电子对数均为3,所以轨道的杂化类型是sp2;与SiF4互为等电子体的阴离子是SO。
(5) 中N原子的价层电子对数=3+(5+1-3×2)=3,所以N原子的轨道杂化类型是sp2。与互为等电子体的一种分子为SO3。
(6)苯甲醇()中和羟基相连的碳原子有4个价层电子对,其轨道的杂化类型是sp3,苯环上的C原子的价层电子对数是3,其轨道的杂化类型是sp2。与 互为等电子体的阳离子为NH,离子的中心原子B的价层电子对数=4+(3+1-4×1)=4,所以其空间构型为正四面体。
22.(1)能量相近
(2)杂化
(3)激发→杂化→轨道重叠
解析:(1)在外界条件影响下,原子内部能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程;
(2)原子轨道杂化后形成的一组新的原子轨道,叫做杂化原子轨道,简称杂化轨道;
(3)轨道杂化的过程:激发→杂化→轨道重叠。
三、元素或物质推断题
23. 第三周期第ⅥA族 S2 >O2 >Na+ 离子键和共价键 二硫化碳(或热碱液、热氢氧化钠溶液) 2CN +O2+4H2O=2HCO3 +2NH3
【分析】A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,A与E同主族,D与F同主族,且A与D能形成两种液态化合物,则A为H,D为O;两种液态化合物,为H2O、H2O2,B的某种单质是自然界中硬度最大的物质,B为C,D与F同主族,F为S,A与E同主族,E介于D、F之间,E为Na,C与D形成的化合物是大气常见污染物之一,C介于B、D之间,C为N。
解析:(1)F为S,在元素周期表中的位置是第三周期第ⅥA族,D为O,E为Na,F为S,简单离子分别为O2-,Na+,S2-,电子层数多的半径大,核外电子排布相同的离子,核电荷数越大,离子半径越小,所以其半径由大到小的顺序S2 >O2 >Na+,故答案为:第三周期第ⅥA族;S2 >O2 >Na+;
(2)E为Na,F为S,形成多原子化合物Na2Sx(x 2),含有离子键、共价键,属于离子化合物,故答案为:离子键和共价键;
(3)F为S,CS2为良好的有机溶剂,可溶解S,硫在加热条件下能与热NaOH溶液反应生成硫化钠、亚硫酸钠和水,所以用热NaOH溶液洗去附着在试管内壁的硫,故答案为:二硫化碳(或热碱液、热氢氧化钠溶液);
(4)B为C,C为N,BC 为CN ,D为O,BC 被D的单质氧化成HCO3 ,同时生成C的简单氢化物NH3,该反应的离子方程式为:2CN +O2+4H2O=2HCO3 +2NH3,故答案为:2CN +O2+4H2O=2HCO3 +2NH3。
