黑龙江省部分中学2022-2023学年高一下学期期中联考化学(学考)试题(含答案)
文档属性
| 名称 | 黑龙江省部分中学2022-2023学年高一下学期期中联考化学(学考)试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 498.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-26 15:09:13 | ||
图片预览


文档简介
黑龙江省部分中学2022-2023学年高一下学期期中联考
化学学科试题(学考)
考试时间:60分钟 总分:100分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 -23 -35.5
一、单选题(共30小题,每题2分,共60分。在每小题给出的四个选项中只有一项符合题目要求)
1.下列过程中,化学反应速率的增大对人类有益的是( )
A.金属的腐蚀 B.食物的腐败 C.塑料的老化 D.氨的合成
2.下列物质之间的转化,必须要加入氧化剂才能实现的是( )
A.SO2→H2SO3 B.Cu→CuSO4 C.NO2→HNO3 D.N2→NH3
3.下列化学用语或模型表示正确的是( )
A.甲烷分子的空间填充模型:
B.氯化氢分子的电子式:
C.钾的原子结构示意图:
D.NaOH的电离方程式:
4.“北溪”天然气管道是俄罗斯向欧洲输气的主要管道。2022年9月26日,“北溪”天然气管道发现两个泄漏点,分别位于丹麦和瑞典附近水域。下列说法错误的是( )
A.天然气的主要成分是CH4
B.甲烷分子具有平面正方形结构
C.甲烷燃烧反应中,生成物的总能量低于反应物的总能量
D.甲烷和氯气光照发生取代反应
5.浓硫酸与下列物质作用时,只表现强氧化性的是( )
A.蓝色硫酸铜品体 B.木材炭化
C.红热的木炭 D.铜
6.下列气体中,不能用浓硫酸干燥的是( )
A.H2 B.NH3 C.HCl D.O2
7.人类生活中处处需要能量。下列图片中利用的能量主要是由化学变化产生的是( )
A.太阳能路灯照明 B.风车发电
C.帆船航行 D.燃油汽车行驶
8.化学反应速率的研究对工农业生产和日常生活有着重要的意义,下列操作不能加快化学反应速率的是( )
A.低温冷藏食物
B.燃煤发电时用煤粉代替煤块
C.用H2O2制备O2时,使用MnO2作催化剂
D.用70%的硫酸溶液代替98%的浓硫酸与Na2SO3粉末反应制备SO2
9.党的二十大报告提出,坚决打赢关键核心技术攻坚战。制造5G芯片的氮化铝属于( )
A.传统无机非金属材料 B.金属材料
C.新型塑料 D.新型无机非金属材料
10.不能用作制冷剂的是( )
A.N2 B.NH3 C.SO2 D.H2SO4
11.关于下图所示的原电池,下列说法正确的是( )
A.石墨电极上发生氧化反应 B.电子由锌片通过导线流向石墨棒
C.该装置将电能转化为化学能 D.将稀硫酸换成乙醇,灯泡亮度不变
12.下列物质中,S元素的化合价最高的是( )
A.SO3 B.H2S C.SO2 D.NaHSO3
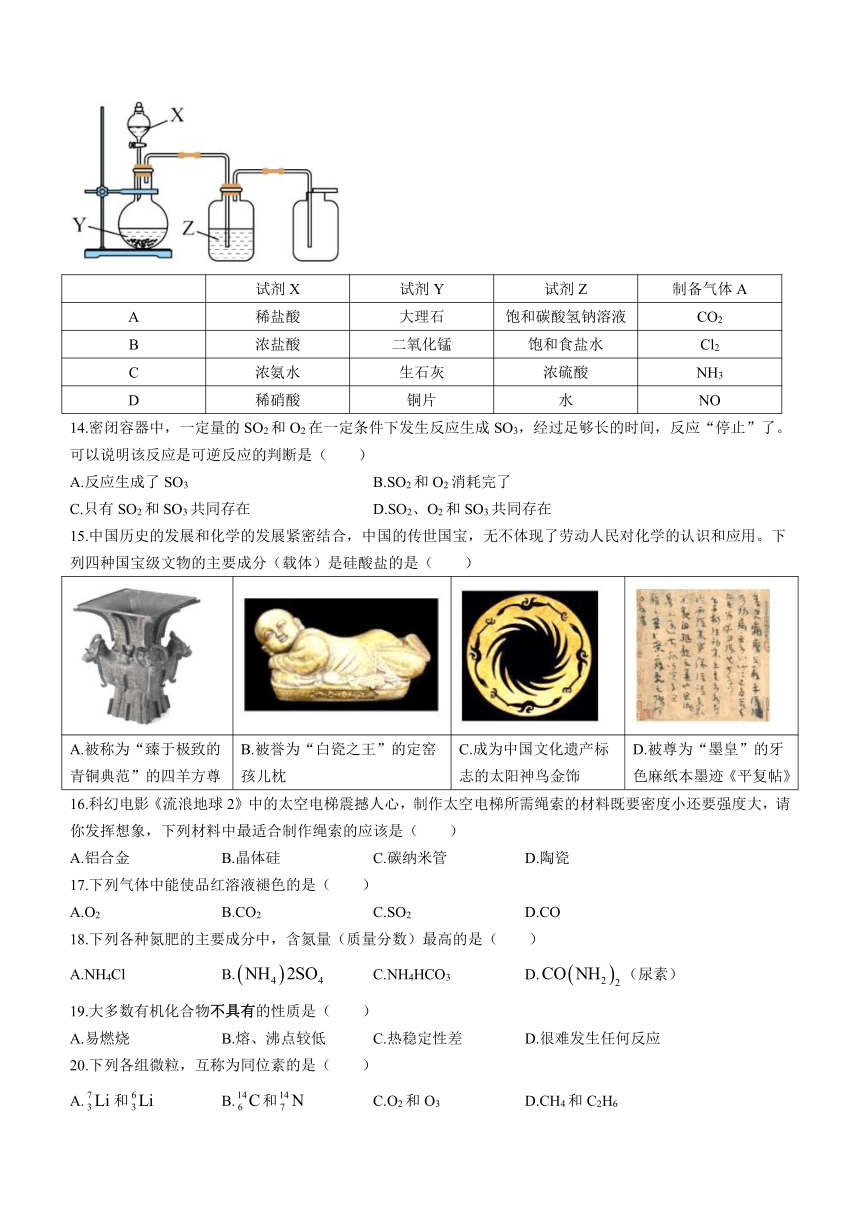
13.实验室采用如图装置制备气体,合理的是( )
试剂X 试剂Y 试剂Z 制备气体A
A 稀盐酸 大理石 饱和碳酸氢钠溶液 CO2
B 浓盐酸 二氧化锰 饱和食盐水 Cl2
C 浓氨水 生石灰 浓硫酸 NH3
D 稀硝酸 铜片 水 NO
14.密闭容器中,一定量的SO2和O2在一定条件下发生反应生成SO3,经过足够长的时间,反应“停止”了。可以说明该反应是可逆反应的判断是( )
A.反应生成了SO3 B.SO2和O2消耗完了
C.只有SO2和SO3共同存在 D.SO2、O2和SO3共同存在
15.中国历史的发展和化学的发展紧密结合,中国的传世国宝,无不体现了劳动人民对化学的认识和应用。下列四种国宝级文物的主要成分(载体)是硅酸盐的是( )
A.被称为“臻于极致的青铜典范”的四羊方尊 B.被誉为“白瓷之王”的定窑孩儿枕 C.成为中国文化遗产标志的太阳神鸟金饰 D.被尊为“墨皇”的牙色麻纸本墨迹《平复帖》
16.科幻电影《流浪地球2》中的太空电梯震撼人心,制作太空电梯所需绳索的材料既要密度小还要强度大,请你发挥想象,下列材料中最适合制作绳索的应该是( )
A.铝合金 B.晶体硅 C.碳纳米管 D.陶瓷
17.下列气体中能使品红溶液褪色的是( )
A.O2 B.CO2 C.SO2 D.CO
18.下列各种氮肥的主要成分中,含氮量(质量分数)最高的是( )
A.NH4Cl B. C.NH4HCO3 D.(尿素)
19.大多数有机化合物不具有的性质是( )
A.易燃烧 B.熔、沸点较低 C.热稳定性差 D.很难发生任何反应
20.下列各组微粒,互称为同位素的是( )
A.和 B.和 C.O2和O3 D.CH4和C2H6
21.下列物质中不含甲烷的是( )
A.海底可燃冰 B.天然气 C.瓦斯气 D.水煤气
22.下列反应中生成物的总能量高于反应物的总能量的是( )
A.碳酸钙受热分解 B.乙醇燃烧 C.钠与水反应 D.氧化钙溶于水
23.在一定条件下,下列物质可与甲烷发生反应的是( )
A.Cl2 B.浓硫酸 C.氢氧化钠溶液 D.酸性高锰酸钾溶液
24.鉴别甲烷和氢气两种无色气体的正确方法是( )
A.点燃后观察实验现象
B.点燃后罩上干燥的冷烧杯
C.点燃后罩上内壁涂有澄清石灰水的冷烧杯
D.通入澄清石灰水
25.有机反应属于( )
A.取代反应 B.加成反应 C.加聚反应 D.酯化反应
26.下列物质属于高分子化合物的是( )
A.苯 B.聚丙烯 C.乙烯 D.1,2-二溴乙烷
27.在2L的密闭容器中,自开始至2秒,氨的物质的量由0变为0.4mol,则以氨气表示的化学反应速率是( )
A. B. C. D.
28.下列装置或过程能实现化学能转化为电能的是( )
A.银锌纽扣电池 B.冶炼金属钠 C.太阳能电池 D.天然气燃烧
29.下列反应体系中,不属于可逆反应的是( )
A.Cl2溶于水
B.氨气溶于水
C.工业合成氨
D.和
30.下列反应属于氮的固定的是( )
A.工业上用氮气与氢气合成氨 B.NH3和HCl反应制取NH4Cl
C.氯化铵与烧碱的复分解反应 D.空气中的氮氧化物转化成酸雨
第Ⅱ卷(非选题,共40分)
二、填空题(共28分)
31.(10分)硫酸的物理性质及酸的通性
(1)物理性质
纯净的硫酸是无色黏稠状液体,密度比水__________,能与水以任意比混合,沸点__________,难挥发。
(2)酸的通性
H2SO4在水里电离出大量__________,所以具有__________,能使紫色石蕊试液显红色,请写出下列反应的离子方程式。
①和活泼金属(如Fe):__________。
②和金属氧化物(如MgO):__________。
③和盐(如NaHCO3):__________。
32.(10分)已知A、B、C、D、E是中学化学中的常见气体,它们都是由1-18号元素组成的单质或化合物,并有如下的信息:
①A气体能使湿润的红色石蕊试纸变蓝;
②B气体通入品红溶液,红色褪去,继续加热,溶液又变红色;
③C气体密度相对空气来说很小,通过灼热的氧化铜可以使其变红;
④D为红棕色、有刺激性气味的气体,能和水反应生成无色气体;
⑤E为黄绿色的、有刺激性气味的气体。
试确定它们的化学式:A__________,B__________,C__________,D__________,E__________。
33.(8分)利用生活中或实验中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:。
(2)实验装置(如图)。
(3)原电池设计及注意的问题:
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓——”的声音。其原因是:在原电池中,由化学能转化为__________,在耳机中又转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的__________极,电极反应是发生了__________反应。
三、计算题(共4分)
34.(4分)将16gNaOH固体溶于100mL水中,再用蒸馏水稀释,配成1L溶液。请计算:
(1)所配IL溶液的物质的量浓度。
(2)从上述溶液中取出10mL,逐滴加入0.1mol/L的盐酸,当恰好完全中和时,求加入盐酸的体积。
四、实验题(共8分)
35.(8分)我校化学兴趣小组的小王同学用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
实验编号 锌的状态 反应温度/℃ 收集100mL氢气所需时间/s
① 薄片 15 180
② 薄片 25 70
③ 粉末 25 15
(1)该实验的目的是探究__________对锌和稀盐酸反应速率的影响;
(2)实验①和②表明__________,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是__________和__________;
(4)你猜想下列因素中能影响酸与金属反应的反应速率的有__________。
①酸的种类 ②酸溶液的体积(确保金属与酸充分接触) ③金属的颜色 ④金属的种类
黑龙江省部分中学2022-2023学年高一下学期期中联考
化学学科试题(学考)答案及评分标准
一、单选题
1 2 3 4 5 6 7 8 9 10
D B A B C B D A D D
11 12 13 14 15 16 17 18 19 20
B A A D B C C D D A
21 22 23 24 25 26 27 28 29 30
D A A C B B B A D A
二、填空题
31.(10分)
(1)大(1分) 高(1分)
(2)(1分,写汉字“氢离子”亦给分,“硫酸根”写出与否不影响给分) 酸性(1分)
①(2分,气体符号不写得1分,其余错误0分)
②(2分,有错误0分)
③(2分,有错误0分)
32.(10分)
A.NH3 B.SO2 C.H2 D.NO2 E.Cl2(每个2分,写汉字名称0分)
33.(8分)
(3)①电能(2分) ②负(2分) (2分)氧化(2分,若写“氧化反应”也给分)34.(4分)
(1)(2分,其中若按上式计算公式正确但结果错误得1分;若分步计算且两个公式都正确但结果不对则得1分;若第一步求物质的量公式正确且结果正确但浓度公式错误(无论浓度数值是否正确)则得1分,其余情况均不得分)
(2)(2分,结果写成两种单位均可,最终表达式推导过程可以省略。其中若能得到最终表达式但结果错误(无论是前问结果错误导致还是本问计算导致)得1分,其余情况均不得分)
35.(8分)
(1)固体表面积,温度(2分,其中“固体表面积”写成“锌的状态”也给分) (2)温度越高(2分)
(3)②和③(2分,两个同时正确才得2分,写对其中一个不得分)
(4)①④(2分,每写对一个得1分,每写错一个扣1分,本空最低0分)
化学学科试题(学考)
考试时间:60分钟 总分:100分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 -23 -35.5
一、单选题(共30小题,每题2分,共60分。在每小题给出的四个选项中只有一项符合题目要求)
1.下列过程中,化学反应速率的增大对人类有益的是( )
A.金属的腐蚀 B.食物的腐败 C.塑料的老化 D.氨的合成
2.下列物质之间的转化,必须要加入氧化剂才能实现的是( )
A.SO2→H2SO3 B.Cu→CuSO4 C.NO2→HNO3 D.N2→NH3
3.下列化学用语或模型表示正确的是( )
A.甲烷分子的空间填充模型:
B.氯化氢分子的电子式:
C.钾的原子结构示意图:
D.NaOH的电离方程式:
4.“北溪”天然气管道是俄罗斯向欧洲输气的主要管道。2022年9月26日,“北溪”天然气管道发现两个泄漏点,分别位于丹麦和瑞典附近水域。下列说法错误的是( )
A.天然气的主要成分是CH4
B.甲烷分子具有平面正方形结构
C.甲烷燃烧反应中,生成物的总能量低于反应物的总能量
D.甲烷和氯气光照发生取代反应
5.浓硫酸与下列物质作用时,只表现强氧化性的是( )
A.蓝色硫酸铜品体 B.木材炭化
C.红热的木炭 D.铜
6.下列气体中,不能用浓硫酸干燥的是( )
A.H2 B.NH3 C.HCl D.O2
7.人类生活中处处需要能量。下列图片中利用的能量主要是由化学变化产生的是( )
A.太阳能路灯照明 B.风车发电
C.帆船航行 D.燃油汽车行驶
8.化学反应速率的研究对工农业生产和日常生活有着重要的意义,下列操作不能加快化学反应速率的是( )
A.低温冷藏食物
B.燃煤发电时用煤粉代替煤块
C.用H2O2制备O2时,使用MnO2作催化剂
D.用70%的硫酸溶液代替98%的浓硫酸与Na2SO3粉末反应制备SO2
9.党的二十大报告提出,坚决打赢关键核心技术攻坚战。制造5G芯片的氮化铝属于( )
A.传统无机非金属材料 B.金属材料
C.新型塑料 D.新型无机非金属材料
10.不能用作制冷剂的是( )
A.N2 B.NH3 C.SO2 D.H2SO4
11.关于下图所示的原电池,下列说法正确的是( )
A.石墨电极上发生氧化反应 B.电子由锌片通过导线流向石墨棒
C.该装置将电能转化为化学能 D.将稀硫酸换成乙醇,灯泡亮度不变
12.下列物质中,S元素的化合价最高的是( )
A.SO3 B.H2S C.SO2 D.NaHSO3
13.实验室采用如图装置制备气体,合理的是( )
试剂X 试剂Y 试剂Z 制备气体A
A 稀盐酸 大理石 饱和碳酸氢钠溶液 CO2
B 浓盐酸 二氧化锰 饱和食盐水 Cl2
C 浓氨水 生石灰 浓硫酸 NH3
D 稀硝酸 铜片 水 NO
14.密闭容器中,一定量的SO2和O2在一定条件下发生反应生成SO3,经过足够长的时间,反应“停止”了。可以说明该反应是可逆反应的判断是( )
A.反应生成了SO3 B.SO2和O2消耗完了
C.只有SO2和SO3共同存在 D.SO2、O2和SO3共同存在
15.中国历史的发展和化学的发展紧密结合,中国的传世国宝,无不体现了劳动人民对化学的认识和应用。下列四种国宝级文物的主要成分(载体)是硅酸盐的是( )
A.被称为“臻于极致的青铜典范”的四羊方尊 B.被誉为“白瓷之王”的定窑孩儿枕 C.成为中国文化遗产标志的太阳神鸟金饰 D.被尊为“墨皇”的牙色麻纸本墨迹《平复帖》
16.科幻电影《流浪地球2》中的太空电梯震撼人心,制作太空电梯所需绳索的材料既要密度小还要强度大,请你发挥想象,下列材料中最适合制作绳索的应该是( )
A.铝合金 B.晶体硅 C.碳纳米管 D.陶瓷
17.下列气体中能使品红溶液褪色的是( )
A.O2 B.CO2 C.SO2 D.CO
18.下列各种氮肥的主要成分中,含氮量(质量分数)最高的是( )
A.NH4Cl B. C.NH4HCO3 D.(尿素)
19.大多数有机化合物不具有的性质是( )
A.易燃烧 B.熔、沸点较低 C.热稳定性差 D.很难发生任何反应
20.下列各组微粒,互称为同位素的是( )
A.和 B.和 C.O2和O3 D.CH4和C2H6
21.下列物质中不含甲烷的是( )
A.海底可燃冰 B.天然气 C.瓦斯气 D.水煤气
22.下列反应中生成物的总能量高于反应物的总能量的是( )
A.碳酸钙受热分解 B.乙醇燃烧 C.钠与水反应 D.氧化钙溶于水
23.在一定条件下,下列物质可与甲烷发生反应的是( )
A.Cl2 B.浓硫酸 C.氢氧化钠溶液 D.酸性高锰酸钾溶液
24.鉴别甲烷和氢气两种无色气体的正确方法是( )
A.点燃后观察实验现象
B.点燃后罩上干燥的冷烧杯
C.点燃后罩上内壁涂有澄清石灰水的冷烧杯
D.通入澄清石灰水
25.有机反应属于( )
A.取代反应 B.加成反应 C.加聚反应 D.酯化反应
26.下列物质属于高分子化合物的是( )
A.苯 B.聚丙烯 C.乙烯 D.1,2-二溴乙烷
27.在2L的密闭容器中,自开始至2秒,氨的物质的量由0变为0.4mol,则以氨气表示的化学反应速率是( )
A. B. C. D.
28.下列装置或过程能实现化学能转化为电能的是( )
A.银锌纽扣电池 B.冶炼金属钠 C.太阳能电池 D.天然气燃烧
29.下列反应体系中,不属于可逆反应的是( )
A.Cl2溶于水
B.氨气溶于水
C.工业合成氨
D.和
30.下列反应属于氮的固定的是( )
A.工业上用氮气与氢气合成氨 B.NH3和HCl反应制取NH4Cl
C.氯化铵与烧碱的复分解反应 D.空气中的氮氧化物转化成酸雨
第Ⅱ卷(非选题,共40分)
二、填空题(共28分)
31.(10分)硫酸的物理性质及酸的通性
(1)物理性质
纯净的硫酸是无色黏稠状液体,密度比水__________,能与水以任意比混合,沸点__________,难挥发。
(2)酸的通性
H2SO4在水里电离出大量__________,所以具有__________,能使紫色石蕊试液显红色,请写出下列反应的离子方程式。
①和活泼金属(如Fe):__________。
②和金属氧化物(如MgO):__________。
③和盐(如NaHCO3):__________。
32.(10分)已知A、B、C、D、E是中学化学中的常见气体,它们都是由1-18号元素组成的单质或化合物,并有如下的信息:
①A气体能使湿润的红色石蕊试纸变蓝;
②B气体通入品红溶液,红色褪去,继续加热,溶液又变红色;
③C气体密度相对空气来说很小,通过灼热的氧化铜可以使其变红;
④D为红棕色、有刺激性气味的气体,能和水反应生成无色气体;
⑤E为黄绿色的、有刺激性气味的气体。
试确定它们的化学式:A__________,B__________,C__________,D__________,E__________。
33.(8分)利用生活中或实验中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:。
(2)实验装置(如图)。
(3)原电池设计及注意的问题:
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓——”的声音。其原因是:在原电池中,由化学能转化为__________,在耳机中又转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的__________极,电极反应是发生了__________反应。
三、计算题(共4分)
34.(4分)将16gNaOH固体溶于100mL水中,再用蒸馏水稀释,配成1L溶液。请计算:
(1)所配IL溶液的物质的量浓度。
(2)从上述溶液中取出10mL,逐滴加入0.1mol/L的盐酸,当恰好完全中和时,求加入盐酸的体积。
四、实验题(共8分)
35.(8分)我校化学兴趣小组的小王同学用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
实验编号 锌的状态 反应温度/℃ 收集100mL氢气所需时间/s
① 薄片 15 180
② 薄片 25 70
③ 粉末 25 15
(1)该实验的目的是探究__________对锌和稀盐酸反应速率的影响;
(2)实验①和②表明__________,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是__________和__________;
(4)你猜想下列因素中能影响酸与金属反应的反应速率的有__________。
①酸的种类 ②酸溶液的体积(确保金属与酸充分接触) ③金属的颜色 ④金属的种类
黑龙江省部分中学2022-2023学年高一下学期期中联考
化学学科试题(学考)答案及评分标准
一、单选题
1 2 3 4 5 6 7 8 9 10
D B A B C B D A D D
11 12 13 14 15 16 17 18 19 20
B A A D B C C D D A
21 22 23 24 25 26 27 28 29 30
D A A C B B B A D A
二、填空题
31.(10分)
(1)大(1分) 高(1分)
(2)(1分,写汉字“氢离子”亦给分,“硫酸根”写出与否不影响给分) 酸性(1分)
①(2分,气体符号不写得1分,其余错误0分)
②(2分,有错误0分)
③(2分,有错误0分)
32.(10分)
A.NH3 B.SO2 C.H2 D.NO2 E.Cl2(每个2分,写汉字名称0分)
33.(8分)
(3)①电能(2分) ②负(2分) (2分)氧化(2分,若写“氧化反应”也给分)34.(4分)
(1)(2分,其中若按上式计算公式正确但结果错误得1分;若分步计算且两个公式都正确但结果不对则得1分;若第一步求物质的量公式正确且结果正确但浓度公式错误(无论浓度数值是否正确)则得1分,其余情况均不得分)
(2)(2分,结果写成两种单位均可,最终表达式推导过程可以省略。其中若能得到最终表达式但结果错误(无论是前问结果错误导致还是本问计算导致)得1分,其余情况均不得分)
35.(8分)
(1)固体表面积,温度(2分,其中“固体表面积”写成“锌的状态”也给分) (2)温度越高(2分)
(3)②和③(2分,两个同时正确才得2分,写对其中一个不得分)
(4)①④(2分,每写对一个得1分,每写错一个扣1分,本空最低0分)
同课章节目录
