第1章 有机化合物的结构与性质 烃 单元测(含解析) 高下学期二化学鲁科版(2019)选择性必修3
文档属性
| 名称 | 第1章 有机化合物的结构与性质 烃 单元测(含解析) 高下学期二化学鲁科版(2019)选择性必修3 |  | |
| 格式 | docx | ||
| 文件大小 | 719.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-26 15:28:49 | ||
图片预览




文档简介
第1章《有机化合物的结构与性质 烃》单元测试卷
一、单选题
1.下列说法正确的是
A.乙烯和氯乙烯都可以通过聚合反应得到高分子材料
B.用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3
C.乙烯分子与苯分子都能与H2发生加成反应,说明二者所含碳碳键相同
D.乙酸乙酯在碱性条件下的水解反应又叫皂化反应
2.甲烷分子中的4个氢原子都可以被取代,若甲烷分子中的4个氢原子都被苯基取代,可以得到的分子如图,对该分子的描述,不正确的是
A.分子式为C25H20
B.所有的碳原子可能都在同一平面上
C.所有原子一定不在同一平面上
D.此物质属于芳香烃类物质
3.据报道,新合成的桥连多环烃( )拓展了人工合成自然产物的技术。下列有关该烃的说法中正确的是
A.不能发生氧化反应 B.一氯代物只有种
C.分子中含有个五元环 D.所有原子处于同一平面
4.左旋多巴可用于改善运动迟缓,结构简式如下图所示,其中不含有的官能团是
A.羟基 B.氨基 C.酯基 D.羧基
5.甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是
A.该化合物分子中所有原子不可能处于同一平面
B.分子中所有原子一定处于同一平面
C.分子式为C25H20
D.该化合物为芳香烃
6.下列有机物命名正确的是
A. 2-乙基丙烷 B. 1-氯丁烷
C. 2-乙基-1,3-戊二烯 D. 2-甲基-2-丙烯
7.下列说法不正确的是
A.CH3CH2OH和CH3OCH3互为同分异构体
B.因为甲烷是正四面体结构,所以CH2Cl2只有一种结构
C.丙二酸和乙酸互为同系物
D.乙酸乙酯和2-甲基丙酸互为同分异构体
8.二环[4.1.0]庚烷()是一种典型的桥环烃,下列关于二环[4.1.0]庚烷的说法错误的是
A.与环庚烯互为同分异构体
B.所有的碳原子均在同一平面上
C.一氯代物有4种(不考虑立体异构)
D.1mol二环[4.1.0]庚烷完全燃烧时消耗10molO2
9.加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯。用如图所示装置探究废旧塑料的再利用。下列叙述不正确的是
A.最后收集的气体可以作为清洁燃料使用
B.装置丙中的试剂吸收反应产生的气体后得到的产物的密度均比水大
C.装置乙试管中收集到的液体可以与溴水发生取代反应
D.甲烷光照条件下与氯气的取代反应产物有多种
10.1mol某气态烃能与2mol氯化氢发生加成反应,加成后的产物又可与8mol氯气发生完全的取代反应,则该烃可能为
A.乙炔 B.丙炔 C.丙烯 D.2-丁炔
11.1mol乙烯与氯气完全加成后再与氯气取代,整个过程最多需氯气
A.5mol B.4mol C.1mol D.6mol
12.有关 CH3CH=CHC ≡ CCF3 分子结构的下列叙述中,正确的是( )
A.分子中6个碳原子可能都在一条直线上 B.分子中最少5个碳原子在同一条直线上
C.分子中的饱和碳原子数目为3 D.分子中最多可能有10个原子在同一平面上
13.下列有机物命名正确的是
A.2﹣乙基丙烷 B.2﹣甲基﹣2﹣丙烯
C.邻二甲苯 D.3—丁醇
14.下列说法正确的是
A.“结草为庐”所用的秸秆,经现代科技可转化为苯乙酸、苯乙醇、苯乙烯等芳香烃
B.天和核心舱电推进系统腔体的氮化硼陶瓷属于新型无机非金属材料
C.太阳能电池翼伸展机构用到的SiC是一种新型硅酸盐材料
D.涤纶、石墨烯、纤维素属于有机高分子化合物
15.乙烯的相关转化关系如图。下列有关说法正确的是
A.甲与乙醚互为同分异构体
B.甲→乙的反应类型为加成反应
C.丙为氯气
D.聚乙烯不是纯净物
二、填空题
16.写出下列物质发生加聚反应所得产物的结构简式。
(1)1,1-二氯乙烯_______;
(2)丙烯_______;
(3)2-甲基-1,3-丁二烯_______;
(4)2-甲基-1,3丁二烯与1mol溴发生加成反应得到三种产物的结构简式_______、_______、_______。
17.石油裂解得到某烃A,其球棍模型为 ,它是重要的化工基本原料。
①A的结构简式为_______。
②A与溴的四氯化碳溶液反应的化学方程式为_____________________。
③A能使酸性高锰酸钾溶液褪色,发生的反应类型为:______________。
④A的同系物B的相对分子质量比A大14,B的结构有________种。(不考虑顺反异构)。
三、实验题
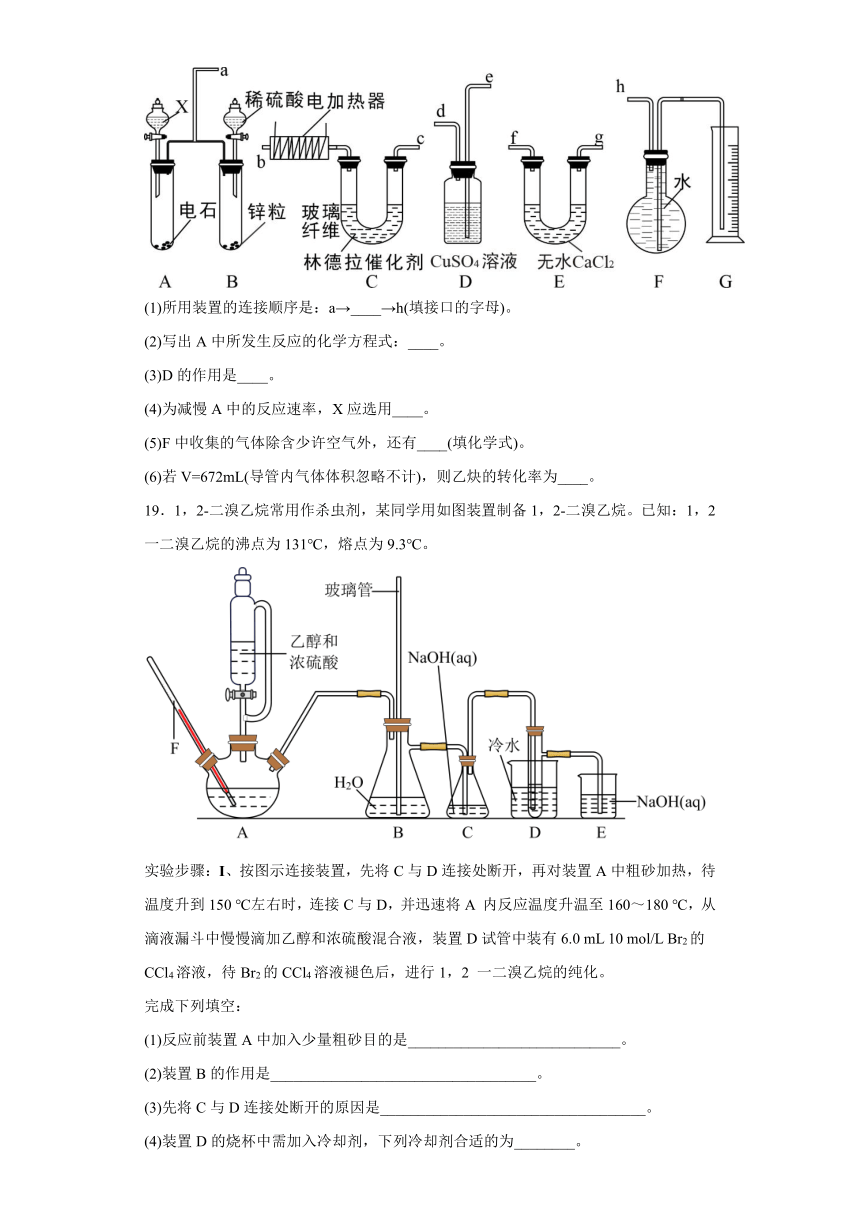
18.已知在常用催化剂(如铂、钯)的催化下,氢气和炔烃加成生成烷烃,难以得到烯烃,但使用活性较低的林德拉催化剂[Pd/(PdO、CaCO3),其中钯附着于碳酸钙及少量氧化铅上],可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化。现有一课外活动兴趣小组利用上述原理设计了一套由如图所示仪器组装而成的实验装置(铁架台未画出),拟由乙炔制乙烯,并测定乙炔的转化率。若用含0.02molCaC2的电石与足量X反应制乙炔,用1.6g含杂质18.7%的锌粒(杂质不与酸反应)与足量稀硫酸反应制H2,当乙炔和H2反应完全后,假定在标准状况下测得G中收集到的水的体积为V。试回答下列问题:
(1)所用装置的连接顺序是:a→____→h(填接口的字母)。
(2)写出A中所发生反应的化学方程式:____。
(3)D的作用是____。
(4)为减慢A中的反应速率,X应选用____。
(5)F中收集的气体除含少许空气外,还有____(填化学式)。
(6)若V=672mL(导管内气体体积忽略不计),则乙炔的转化率为____。
19.1,2-二溴乙烷常用作杀虫剂,某同学用如图装置制备1,2-二溴乙烷。已知:1,2 一二溴乙烷的沸点为131℃,熔点为9.3℃。
实验步骤:Ⅰ、按图示连接装置,先将C与D连接处断开,再对装置A中粗砂加热,待温度升到150 ℃左右时,连接C与D,并迅速将A 内反应温度升温至160~180 ℃,从滴液漏斗中慢慢滴加乙醇和浓硫酸混合液,装置D试管中装有6.0 mL 10 mol/L Br2的CCl4溶液,待Br2的CCl4溶液褪色后,进行1,2 一二溴乙烷的纯化。
完成下列填空:
(1)反应前装置A中加入少量粗砂目的是____________________________。
(2)装置B的作用是___________________________________。
(3)先将C与D连接处断开的原因是___________________________________。
(4)装置D的烧杯中需加入冷却剂,下列冷却剂合适的为________。
a.冰水混合物 b.5℃的水 c.10℃的水
Ⅱ、1,2 一二溴乙烷的纯化
步骤①:冷却后,把装置 D 试管中的产物转移至分液漏斗中,用 1%的氢氧化钠水溶液洗涤。
步骤②:用水洗至中性。
步骤③:“向所得的有机层中加入适量无水氯化钙,过滤,转移至蒸馏烧瓶中蒸馏,收集130~132℃的馏分,得到产品7.896 g。
(5)步骤①中加入 1%的氢氧化钠水溶液时,发生反应的离子方程式为_________________________。
(6)步骤③中加入无水氯化钙的作用为_________________________。该实验所得产品的产率为_____________。
四、计算题
20.在25℃和101KPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合烃中乙炔的体积分数是_____。
21.碳原子之间可以形成单键、双键、三键,不同分子中碳原子数目不等,有机物的数量繁多,现有以下几种有机物:
①CH4② ③ ④ ⑤ ⑥丁烷⑦丙烷
请利用上述给出的物质按要求回答下列问题:
(1)相对分子质量为的烷烃的结构简式为_______;
(2)分子中含有个氢原子的环烷烃的分子式是_______;
(3)与②互为同分异构体的是_______(填序号);
(4)丙烷与氯气光照条件下反应,生成的一氯丙烷有_______种结构;
(5)在120℃、1.01×105Pa状态下,某种气态烃与足量的完全反应后,测得反应前后气体的体积没有发生改变,则该烃是_______(分子式);它与⑦互为_______关系。
参考答案:
1.A
【详解】A.乙烯和氯乙烯均含有碳碳双键,可加聚得到高分子材料,正确;
B.核磁共振氢谱中,前者有两种峰,后者有三种峰,可以区分,B错误;
C.中是一种介于碳碳单键和碳碳双键之间的一种独特的化学键;
D.油脂在碱性条件下的水解叫皂化反应,D错误;
答案选A。
2.B
【详解】A. 分子中含有4个苯环,共含有25个C和20个H,则分子式为C25H20,故A正确;
B. 甲烷是正四面体,乙烯是平面型分子,中间碳所连的四个碳原子一定不在同一平面上,故B错误;
C.分子中含有饱和烃基,具有甲烷的结构特点,所有原子不可能在同一平面上,故C正确;
D. 该有机物C和H元素,且含有苯环,属于芳香烃,故D正确;
故选B。
3.C
【详解】A.该烃可燃烧,能发生氧化反应,A错误;
B.从该烃的结构简式分析,其含有5种不同环境的氢原子,则其一氯代物有5种,B错误;
C.从图中分析可知,该分子中含有个五元环,分别是两个六元环内的碳,与六元环上的其它碳原子构成的两个五元环,C正确;
D.根据甲烷的正四面体构型可知,该桥连多环烃饱和碳原子与其连接的四个原子构成四面体型,故所有原子不可能处于同一平面,D错误;
故选C。
4.C
【分析】羟基的结构为-OH,氨基的结构为-NH2,酯基的结构为-COOC-,羧基的结构为-COOH。
【详解】根据左旋多巴的结构简式可知,左旋多巴中不含有酯基,故选:C。
5.B
【详解】A.若有机物分子中含有饱和碳原子,分子中所有原子不可能处于同一平面,由有机物的结构简式可知,与四个苯环相连的碳原子为饱和碳原子,则分子中所有原子不可能处于同一平面,故A正确;
B.若有机物分子中含有饱和碳原子,分子中所有原子不可能处于同一平面,由有机物的结构简式可知,与四个苯环相连的碳原子为饱和碳原子,则分子中所有原子不可能处于同一平面,故B错误;
C.由有机物的结构简式可知,该有机物分子中含有四个苯环,属于芳香烃,分子式为C25H20,故C正确;
D.由有机物的结构简式可知,该有机物分子中含有四个苯环,属于芳香烃,故D正确;
故选B。
6.B
【详解】A.主链为碳原子最多的碳链,所以 的名称为:2-甲基丁烷,A错误;
B.在第1个碳原子上有1个Cl原子,名称为:1-氯丁烷,B正确;
C.官能团都在主链上,所以 名称为:2-乙基-1,3-丁二烯,C错误;
D.命名时,从离官能团最近的一端开始标号,所以 为2-甲基-1-丙烯,D错误;
故选B。
7.C
【详解】A.CH3CH2OH和CH3OCH3的分子式相同(都为C2H6O)而结构不同,故互为同分异构体,故A正确;
B.因为甲烷是正四面体结构,所以甲烷的二氯取代物CH2Cl2只有一种结构,故B正确;
C.丙二酸含有两个羧基,乙酸含有一个羧基,两种物质不是结构相似且两种物质的分子组成上不是相差若干个CH2原子团,故不互为同系物,故C错误;
D.乙酸乙酯和2-甲基丙酸的分子式相同(都为C4H8O2)且结构不同,故互为同分异构体,故D正确;
故选C。
8.B
【详解】A.由二环[4.1.0]庚烷()的结构简式可知其分子式为:C7H12,环庚烯的分子式为:C7H12,两者分子式相同结构不同,互为同分异构体,故A正确;
B.该结构中存在两个与3个碳相连的碳原子,不可能所有碳原子共面,故B错误;
C.该结构存在对称轴,根据等效氢原则可知其有4种氢原子,一氯代物有四种,故C正确;
D.由其分子式可知1mol二环[4.1.0]庚烷完全燃烧时消耗氧气的物质的量为7+=10mol,故D正确;
故选:B。
9.C
【分析】加强热时,聚丙烯分解生成碳、氢气、甲烷、乙烯、丙烯、苯和甲苯,除碳为固体,其他物质均为气体;冷却后,苯和甲苯液化,氢气、甲烷、乙烯和丙烯都是气体,其中,乙烯和丙烯与丙中溴发生加成反应,最后收集的气体为氢气和甲烷。
【详解】A.最后收集的氢气和甲烷可作清洁燃料,故A正确;
B.1,2-二溴乙烷、1,2-二溴丙烷的密度都大于水的密度,故B正确;
C.装置乙试管中收集的液体是甲苯和苯,在铁粉或FeBr3存在下均可与液溴发生取代反应,故C错误;
D.甲烷光照条件下与氯气的取代反应,生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳,故D正确;
故答案为:C。
10.D
【分析】某气态烃1mol能与2mol氯化氢发生加成反应,说明分子中含有1个C≡C或2个C=C键,所得产物又能与8mol氯气发生取代反应,得到一种只含碳氯元素的化合物,说明加成产物中含有8个H原子,则原气态烃为炔烃或二烯烃,且有6个H原子。
【详解】A.乙烯分子中只含1个C=C键,故A错误;
B.丙炔分子式为C3H4,不满足条件,故B错误;
C.丙烯只含1个C=C键,故C错误;
D.2-丁炔分子式为C4H6,分子中含6个氢原子,满足条件,故D正确;
故选D。
【点睛】有机物和HCl发生加成反应后,会引入2个H原子,做题时容易忽略新引入的H原子导致错误。
11.A
【详解】1mol乙烯与氯气完全加成需要1mol氯气。生成物的卤代烃中还含有4个氢原子,所以又需要4mol氯气取代,共计是5mol,答案选A。
12.D
【分析】该有机物分子中含有甲基、C=C、C≡C,结合甲烷为正四面体结构、乙烯为平面型结构、乙炔为直线型结构,分子中碳链空间结构为平面型,如图所示。
【详解】A.分子中6个碳原子不可能都在一条直线上,故A错误;
B.乙炔为直线型结构,-C≡C-决定了3、4、5、6号4个碳原子在同一直线上,2、3、4号3个C键角接近120度,则最多4个碳原子在一条直线上,故B错误;
C.根据CH3CH=CHC ≡ CCF3,分子中的饱和碳原子数目为2,故C错误;
D.乙烯为平面型结构,决定1、2、3、4号4个碳原子在同一平面内,而3、4、5、6号4个碳原子在同一直线上,3、4号两个C原子已经在平面上,因此这条直线在这个平面上,即6个C原子共面,两端的氢原子也在这个平面上,碳碳单键可以旋转,能够使甲基和-CF3上的1个H和1个F原子处于该平面,故D正确;
故选D。
【点睛】本题考查有机物的结构特点。注意有机分子中原子共线、共面问题:(1)甲烷,正四面体结构,C原子居于正四面体的中心,分子中的5个中没有任何4个原子处于同一平面内;其中任意三个原子在同一平面内,任意两个原子在同一直线上;(2)乙烯,平面型结构,分子中的6个原子处于同一平面内,键角都约为120度;(3)乙炔,直线型结构,分子中的4个原子处于同一直线上.(4)苯,平面型结构,分子中的12个原子都处于同一平面。
13.C
【详解】A.属于烷烃,名称为2﹣甲基丁烷,故A错误;
B.属于烯烃,名称为2﹣甲基﹣1﹣丙烯,故B错误;
C.属于苯的同系物,名称为邻二甲苯,故C正确;
D.属于饱和一元醇,名称为2—丁醇,故D错误;
故选C。
14.B
【详解】A.芳香烃是C、H化合物,故A错误;
B.氮化硼陶瓷属于新型无机非金属材料,故B正确;
C.SiC是一种新型无机非金属材料,故C错误;
D.石墨烯是单质,属于有机高分子化合物,故D错误;
故答案为B
15.D
【分析】乙烯与水加成生成乙醇,乙醇氧化为乙醛,则乙为乙醛,乙烯与HCl加成生成氯乙烷,据此分析解题。
【详解】A.甲为乙醇为C2H6O,乙醚的分子式为C4H10O,不为同分异构体,A错误;
B.甲→乙的反应类型为氧化反应,B错误;
C.丙为氯化氢,C错误;
D.聚乙烯不是纯净物,因为n值不固定,故由多种物质组成,D正确;
答案选D。
16.(1)
(2)
(3)
(4)
【解析】(1)
1,1-二氯乙烯发生加聚反应所得产物的结构简式为:;
(2)
丙烯发生加聚反应所得产物的结构简式为:;
(3)
2-甲基-1,3-丁二烯发生加聚反应所得产物的结构简式为:;
(4)
2-甲基-1,3丁二烯与1mol溴发生1,2加成反应得到、,发生1,4加成得到,发生加聚反应所得产物分别是、、。
17. CH3CH=CH2 CH3CH=CH2+Br2CH3CHBrCH2Br 氧化反应 3
【详解】①根据A的模型得到A的结构简式为CH3CH=CH2;故答案为:CH3CH=CH2。
②A与溴的四氯化碳溶液发生加成反应,其反应的化学方程式为CH3CH=CH2+Br2CH3CHBrCH2Br;故答案为:CH3CH=CH2+Br2CH3CHBrCH2Br。
③A含有碳碳双键,被酸性高锰酸钾溶液氧化,发生的反应类型为氧化反应;故答案为:氧化反应。
④A的同系物B的相对分子质量比A大14,B的分子式为C4H8,四个碳的碳架结构有两种即C—C—C—C, ,第一种碳架结构有两种同分异构,第二种碳架结构有一种同分异构,共3种;故答案为:3。
18.(1)edfgbc(f、g可调换顺序)
(2)CaC2+2H2O→CH≡CH↑+Ca(OH)2
(3)除去乙炔中的杂质气体
(4)饱和食盐水
(5)H2、C2H2、C2H4
(6)50%
【分析】装置A中电石和饱和食盐水反应制备乙炔,装置B中锌与稀硫酸反应制备氢气,两者混合后通入D中以除去气体中的杂质硫化氢,然后通过装置E干燥气体,将干燥的气体通过装置C发生加成反应制备乙烯,最后通到装置F中,通过测量G中水的体积,测量进入F中气体的体积。
【详解】(1)依据分析,装置口的连接顺序为:aedfgbch(f、g可调换顺序)。
(2)A中为电石和饱和食盐水反应制备乙炔,反应的化学方程式为:CaC2+2H2O→CH≡CH↑+Ca(OH)2。
(3)电石制得的乙炔气体中混有硫化氢,D中硫酸铜溶液是为了除去杂质气体硫化氢。
(4)由于水与碳化钙反应剧烈,不易控制反应速率,因此为了减缓A中反应速率,X应选用饱和食盐水。
(5)由于乙炔与氢气的加成反应不能完全反应,所以F中的气体除了含有少许空气外,还有未反应完的乙炔、氢气和生成的乙烯。
(6)0.02molCaC2与足量饱和食盐水反应生成0.02mol乙炔,1.6g含杂质18.7%的锌粒中锌的物质的量为≈0.02mol,锌粒(杂质不与酸反应)与足量稀硫酸反应生成0.02mol氢气,烧瓶中气体的物质的量为0.03mol,根据反应CH≡CH+H2CH2=CH2,设参加反应的乙炔的物质的量为xmol,则有(0.02-x)+(0.02-x)+x=0.03,解得x=0.01,所以乙炔的转化率为100%=50%。
19. 防止暴沸 调节压强,控制气体流速 减少气体流入D装置,减少溴的挥发 c Br2+2OH-=Br-+BrO-+H2O 干燥产品(除去产品中的水) 70%
【分析】在装置A中乙醇与浓硫酸混合加热170°C发生消去反应产生CH2=CH2和H2O,由于浓硫酸具有强氧化性,在加热时可能有一部分与乙醇发生氧化还原反应,乙醇被氧化CO2等,浓硫酸被还原产生SO2气体,装置B的作用是安全瓶,防止气流过大,装置C是除去杂质SO2、CO2,防止干扰CH2=CH2与溴的反应,装置D是冷却收集制取的产品1,2-二溴乙烷,装置E是尾气处理,防止大气污染,在1,2-二溴乙烷的净化阶段,第一步加入NaOH溶液是为了吸收剩余的Br2,第二步水洗是为了洗去NaOH溶液,第三步的无水氯化钙用来干燥生成的1,2- 二溴乙烷,据此答题。
【详解】(1)反应前装置A中加入少量粗砂目的是防止液体混合物加热时产生暴沸现象,故答案为:防止暴沸;
(2)装置B可以适当储存部分气体。B装置中有一个导气管,当气流过大时,水被压入导气管中,使气体压强减小;当气流过小时,锥形瓶中储存的气体又起到补充作用,故装置B的作用是调节压强,控制气体流速,故答案为:调节压强,控制气体流速;
(3)实验前先将C与D连接处断开目的是减少气体流入D装置,减少溴的挥发,故答案为:减少气体流入D装置,减少溴的挥发;
(4) 溴在常温下易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,故开始反应时为防止液溴挥发,要给装置D的烧杯中降温,又已知: 1,,2-二溴乙烷的沸点为131 ℃,熔点为9.3℃,在D中制备时防止产品堵塞试管,要确保1,2-二溴乙烷是液体状态,故最好用10℃的冷水。故答案为:c;
(5) 由于溴有挥发性、有毒,故用1%的氢氧化钠水溶液吸收多余的Br2,反应原理类似与Cl2和NaOH反应,故Br2与NaOH发生反应的离子方程式为:Br2+2OH-=Br-+BrO-+H2O,故答案为:Br2+2OH-=Br-+BrO-+H2O;
(6) 分液后,然后加干燥剂,无水氯化钙是用来干燥生成的1,2-二溴乙烷,故答案为:干燥产品(除去产品中的水)。
6.0 mL 10 mol/L Br2物质的量为6.0×10-3 L×10 mol/L=0.06 mol,根据CH2=CH2与Br2反应化学方程式CH2=CH2+Br2CH2BrCH2Br可知1,2-二溴乙烷CH2BrCH2Br物质的量也为0.06 mol,故1,2-二溴乙烷CH2BrCH2Br理论质量为:0.06 mol×188 g /mol=11.28 g,而实际质量为7.896 g,故该实验所得产品的产率为,故答案为:70%。
【点睛】本题考查了实验室制取1, 2-二溴乙烷方法、乙烯的化学性质,明确实验原理是解答本题的关键,根据浓硫酸、乙烯的性质来分析解答,注意二氧化硫、乙烯都能使溴水褪色,但褪色原理不同,乙烯使溴水褪色是发生了加成反应,二氧化硫使溴水褪色是发生了氧化还原反应。把握制备实验的原理,能正确理解设计的实验顺序,牢固把握实验基本操作是解答该类题目的保证。
20.25%
【详解】根据烃燃烧通式,用体积差计算:
可得y=5,即氢原子的平均值是5,乙烷和丙烯都含有6个氢原子,乙炔含有2个氢原子,根据十字交叉法可知n(乙炔):n(丙烯+乙烷)=(6-5):(5-2)=1:3 ,因此乙炔的体积分数为25%。
21.(1)CH3CH2CH3
(2)C7H14
(3)⑤
(4)2
(5) CH4 同系物
【详解】(1)设烷烃的通式为CnH2n+2,由烷烃的相对分子质量为44可得:14n+2=44,解得n=3,则烷烃的分子式为C3H8,结构简式为CH3CH2CH3,故答案为:CH3CH2CH3;
(2)设环烷烃的通式为CnH2n,由环烷烃分子中含有个氢原子可得:2n=14,解得n=7,则环烷烃的分子式为C7H14,故答案为:C7H14;
(3)由结构简式可知,②和⑤的分子式相同,结构不同,互为同分异构体,故答案为:⑤;
(4)丙烷分子中含有2类氢原子,所以丙烷与氯气光照条件下反应,生成的一氯丙烷有2种,故答案为:2;
(5)设烃的分子式为CxHy,CxHy燃烧的化学方程式为CxHy+(x+)xCO2+H2O,由在120℃、1.01×105Pa状态下,某种气态烃与足量的完全反应后,测得反应前后气体的体积没有发生改变可得:1+(x+)=x+,解得y=4,烃的分子式为CH4,由分子式可知,甲烷与丙烷的结构相似,分子组成相差2个CH2原子团,互为同系物,故答案为:CH4;同系物。
一、单选题
1.下列说法正确的是
A.乙烯和氯乙烯都可以通过聚合反应得到高分子材料
B.用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3
C.乙烯分子与苯分子都能与H2发生加成反应,说明二者所含碳碳键相同
D.乙酸乙酯在碱性条件下的水解反应又叫皂化反应
2.甲烷分子中的4个氢原子都可以被取代,若甲烷分子中的4个氢原子都被苯基取代,可以得到的分子如图,对该分子的描述,不正确的是
A.分子式为C25H20
B.所有的碳原子可能都在同一平面上
C.所有原子一定不在同一平面上
D.此物质属于芳香烃类物质
3.据报道,新合成的桥连多环烃( )拓展了人工合成自然产物的技术。下列有关该烃的说法中正确的是
A.不能发生氧化反应 B.一氯代物只有种
C.分子中含有个五元环 D.所有原子处于同一平面
4.左旋多巴可用于改善运动迟缓,结构简式如下图所示,其中不含有的官能团是
A.羟基 B.氨基 C.酯基 D.羧基
5.甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是
A.该化合物分子中所有原子不可能处于同一平面
B.分子中所有原子一定处于同一平面
C.分子式为C25H20
D.该化合物为芳香烃
6.下列有机物命名正确的是
A. 2-乙基丙烷 B. 1-氯丁烷
C. 2-乙基-1,3-戊二烯 D. 2-甲基-2-丙烯
7.下列说法不正确的是
A.CH3CH2OH和CH3OCH3互为同分异构体
B.因为甲烷是正四面体结构,所以CH2Cl2只有一种结构
C.丙二酸和乙酸互为同系物
D.乙酸乙酯和2-甲基丙酸互为同分异构体
8.二环[4.1.0]庚烷()是一种典型的桥环烃,下列关于二环[4.1.0]庚烷的说法错误的是
A.与环庚烯互为同分异构体
B.所有的碳原子均在同一平面上
C.一氯代物有4种(不考虑立体异构)
D.1mol二环[4.1.0]庚烷完全燃烧时消耗10molO2
9.加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯。用如图所示装置探究废旧塑料的再利用。下列叙述不正确的是
A.最后收集的气体可以作为清洁燃料使用
B.装置丙中的试剂吸收反应产生的气体后得到的产物的密度均比水大
C.装置乙试管中收集到的液体可以与溴水发生取代反应
D.甲烷光照条件下与氯气的取代反应产物有多种
10.1mol某气态烃能与2mol氯化氢发生加成反应,加成后的产物又可与8mol氯气发生完全的取代反应,则该烃可能为
A.乙炔 B.丙炔 C.丙烯 D.2-丁炔
11.1mol乙烯与氯气完全加成后再与氯气取代,整个过程最多需氯气
A.5mol B.4mol C.1mol D.6mol
12.有关 CH3CH=CHC ≡ CCF3 分子结构的下列叙述中,正确的是( )
A.分子中6个碳原子可能都在一条直线上 B.分子中最少5个碳原子在同一条直线上
C.分子中的饱和碳原子数目为3 D.分子中最多可能有10个原子在同一平面上
13.下列有机物命名正确的是
A.2﹣乙基丙烷 B.2﹣甲基﹣2﹣丙烯
C.邻二甲苯 D.3—丁醇
14.下列说法正确的是
A.“结草为庐”所用的秸秆,经现代科技可转化为苯乙酸、苯乙醇、苯乙烯等芳香烃
B.天和核心舱电推进系统腔体的氮化硼陶瓷属于新型无机非金属材料
C.太阳能电池翼伸展机构用到的SiC是一种新型硅酸盐材料
D.涤纶、石墨烯、纤维素属于有机高分子化合物
15.乙烯的相关转化关系如图。下列有关说法正确的是
A.甲与乙醚互为同分异构体
B.甲→乙的反应类型为加成反应
C.丙为氯气
D.聚乙烯不是纯净物
二、填空题
16.写出下列物质发生加聚反应所得产物的结构简式。
(1)1,1-二氯乙烯_______;
(2)丙烯_______;
(3)2-甲基-1,3-丁二烯_______;
(4)2-甲基-1,3丁二烯与1mol溴发生加成反应得到三种产物的结构简式_______、_______、_______。
17.石油裂解得到某烃A,其球棍模型为 ,它是重要的化工基本原料。
①A的结构简式为_______。
②A与溴的四氯化碳溶液反应的化学方程式为_____________________。
③A能使酸性高锰酸钾溶液褪色,发生的反应类型为:______________。
④A的同系物B的相对分子质量比A大14,B的结构有________种。(不考虑顺反异构)。
三、实验题
18.已知在常用催化剂(如铂、钯)的催化下,氢气和炔烃加成生成烷烃,难以得到烯烃,但使用活性较低的林德拉催化剂[Pd/(PdO、CaCO3),其中钯附着于碳酸钙及少量氧化铅上],可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化。现有一课外活动兴趣小组利用上述原理设计了一套由如图所示仪器组装而成的实验装置(铁架台未画出),拟由乙炔制乙烯,并测定乙炔的转化率。若用含0.02molCaC2的电石与足量X反应制乙炔,用1.6g含杂质18.7%的锌粒(杂质不与酸反应)与足量稀硫酸反应制H2,当乙炔和H2反应完全后,假定在标准状况下测得G中收集到的水的体积为V。试回答下列问题:
(1)所用装置的连接顺序是:a→____→h(填接口的字母)。
(2)写出A中所发生反应的化学方程式:____。
(3)D的作用是____。
(4)为减慢A中的反应速率,X应选用____。
(5)F中收集的气体除含少许空气外,还有____(填化学式)。
(6)若V=672mL(导管内气体体积忽略不计),则乙炔的转化率为____。
19.1,2-二溴乙烷常用作杀虫剂,某同学用如图装置制备1,2-二溴乙烷。已知:1,2 一二溴乙烷的沸点为131℃,熔点为9.3℃。
实验步骤:Ⅰ、按图示连接装置,先将C与D连接处断开,再对装置A中粗砂加热,待温度升到150 ℃左右时,连接C与D,并迅速将A 内反应温度升温至160~180 ℃,从滴液漏斗中慢慢滴加乙醇和浓硫酸混合液,装置D试管中装有6.0 mL 10 mol/L Br2的CCl4溶液,待Br2的CCl4溶液褪色后,进行1,2 一二溴乙烷的纯化。
完成下列填空:
(1)反应前装置A中加入少量粗砂目的是____________________________。
(2)装置B的作用是___________________________________。
(3)先将C与D连接处断开的原因是___________________________________。
(4)装置D的烧杯中需加入冷却剂,下列冷却剂合适的为________。
a.冰水混合物 b.5℃的水 c.10℃的水
Ⅱ、1,2 一二溴乙烷的纯化
步骤①:冷却后,把装置 D 试管中的产物转移至分液漏斗中,用 1%的氢氧化钠水溶液洗涤。
步骤②:用水洗至中性。
步骤③:“向所得的有机层中加入适量无水氯化钙,过滤,转移至蒸馏烧瓶中蒸馏,收集130~132℃的馏分,得到产品7.896 g。
(5)步骤①中加入 1%的氢氧化钠水溶液时,发生反应的离子方程式为_________________________。
(6)步骤③中加入无水氯化钙的作用为_________________________。该实验所得产品的产率为_____________。
四、计算题
20.在25℃和101KPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合烃中乙炔的体积分数是_____。
21.碳原子之间可以形成单键、双键、三键,不同分子中碳原子数目不等,有机物的数量繁多,现有以下几种有机物:
①CH4② ③ ④ ⑤ ⑥丁烷⑦丙烷
请利用上述给出的物质按要求回答下列问题:
(1)相对分子质量为的烷烃的结构简式为_______;
(2)分子中含有个氢原子的环烷烃的分子式是_______;
(3)与②互为同分异构体的是_______(填序号);
(4)丙烷与氯气光照条件下反应,生成的一氯丙烷有_______种结构;
(5)在120℃、1.01×105Pa状态下,某种气态烃与足量的完全反应后,测得反应前后气体的体积没有发生改变,则该烃是_______(分子式);它与⑦互为_______关系。
参考答案:
1.A
【详解】A.乙烯和氯乙烯均含有碳碳双键,可加聚得到高分子材料,正确;
B.核磁共振氢谱中,前者有两种峰,后者有三种峰,可以区分,B错误;
C.中是一种介于碳碳单键和碳碳双键之间的一种独特的化学键;
D.油脂在碱性条件下的水解叫皂化反应,D错误;
答案选A。
2.B
【详解】A. 分子中含有4个苯环,共含有25个C和20个H,则分子式为C25H20,故A正确;
B. 甲烷是正四面体,乙烯是平面型分子,中间碳所连的四个碳原子一定不在同一平面上,故B错误;
C.分子中含有饱和烃基,具有甲烷的结构特点,所有原子不可能在同一平面上,故C正确;
D. 该有机物C和H元素,且含有苯环,属于芳香烃,故D正确;
故选B。
3.C
【详解】A.该烃可燃烧,能发生氧化反应,A错误;
B.从该烃的结构简式分析,其含有5种不同环境的氢原子,则其一氯代物有5种,B错误;
C.从图中分析可知,该分子中含有个五元环,分别是两个六元环内的碳,与六元环上的其它碳原子构成的两个五元环,C正确;
D.根据甲烷的正四面体构型可知,该桥连多环烃饱和碳原子与其连接的四个原子构成四面体型,故所有原子不可能处于同一平面,D错误;
故选C。
4.C
【分析】羟基的结构为-OH,氨基的结构为-NH2,酯基的结构为-COOC-,羧基的结构为-COOH。
【详解】根据左旋多巴的结构简式可知,左旋多巴中不含有酯基,故选:C。
5.B
【详解】A.若有机物分子中含有饱和碳原子,分子中所有原子不可能处于同一平面,由有机物的结构简式可知,与四个苯环相连的碳原子为饱和碳原子,则分子中所有原子不可能处于同一平面,故A正确;
B.若有机物分子中含有饱和碳原子,分子中所有原子不可能处于同一平面,由有机物的结构简式可知,与四个苯环相连的碳原子为饱和碳原子,则分子中所有原子不可能处于同一平面,故B错误;
C.由有机物的结构简式可知,该有机物分子中含有四个苯环,属于芳香烃,分子式为C25H20,故C正确;
D.由有机物的结构简式可知,该有机物分子中含有四个苯环,属于芳香烃,故D正确;
故选B。
6.B
【详解】A.主链为碳原子最多的碳链,所以 的名称为:2-甲基丁烷,A错误;
B.在第1个碳原子上有1个Cl原子,名称为:1-氯丁烷,B正确;
C.官能团都在主链上,所以 名称为:2-乙基-1,3-丁二烯,C错误;
D.命名时,从离官能团最近的一端开始标号,所以 为2-甲基-1-丙烯,D错误;
故选B。
7.C
【详解】A.CH3CH2OH和CH3OCH3的分子式相同(都为C2H6O)而结构不同,故互为同分异构体,故A正确;
B.因为甲烷是正四面体结构,所以甲烷的二氯取代物CH2Cl2只有一种结构,故B正确;
C.丙二酸含有两个羧基,乙酸含有一个羧基,两种物质不是结构相似且两种物质的分子组成上不是相差若干个CH2原子团,故不互为同系物,故C错误;
D.乙酸乙酯和2-甲基丙酸的分子式相同(都为C4H8O2)且结构不同,故互为同分异构体,故D正确;
故选C。
8.B
【详解】A.由二环[4.1.0]庚烷()的结构简式可知其分子式为:C7H12,环庚烯的分子式为:C7H12,两者分子式相同结构不同,互为同分异构体,故A正确;
B.该结构中存在两个与3个碳相连的碳原子,不可能所有碳原子共面,故B错误;
C.该结构存在对称轴,根据等效氢原则可知其有4种氢原子,一氯代物有四种,故C正确;
D.由其分子式可知1mol二环[4.1.0]庚烷完全燃烧时消耗氧气的物质的量为7+=10mol,故D正确;
故选:B。
9.C
【分析】加强热时,聚丙烯分解生成碳、氢气、甲烷、乙烯、丙烯、苯和甲苯,除碳为固体,其他物质均为气体;冷却后,苯和甲苯液化,氢气、甲烷、乙烯和丙烯都是气体,其中,乙烯和丙烯与丙中溴发生加成反应,最后收集的气体为氢气和甲烷。
【详解】A.最后收集的氢气和甲烷可作清洁燃料,故A正确;
B.1,2-二溴乙烷、1,2-二溴丙烷的密度都大于水的密度,故B正确;
C.装置乙试管中收集的液体是甲苯和苯,在铁粉或FeBr3存在下均可与液溴发生取代反应,故C错误;
D.甲烷光照条件下与氯气的取代反应,生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳,故D正确;
故答案为:C。
10.D
【分析】某气态烃1mol能与2mol氯化氢发生加成反应,说明分子中含有1个C≡C或2个C=C键,所得产物又能与8mol氯气发生取代反应,得到一种只含碳氯元素的化合物,说明加成产物中含有8个H原子,则原气态烃为炔烃或二烯烃,且有6个H原子。
【详解】A.乙烯分子中只含1个C=C键,故A错误;
B.丙炔分子式为C3H4,不满足条件,故B错误;
C.丙烯只含1个C=C键,故C错误;
D.2-丁炔分子式为C4H6,分子中含6个氢原子,满足条件,故D正确;
故选D。
【点睛】有机物和HCl发生加成反应后,会引入2个H原子,做题时容易忽略新引入的H原子导致错误。
11.A
【详解】1mol乙烯与氯气完全加成需要1mol氯气。生成物的卤代烃中还含有4个氢原子,所以又需要4mol氯气取代,共计是5mol,答案选A。
12.D
【分析】该有机物分子中含有甲基、C=C、C≡C,结合甲烷为正四面体结构、乙烯为平面型结构、乙炔为直线型结构,分子中碳链空间结构为平面型,如图所示。
【详解】A.分子中6个碳原子不可能都在一条直线上,故A错误;
B.乙炔为直线型结构,-C≡C-决定了3、4、5、6号4个碳原子在同一直线上,2、3、4号3个C键角接近120度,则最多4个碳原子在一条直线上,故B错误;
C.根据CH3CH=CHC ≡ CCF3,分子中的饱和碳原子数目为2,故C错误;
D.乙烯为平面型结构,决定1、2、3、4号4个碳原子在同一平面内,而3、4、5、6号4个碳原子在同一直线上,3、4号两个C原子已经在平面上,因此这条直线在这个平面上,即6个C原子共面,两端的氢原子也在这个平面上,碳碳单键可以旋转,能够使甲基和-CF3上的1个H和1个F原子处于该平面,故D正确;
故选D。
【点睛】本题考查有机物的结构特点。注意有机分子中原子共线、共面问题:(1)甲烷,正四面体结构,C原子居于正四面体的中心,分子中的5个中没有任何4个原子处于同一平面内;其中任意三个原子在同一平面内,任意两个原子在同一直线上;(2)乙烯,平面型结构,分子中的6个原子处于同一平面内,键角都约为120度;(3)乙炔,直线型结构,分子中的4个原子处于同一直线上.(4)苯,平面型结构,分子中的12个原子都处于同一平面。
13.C
【详解】A.属于烷烃,名称为2﹣甲基丁烷,故A错误;
B.属于烯烃,名称为2﹣甲基﹣1﹣丙烯,故B错误;
C.属于苯的同系物,名称为邻二甲苯,故C正确;
D.属于饱和一元醇,名称为2—丁醇,故D错误;
故选C。
14.B
【详解】A.芳香烃是C、H化合物,故A错误;
B.氮化硼陶瓷属于新型无机非金属材料,故B正确;
C.SiC是一种新型无机非金属材料,故C错误;
D.石墨烯是单质,属于有机高分子化合物,故D错误;
故答案为B
15.D
【分析】乙烯与水加成生成乙醇,乙醇氧化为乙醛,则乙为乙醛,乙烯与HCl加成生成氯乙烷,据此分析解题。
【详解】A.甲为乙醇为C2H6O,乙醚的分子式为C4H10O,不为同分异构体,A错误;
B.甲→乙的反应类型为氧化反应,B错误;
C.丙为氯化氢,C错误;
D.聚乙烯不是纯净物,因为n值不固定,故由多种物质组成,D正确;
答案选D。
16.(1)
(2)
(3)
(4)
【解析】(1)
1,1-二氯乙烯发生加聚反应所得产物的结构简式为:;
(2)
丙烯发生加聚反应所得产物的结构简式为:;
(3)
2-甲基-1,3-丁二烯发生加聚反应所得产物的结构简式为:;
(4)
2-甲基-1,3丁二烯与1mol溴发生1,2加成反应得到、,发生1,4加成得到,发生加聚反应所得产物分别是、、。
17. CH3CH=CH2 CH3CH=CH2+Br2CH3CHBrCH2Br 氧化反应 3
【详解】①根据A的模型得到A的结构简式为CH3CH=CH2;故答案为:CH3CH=CH2。
②A与溴的四氯化碳溶液发生加成反应,其反应的化学方程式为CH3CH=CH2+Br2CH3CHBrCH2Br;故答案为:CH3CH=CH2+Br2CH3CHBrCH2Br。
③A含有碳碳双键,被酸性高锰酸钾溶液氧化,发生的反应类型为氧化反应;故答案为:氧化反应。
④A的同系物B的相对分子质量比A大14,B的分子式为C4H8,四个碳的碳架结构有两种即C—C—C—C, ,第一种碳架结构有两种同分异构,第二种碳架结构有一种同分异构,共3种;故答案为:3。
18.(1)edfgbc(f、g可调换顺序)
(2)CaC2+2H2O→CH≡CH↑+Ca(OH)2
(3)除去乙炔中的杂质气体
(4)饱和食盐水
(5)H2、C2H2、C2H4
(6)50%
【分析】装置A中电石和饱和食盐水反应制备乙炔,装置B中锌与稀硫酸反应制备氢气,两者混合后通入D中以除去气体中的杂质硫化氢,然后通过装置E干燥气体,将干燥的气体通过装置C发生加成反应制备乙烯,最后通到装置F中,通过测量G中水的体积,测量进入F中气体的体积。
【详解】(1)依据分析,装置口的连接顺序为:aedfgbch(f、g可调换顺序)。
(2)A中为电石和饱和食盐水反应制备乙炔,反应的化学方程式为:CaC2+2H2O→CH≡CH↑+Ca(OH)2。
(3)电石制得的乙炔气体中混有硫化氢,D中硫酸铜溶液是为了除去杂质气体硫化氢。
(4)由于水与碳化钙反应剧烈,不易控制反应速率,因此为了减缓A中反应速率,X应选用饱和食盐水。
(5)由于乙炔与氢气的加成反应不能完全反应,所以F中的气体除了含有少许空气外,还有未反应完的乙炔、氢气和生成的乙烯。
(6)0.02molCaC2与足量饱和食盐水反应生成0.02mol乙炔,1.6g含杂质18.7%的锌粒中锌的物质的量为≈0.02mol,锌粒(杂质不与酸反应)与足量稀硫酸反应生成0.02mol氢气,烧瓶中气体的物质的量为0.03mol,根据反应CH≡CH+H2CH2=CH2,设参加反应的乙炔的物质的量为xmol,则有(0.02-x)+(0.02-x)+x=0.03,解得x=0.01,所以乙炔的转化率为100%=50%。
19. 防止暴沸 调节压强,控制气体流速 减少气体流入D装置,减少溴的挥发 c Br2+2OH-=Br-+BrO-+H2O 干燥产品(除去产品中的水) 70%
【分析】在装置A中乙醇与浓硫酸混合加热170°C发生消去反应产生CH2=CH2和H2O,由于浓硫酸具有强氧化性,在加热时可能有一部分与乙醇发生氧化还原反应,乙醇被氧化CO2等,浓硫酸被还原产生SO2气体,装置B的作用是安全瓶,防止气流过大,装置C是除去杂质SO2、CO2,防止干扰CH2=CH2与溴的反应,装置D是冷却收集制取的产品1,2-二溴乙烷,装置E是尾气处理,防止大气污染,在1,2-二溴乙烷的净化阶段,第一步加入NaOH溶液是为了吸收剩余的Br2,第二步水洗是为了洗去NaOH溶液,第三步的无水氯化钙用来干燥生成的1,2- 二溴乙烷,据此答题。
【详解】(1)反应前装置A中加入少量粗砂目的是防止液体混合物加热时产生暴沸现象,故答案为:防止暴沸;
(2)装置B可以适当储存部分气体。B装置中有一个导气管,当气流过大时,水被压入导气管中,使气体压强减小;当气流过小时,锥形瓶中储存的气体又起到补充作用,故装置B的作用是调节压强,控制气体流速,故答案为:调节压强,控制气体流速;
(3)实验前先将C与D连接处断开目的是减少气体流入D装置,减少溴的挥发,故答案为:减少气体流入D装置,减少溴的挥发;
(4) 溴在常温下易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,故开始反应时为防止液溴挥发,要给装置D的烧杯中降温,又已知: 1,,2-二溴乙烷的沸点为131 ℃,熔点为9.3℃,在D中制备时防止产品堵塞试管,要确保1,2-二溴乙烷是液体状态,故最好用10℃的冷水。故答案为:c;
(5) 由于溴有挥发性、有毒,故用1%的氢氧化钠水溶液吸收多余的Br2,反应原理类似与Cl2和NaOH反应,故Br2与NaOH发生反应的离子方程式为:Br2+2OH-=Br-+BrO-+H2O,故答案为:Br2+2OH-=Br-+BrO-+H2O;
(6) 分液后,然后加干燥剂,无水氯化钙是用来干燥生成的1,2-二溴乙烷,故答案为:干燥产品(除去产品中的水)。
6.0 mL 10 mol/L Br2物质的量为6.0×10-3 L×10 mol/L=0.06 mol,根据CH2=CH2与Br2反应化学方程式CH2=CH2+Br2CH2BrCH2Br可知1,2-二溴乙烷CH2BrCH2Br物质的量也为0.06 mol,故1,2-二溴乙烷CH2BrCH2Br理论质量为:0.06 mol×188 g /mol=11.28 g,而实际质量为7.896 g,故该实验所得产品的产率为,故答案为:70%。
【点睛】本题考查了实验室制取1, 2-二溴乙烷方法、乙烯的化学性质,明确实验原理是解答本题的关键,根据浓硫酸、乙烯的性质来分析解答,注意二氧化硫、乙烯都能使溴水褪色,但褪色原理不同,乙烯使溴水褪色是发生了加成反应,二氧化硫使溴水褪色是发生了氧化还原反应。把握制备实验的原理,能正确理解设计的实验顺序,牢固把握实验基本操作是解答该类题目的保证。
20.25%
【详解】根据烃燃烧通式,用体积差计算:
可得y=5,即氢原子的平均值是5,乙烷和丙烯都含有6个氢原子,乙炔含有2个氢原子,根据十字交叉法可知n(乙炔):n(丙烯+乙烷)=(6-5):(5-2)=1:3 ,因此乙炔的体积分数为25%。
21.(1)CH3CH2CH3
(2)C7H14
(3)⑤
(4)2
(5) CH4 同系物
【详解】(1)设烷烃的通式为CnH2n+2,由烷烃的相对分子质量为44可得:14n+2=44,解得n=3,则烷烃的分子式为C3H8,结构简式为CH3CH2CH3,故答案为:CH3CH2CH3;
(2)设环烷烃的通式为CnH2n,由环烷烃分子中含有个氢原子可得:2n=14,解得n=7,则环烷烃的分子式为C7H14,故答案为:C7H14;
(3)由结构简式可知,②和⑤的分子式相同,结构不同,互为同分异构体,故答案为:⑤;
(4)丙烷分子中含有2类氢原子,所以丙烷与氯气光照条件下反应,生成的一氯丙烷有2种,故答案为:2;
(5)设烃的分子式为CxHy,CxHy燃烧的化学方程式为CxHy+(x+)xCO2+H2O,由在120℃、1.01×105Pa状态下,某种气态烃与足量的完全反应后,测得反应前后气体的体积没有发生改变可得:1+(x+)=x+,解得y=4,烃的分子式为CH4,由分子式可知,甲烷与丙烷的结构相似,分子组成相差2个CH2原子团,互为同系物,故答案为:CH4;同系物。
