第二章 分子结构与性质 测试题 (含解析)2022-2023学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 第二章 分子结构与性质 测试题 (含解析)2022-2023学年高二下学期化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 573.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-26 15:35:41 | ||
图片预览




文档简介
第二章 分子结构与性质 测试题
一、选择题
1.下列叙述不正确的是
A.元素电负性的大小不但影响形成物质的化学性质,还影响其物理性质
B.手性分子发生化学变化后手性可能消失
C.氢键的存在可能使物质的熔沸点降低
D.气体单质中一定存在σ键,可能存在π键
2.某离子化合物中的阳离子结构模型如图。已知X、Y、Z为原子序数依次增大的短周期元素,Z的核外成对电子数和未成对电子数之比为。下列说法错误的是
A.X、Y、Z原子的电负性大小为Z>X>Y
B.1mol该阳离子所含的配位键数为2NA(NA为阿伏加德罗常数的值)
C.该阳离子可与水中的氢原子形成氢键
D.X分别能与Y、Z形成正四面体形的离子
3.有机金属氯化物由原子序数依次增大的短周期主族元素X、Y、Z、M、N组成,部分结构如图所示,基态原子M核外电子所占据原子轨道全充满,N元素的价层电子排布式为nsn-1np2n-1。下列说法错误的是
A.YN4为正四面体结构
B.氢化物的沸点Z>Y
C.Z元素的第一电离能比同周期相邻元素的大
D.与M同族元素的基态原子最高能级的电子云轮廓图呈球形
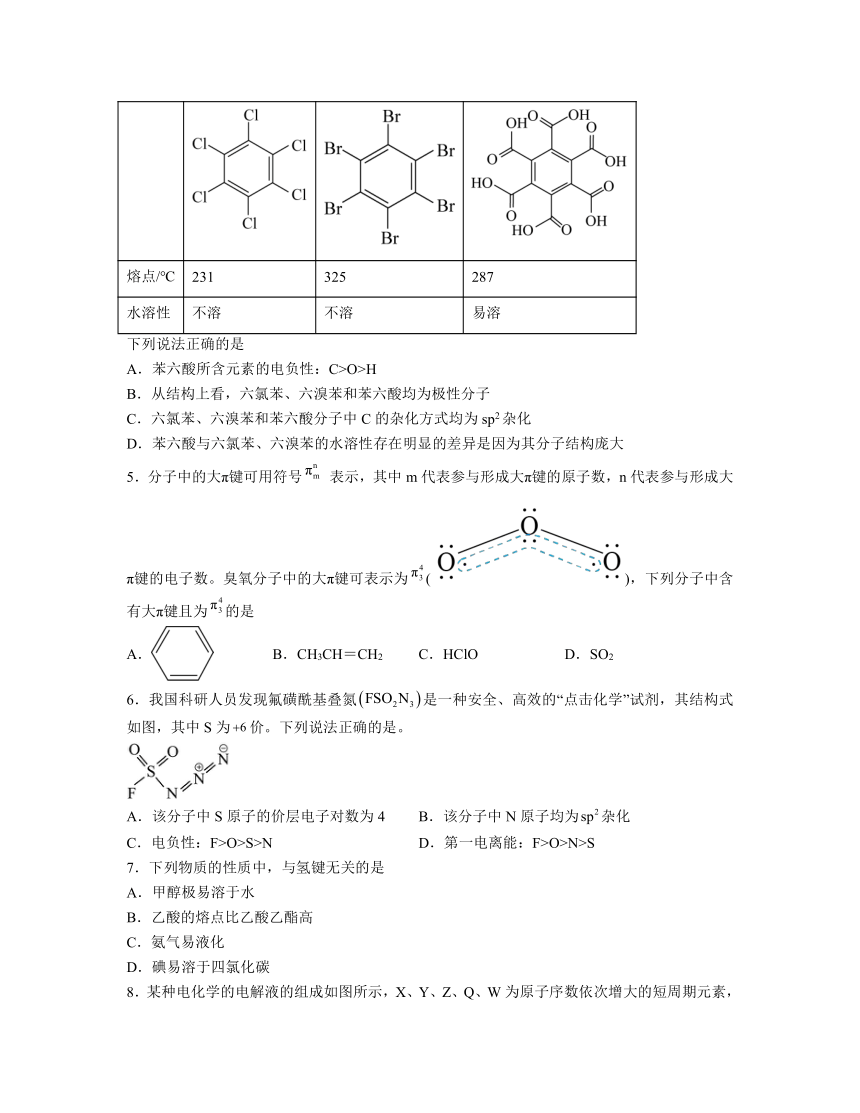
4.石墨烯具有优异的光学、电学、力学特性,在材料学、微纳加工、能源和生物医学等方面具有广阔的应用前景,石墨烯可采用化学方法制备,如以六氯苯、六溴苯为原料可制备石墨烯。下表是六氯苯、六溴苯、苯六酸的熔点和水溶性:
物质 六氯苯 六溴苯 苯六酸
熔点/℃ 231 325 287
水溶性 不溶 不溶 易溶
下列说法正确的是
A.苯六酸所含元素的电负性:C>O>H
B.从结构上看,六氯苯、六溴苯和苯六酸均为极性分子
C.六氯苯、六溴苯和苯六酸分子中C的杂化方式均为sp2杂化
D.苯六酸与六氯苯、六溴苯的水溶性存在明显的差异是因为其分子结构庞大
5.分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。臭氧分子中的大π键可表示为(),下列分子中含有大π键且为的是
A. B.CH3CH=CH2 C.HClO D.SO2
6.我国科研人员发现氟磺酰基叠氮是一种安全、高效的“点击化学”试剂,其结构式如图,其中S为价。下列说法正确的是。
A.该分子中S原子的价层电子对数为4 B.该分子中N原子均为杂化
C.电负性:F>O>S>N D.第一电离能:F>O>N>S
7.下列物质的性质中,与氢键无关的是
A.甲醇极易溶于水
B.乙酸的熔点比乙酸乙酯高
C.氨气易液化
D.碘易溶于四氯化碳
8.某种电化学的电解液的组成如图所示,X、Y、Z、Q、W为原子序数依次增大的短周期元素,下列说法正确的是
A.电解熔融可获得Q的单质 B.原子半径:
C.W的含氧酸均为强酸 D.QW的空间构型为正四面体
9.下列化学用语的表述错误的是
A.明矾的化学式:KAl(SO4)2·12H2O B.NH3分子的球棍模型:
C.铝原子的结构示意图: D.N2的电子式:
10.下列有关杂化轨道的说法错误的是
A.由同一能层上的s轨道与p轨道杂化而成
B.所形成的3个杂化轨道的能量相同
C.每个杂化轨道中s能级成分占三分之一
D.杂化轨道最多可形成2个键
11.气态N4分子,其分子结构如下图所示。已知断裂1molN—N吸收167kJ热量,生成1molN≡N放出942kJ热量,判断下列说法正确的是
A.N4属于一种新型的化合物 B.N4分子中存在非极性键
C.N4分子中N—N键角为109°28′ D.1molN4转变成N2将吸收882kJ热量
12.以下比较,正确的是
A.微粒半径:F->O2->Na+ B.电负性:F>Cl>Br
C.分子中的键角:BF3>CO2 D.稳定性:H2O<H2S
13.下列有关化学用语表示正确的是
A.二硫化碳的空间填充模型: B.是的原子结构示意图
C.固体的电子式: D.Cl-Cl的p-p σ键电子云图形:
14.乙烯是一种常用的催熟剂,下列对于乙烯中化学键的分析中正确的是
A.在乙烯分子中有一个σ键、一个π键
B.乙烯在发生加成反应时,断裂的是碳原子间的σ键
C.乙烯可以在一定条件下制得氯乙烷,在该过程断裂的是C-Hσ键
D.乙烯分子中的π键关于镜面对称
15.下列化学反应所断裂的共价键中,仅断裂键的是
A.
B.
C.
D.
二、填空题
16.甲醇(CH3OH)空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为2CH3OH+O22+2H2O
(1)C、H、O 三种元素的电负性由大到小的顺序为_______。
(2)HCHO的空间结构为_______。
(3)CH3OH和HCHO分子中碳原子的杂化轨道类型分别为_______和_______。
(4)甲醇氧化生成HCHO时,会产生CO、CO2、CH3OCH3等副产物。相同条件下,CO2的沸点比O2的高,主要原因为_______。
17.氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3气体和BN,如图所示:
请回答下列问题:
(1)由B2O3、CaF2和H2SO4制备BF3的化学方程式为_______;
(2)在BF3分子中,F-B-F的键角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF4,BF的立体构型为_______;与BF互为等电子体的分子的化学式为_______(写一种)。
18.回答下列问题:
(1)同学们吃的零食的包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
①生石灰属于哪种类型的物质?_______。
②生石灰可做干燥剂的理由是(用化学方程式表示)_______。
③生石灰还可以跟哪些类别的物质发生化学反应?列举两例,并写出化学方程式:_______ 。
(2)氮化钠(Na3N)是科学家制备的一种重要化合物。它与水作用可产生氨气(NH3)。试回答下列问题:
①氮化钠(Na3N)中N元素化合价是_______,该化合物属于_______化合物(填“离子”或“共价”,下同),生成的NH3属于_______化合物。
②氮化钠(Na3N)与水反应的方程式是_______。
19.(1)尿素又称碳酰胺,在160℃分解为氨气和异氰酸,请写出尿素的结构式和氨气的空间构型___________;___________。
(2)的沸点高于的沸点的主要原因是___________。
(3)可用于漂白和杀菌,请写出一定条件下与水反应的方程式___________。
20.按要求填空:
(1)柠檬酸的结构简式见图。1mol柠檬酸分子中碳原子与氧原子形成的键的数目为_________mol。
(2)CO2分子中存在_________个键和_________个键。
(3)N2分子中键与键的数目比 _________。
21.下表为长式周期表的一部分,其中的编号代表对应的元素。请回答下列问题:
①
② ③
④ ⑤ ⑥ ⑦
⑧ ⑨ ⑩
(1)表中属于ds区元素的是_______(填元素符号)。
(2)③和⑦形成的一种常见溶剂是_______(填“极性”或“非极性”)分子。
(3)某元素原子的价层电子排布式为nsnnpn+1,该元素原子的未成对电子数为_______;该元素与元素①所形成化合物的水溶液显_______性(填“酸”或“碱”)。
(4)元素④的第一电离能_______元素⑤(填“>”、“=”“<”,下同)的第一电离能;元素⑥的电负性_______元素⑦的电负性。
(5)元素⑦和⑧形成的化合物的电子式为_______。
(6)元素⑨的基态原子简化电子排布式是_______。
22.已知A、B、C、D、E为元素周期表中前四周期元素,且原子序数依次增大,A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E元素位于元素周期表的第11列。试回答下列有关的问题:
(1)E元素位于元素周期表的_______区。
(2)画出A、B、C中第一电离能最大的元素的原子结构式意图,_______;这三种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序_______(写化学式)。
(3)D可形成化合物。
①中配体的模型名称是_______。该化合物中阴离子的中心原子的轨道杂化类型为_______。
②中的键角____的键角(填“>”、<”、“=”),原因是____。
23.铁及其化合物在生活中用途广泛,绿矾(FeSO4·7H2O)是一种常见的中草药成分,失水后可转为FeSO4·H2O,与FeS2可联合制备铁粉精(FexOy)和H2SO4。
i.FeSO4·H2O结构如图所示:
(1)Fe2+价层电子排布式为_________。
(2)比较和分子中的键角大小并给出相应解释:_________。
(3)与和之间的作用力分别为_________。
ii.实验室以 FeCl2溶液为原料制备高密度磁记录材料 Fe/Fe3O4复合物。
(4)在氩气气氛下,向装有50mL1mol L 1FeCl2溶液的三颈烧瓶(装置如图)中逐滴加入 100mL14 mol L 1KOH溶液,用磁力搅拌器持续搅拌,在100℃下回流3h,得到成分为Fe和Fe3O4的黑色沉淀。
①三颈烧瓶发生反应的离子方程式为_________。
②检验反应是否进行完全的操作是_________。
(5)待三颈烧瓶中的混合物冷却后,过滤,再依次用沸水和乙醇洗涤,在40℃干燥后焙烧3h,得到Fe/Fe3O4复合物产品 3.24g。
①焙烧需在隔绝空气条件下进行,原因是_________。
②计算实验所得产品的产率_________。
【参考答案】
一、选择题
1.D
解析:A.电负性相差1.7以上为离子键,电负性相差1.7以下为共价键。同时已成键的电负性大的F、O、N与已成键的H之间可以形成氢键影响物质的熔沸点和溶解度,故A项正确;
B.手性分子发生反应后改变分子中基团,所以手性可能消失,B项正确;
C.分子内的氢键降低物质的熔沸点,C项正确;
D.稀有气体为氮原子分子不存在化学键,D项错误;
故选D。
2.C
【分析】X、Y、Z为原子序数依次增大的短周期元素,Z的核外成对电子数和未成对电子数之比为,Z为N元素,X形成1个共价键,X是H元素;Y能形成4个共价键,其中2个为配位键,该阳离子带1个单位正电荷,所以Y是B元素。
解析:A.由题意可知,X、Y、Z分别为H、B、N,因此电负性:,故A正确;
B.该阳离子中的磞原子分别与两个氮原子形成配位键,1mol该阳离子所含的配位键数为2NA,故B正确;
C.该阳离子中的氮原子没有孤电子对,不具备给电子能力,因此不能与水中的氢原子形成氢键,C错误;
D.H可分别与B、N形成、,其中B、N分别为杂化,其空间结构为正四面体形,故D正确;
故选C。
3.B
【分析】已知该物质为有机金属氯化物的一部分,同时原子序数依次增大,则X为H,Y为C,从结构来看Z为N或P。若Z为P,M只能为S元素,其电子占据的轨道没有充满电子不符合题意,所以Z为N,而M为1s22s22p63s2的Mg。N元素的价层电子排布式为nsn-1np2n-1,n-1=2所以N为Cl。X、Y、Z、M、N分别为H、C、N、Mg、Cl。
解析:A.YN4为CCl4其价层电子对为4对,孤电子对为0,为正四面体结构,A项正确;
B.没有说明简单氢化物,C的氢化物有很多如苯等,无法比较,B项错误;
C.Z的电子排布为1s22s22p3为半满结构稳定难失电子所以其第一电离能大于同周期相邻元素,C项正确;
D.与M同族的基态原子最高能级为ns2,电子云轮廓图为球形,D项正确;
故选B。
4.C
解析:A.碳氢化合物中,C显负价,说明电负性C>H,碳氧化合物中,C显正价,说明电负性O>C,所以电负性:O>C>H,A错误;
B.六氯苯、六溴苯结构高度对称,正负电荷中心重合,为非极性分子,B错误;
C.六氯苯、六溴苯中C原子均位于苯环上,为sp2杂化,苯六酸中C原子为苯环上的碳和碳氧双键中的碳,也为sp2杂化,C正确;
D.苯六酸与六氯苯、六溴苯的水溶性存在明显的差异是因为苯六酸中含有羧基,可以和水分子形成分子间氢键,D错误;
综上所述答案为C。
5.D
解析:A.苯分子中存在的大π键为π,故A错误;
B.CH3CH=CH2分子中不存在大π键,故B错误;
C.HClO分子中不存在大π键,故C错误;
D.SO2分子中S采取sp2杂化,为参与杂化的3p轨道与2个O原子的2p轨道互相平行,形成离域π键,S原子提供2个电子,每个O原子各提供1个电子,故SO2分子中大π键为,故D正确;
故选D。
6.A
解析:A.由图可知,该分子中S原子形成4个键,且没有孤电子对,价层电子对数为4,故A正确;
B.由结构式可知,该分子中与S相连的N原子价层电子对数为2+1=3,杂化方式为杂化,另外两个N原子价层电子对数为2,杂化方式为sp杂化,故B错误;
C.元素的非金属性越强,其电负性越大,由于元素的非金属性: F>O>N>S,则元素的电负性大小顺序为:F>O>N>S,C错误;
D.元素的非金属性越强,其第一电离能越大;同一周期元素从左往右第一电离能呈增大趋势,但第IIA、第VA元素原子核外电子处于全满、半满的稳定状态,其第一电离能比同周期相邻元素的大,故这四种元素的第一电离能大小顺序:F>N>O>S,D错误;
故选A。
7.D
解析:A.甲醇能和水分子形成氢键,导致极易溶于水,故A不符合题意;
B.乙酸能形成氢键,导致其熔点比乙酸乙酯高,故B不符合题意;
C.氨分子间存在氢键,导致其沸点较高,故氨气易液化,故C不符合题意;
D.碘为非极性分子易溶于非极性溶剂四氯化碳,与氢键无关,故D符合题意;
故选D。
8.D
【分析】根据组成结构以及成键特点,X和W只有一个共价键,可能是为H和卤族元素,Y有四个共价键,五种元素原子序数依次增大,且属于短周期元素,因此Y为C,X为H,W应为Cl,一个Z有三个共价键,因此该物质为离子化合物,形成四个键的Z失去一个电子,因此Z为N,Q形成四个共价键中有一个配位键,因此Q为Al。X为H,Y为C,Z为N,Q为Al,W为Cl,据此分析。
解析:A.QW3为AlCl3,氯化铝为分子晶体,熔融状态不导电,因此工业上上常电解氧化铝获得金属铝,故A错误;
B.同一周期,从左到右原子半径依次递减,则半径:Z(N)C.氯的含氧酸可能为强酸,如HClO4,也可能为弱酸,如HClO,故C错误;
D.中Al有4个σ键,无孤电子对数,无孤电子对数,空间构型为正四面体,故D正确;
答案为D。
9.D
解析:A. 明矾是十二水合硫酸铝钾的俗名,其化学式为:KAl(SO4)2·12H2O,故A正确;
B. NH3分子的中心原子氮原子的σ键电子对数为3,孤电子对数为,则氨气分子为三角锥形,故B正确;
C. 铝原子为13号元素,核内质子数=核外电子数=13,其结构示意图为:,故C正确;
D. N2中氮原子之间形成3对共用电子对,每个氮原子周围8个电子,其电子式为:,故D错误;
故选D。
10.D
解析:A.同一能层上的s轨道与p轨道的能量差异不大,杂化轨道是由同一能层上的s轨道与p轨道杂化而成的,A项正确;
B.同种类型的杂化轨道能量相同,B项正确;
C.杂化轨道是由1个s轨道与2个p轨道杂化而成的,C项正确;
D.杂化轨道最多可形成3个键,D项错误。
故选:D。
11.B
解析:A. N4是由氮元素形成的一种单质,不属于化合物,故A错误;
B.氮元素是活泼的非金属,氮元素与氮元素之间形成的是非极性键,故B正确;
C.根据图示,N4是正四面体型结构,键角是60°,故C错误;
D.已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,则1molN4转变成N2时的反应热△H=6×167 kJ/mol-2×942 kJ/mol=-882 kJ/mol,因此1 molN4转变成N2将放出882kJ热量,故D错误;
选B。
12.B
解析:A.电子层数相同时,核电荷数越多,微粒半径越小,微粒半径:O2->F->Na+,A错误;
B.同一主族元素从上向下电负性逐渐减小,电负性:F>Cl>Br,B正确;
C.BF3的中心原子采取sp2杂化,空间构型为平面三角形,键角为120°,CO2的中心原子采取sp杂化,空间构型为直线型,键角为180°,分子中的键角:BF3D.元素非金属性越强,其简单氢化物越稳定,非金属性:O>S,稳定性:H2O>H2S,D错误;
答案选B。
13.D
解析:A.二硫化碳的中心原子C为sp杂化,分子为直线结构,且S原子半径比C的大,A错误;
B.质子教为6的碳原子表示不正确,应为,B错误;
C.为共价晶体,呈空间立体网状结构,没有分子,C错误;
D.Cl-Cl的p-p σ键电子云图形:,D正确;
故选D。
14.D
解析:A.乙烯中含碳碳双键和碳氢键,单键全部是σ键,双键中含一个σ键、一个π键,故乙烯分子中含五个σ键、一个π键,A错误;
B.乙烯的双键中σ键比π键稳定,发生加成反应时断裂的是碳原子间的π键,B错误;
C.乙烯可以在一定条件下与HCl加成制得氯乙烷,在该过程断裂的是碳原子间的π键,C错误;
D.乙烯分子中的π键关于镜面对称,D正确;
故选D。
15.C
解析:A.中含氮氮键叁键,反应中1个键和2个键均断裂,故A错误;
B.C2H2中含碳碳叁键,反应中1个键和2个键均断裂,故B错误;
C.键、键均为单键,反应中仅断裂σ键,故C正确;
D.中含碳碳双键,反应中π键断裂,故D错误;
综上所述,答案为C。
【点睛】一般非金属元素之间形成共价键,单键均为σ键,双键或叁键中只有1个σ键。
二、填空题
16.(1)O>C>H
(2)平面三角形
(3) sp3 sp2
(4)CO2和O2都属于分子晶体,CO2相对分子质量大,范德华力强
解析:(1)C、H、O三种元素非金属性:HC>H;
(2)HCHO中心碳原子杂化类型为sp2杂化,甲醛的空间结构为平面结构;
(3)CH3OH中C原子成4个σ键键、没有孤电子对,价层电子对,杂化轨道数目为4,故其杂化类型为sp3杂化,HCHO分子,C原子成3个σ键、没有孤电子对,价层电子对,杂化轨道数目为3,故其杂化类型为 sp2杂化;
(4)分子晶体的沸点与其相对分子质量成正比,CO2和O2都属于分子晶体,CO2相对分子质量大,范德华力强,CO2的沸点比O2的高。
17. B2O3+3CaF2+3H2SO42BF3↑+3CaSO4+3H2O 120° sp2杂化 正四面体形 CCl4
解析:(1) B2O3、CaF2和H2SO4反应生成BF3 、CaSO4和H2O,反应的化学方程式为B2O3+3CaF2+3H2SO42BF3↑+3CaSO4+3H2O;
(2)在BF3分子中,B原子价电子对数是,无孤电子对,BF3为平面三角形,F-B-F的键角是120°,B原子的杂化轨道类型为sp2杂化;BF3和过量NaF作用可生成NaBF4,BF中B原子价电子对数是,无孤电子对,立体构型为正四面体形;原子数相同、价电子数也相同的微粒互为等电子体,与BF互为等电子体的分子的化学式为CCl4等。
18.(1) 碱性氧化物 CaO+H2O=Ca(OH)2 与酸反应,CaO+2HCl=CaCl2+H2O,与酸性氧化物反应,CaO+CO2=CaCO3
(2) -3价 离子 共价 Na3N+3H2O=NH3↑+3NaOH
解析:(1)生石灰为CaO,属于碱性氧化物。生石灰可与水反应生成氢氧化钙,化学方程式为CaO+H2O=Ca(OH)2,故可用做干燥剂。生石灰还可以和酸反应,如和盐酸反应,化学方程式为CaO+2HCl=CaCl2+H2O,还可以和酸性氧化物反应,如和CO2反应,化学方程式为CaO+CO2=CaCO3。
(2)Na3N中钠为+1价,则N为-3价,钠元素和氮元素分别是活泼的金属元素和活泼的非金属元素,所以二者形成的化合物为离子化合物。NH3中N和H之间通过共价键连接,NH3为共价化合物。Na3N与水反应生成NH3和NaOH,化学方程式为Na3N+3H2O=NH3↑+3NaOH。
19. 三角锥形 分子间存在氢键
解析:(1)尿素在160℃分解为氨气和异氰酸,氨气的分子式为NH3,异氰酸的分子式为HNCO,尿素的分子式为CO(NH2)2,尿素的结构式为;NH3分子中氮原子形成3个键、还有一对孤电子对,所以空间构型是三角锥形。故答案为:;三角锥形。
(2)分子间能形成氢键的氢化物熔沸点较高,和均为分子晶体,而氨气分子间有氢键,分子间没有氢键,氢键的存在导致氨气熔沸点较高。故答案为:分子间存在氢键。
(3)NCl3可用于漂白和杀菌,说明一定条件下与水反应有HClO生成,HClO有漂白和杀菌的作用,则方程式为。故答案为:。
20.(1)7
(2) 2 2
(3)
解析:(1)1个柠檬酸分子中有4个C-O键和3个C=O键,则1mol柠檬酸分子中碳原子与氧原子形成的键共7mol。
(2)CO2的结构式为O=C=O,则1个CO2分子中存在2个键和2个键。
(3)N2的结构式为,则。
21.(1)Cu
(2)非极性
(3) 3 碱
(4) > <
(5)
(6)[Ar]3d44s2
【分析】依据元素在周期表中位置可知:①为H,②为Be,③为C,④为Mg,⑤为Al,⑥为P,⑦为Cl,⑧为Ca,⑨为Ti,⑩为Cu;
解析:(1)ds区包含IB族、IIB族,表中Cu处于第四周期IB族,属于ds区,故答案为:Cu;
(2)C、Cl形成常见溶剂为CCl4,整个分子的正负电荷重心是重合,是非极性分子,故答案为:非极性;
(3)某元素原子的价层电子排布式为nsnnpn+1,n=2,2p能级3个电子分别占据1个轨道,原子有3个单电子,该元素为N元素,与元素①所形成化合物为NH3,其水溶液呈碱性,故答案为:3;碱;
(4)Mg的3s轨道为全充满稳定状态,而Al失去的3p能级的电子,3p电子能量比3sd能量高,故第一电离能Mg>Al;同周期主族元素自左而右电负性增大,故电负性P<Cl,故答案为:>;<;
(5)元素⑦和⑧形成的化合物为CaCl2,由钙离子与氯离子构成,其电子式为;
(6)元素⑨处于第四周期第IVB族,基态原子核外电子排布式为1s22s22p63s23p63d24s2,故答案为:[Ar]3d44s2。
22.(1)ds
(2) NaOH>H3PO4>HClO4
(3) 四面体 sp2 < 中无孤电子对,而H2O中含有两对孤对电子,孤电子对对成键电子对的排斥作用大于成键电子对之间的排斥作用
【分析】A、B、C、D、E为元素周期表中前四周期元素,且原子序数依次增大。A是短周期中原子半径最大的元素,则A为Na元素;B元素3p能级半充满,则B的价电子排布为3s23p3,则B为P元素;C是所在周期电负性最大的元素,在第VIIA族,原子序数比P大,所以为Cl元素;D是第四周期未成对电子最多的元素,为Cr元素;E元素位于元素周期表的第11列,为Cu元素。
解析:(1)E为Cu元素,价电子排布式为3d104s1,E元素位于元素周期表的ds区;
(2)A、B、C分别为Na、P、Cl,同周期元素从左到右第一电离能增大,第一电离能最大的元素是Cl,为17号元素,其原子结构式意图为;最高价氧化物的水化物的碱性越强,溶液的pH越大,酸性越强,pH越小,物质的量浓度相同时,pH由大到小的顺序NaOH>H3PO4>HClO4;
(3)①[Cu(H2O)6](NO3)3中配位体为H2O,H2O中O的价层电子对数为2+=4,H2O的VSEPR模型名称是四面体;该化合物中阴离子的中心原子的价层电子对数为3+=3,轨道杂化类型为sp2;故答案为:四面体;sp2;
②中无孤电子对,而H2O中含有两对孤对电子,孤电子对对成键电子对的排斥作用大于成键电子对之间的排斥作用,则的键角<的键角;
23.(1)3d6
(2)中心原子硫原子不存在孤对电子、和中心原子氧原子有2对孤对电子,孤电子对与成键电子对之间的斥力较大,故中的键角大于中的键角
(3)配位键、氢键
(4) 取样品,滴加KSCN溶液,溶液不变色,再滴加氯水,溶液仍不变色,说明反应进行完全
(5) 防止复合物产品中铁被空气中氧气氧化 90.0%
【分析】FeCl2溶液逐滴加入KOH溶液得到成分为Fe和Fe3O4的黑色沉淀,分离出固体用沸水和乙醇洗涤,在40℃干燥后焙烧3h,得到Fe/Fe3O4复合物产品;
解析:(1)Fe2+为铁原子失去2个电子后形成的离子,价层电子排布式为3d6;
(2)孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力;中心原子硫原子不存在孤对电子、中心原子氧原子有2对孤对电子,孤电子对与成键电子对之间的斥力较大,故中的键角大于中的键角;
(3)由图可知,亚铁离子提供空轨道、提供孤对电子两者形成配位键;氧的电负性较大,故和之间形成氢键;
(4)①FeCl2溶液逐滴加入KOH溶液得到成分为Fe和Fe3O4的黑色沉淀,则三颈烧瓶发生反应的离子方程式为。
②检验反应是否进行完全,就是检验是否还存在亚铁离子,亚铁离子能被氯水氧化使KSCN溶液变红色的铁离子,故操作为:取样品,滴加KSCN溶液,溶液不变色,再滴加氯水,溶液仍不变色,说明反应进行完全;
(5)①空气中氧气具有氧化性,焙烧需在隔绝空气条件下进行,原因是防止复合物产品中铁被空气中氧气氧化。
②50mL1mol L 1FeCl2溶液中铁元素为0.05mol,根据可知生成Fe、Fe3O4各0.0125mol,故实验所得产品的产率为
一、选择题
1.下列叙述不正确的是
A.元素电负性的大小不但影响形成物质的化学性质,还影响其物理性质
B.手性分子发生化学变化后手性可能消失
C.氢键的存在可能使物质的熔沸点降低
D.气体单质中一定存在σ键,可能存在π键
2.某离子化合物中的阳离子结构模型如图。已知X、Y、Z为原子序数依次增大的短周期元素,Z的核外成对电子数和未成对电子数之比为。下列说法错误的是
A.X、Y、Z原子的电负性大小为Z>X>Y
B.1mol该阳离子所含的配位键数为2NA(NA为阿伏加德罗常数的值)
C.该阳离子可与水中的氢原子形成氢键
D.X分别能与Y、Z形成正四面体形的离子
3.有机金属氯化物由原子序数依次增大的短周期主族元素X、Y、Z、M、N组成,部分结构如图所示,基态原子M核外电子所占据原子轨道全充满,N元素的价层电子排布式为nsn-1np2n-1。下列说法错误的是
A.YN4为正四面体结构
B.氢化物的沸点Z>Y
C.Z元素的第一电离能比同周期相邻元素的大
D.与M同族元素的基态原子最高能级的电子云轮廓图呈球形
4.石墨烯具有优异的光学、电学、力学特性,在材料学、微纳加工、能源和生物医学等方面具有广阔的应用前景,石墨烯可采用化学方法制备,如以六氯苯、六溴苯为原料可制备石墨烯。下表是六氯苯、六溴苯、苯六酸的熔点和水溶性:
物质 六氯苯 六溴苯 苯六酸
熔点/℃ 231 325 287
水溶性 不溶 不溶 易溶
下列说法正确的是
A.苯六酸所含元素的电负性:C>O>H
B.从结构上看,六氯苯、六溴苯和苯六酸均为极性分子
C.六氯苯、六溴苯和苯六酸分子中C的杂化方式均为sp2杂化
D.苯六酸与六氯苯、六溴苯的水溶性存在明显的差异是因为其分子结构庞大
5.分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。臭氧分子中的大π键可表示为(),下列分子中含有大π键且为的是
A. B.CH3CH=CH2 C.HClO D.SO2
6.我国科研人员发现氟磺酰基叠氮是一种安全、高效的“点击化学”试剂,其结构式如图,其中S为价。下列说法正确的是。
A.该分子中S原子的价层电子对数为4 B.该分子中N原子均为杂化
C.电负性:F>O>S>N D.第一电离能:F>O>N>S
7.下列物质的性质中,与氢键无关的是
A.甲醇极易溶于水
B.乙酸的熔点比乙酸乙酯高
C.氨气易液化
D.碘易溶于四氯化碳
8.某种电化学的电解液的组成如图所示,X、Y、Z、Q、W为原子序数依次增大的短周期元素,下列说法正确的是
A.电解熔融可获得Q的单质 B.原子半径:
C.W的含氧酸均为强酸 D.QW的空间构型为正四面体
9.下列化学用语的表述错误的是
A.明矾的化学式:KAl(SO4)2·12H2O B.NH3分子的球棍模型:
C.铝原子的结构示意图: D.N2的电子式:
10.下列有关杂化轨道的说法错误的是
A.由同一能层上的s轨道与p轨道杂化而成
B.所形成的3个杂化轨道的能量相同
C.每个杂化轨道中s能级成分占三分之一
D.杂化轨道最多可形成2个键
11.气态N4分子,其分子结构如下图所示。已知断裂1molN—N吸收167kJ热量,生成1molN≡N放出942kJ热量,判断下列说法正确的是
A.N4属于一种新型的化合物 B.N4分子中存在非极性键
C.N4分子中N—N键角为109°28′ D.1molN4转变成N2将吸收882kJ热量
12.以下比较,正确的是
A.微粒半径:F->O2->Na+ B.电负性:F>Cl>Br
C.分子中的键角:BF3>CO2 D.稳定性:H2O<H2S
13.下列有关化学用语表示正确的是
A.二硫化碳的空间填充模型: B.是的原子结构示意图
C.固体的电子式: D.Cl-Cl的p-p σ键电子云图形:
14.乙烯是一种常用的催熟剂,下列对于乙烯中化学键的分析中正确的是
A.在乙烯分子中有一个σ键、一个π键
B.乙烯在发生加成反应时,断裂的是碳原子间的σ键
C.乙烯可以在一定条件下制得氯乙烷,在该过程断裂的是C-Hσ键
D.乙烯分子中的π键关于镜面对称
15.下列化学反应所断裂的共价键中,仅断裂键的是
A.
B.
C.
D.
二、填空题
16.甲醇(CH3OH)空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为2CH3OH+O22+2H2O
(1)C、H、O 三种元素的电负性由大到小的顺序为_______。
(2)HCHO的空间结构为_______。
(3)CH3OH和HCHO分子中碳原子的杂化轨道类型分别为_______和_______。
(4)甲醇氧化生成HCHO时,会产生CO、CO2、CH3OCH3等副产物。相同条件下,CO2的沸点比O2的高,主要原因为_______。
17.氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3气体和BN,如图所示:
请回答下列问题:
(1)由B2O3、CaF2和H2SO4制备BF3的化学方程式为_______;
(2)在BF3分子中,F-B-F的键角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF4,BF的立体构型为_______;与BF互为等电子体的分子的化学式为_______(写一种)。
18.回答下列问题:
(1)同学们吃的零食的包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
①生石灰属于哪种类型的物质?_______。
②生石灰可做干燥剂的理由是(用化学方程式表示)_______。
③生石灰还可以跟哪些类别的物质发生化学反应?列举两例,并写出化学方程式:_______ 。
(2)氮化钠(Na3N)是科学家制备的一种重要化合物。它与水作用可产生氨气(NH3)。试回答下列问题:
①氮化钠(Na3N)中N元素化合价是_______,该化合物属于_______化合物(填“离子”或“共价”,下同),生成的NH3属于_______化合物。
②氮化钠(Na3N)与水反应的方程式是_______。
19.(1)尿素又称碳酰胺,在160℃分解为氨气和异氰酸,请写出尿素的结构式和氨气的空间构型___________;___________。
(2)的沸点高于的沸点的主要原因是___________。
(3)可用于漂白和杀菌,请写出一定条件下与水反应的方程式___________。
20.按要求填空:
(1)柠檬酸的结构简式见图。1mol柠檬酸分子中碳原子与氧原子形成的键的数目为_________mol。
(2)CO2分子中存在_________个键和_________个键。
(3)N2分子中键与键的数目比 _________。
21.下表为长式周期表的一部分,其中的编号代表对应的元素。请回答下列问题:
①
② ③
④ ⑤ ⑥ ⑦
⑧ ⑨ ⑩
(1)表中属于ds区元素的是_______(填元素符号)。
(2)③和⑦形成的一种常见溶剂是_______(填“极性”或“非极性”)分子。
(3)某元素原子的价层电子排布式为nsnnpn+1,该元素原子的未成对电子数为_______;该元素与元素①所形成化合物的水溶液显_______性(填“酸”或“碱”)。
(4)元素④的第一电离能_______元素⑤(填“>”、“=”“<”,下同)的第一电离能;元素⑥的电负性_______元素⑦的电负性。
(5)元素⑦和⑧形成的化合物的电子式为_______。
(6)元素⑨的基态原子简化电子排布式是_______。
22.已知A、B、C、D、E为元素周期表中前四周期元素,且原子序数依次增大,A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E元素位于元素周期表的第11列。试回答下列有关的问题:
(1)E元素位于元素周期表的_______区。
(2)画出A、B、C中第一电离能最大的元素的原子结构式意图,_______;这三种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序_______(写化学式)。
(3)D可形成化合物。
①中配体的模型名称是_______。该化合物中阴离子的中心原子的轨道杂化类型为_______。
②中的键角____的键角(填“>”、<”、“=”),原因是____。
23.铁及其化合物在生活中用途广泛,绿矾(FeSO4·7H2O)是一种常见的中草药成分,失水后可转为FeSO4·H2O,与FeS2可联合制备铁粉精(FexOy)和H2SO4。
i.FeSO4·H2O结构如图所示:
(1)Fe2+价层电子排布式为_________。
(2)比较和分子中的键角大小并给出相应解释:_________。
(3)与和之间的作用力分别为_________。
ii.实验室以 FeCl2溶液为原料制备高密度磁记录材料 Fe/Fe3O4复合物。
(4)在氩气气氛下,向装有50mL1mol L 1FeCl2溶液的三颈烧瓶(装置如图)中逐滴加入 100mL14 mol L 1KOH溶液,用磁力搅拌器持续搅拌,在100℃下回流3h,得到成分为Fe和Fe3O4的黑色沉淀。
①三颈烧瓶发生反应的离子方程式为_________。
②检验反应是否进行完全的操作是_________。
(5)待三颈烧瓶中的混合物冷却后,过滤,再依次用沸水和乙醇洗涤,在40℃干燥后焙烧3h,得到Fe/Fe3O4复合物产品 3.24g。
①焙烧需在隔绝空气条件下进行,原因是_________。
②计算实验所得产品的产率_________。
【参考答案】
一、选择题
1.D
解析:A.电负性相差1.7以上为离子键,电负性相差1.7以下为共价键。同时已成键的电负性大的F、O、N与已成键的H之间可以形成氢键影响物质的熔沸点和溶解度,故A项正确;
B.手性分子发生反应后改变分子中基团,所以手性可能消失,B项正确;
C.分子内的氢键降低物质的熔沸点,C项正确;
D.稀有气体为氮原子分子不存在化学键,D项错误;
故选D。
2.C
【分析】X、Y、Z为原子序数依次增大的短周期元素,Z的核外成对电子数和未成对电子数之比为,Z为N元素,X形成1个共价键,X是H元素;Y能形成4个共价键,其中2个为配位键,该阳离子带1个单位正电荷,所以Y是B元素。
解析:A.由题意可知,X、Y、Z分别为H、B、N,因此电负性:,故A正确;
B.该阳离子中的磞原子分别与两个氮原子形成配位键,1mol该阳离子所含的配位键数为2NA,故B正确;
C.该阳离子中的氮原子没有孤电子对,不具备给电子能力,因此不能与水中的氢原子形成氢键,C错误;
D.H可分别与B、N形成、,其中B、N分别为杂化,其空间结构为正四面体形,故D正确;
故选C。
3.B
【分析】已知该物质为有机金属氯化物的一部分,同时原子序数依次增大,则X为H,Y为C,从结构来看Z为N或P。若Z为P,M只能为S元素,其电子占据的轨道没有充满电子不符合题意,所以Z为N,而M为1s22s22p63s2的Mg。N元素的价层电子排布式为nsn-1np2n-1,n-1=2所以N为Cl。X、Y、Z、M、N分别为H、C、N、Mg、Cl。
解析:A.YN4为CCl4其价层电子对为4对,孤电子对为0,为正四面体结构,A项正确;
B.没有说明简单氢化物,C的氢化物有很多如苯等,无法比较,B项错误;
C.Z的电子排布为1s22s22p3为半满结构稳定难失电子所以其第一电离能大于同周期相邻元素,C项正确;
D.与M同族的基态原子最高能级为ns2,电子云轮廓图为球形,D项正确;
故选B。
4.C
解析:A.碳氢化合物中,C显负价,说明电负性C>H,碳氧化合物中,C显正价,说明电负性O>C,所以电负性:O>C>H,A错误;
B.六氯苯、六溴苯结构高度对称,正负电荷中心重合,为非极性分子,B错误;
C.六氯苯、六溴苯中C原子均位于苯环上,为sp2杂化,苯六酸中C原子为苯环上的碳和碳氧双键中的碳,也为sp2杂化,C正确;
D.苯六酸与六氯苯、六溴苯的水溶性存在明显的差异是因为苯六酸中含有羧基,可以和水分子形成分子间氢键,D错误;
综上所述答案为C。
5.D
解析:A.苯分子中存在的大π键为π,故A错误;
B.CH3CH=CH2分子中不存在大π键,故B错误;
C.HClO分子中不存在大π键,故C错误;
D.SO2分子中S采取sp2杂化,为参与杂化的3p轨道与2个O原子的2p轨道互相平行,形成离域π键,S原子提供2个电子,每个O原子各提供1个电子,故SO2分子中大π键为,故D正确;
故选D。
6.A
解析:A.由图可知,该分子中S原子形成4个键,且没有孤电子对,价层电子对数为4,故A正确;
B.由结构式可知,该分子中与S相连的N原子价层电子对数为2+1=3,杂化方式为杂化,另外两个N原子价层电子对数为2,杂化方式为sp杂化,故B错误;
C.元素的非金属性越强,其电负性越大,由于元素的非金属性: F>O>N>S,则元素的电负性大小顺序为:F>O>N>S,C错误;
D.元素的非金属性越强,其第一电离能越大;同一周期元素从左往右第一电离能呈增大趋势,但第IIA、第VA元素原子核外电子处于全满、半满的稳定状态,其第一电离能比同周期相邻元素的大,故这四种元素的第一电离能大小顺序:F>N>O>S,D错误;
故选A。
7.D
解析:A.甲醇能和水分子形成氢键,导致极易溶于水,故A不符合题意;
B.乙酸能形成氢键,导致其熔点比乙酸乙酯高,故B不符合题意;
C.氨分子间存在氢键,导致其沸点较高,故氨气易液化,故C不符合题意;
D.碘为非极性分子易溶于非极性溶剂四氯化碳,与氢键无关,故D符合题意;
故选D。
8.D
【分析】根据组成结构以及成键特点,X和W只有一个共价键,可能是为H和卤族元素,Y有四个共价键,五种元素原子序数依次增大,且属于短周期元素,因此Y为C,X为H,W应为Cl,一个Z有三个共价键,因此该物质为离子化合物,形成四个键的Z失去一个电子,因此Z为N,Q形成四个共价键中有一个配位键,因此Q为Al。X为H,Y为C,Z为N,Q为Al,W为Cl,据此分析。
解析:A.QW3为AlCl3,氯化铝为分子晶体,熔融状态不导电,因此工业上上常电解氧化铝获得金属铝,故A错误;
B.同一周期,从左到右原子半径依次递减,则半径:Z(N)
D.中Al有4个σ键,无孤电子对数,无孤电子对数,空间构型为正四面体,故D正确;
答案为D。
9.D
解析:A. 明矾是十二水合硫酸铝钾的俗名,其化学式为:KAl(SO4)2·12H2O,故A正确;
B. NH3分子的中心原子氮原子的σ键电子对数为3,孤电子对数为,则氨气分子为三角锥形,故B正确;
C. 铝原子为13号元素,核内质子数=核外电子数=13,其结构示意图为:,故C正确;
D. N2中氮原子之间形成3对共用电子对,每个氮原子周围8个电子,其电子式为:,故D错误;
故选D。
10.D
解析:A.同一能层上的s轨道与p轨道的能量差异不大,杂化轨道是由同一能层上的s轨道与p轨道杂化而成的,A项正确;
B.同种类型的杂化轨道能量相同,B项正确;
C.杂化轨道是由1个s轨道与2个p轨道杂化而成的,C项正确;
D.杂化轨道最多可形成3个键,D项错误。
故选:D。
11.B
解析:A. N4是由氮元素形成的一种单质,不属于化合物,故A错误;
B.氮元素是活泼的非金属,氮元素与氮元素之间形成的是非极性键,故B正确;
C.根据图示,N4是正四面体型结构,键角是60°,故C错误;
D.已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,则1molN4转变成N2时的反应热△H=6×167 kJ/mol-2×942 kJ/mol=-882 kJ/mol,因此1 molN4转变成N2将放出882kJ热量,故D错误;
选B。
12.B
解析:A.电子层数相同时,核电荷数越多,微粒半径越小,微粒半径:O2->F->Na+,A错误;
B.同一主族元素从上向下电负性逐渐减小,电负性:F>Cl>Br,B正确;
C.BF3的中心原子采取sp2杂化,空间构型为平面三角形,键角为120°,CO2的中心原子采取sp杂化,空间构型为直线型,键角为180°,分子中的键角:BF3
答案选B。
13.D
解析:A.二硫化碳的中心原子C为sp杂化,分子为直线结构,且S原子半径比C的大,A错误;
B.质子教为6的碳原子表示不正确,应为,B错误;
C.为共价晶体,呈空间立体网状结构,没有分子,C错误;
D.Cl-Cl的p-p σ键电子云图形:,D正确;
故选D。
14.D
解析:A.乙烯中含碳碳双键和碳氢键,单键全部是σ键,双键中含一个σ键、一个π键,故乙烯分子中含五个σ键、一个π键,A错误;
B.乙烯的双键中σ键比π键稳定,发生加成反应时断裂的是碳原子间的π键,B错误;
C.乙烯可以在一定条件下与HCl加成制得氯乙烷,在该过程断裂的是碳原子间的π键,C错误;
D.乙烯分子中的π键关于镜面对称,D正确;
故选D。
15.C
解析:A.中含氮氮键叁键,反应中1个键和2个键均断裂,故A错误;
B.C2H2中含碳碳叁键,反应中1个键和2个键均断裂,故B错误;
C.键、键均为单键,反应中仅断裂σ键,故C正确;
D.中含碳碳双键,反应中π键断裂,故D错误;
综上所述,答案为C。
【点睛】一般非金属元素之间形成共价键,单键均为σ键,双键或叁键中只有1个σ键。
二、填空题
16.(1)O>C>H
(2)平面三角形
(3) sp3 sp2
(4)CO2和O2都属于分子晶体,CO2相对分子质量大,范德华力强
解析:(1)C、H、O三种元素非金属性:H
(2)HCHO中心碳原子杂化类型为sp2杂化,甲醛的空间结构为平面结构;
(3)CH3OH中C原子成4个σ键键、没有孤电子对,价层电子对,杂化轨道数目为4,故其杂化类型为sp3杂化,HCHO分子,C原子成3个σ键、没有孤电子对,价层电子对,杂化轨道数目为3,故其杂化类型为 sp2杂化;
(4)分子晶体的沸点与其相对分子质量成正比,CO2和O2都属于分子晶体,CO2相对分子质量大,范德华力强,CO2的沸点比O2的高。
17. B2O3+3CaF2+3H2SO42BF3↑+3CaSO4+3H2O 120° sp2杂化 正四面体形 CCl4
解析:(1) B2O3、CaF2和H2SO4反应生成BF3 、CaSO4和H2O,反应的化学方程式为B2O3+3CaF2+3H2SO42BF3↑+3CaSO4+3H2O;
(2)在BF3分子中,B原子价电子对数是,无孤电子对,BF3为平面三角形,F-B-F的键角是120°,B原子的杂化轨道类型为sp2杂化;BF3和过量NaF作用可生成NaBF4,BF中B原子价电子对数是,无孤电子对,立体构型为正四面体形;原子数相同、价电子数也相同的微粒互为等电子体,与BF互为等电子体的分子的化学式为CCl4等。
18.(1) 碱性氧化物 CaO+H2O=Ca(OH)2 与酸反应,CaO+2HCl=CaCl2+H2O,与酸性氧化物反应,CaO+CO2=CaCO3
(2) -3价 离子 共价 Na3N+3H2O=NH3↑+3NaOH
解析:(1)生石灰为CaO,属于碱性氧化物。生石灰可与水反应生成氢氧化钙,化学方程式为CaO+H2O=Ca(OH)2,故可用做干燥剂。生石灰还可以和酸反应,如和盐酸反应,化学方程式为CaO+2HCl=CaCl2+H2O,还可以和酸性氧化物反应,如和CO2反应,化学方程式为CaO+CO2=CaCO3。
(2)Na3N中钠为+1价,则N为-3价,钠元素和氮元素分别是活泼的金属元素和活泼的非金属元素,所以二者形成的化合物为离子化合物。NH3中N和H之间通过共价键连接,NH3为共价化合物。Na3N与水反应生成NH3和NaOH,化学方程式为Na3N+3H2O=NH3↑+3NaOH。
19. 三角锥形 分子间存在氢键
解析:(1)尿素在160℃分解为氨气和异氰酸,氨气的分子式为NH3,异氰酸的分子式为HNCO,尿素的分子式为CO(NH2)2,尿素的结构式为;NH3分子中氮原子形成3个键、还有一对孤电子对,所以空间构型是三角锥形。故答案为:;三角锥形。
(2)分子间能形成氢键的氢化物熔沸点较高,和均为分子晶体,而氨气分子间有氢键,分子间没有氢键,氢键的存在导致氨气熔沸点较高。故答案为:分子间存在氢键。
(3)NCl3可用于漂白和杀菌,说明一定条件下与水反应有HClO生成,HClO有漂白和杀菌的作用,则方程式为。故答案为:。
20.(1)7
(2) 2 2
(3)
解析:(1)1个柠檬酸分子中有4个C-O键和3个C=O键,则1mol柠檬酸分子中碳原子与氧原子形成的键共7mol。
(2)CO2的结构式为O=C=O,则1个CO2分子中存在2个键和2个键。
(3)N2的结构式为,则。
21.(1)Cu
(2)非极性
(3) 3 碱
(4) > <
(5)
(6)[Ar]3d44s2
【分析】依据元素在周期表中位置可知:①为H,②为Be,③为C,④为Mg,⑤为Al,⑥为P,⑦为Cl,⑧为Ca,⑨为Ti,⑩为Cu;
解析:(1)ds区包含IB族、IIB族,表中Cu处于第四周期IB族,属于ds区,故答案为:Cu;
(2)C、Cl形成常见溶剂为CCl4,整个分子的正负电荷重心是重合,是非极性分子,故答案为:非极性;
(3)某元素原子的价层电子排布式为nsnnpn+1,n=2,2p能级3个电子分别占据1个轨道,原子有3个单电子,该元素为N元素,与元素①所形成化合物为NH3,其水溶液呈碱性,故答案为:3;碱;
(4)Mg的3s轨道为全充满稳定状态,而Al失去的3p能级的电子,3p电子能量比3sd能量高,故第一电离能Mg>Al;同周期主族元素自左而右电负性增大,故电负性P<Cl,故答案为:>;<;
(5)元素⑦和⑧形成的化合物为CaCl2,由钙离子与氯离子构成,其电子式为;
(6)元素⑨处于第四周期第IVB族,基态原子核外电子排布式为1s22s22p63s23p63d24s2,故答案为:[Ar]3d44s2。
22.(1)ds
(2) NaOH>H3PO4>HClO4
(3) 四面体 sp2 < 中无孤电子对,而H2O中含有两对孤对电子,孤电子对对成键电子对的排斥作用大于成键电子对之间的排斥作用
【分析】A、B、C、D、E为元素周期表中前四周期元素,且原子序数依次增大。A是短周期中原子半径最大的元素,则A为Na元素;B元素3p能级半充满,则B的价电子排布为3s23p3,则B为P元素;C是所在周期电负性最大的元素,在第VIIA族,原子序数比P大,所以为Cl元素;D是第四周期未成对电子最多的元素,为Cr元素;E元素位于元素周期表的第11列,为Cu元素。
解析:(1)E为Cu元素,价电子排布式为3d104s1,E元素位于元素周期表的ds区;
(2)A、B、C分别为Na、P、Cl,同周期元素从左到右第一电离能增大,第一电离能最大的元素是Cl,为17号元素,其原子结构式意图为;最高价氧化物的水化物的碱性越强,溶液的pH越大,酸性越强,pH越小,物质的量浓度相同时,pH由大到小的顺序NaOH>H3PO4>HClO4;
(3)①[Cu(H2O)6](NO3)3中配位体为H2O,H2O中O的价层电子对数为2+=4,H2O的VSEPR模型名称是四面体;该化合物中阴离子的中心原子的价层电子对数为3+=3,轨道杂化类型为sp2;故答案为:四面体;sp2;
②中无孤电子对,而H2O中含有两对孤对电子,孤电子对对成键电子对的排斥作用大于成键电子对之间的排斥作用,则的键角<的键角;
23.(1)3d6
(2)中心原子硫原子不存在孤对电子、和中心原子氧原子有2对孤对电子,孤电子对与成键电子对之间的斥力较大,故中的键角大于中的键角
(3)配位键、氢键
(4) 取样品,滴加KSCN溶液,溶液不变色,再滴加氯水,溶液仍不变色,说明反应进行完全
(5) 防止复合物产品中铁被空气中氧气氧化 90.0%
【分析】FeCl2溶液逐滴加入KOH溶液得到成分为Fe和Fe3O4的黑色沉淀,分离出固体用沸水和乙醇洗涤,在40℃干燥后焙烧3h,得到Fe/Fe3O4复合物产品;
解析:(1)Fe2+为铁原子失去2个电子后形成的离子,价层电子排布式为3d6;
(2)孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力;中心原子硫原子不存在孤对电子、中心原子氧原子有2对孤对电子,孤电子对与成键电子对之间的斥力较大,故中的键角大于中的键角;
(3)由图可知,亚铁离子提供空轨道、提供孤对电子两者形成配位键;氧的电负性较大,故和之间形成氢键;
(4)①FeCl2溶液逐滴加入KOH溶液得到成分为Fe和Fe3O4的黑色沉淀,则三颈烧瓶发生反应的离子方程式为。
②检验反应是否进行完全,就是检验是否还存在亚铁离子,亚铁离子能被氯水氧化使KSCN溶液变红色的铁离子,故操作为:取样品,滴加KSCN溶液,溶液不变色,再滴加氯水,溶液仍不变色,说明反应进行完全;
(5)①空气中氧气具有氧化性,焙烧需在隔绝空气条件下进行,原因是防止复合物产品中铁被空气中氧气氧化。
②50mL1mol L 1FeCl2溶液中铁元素为0.05mol,根据可知生成Fe、Fe3O4各0.0125mol,故实验所得产品的产率为
