专题4 生活中常用的有机物--烃的含氧衍生物 单元检测题(含答案) 2022-2023学年高二下学期化学苏教版(2019)选择性必修3
文档属性
| 名称 | 专题4 生活中常用的有机物--烃的含氧衍生物 单元检测题(含答案) 2022-2023学年高二下学期化学苏教版(2019)选择性必修3 |  | |
| 格式 | docx | ||
| 文件大小 | 724.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-26 16:27:24 | ||
图片预览



文档简介
专题4《生活中常用的有机物—烃的含氧衍生物》单元检测题
一、单选题(共13题)
1.化合物Y具有抗菌、消炎作用,可由X制得。下列有关化合物X、Y的说法不正确的是
A.Y与乙醇发生酯化反应可得到X B.1mol X最多能与3mol NaOH反应
C.X、Y均能与酸性KMnO4溶液反应 D.1mol Y最多可以与8molH2发生加成反应
2.实验室中欲分离乙酸乙酯、乙酸、乙醇的混合物,如图是分离操作流程图 ( )
A.①蒸馏 ②过滤 ③分液 B.①分液 ②蒸馏 ③结晶
C.①蒸馏 ②分液 ③分液 D.①分液 ②蒸馏 ③蒸馏
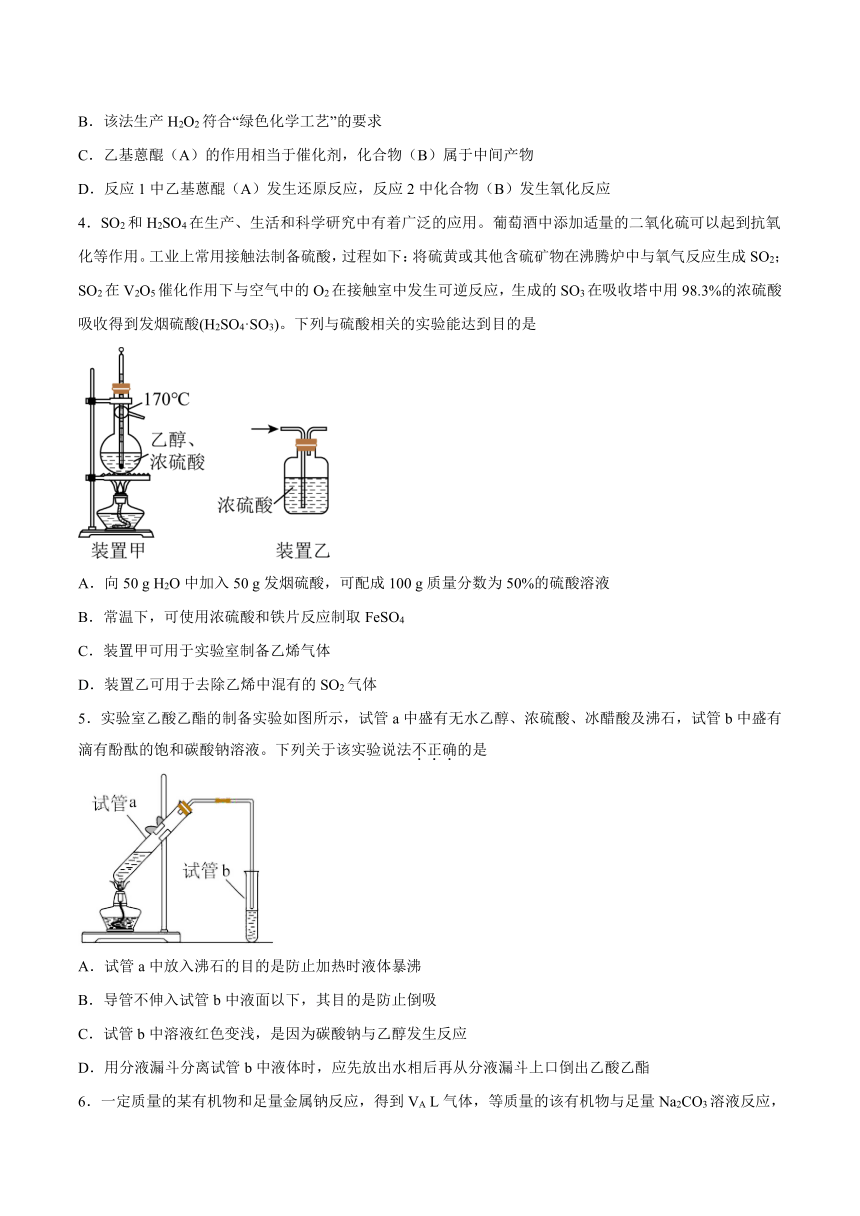
3.“绿色化学”是当今社会人们提出的一个新概念,“绿色化学”工艺中原子利用率为100%。工业上可用乙基蒽醌(A)经两步反应制备H2O2,其反应可简单表示如下(条件省略):
下列有关说法不正确的是
A.上述工业生产消耗的原料是H2.O2和乙基蒽醌
B.该法生产H2O2符合“绿色化学工艺”的要求
C.乙基蒽醌(A)的作用相当于催化剂,化合物(B)属于中间产物
D.反应1中乙基蒽醌(A)发生还原反应,反应2中化合物(B)发生氧化反应
4.SO2和H2SO4在生产、生活和科学研究中有着广泛的应用。葡萄酒中添加适量的二氧化硫可以起到抗氧化等作用。工业上常用接触法制备硫酸,过程如下:将硫黄或其他含硫矿物在沸腾炉中与氧气反应生成SO2;SO2在V2O5催化作用下与空气中的O2在接触室中发生可逆反应,生成的SO3在吸收塔中用98.3%的浓硫酸吸收得到发烟硫酸(H2SO4·SO3)。下列与硫酸相关的实验能达到目的是
A.向50 g H2O中加入50 g发烟硫酸,可配成100 g质量分数为50%的硫酸溶液
B.常温下,可使用浓硫酸和铁片反应制取FeSO4
C.装置甲可用于实验室制备乙烯气体
D.装置乙可用于去除乙烯中混有的SO2气体
5.实验室乙酸乙酯的制备实验如图所示,试管a中盛有无水乙醇、浓硫酸、冰醋酸及沸石,试管b中盛有滴有酚酞的饱和碳酸钠溶液。下列关于该实验说法不正确的是
A.试管a中放入沸石的目的是防止加热时液体暴沸
B.导管不伸入试管b中液面以下,其目的是防止倒吸
C.试管b中溶液红色变浅,是因为碳酸钠与乙醇发生反应
D.用分液漏斗分离试管b中液体时,应先放出水相后再从分液漏斗上口倒出乙酸乙酯
6.一定质量的某有机物和足量金属钠反应,得到VA L气体,等质量的该有机物与足量Na2CO3溶液反应,可得VB L气体,已知同温同压下VA>VB.则该有机物可能是( )
A.HO(CH2)2CHO B.CH3CH(OH)COOH C.HOOC﹣COOH D.HO﹣CH2﹣CH2﹣OH
7.下列离子方程式正确的是
A.把通入苯酚钠溶液中:
B.室温下稀与铜反应:
C.磁性氧化铁溶于稀:
D.向稀溶液中加入过量稀氨水:
8.化学与生产、生活密切相关,下列说法错误的是
A.油脂可用于生产肥皂 B.碳酸氢铵可作为复合膨松剂的成分
C.氧化铁常用作油漆的红色颜料 D.苯甲酸及其钠盐常用作食品抗氧化剂
9.从葡萄籽中提取的原花青素结构如图,原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病。有关原花青素的下列说法不正确的是
A.该物质既可看做醇类,也可看做酚类
B.1mol该物质可与4molBr2反应
C.1mol该物质可与7molNaOH反应
D.1mol该物质可与7molNa反应
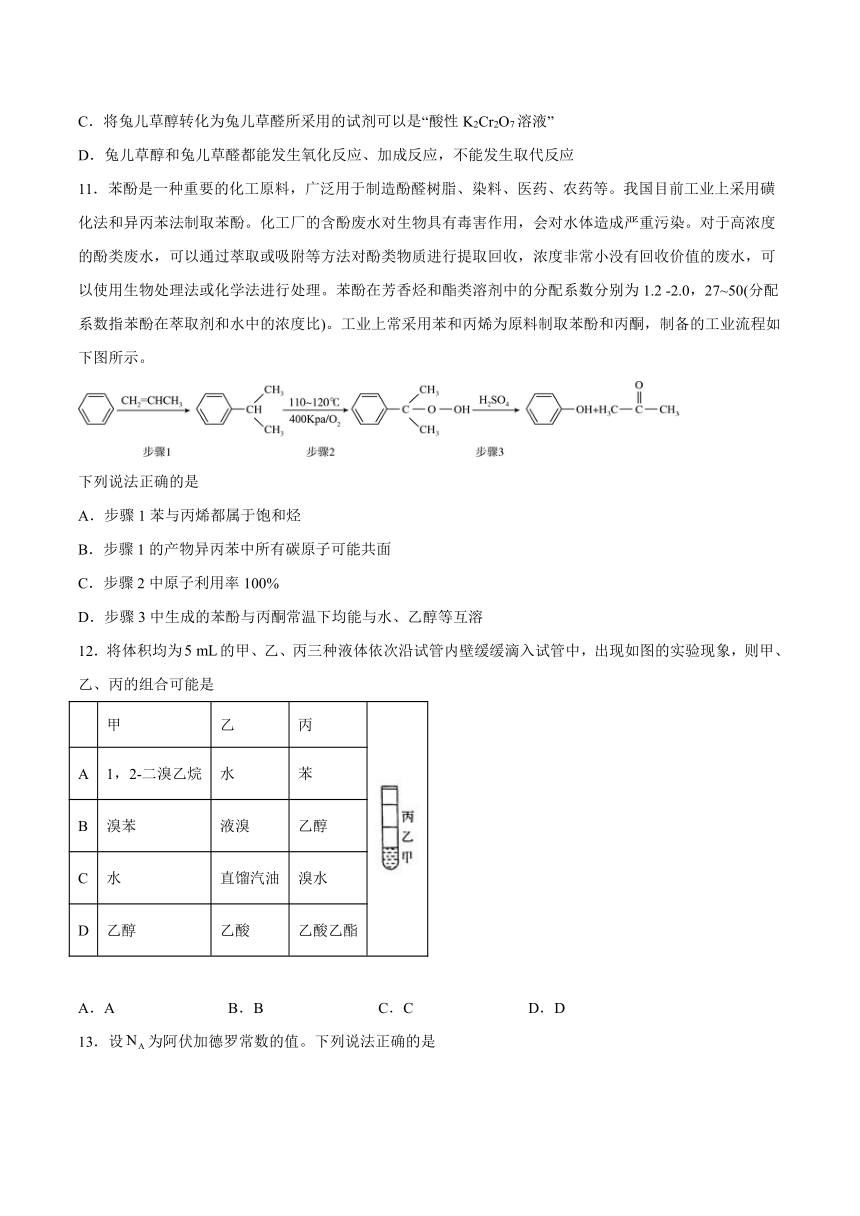
10.兔儿草醛是一种常见的香料添加剂。由兔儿草醇制备兔儿草醛的反应如图,下列说法正确的是
A.兔儿草醛的分子结构中苯环上的二溴代物有4种
B.兔儿草醇最多能与3mol H2发生加成反应
C.将兔儿草醇转化为兔儿草醛所采用的试剂可以是“酸性K2Cr2O7溶液”
D.兔儿草醇和兔儿草醛都能发生氧化反应、加成反应,不能发生取代反应
11.苯酚是一种重要的化工原料,广泛用于制造酚醛树脂、染料、医药、农药等。我国目前工业上采用磺化法和异丙苯法制取苯酚。化工厂的含酚废水对生物具有毒害作用,会对水体造成严重污染。对于高浓度的酚类废水,可以通过萃取或吸附等方法对酚类物质进行提取回收,浓度非常小没有回收价值的废水,可以使用生物处理法或化学法进行处理。苯酚在芳香烃和酯类溶剂中的分配系数分别为1.2 -2.0,27~50(分配系数指苯酚在萃取剂和水中的浓度比)。工业上常采用苯和丙烯为原料制取苯酚和丙酮,制备的工业流程如下图所示。
下列说法正确的是
A.步骤1苯与丙烯都属于饱和烃
B.步骤1的产物异丙苯中所有碳原子可能共面
C.步骤2中原子利用率100%
D.步骤3中生成的苯酚与丙酮常温下均能与水、乙醇等互溶
12.将体积均为的甲、乙、丙三种液体依次沿试管内壁缓缓滴入试管中,出现如图的实验现象,则甲、乙、丙的组合可能是
甲 乙 丙
A 1,2-二溴乙烷 水 苯
B 溴苯 液溴 乙醇
C 水 直馏汽油 溴水
D 乙醇 乙酸 乙酸乙酯
A.A B.B C.C D.D
13.设为阿伏加德罗常数的值。下列说法正确的是
A.工业上电解制备时,产生气体的分子数为3
B.三硫化四磷(,如图所示)中含有的极性键的数目为6
C.标准状况下,22.4L氯气与足量烧碱溶液反应,转移的电子数为2
D.与足量乙醇在一定条件下反应,生成的酯基的数目为2
二、非选择题(共10题)
14.苹果酸是一种常见的有机酸,其结构简式为。
(1)苹果酸分子中所含官能团的名称是_______________。
(2)苹果酸不可能发生的反应有________(填序号)。
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应 ⑤消去反应 ⑥取代反应
(3)物质A 可与乙二醇反应生成八元环酯,请写出此过程的化学方程式是______________________________________________。
(4)写出苹果酸在浓硫酸加热下与乙酸反应的化学方程式_______________________,反应类型为_________________
15.MMA()用于合成有机玻璃,是无色易挥发的液体。
(1)MMA属于_______(填“无机化合物”或“有机化合物”)。
(2)MMA中官能团有碳碳双键和_______ (填名称)。
(3)向MMA溶液中滴入几滴酸性KMnO4溶液,溶液褪色,说明MMA 具有_______。(填“还原性”或“氧化性”)
(4)向MMA溶液中滴入几滴稀溴水,实验现象为_______。
三、实验题
16.实验室制备1,2—二溴乙烷的反应原理如下:CH3CH2OHCH2=CH2↑+H2O,CH2=CH2+Br2→BrCH2CH2Br。
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。
用少量溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:
乙醇 1,2—二溴乙烷 乙醚
状态 无色液体 无色液体 无色液体
密度/g cm-3 0.79 2.2 0.71
沸点/℃ 78.5 132 34.6
熔点/℃ -130 9 -116
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___(填正确选项前的字母)。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入___,其目的是吸收反应中可能生成的酸性气体(填字母)。
a.水 b.氢氧化钠溶液 c.浓硫酸
(3)判断该制备反应已经结束的最简单方法是___。
(4)若产物中有少量未反应的Br2,最好用___洗涤除去(填正确选项前的字母)。
a.水 b.乙醇 c.氢氧化钠溶液
(5)若产物中有少量副产物乙醚,可用的___方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是___;但又不能过度冷却(如用冰水),其原因是___。
17.用图示装置制取少量乙酸乙酯(酒精灯、铁架台等在图中均已略去),请填空:
(1)写出试管a中发生反应的化学方程式______
(2)某同学在实验过程中,试管a中忘记加入碎瓷片就加热进行实验,为防止暴沸,下一步的操作是:______。
(3)实验中加热试管a的目的是:
①:______
②:______
(4)反应结束后,振荡试管b静置,观察到的现象是______。
18.己二酸是一种二元弱酸,通常为白色结晶体,微溶于冷水,易溶于热水和乙醇。实验室以环己醇( )为原料制取己二酸的实验流程如图:
已知:①“氧化”过程在(如图1所示)三颈烧瓶中进行,发生的主要反应为:KOOC(CH2)4COOK △H<0
②不同温度下,相关物质在水中的溶解度:
物质 己二酸 氯化钠 氯化钾
25℃时溶解度/g 2.1 36.1 34.3
70℃时溶解度/g 68 37.8 48
100℃时溶解度/g 160 39.5 56.3
回答下列问题:
(1)图1中冷却水从冷凝管___________(填“a”或“b”)口流入。
(2)“氧化”过程,不同环己醇滴速下,溶液温度随时间变化曲线如图2,应选择的环己醇滴速为___________滴/min,选择的理由是___________。
(3)流程中操作1为___________(填“趁热”或“冷却”)减压过滤,减压过滤的优点是___________。(答出一点即可)
(4)流程中最后一次洗涤沉淀的方法为___________(填字母)。
A.用乙醇洗涤 B.用热水洗涤 C.用冷水洗涤
(5)除去己二酸晶体中含有的氯化钠杂质采取的实验方法为___________。
(6)称取己二酸(M=146g/mol)样品 0.2920g,用新煮沸的50.00mL 热水溶解,滴入2滴酚酞试液作指示剂,用 0.1500mol·L-1 NaOH 溶液滴定至终点,进行平行实验及空白实验后,消耗 NaOH 的平均体积为20.00mL,计算己二酸样品的纯度。(已知:己二酸氢钠溶液呈弱酸性)
①滴定终点的现象为:滴入最后一滴NaOH 溶液,___________。
②己二酸样品的纯度为___________。
四、计算题
19.10.8g某芳香族化合物A完全燃烧后,将生成的气体依次通过足量的浓硫酸和碱石灰,经测定前者增重7.2g,后者增重30.8g。A的蒸气密度是相同状况下H2的54倍。则:
(1)A的分子式为________。
(2)若A不能与NaOH溶液反应,则A的结构简式为________、________。
(3)若A与浓溴水作用时,1molA能消耗3molBr2,则A的结构简式为________。
20.将12g某有机物在足量氧气中完全燃烧生成CO2和H2O,并将CO2和H2O通过浓硫酸,浓硫酸增重14.4g,再通过碱石灰,碱石灰增重26.4g。
(1)请写出该有机物的分子式___。
(2)请写出该有机物可能的结构简式___。
21.某有机化合物A广泛存在于多种水果中。经测定,A的相对分子质量为134,A仅含碳、氢、氧三种元素。A既可以与乙醇发生酯化反应,又可以与乙酸发生酯化反应,且测得0.1molA与乙醇完全酯化得有机产物的质量为19.0g。
(1)每个有机化合物A分子中含有___________个羧基;
(2)有机化合物A的分子式___________。(书写计算过程)
22.化学物X由3种元素组成,某学习小组按如下流程进行实验:
已知:溶液A只含一种溶质,焰色试验呈黄色。
(1)组成化合物X的3种元素为___________,化合物X的化学式为___________;
(2)混合气体D中能使澄清石灰水变浑浊的气体的电子式___________;
(3)X与反应的化学方程式___________;
(4)气体B也能和水反应,生成的物质不稳定,容易转变为具有刺激性气味的液体G,请设计实验验证G中含有的官能团___________。
23.W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W最外层电子数与电子层数相同,Y与X相邻,Y与Z也相邻;元素Z在地壳中含量最高。试回答下列各题:
(1)写出由其中两种元素组成的盐的电子式________________。
(2)比较Y、Z离子半径大小_____________________( 用化学式表示)
(3)已知W、Y、Z三种元素两两组合,可组成多种10电子微粒,请写出反应物生成物均为10电子微粒的离子方程式_______________________________________。
(4)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A是日常生活中常用调味品的主要成分,且A与B能够反应生成C,C是一种有香味的液体。试写出该反应的化学方程式____________________________________________。
(5)由W、X、Y、Z四种元素中的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式_________________________。
(6)已知由元素X和Z可组成A、B、C、D四种中学化学中常见的单质或化合物,四种物质之间存在如图所示的转化关系。
①写出A与B反应生成C的化学方程式____________________________________;
②向50 mL4 mol·L-1的NaOH溶液中通入1.12 L B(标准状况),反应后溶液中溶质的物质的量之比为__________________________________。
参考答案:
1.A 2.D 3.A 4.C 5.C 6.B 7.D 8.D 9.C 10.A 11.C 12.A
13.B
14. 羟基、 羧基 ①③ +CH3COOH CH3COO-CH(COOH)-CH2COOH + H2O 酯化反应(取代反应)
15. 有机化合物 酯基 还原性 溴水褪色
16.(1)d
(2)b
(3)溴的颜色完全褪去
(4)c
(5)蒸馏
(6) 防止溴的挥发 1,2-二溴乙烷的熔点为9℃,过度冷却会变成固体而使进气导管堵塞
17. 停止加热,待试管a冷却后,加入碎瓷片,重新实验 加快反应速率 及时将乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动 b中的液体分层,上层是透明的油状液体
18. b 5 “氧化”过程应在小于50℃温度下进行,由图可知滴速过快,反应器内温度升高过快,影响反应 趁热 过滤速度快,滤出的固体容易干燥 C 重结晶 溶液由无色变成浅红色,且半分钟内不褪色 75%
19.(1)C7H8O
(2)
(3)
20. C3H8O CH3CH2CH2OH、、CH3CH2OCH3
21.(1)2
(2)C4H6O5
22.(1) 钠、碳、氢 NaC2H
(2)
(3)
(4)取乙醛溶液,加入新制的银氨溶液,水浴加热,生成银白色银单质,说明乙醛中含有醛基
23.(1)
(2)N3->O2-
(3)NH+OH-=NH3↑+H2O
(4)CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O
(5)C+4HNO3(浓)CO2↑+4NO2↑+2H2O
(6) CO2+C2CO n(Na2CO3):n(NaOH)=1:2
一、单选题(共13题)
1.化合物Y具有抗菌、消炎作用,可由X制得。下列有关化合物X、Y的说法不正确的是
A.Y与乙醇发生酯化反应可得到X B.1mol X最多能与3mol NaOH反应
C.X、Y均能与酸性KMnO4溶液反应 D.1mol Y最多可以与8molH2发生加成反应
2.实验室中欲分离乙酸乙酯、乙酸、乙醇的混合物,如图是分离操作流程图 ( )
A.①蒸馏 ②过滤 ③分液 B.①分液 ②蒸馏 ③结晶
C.①蒸馏 ②分液 ③分液 D.①分液 ②蒸馏 ③蒸馏
3.“绿色化学”是当今社会人们提出的一个新概念,“绿色化学”工艺中原子利用率为100%。工业上可用乙基蒽醌(A)经两步反应制备H2O2,其反应可简单表示如下(条件省略):
下列有关说法不正确的是
A.上述工业生产消耗的原料是H2.O2和乙基蒽醌
B.该法生产H2O2符合“绿色化学工艺”的要求
C.乙基蒽醌(A)的作用相当于催化剂,化合物(B)属于中间产物
D.反应1中乙基蒽醌(A)发生还原反应,反应2中化合物(B)发生氧化反应
4.SO2和H2SO4在生产、生活和科学研究中有着广泛的应用。葡萄酒中添加适量的二氧化硫可以起到抗氧化等作用。工业上常用接触法制备硫酸,过程如下:将硫黄或其他含硫矿物在沸腾炉中与氧气反应生成SO2;SO2在V2O5催化作用下与空气中的O2在接触室中发生可逆反应,生成的SO3在吸收塔中用98.3%的浓硫酸吸收得到发烟硫酸(H2SO4·SO3)。下列与硫酸相关的实验能达到目的是
A.向50 g H2O中加入50 g发烟硫酸,可配成100 g质量分数为50%的硫酸溶液
B.常温下,可使用浓硫酸和铁片反应制取FeSO4
C.装置甲可用于实验室制备乙烯气体
D.装置乙可用于去除乙烯中混有的SO2气体
5.实验室乙酸乙酯的制备实验如图所示,试管a中盛有无水乙醇、浓硫酸、冰醋酸及沸石,试管b中盛有滴有酚酞的饱和碳酸钠溶液。下列关于该实验说法不正确的是
A.试管a中放入沸石的目的是防止加热时液体暴沸
B.导管不伸入试管b中液面以下,其目的是防止倒吸
C.试管b中溶液红色变浅,是因为碳酸钠与乙醇发生反应
D.用分液漏斗分离试管b中液体时,应先放出水相后再从分液漏斗上口倒出乙酸乙酯
6.一定质量的某有机物和足量金属钠反应,得到VA L气体,等质量的该有机物与足量Na2CO3溶液反应,可得VB L气体,已知同温同压下VA>VB.则该有机物可能是( )
A.HO(CH2)2CHO B.CH3CH(OH)COOH C.HOOC﹣COOH D.HO﹣CH2﹣CH2﹣OH
7.下列离子方程式正确的是
A.把通入苯酚钠溶液中:
B.室温下稀与铜反应:
C.磁性氧化铁溶于稀:
D.向稀溶液中加入过量稀氨水:
8.化学与生产、生活密切相关,下列说法错误的是
A.油脂可用于生产肥皂 B.碳酸氢铵可作为复合膨松剂的成分
C.氧化铁常用作油漆的红色颜料 D.苯甲酸及其钠盐常用作食品抗氧化剂
9.从葡萄籽中提取的原花青素结构如图,原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病。有关原花青素的下列说法不正确的是
A.该物质既可看做醇类,也可看做酚类
B.1mol该物质可与4molBr2反应
C.1mol该物质可与7molNaOH反应
D.1mol该物质可与7molNa反应
10.兔儿草醛是一种常见的香料添加剂。由兔儿草醇制备兔儿草醛的反应如图,下列说法正确的是
A.兔儿草醛的分子结构中苯环上的二溴代物有4种
B.兔儿草醇最多能与3mol H2发生加成反应
C.将兔儿草醇转化为兔儿草醛所采用的试剂可以是“酸性K2Cr2O7溶液”
D.兔儿草醇和兔儿草醛都能发生氧化反应、加成反应,不能发生取代反应
11.苯酚是一种重要的化工原料,广泛用于制造酚醛树脂、染料、医药、农药等。我国目前工业上采用磺化法和异丙苯法制取苯酚。化工厂的含酚废水对生物具有毒害作用,会对水体造成严重污染。对于高浓度的酚类废水,可以通过萃取或吸附等方法对酚类物质进行提取回收,浓度非常小没有回收价值的废水,可以使用生物处理法或化学法进行处理。苯酚在芳香烃和酯类溶剂中的分配系数分别为1.2 -2.0,27~50(分配系数指苯酚在萃取剂和水中的浓度比)。工业上常采用苯和丙烯为原料制取苯酚和丙酮,制备的工业流程如下图所示。
下列说法正确的是
A.步骤1苯与丙烯都属于饱和烃
B.步骤1的产物异丙苯中所有碳原子可能共面
C.步骤2中原子利用率100%
D.步骤3中生成的苯酚与丙酮常温下均能与水、乙醇等互溶
12.将体积均为的甲、乙、丙三种液体依次沿试管内壁缓缓滴入试管中,出现如图的实验现象,则甲、乙、丙的组合可能是
甲 乙 丙
A 1,2-二溴乙烷 水 苯
B 溴苯 液溴 乙醇
C 水 直馏汽油 溴水
D 乙醇 乙酸 乙酸乙酯
A.A B.B C.C D.D
13.设为阿伏加德罗常数的值。下列说法正确的是
A.工业上电解制备时,产生气体的分子数为3
B.三硫化四磷(,如图所示)中含有的极性键的数目为6
C.标准状况下,22.4L氯气与足量烧碱溶液反应,转移的电子数为2
D.与足量乙醇在一定条件下反应,生成的酯基的数目为2
二、非选择题(共10题)
14.苹果酸是一种常见的有机酸,其结构简式为。
(1)苹果酸分子中所含官能团的名称是_______________。
(2)苹果酸不可能发生的反应有________(填序号)。
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应 ⑤消去反应 ⑥取代反应
(3)物质A 可与乙二醇反应生成八元环酯,请写出此过程的化学方程式是______________________________________________。
(4)写出苹果酸在浓硫酸加热下与乙酸反应的化学方程式_______________________,反应类型为_________________
15.MMA()用于合成有机玻璃,是无色易挥发的液体。
(1)MMA属于_______(填“无机化合物”或“有机化合物”)。
(2)MMA中官能团有碳碳双键和_______ (填名称)。
(3)向MMA溶液中滴入几滴酸性KMnO4溶液,溶液褪色,说明MMA 具有_______。(填“还原性”或“氧化性”)
(4)向MMA溶液中滴入几滴稀溴水,实验现象为_______。
三、实验题
16.实验室制备1,2—二溴乙烷的反应原理如下:CH3CH2OHCH2=CH2↑+H2O,CH2=CH2+Br2→BrCH2CH2Br。
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。
用少量溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:
乙醇 1,2—二溴乙烷 乙醚
状态 无色液体 无色液体 无色液体
密度/g cm-3 0.79 2.2 0.71
沸点/℃ 78.5 132 34.6
熔点/℃ -130 9 -116
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___(填正确选项前的字母)。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入___,其目的是吸收反应中可能生成的酸性气体(填字母)。
a.水 b.氢氧化钠溶液 c.浓硫酸
(3)判断该制备反应已经结束的最简单方法是___。
(4)若产物中有少量未反应的Br2,最好用___洗涤除去(填正确选项前的字母)。
a.水 b.乙醇 c.氢氧化钠溶液
(5)若产物中有少量副产物乙醚,可用的___方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是___;但又不能过度冷却(如用冰水),其原因是___。
17.用图示装置制取少量乙酸乙酯(酒精灯、铁架台等在图中均已略去),请填空:
(1)写出试管a中发生反应的化学方程式______
(2)某同学在实验过程中,试管a中忘记加入碎瓷片就加热进行实验,为防止暴沸,下一步的操作是:______。
(3)实验中加热试管a的目的是:
①:______
②:______
(4)反应结束后,振荡试管b静置,观察到的现象是______。
18.己二酸是一种二元弱酸,通常为白色结晶体,微溶于冷水,易溶于热水和乙醇。实验室以环己醇( )为原料制取己二酸的实验流程如图:
已知:①“氧化”过程在(如图1所示)三颈烧瓶中进行,发生的主要反应为:KOOC(CH2)4COOK △H<0
②不同温度下,相关物质在水中的溶解度:
物质 己二酸 氯化钠 氯化钾
25℃时溶解度/g 2.1 36.1 34.3
70℃时溶解度/g 68 37.8 48
100℃时溶解度/g 160 39.5 56.3
回答下列问题:
(1)图1中冷却水从冷凝管___________(填“a”或“b”)口流入。
(2)“氧化”过程,不同环己醇滴速下,溶液温度随时间变化曲线如图2,应选择的环己醇滴速为___________滴/min,选择的理由是___________。
(3)流程中操作1为___________(填“趁热”或“冷却”)减压过滤,减压过滤的优点是___________。(答出一点即可)
(4)流程中最后一次洗涤沉淀的方法为___________(填字母)。
A.用乙醇洗涤 B.用热水洗涤 C.用冷水洗涤
(5)除去己二酸晶体中含有的氯化钠杂质采取的实验方法为___________。
(6)称取己二酸(M=146g/mol)样品 0.2920g,用新煮沸的50.00mL 热水溶解,滴入2滴酚酞试液作指示剂,用 0.1500mol·L-1 NaOH 溶液滴定至终点,进行平行实验及空白实验后,消耗 NaOH 的平均体积为20.00mL,计算己二酸样品的纯度。(已知:己二酸氢钠溶液呈弱酸性)
①滴定终点的现象为:滴入最后一滴NaOH 溶液,___________。
②己二酸样品的纯度为___________。
四、计算题
19.10.8g某芳香族化合物A完全燃烧后,将生成的气体依次通过足量的浓硫酸和碱石灰,经测定前者增重7.2g,后者增重30.8g。A的蒸气密度是相同状况下H2的54倍。则:
(1)A的分子式为________。
(2)若A不能与NaOH溶液反应,则A的结构简式为________、________。
(3)若A与浓溴水作用时,1molA能消耗3molBr2,则A的结构简式为________。
20.将12g某有机物在足量氧气中完全燃烧生成CO2和H2O,并将CO2和H2O通过浓硫酸,浓硫酸增重14.4g,再通过碱石灰,碱石灰增重26.4g。
(1)请写出该有机物的分子式___。
(2)请写出该有机物可能的结构简式___。
21.某有机化合物A广泛存在于多种水果中。经测定,A的相对分子质量为134,A仅含碳、氢、氧三种元素。A既可以与乙醇发生酯化反应,又可以与乙酸发生酯化反应,且测得0.1molA与乙醇完全酯化得有机产物的质量为19.0g。
(1)每个有机化合物A分子中含有___________个羧基;
(2)有机化合物A的分子式___________。(书写计算过程)
22.化学物X由3种元素组成,某学习小组按如下流程进行实验:
已知:溶液A只含一种溶质,焰色试验呈黄色。
(1)组成化合物X的3种元素为___________,化合物X的化学式为___________;
(2)混合气体D中能使澄清石灰水变浑浊的气体的电子式___________;
(3)X与反应的化学方程式___________;
(4)气体B也能和水反应,生成的物质不稳定,容易转变为具有刺激性气味的液体G,请设计实验验证G中含有的官能团___________。
23.W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W最外层电子数与电子层数相同,Y与X相邻,Y与Z也相邻;元素Z在地壳中含量最高。试回答下列各题:
(1)写出由其中两种元素组成的盐的电子式________________。
(2)比较Y、Z离子半径大小_____________________( 用化学式表示)
(3)已知W、Y、Z三种元素两两组合,可组成多种10电子微粒,请写出反应物生成物均为10电子微粒的离子方程式_______________________________________。
(4)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A是日常生活中常用调味品的主要成分,且A与B能够反应生成C,C是一种有香味的液体。试写出该反应的化学方程式____________________________________________。
(5)由W、X、Y、Z四种元素中的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式_________________________。
(6)已知由元素X和Z可组成A、B、C、D四种中学化学中常见的单质或化合物,四种物质之间存在如图所示的转化关系。
①写出A与B反应生成C的化学方程式____________________________________;
②向50 mL4 mol·L-1的NaOH溶液中通入1.12 L B(标准状况),反应后溶液中溶质的物质的量之比为__________________________________。
参考答案:
1.A 2.D 3.A 4.C 5.C 6.B 7.D 8.D 9.C 10.A 11.C 12.A
13.B
14. 羟基、 羧基 ①③ +CH3COOH CH3COO-CH(COOH)-CH2COOH + H2O 酯化反应(取代反应)
15. 有机化合物 酯基 还原性 溴水褪色
16.(1)d
(2)b
(3)溴的颜色完全褪去
(4)c
(5)蒸馏
(6) 防止溴的挥发 1,2-二溴乙烷的熔点为9℃,过度冷却会变成固体而使进气导管堵塞
17. 停止加热,待试管a冷却后,加入碎瓷片,重新实验 加快反应速率 及时将乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动 b中的液体分层,上层是透明的油状液体
18. b 5 “氧化”过程应在小于50℃温度下进行,由图可知滴速过快,反应器内温度升高过快,影响反应 趁热 过滤速度快,滤出的固体容易干燥 C 重结晶 溶液由无色变成浅红色,且半分钟内不褪色 75%
19.(1)C7H8O
(2)
(3)
20. C3H8O CH3CH2CH2OH、、CH3CH2OCH3
21.(1)2
(2)C4H6O5
22.(1) 钠、碳、氢 NaC2H
(2)
(3)
(4)取乙醛溶液,加入新制的银氨溶液,水浴加热,生成银白色银单质,说明乙醛中含有醛基
23.(1)
(2)N3->O2-
(3)NH+OH-=NH3↑+H2O
(4)CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O
(5)C+4HNO3(浓)CO2↑+4NO2↑+2H2O
(6) CO2+C2CO n(Na2CO3):n(NaOH)=1:2
