2023年中考化学复习 第9讲 溶液及溶解度课件(共38张PPT)
文档属性
| 名称 | 2023年中考化学复习 第9讲 溶液及溶解度课件(共38张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-26 15:46:25 | ||
图片预览










文档简介
(共38张PPT)
第一部分
基础知识复习
第三板块 身边的化学物质
1
直击重点
2
知识梳理
3
金牌重难点
4
中考特训
5
广东真题
第9讲 溶液及溶解度
1.认识溶解现象,知道溶液的组成以及在生产生活中的重要意义。
2.了解饱和溶液和溶解度的含义。
3.认识乳化现象、结晶现象。
4.能进行溶质质量分数的简单计算。
5.初步学会配制一定溶质质量分数的溶液。
1.溶液的特征:__________性、__________性的__________物。
2.溶液的组成:__________和__________。
3.溶液的分类:按是否饱和分为饱和溶液和不饱和溶液;按所含溶质多少分为稀溶液和浓溶液。
4.不饱和溶液与饱和溶液的相互转化
知识点一:
溶液的形成
不饱和溶液 饱和溶液[Ca(OH)2除外]
( )( )( )
( )( )
混合
均一
稳定
溶剂
溶质
加入溶剂
降低温度
加入溶质
蒸发溶剂
升高温度
5.物质溶解的热效应现象:有些物质溶解时会放热,如 、 等;有些物质溶解时会吸热,如 等;有些物质溶解时无明显温度变化,如氯化钠等。
氢氧化钠
硝酸铵
浓硫酸
乳化现象:洗涤剂等乳化剂使植物油等在水中分散成无数细小的液滴,而不聚集成大的油珠,从而使油和水不再分层的现象。其中洗涤剂所起的作用就是乳化作用。
乳化作用:洗涤剂去油污的作用就是乳化作用。
除去油污的两种方法是 (选填序号)。
①用汽油等溶解 ②用洗洁精等乳化 ③加入盐酸反应
(注意:汽油去油污是利用溶解的原理)
知识点二:
乳化作用
①②
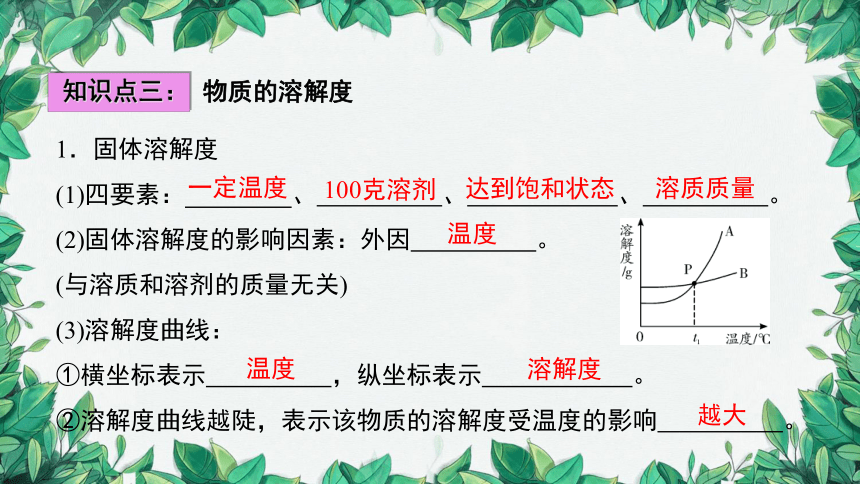
1.固体溶解度
(1)四要素: 、 、 、 。
(2)固体溶解度的影响因素:外因 。
(与溶质和溶剂的质量无关)
(3)溶解度曲线:
①横坐标表示 ,纵坐标表示 。
②溶解度曲线越陡,表示该物质的溶解度受温度的影响 。
知识点三:
物质的溶解度
溶质质量
一定温度
100克溶剂
达到饱和状态
温度
温度
溶解度
越大
③溶解度曲线交点表示的意义,以P点为例,含义是: 。
④物质溶解度变化规律:大多数物质的溶解度随温
度的升高而增大,如 ;极少数物质的溶解度随温度的升高而降低,如 ;少数物质的溶解度受温度的影响比较小,如 。
在t1℃时,A与B溶解度相等
硝酸钾
氢氧化钙
氯化钠
(4)溶液的结晶方法
蒸发溶剂(蒸发结晶)——适用于溶解度受温度影响 的固体物质。如:NaCl。
冷却热的饱和溶液(降温结晶) ——适用于溶解度受温度影响
的固体物质。如:KNO3。
较大
较小
2.气体溶解度
(1)定义:在一定温度、 压强时,某气体在1体积水中达到饱和状态时所溶解的体积。
(2)影响因素(外因):温度和压强。温度不变时,压强越大,气体溶解度越大;压强不变时,温度越高,气体溶解度越小。
1.关系式:溶液中溶质的质量分数(A%)= ×100%(溶液的质量=溶质的质量+溶剂的质量)
知识点四:
溶质的质量分数
2.溶液的稀释
(1)原理:稀释前的 质量=稀释后的 质量。
(2)计算公式: ×浓溶液的质量分数= . ×稀溶液的质量分数。
注意:加入水的质量=稀释后溶液的质量-稀释前的溶液质量。
溶质
溶质
浓溶液质量
稀溶液质量
溶液 (选填“一定”或“不一定”,下同)是无色的;均一、稳定的液体 是溶液;溶液中的溶质 是固体;饱和溶液 是浓溶液;不饱和溶液 是稀溶液。
不一定
不一定
不一定
不一定
不一定
(2022·衡阳)下列关于溶液的说法正确的是( )
A. 溶液是具有均一性、稳定性的混合物
B. 饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
C. 打开汽水瓶盖后有气泡冒出,主要是因为温度升高,气体溶解度减小
D. 溶液都是无色透明的液体
重难点一:
溶液相关概念
A
【思路点拨】 选A。A.溶液是由溶质和溶剂混合而成的均一、稳定的混合物,A符合题意;B.饱和溶液不一定是浓溶液,是常温下,氢氧化钙的饱和溶液是稀溶液,不饱和溶液不一定是稀溶液,如常温下,硝酸钾的饱和溶液是浓溶液,B不符合题意;C.打开汽水瓶盖后有气泡冒出,主要是因为压强减小,气体的溶解度减小,C不符合题意;D.溶液不一定是无色的,如硫酸铜溶液是蓝色的,D不符合题意。故选A。
(2022·赤峰)a、b、c三种固体物质在水中的溶解度曲线如图所示。下列说法正确的是( )
A.P点表示t1℃时,a、c两种物质的饱和溶液中溶质质量相等
B.t2℃时,将30 g a物质加入到50 g水中可得到80 g a的溶液
C.将t1℃时a、b、c三种物质的饱和溶液升温至t2℃,
b溶液的溶质质量分数最大
D.将t2℃时a、b、c三种物质的饱和溶液降温至t1℃,
a溶液析出的晶体最多
重难点二:
溶解度相应的图像或表格(重难点)
C
【思路点拨】 选C。A.P点表示t1℃时,a、c两种物质的饱和溶液中溶质质量分数相等,溶质质量不一定相等,是因为不知道饱和溶液质量,该选项不正确。B.t2℃时a的溶解度是30 g,将30 g a物质加入到50 g水中,能够溶解15 g,可得到65 g a的溶液,该选项不正确。C.将t1℃时a、b、c三种物质的饱和溶液升温至t2℃,a、b都变成不饱和溶液,溶质质量分数都不变,由于t1℃时b的溶解度最大,因此b的质量分数大于a,c析出固体后仍然是饱和溶液,溶解度减小,c的溶质质量分数小于a,b溶液的溶质质量分数最大,该选项正确。D.不知道饱和溶液质量,不能计算析出固体质量大小,该选项不正确。故选:C。
如何判断溶液浓度的变化?
(1)例如将硝酸钾的不饱和溶液转化成饱和溶液,其溶液浓度如何改变?
①若通过加入硝酸钾而转化成饱和溶液的,溶液浓度一定变大;
②若通过蒸发水而转化成饱和溶液的,溶液浓度一定变大;
③若通过降低温度而转化成饱和溶液的,溶液浓度开始不变(溶液未有晶体析出);一旦溶液有晶体析出时,溶液浓度则变小。
(2)在饱和的氢氧化钠溶液中加入少量的氢氧化钠固体,NaOH固体溶于水放热,温度升高,溶解度变大,能溶更多NaOH,其溶液的浓度开始变大,待溶液恢复为原来的温度时,溶解的NaOH又析出,则溶液的浓度和原来的是一样。
(3)在饱和的氢氧化钙溶液中加入少量的氧化钙固体,CaO与H2O反应温度升高,则溶解度变小。①若未恢复为原来的温度时,溶液浓度一定变小;②若已恢复为原来的温度时,溶液浓度和原来的是一样。
★溶液的形成
1.(2022·永州)生活中下列物质加入适量水不能形成溶液的是( )
A.食醋 B.食用油 C.白砂糖 D.食盐
基础过关
2.下列关于溶液的说法,正确的是( )
A.只有固体可以作溶质
B.凡是均一的、稳定的液体一定是溶液
C.饱和溶液的浓度一定比不饱和溶液的浓度大
D.氢氧化钠固体在溶于水形成溶液的过程中,会放出热量
B
D
3.蔗糖溶解在水中形成溶液。下图能较好地反映溶液中蔗糖分子分布的是(水分子未画出)( )
A B C D
D
★溶解过程的热效应及乳化作用
4.(2021·重庆) 将一定量的下列固体放入适量水中,能形成溶液且温度明显升高的是( )
A.CaCO3 B.NaOH C.NaCl D.NH4NO3
B
5.(2021·陕西) 如图,室温下,盛水的烧杯内放置两支分别盛有等质量KNO3溶液和饱和石灰水的试管甲和乙,向烧杯内的水中加入NH4NO3固体后,甲中未观察到明显现象。下列说法正确的是( )
A.乙中溶液一定变浑浊
B.甲中溶液一定变成饱和溶液
C.乙中溶液溶质的质量分数一定变小
D.甲、乙中溶液质量一定相等
D
6.下列过程属于乳化作用的是( )
A.用汽油清洗机械表面的污渍
B.用稀盐酸除去钢铁表面的锈
C.用洗涤剂洗去衣服上的油污
D.用氢氧化钠溶液清洗炉具的油污
C
★饱和溶液和不饱和溶液
7.不同温度时,NaCl固体的溶解度如下表所示。据表中内容回答问题。
下列能将不饱和NaCl溶液变为饱和NaCl溶液的方法是( )
A.加水 B.升高温度 C.加入NaCl D.倒出部分溶液
温度/℃ 20 40 60 80 100
溶解度/g 36.0 36.6 37.3 38.4 39.8
C
8.(2022·成都)根据图示实验和溶解度表,下列说法正确的是( )
A. 若a是NaCl,则③中的溶液是不饱和溶液
B. 若a是NaCl,则④中溶质的质量分数约为27.2%
C. 若a是KNO3,则③到④溶液由不饱和转化为饱和
D. 实验证明溶液是否饱和与温度、溶质的量和溶剂种类有关
温度/℃ 0 20 40 60 80
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4
KNO3 13.3 31.6 63.9 110 169
B
★溶解度及溶解度曲线的应用
9.能增大氧气在水中溶解度的方法是( )
A.增大压强 B.增加氧气的体积
C.增加水的质量 D.升高温度
A
10.喝了汽水以后常常会打嗝。下列图示能正确解释这一现象的是( )
A B C D
B
11.(2022·连云港)KC1和KNO3的溶解度(见下表)和溶解度曲线(见图)。下列说法正确的是( )
A. 曲线甲代表KCl的溶解度曲线
B. 40℃时KNO3饱和溶液中KNO3的质量分数为63.9%
C. t1的值在20~30之间
D. 将t1℃时甲和乙饱和溶液升温至t2℃时,溶液中溶
质的质量分数:甲>乙
温度/℃ 0 10 20 30 40 50 60
溶解度/g KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5
C
12.(2022·眉山)甲、乙、丙三种固体物质的溶解度
曲线如图所示。下列说法正确的是( )
A.20℃时,甲的溶解度大于乙的溶解度
B.图中P点表示10℃时丙的饱和溶液
C.20℃时,100 g乙的饱和溶液中含有乙的质量为30 g
D.50℃时,同质量的甲、乙、丙饱和溶液降温至10℃,甲溶液中析出固体最多
D
13.(2022·哈尔滨)如图是甲、乙两种固体物质(均
不含结晶水)的溶解度曲线、结合图示判断,下列
说法正确的是( )
A.甲的溶解度为20
B.甲、乙两种物质相比较,乙的溶解度受温度变化的影响更大
C.t2℃时,等质量的甲、乙饱和溶液中所含溶质的质量甲大于乙
D.t1℃时,甲、乙溶液中溶质的质量分数定相等
C
14.(2022·达州)t1℃时,将相同质量的KNO3和KCl分别加入盛有100 g水的甲、乙烧杯中,充分搅拌后现象如图I所示,图Ⅱ为两物质的溶解度曲线。以下说法正确的是( )
A. 甲烧杯中的溶质为KNO3
B. 将温度升高到t2℃时,乙烧杯中仍然
有固体剩余
C. 若KNO3中混有少量KCl,可采用蒸发结晶的方法提纯KNO3
D. 若取t3℃时KNO3和KCl的饱和溶液各100 g,降温至t2℃时,析出晶体较多的是KNO3
能力提升
D
15.(2022·南充)海洋中蕴藏着丰富的化学资源,
按目前测定,海水中含有的化学元素有80多种。
其中由某些元素组成的盐(均不含结晶水)的溶解
度曲线如下图所示。
(1)在 ℃时,氯化钠和硝酸钾的溶解度相等。
(2)将接近饱和的硒酸镉溶液变为饱和溶液的方法有________________________________________________(任写一种)。
t1
升高温度或加溶质/硒酸镉或蒸发溶剂/水
(3)t2℃时,30 g硒酸镉固体加到50 g水中,充分溶解
并恢复至原温度后,所得溶液中溶质的质量分数是
(精确到0.1%)。
(4)t1℃时,将三种物质的等质量饱和溶液升温至t3℃
(不考虑溶剂蒸发),下列说法正确的是 (填选项)。
A. 有晶体析出的是硒酸镉溶液
B. 溶质质量分数大小关系是:硝酸钾溶液>氯化钠溶液>硒酸镉溶液
C. 溶剂质量大小关系是:硝酸钾溶液=氯化钠溶液>硒酸镉溶液
33.3%
AC
1.(2022·广东)根据如图,判断下列说法正确的是( )
A.t1 ℃时,50 g甲能完全溶于50 g水
B.乙的溶解度随温度升高而降低
C.t2 ℃时,丙和丁的溶解度相同
D.加压或升温能增加戊的溶解度
C
2.(2021·广东) 右图是硼酸的溶解度曲线,下列说法正确的是( )
A.a点的硼酸溶液中溶质的质量分数为10%
B.将a点的硼酸溶液升温至t2℃时,仍是饱和溶液
C.将b点的硼酸溶液降温至t1℃时,有晶体析出
D.t2℃时,向50 g水中加入20 g硼酸后充分搅拌,
可得70 g溶液
C
3.(2020·广东) 左下图是KNO3的溶解度曲线,
下列说法正确的是( )
A.溶液从b点降温到a点,有晶体析出
B.60 ℃时,b、c点对应的都是饱和溶液
C.将a点的饱和溶液从20 ℃升温到60 ℃时仍是饱和溶液
D.60 ℃时,向50 g水中加入60 g KNO3,形成不饱和溶液
A
4.(2019·广东) 如上中图所示是三种物质的溶解度曲线。请回答:
(1)溶解度随温度升高而降低的是 ;30 ℃
时溶解度最大的是 。
(2)80 ℃时硝酸钠饱和溶液的溶质质量分数为 。
使硝酸钠不饱和溶液变为饱和溶液,可采取的措施有
(写一种)。
(3)某硝酸钾固体中混有少量硝酸铈杂质,分离提纯硝酸钾的操作是:配成高温下的硝酸钾饱和溶液、 、过滤、洗涤、干燥。
硝酸钠
硝酸铈
60%
增加溶质或减少溶剂或降低温度
降温结晶
5.(2018·广东) 如上右图为两物质的溶解度曲线。请回答:
(1)50 ℃时Na2Cr2O7的溶解度为 g,60 ℃时溶解度:Na2Cr2O7 Na2SO4 (选填“<”“=”或 “>”)。
(2)在50 ℃时,把210 g Na2Cr2O7饱和溶液降温到10 ℃,析出Na2Cr2O7 g(假设不含结晶水)。
50
110
>
第一部分
基础知识复习
第三板块 身边的化学物质
1
直击重点
2
知识梳理
3
金牌重难点
4
中考特训
5
广东真题
第9讲 溶液及溶解度
1.认识溶解现象,知道溶液的组成以及在生产生活中的重要意义。
2.了解饱和溶液和溶解度的含义。
3.认识乳化现象、结晶现象。
4.能进行溶质质量分数的简单计算。
5.初步学会配制一定溶质质量分数的溶液。
1.溶液的特征:__________性、__________性的__________物。
2.溶液的组成:__________和__________。
3.溶液的分类:按是否饱和分为饱和溶液和不饱和溶液;按所含溶质多少分为稀溶液和浓溶液。
4.不饱和溶液与饱和溶液的相互转化
知识点一:
溶液的形成
不饱和溶液 饱和溶液[Ca(OH)2除外]
( )( )( )
( )( )
混合
均一
稳定
溶剂
溶质
加入溶剂
降低温度
加入溶质
蒸发溶剂
升高温度
5.物质溶解的热效应现象:有些物质溶解时会放热,如 、 等;有些物质溶解时会吸热,如 等;有些物质溶解时无明显温度变化,如氯化钠等。
氢氧化钠
硝酸铵
浓硫酸
乳化现象:洗涤剂等乳化剂使植物油等在水中分散成无数细小的液滴,而不聚集成大的油珠,从而使油和水不再分层的现象。其中洗涤剂所起的作用就是乳化作用。
乳化作用:洗涤剂去油污的作用就是乳化作用。
除去油污的两种方法是 (选填序号)。
①用汽油等溶解 ②用洗洁精等乳化 ③加入盐酸反应
(注意:汽油去油污是利用溶解的原理)
知识点二:
乳化作用
①②
1.固体溶解度
(1)四要素: 、 、 、 。
(2)固体溶解度的影响因素:外因 。
(与溶质和溶剂的质量无关)
(3)溶解度曲线:
①横坐标表示 ,纵坐标表示 。
②溶解度曲线越陡,表示该物质的溶解度受温度的影响 。
知识点三:
物质的溶解度
溶质质量
一定温度
100克溶剂
达到饱和状态
温度
温度
溶解度
越大
③溶解度曲线交点表示的意义,以P点为例,含义是: 。
④物质溶解度变化规律:大多数物质的溶解度随温
度的升高而增大,如 ;极少数物质的溶解度随温度的升高而降低,如 ;少数物质的溶解度受温度的影响比较小,如 。
在t1℃时,A与B溶解度相等
硝酸钾
氢氧化钙
氯化钠
(4)溶液的结晶方法
蒸发溶剂(蒸发结晶)——适用于溶解度受温度影响 的固体物质。如:NaCl。
冷却热的饱和溶液(降温结晶) ——适用于溶解度受温度影响
的固体物质。如:KNO3。
较大
较小
2.气体溶解度
(1)定义:在一定温度、 压强时,某气体在1体积水中达到饱和状态时所溶解的体积。
(2)影响因素(外因):温度和压强。温度不变时,压强越大,气体溶解度越大;压强不变时,温度越高,气体溶解度越小。
1.关系式:溶液中溶质的质量分数(A%)= ×100%(溶液的质量=溶质的质量+溶剂的质量)
知识点四:
溶质的质量分数
2.溶液的稀释
(1)原理:稀释前的 质量=稀释后的 质量。
(2)计算公式: ×浓溶液的质量分数= . ×稀溶液的质量分数。
注意:加入水的质量=稀释后溶液的质量-稀释前的溶液质量。
溶质
溶质
浓溶液质量
稀溶液质量
溶液 (选填“一定”或“不一定”,下同)是无色的;均一、稳定的液体 是溶液;溶液中的溶质 是固体;饱和溶液 是浓溶液;不饱和溶液 是稀溶液。
不一定
不一定
不一定
不一定
不一定
(2022·衡阳)下列关于溶液的说法正确的是( )
A. 溶液是具有均一性、稳定性的混合物
B. 饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
C. 打开汽水瓶盖后有气泡冒出,主要是因为温度升高,气体溶解度减小
D. 溶液都是无色透明的液体
重难点一:
溶液相关概念
A
【思路点拨】 选A。A.溶液是由溶质和溶剂混合而成的均一、稳定的混合物,A符合题意;B.饱和溶液不一定是浓溶液,是常温下,氢氧化钙的饱和溶液是稀溶液,不饱和溶液不一定是稀溶液,如常温下,硝酸钾的饱和溶液是浓溶液,B不符合题意;C.打开汽水瓶盖后有气泡冒出,主要是因为压强减小,气体的溶解度减小,C不符合题意;D.溶液不一定是无色的,如硫酸铜溶液是蓝色的,D不符合题意。故选A。
(2022·赤峰)a、b、c三种固体物质在水中的溶解度曲线如图所示。下列说法正确的是( )
A.P点表示t1℃时,a、c两种物质的饱和溶液中溶质质量相等
B.t2℃时,将30 g a物质加入到50 g水中可得到80 g a的溶液
C.将t1℃时a、b、c三种物质的饱和溶液升温至t2℃,
b溶液的溶质质量分数最大
D.将t2℃时a、b、c三种物质的饱和溶液降温至t1℃,
a溶液析出的晶体最多
重难点二:
溶解度相应的图像或表格(重难点)
C
【思路点拨】 选C。A.P点表示t1℃时,a、c两种物质的饱和溶液中溶质质量分数相等,溶质质量不一定相等,是因为不知道饱和溶液质量,该选项不正确。B.t2℃时a的溶解度是30 g,将30 g a物质加入到50 g水中,能够溶解15 g,可得到65 g a的溶液,该选项不正确。C.将t1℃时a、b、c三种物质的饱和溶液升温至t2℃,a、b都变成不饱和溶液,溶质质量分数都不变,由于t1℃时b的溶解度最大,因此b的质量分数大于a,c析出固体后仍然是饱和溶液,溶解度减小,c的溶质质量分数小于a,b溶液的溶质质量分数最大,该选项正确。D.不知道饱和溶液质量,不能计算析出固体质量大小,该选项不正确。故选:C。
如何判断溶液浓度的变化?
(1)例如将硝酸钾的不饱和溶液转化成饱和溶液,其溶液浓度如何改变?
①若通过加入硝酸钾而转化成饱和溶液的,溶液浓度一定变大;
②若通过蒸发水而转化成饱和溶液的,溶液浓度一定变大;
③若通过降低温度而转化成饱和溶液的,溶液浓度开始不变(溶液未有晶体析出);一旦溶液有晶体析出时,溶液浓度则变小。
(2)在饱和的氢氧化钠溶液中加入少量的氢氧化钠固体,NaOH固体溶于水放热,温度升高,溶解度变大,能溶更多NaOH,其溶液的浓度开始变大,待溶液恢复为原来的温度时,溶解的NaOH又析出,则溶液的浓度和原来的是一样。
(3)在饱和的氢氧化钙溶液中加入少量的氧化钙固体,CaO与H2O反应温度升高,则溶解度变小。①若未恢复为原来的温度时,溶液浓度一定变小;②若已恢复为原来的温度时,溶液浓度和原来的是一样。
★溶液的形成
1.(2022·永州)生活中下列物质加入适量水不能形成溶液的是( )
A.食醋 B.食用油 C.白砂糖 D.食盐
基础过关
2.下列关于溶液的说法,正确的是( )
A.只有固体可以作溶质
B.凡是均一的、稳定的液体一定是溶液
C.饱和溶液的浓度一定比不饱和溶液的浓度大
D.氢氧化钠固体在溶于水形成溶液的过程中,会放出热量
B
D
3.蔗糖溶解在水中形成溶液。下图能较好地反映溶液中蔗糖分子分布的是(水分子未画出)( )
A B C D
D
★溶解过程的热效应及乳化作用
4.(2021·重庆) 将一定量的下列固体放入适量水中,能形成溶液且温度明显升高的是( )
A.CaCO3 B.NaOH C.NaCl D.NH4NO3
B
5.(2021·陕西) 如图,室温下,盛水的烧杯内放置两支分别盛有等质量KNO3溶液和饱和石灰水的试管甲和乙,向烧杯内的水中加入NH4NO3固体后,甲中未观察到明显现象。下列说法正确的是( )
A.乙中溶液一定变浑浊
B.甲中溶液一定变成饱和溶液
C.乙中溶液溶质的质量分数一定变小
D.甲、乙中溶液质量一定相等
D
6.下列过程属于乳化作用的是( )
A.用汽油清洗机械表面的污渍
B.用稀盐酸除去钢铁表面的锈
C.用洗涤剂洗去衣服上的油污
D.用氢氧化钠溶液清洗炉具的油污
C
★饱和溶液和不饱和溶液
7.不同温度时,NaCl固体的溶解度如下表所示。据表中内容回答问题。
下列能将不饱和NaCl溶液变为饱和NaCl溶液的方法是( )
A.加水 B.升高温度 C.加入NaCl D.倒出部分溶液
温度/℃ 20 40 60 80 100
溶解度/g 36.0 36.6 37.3 38.4 39.8
C
8.(2022·成都)根据图示实验和溶解度表,下列说法正确的是( )
A. 若a是NaCl,则③中的溶液是不饱和溶液
B. 若a是NaCl,则④中溶质的质量分数约为27.2%
C. 若a是KNO3,则③到④溶液由不饱和转化为饱和
D. 实验证明溶液是否饱和与温度、溶质的量和溶剂种类有关
温度/℃ 0 20 40 60 80
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4
KNO3 13.3 31.6 63.9 110 169
B
★溶解度及溶解度曲线的应用
9.能增大氧气在水中溶解度的方法是( )
A.增大压强 B.增加氧气的体积
C.增加水的质量 D.升高温度
A
10.喝了汽水以后常常会打嗝。下列图示能正确解释这一现象的是( )
A B C D
B
11.(2022·连云港)KC1和KNO3的溶解度(见下表)和溶解度曲线(见图)。下列说法正确的是( )
A. 曲线甲代表KCl的溶解度曲线
B. 40℃时KNO3饱和溶液中KNO3的质量分数为63.9%
C. t1的值在20~30之间
D. 将t1℃时甲和乙饱和溶液升温至t2℃时,溶液中溶
质的质量分数:甲>乙
温度/℃ 0 10 20 30 40 50 60
溶解度/g KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5
C
12.(2022·眉山)甲、乙、丙三种固体物质的溶解度
曲线如图所示。下列说法正确的是( )
A.20℃时,甲的溶解度大于乙的溶解度
B.图中P点表示10℃时丙的饱和溶液
C.20℃时,100 g乙的饱和溶液中含有乙的质量为30 g
D.50℃时,同质量的甲、乙、丙饱和溶液降温至10℃,甲溶液中析出固体最多
D
13.(2022·哈尔滨)如图是甲、乙两种固体物质(均
不含结晶水)的溶解度曲线、结合图示判断,下列
说法正确的是( )
A.甲的溶解度为20
B.甲、乙两种物质相比较,乙的溶解度受温度变化的影响更大
C.t2℃时,等质量的甲、乙饱和溶液中所含溶质的质量甲大于乙
D.t1℃时,甲、乙溶液中溶质的质量分数定相等
C
14.(2022·达州)t1℃时,将相同质量的KNO3和KCl分别加入盛有100 g水的甲、乙烧杯中,充分搅拌后现象如图I所示,图Ⅱ为两物质的溶解度曲线。以下说法正确的是( )
A. 甲烧杯中的溶质为KNO3
B. 将温度升高到t2℃时,乙烧杯中仍然
有固体剩余
C. 若KNO3中混有少量KCl,可采用蒸发结晶的方法提纯KNO3
D. 若取t3℃时KNO3和KCl的饱和溶液各100 g,降温至t2℃时,析出晶体较多的是KNO3
能力提升
D
15.(2022·南充)海洋中蕴藏着丰富的化学资源,
按目前测定,海水中含有的化学元素有80多种。
其中由某些元素组成的盐(均不含结晶水)的溶解
度曲线如下图所示。
(1)在 ℃时,氯化钠和硝酸钾的溶解度相等。
(2)将接近饱和的硒酸镉溶液变为饱和溶液的方法有________________________________________________(任写一种)。
t1
升高温度或加溶质/硒酸镉或蒸发溶剂/水
(3)t2℃时,30 g硒酸镉固体加到50 g水中,充分溶解
并恢复至原温度后,所得溶液中溶质的质量分数是
(精确到0.1%)。
(4)t1℃时,将三种物质的等质量饱和溶液升温至t3℃
(不考虑溶剂蒸发),下列说法正确的是 (填选项)。
A. 有晶体析出的是硒酸镉溶液
B. 溶质质量分数大小关系是:硝酸钾溶液>氯化钠溶液>硒酸镉溶液
C. 溶剂质量大小关系是:硝酸钾溶液=氯化钠溶液>硒酸镉溶液
33.3%
AC
1.(2022·广东)根据如图,判断下列说法正确的是( )
A.t1 ℃时,50 g甲能完全溶于50 g水
B.乙的溶解度随温度升高而降低
C.t2 ℃时,丙和丁的溶解度相同
D.加压或升温能增加戊的溶解度
C
2.(2021·广东) 右图是硼酸的溶解度曲线,下列说法正确的是( )
A.a点的硼酸溶液中溶质的质量分数为10%
B.将a点的硼酸溶液升温至t2℃时,仍是饱和溶液
C.将b点的硼酸溶液降温至t1℃时,有晶体析出
D.t2℃时,向50 g水中加入20 g硼酸后充分搅拌,
可得70 g溶液
C
3.(2020·广东) 左下图是KNO3的溶解度曲线,
下列说法正确的是( )
A.溶液从b点降温到a点,有晶体析出
B.60 ℃时,b、c点对应的都是饱和溶液
C.将a点的饱和溶液从20 ℃升温到60 ℃时仍是饱和溶液
D.60 ℃时,向50 g水中加入60 g KNO3,形成不饱和溶液
A
4.(2019·广东) 如上中图所示是三种物质的溶解度曲线。请回答:
(1)溶解度随温度升高而降低的是 ;30 ℃
时溶解度最大的是 。
(2)80 ℃时硝酸钠饱和溶液的溶质质量分数为 。
使硝酸钠不饱和溶液变为饱和溶液,可采取的措施有
(写一种)。
(3)某硝酸钾固体中混有少量硝酸铈杂质,分离提纯硝酸钾的操作是:配成高温下的硝酸钾饱和溶液、 、过滤、洗涤、干燥。
硝酸钠
硝酸铈
60%
增加溶质或减少溶剂或降低温度
降温结晶
5.(2018·广东) 如上右图为两物质的溶解度曲线。请回答:
(1)50 ℃时Na2Cr2O7的溶解度为 g,60 ℃时溶解度:Na2Cr2O7 Na2SO4 (选填“<”“=”或 “>”)。
(2)在50 ℃时,把210 g Na2Cr2O7饱和溶液降温到10 ℃,析出Na2Cr2O7 g(假设不含结晶水)。
50
110
>
同课章节目录
